Регенерация чешуи данио-рерио in toto и ex vivo Культура чешуи
In This Article
Summary
Этот протокол описывает сбор и визуализацию эласмоидной чешуи рыбок данио во время регенерации in vivo . Кроме того, представлена культура ex vivo этих чешуек в течение 7 дней после сбора урожая.
Abstract
Заболевания скелета часто имеют сложную этиологию и поражают миллионы людей во всем мире. В связи со старением населения существует потребность в новых терапевтических средствах, которые могли бы снизить нагрузку на системы здравоохранения. Поскольку эти заболевания являются сложными, трудно и дорого точно смоделировать патофизиологию костей в лабораторных условиях. Задача в этой области состоит в том, чтобы создать экономически эффективную, биологически значимую платформу для моделирования заболеваний костей, которая может быть использована для тестирования потенциальных терапевтических соединений. В идеале такая платформа должна позволять динамически визуализировать поведение клеток костеобразующих остеобластов и костеразрушающих остеокластов, действующих в минерализованной матриксной среде. Рыбки данио-рерио все чаще используются в качестве моделей из-за доступности генетических инструментов, в том числе трансгенных репортерных линий, и того факта, что некоторые скелетные ткани (включая чешую) остаются полупрозрачными до взрослого возраста, что позволяет использовать динамические возможности визуализации. Поскольку чешуя данио-рерио имеет как остеобласты, так и остеокласты и очень многочисленна, она представляет собой легкодоступный и обильно доступный ресурс независимых костных единиц. Кроме того, после удаления чешуя взрослых рыбок данио полностью регенерирует, что позволяет изучать пространственно-временной рост минерализованной ткани in vivo. Здесь мы подробно описываем протоколы сбора урожая и отслеживания регенерации чешуек. Наконец, представлен протокол стабильного культивирования чешуек ex vivo в течение недели и последующего ответа на заживление после контролируемого повреждения минерализованного матрикса шкалы с течением времени.
Introduction
Кость — это твердая соединительная ткань, которая составляет основную часть скелета, обеспечивая передвижение и действуя как минеральный резерв в организме. Для поддержания здоровья костей необходим тонкий баланс между формированием и деградацией костной ткани благодаря взаимодействию остеобластов (которые анаболически) и остеокластов (которые рассасывают кость). Этот баланс нарушается старением или гормональным дисбалансом, что часто приводит к заболеваниям хрупкости костей, таким как остеопороз1. Несмотря на то, что существующие препараты были одобрены для борьбы с заболеваниями, связанными с хрупкостью костей, многие из них имеют побочные эффекты; В связи с этим существует потребность в новых терапевтических средствах1. Таким образом, сохраняется потребность в обильных источниках биологически значимой костной ткани, которая может быть использована для тестирования потенциальных терапевтических соединений.
Традиционно для изучения биологии костей использовались модели грызунов и системы клеточных культур. Тем не менее, рыбки данио-рерио все чаще становятся еще одной моделью выбора. Несмотря на то, что рыбки данио не являются системой млекопитающих, они имеют определенные преимущества для исследования костей по сравнению с грызунами; К ним относятся их плодовитость и полупрозрачность личинок; Даже во взрослом возрасте некоторые скелетные ткани, включая чешую и плавники, остаются полупрозрачными, что позволяет получать изображения in vivo с высоким разрешением и увеличивать доступность скелетных мутантов 2,3. Как плавники, так и чешуя данио-рерио способны к полной регенерации после удаления. Регенерация скелета и восстановление повреждений плавников данио-рерио были широко изучены 4,5, в то время как чешуя рыбок данио-рерио является более новой моделью костей в этой области, но предлагает преимущества для культуры ex vivo 6.
Чешуя очень обильная, не менее 300 чешуек на каждой рыбе, которые служат защитным покровом для рыбы. Каждая чешуйка представляет собой небольшую минерализованную пластинку, состоящую из костеобразующих остеобластов и кострезорбирующих остеокластов богатого коллагеном скелетного матрикса7. Процесс окостенения как чешуи рыбок данио, так и костей человека требует дифференцировки мезенхимальных стволовых клеток в остеобласты для формирования минерализованного матрикса. Чешуя рыбок данио-рерио дает большое преимущество для исследований скелета благодаря своей сильной регенеративной способности, которую можно использовать для изучения регенерации и восстановления костей. Однако, несмотря на наличие как остеобластов, так и остеокластов, у чешуи данио-рерио отсутствуют остеоциты, которые важны для ремоделирования костей и механочувствительности человека; Поверхностное расположение чешуек означает, что их можно легко удалить с помощью щипцов. При снятии накипи происходит каскад событий, и начинается регенерация накипи 8,9. Существуют различные варианты окрашивания и визуализации для визуализации активности остеобластов и остеокластов, а также минерализации чешуек, как показано на рисунке 1. Кроме того, наличие многих соответствующих флуоресцентных трансгенных репортерных линий данио-рерио означает, что можно визуализировать динамику клеток во время регенерации 7,10,11. Этот процесс позволяет лучше понять формирование костей de novo, наблюдая за ранним паттерном регенерации чешуи на боку рыбы, чтобы изучить морфологию, клеточную активность и генетические профили этих регенерированных чешуек. Хорошо охарактеризована биология образования и регенерации накипи. Важно отметить, что чешуя может демонстрировать хорошую прогностическую способность для терапевтически значимых соединений12, а лечение рыб глюкокортикоидами приводит к тому, что чешуя регенерирует, демонстрируя остеопорозические фенотипы13. Транскриптом регенерирующих чешуек показывает, что гены, активированные при регенерации чешуи, обогащаются для генов, связанных с заболеваниями скелета человека, что еще раз демонстрирует их актуальность в качестве модельной системы 6,14.
Наконец, эти чешуйки можно культивировать ex vivo в течение 7 дней. По сравнению с культурами клеточных линий, которые, как правило, состоят из одного типа клеток, культура ex vivo предоставляет возможности для изучения костей in vitro в естественной среде, содержащей как остеобласты, так и остеокласты с естественным внеклеточным матриксом 8,12,15,16.
Масштабирование накипи также позволяет нам проводить скрининг лекарственных препаратов для выявления новых остеоанаболических мишеней. Обилие чешуи на рыбе означает, что можно заполнить по крайней мере две пластины из 96-луночной тарелки только из одной рыбы, что позволяет проводить комплексный скрининг в формате нескольких лунок, где каждая лунка содержит одну чешую вместе со своей естественной нишей клеток. Кроме того, поскольку чешуйки тонкие, всасывание лекарства предсказуемо12. Таким образом, эласмоидная чешуя рыбок данио-рерио имеет большой потенциал в исследованиях скелета и может помочь нам получить больше информации о клеточных событиях во время формирования и восстановления костей. Здесь мы опишем протоколы сбора чешуек для последующей регенерации in vivo и культивирования чешуек ex vivo.
Protocol
Университетский научный отдел животных (ASU) отвечает за уход за рыбками данио-рерио в соответствии с рекомендациями по разведению данио-рерио. Все процедуры, включая сбор зубного камня, окрашивание костей и визуализацию в реальном времени, были одобрены и выполнены в соответствии с проектной лицензией Министерства внутренних дел Великобритании (PP4700996). Для данной рукописи использовалась молодая особь трансгенной рыбки данио-рерио из линии sp7:mCherry [Tg(osterix:mCherry-NTR)pd46]17. Среди рыб были как самцы, так и самки в возрасте 4 месяцев.
1. Регенерация масштаба in vivo
- Перед началом эксперимента по регенерации щитовки пересадите рыбок данио-рерио из их основных аквариумов в отдельные резервуары (см. таблицу материалов) и вернитесь в эти индивидуальные резервуары после визуализации на протяжении всего эксперимента, как показано на рисунке 2. Это необходимо для того, чтобы гарантировать, что все регенерирующие чешуйки являются теми, которые были собраны для эксперимента; Групповое содержание может привести к спорадической потере чешуи из-за травм, нанесенных другими рыбами.
ПРИМЕЧАНИЕ: Рыбы размещаются по отдельности, чтобы избежать драки и последующей потери чешуи между рыбами. - Запишите информацию о каждой экспериментальной рыбе (т.е. генотип, возраст и пол) в соответствии с планом эксперимента. Используйте камеру (камеры смартфона работают нормально), чтобы сделать снимок каждой рыбы рядом с линейкой, чтобы записать размер/длину рыбы и состояние здоровья.
- В день эксперимента обезболивайте рыбок данио, используя 0,05% (v/v) трикаина метана сульфоната (MS222, см. таблицу материалов) путем погружения, затем поместите его на чашку Петри с влажной тканью, чтобы избежать движения рыбы во время визуализации или вылова.
- Положите рыбу на бок (обычно здесь используется левый бок для консистенции). Выполните визуализацию боковых поверхностей с помощью стереомикроскопа с соответствующим увеличением (как правило, в настоящем исследовании использовались 2x, 4x и/или 6,3x и 8x, чтобы захватить как общую регенерирующую область, так и увеличенную область для детального наблюдения).
ПРИМЕЧАНИЕ: Временные точки визуализации боковых поверхностей зависят от цели эксперимента и выбора трансгенных репортеров. Например, для отслеживания остеобластов во время регенерации накипи рекомендуемые временные точки: день 0 (онтогенетический), 2 дня после сбора урожая (dph), 4 dph, 7 dph, 10 dph, 14 dph, 21 dph. Чтобы уменьшить эффект от повторной анестезии, используйте минимальное количество времени визуализации, необходимое для эксперимента. - Соберите чешуйки с помощью тонкого пинцета и щипцов под стереомикроскопом. Переложите собранные чешуйки в сборные пробирки для последующего окрашивания накипи.
ПРИМЕЧАНИЕ: Максимальное количество чешуек, которые могут быть собраны, будет зависеть от местных этических разрешений. Обычно мы собираем от 20 до 30 чешуек и собираем их в отдельные пробирки для последующего окрашивания накипи, например, ALP, von Kossa14. - Соберите чешуйки в пробирку объемом 1,5 мл или 2 мл. Это зависит от используемой техники окрашивания.
- Как для окрашивания ЩФ, так и для окрашивания по Коссе переносят чешуйки в пробирки для сбора, содержащие деионизированную воду, тогда как для окрашивания TRAP или иммуногистохимии переносят чешуйки в пробирки для сбора, содержащие 4% PFA (фиксирующий раствор).
- Опционально: Перед переносом весов в пробирки при необходимости сделайте снимки отдельных собранных чешуек.
ПРИМЕЧАНИЕ: Рекомендуемые временные точки сбора чешуи: день 0 (онтогенетический), день 10 и день 21 (регенерированные чешуйки).
2. Живое окрашивание костей
ПРИМЕЧАНИЕ: Окрашивание живых скелетов может быть выполнено либо в том случае, если экспериментальные рыбы не являются трансгенными для флуоресцентных репортеров, либо при ношении одноцветных трансгенных репортеров. Живое окрашивание может быть использовано в качестве дополнения к трансгенным препаратам; Например, можно использовать репортёр остеобластов, такой как SP7/OSX , в одном цвете (например, GFP), а затем окрасить кость в красный цвет ализариновым красным (AR). AR и кальцеин зеленый можно использовать для одной и той же рыбы вместе; В этом сценарии AR используется для мечения исходной или онтогенетической кости путем связывания с минерализованным матриксом старой кости, а кальцеин связывается с ионами кальция, которые в изобилии содержатся во вновь сформированной кости. Например, при окрашивании онтогенетической шкалы можно визуализировать АР, но кальцеиновый зеленый может отсутствовать или быть минимальным, так как онтогенетические чешуйки имеют низкий уровень образования новой костной ткани.
- Окрашивание ализариновым красным (AR) в прямом эфире.
- Приготовьте флакон 2x раствора для окрашивания AR, смешав 0,5% (по массе) исходный раствор ализарина (10 мл) с 10 мл 1 M стока HEPES (конечная концентрация, 10 мМ) (см. таблицу материалов).
- Долейте до 1 л 1x раствора Danieau (см. Таблицу материалов). Раствор необходимо хранить в темноте или обернуть пленкой.
- В день эксперимента принесите 500 мл 2-кратного раствора AR в помещение для рыбок данио-рерио и добавьте 500 мл системной воды (из аквариума), чтобы получить 1 рабочий раствор AR.
- Переложите рыб из аквариума в 1x рабочий раствор для окрашивания AR и оставьте на 15-20 минут. Смойте излишки пятна на рыбе 15-минутной «стиркой» в системной воде.
- Выполните живое окрашивание Calcein Green.
- Приготовьте флакон 2x раствора для окрашивания Calcein Green, добавив 45 мг порошка кальцеина в 900 мл 1x раствора Danieau (см. Таблицу материалов). Используйте магнитную мешалку, чтобы порошок полностью растворился.
- Отрегулируйте pH до 8. Это 2-кратный стоковый раствор Calcein Green. Раствор можно хранить в темноте/обернутом фольгой до 1 месяца.
- В день эксперимента принесите 500 мл 2x раствора Calcein Green на ферму по выращиванию рыбок данио и добавьте 500 мл системной воды, чтобы получить 1x рабочий раствор Calcein Green. Рекомендуется использовать свежеприготовленный раствор для окрашивания Calcein.
- Пересадите рыб из аквариумов в 1-кратный рабочий раствор для окрашивания Calcein Green и оставьте на 1-2 часа. В зависимости от размера рыбы может потребоваться более длительное время окрашивания.
- Смойте излишки пятна на рыбе 15-минутной «стиркой» в системной воде.
ПРИМЕЧАНИЕ: Как можно скорее изобразите рыбу, окрашенную в зеленый цвет Calcein, так как это пятно исчезнет через несколько часов.
3. Окрашивание щелочной фосфатазой (ЩФ) чешуи после сбора урожая
- Приготовьте раствор для окрашивания ЩФ, смешав 100 мМ Tris (рН 9,5 с HCl) со 100 мМ NaCl и 50 мМ MgCl2.
- Используйте имеющееся в продаже решение NBT/BCIP (см. Таблицу материалов).
- Переложите весы в пробирки с деионизированной водой.
- Промыть чешуйки в растворе для окрашивания ALP в течение 5 мин.
- Тем временем приготовьте рабочий раствор для окрашивания, добавив 200 мкл раствора NBT/BCIP к 10 мл буфера для окрашивания ЩФ. Это нужно свежеприготовленное в момент окрашивания.
- Окрашивайте чешуйки рабочим раствором для окрашивания ЩФ в течение 15 мин.
- Остановите реакцию, промыв чешуйки деионизированной водой.
4. Окрашивание по Фон Коссе на чешуйках после сбора урожая
- Приготовьте 5% раствор нитрата серебра.
- Приготовьте 5% (по массе) раствор тиосульфата натрия.
- Переложите собранные чешуйки в пробирки с деионизированной водой.
- Инкубируйте чешую в растворе нитрата серебра в течение 40 мин при сильном освещении.
ПРИМЕЧАНИЕ: Носите СИЗ (средства индивидуальной защиты), так как нитрат серебра оставляет пятно, которое трудно удалить. - Промойте чешую дважды в течение 5 минут деионизированной водой.
ПРИМЕЧАНИЕ: Отходы нитрата серебра должны собираться и утилизироваться в соответствии с местными правилами. - Инкубируйте чешую в тиосульфате натрия в течение 5 мин.
- Промойте чешую дважды в течение 5 минут деионизированной водой.
5. Колориметрическое окрашивание TRAP
ПРИМЕЧАНИЕ: Для получения подробной информации о процедуре, пожалуйста, обратитесь к ранее опубликованной работе18.
- Приготовьте красящие растворы.
- Приготовьте раствор фосфата Нафтол АС-МХ в дозе 10 мг/мл.
- Взвесьте 5 мг фосфата нафтола AS-MX (см. таблицу материалов).
- В вытяжном шкафу приготовьте пробирку с 0,5 мл N, N'-диметилформамида и растворите 5 мг фосфата Нафтола АС-МХ в 0,5 мл N, N'-диметилформамида до получения исходного раствора 10 мг/мл фосфата Нафтола АС-МХ (осторожно встряхните).
- Приготовьте 1,6 мМ исходного раствора Fast Red Violet LB в 50 мМ тартрата натрия.
- Приготовьте 50 мл 0,1 М ацетата натрия при рН 5 (добавьте 0,41015 г ацетата натрия в 50 мл деионизированной воды и доведите рН до 5 100% уксусной кислотой).
- Растворить 0,575 г двухосновного дигидрата L-тартрата натрия (см. таблицу материалов) в 50 мл 0,1 М буфера ацетата натрия (рН = 5).
- Добавьте 30 мг быстрой красно-фиолетовой соли.
- Приготовьте PBS-0,1Tx (растворите 500 мкл Triton-X в 500 мл PBS).
- Приготовьте PBS-0,1Tw (растворите 500 мкл Tween-20 в 500 мл PBS).
- Приготовьте раствор фосфата Нафтол АС-МХ в дозе 10 мг/мл.
- Приготовьте рабочий раствор TRAP.
- Смешайте оба исходных раствора в вытяжном шкафу (0,5 мл раствора фосфата Нафтола AS-MX 10 мг/мл и 50 мл исходного раствора Fast Red Violet LB объемом 1,6 мМ в тартрате натрия 50 мМ).
ПРИМЕЧАНИЕ: Рабочий раствор теперь можно использовать вне вытяжного шкафа. Его можно хранить в холодильнике (завернув в фольгу) до месяца. Хранят в отдельной таре от антител или других реагентов, чувствительных к фиксаторам. Держитесь как можно дальше от света. - Дополнительно: приготовить отбеливающий раствор (на образцах, окрашенных TRAP) в PBS и 0,1% Tween-20 (PBS-0,1%Tw).
- Приготовьте окончательную концентрационную смесь из 0,5% гидроксида калия (KOH) (из 10% исходного раствора (w/v)) и 3% перекиси водорода (H2O2) (33% исходный раствор, хранящийся в холодильнике).
- Смешайте оба исходных раствора в вытяжном шкафу (0,5 мл раствора фосфата Нафтола AS-MX 10 мг/мл и 50 мл исходного раствора Fast Red Violet LB объемом 1,6 мМ в тартрате натрия 50 мМ).
- Выполните фиксацию образца.
- Зафиксируйте весы в 4% PFA в 1x PBS, раскачивая или вращая в течение 40 минут при комнатной температуре (RT).
- Удалите 4% PFA и промойте PBS-0,1Tx не менее 3 раз в течение 5 минут при каждой стирке.
- Сразу переходите к окрашиванию TRAP (лучший подход) или храните в PBS-0.1 Tx на ночь.
- Выполните окрашивание чешуи методом TRAP.
- Удалите раствор PBS-0,1 Tx и добавьте колориметрический рабочий раствор TRAP (шаг 5.2.1), чтобы полностью покрыть образцы (т. е. 1 мл в пробирку микроцентрифуги объемом 1,5 мл).
- Выдерживают 1-2 ч при РТ, покачивая в темноте.
- Удалите раствор для окрашивания и промойте не менее 3 раз ПБС-0,1 ТВт в течение 5 мин при каждой стирке.
- После закрепления образцов в 4% PFA в течение 30 мин при RT, осторожно покачивая в темноте.
- Удалите раствор PFA, промыв 3 раза PBS-0,1 Tw в течение 5 мин на каждом этапе.
ПРИМЕЧАНИЕ: Образцы можно хранить (в растворах для хранения/устанавливать на предметные стекла микроскопа) при температуре 4 °C в темноте неограниченное время.
6. Монтаж окрашенных весов
- Приготовьте монтажную среду, добавив 2,4 г кристаллов Mowiol 4-88 к 6 г глицерина (см. таблицу материалов). Можно использовать любой предпочтительный монтажный носитель.
- Добавьте 6 мл деионизированной воды и оставьте на магнитной мешалке на час.
- Добавьте 12 мл 0,2 М Триса (pH 8,5) и инкубируйте примерно при 53 ° C до полного растворения кристаллов Mowiol.
- Осветляют раствор центрифугированием при 2000 х г в течение 20 мин при комнатной температуре.
- Переложите раствор в емкость для хранения. Монтажную среду можно хранить в морозильной камере около 12 месяцев. Размороженный раствор Mowiol стабилен до 1 месяца.
- Установите весы на предметное стекло микроскопа в монтажной среде, накройте их покровным стеклом и рассмотрите под микроскопом.
7. Культура масштабов ex vivo
ПРИМЕЧАНИЕ: Этот шаг адаптирован из de Vrieze et al.12.
- Перед заготовкой чешуек в стерильной среде подготовьте остеогенную среду и культуральную пластину.
- Остеогенная питательная среда (OCM): В стерильной центрифужной пробирке вносят 15 мл OCM в стандартную клеточную культуральную среду (с высоким содержанием глюкозы, без глютамина, без фенолового красного) в конечных концентрациях 1% сыворотки крупного рогатого скота, 1% (200 мМ L-аланил-L-глутамина дипептида в 0,85% NaCl), 1% раствора антибиотика/антимикотика (100x), 4 мМ CaCl2, 10 мМ β-глицерофосфата, 1 нМ пирувата натрия и 1 % амфотерицина B (опционально) (см. таблицу материалов).
- Налейте OCM в стерильный резервуар с реагентом и с помощью многоканальной пипетки добавьте 100 мкл в каждую лунку 96-луночного планшета.
- Закройте 96-луночную пластину и храните ее. OCM можно хранить в холодильнике в течение короткого периода времени (от ночи до 1 недели) и выдерживать температуру 28 °C перед использованием.
- Выполните сбор накипи и промывку PBS.
- Соберите чешуйки с помощью стерильного пинцета/щипцов и поместите их в чашку Петри, содержащую стерильный раствор PBS.
- Выполните настройку пластины.
- Перенесите каждую шкалу из чашки Петри в каждую лунку на 96-луночном планшете со 100 мкл OCM (нагретой до 28 °C) с помощью стерильных щипцов.
- После того, как все чешуйки будут перенесены на пластину, поднесите пластину под стереомикроскоп. Используйте тонкий стерильный наконечник пипетки, чтобы осторожно переместить каждую шкалу на дно лунки и держать их подальше от стенок лунок, чтобы избежать отражения света во время получения изображения.
ПРИМЕЧАНИЕ: Этот шаг требуется только при выполнении визуализации в реальном времени. - Осторожно перенесите планшет в инкубатор или систему визуализации в реальном времени (ЛИС, см. Таблицу материалов) (установленную при температуре 28 °C, 5% CO2), где чешуйки можно культивировать в течение 7 дней.
- Обновите OCM (необязательно).
- Нагрейте OCM, хранившийся в холодильнике, до 28 °C.
- Осторожно перенесите 96-луночный планшет в стерильную среду. С помощью многоканальной пипетки отсасывайте по 50 мкл из каждой лунки. Для этого прижмите кончики к стенкам и не погружайте их до дна, чтобы избежать аспирации/перемещения/удаления чешуек. Используйте новые советы для разных условий.
- Залейте OCM в стерильный резервуар с реагентами и с помощью многоканальной пипетки добавьте 60 мкл OCM в каждую лунку.
- Поместите планшет под стереомикроскоп и проверьте, нет ли неправильно расположенных чешуек (слишком близко к стенкам, плавающих или в вертикальном положении в среде). При необходимости переместите их с помощью тонкого стерильного наконечника для пипетки.
- Поместите планшет обратно в инкубатор/ЛИС.
ПРИМЕЧАНИЕ: Не обновляйте среду, если эксперимент включает в себя циркадный ритм (КР), так как сывороточный шок может повлиять на биологические часы. Обратите внимание, что при изучении CR заметят, что условия освещения также сбрасывают часы.
- Выполните посткультуральное окрашивание и визуализацию по шкале (необязательно).
- После 6 дней культивирования зафиксируйте их и направьте на соответствующее окрашивание, такое как Von Kossa и ALP, упомянутые выше.
- В качестве альтернативы, если у подопытных рыб есть флуоресцентная метка, поместите пластину в систему визуализации в реальном времени.
ПРИМЕЧАНИЕ: Если вы используете систему визуализации в реальном времени, убедитесь, что она настроена на температуру и уровеньCO2 , подходящие для эксперимента. Как правило, в этом исследовании использовали 28 °C и 5%CO2 . Выберите подходящие фильтры и временные точки визуализации (в данном случае использовался интервал в 2 или 4 ч, достаточный для отслеживания миграции остеобластов) и объективы с малым увеличением (т.е. 4x), чтобы обеспечить равномерное изображение всей лунки. Это связано с тем, что весы имеют тенденцию перемещаться внутри лунок, особенно при смене среды.
Representative Results
Регенерация накипи
Регенерация чешуи может быть отслежена с помощью стандартного флуоресцентного стереомикроскопа, визуализируя бок рыбки данио. На рисунке 3A показаны изменения в экспрессии sp7/osx чешуи во время регенерации чешуи у 4-месячной рыбки данио. Временные точки для визуализации флангов, показанные на рисунке 3A : онтогенетические (исходные чешуйки, до сбора урожая), день 2, день 4 и день 10 после сбора урожая. Обычно мы используем трансгенные линии osx (также известные как osterix или sp7) (либо в виде GFP (Tg(Ola.sp7:NLS-eGFP)19 , либо mCherry Tg(osterix:mCherry-NTR)pd46)17 для отслеживания изменений в костной системе, поскольку они маркируют костные остеобласты. Раннее осыпание новообразованных чешуек можно заметить на 2 день регенерации. Этот ранний паттерн регенерации чешуи нарушается в некоторых случаях, особенно у скелетных мутантов. Отслеживая ход регенерации, можно проанализировать мощность и скорость регенерации. В день сбора окалины можно выполнить индивидуальную визуализацию собранных чешуек после визуализации боковых поверхностей с помощью того же стереомикроскопа, как показано на рисунке 3B. Регенерированные чешуйки имеют гораздо более высокую экспрессию osx по сравнению с онтогенетическими чешуйками 0-го дня, потому что для формирования новой кости необходимы остеобласты.
Масштабная культура ex vivo
Несмотря на то, что процесс формирования костной ткани de novo можно изучать, отслеживая процесс регенерации на боку рыбы, мы также можем использовать эту модель для изучения восстановления и заживления скелетных повреждений с помощью культуры чешуи ex vivo путем нанесения травмы на чешую с помощью скальпеля. С помощью системы визуализации в реальном времени можно отслеживать ремонт в режиме реального времени. На рисунке 4 показан репрезентативный результат реакции заживления травмы в онтогенетическом масштабе за 3 дня в культуре, где остеобласты помечены osx: mCherry. Место повреждения, показанное врезками в начале посева, показывает четкий зазор между остеобластами и циркулярными чешуйками (рис. 4А). Можно отслеживать миграцию остеобластов к месту повреждения с помощью покадровой визуализации. Через 3 дня в культуре ширина зазора уменьшается, и между зазором и вновь образованными циркулярами чешуи можно увидеть экспрессиюosx (рис. 4B). Кроме того, морфология с точки зрения формы остеобластов более круглая в начале посева и через 3 дня более вытянутая. Это изменение внешнего вида остеобласта, вероятно, связано с нахождением в культуре, а не в естественной среде обитания (прикрепленной к рыбе).
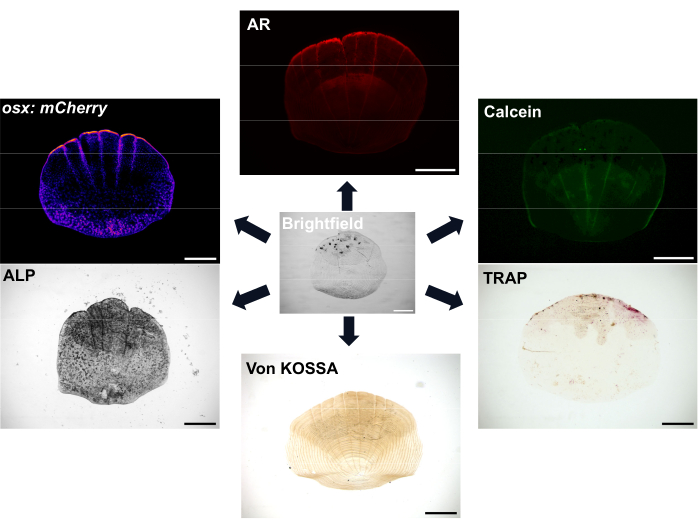
Рисунок 1: Примеры вариантов визуализации для весов. Остеобласты могут быть визуализированы с помощью трансгенных репортерных линий osx/sp7 (либо в GFP, либо в mCherry). Окрашивание ЩФ может быть использовано для демонстрации активности остеобластов. Окрашивание TRAP может показать активность остеокластов. Ализарин красный (AR) и кальцеин зеленый - это красители, которые можно использовать для живой рыбы; AR помечает минерализацию, а кальцеин — новообразованную кость. Степень минерализации также может быть показана с помощью окрашивания по Коссе. Масштабные линейки: 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
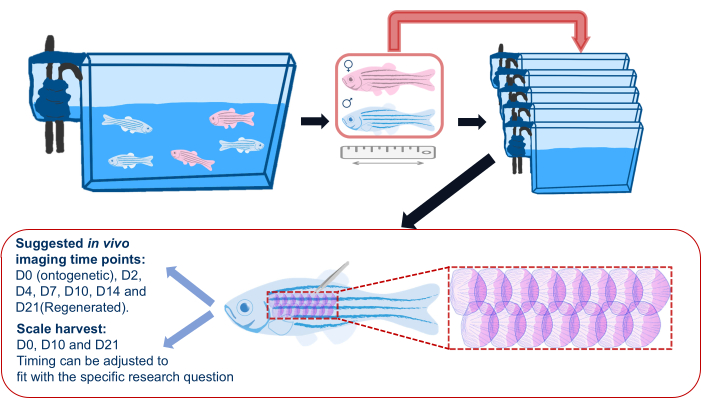
Рисунок 2: Схематическая иллюстрация эксперимента по регенерации накипи. Общая схема эксперимента по регенерации чешуи, показывающая, что перед экспериментом рыбу разделяют по отдельным аквариумам. Записывается длина, пол и здоровье. На схеме также показана предполагаемая область на боку рыбы для сбора чешуи и предполагаемые временные точки изображения. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
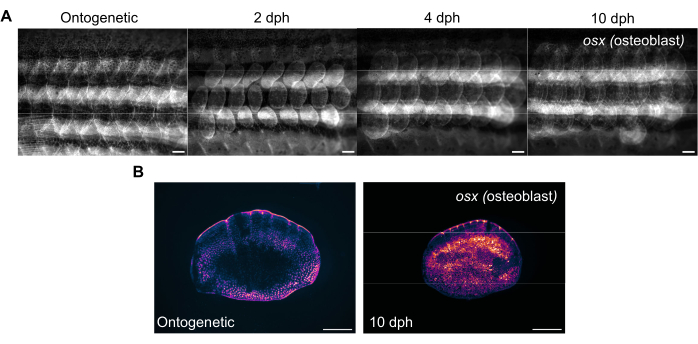
Рисунок 3: Репрезентативные изображения экспрессии остерикса (для визуализации остеобластов) во время регенерации чешуи, взятые у 4-месячной рыбки данио. (A) Боковые изображения, полученные на 0-й день (предуборочный, онтогенетический масштаб), 2-й день (2-й день после сбора урожая), 4-й и 10-й день/ч для отслеживания изменений в экспрессии OSX . Масштабные линейки: 1 мм. (В) Репрезентативные изображения онтогенетической шкалы и шкалы со скоростью 10 dph, взятые у той же рыбы, что и на панели (A). Обратите внимание на повышенные уровни экспрессии osx , показанные пурпурным цветом в центре регенерирующих чешуек. Масштабные линейки: 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
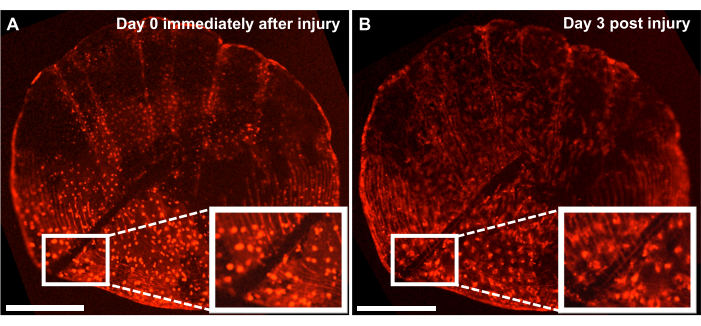
Рисунок 4: Репрезентативные результаты реакции на восстановление повреждений скелета в онтогенетическом масштабе, полученные у 4-месячной рыбки данио с помощью системы визуализации в реальном времени. (A) Онтогенетические чешуйки с травмой, нанесенной скальпелем в тот же день, что и сбор урожая (точка времени 0/день0) культуры. (Б) Та же шкала показана через 3 дня после травмы. На врезке показана область повреждения. Масштабные линейки: 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Discussion
Эласмоидная чешуя рыбок данио, как новая модель для исследований скелета, обладает большим потенциалом, чтобы помочь нашему пониманию поддержания костей, регенерации и восстановления травм. Обилие чешуи на рыбе позволяет проводить средне- и высокопроизводительный скрининг соединений при одновременном снижении количества используемых животных и ограничении внутрииндивидуальных вариаций. Здесь представлены протоколы регенерации накипи и культивирования масштаба ex vivo для изучения регенерации и репарации.
При следовании этому протоколу необходимо учитывать некоторые критические шаги. Тщательное удаление чешуек имеет важное значение, особенно при использовании трансгенной репортерной линии, чтобы ограничить нарушение клеточной популяции, вызванное забором. Если необходимо провести сравнение с онтогенетической чешуей, убедитесь, что в этой области нет самовосстанавливающихся чешуек (которые могут естественным образом возникать на протяжении всей жизни рыбы). Обеспечьте стерильную среду и оборудование для культивирования ex vivo для достижения оптимальной выживаемости клеток и минимальной инфекции в культуре.
В зависимости от конкретного исследовательского вопроса, в протокол могут быть внесены изменения, такие как объединение различных трансгенных репортерных линий для визуализации профилей экспрессии генов других типов клеток во время регенерации и репарации11,14.
Широкий диапазон окрашивания, который можно выполнить на весах, означает, что для каждого исследуемого соединения или состояния можно посмотреть на его воздействие на кость под разными углами; в то время как репортеры SP7/OSX могут показать количество остеобластов, окрашивание ALP может визуализировать активность остеобластов, окрашивание TRAP может визуализировать активность остеокластов, живое окрашивание кальцеином зеленым может пометить новообразованную кость, а красное окрашивание ализарином или окрашивание по Коссе может показать масштабную минерализацию. Активность люциферазы для количественного определения остеобластов также может быть использована12. В сочетании с этими методами окрашивания можно узнать относительный вклад остеобластов и остеокластов в тот или иной костный эффект. Чешуйки лишены остеоцитов, которые преобладают в костях млекопитающих и являются основными драйверами механосенсорной реакции костей; Репарация и регенерация накипи в этой модели в основном обусловлены остеобластами с последующим ремоделированием остеокластами 8,9. Важно отметить, что различия происходят между отдельными людьми и возрастными группами20. Чтобы свести это к минимуму, площадь вылова чешуи должна быть постоянной, так как в разных местах может образовываться различная морфология чешуи, и используются рыбы из одних и тех же родственных групп, чтобы возраст и размер были одинаковыми. Однако, поскольку для одной рыбы можно собрать несколько чешуек, можно провести больше экспериментов, используя меньшее количество рыбы, уменьшая внутрииндивидуальную изменчивость.
Таким образом, эти протоколы демонстрируют экспериментальные методы, которые могут быть применены к онтогенетическим и регенерирующим шкалам. В заключение, эласмоидные чешуйки демонстрируют большой потенциал в качестве скелетной модели, помогающей понять формирование и восстановление костной ткани; и поможет сократить использование животных для высокопроизводительного скрининга остеоанаболических соединений.
Disclosures
У авторов нет конфликта интересов, который можно было бы раскрыть.
Acknowledgements
Мы хотели бы поблагодарить Мэтью Грина (Mathew Green) из отдела обслуживания животных (Animal Service Unit) по рыбоводству и Кэти Джепсон (Katy Jepson) из Центра биовизуализации Вольфсона. CLH, DB и QT финансировались организацией Versus Arthritis (CLH Senior Fellowship 21937, DB and QT Intermediate Fellowship 22044), RR финансировалась (NHMRC APP1158758). Эта работа также была поддержана грантом BBSRC (BB/T001984/1).
Materials
| Name | Company | Catalog Number | Comments |
| 10x Phosphate buffered saline (PBS) | Gibco | 70013-016 | PBS |
| 12-Multichanel Pipette | Sartorius | 728230 | Multichanel pipette, Proline Plus Mechanical Pipette, 12 Channel, , 10-100 µL. |
| 15 mL Centrifuge tubes | Corning | 430791 | Centrifuge tube, CentriStar Cap, Polypropylene, RNAse/DNAse free, Non-pyrogenic |
| 4% Paraformaldehyde (PFA) | Sigma | P6148 | PFA |
| Alizarin red | Sigma | A5533 | |
| Amphotericin B | ThermoFisher Scientific | 15290026 | |
| Bemis Parafilm M Laboratory Wrapping Film | Fisher Scientific | 11772644 | Sealing film |
| Calcein powder | Sigma | C0875 | |
| Calcium Chloride | Thermo Scientific | L13191.30 | |
| Corning 96 well plate | Corning | 3596 | 96-well-plate, Clear, Flat Bottom Polystyrene TC-treated Microplates, Individually Wrapped, with Lid, Sterile |
| Cover slips | VWR | 631-0146 | |
| Cytiva HyClone Iron-Supplemented Calf Serum | Fisher Scientific | SH30072.03 | |
| Danieau | Sigma | ||
| DMEM | Life Technologies | 31053 | |
| Falcon tubes | Corning | 430828 | |
| Fast Red Violet LB stock solution | Sigma | F3381 | |
| GlutaMAX Supplement | Life Technologies | 35050 | |
| Glycerol | Sigma | 81381 | |
| Hepes | Sigma | H3375 | |
| Incubator | X | Incubator, Set up to 28 °C and 5% CO2 | |
| IncuCyte Zoom | Sartorious | X | Live Imaging System, Set up to 28 °C and 5% CO2 |
| Leica stereomicroscope | X | Sterioscope | |
| L-tartrate dibasic dihydrate | Sigma | 228729 | |
| Mgcl2 | BDH Laboratory Sup. | 261237T | |
| Microscope slides | Epredia | J2800AMNZ | |
| Mowiol 4-88 | Sigma | 9002-89-5 | |
| MQ water | X | ||
| N, N’-dimethylformamide (Merck: D4451) | Merck | D4451 | |
| NaCL | Fisher Chemical | S/3120/53 | |
| Naphthol AS-MX phosphate | Merck | N4875 | |
| NBT/BCIP solution | Sigma | #000000011681451001 | |
| Penicillin-Streptomycin | Life Technologies | 15140 | |
| Petri Dishes | Corning | 430589 | 35 mm sterile Petri dish, Non-treated, Nonpyrogenic, Polystyrene. |
| Reagent Reservoir | Startub | E2310-1025 | 25mL Reagent Reservoir |
| Silver nitrate | Sigma | 209139 | |
| Sodium acetate | Sigma | 52889 | |
| Sodium beta-glycerophosphate pentahydrate | Thermo Scientific | L03425.14 | |
| Sodium pyruvate solution | Sigma | S8636 | |
| Sodium tartrate | Sigma | S4797 | |
| Sodium thioculphate | Sigma | 563188 | |
| Tricaine methane sulfonate (MS222) | Sigma | E10521 | |
| Tris | Sigma | 252859 | |
| Triton-X100 | Sigma | T8787 | |
| Tween-20 | SLS | CHE3852 | |
| Tweezers Number 5 | Dumont | 500341 | Tweezer, INOX, biology grade |
| Zebrafish tanks | Tecniplast | ZB30BCP | 3.5 L - 28 cm x 11 cm x 17 cm |
| Zebrafish tanks | Tecniplast | ZB30BCP | 1 L - 28 cm x 7 cm x 11 cm |
References
- Tobias, J. H., et al. Opportunities and challenges in functional genomics research in osteoporosis: report from a workshop held by the causes working group of the osteoporosis and bone research academy of the Royal Osteoporosis Society on October 5th 2020,". Frontiers in Endocrinology. 11, (2021).
- Busse, B., Galloway, J. L., Gray, R. S., Harris, M. P., Kwon, R. Y. Zebrafish: An emerging model for orthopedic research. Journal of Orthopaedic Research. 38 (5), 925-936 (2020).
- Dietrich, K., et al. Skeletal biology and disease modeling in zebrafish. Journal of Bone and Mineral Research. 36 (3), 436-458 (2021).
- McGowan, L. M., Kague, E., Vorster, A., Newham, E., Cross, S., Hammond, C. L. Wnt16 elicits a protective effect against fractures and supports bone repair in zebrafish. JBMR Plus. 5 (3), 10461 (2021).
- Sehring, I., Weidinger, G. Zebrafish fin: Complex molecular interactions and cellular mechanisms guiding regeneration. Cold Spring Harbor Perspectives in Biology. 14 (7), 040758 (2022).
- Bergen, D. J. M., Kague, E., Hammond, C. L. Zebrafish as an emerging model for osteoporosis: a primary testing platform for screening new osteo-active compounds. Frontiers in Endocrinology. 10 (6), (2019).
- Aman, A. J., Fulbright, A. N., Parichy, D. M. Wnt/β-catenin regulates an ancient signaling network during zebrafish scale development. Elife. 7, 37001 (2018).
- Iwasaki, M., Kuroda, J., Kawakami, K., Wada, H. Epidermal regulation of bone morphogenesis through the development and regeneration of osteoblasts in the zebrafish scale. Developmental Biology. 437 (2), 105-119 (2018).
- Metz, J. R., de Vrieze, E., Lock, E. J., Schulten, I. E., Flik, G. Elasmoid scales of fishes as model in biomedical bone research. Journal of Applied Ichthyology. 28 (3), 382-387 (2012).
- Cox, B. D., De Simone, A., Tornini, V. A., Singh, S. P., Di Talia, S., Poss, K. D. In toto imaging of dynamic osteoblast behaviors in regenerating skeletal bone. Current Biology. 28 (24), 3937-3947 (2018).
- Tonelli, F., et al. Zebrafish: A resourceful vertebrate model to investigate skeletal disorders,". Frontiers in Endocrinology. 11, (2020).
- de Vrieze, E., Zethof, J., Schulte-Merker, S., Flik, G., Metz, J. R. Identification of novel osteogenic compounds by an ex-vivo sp7: Luciferase zebrafish scale assay. Bone. 74, 106-113 (2015).
- De Vrieze, E., Moren, M., Metz, J. R., Flik, G., Lie, K. K. Arachidonic acid enhances turnover of the dermal skeleton: Studies on zebrafish scales. PLoS One. 9 (2), 89347 (2014).
- Bergen, D. J. M., et al. Regenerating zebrafish scales express a subset of evolutionary conserved genes involved in human skeletal disease. BMC Biology. 20 (1), 21 (2022).
- Bergen, D. J. M., et al. High bone mass disorders: New insights from connecting the clinic and the bench. Journal of Bone and Mineral Research. , (2022).
- Pasqualetti, S., Banfi, G., Mariotti, M. Osteoblast and osteoclast behavior in zebrafish cultured scales. Cell and Tissue Research. 350 (1), 69-75 (2012).
- Singh, S. P., Holdway, J. E., Poss, K. D. Regeneration of amputated zebrafish fin rays from de novo osteoblasts. Developmental Cell. 22 (4), 879-886 (2012).
- Ethiraj, L. P., Fong, E. L. S., Liu, R., Chan, M., Winkler, C., Carney, T. J. Colorimetric and fluorescent TRAP assays for visualising and quantifying fish osteoclast activity. European Journal of Histochemistry. 66 (2), 3369 (2022).
- DeLaurier, A., et al. Zebrafish sp7:EGFP: a transgenic for studying otic vesicle formation, skeletogenesis, and bone regeneration. Genesis. 48 (8), 505 (2010).
- Carnovali, M., Banfi, G., Mariotti, M. Age-dependent modulation of bone metabolism in zebrafish scales as new model of male osteoporosis in lower vertebrates. Geroscience. 43 (2), 927-940 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved