Produção e análise otimizadas de vesículas cheias de proteína recombinante de E. coli
In This Article
Summary
O presente protocolo descreve um método detalhado para a produção bacteriana de proteínas recombinantes, incluindo proteínas tipicamente insolúveis ou contendo ligação dissulfeto, embaladas dentro de vesículas ligadas à membrana extracelular. Isso tem potencial para ser aplicado a áreas versáteis da pesquisa científica, incluindo biotecnologia aplicada e medicina.
Abstract
Este sistema inovador, usando uma etiqueta peptídica curta, que exporta múltiplas proteínas recombinantes em vesículas ligadas à membrana de E. coli, fornece uma solução eficaz para uma série de problemas associados à expressão de proteínas recombinantes bacterianas. Essas vesículas recombinantes compartimentam proteínas dentro de um microambiente que facilita a produção de proteínas de bactérias que de outra forma desafiam, tóxicas, insolúveis ou contendo ligações de dissulfeto. O rendimento proteico é aumentado consideravelmente quando comparado à expressão bacteriana típica na ausência da etiqueta peptídica nucleante da vesícula. A liberação de proteínas embaladas na vesícula suporta o isolamento do meio de cultura e permite o armazenamento de proteína ativa a longo prazo. Esta tecnologia dá origem ao aumento dos rendimentos de proteínas funcionais embaladas com vesículas para processamento simplificado a jusante para uma gama diversificada de aplicações, desde biotecnologia aplicada até ciência e medicina de descobertas. No presente artigo e no vídeo associado, um protocolo detalhado do método é fornecido, destacando etapas fundamentais na metodologia para maximizar a produção de vesículas preenchidas por proteína recombinante.
Introduction
A bactéria Gram-negativa E. coli é um sistema atrativo para a produção de proteínas recombinantes em escala industrial e acadêmica. Não é apenas custo-efetivo e simples o cultivo em lotes de altas densidades, mas um amplo espectro de reagentes, cepas, ferramentas e promotores foram estabelecidos para promover a geração de proteínas funcionais em E. coli1. Além disso, técnicas de biologia sintética estão superando obstáculos tipicamente relacionados à aplicação de modificações pós-traducionais e enovelamento de proteínascomplexas2. A capacidade de direcionar a secreção de proteínas recombinantes em meios de cultura é atraente para melhorar o rendimento e reduzir os custos de fabricação. O empacotamento controlado de proteínas definidas pelo usuário em vesículas de membrana auxilia o desenvolvimento de produtos e tecnologias dentro das indústrias de biotecnologia aplicada e médica. Até o momento, faltavam métodos amplamente aplicáveis para a secreção de proteínas recombinantes de E. coli 3.
Eastwood e col. desenvolveram recentemente um método baseado em marcação de peptídeos para produzir e isolar vesículas contendo proteínas recombinantes de E. coli1. Este peptídeo nucleante de vesícula (VNp) permite a produção de vesículas de membrana bacteriana extracelular, nas quais a proteína recombinante de escolha pode ser direcionada para simplificar a purificação e o armazenamento da proteína-alvo, e permite rendimentos significativamente mais altos do que o normalmente permitido a partir de culturas de frascos agitados. Foram relatados rendimentos de cerca de 3 g de proteína recombinante por litro de cultura em frasco, com rendimentos >100x maiores do que aqueles obtidos com proteínas equivalentes sem a etiqueta VNp. Essas vesículas recombinantes enriquecidas com proteínas podem ser rapidamente purificadas e concentradas a partir do meio de cultura e fornecer um ambiente estável para armazenamento. Esta tecnologia representa um grande avanço na produção de proteína recombinante de E. coli. As vesículas compartimentalizam proteínas tóxicas e contendo ligação dissulfeto em uma forma solúvel e funcional, e suportam a purificação simples, eficiente e rápida de proteínas funcionais embaladas com vesículas para armazenamento de longo prazo ou processamento direto1.
As principais vantagens que essa tecnologia apresenta sobre as técnicas atuais são: (1) a aplicabilidade a uma variedade de tamanhos (1 kDa a >100 kDa) e tipos de proteínas; (2) facilitar a formação de ligações dissulfeto inter e intraproteínas; (3) aplicável a complexos multiproteicos; (4) pode ser usado com uma variedade de promotores e cepas padrão de E. coli de laboratório; (5) a geração de rendimentos de proteínas a partir de frascos agitados normalmente observados apenas em culturas de fermentação; as proteínas são exportadas e embaladas em vesículas ligadas à membrana que (6) fornecem um ambiente estável para o armazenamento da proteína solúvel ativa; e (7) simplifica o processamento a jusante e a purificação de proteínas. Esta ferramenta de proteína recombinante simples e econômica provavelmente terá um impacto positivo nas indústrias de biotecnologia e médica, bem como na ciência da descoberta.
Aqui, um protocolo detalhado, desenvolvido ao longo de vários anos, descreve as condições ideais para produzir vesículas cheias de proteínas recombinantes a partir de bactérias com a tecnologia VNp. Imagens de exemplo desse sistema na prática são mostradas, com uma proteína fluorescente sendo expressa, permitindo a visualização da presença de vesículas durante diferentes etapas de produção, purificação e concentração. Finalmente, são fornecidas orientações sobre como usar imagens de células vivas para validar a produção de vesículas contendo fusão de VNp a partir das bactérias.
Protocol
O trabalho bacteriano realizado segue as regulamentações locais, nacionais e internacionais de contenção de biossegurança adequadas ao nível de risco de biossegurança particular de cada cepa.
1. Seleção de diferentes VNps
- Identifique as sequências VNp.
NOTA: Para o presente estudo, foram identificadas três sequências de VNp1 que resultam em rendimento máximo e exportação vesicular das proteínas examinadas até o momento: VNp2, VNp6 e VNp15. Atualmente, não está claro por que certas variantes do VNp funcionam de forma mais eficiente com algumas proteínas do que outras; portanto, recomenda-se que sejam geradas fusões entre uma nova proteína de interesse com cada variante do VNp (i.e., VNp2, 6 ou 15).
VNp2: MDVFMKGLSKAKEGVVAAAEKTKQGVAEA
AGKTKEGVL
VNp6: MDVFKKGFSIADEGVVGAVEKTDQGVTEA
AEKTKEGVM
VNp15: MDVFKKGFSIADEGVVGAVE
Plasmídeos que permitem a expressão da proteína de interesse com diferentes fusões de VNp amino terminais foram disponibilizados comercialmente (ver Tabela de Materiais). - Projetar uma estratégia de clonagem para inserir o gene de interesse na extremidade 3' do cDNA que codifica para o VNp em uma dessas construções, ou adaptar um plasmídeo existente integrando o cDNA de VNp sintetizado a montante do primeiro códon ATG do gene que codifica para a proteína de interesse. Use os métodos descritos em1.
- Para proteínas tóxicas, use um vetor com um promotor de expressão repressível ou um promotor com mínimo ruído de expressão não induzido.
- Clone o tag de sequência VNp no amino-terminal da proteína de fusão. Certifique-se de que as etiquetas de afinidade, sequências de clivagem de protease, etc., e a proteína de interesse estejam localizadas no lado carboxila da etiqueta VNp. Recomenda-se separar o VNp do peptídeo a jusante com uma região ligante flexível, como duas ou três repetições de uma sequência polipeptídica -G-G-S-G- (Figura 1).
NOTA: Use plasmídeos com uma seleção de antibióticos que não tem como alvo o peptidoglicano, o que enfraquece a superfície celular e reduz o rendimento da vesícula. Kanamicina e cloranfenicol (ver Tabela de Materiais) foram os antibióticos preferidos utilizados para este estudo.
2. Cultura de células bacterianas e indução de proteínas
NOTA: As estirpes bacterianas normalmente utilizadas neste protocolo são Escherichia coli BL21 (DE3) ou W3110. As células de E. coli são cultivadas em caldo lisogênico (LB) (10 g/L triptona; 10 g/L NaCl; 5 g/L extrato de levedura) ou caldo fantástico (TB) (12 g/L triptona; 24 g/L extrato de levedura; 4 mL/L 10% glicerol; 17 mM KH 2 PO 4; 72 mM K2HPO4, sais autoclavados separadamente) (ver Tabela de Materiais). Imagens de exemplo mostrando cada etapa da indução da proteína e subsequente processo de isolamento e purificação são mostradas na Figura 2.
- Cultivar 5 mL de LB a partir de transformações bacterianas frescas a 37 °C até a saturação e utilizá-los para inocular 25 mL de TB em um frasco cônico de 500 mL, todos com seleção adequada de antibióticos.
- A relação superfície:volume é um fator importante na otimização deste sistema. Utilizar um frasco de volume tão grande quanto possível (por exemplo, frasco de 5 L contendo 1 L de cultura; para ensaios de otimização, utilizar 25 ml de meio num frasco de 500 ml).
- Incubar as culturas de frascos de agitação maiores numa estufa a 37 °C com agitação a 200 rpm (lançamento orbital de ≥25 mm) até atingir um valor de densidade óptica de 600 nm (OD600) de 0,8-1,0.
NOTA: A vesiculação é ideal quando as células são cultivadas a 37 °C. Entretanto, algumas proteínas recombinantes requerem expressão em temperaturas mais baixas. Se este for o caso da proteína de interesse, o tag VNp6 deve ser usado, pois isso permite a exportação de vesículas de alto rendimento em temperaturas de até 25 °C. - Para induzir a expressão de proteínas recombinantes do promotor T7, adicionar isopropil β-D-1-thiogalactopyranoside (IPTG) a uma concentração final de até 20 μg/mL (84 μM) (ver Tabela de Materiais). A indução da expressão de proteínas recombinantes deve ocorrer na fase logarítmica tardia (isto é, OD600 típica de 0,8-1,0) para a produção de vesículas.
NOTA: A duração do período de indução pode diferir entre as proteínas, com algumas atingindo a produção máxima em 4 h e outras durante a noite (18 h). Até à data, a exportação máxima de vesículas foi obtida em culturas nocturnas.
3. Isolamento de vesículas recombinantes
- Pellet as células por centrifugação a 3.000 x g (4 °C) por 20 min.
- Para esterilizar meios contendo vesículas para armazenamento a longo prazo, passe o meio de cultura limpo através de um filtro de polietersulfona (PES) 0,45 μm estéril e sem detergente (ver Tabela de Materiais).
NOTA: Para testar a exclusão de células viáveis do filtrado contendo vesículas, colocar placa em ágar LB e incubar durante a noite a 37 °C. - Para concentrar as vesículas em um volume menor, passe o meio estéril contendo vesículas através de um filtro estéril e livre de detergente de 0,1 μm de ésteres mistos de celulose (MCE) (ver Tabela de Materiais).
- Lave suavemente a membrana com 0,5-1 mL de PBS estéril usando um raspador de células ou espalhador de plástico para remover cuidadosamente as vesículas da membrana. Transfira para um tubo de microfuga fresco.
NOTA: As vesículas purificadas podem ser armazenadas em meio estéril ou solução salina tamponada com fosfato (PBS) a 4 °C. Existem exemplos de proteínas recombinantes armazenadas nessas vesículas por 6 meses, desta forma, sem perda da atividade enzimática.
4. Liberação de proteínas solúveis de vesículas isoladas
- Uma vez que as vesículas contendo proteínas tenham sido isoladas no meio/tampão estéril, submeter as membranas lipídicas vesiculares à sonicação usando um esquema apropriado para o aparelho (por exemplo, ciclos de ligação e desativação de 6x 20 s) e centrifugação a 39.000 x g (4 °C) por 20 minutos para remover detritos vesiculares.
NOTA: O choque osmótico ou o tratamento com detergente podem ser usados como uma alternativa para quebrar as vesículas, mas deve-se considerar o impacto sobre a funcionalidade da proteína e/ou a aplicação a jusante. - Se a fusão de VNp permanecer citosólica e não for liberada no meio, isole a proteína usando protocolos padrão (por exemplo, ressuspender os pellets de células em 5 mL de um tampão de extração apropriado (tris 20 mM, NaCl 500 mM), sonicar e remover os restos celulares por centrifugação).
5. Determinação da concentração de proteínas
- Determinar a concentração de proteínas por análise de densitometria em gel de amostras triplicadas1. Executar juntamente com os padrões de carregamento de albumina de soro bovino (BSA) em géis de eletroforese em gel de poliacrilamida de poliacrilamida corados com coomassie (SDS-PAGE). Digitalize e analise os géis usando o software apropriado (por exemplo, Imagem J; ver Tabela de Materiais).
6. Visualização da formação de vesículas e vesículas isoladas por microscopia de fluorescência
NOTA: Se as células contiverem marcadores de fusão ou membrana de VNp marcados fluorescentemente, a imagem de células vivas pode ser usada para acompanhar a formação de vesículas. Alternativamente, corantes lipídicos fluorescentes podem ser usados para visualizar vesículas para confirmar a produção e purificação.
- Montagem de células
- Induza a expressão de fusão de VNp por várias horas antes de montar na lamínula.
- Método da almofada de agarose (Figura 3A-C): pipetar as células para uma almofada LB-agarose circular fina (<1 mm) que foi deixada formar e colocada em uma lâmina de vidro limpa. Deixe as células se acomodarem e se equilibrarem e coloque uma tampa de 50 mm x 25 mm sobre a almofada e as células. Segure a tampa no lugar com espaçadores e fita adesiva.
- Método da polietilenoimina (PEI) (Figura 3D-F): espalhe 20 μL de PEI a 0,05% (em dH2O) sobre uma lamínula com ponta de pipeta e deixe por 3-5 min para se prender ao vidro sem deixar secar. Adicionar 50 μL de cultura celular e deixar por 5-10 min para garantir que as bactérias tenham se associado à superfície revestida com PEI4. Lave a tampa com 100 μL de meio antes de colocá-la na lâmina e segure-a no lugar com espaçadores e fita adesiva.
- Montagem de vesículas
- Pipetar vesículas purificadas sobre uma almofada LB-agarose circular fina (<1 mm) que foi deixada formar e colocada em uma lâmina de vidro limpa. Depois de secar, coloque uma tampa de 50 mm x 25 mm sobre a almofada e as vesículas. Segure a tampa no lugar com espaçadores e fita adesiva.
- O corante lipídico fluorescente FM4-64 é capaz de corar membranas5 e, portanto, pode ser usado para visualizar vesículas. Adicionar FM4-64 (ver Tabela de Materiais) às vesículas purificadas a uma concentração final de 2 μM (a partir de um estoque de 2 mM dissolvido em dimetilsulfóxido [DMSO]) e imagem após uma incubação de 10 min. Isso é especialmente útil para identificar vesículas contendo cargas marcadas sem fluorescência5.
- Enxaguar as lamínulas com o mesmo meio utilizado para cultivar as células observadas.
NOTA: Alguns meios complexos (por exemplo, TB) podem apresentar autofluorescência, o que pode resultar em excesso de sinal de fundo.
- Vesículas de imagem
NOTA: Exemplos de imagens de microscopia de vesículas recombinantes de VNp podem ser vistos na Figura 4.- Monte a lâmina em um microscópio invertido (veja Tabela de Materiais) usando uma objetiva de imersão em óleo e deixe por 2-3 min para permitir que a amostra se estabeleça e a temperatura se equilibre.
NOTA: Todas as imagens de células vivas para cada amostra devem ser concluídas dentro de 30 minutos após a montagem das células em lamínulas para minimizar o impacto da fototoxicidade e do estresse anaeróbio. Por essa razão, as imagens de plano único são preferidas às pilhas z. - Utilizar fontes de luz apropriadas (por exemplo, diodo emissor de luz [LED] ou lâmpada halógena; ver Tabela de Materiais) e combinações de filtros para a(s) proteína(s)/corante(s) fluorescente(s) utilizado(s)6.
- Use uma lente de alta ampliação (i.e., 100x ou 150x) e alta abertura numérica (i.e., NA ≥1.4) para obter imagens das células microbianas e vesículas.
- Determine a intensidade luminosa mínima necessária para visualizar sinais de fluorescência de células e/ou vesículas. Isso pode exigir algum ajuste das configurações de exposição e ganho para a câmera em uso.
NOTA: Os tempos de exposição típicos das atuais câmeras CMOS (complementary metal-oxide semiconductor) variam entre 50-200 ms, dependendo do sistema de imagem. - Para imagens de quadro único, use a média de três imagens para reduzir o ruído de fundo aleatório dependente do hardware.
- Para imagens de lapso de tempo, aguarde de 3 a 5 minutos entre quadros individuais.
NOTA: Dependendo da configuração do microscópio, o foco pode precisar ser ajustado intermitentemente ao longo de experimentos de lapso de tempo mais longos.
- Monte a lâmina em um microscópio invertido (veja Tabela de Materiais) usando uma objetiva de imersão em óleo e deixe por 2-3 min para permitir que a amostra se estabeleça e a temperatura se equilibre.
Representative Results
BL21 DE3 E. coli contendo o construto de expressão VNp6-mNeongreen foram cultivadas até a fase logarítmica tardia (Figura 2A). A expressão de VNp6-mNeongreen foi induzida pela adição de IPTG à cultura (concentração final de 20 μg/mL ou 84 μM), que foi posteriormente deixada para crescer durante a noite a 37 °C com agitação vigorosa (200 rpm, lançamento orbital de ≥25 mm). Na manhã seguinte, a cultura mostrou fluorescência7 mNeongreen (Figura 2B), que permaneceu visível na mídia após a remoção das células bacterianas por centrifugação (Figura 2C). A presença de VNp-mNeongreen no interior da cultura e dos meios de cultura limpos foi confirmada por SDS-PAGE (Figura 2D). As vesículas contendo mNeongreen foram isoladas em um filtro MCE de 0,1 μm (Figura 2E) e ressuspensas em PBS (Figura 2F). As vesículas purificadas foram posteriormente montadas em uma almofada de agarose (Figura 3A-C) e imageadas usando microscopia de fluorescência de campo largo (Figura 4A). A presença de membranas vesiculares foi confirmada pelo corante lipofílico fluorescente FM4-64 (Figura 4B). As células de E. coli que expressam a proteína CydB da membrana interna fusionada a mNeongreen (verde) e VNp6-mCherry2 (magenta)8 mostram produção de vesículas e inserção de carga em células bacterianas vivas (Figura 4C). As figuras 4A,B foram captadas em microscópio de fluorescência de campo largo, enquanto a Figura 4C foi adquirida em microscopia de iluminação estruturada (SIM), utilizando-se métodos descritosanteriormente9,10.
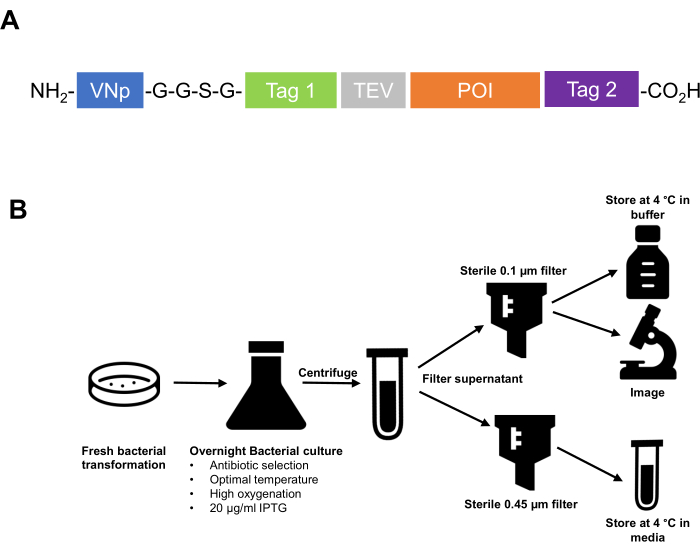
Figura 1: Resumo da tecnologia VNp desde a concepção de uma estratégia de clonagem até a purificação e armazenamento de vesículas extracelulares . (A) Esquema de uma proteína típica de fusão de VNp. VNp no terminal NH2, seguido por um ligante flexível e uma combinação apropriada de tags de afinidade e fluorescência (Tag1, Tag 2, local de clivagem de protease [por exemplo, TEV]) e proteína de interesse. (B) Diagrama esquemático resumindo o protocolo para a expressão e purificação de vesículas de membrana preenchidas por proteínas recombinantes de E. coli. Clique aqui para ver uma versão maior desta figura.
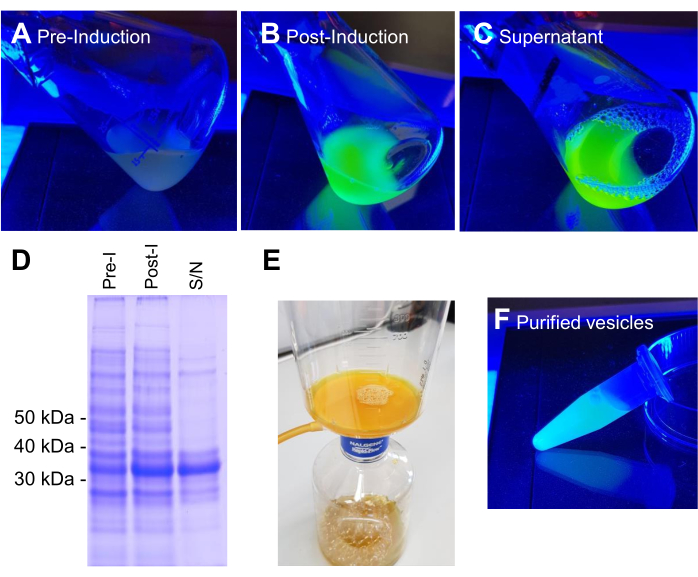
Figura 2: Etapas de produção e purificação das vesículas VNp6-mNg. Culturas de células de E. coli contendo a expressão de VNp-mNeongreen foram construídas em luz azul antes (A) ou após (B) expressão induzida por IPTG da proteína de fusão. As células de (B) foram removidas por centrifugação, deixando vesículas preenchidas com VNp-mNeongreen no meio (C). (D) Amostras equivalentes de A, B e C foram analisadas por SDS-PAGE e coloração de coomassie. As vesículas foram isoladas em um filtro de 0,1 μm (E) e posteriormente lavadas em um volume apropriado de tampão (F). Clique aqui para ver uma versão maior desta figura.
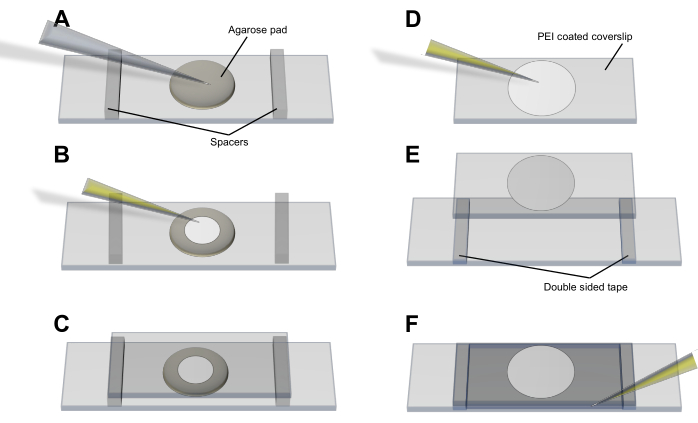
Figura 3: Procedimento de montagem celular para obtenção de imagens de vesículas e produção de vesículas. (A-C) O método da almofada de agarose e (D-F) o método PEI para a montagem de células de E. coli na lamínula. Clique aqui para ver uma versão maior desta figura.
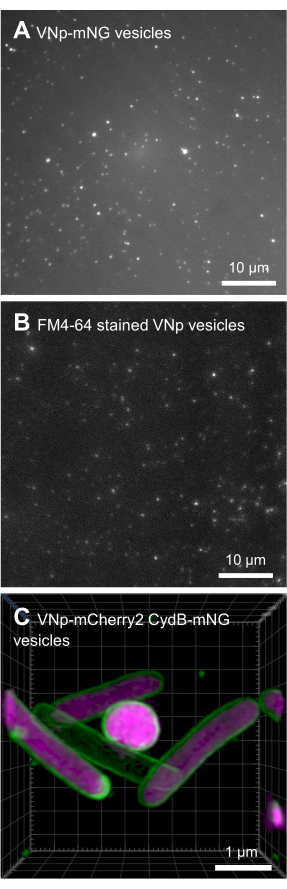
Figura 4: Imagens microscópicas de vesículas recombinantes de VNp. Imagens de emissão verde (A) e vermelha (B) de diferentes campos de vesículas contendo FM4-64 marcadas com VNp6-mNeongreen montadas em uma almofada de agarose. (C) Imagens de células de E. coli expressando a proteína de membrana interna CydB fusionada a mNeongreen (verde) e VNp6-mCherry2 (magenta) mostram a produção de vesículas e inserção de carga em células bacterianas vivas. (A,B) foram obtidas usando microscópio de fluorescência de campo largo, enquanto (C) foi adquirida usando microscopia de iluminação estruturada (SIM). Barras de escala: (A,B) = 10 μm; (C) = 1 μm. Clique aqui para ver uma versão maior desta figura.
Discussion
O método marcado com peptídeo amino-terminal para a produção de proteínas recombinantes descrito acima é um processo simples, que consistentemente produz grandes quantidades de proteína que podem ser eficientemente isoladas e/ou armazenadas por meses.
É importante destacar as principais etapas do protocolo que são necessárias para o uso ideal desse sistema. Em primeiro lugar, a etiqueta VNp1 deve estar localizada no terminal N, seguida da proteína de interesse e das etiquetas apropriadas. Também é importante evitar o uso de antibióticos que têm como alvo a camada peptidoglicana, como a ampicilina.
Em termos de condições de crescimento, meios ricos (por exemplo, meios LB ou TB) e uma alta relação área:volume são necessários para maximizar a produção de vesículas. A temperatura ótima para a produção de vesículas extracelulares é de 37 °C, mas as condições tipicamente necessárias para a expressão da proteína de interesse também devem ser consideradas. Para temperaturas de indução mais baixas, deve-se usar VNp6. Crucialmente, a indução do promotor T7 deve ser obtida usando não mais do que 20 μg/mL (84 μM) de IPTG quando as células atingirem um OD600 de 0,8-1,0. As proteínas expressas usando o sistema atingem a produção máxima de vesículas em 4 h ou após a indução noturna.
Apesar da simplicidade deste protocolo, ele requer otimização. A fusão da variante VNp, as temperaturas de expressão e os períodos de tempo de indução podem diferir dependendo da proteína de interesse. Além disso, há necessidade de otimizar a purificação e subsequente concentração de vesículas extracelulares do meio. O procedimento atual não é escalável e pode ser demorado. Essas são as limitações dessa metodologia.
A tecnologia VNp apresenta muitas vantagens em relação aos métodos tradicionais2. Permite a exportação vesicular de diversas proteínas, sendo o tamanho máximo expresso com sucesso até o momento de 175 kDa para vesículas que permanecem internas e 85 kDa para as que são exportadas. Além disso, essa tecnologia pode aumentar significativamente o rendimento de proteínas recombinantes com uma variedade de propriedades físicas e atividades. As vesículas exportadas contendo a proteína de interesse podem ser isoladas por filtração simples do meio pré-desembaraçado e podem ser posteriormente armazenadas, em meio de cultura estéril ou tamponamento, a 4 °C por vários meses.
As aplicações desse sistema são diversas, desde a ciência da descoberta até a biotecnologia aplicada e a medicina (por exemplo, através da produção de terapêuticas funcionais)3. A facilidade de produção, o processamento a jusante e o alto rendimento são qualidades atraentes nessas áreas e, especialmente, na indústria.
Disclosures
Os autores declaram não haver interesses financeiros concorrentes ou outros conflitos de interesse.
Acknowledgements
Os autores agradecem a diversos usuários do Twitter que levantaram questões sobre o protocolo apresentado no artigo que descreve a tecnologia VNp. A Figura 1A foi gerada usando ícones de flaticon.com. Este trabalho foi financiado pela Universidade de Kent e financiado pelo Conselho de Pesquisa em Biotecnologia e Ciências Biológicas (BB/T008/768/1 e BB/S005544/1).
Materials
| Name | Company | Catalog Number | Comments |
| Ampicillin | Melford | 69-52-3 | |
| Chloramphenicol | Acros Organics (Thermofisher Scientific) | 56-75-7 | |
| E. coli BL21 (DE3) | Lab Stock | N/A | |
| E. coli DH10β | Lab Stock | N/A | |
| Filters for microscope | Chroma | ||
| FM4-64 | Molecular Probes (Invitrogen) | T-3166 | Dissolved in DMSO, stock concentration 2 mM |
| ImageJ | Open Source | Downloaded from: https://imagej.net/ij/index.html | |
| Inverted microscope | Olympus | ||
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Melford | 367-93-1 | |
| Kanamycin sulphate | Gibco (Thermofisher Scientific) | 11815-024 | |
| LED light source for micrscope | Cairn Research Ltd | ||
| Lysogeny Broth (LB) / LB agar | Lab Stock | N/A | 10 g/L Tryptone; 10 g/L NaCl; 5 g/L Yeast Extract (1.5 g/L agar) |
| Metamorph imaging software | Molecular Devices | ||
| MF-Millipore Membrane filter (0.1 µm, MCE) | Merck | VCWP04700 | |
| Millipore Express PLUS membrane filter (0.45 µm, PES) | Merck | HPWP04700 | |
| Phosphate buffered saline (PBS) | Lab Stock | N/A | |
| Plasmids allowing expression of protein of interest with different VNp amino terminal fusions | Addgene | https://www.addgene.org/Dan_Mulvihill/ | |
| Terrific Broth (TB) | Lab Stock | N/A | 12 g/L Tryptone; 24 g/L Yeast Extract; 4 ml/L 10% glycerol; 17 mM KH2PO4 72 mM K2HPO4 |
References
- Eastwood, T. A., et al. High-yield vesicle-packaged recombinant protein production from E. coli. Cell Reports Methods. 3 (2), 100396 (2023).
- Makino, T., Skretas, G., Georgiou, G. Strain engineering for improved expression of recombinant proteins in bacteria. Microbial Cell Factories. 10, 32 (2011).
- Peng, C., et al. Factors influencing recombinant protein secretion efficiency in gram-positive bacteria: Signal peptide and beyond. Frontiers in Bioengineering and Biotechnology. 7, 139 (2019).
- Lewis, K., Klibanov, A. M. Surpassing nature: rational design of sterile-surface materials. Trends in Biotechnology. 23 (7), 343-348 (2005).
- Betz, W. J., Mao, F., Smith, C. B. Imaging exocytosis and endocytosis. Current Opinion in Neurobiology. 6 (3), 365-371 (1996).
- Mulvihill, D. P. Live cell imaging in fission yeast. Cold Spring Harbor Protocols. 2017 (10), (2017).
- Shaner, N. C., et al. A bright monomeric green fluorescent protein derived from Branchiostoma lanceolatum. Nature Methods. 10 (5), 407-409 (2013).
- Shen, Y., Chen, Y., Wu, J., Shaner, N. C., Campbell, R. E. Engineering of mCherry variants with long Stokes shift, red-shifted fluorescence, and low cytotoxicity. PloS One. 12 (2), e0171257 (2017).
- Periz, J., et al. A highly dynamic F-actin network regulates transport and recycling of micronemes in Toxoplasma gondii vacuoles. Nature Communications. 10 (1), 4183 (2019).
- Qiu, H., et al. Uniform patchy and hollow rectangular platelet micelles from crystallizable polymer blends. Science. 352 (6286), 697-701 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved