Microarray Polymer Profiling (MAPP) per l'analisi dei glicani ad alto rendimento
In This Article
Summary
La profilazione polimerica microarray (MAPP) è una tecnica ad alto rendimento per l'analisi della composizione dei glicani in campioni biologici.
Abstract
La profilazione polimerica con microarray (MAPP) è un approccio robusto e riproducibile per determinare sistematicamente la composizione e l'abbondanza relativa di glicani e glicoconiugati all'interno di una varietà di campioni biologici, inclusi tessuti vegetali e algali, materiali alimentari e campioni umani, animali e microbici. La tecnologia Microarray è alla base dell'efficacia di questo metodo fornendo una piattaforma di screening miniaturizzata e ad alto rendimento, che consente di caratterizzare contemporaneamente migliaia di interazioni tra glicani e sonde molecolari dirette da glicani altamente specifiche, utilizzando solo piccole quantità di analiti. I glicani costituenti vengono frazionati chimicamente ed enzimaticamente, prima di essere estratti sequenzialmente dal campione e immobilizzati direttamente su membrane di nitrocellulosa. La composizione dei glicani è determinata dall'attaccamento di specifiche sonde molecolari che riconoscono i glicani alle molecole estorte e stampate. MAPP è complementare alle tecniche convenzionali di analisi dei glicani, come l'analisi dei monosaccaridi e dei linkage e la spettrometria di massa. Tuttavia, le sonde molecolari che riconoscono i glicani forniscono informazioni sulle configurazioni strutturali dei glicani, che possono aiutare a chiarire le interazioni biologiche e i ruoli funzionali.
Introduction
I glicani sono onnipresenti in tutti i domini della vita e mostrano una diversità senza precedenti nella struttura e nella funzione rispetto ad altremacromolecole. Tuttavia, a causa della loro complessità, della variabilità nella biosintesi e nei legami glicosidici e della scarsità di metodi appropriati per sezionare le strutture dei glicani, la nostra comprensione di questa diversità nelle strutture e nelle funzioni èrelativamente limitata.
Molte tecniche di analisi dei glicani sono distruttive e richiedono la scomposizione dei glicani nei loro monosaccaridi costituenti, che possono oscurare contesti tridimensionali e biologici rilevanti3. Al contrario, gli anticorpi monoclonali (mAb), i moduli leganti i carboidrati (CBM), le lectine, le agglutinine virali e le adesine microbiche, note collettivamente come sonde molecolari che riconoscono i glicani (GRMP)4, riconoscono e si legano a epitopi specifici e possono essere utilizzati come strumenti per rilevare e discriminare tra glicani all'interno di matrici multiglicaniche complesse 5,6.
In questo articolo presentiamo il microarray polymer profiling (MAPP), un metodo rapido, versatile e non distruttivo per l'analisi dei glicani, applicabile a un ampio spettro di campioni biologici. Il metodo mira a fornire una tecnologia robusta e ad alto rendimento per l'analisi dei glicani da diversi sistemi biologici e industriali/commerciali. MAPP unisce la specificità di riconoscimento delle sonde molecolari dirette da glicani con una tecnologia di screening microarray riproducibile e ad alte prestazioni per consentire il profilo di migliaia di interazioni molecolari in parallelo. Il risultato di questo approccio è l'intuizione diagnostica della composizione e dell'abbondanza relativa di glicani all'interno di un campione o di un tessuto di interesse.
MAPP può essere utilizzato come metodo indipendente, stand-alone, o in combinazione con altre tecniche biochimiche, come la microscopia a immunofluorescenza 7,8,9 e l'analisi monosaccaridica o di linkage10,11. La tecnica può anche essere utilizzata per mappare le specificità degli epitopi dei nuovi GRMP, utilizzando array stampati con standard di oligosaccaridi puri e strutturalmente ben definiti12. Uno dei principali vantaggi di MAPP rispetto ad altri metodi, come il saggio di immunoassorbimento enzimatico (ELISA), è la sua compatibilità con piccoli volumi di campione13,14. Inoltre, MAPP offre un'analisi a produttività significativamente più elevata15 e fornisce una forma efficace di conservazione dei campioni, poiché i campioni stampati sono asciutti e stabili quando immobilizzati su nitrocellulosa16.
Il legame dei GRMP dipende generalmente dalla presenza di un certo numero di residui zuccherini contigui che formano collettivamente un sito di legame (epitopo) che è unico per una particolare classe di polisaccaridi (xilano, mannano, xiloglucano, ecc.) 17. Al contrario, i singoli residui zuccherini (xilosio, mannosio, glucosio) quantificati utilizzando la maggior parte delle tecniche biochimiche, ad esempio la composizione dei monosaccaridi o l'analisi della metilazione, possono essere componenti di più classi di polisaccaridi e quindi difficili da assegnare18.
MAPP è stato sviluppato in risposta a una lacuna tecnologica, vale a dire la capacità di analizzare rapidamente più glicani da una varietà di fonti utilizzando piccole quantità di materiale. MAPP capitalizza l'ampio repertorio di GRMP che sono stati sviluppati e caratterizzati negli ultimi tre decenni 12,19,20,21,22,23,24,25,26,27,28,29,30,31,32. Lo sviluppo di MAPP è stato un processo iterativo, con la tecnica costantemente perfezionata e ottimizzata. Esiste ora una notevole letteratura che descrive l'applicazione di MAPP a vari sistemi naturali e industriali in cui i glicani svolgono ruoli centrali 5,6,9,10,21,33,34,35,36,37,38,39. Qui descriviamo lo stato attuale dell'arte di MAPP.
Protocol
Le principali fasi sperimentali del metodo MAPP sono riassunte nella Figura 1.
1. Preparazione dei campioni
NOTA: In questo caso, il metodo viene applicato ai tessuti vegetali a scopo illustrativo. Le piante selezionate sono state Coffea arabica, Allium sativum var. ophioscorodon e diverse varietà di mango thailandese (Aokrong, Kam, Rad, Chokanan, Mamkamdang, Talabnak, Mahachanok e Nga). Le piante sono state selezionate per la loro importanza commerciale. La loro lavorazione per il consumo umano genera scarti agroindustriali attualmente sottoutilizzati, che possono fornire una fonte di prodotti a valore aggiunto, tra cui i glicani puri. Pertanto, MAPP è stato applicato per caratterizzare la composizione glicanica della biomassa vegetale di scarto per scopi di bioprospezione.
- Separare il materiale vegetale in diversi tessuti (ad es. radice, stelo e foglie).
- Essiccare i tessuti vegetali in forno ad aria calda a 40 °C per 12-24 h (diminuire/aumentare il tempo in base al campione). In alternativa, congelare i campioni in azoto liquido e successivamente liofilizzare per ~4 giorni.
- Omogeneizzare i campioni fino a ridurli in polvere fine utilizzando un pestello e un mortaio o un lizzatore meccanico per tessuti (vedere Tabella dei materiali) con un cuscinetto a sfere in ciascuna provetta.
NOTA: Per i tessuti vegetali freschi, si consiglia l'essiccazione o la liofilizzazione prima dell'omogeneizzazione. Generalmente, l'omogeneizzazione con un pestello e un mortaio è sufficiente per la maggior parte dei campioni secchi. Per campioni particolarmente resistenti, come cereali, legumi e alimenti trasformati come la pasta, la surgelazione istantanea in azoto liquido può aumentare la velocità e l'efficienza dell'omogeneizzazione del campione. Abbiamo scoperto che l'omogeneizzazione meccanica è compatibile con quasi tutti i tipi di campioni, è considerevolmente più veloce e meno laboriosa e riduce efficacemente il rischio di contaminazione incrociata del campione dall'uso ripetuto della stessa apparecchiatura (ad esempio, pestello e mortaio).
2. Preparazione del residuo insolubile in alcool (ARIA)
- Aggiungere 1,5 mL di etanolo al 70% (v/v) a 50-100 mg di campione essiccato all'aria e omogeneizzato.
- Frullare accuratamente per mescolare e poi centrifugare a 10.000 x g per 10 minuti a temperatura ambiente. Scartare il surnatante risultante utilizzando una pipetta e trattenere il pellet.
- Al pellet rimanente, aggiungere 1,5 mL di metanolo e cloroformio (1:1 [v/v]). Vorticare, centrifugare ed eliminare il surnatante, come da passaggio 2.2.
- Al pellet rimanente, aggiungere 1,5 mL di acetone al 100%. Vorticare, centrifugare ed eliminare il surnatante, come da passaggio 2.2.
- Mettere il pellet risultante per una notte in una cappa aspirante per consentire l'evaporazione dell'acetone residuo o in una centrifuga sottovuoto fino a quando non è asciutto.
NOTA: Il materiale AIR può essere conservato a temperatura ambiente fino a quando non è necessario.
3. Estrazione di glicani
NOTA: Se possibile, eseguire tutte le fasi di estrazione in un lizzatore tissutale con un cuscinetto a sfere in ciascuna provetta per favorire la risospensione. Se non è disponibile un lisatore tissutale, le estrazioni possono essere eseguite con agitazione o agitazione continua. Se ciò non è possibile, potrebbe essere necessario prolungare il tempo di estrazione.
- A 10 mg di materiale AIR, aggiungere 30 μL/mg di acido cicloesandiamminotetraacetico 50 mM (CDTA; vedere Tabella dei materiali), pH 7,5.
- Agitare a 27 Hz per 2 minuti, seguito da 10 Hz per 2 ore.
- Centrifugare a 10.000 x g per 10 minuti a 4 °C. Conservare il surnatante risultante, aggiungerlo a una provetta sterile per microcentrifuga e conservarlo a 4 °C su un agitatore rotante.
- Al pellet residuo, aggiungere 30 μL/mg 4 M NaOH + 0,1 % (p/v) NaBH4.
ATTENZIONE: NaBH4 è tossico se ingerito. Utilizzare dispositivi di protezione individuale (DPI). Maniglia sotto una cappa aspirante. Evitare la formazione di polvere. Evitare di respirare la polvere. Evitare che il prodotto entri in contatto con l'acqua. - Ripetere i passaggi da 3.2 a 3.3. Lavare il pellet residuo due o tre volte con dH2O per rimuovere il NaOH residuo.
- Aggiungere 30 μL/mg di cellulasi (preferibilmente GH5 endo-1,4-β-glucanasi, in un tampone enzimatico appropriato, come raccomandato dal produttore; vedere la tabella dei materiali) al pellet e incubare alla temperatura ottimale dell'enzima per 16 ore.
- Centrifugare i campioni a 10.000 x g per 10 minuti a 4 °C. Conservare il surnatante, trasferire in provette di microcentrifuga pulite e conservare a 4 °C su un agitatore rotante. Una volta estratti, i campioni devono essere stampati il prima possibile.
- Centrifugare nuovamente tutti gli estratti conservati a 10.000 x g per 10 minuti a 4 °C.
NOTA: I campioni devono essere privi di particolato e detriti. Se necessario, passare attraverso un filtro di rotazione da 0,2 μm prima della stampa su microarray. I campioni particolarmente viscosi sono incompatibili con l'analisi dei microarray, poiché i capillari del microarrayer e la testina di stampa possono ostruirsi facilmente. Come regola generale, gli utenti dovrebbero essere in grado di pipettare tutti i campioni destinati alla stampa con una pipetta standard a basso volume.
4. Elaborazione delle norme
- Preparare soluzioni da 1 mg/mL di standard glicani definiti (Tabella 1) in dH2O sterile. Se si utilizza pachyman come standard, sciogliere invece in NaOH 4 M e neutralizzare con acido acetico glaciale dopo la solubilizzazione.
- Conservare gli standard preparati per una notte a 4 °C su un agitatore rotante per consentire la completa solubilizzazione.
- Centrifugare tutti gli standard per 10 minuti a 10.000 x g a 4 °C per pellettare eventuali detriti. Il surnatante risultante viene utilizzato per la stampa successiva.
5. Stampa di microarray
- Preparare una diluizione 1:20 (v/v) di inchiostro di china/inchiostro da disegno nero in tampone del sistema glicerolo (GSB; combinare 47% glicerolo, 52,9% dH2O, 0,06% Triton X-100 e 0,04% biocida [0,15%-0,17% nitrato rameico e 1,4%-2,0% nitrato di magnesio in acqua] e sterilizzare con filtro) (vedere Tabella dei materiali) e centrifugare per 10 minuti a 15.000 x g (temperatura ambiente).
NOTA: La soluzione di inchiostro è necessaria per creare un bordo superiore e inferiore attorno ai campioni stampati, in modo che i microarray stampati possano essere rilevati visivamente sulla membrana. Tuttavia, è probabile che la soluzione di inchiostro contenga sedimenti. Tutte le soluzioni devono essere prive di particolato per la stampa, in modo da evitare di disturbare il sedimento durante il pipettaggio. Scartare e preparare fresco quando ciò non è più possibile. La soluzione non può essere facilmente filtrata per rimuovere il particolato. - Aggiungere 40 μL di soluzione di inchiostro e GSB alla prima sezione della prima piastra a 384 pozzetti (Figura 2).
- Aggiungere 25 μL di GSB a tutti i pozzetti di diluizione 1 (D1). Aggiungere 40 μL di GSB a tutti i pozzetti di diluizione 2, 3 e 4 (D2-D4).
- Diluire i campioni di glicani estratti e i substrati glicani definiti 1:1 (v/v) con GSB aggiungendo 25 μL di campione di glicani estratti ai pozzetti D1 nell'ordine.
- Diluire in serie ogni campione quattro volte prelevando 10 μL del campione dal pozzetto D1 e aggiungendolo al pozzetto D2. Aspirare delicatamente con una pipetta per mescolare.
- Ripetere il processo prelevando 10 μL di campione dal pozzetto D2 e aggiungendolo al pozzetto D3.
- Ripetere l'operazione per il pozzo D4. Dopo la miscelazione, scartare 10 μL dal pozzetto D4 in modo che ogni pozzetto contenga un volume finale di 40 μL.
- Aggiungere 40 μL di soluzione di inchiostro e GSB al blocco finale della lastra finale.
- Coprire le piastre con un coperchio adesivo e centrifugare per 10 minuti a 3.000 x g (temperatura ambiente). Assicurarsi che non rimangano bolle dopo la centrifugazione e ripetere se necessario.
- Utilizzando un robot di stampa piezoelettrico senza contatto, stampare i campioni sulla membrana di nitrocellulosa (vedere la tabella dei materiali) seguendo i passaggi seguenti.
NOTA: Di seguito sono riportate le azioni consigliate per una qualità di stampa ottimale; Tuttavia, i parametri specifici richiesti dipenderanno in ultima analisi dallo strumento utilizzato. Si consiglia agli utenti di contattare il produttore dello strumento per discutere le personalizzazioni appropriate e le impostazioni di stampa necessarie per il proprio dispositivo.- Prima di stampare, svuotare il serbatoio del tampone di scarto e riempire il serbatoio del tampone pulito con GSB pulito, se necessario. Accendere lo strumento e lasciarlo stabilizzare per >10 minuti se dispone di un sistema di controllo dell'umidità e della temperatura integrato. Accendere il microarrayer e inizializzare il sistema.
NOTA: Si consiglia di eseguire un test per determinare la pressione interna dello strumento. Se la pressione è troppo bassa, potrebbe essere necessario eseguire uno spurgo ad alta pressione. Anche in questo caso, contattare il produttore dello strumento per discutere il funzionamento specifico dello strumento specifico. - Spurgare più volte la testina di stampa e i capillari con GSB per rimuovere detriti e potenziali contaminanti. Eseguire una tiratura di stampa di prova caricando solo una lastra di GSB o impostando lo strumento per stampare direttamente dal serbatoio del tampone pulito, bypassando l'aspirazione del campione da una lastra caricata.
NOTA: Non è necessario eseguire la stampa di prova utilizzando una membrana in nitrocellulosa; I vetrini puliti del microscopio sono sufficienti e offrono il vantaggio che le dimensioni, la forma e la qualità dello spot possono essere valutate visivamente prima della stampa del campione. - Quando si stampano campioni di glicani estratti, programmare il sistema in modo che venga lavato con GSB pulito tra un campione e l'altro.
NOTA: In genere, il volume del campione per punto stampato è compreso tra 100 pL e 10 nL e la dimensione del punto varia da 20 μm a 100 μm, a seconda del volume del campione selezionato. La stampa di 100 microarray da un'unica piastra a 384 pozzetti richiede circa 40 minuti, compreso il lavaggio del sistema. I microarray risultanti avranno una dimensione di circa 1 cm2 . Le piastre aggiuntive aumenteranno la lunghezza dell'array di circa 1 cm per piastra. Uno schema del progetto del microarray stampato è mostrato nella Figura 3. Una volta stampati, i microarray sono immediatamente pronti per l'uso e possono essere conservati per diversi anni. Se il lavoro di stampa deve essere ripetuto per qualsiasi motivo, a causa della potenziale evaporazione dei campioni durante la stampa, si consiglia di caricare una nuova lastra campione e di scartare la lastra originale. - Una volta alla settimana, pulire accuratamente la testina di stampa e i capillari. A tale scopo, caricare un pozzetto da 384 contenente una diluizione 1:20 di NaOH concentrato in GSB ed eseguire una tiratura di stampa da 40 minuti a 1 ora su vetrini da microscopio. Gli utenti devono assicurarsi che questa soluzione detergente sia compatibile con il proprio strumento prima di procedere.
- Prima di stampare, svuotare il serbatoio del tampone di scarto e riempire il serbatoio del tampone pulito con GSB pulito, se necessario. Accendere lo strumento e lasciarlo stabilizzare per >10 minuti se dispone di un sistema di controllo dell'umidità e della temperatura integrato. Accendere il microarrayer e inizializzare il sistema.
- Salvare il file griglia univoco (file .gal) prodotto per il microarray stampato pronto per l'analisi a valle.
6. Sonda di microarray
- Ritagliare singoli microarray stampati identici dalla membrana di nitrocellulosa e posizionarli in un recipiente di dimensioni adeguate per il sondaggio (ad esempio, una piastra per microtitolazione a 12 o 24 pozzetti) (vedere Tabella dei materiali). L'array dovrebbe essere piatto sulla base del recipiente. È necessario un microarray per sonda e rappresenta una replica tecnica.
- Per ridurre il legame non specifico, incubare i microarray per 1 ora in tampone bloccante MP-TBST (1x soluzione salina tamponata Tris, pH 7,5, + 0,1% [v/v] TWEEN 20 [TBST] e integrata con latte scremato in polvere al 5% [p/v]; vedere Tabella dei materiali) su un agitatore rotante/oscillante. Assicurarsi che il volume sia sufficiente per sommergere l'intero array.
- Dopo l'incubazione, rimuovere l'MP-TBST e sostituirlo con un nuovo volume di MP-TBST.
- Incubare gli array con anticorpi monoclonali (mAb) o CBM marcati con His, o altri GRMP (ad es. lectine), diluiti 1:10-1:1.000 (come specificato dal produttore; vedere la tabella dei materiali) in MP-TBST per 2 ore su un agitatore rotante/oscillante.
- Dopo l'incubazione, rimuovere la soluzione della sonda molecolare e coprire gli array con TBST pulito, assicurandosi che gli array siano completamente immersi. Per rimuovere la soluzione residua della sonda, rimuovere immediatamente il TBST e sostituirlo con un nuovo volume. Posizionare gli array su uno shaker rotante/oscillante per 5 minuti. Dopo 5 minuti, rimuovere il TBST, sostituirlo con un volume fresco e metterlo su uno shaker rotante/oscillante per 5 minuti.
NOTA: Questo processo deve essere ripetuto tre volte, senza includere l'aggiunta iniziale e la rimozione immediata di TBST. - Incubare le matrici con anticorpi secondari coniugati alcalino-fosfatasi (anti-topo, anti-ratto, anti-coniglio, anti-His, a seconda dei casi; vedere la tabella dei materiali) diluiti 1:1.000 in MP-TBST per 2 ore su un agitatore oscillante/rotante.
NOTA: Sono adatti anche gli anticorpi secondari coniugati con perossidasi di rafano, utilizzati in combinazione con il substrato di tetrametilbenzidina (TMB)/perossido di idrogeno per lo sviluppo del colore. - Dopo l'incubazione, ripetere la procedura di lavaggio, come indicato al punto 6.5, per rimuovere gli anticorpi secondari non legati in modo specifico.
- Coprire gli array in soluzione di sviluppo del colore nitro-blu tetrazolio (NBT)/5-bromo-4-cloro-3-indolil-fosfato (BCIP) (vedere la tabella dei materiali) per la rilevazione cromogenica del legame anticorpale. Lasciare agire fino a quando non si sviluppano macchie di precipitato viola nei siti di legame dell'antigene (in genere 5-30 minuti, tuttavia gli array devono essere monitorati attentamente per evitare la sovrasaturazione, poiché la reazione può avvenire rapidamente).
ATTENZIONE: Il BCIP è dannoso a contatto con la pelle e può causare irritazione delle vie respiratorie. Utilizzare i DPI. Evitare la formazione di polvere. Evitare di respirare la polvere. - Per terminare la reazione, immergere gli array in acqua di rubinetto pulita e lavare abbondantemente.
- Posizionare le matrici tra le carte assorbenti per una notte a temperatura ambiente ad asciugare.
- Scartare gli array con difetti evidenti e ripetere il protocollo di sondaggio in tali casi (Figura 4).
7. Analisi e quantificazione
- Scansiona gli array sviluppati con una risoluzione di 2.400 punti per pollice (dpi) utilizzando uno scanner desktop. Converti le immagini in file TIFF e poi in negativi.
- Utilizzando il software di analisi del microarray (vedere la tabella dei materiali), sovrapporre il file di griglia .gal univoco su ciascuna immagine del microarray per calcolare l'intensità del colore del punto prodotto in ciascun sito di legame dell'antigene e sottrarre lo sfondo locale.
- Esportare i dati della griglia come file .txt. Questi possono quindi essere importati manualmente in un foglio Excel per l'analisi.
- Generare un valore medio dell'intensità del segnale spot per ciascun campione calcolando la media dell'intensità spot prima su ciascuna diluizione del campione e poi su tutte le repliche biologiche incluse.
- Assegnare un valore di 100 all'intensità media massima del segnale spot e normalizzare i dati rimanenti di conseguenza.
NOTA: Le intensità medie normalizzate del segnale spot possono quindi essere presentate come una mappa termica dell'abbondanza relativa dell'epitopo di glicani utilizzando la funzione di formattazione condizionale in Excel33 o utilizzando la funzione geom_tile nel pacchetto R ggplot240,41.
Representative Results
MAPP è stato applicato per determinare la composizione glicanica degli scarti di biomassa agricola, comprendenti bucce di mango di diverse varietà della Thailandia settentrionale, polpa di ciliegia Coffea arabica e scarti di lavorazione dei chicchi di caffè e radici, steli e tessuti fogliari di aglio nero tailandese, Allium sativum var. Diversi polisaccaridi di origine vegetale sono utilizzati nell'industria alimentare come ingredienti funzionali42,43. Pertanto, lo scopo di questo esperimento è stato quello di dedurre se questi materiali di scarto agro-industriali abbondanti e attualmente sottoutilizzati possano fornire una fonte di polisaccaridi puri a valore aggiunto.
Il materiale AIR viene utilizzato abitualmente per preparare campioni destinati all'analisi dei glicani44. Ci sono diversi vantaggi nell'utilizzo di AIR; il trattamento con solventi rimuove efficacemente CAZymes, metaboliti, piccoli saccaridi, lipidi e pigmenti endogeni, ottenendo campioni arricchiti con polisaccaridi e proteine strutturali34. Inoltre, la produzione di AIR è un modo rapido ed efficace per aumentare la longevità del campione, in quanto è termostabile e può essere conservato per diversi anni.
Tre frazioni miste di glicani costituenti sono state estratte in sequenza dal materiale AIR vegetale utilizzando CDTA, NaOH e cellulasi. CDTA chela gli ioni Ca2+ , che consentono la rimozione delle pectine deesterificate reticolate di Ca2+ dalle pareti cellulari vegetali45. Le condizioni alcaline consentono il rilascio di emicellulose, come mannano, xilano e β-glucano, a causa dell'interruzione del legame idrogeno e della saponificazione dei legami estere tra microfibrille di cellulosa ed emicellulosa e lignina ed emicellulosa, rispettivamente,46. Un'endo-1,4-β-glucanasi ricombinante da Bacillus spp. è stata utilizzata per degradare le regioni amorfe delle microfibrille strutturali di cellulosa, rilasciando glicani residui legati alla cellulosa all'interno delle pareti cellulari47. Sebbene questo metodo separi efficacemente i glicani in questi tre grandi gruppi, va notato che i campioni non sono puri; per la natura stessa del metodo di estrazione, l'emicellulosa, se presente nel campione, sarà inevitabilmente estratta e successivamente rilevata in varia misura nelle frazioni CDTA e cellulasi. Allo stesso modo, un po' di pectina sarà rilevata nell'estrazione di NaOH se presente nel campione.
Un robot piezoelettrico senza contatto per la stampa di microarray è stato utilizzato per immobilizzare le frazioni glicaniche estratte sulla nitrocellulosa tramite l'attacco non covalente11, formando 300 microarray identici. Gli standard di glicani definiti (Tabella 1) sono stati inclusi anche nei microarray stampati come controlli positivi (Figura 5). Il profilo di legame MAPP ottenuto per gli standard glicani selezionati corrisponde alle specificità degli epitopi precedentemente riportate. Ad esempio, LM21 ha mostrato un forte legame con più polisaccaridi di mannano (galattomannano e glucomannano), mentre LM22 ha mostrato solo un debole legame con il galattomannano25. Allo stesso modo, LM19 si lega preferenzialmente all'omogalatturonanodeesterificato 48 e LM15 si lega allo xiloglucano23 del seme di tamarindo.
L'abbondanza relativa di 16 epitopi, diagnostici di polisaccaridi della parete cellulare vegetale non cellulosica, è stata rilevata mediante l'attaccamento di anticorpi monoclonali diretti ai glicani (Tabella 2) agli estratti stampati (Figura 6). La maggior parte dei glicani estratti è stata rilevata all'interno della frazione alcalina di NaOH. Forti segnali di legame sono stati registrati per gli anticorpi monoclonali LM10 e LM11, che rappresentano xilano/arabinoxilan, all'interno delle bucce di tutte le varietà di mango testate. All'interno dei campioni di aglio, LM10 e LM11 si sono legati preferenzialmente all'estratto di tessuto radicale (aglio R) e hanno mostrato solo un debole legame con l'estratto di tessuto fogliare (aglio L). LM19, che rappresenta omogalatturonan parzialmente metil-esterificato o non esterificato, fortemente legato ad alcuni estratti di varietà di mango (Aokrong e Talabnak), ma legato solo debolmente, o il suo legame non era rilevabile, in altre varietà (Chokanan, Mamkamdang, Mahachanok e Nga). Inoltre, LM19 si è legato solo alle frazioni di polpa di caffè e non si è legato al materiale di scarto della lavorazione dei chicchi di caffè, precedentemente ritenuto composto da pectina di caffè semi-purificata (dati non pubblicati).
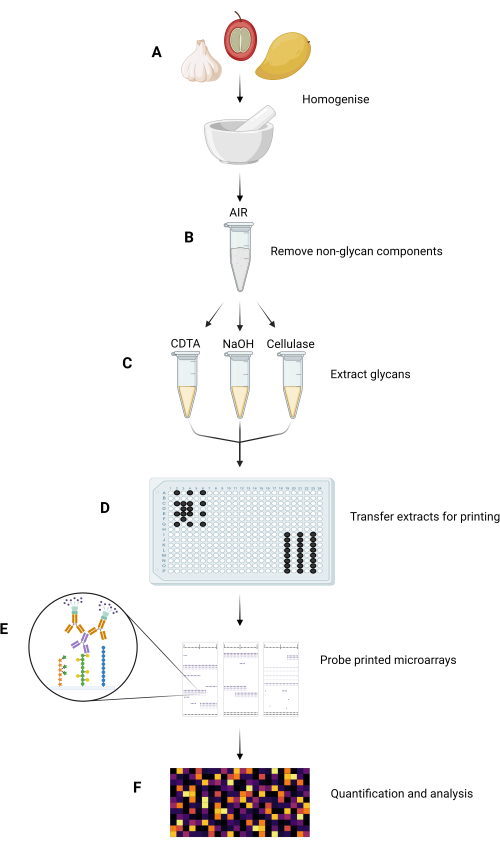
Figura 1: Principali fasi sperimentali del metodo MAPP. (A) I campioni vengono omogeneizzati per formare polveri fini. (B) I campioni omogeneizzati vengono processati per isolare i loro AIR. (C) I glicani costituenti sono estratti in sequenza utilizzando un regime di estrazione su misura. (D) Le frazioni glicaniche estratte vengono trasferite in piastre da 384 pozzetti, secondo il layout della piastra, per la stampa su nitrocellulosa. (E) I microarray stampati vengono sondati con GRMP selezionati. (F) Il legame dei GRMP alle frazioni glicaniche stampate viene quantificato e analizzato prima che i dati vengano presentati come mappa di calore. Fare clic qui per visualizzare una versione più grande di questa figura.
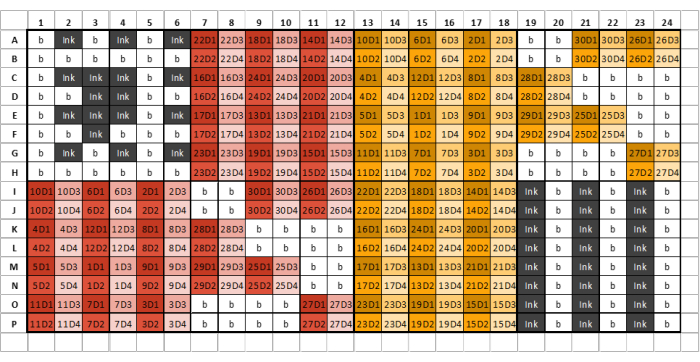
Figura 2: Esempio di layout di una piastra a 384 pozzetti per il caricamento di campioni, inchiostri e GSB con quattro diluizioni per campione/standard di glicani estratti. Colori diversi denotano campioni derivanti da diversi reagenti di estrazione, mentre tonalità diverse rappresentano diluizioni seriali. Il primo numero nel codice rappresenta il numero del campione, mentre il numero finale rappresenta il numero di diluizione (D1 indica la diluizione uno, D2 indica la diluizione due e così via). Ad esempio, un bene etichettato '12D3' rappresenta il campione di glicani 12, diluizione tre. Le piastre dei pozzetti devono essere divise in otto sezioni identiche composte da sei colonne e otto file. La prima sezione della prima lastra deve contenere solo inchiostro e tampone e deve essere simile al layout della lastra di esempio. I campioni di glicani estratti possono quindi essere caricati nelle sezioni successive della piastra in base al layout della piastra. Reagenti di estrazione diversi non devono essere caricati nella stessa sezione della piastra. Se non ci sono campioni sufficienti per riempire un'intera sezione, riempire tutti i pozzetti rimanenti in quella sezione con tampone; Non lasciare i pozzi vuoti. Se sono necessarie più lastre, la sezione successiva dopo che tutti i campioni sono stati caricati deve contenere tre colonne alternate di inchiostro e GSB: questa potrebbe non essere la sezione otto, a seconda del numero di campioni stampati. Fare clic qui per visualizzare una versione più grande di questa figura.
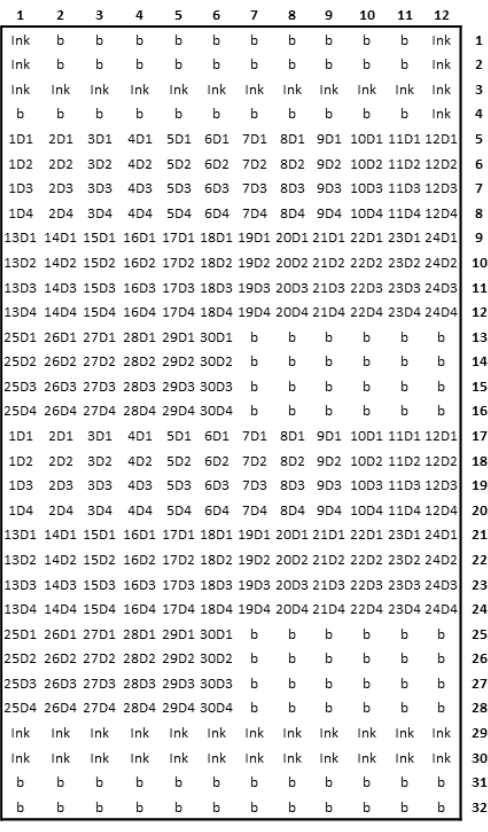
Figura 3: Rappresentazione schematica del progetto di microarray stampato. Fare clic qui per visualizzare una versione più grande di questa figura.
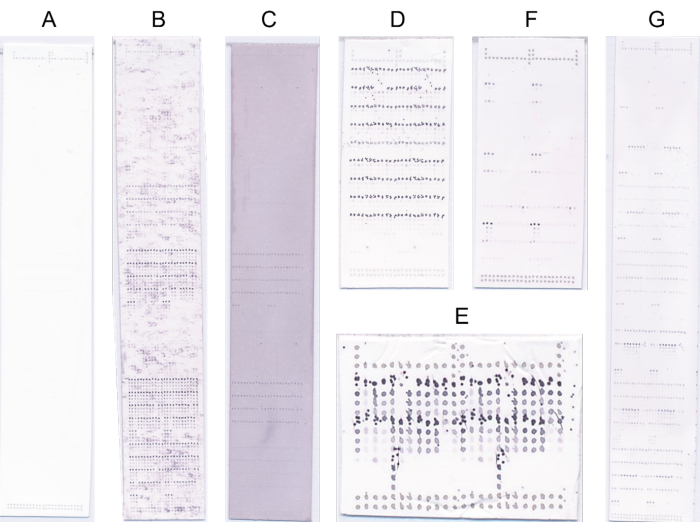
Figura 4: Microarray rappresentativi. (A) Nessun vincolo. (B) Il segnale di legame è oscurato da un segnale di fondo elevato. (C) Colorazione blu/viola generalizzata dovuta a sovrasaturazione con NBT/BCIP. (D) Tastatura difettosa a causa dell'elevata concentrazione del substrato. (E) Stampa difettosa a causa della testina di stampa sporca. (F) Forte legame a pochi campioni. (G) Forte legame con molti campioni. Fare clic qui per visualizzare una versione più grande di questa figura.
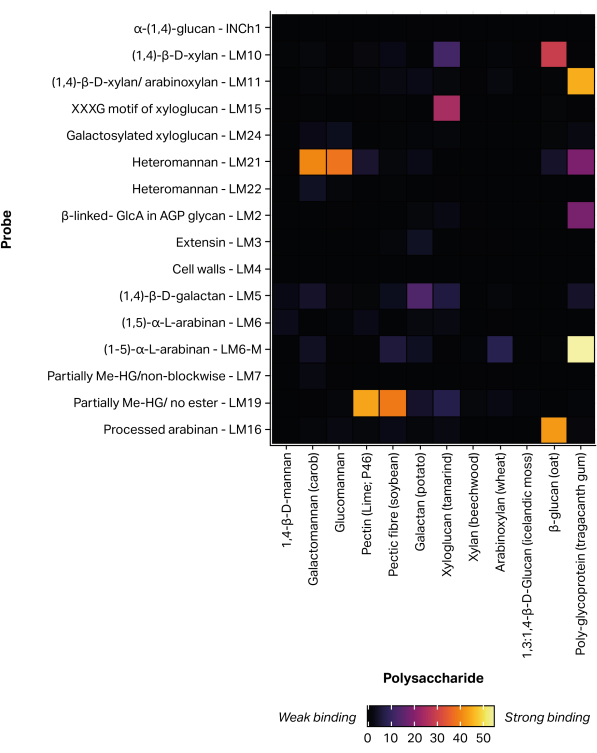
Figura 5: Legame dell'anticorpo monoclonale a standard glicani definiti, incluso per convalidare il processo di stampa e sondaggio. Fare clic qui per visualizzare una versione più grande di questa figura.
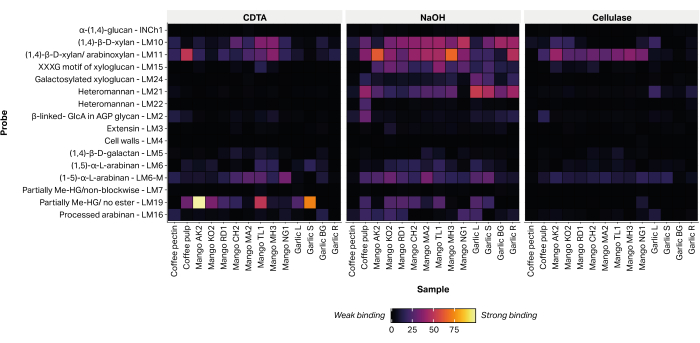
Figura 6: MAPP di glicani estratti da scarti di biomassa agricola. I campioni includono scarti di polpa di caffè (polpa di caffè e pectina di caffè), bucce di mango di diverse varietà thailandesi (AO, Aokrong; KO, Kam; RD, Rad; CH, Chokanan; MA, Mamkamdang; TL, Talabnak; MH, Mahachanok; NG, Nga) e foglie di aglio nero (Aglio L), gambo (Aglio S), bulbo (Aglio BG) e radici (Aglio R), utilizzando CDTA, NaOH e cellulasi (Bacillus spp. cellulasi 5A). Fare clic qui per visualizzare una versione più grande di questa figura.
Tabella 1: Standard commerciali definiti per i polisaccaridi utilizzati nell'analisi MAPP come controlli positivi. Clicca qui per scaricare questa tabella.
Tabella 2: Anticorpi monoclonali diretti contro glicani selezionati per l'interrogazione di microarray di glicani vegetali estratti. Clicca qui per scaricare questa tabella.
Discussion
La tecnica MAPP qui descritta è ormai un metodo consolidato per l'analisi dei glicani. I principi di base sono stati descritti per la prima volta nel 200711, ma la tecnica ha subito un continuo sviluppo al fine di capitalizzare le ultime innovazioni nella tecnologia dei microarray, lo sviluppo di sonde molecolari e i progressi nella nostra comprensione della biochimica dei glicani. In generale, i glicani, in particolare i polisaccaridi, sono più difficili da analizzare rispetto alle proteine e ai nucleotidi a causa della loro complessità strutturale ed eterogeneità45, nonché del fatto che non possono essere facilmente sequenziati o sintetizzati1. In molti casi, nessuna singola tecnica può decifrare in modo definitivo la complessità dei glicani; pertanto, MAPP viene spesso utilizzato con altri metodi. Questo è uno dei motivi per cui la preparazione dell'AIR viene solitamente scelta come punto di partenza per MAPP, poiché l'AIR è compatibile con la maggior parte degli altri metodi di analisi dei glicani34, facilitando il successivo confronto dei set di dati.
A causa dell'omogeneizzazione del campione prima della preparazione dell'aria, alcune informazioni spaziali vengono invariabilmente perse. Tuttavia, poiché i polisaccaridi vengono rilasciati sequenzialmente dai campioni, la presenza di epitopi nelle frazioni ottenute fornisce informazioni sull'architettura molecolare e sulla composizione di quel campione17. Pertanto, la selezione di un regime di estrazione appropriato è fondamentale per il successo del metodo. Diversi parametri determinano l'idoneità del metodo di estrazione: struttura cellulare, tempo, temperatura, pH, pressione, forza ionica del solvente e finezza del campione di particolato solido49. Si raccomanda di utilizzare una gamma di solventi sempre più aggressivi per massimizzare la probabilità di estrarre con successo i glicani costituenti e costruire un quadro compositivo rappresentativo del campione. Per la maggior parte dei campioni, CDTA, NaOH e cellulasi sono sufficienti per rimuovere i polisaccaridi di origine vegetale e della parete cellulare 33,50,51,52. Per alcuni campioni di tessuto, un regime di estrazione ibrido che include anche CaCl2, HCl e Na2CO3 ha dimostrato di avere successo53, mentre i campioni di microalghe marine possono richiedere l'aggiunta di acido etilendiamminotetraacetico (EDTA)10.
I microarray dovrebbero includere una serie di standard di glicani puri e definiti da utilizzare come controlli positivi5. Le norme incluse devono essere modificate in base alla natura del campione. Una volta stampato, è necessario selezionare i GRMP appropriati. La generazione di anticorpi monoclonali ibridomi in strutture polisaccaridicheè impegnativa 54; Gli anticorpi leganti i glicani sono difficili da allevare e possono avere una bassa affinità55. Fortunatamente, le informazioni sulla sequenza genica per i CBM possono essere ottenute con relativa facilità per l'espressione ricombinante4 e l'ingegnerizzazione delle loro specificità di legame56,57. Sebbene sia stato sviluppato un impressionante catalogo di GRMP, la maggior parte dei quali è ora disponibile da fonti commerciali, in relazione alla diversità delle strutture glicaniche esistenti in natura, solo una piccola parte è stata prodotta e caratterizzata con successo58. Ciò può limitare la capacità di rilevare e discriminare tra determinate strutture. Si consiglia di eseguire un primo esperimento di sondaggio utilizzando una o due sonde rappresentative di ciascuna struttura glicana principale che si prevede sia presente, per la quale la specificità di legame è ben caratterizzata. Nei successivi esperimenti di sondaggio, l'elenco delle sonde può essere ampliato per coprire una gamma più ampia di glicani e approfondire le strutture fini.
Anche se banale, garantire che i microarray vengano lavati accuratamente dopo ogni fase di incubazione è fondamentale per il successo della procedura di sondaggio. La rimozione inefficace di sonde non legate in modo specifico rischia di oscurare il risultato causando un segnale di fondo elevato dopo lo sviluppo del colore. In questo caso, è necessario ripetere la procedura di sondaggio, iniziando con un nuovo microarray. Inoltre, le matrici devono essere toccate con parsimonia e solo tenendo i bordi con una pinza; La membrana in nitrocellulosa è fragile e si danneggia facilmente. La soluzione per lo sviluppo del colore si accumula in crepe e pieghe, causando una sovrasaturazione, che impedisce l'analisi dell'array.
MAPP è veloce, adattabile e conveniente. Questo metodo è compatibile con glicani animali, microbici o vegetali derivati da qualsiasi sistema biologico o industriale, purché possano essere estratti e immobilizzati su nitrocellulosa, e per i quali si disponga di apposite sonde molecolari. I dati generati forniscono informazioni dettagliate, semi-quantitative, composizionali, che non possono essere facilmente ottenute tramite altri metodi di analisi dei glicani.
Disclosures
Gli autori dichiarano di non avere alcun conflitto di interessi.
Acknowledgements
Gli autori ringraziano ArrayJet per la sua consulenza esperta in materia di robotica microarray. SS e JS desiderano riconoscere il sostegno del Fondo fondamentale 2022 (FF65/004), Università di Chiang Mai.
Materials
| Name | Company | Catalog Number | Comments |
| 1,3:1,4-β-D-Glucan, Lichenan (icelandic moss) | Megazyme | P-LICHN | |
| 1,4-β-D-Mannan | Megazyme | P-MANCB | |
| 384-well microtiter plate | Greiner Bio-One | M1686 | |
| 5-bromo-4-chloro-3-indolyl-phosphate (BCIP) | Melford | B74100-1.0 | |
| Acetone | Sigma | 270725 | |
| Alkaline Phosphatase AffiniPure Goat Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 115-055-003 | |
| Alkaline Phosphatase AffiniPure Goat Anti-Rat IgG (H+L) | Jackson ImmunoResearch | 112-055-003 | |
| Alkaline Phosphatase AffiniPure Rabbit Anti-His Tag | Jackson ImmunoResearch | 300-055-240 | |
| Arabinoxylan (wheat) | Megazyme | P-WAXYL | |
| Array-Pro Analyzer Software | Media Cybernetics | Version 6.3 | |
| Bacillus sp. Cellulase 5A (BCel5A) | NZYTech | CZ0564 | |
| BAM antibodies | SeaProbes | Various | |
| Black drawing ink (indian ink) | Winsor & Newton | GWD030 | |
| Carbohydrate binding modules | NZYTech | Various | |
| CCRC antibodies | CarboSource | Various | |
| CDTA | Sigma | 319945 | |
| Chloroform | Sigma | PHR1552 | |
| Ethanol | Sigma | 1.11727 | |
| Galactan (potato) | Megazyme | P-GALPOT | |
| Galactomannan (carob) | Megazyme | P-GALML | |
| Glycerol solution | Sigma | 49781-5L | |
| Gum tragacanth (legumes) | Sigma-Aldrich | G1128 | |
| INCh antibodies | INRA | Various | |
| LM and JIM antibodies | PlantProbes | Various | |
| Marathon Argus Microarray Printer | ArrayJet | ||
| Methanol | Sigma | 34860 | |
| Monoclonal antibodies | Biosupplies Australia | Various | |
| NaBH4 | Sigma | 452882 | |
| NaOH | Sigma | S5881 | |
| Nitro-blue tetrazolium (NBT) | Melford | N66000-1.0 | |
| Nitrocellulose membrane | Thermo Fisher Scientific | 88018 | |
| Pectin (degree of methyl esterification 46%) | Danisco | NA | |
| ProClin 200 | Sigma | 48171-U | |
| Rhamnogalacturonan (soybean pectic fibre) | Megazyme | P-RHAGN | |
| Rotating mixer | Fisher Scientific | 88-861-050 | |
| Rotating/rocking Shaker | Cole-Parmer | ||
| Skimmed milk powder | Marvel | ||
| Spin filter | Costar Spin-X | 8160 | |
| Stainless steel beads | Qiagen | 69989 | |
| TissueLyser II | Qiagen | 85300 | |
| Tris | Sigma | 93362 | |
| Triton X-100 | Sigma | T8787-250ML | |
| Tween 20 | Sigma | P9416-100ML | |
| Xylan (beechwood) | Megazyme | P-XYLNBE | |
| Xyloglucan (tamarind) | Megazyme | P-XYGLN | |
| β-Glucan (oat) | Megazyme | P-BGOM |
References
- Amicucci, M. J., et al. A nonenzymatic method for cleaving polysaccharides to yield oligosaccharides for structural analysis. Nature Communications. 11 (1), 3963 (2020).
- Gagneux, P., Panin, V., Hennet, T., Aebi, M., Varki, A. Evolution of glycan diversity. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Willats, W. G. T., McCartney, L., Knox, J. P. Pectin cell biology: complexity in context. Advances in Pectin and Pectinase Research. , 147-157 (2003).
- Cummings, R. D., et al. Glycan-recognizing probes as tools. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Bakshani, C. R., et al. Analysis of glycans in a Burnt-on/Baked-on (BoBo) model food soil using Microarray Polymer Profiling (MAPP) and immunofluorescence microscopy. Food Chemistry. 410, 135379 (2023).
- Salmeán, A. A., Willats, W. G. T., Ribeiro, S., Andersen, T. J., Ellegaard, M. Over 100-year preservation and temporal fluctuations of cell wall polysaccharides in marine sediments. Frontiers in Plant Science. 13, 785902 (2022).
- Cid, M., et al. Recognition of the helical structure of β-1,4-galactan by a new family of carbohydrate-binding modules. Journal of Biological Chemistry. 285 (46), 35999-36009 (2010).
- Runavot, J. -. L., et al. Non-cellulosic polysaccharides from cotton fibre are differently impacted by textile processing. PLoS One. 9 (12), e115150 (2014).
- Ahl, L. I., et al. Analyses of aloe polysaccharides using carbohydrate microarray profiling. Journal of AOAC International. 101 (6), 1720-1728 (2018).
- Vidal-Melgosa, S., et al. Diatom fucan polysaccharide precipitates carbon during algal blooms. Nature Communications. 12 (1), 1150 (2021).
- Moller, I., et al. High-throughput mapping of cell-wall polymers within and between plants using novel microarrays. The Plant Journal. 50 (6), 1118-1128 (2007).
- Ruprecht, C., et al. A synthetic glycan microarray enables epitope mapping of plant cell wall glycan-directed antibodies. Plant Physiology. 175 (3), 1094-1104 (2017).
- Cummings, R. D., et al. Principles of glycan recognition. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Gao, C., et al. Glycan microarrays as chemical tools for identifying glycan recognition by immune proteins. Frontiers in Chemistry. 7, 833 (2019).
- Vidal-Melgosa, S., et al. A new versatile microarray-based method for high throughput screening of carbohydrate-active enzymes. Journal of Biological Chemistry. 290 (14), 9020-9036 (2015).
- Willats, W. G. T., Rasmussen, S. E., Kristensen, T., Mikkelsen, J. D., Knox, J. P. Sugar-coated microarrays: A novel slide surface for the high-throughput analysis of glycans. Proteomics. 2 (12), 1666-1671 (2002).
- Sørensen, I., et al. The charophycean green algae provide insights into the early origins of plant cell walls. The Plant Journal. 68 (2), 201-211 (2011).
- Liu, D., Tang, W., Yin, J. -. Y., Nie, S. -. P., Xie, M. -. Y. Monosaccharide composition analysis of polysaccharides from natural sources: Hydrolysis condition and detection method development. Food Hydrocolloids. 116, 106641 (2021).
- Pattathil, S., et al. A comprehensive toolkit of plant cell wall glycan-directed monoclonal antibodies. Plant Physiology. 153 (2), 514-525 (2010).
- Verhertbruggen, Y., et al. Developmental complexity of arabinan polysaccharides and their processing in plant cell walls. The Plant Journal. 59 (3), 413-425 (2009).
- Rydahl, M. G., et al. Development of novel monoclonal antibodies against starch and ulvan - implications for antibody production against polysaccharides with limited immunogenicity. Scientific Reports. 7 (1), 9326 (2017).
- McCartney, L., Marcus, S. E., Knox, J. P. Monoclonal antibodies to plant cell wall xylans and arabinoxylans. The Journal of Histochemistry and Cytochemistry. 53 (4), 543-546 (2005).
- Marcus, S. E., et al. Pectic homogalacturonan masks abundant sets of xyloglucan epitopes in plant cell walls. BMC Plant Biology. 8, 60 (2008).
- Pedersen, H. L., et al. Versatile high resolution oligosaccharide microarrays for plant glycobiology and cell wall research. The Journal of Biological Chemistry. 287 (47), 39429-39438 (2012).
- Marcus, S. E., et al. Restricted access of proteins to mannan polysaccharides in intact plant cell walls. The Plant Journal. 64 (2), 191-203 (2010).
- Smallwood, M., Martin, H., Knox, J. P. An epitope of rice threonine-and hydroxyproline-rich glycoprotein is common to cell wall and hydrophobic plasma-membrane glycoproteins. Planta. 196 (3), 510-522 (1995).
- Smallwood, M., Yates, E. A., Willats, W. G. T., Martin, H., Knox, J. P. Immunochemical comparison of membrane-associated and secreted arabinogalactan-proteins in rice and carrot. Planta. 198 (3), 452-459 (1996).
- Wisniewski, J. P., Rathbun, E. A., Knox, J. P., Brewin, N. J. Involvement of diamine oxidase and peroxidase in insolubilization of the extracellular matrix: implications for pea nodule initiation by Rhizobium leguminosarum. Molecular Plant-Microbe Interactions. 13 (4), 413-420 (2000).
- Jones, L., Seymour, G. B., Knox, J. P. Localization of pectic galactan in tomato cell walls using a monoclonal antibody specific to (1[->]4)-β-D-galactan. Plant Physiology. 113 (4), 1405-1412 (1997).
- Willats, W. G., Marcus, S. E., Knox, J. P. Generation of a monoclonal antibody specific to (1→5)-α-L-arabinan. Carbohydrate Research. 308 (15), 149-152 (1998).
- Cornuault, V., et al. LM6-M: a high avidity rat monoclonal antibody to pectic α-1, 5-L-arabinan. BioRxiv. , 161604 (2017).
- Sutherland, P., Hallett, I., Jones, M. Probing cell wall structure and development by the use of antibodies: a personal perspective. New Zealand Journal of Forestry Science. 39, 197-205 (2009).
- Mikkelsen, M. D., et al. Ancient origin of fucosylated xyloglucan in charophycean green algae. Communications Biology. 4 (1), 754 (2021).
- Fangel, J. U., Jones, C. Y., Ulvskov, P., Harholt, J., Willats, W. G. T. Analytical implications of different methods for preparing plant cell wall material. Carbohydrate Polymers. 261, 117866 (2021).
- Moore, J. P., et al. Analysis of plant cell walls using high-throughput profiling techniques with multivariate methods. The Plant Cell Wall: Methods and Protocols. , 327-337 (2020).
- Gao, Y., Fangel, J. U., Willats, W. G. T., Moore, J. P. Tracking polysaccharides during white winemaking using glycan microarrays reveals glycoprotein-rich sediments. Food Research International. 123, 662-673 (2019).
- Solden, L. M., et al. Interspecies cross-feeding orchestrates carbon degradation in the rumen ecosystem. Nature Microbiology. 3 (11), 1274-1284 (2018).
- Fangel, J. U., et al. Tracking polysaccharides through the brewing process. Carbohydrate Polymers. 196, 465-473 (2018).
- Mravec, J., et al. Pea border cell maturation and release involve complex cell wall structural dynamics. Plant Physiology. 174 (2), 1051-1066 (2017).
- Wickham, H. . ggplot2: elegant graphics for data analysis. , (2009).
- Gu, Z. Complex heatmap visualization. iMeta. 1 (3), 43 (2022).
- Nasrollahzadeh, M., Nezafat, Z., Shafiei, N., Soleimani, F. . Polysaccharides in Food Industry. , (2021).
- Shao, P., et al. Recent advances in improving stability of food emulsion by plant polysaccharides. Food Research International. 137, 109376 (2020).
- Sanz, M. L., Martínez-Castro, I. Recent developments in sample preparation for chromatographic analysis of carbohydrates. Journal of Chromatography. A. 1153 (1-2), 74-89 (2007).
- Bethke, G., Glazebrook, J. Cyclohexane diamine tetraacetic acid (CDTA) extraction of plant cell wall pectin. Bio-Protocol. 4 (24), e1357 (2014).
- Lu, Y., He, Q., Fan, G., Cheng, Q., Song, G. Extraction and modification of hemicellulose from lignocellulosic biomass: A review. Green Processing and Synthesis. 10 (1), 779-804 (2021).
- Jayasekara, S., Ratnayake, R. Microbial cellulases: an overview and applications. Cellulose. 22, 92 (2019).
- Verhertbruggen, Y., Marcus, S. E., Haeger, A., Ordaz-Ortiz, J. J., Knox, J. P. An extended set of monoclonal antibodies to pectic homogalacturonan. Carbohydrate Research. 344 (14), 1858-1862 (2009).
- Villares, A., Mateo-Vivaracho, L., Guillamón, E. Structural features and healthy properties of polysaccharides occurring in mushrooms. Agriculture. 2 (4), 452-471 (2012).
- Kračun, S. K., et al. Carbohydrate microarray technology applied to high-throughput mapping of plant cell wall glycans using comprehensive microarray polymer profiling (CoMPP). Methods in Molecular Biology. 1503, 147-165 (2017).
- Rajasundaram, D., et al. Understanding the relationship between cotton fiber properties and non-cellulosic cell wall polysaccharides. PLoS One. 9 (11), e112168 (2014).
- Michalak, L., et al. Microbiota-directed fibre activates both targeted and secondary metabolic shifts in the distal gut. Nature Communications. 11 (1), 5773 (2020).
- Salmeán, A. A., Hervé, C., Jørgensen, B., Willats, W. G., Mravec, J. Microarray glycan profiling reveals algal fucoidan epitopes in diverse marine metazoans. Frontiers in Marine Science. 4, 293 (2017).
- Knox, J. P. Revealing the structural and functional diversity of plant cell walls. Current Opinion in Plant Biology. 11 (3), 308-313 (2008).
- Manimala, J. C., Roach, T. A., Li, Z., Gildersleeve, J. C. High-throughput carbohydrate microarray profiling of 27 antibodies demonstrates widespread specificity problems. Glycobiology. 17 (8), 17-23 (2007).
- Stephen, P., Tseng, K. -. L., Liu, Y. -. N., Lyu, P. -. C. Circular permutation of the starch-binding domain: inversion of ligand selectivity with increased affinity. Chemical Communications. 48 (20), 2612-2614 (2012).
- Gunnarsson, L. C., Dexlin, L., Karlsson, E. N., Holst, O., Ohlin, M. Evolution of a carbohydrate binding module into a protein-specific binder. Biomolecular Engineering. 23 (2-3), 111-117 (2006).
- Moller, I., et al. High-throughput screening of monoclonal antibodies against plant cell wall glycans by hierarchical clustering of their carbohydrate microarray binding profiles. Glycoconjugate Journal. 25 (1), 37-48 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved