Профилирование полимеров на микрочипах (MAPP) для высокопроизводительного гликанового анализа
In This Article
Summary
Микроматричное профилирование полимеров (MAPP) — это высокопроизводительный метод анализа состава гликанов в биологических образцах.
Abstract
Профилирование полимеров с помощью микрочипов (MAPP) — это надежный и воспроизводимый подход к систематическому определению состава и относительного содержания гликанов и гликоконъюгатов в различных биологических образцах, включая ткани растений и водорослей, пищевые материалы, а также образцы людей, животных и микробов. Технология микрочипов подкрепляет эффективность этого метода, предоставляя миниатюрную, высокопроизводительную платформу для скрининга, позволяющую одновременно характеризовать тысячи взаимодействий между гликанами и высокоспецифичными гликан-направленными молекулярными зондами, используя только небольшие количества аналитов. Составляющие гликаны химически и ферментативно фракционируются, а затем последовательно извлекаются из образца и непосредственно иммобилизуются на нитроцеллюлозные мембраны. Состав гликанов определяется путем присоединения специфических гликан-распознающих молекулярных зондов к извлеченным и напечатанным молекулам. MAPP дополняет традиционные методы анализа гликанов, такие как анализ моносахаридов и сцепления, а также масс-спектрометрия. Тем не менее, молекулярные зонды, распознающие гликаны, дают представление о структурных конфигурациях гликанов, что может помочь в выяснении биологических взаимодействий и функциональных ролей.
Introduction
Гликаны повсеместно распространены во всех сферах жизни и демонстрируют беспрецедентное разнообразие в структуре и функциях по сравнению с другимимакромолекулами. Однако из-за их сложности, вариабельности биосинтеза и гликозидных связей, а также недостатка соответствующих методов для рассечения гликановых структур, наше понимание этого разнообразия структур и функцийотносительно ограничено.
Многие методы анализа гликанов являются деструктивными и требуют расщепления гликанов на составляющие их моносахариды, что может затемнять соответствующие трехмерные и биологическиеконтексты. И наоборот, моноклональные антитела (мАТ), модули связывания углеводов (МКМ), лектины, вирусные агглютинины и микробные адгезины, известные под общим названием молекулярные зонды, распознающие гликан (GRMP)4, распознают и связываются со специфическими эпитопами и могут использоваться в качестве инструментов для обнаружения и дифференциации гликанов в сложных мультигликановых матрицах 5,6.
В этой статье мы представляем микроматричное профилирование полимеров (MAPP) — быстрый, универсальный и неразрушающий метод анализа гликанов, применимый к широкому спектру биологических образцов. Метод направлен на обеспечение надежной и высокопроизводительной технологии для анализа гликанов из различных биологических и промышленных/коммерческих систем. MAPP объединяет специфичность распознавания гликан-ориентированных молекулярных зондов с воспроизводимой, высокопроизводительной технологией скрининга микрочипов, что позволяет параллельно профилировать тысячи молекулярных взаимодействий. Результатом этого подхода является диагностическое понимание состава и относительного содержания гликанов в образце или ткани, представляющей интерес.
MAPP может использоваться как самостоятельный метод или в сочетании с другими биохимическими методами, такими как иммунофлуоресцентная микроскопия 7,8,9 и анализ моносахаридов или сцепления10,11. Этот метод также может быть использован для картирования эпитопных специфичностей новых GRMP с использованием матриц, напечатанных с чистыми и структурно четко определенными олигосахаридными стандартами12. Основным преимуществом МАПП по сравнению с другими методами, такими как иммуноферментный анализ (ИФА), является его совместимость с небольшими объемами образцов13,14. Кроме того, MAPP обеспечивает значительно более высокую производительность анализа15 и обеспечивает эффективную форму консервации образцов, поскольку напечатанные образцы сухие и стабильные при иммобилизации на нитроцеллюлозе16.
Связывание GRMP, как правило, зависит от наличия ряда смежных сахарных остатков, которые в совокупности образуют сайт связывания (эпитоп), уникальный для определенного класса полисахаридов (ксилан, маннан, ксилоглюкозан и т. д.). 17. Напротив, отдельные остатки сахара (ксилоза, манноза, глюкоза), которые количественно оцениваются с помощью большинства биохимических методов, например, состава моносахаридов или анализа метилирования, могут быть компонентами нескольких классов полисахаридов и, таким образом, их трудно отнести к18.
MAPP был разработан в ответ на технологический пробел, а именно на возможность быстрого анализа нескольких гликанов из различных источников с использованием небольших количеств материала. MAPP использует обширный репертуар GRMP, который был разработан и охарактеризован за последние три десятилетия 12,19,20,21,22,23,24,25,26,27,28,29,30,31,32. Разработка MAPP была итеративным процессом, при этом техника постоянно совершенствовалась и оптимизировалась. В настоящее время существует значительный объем литературы, описывающей применение MAPP к различным природным и промышленным системам, где гликаны играют центральную роль 5,6,9,10,21,33,34,35,36,37,38,39. В этой статье мы опишем текущее состояние MAPP.
Protocol
Основные этапы эксперимента метода MAPP сведены на рисунке 1.
1. Подготовка образцов
ПРИМЕЧАНИЕ: Здесь метод применяется к растительным тканям в иллюстративных целях. Были выбраны следующие растения: Coffea arabica, Allium sativum var. ophioscorodon и несколько тайских сортов манго (Aokrong, Kam, Rad, Chokanan, Mamkamdang, Talabnak, Mahachanok и Nga). Растения были выбраны по их коммерческому значению. В результате их переработки для потребления человеком образуются недостаточно используемые агропромышленные отходы, которые могут стать источником продуктов с добавленной стоимостью, в том числе чистых гликанов. Таким образом, MAPP был применен для характеристики гликанового состава биомассы отходов завода для целей биоразведки.
- Разделите растительный материал на разные ткани (например, корень, стебель и листья).
- Высушить растительные ткани в печи с горячим воздухом при температуре 40 °C в течение 12-24 ч (уменьшить/увеличить время в соответствии с образцом). В качестве альтернативы можно мгновенно заморозить образцы в жидком азоте и затем лиофилизировать в течение ~4 дней.
- Гомогенизируйте образцы до состояния мелкодисперсного порошка с помощью пестика и ступки или механического тканевого лизера (см. таблицу материалов) с шарикоподшипником в каждой пробирке.
ПРИМЕЧАНИЕ: Для свежих растительных тканей рекомендуется сушка или лиофилизация перед гомогенизацией. Как правило, гомогенизация с помощью пестика и ступки достаточна для большинства сухих образцов. Для особо устойчивых образцов, таких как зерновые, бобовые и обработанные пищевые продукты, такие как макароны, быстрое замораживание в жидком азоте может повысить скорость и эффективность гомогенизации образцов. Мы обнаружили, что механическая гомогенизация совместима практически со всеми типами образцов, значительно быстрее и менее трудоемка, а также эффективно сводит к минимуму риск перекрестного загрязнения образцов при многократном использовании одного и того же оборудования (например, пестика и ступки).
2. Приготовление спиртового нерастворимого остатка (АИР)
- Добавьте 1,5 мл 70%-ного этанола к 50-100 мг высушенного на воздухе и гомогенизированного материала образца.
- Тщательно перемешайте, а затем центрифугируйте при 10 000 x g в течение 10 минут при комнатной температуре. Образовавшуюся надосадочную жидкость выбросьте с помощью пипетки и сохраните гранулу.
- К оставшейся грануле добавьте по 1,5 мл метанола и хлороформа (1:1 [v/v]). Встряхните, центрифугируйте и выбросьте надосадочную жидкость в соответствии с шагом 2.2.
- К оставшейся грануле добавьте 1,5 мл 100% ацетона. Встряхните, центрифугируйте и выбросьте надосадочную жидкость в соответствии с шагом 2.2.
- Поместите получившуюся гранулу либо на ночь в вытяжной шкаф, чтобы остатки ацетона испарились, либо в вакуумную центрифугу до полного высыхания.
ПРИМЕЧАНИЕ: Материал AIR можно хранить при температуре окружающей среды до тех пор, пока это не потребуется.
3. Гликановая экстракция
ПРИМЕЧАНИЕ: Если возможно, выполняйте все этапы экстракции в тканевой лизере с шарикоподшипником в каждой пробирке, чтобы облегчить ресуспендирование. Если тканевый лизер недоступен, вместо него можно провести экстракцию при непрерывном перемешивании или встряхивании. Возможно, потребуется увеличить время экстракции, если это невозможно.
- К 10 мг материала AIR добавляют 30 мкл/мг 50 мМ циклогександиаминтетрауксусной кислоты (CDTA; см. таблицу материалов), pH 7,5.
- Встряхивайте при частоте 27 Гц в течение 2 мин, затем 10 Гц в течение 2 ч.
- Центрифуга при 10 000 x g в течение 10 мин при 4 °C. Полученную надосадочную жидкость сохранить, добавить в стерильную микроцентрифужную пробирку и хранить при температуре 4 °C на ротационном шейкере.
- К остаточной грануле добавляют 30 мкл/мг 4 М NaOH + 0,1 % (по массе) NaBH4.
ВНИМАНИЕ: NaBH4 токсичен при проглатывании. Используйте средства индивидуальной защиты (СИЗ). Ручка под вытяжным шкафом. Избегайте образования пыли. Избегайте вдыхания пыли. Не допускайте контакта изделия с водой. - Повторите шаги 3.2–3.3. Промойте остатки гранул два или три раза dH2O, чтобы удалить остатки NaOH.
- Добавьте 30 мкл/мг целлюлазы (предпочтительно эндо-1,4-β-глюканаза GH5 в соответствующий ферментный буфер - в соответствии с рекомендациями производителя; см. таблицу материалов) к грануле и инкубируйте при оптимальной температуре фермента в течение 16 ч.
- Центрифугируют образцы при 10 000 x g в течение 10 мин при 4 °C. Сохраните надосадочную жидкость, переложите в чистые пробирки для микроцентрифуг и храните при температуре 4 °C на ротационном шейкере. После извлечения образцы должны быть распечатаны как можно скорее.
- Снова центрифугируют все сохраненные экстракты при 10 000 x g в течение 10 мин при 4 °C.
ПРИМЕЧАНИЕ: Образцы не должны содержать твердых частиц и мусора. При необходимости пропустите через спиновой фильтр 0,2 мкм перед печатью микрочипа. Особенно вязкие образцы несовместимы с микроматричным анализом, так как капилляры микрорешетки и печатающая головка могут легко засориться. Как правило, пользователи должны иметь возможность пипетировать все образцы, предназначенные для печати, с помощью стандартной пипетки малого объема.
4. Подготовка стандартов
- Готовят 1 мг/мл растворов определенных гликановых стандартов (табл. 1) в стерильном dH2O. При использовании пахимана в качестве стандарта растворяют в 4 М NaOH и нейтрализуют ледяной уксусной кислотой после солюбилизации.
- Приготовленные образцы хранят в течение ночи при температуре 4 °C на ротационном встряхивателе для обеспечения полной растворимости.
- Центрифугируйте все стандарты в течение 10 минут при 10 000 x g при 4 °C, чтобы гранулировать любой мусор. Полученная надосадочная жидкость используется для последующей печати.
5. Микроматричная печать
- Приготовьте разбавление 1:20 (v/v) черных индийских чернил / чернил для рисования в буфере глицериновой системы (GSB; смешайте 47% глицерина, 52,9% dH2O, 0,06% Triton X-100 и 0,04% биоцида [0,15%-0,17% медной селитры и 1,4%-2,0% нитрата магния в воде] и процедите стерилизацию) (см. Таблицу материалов) и центрифугу в течение 10 мин при 15 000 x G (комнатная температура).
ПРИМЕЧАНИЕ: Раствор чернил необходим для создания верхней и нижней границы вокруг напечатанных образцов, чтобы напечатанные микрочипы можно было визуально обнаружить на мембране. Однако чернильный раствор, скорее всего, будет содержать осадок. Все растворы для печати не должны содержать твердых частиц, поэтому не нарушайте осадок при пипетировании. Выбросьте и приготовьте свежие, когда это станет невозможным. Раствор не может быть легко отфильтрован для удаления твердых частиц. - Добавьте 40 мкл раствора чернил и GSB в первую секцию первой 384-луночной планшета (рис. 2).
- Добавьте 25 мкл GSB во все лунки с разведением 1 (D1). Добавьте 40 мкл GSB во все лунки для разведения 2, 3 и 4 (D2-D4).
- Экстрагированные образцы гликанов и определенные гликановые субстраты 1:1 (v/v) разбавляют GSB, добавляя 25 мкл экстрагированного образца гликана в лунки D1 по порядку.
- Последовательно разбавляют каждый образец в четыре раза, беря 10 мкл образца из лунки D1 и добавляя в лунку D2. Осторожно аспирируйте пипеткой, чтобы перемешать.
- Повторите процесс, взяв 10 мкл образца из лунки D2 и добавив его в лунку D3.
- Повторите то же самое для D4. После смешивания вылейте 10 мкл из лунки D4 так, чтобы каждая лунка содержала окончательный объем 40 мкл.
- Добавьте 40 мкл раствора чернил и GSB в последний блок готовой пластины.
- Накройте пластины клейкой крышкой и центрифугируйте в течение 10 минут при температуре 3 000 x g (комнатная температура). Убедитесь, что после центрифугирования не осталось пузырьков, и при необходимости повторите процедуру.
- Используя бесконтактный пьезоэлектрический робот для печати микрочипов, напечатайте образцы на нитроцеллюлозной мембране (см. таблицу материалов), выполнив следующие действия.
ПРИМЕЧАНИЕ: Ниже приведены действия, рекомендуемые для оптимального качества печати; Однако конкретные требуемые параметры в конечном итоге будут зависеть от используемого инструмента. Мы рекомендуем пользователям связаться с производителем прибора, чтобы обсудить соответствующие настройки и настройки печати, необходимые для их устройства.- Перед печатью опорожните буферный резервуар для отходов и при необходимости заполните чистый буферный резервуар чистым GSB. Включите прибор и дайте ему стабилизироваться в течение >10 минут, если он оснащен встроенной системой контроля влажности и температуры. Включите микроматрицу и инициализируйте систему.
ПРИМЕЧАНИЕ: Рекомендуется провести тест для определения внутреннего давления прибора. Если давление слишком низкое, то может потребоваться выполнить продувку под высоким давлением. Опять же, свяжитесь с производителем прибора, чтобы обсудить конкретную работу конкретного прибора. - Несколько раз продуйте печатающую головку и капилляры с помощью GSB, чтобы удалить мусор и потенциальные загрязнения. Выполните пробную печать, загрузив только пластину GSB или настроив прибор на печать непосредственно из чистого буферного резервуара, минуя аспирацию образца из загруженной пластины.
ПРИМЕЧАНИЕ: Нет необходимости выполнять тестовую печать с использованием нитроцеллюлозной мембраны; Чистых предметных стекол микроскопа достаточно, и их преимущество заключается в том, что размер, форму и качество пятна можно визуально оценить перед печатью образца. - При печати образцов экстрагированного гликана запрограммируйте систему на промывку чистым GSB между каждым образцом.
ПРИМЕЧАНИЕ: Как правило, объем образца на печатное пятно составляет от 100 пЛ до 10 нл, а размер пятна варьируется от 20 мкм до 100 мкм, в зависимости от выбранного объема образца. Печать 100 микрочипов с 384-луночного планшета из одного источника занимает около 40 минут, включая промывку системы. Получившиеся микрочипы будут размером примерно 1см2 . Дополнительные пластины увеличат длину массива примерно на 1 см на каждую пластину. Схема печатной конструкции микрочипа приведена на рисунке 3. После печати микрочипы сразу же готовы к использованию и могут храниться в течение нескольких лет. Если по какой-либо причине из-за возможного испарения образцов во время печати необходимо повторить задание на печать, рекомендуется загрузить новую форму образца и отбраковать исходную форму. - Раз в неделю тщательно очищайте печатающую головку и капилляры. Для этого загружают 384 лунки, содержащие разбавление концентрированного NaOH в GSB в соотношении 1:20, и печатают на предметных стеклах микроскопа от 40 минут до 1 ч. Пользователи должны убедиться, что это чистящее средство совместимо с их инструментом, прежде чем продолжить.
- Перед печатью опорожните буферный резервуар для отходов и при необходимости заполните чистый буферный резервуар чистым GSB. Включите прибор и дайте ему стабилизироваться в течение >10 минут, если он оснащен встроенной системой контроля влажности и температуры. Включите микроматрицу и инициализируйте систему.
- Сохраните уникальный файл сетки (файл .gal), созданный для напечатанного микрочипа, готовый к последующему анализу.
6. Микроматричное зондирование
- Вырежьте из нитроцеллюлозной мембраны отдельные одинаковые напечатанные микрочипы и поместите их в сосуд подходящего размера для зондирования (например, 12- или 24-луночный микротитровый планшет) (см. таблицу материалов). Массив должен лежать ровно на дне сосуда. Для каждого зонда требуется один микрочип, который представляет собой одну техническую реплику.
- Чтобы уменьшить неспецифическое связывание, инкубируют микрочипы в течение 1 ч в блокирующем буфере MP-TBST (1x Tris-буферный физиологический раствор, pH 7,5, + 0,1% [v/v] TWEEN 20 [TBST] и с добавлением 5% [w/v] сухого обезжиренного молока; см. таблицу материалов) на вращающемся/качающемся шейкере. Убедитесь, что объем достаточен для погружения всего массива.
- После инкубации удалите МП-ТБСТ и замените его свежим объемом МП-ТБСТ.
- Инкубируют матрицы с моноклональными антителами (мАТ) или ТПМ с мечением His, или другими GRMP (например, лектинами), разбавленными 1:10-1:1000 (как указано производителем; см. таблицу материалов) в MP-TBST в течение 2 ч на вращающемся/качающемся шейкере.
- После инкубации удалите раствор молекулярного зонда и накройте матрицы чистым TBST, убедившись, что они полностью погружены в воду. Чтобы удалить остатки раствора зонда, немедленно извлеките TBST и замените его новым объемом. Поместите массивы на вращающийся/качающийся шейкер на 5 минут. Через 5 минут извлеките TBST, замените его новым объемом и поместите на вращающийся/качающийся шейкер на 5 минут.
ПРИМЕЧАНИЕ: Этот процесс следует повторить три раза, не включая первоначальное добавление и немедленное удаление TBST. - Инкубируют матрицы с конъюгированными щелочно-фосфатазными вторичными антителами (антимышиными, антикрысиными, антикроличьими, анти-His, в зависимости от обстоятельств; см. таблицу материалов), разбавленными 1:1,000 в MP-TBST в течение 2 ч на качающемся/вращающемся шейкере.
ПРИМЕЧАНИЕ: Вторичные антитела, конъюгированные пероксидазой хрена, также подходят, используемые в сочетании с субстратом тетраметилбензидина (ТМБ)/перекиси водорода для развития цвета. - После инкубации повторите процедуру промывки, как описано в шаге 6.5, чтобы удалить неспецифически связанные вторичные антитела.
- Покройте матрицы раствором для проявления цвета нитро-синего тетразолия (NBT)/5-бром-4-хлор-3-индолилфосфата (BCIP) (см. таблицу материалов) для хромогенного обнаружения связывания антител. Оставьте до тех пор, пока в местах связывания антигенов не разовьются фиолетовые пятна осадка (обычно 5-30 минут, однако следует внимательно следить за массивами, чтобы избежать перенасыщения, так как реакция может произойти быстро).
ВНИМАНИЕ: BCIP вреден при контакте с кожей и может вызвать раздражение дыхательных путей. Используйте СИЗ. Избегайте образования пыли. Избегайте вдыхания пыли. - Чтобы остановить реакцию, погрузите решетки в чистую водопроводную воду и тщательно промойте.
- Поместите массивы между промокательной бумагой на ночь при комнатной температуре, чтобы они высохли.
- Отбросьте массивы с явными дефектами и повторите протокол зондирования в таких случаях (рис. 4).
7. Анализ и количественная оценка
- Сканируйте разработанные массивы с разрешением 2 400 точек на дюйм (dpi) с помощью настольного сканера. Преобразуйте изображения в файлы TIFF, а затем в негативы.
- Используя программное обеспечение для анализа микрочипов (см. таблицу материалов), наложите уникальный файл сетки .gal на каждое изображение микрочипа, чтобы рассчитать интенсивность цвета пятна, образующегося в каждом сайте связывания антигена, и вычесть локальный фон.
- Экспортируйте данные сетки в виде файла .txt. Затем их можно вручную импортировать на лист Excel для анализа.
- Сгенерируйте среднее значение интенсивности точечного сигнала для каждого образца путем усреднения интенсивности пятна сначала по каждому разведению образца, а затем по всем включенным биологическим репликатам.
- Присвойте значение 100 наибольшей средней интенсивности точечного сигнала и соответствующим образом нормализуйте остальные данные.
ПРИМЕЧАНИЕ: Нормализованная средняя интенсивность точечного сигнала может быть представлена в виде тепловой карты относительного содержания гликановых эпитопов с помощью функции условного форматирования в Excel33 или с помощью функции geom_tile в пакете R ggplot240,41.
Representative Results
MAPP был применен для определения гликанового состава отходов сельскохозяйственной биомассы, включающих кожуру манго нескольких северных тайских сортов, мякоть вишни Coffea arabica и отходы переработки кофейных зерен, а также корневую, стеблевую и листовую ткань тайского черного чеснока, Allium sativum var. ophioscorodon. Некоторые полисахариды растительного происхождения используются в пищевой промышленности в качестве функциональных ингредиентов42,43. Таким образом, цель данного эксперимента состояла в том, чтобы выяснить, могут ли эти обильные и в настоящее время недостаточно используемые отходы агропромышленности служить источником чистых полисахаридов с добавленной стоимостью.
Материал AIR обычно используется для подготовки образцов, предназначенных для гликанового анализа44. Использование AIR имеет несколько преимуществ; Обработка растворителями эффективно удаляет эндогенные КАЗимы, метаболиты, мелкие сахариды, липиды и пигменты, в результате чего образцы, обогащенные полисахаридами и структурными белками34. Кроме того, производство AIR является быстрым и эффективным способом увеличения срока службы образца, поскольку он термостабилен и может храниться в течение нескольких лет.
Три смешанные фракции составляющих гликанов последовательно экстрагировали из растительного материала AIR с использованием CDTA, NaOH и целлюлазы. CDTA хелатирует ионыCa2+ , которые позволяют удалять сшитыеCa2+ деэтерифицированные пектины из клеточных стенок растений45. Щелочные условия позволяют высвобождать преимущественно гемицеллюлозы, такие как маннан, ксилан и β-глюкан, из-за нарушения водородных связей и омыления сложных эфиров между микрофибриллами целлюлозы и гемицеллюлозой, а также лигнином и гемицеллюлозой соответственно46. Рекомбинантную эндо-1,4-β-глюканазу из Bacillus spp. использовали для деградации аморфных участков микрофибрилл структурной целлюлозы, высвобождая остаточные гликаны, связанные с целлюлозой в клеточных стенках47. Несмотря на то, что этот метод эффективно разделяет гликаны на эти три большие группы, следует отметить, что образцы не являются чистыми; По самой природе метода экстракции гемицеллюлоза, если она присутствует в образце, неизбежно будет экстрагирована и впоследствии обнаружена в той или иной степени во фракциях CDTA и целлюлазы. Аналогичным образом, некоторое количество пектина будет обнаружено в экстракции NaOH, если он присутствует в образце.
Бесконтактный пьезоэлектрический робот для печати микрочипов был использован для иммобилизации экстрагированных гликановых фракций на нитроцеллюлозу через нековалентную насадку11, образуя 300 идентичных микрочипов. Определенные стандарты гликанов (табл. 1) также были включены в напечатанные микрочипы в качестве положительного контроля (рис. 5). Профиль связывания MAPP, полученный для выбранных гликановых стандартов, соответствует ранее описанным эпитопным особенностям. Например, LM21 демонстрировал сильное связывание с несколькими полисахаридами маннана (галактоманнан и глюкоманнан), в то время как LM22 демонстрировал только слабое связывание с галактоманнаном25. Аналогичным образом, LM19 преимущественно связывается с деэтерифицированным гомогалактуронаном48, а LM15 связывается с ксилоглюканом23 семян тамаринда.
Относительное обилие 16 эпитопов, диагностических полисахаридов нецеллюлозной клеточной стенки растений, было выявлено путем присоединения гликан-направленных моноклональных антител (табл. 2) к печатным экстрактам (рис. 6). Большинство экстрагированных гликанов было обнаружено в щелочной фракции NaOH. Сильные сигналы связывания были зарегистрированы для мАТ LM10 и LM11, представляющих ксилан/арабиноксилан, в кожуре всех протестированных сортов манго. В образцах чеснока LM10 и LM11 связывались преимущественно с экстрактом корневой ткани (Garlic R) и демонстрировали лишь слабое связывание с экстрактом тканей листьев (Garlic L). LM19, представляющий собой частично метилэтерифицированный или неэтерифицированный гомогалактуронан, прочно связывается с экстрактами некоторых сортов манго (Аокронг и Талабнак), но связывается слабо или его связывание не обнаруживается в других сортах (Чоканан, Мамкамданг, Махачанок и Нга). Кроме того, LM19 связывается только с фракциями кофейной мякоти и не связывается с отходами переработки кофейных зерен, ранее считалось, что они состоят из полуочищенного кофейного пектина (неопубликованные данные).
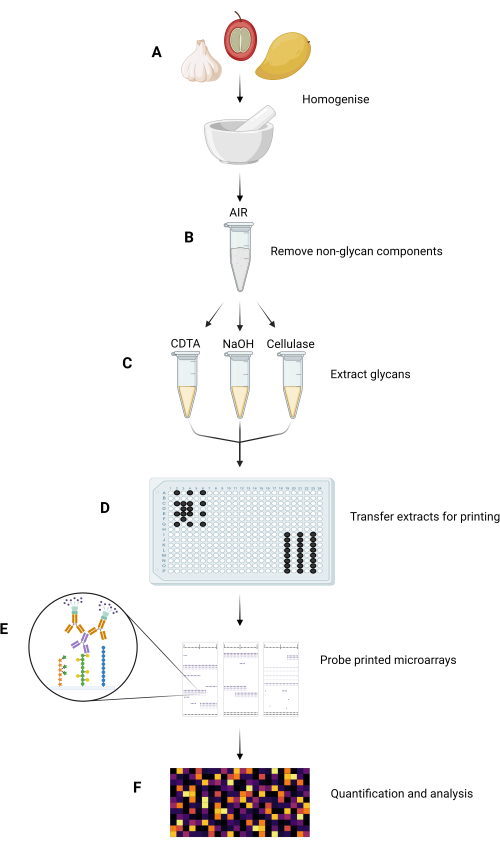
Рисунок 1: Основные этапы эксперимента в методе MAPP. (A) Образцы гомогенизируют с образованием мелкодисперсных порошков. (B) Гомогенизированные пробы обрабатываются для выделения из них AIR. (C) Составляющие гликаны последовательно экстрагируются с использованием специально разработанного режима экстракции. (D) Извлеченные гликановые фракции, чернила и GSB переносятся на 384-луночные пластины в соответствии с компоновкой пластин для печати на нитроцеллюлозе. (E) Напечатанные микрочипы исследуются с помощью выбранных GRMP. (F) Связывание GRMP с напечатанными фракциями гликана количественно оценивается и анализируется перед представлением данных в виде тепловой карты. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
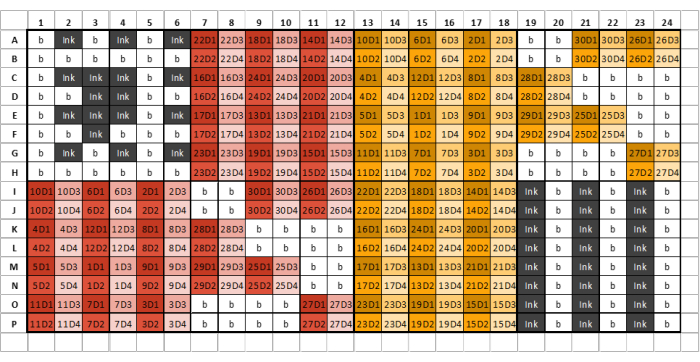
Рисунок 2: Пример 384-луночного планшета для загрузки образца, чернил и GSB с четырьмя разбавлениями на извлеченный образец гликана/стандарт. Разными цветами обозначены образцы, полученные из разных экстракционных реагентов, в то время как разные оттенки представляют собой последовательные разведения. Первое число в коде представляет номер выборки, а конечное число — число разведения (D1 обозначает разбавление один, D2 — разбавление два и т. д.). Например, хорошо помеченный «12D3» представляет собой образец гликана 12, разведение три. Плиты скважин должны быть разделены на восемь одинаковых секций, состоящих из шести столбцов и восьми рядов. Первая секция первой пластины должна содержать только чернила и буфер и напоминать пример макета пластины. Извлеченные образцы гликанов затем могут быть загружены в последующие секции планшета в соответствии с планировкой пластины. В одну и ту же секцию пластины не следует загружать разные экстракционные реагенты. Если проб недостаточно для заполнения всего участка, заполните буфером все оставшиеся скважины в этом участке; Не оставляйте ни одного колодца пустым. Если требуется несколько пластин, следующая секция после загрузки всех образцов должна содержать три чередующихся столбца чернил и GSB — это может быть не восьмой раздел, в зависимости от количества печатаемых образцов. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Рисунок 3: Схематическое изображение печатной конструкции микрочипа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
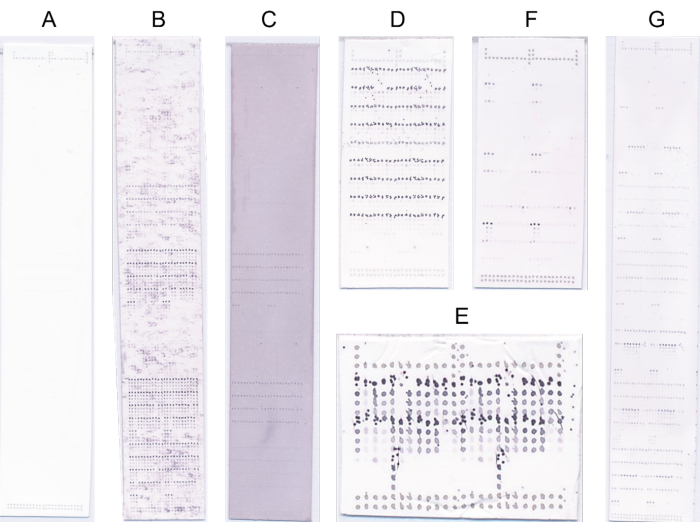
Рисунок 4: Репрезентативные микрочипы. (A) Без привязки. (B) Сигнал привязки заслоняется высоким фоновым сигналом. (C) Генерализованное сине-фиолетовое окрашивание из-за перенасыщения NBT/BCIP. (D) Дефектное зондирование из-за высокой концентрации субстрата. (E) Дефектная печать из-за нечистой печатающей головки. (F) Прочное связывание с небольшим количеством образцов. (G) Прочное связывание со многими образцами. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
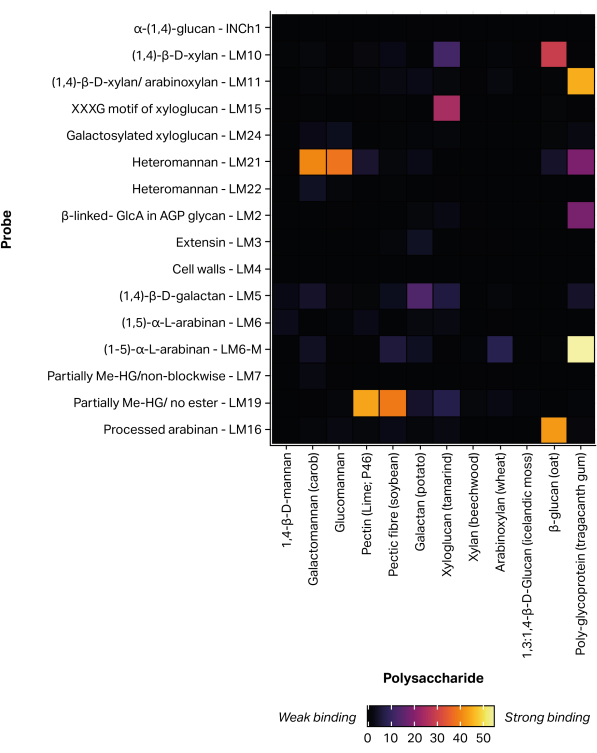
Рисунок 5: Связывание моноклональных антител с определенными гликановыми стандартами, включенное для валидации процесса печати и зондирования. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
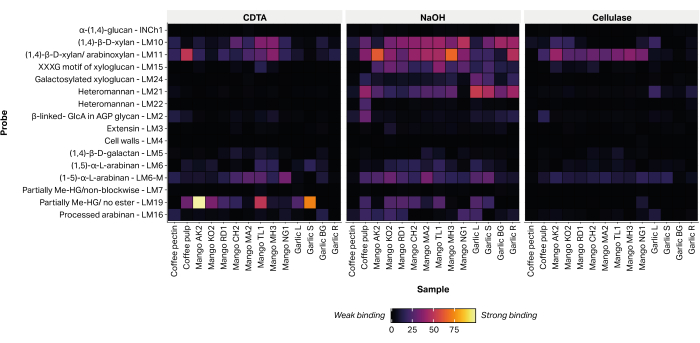
Рисунок 6: MAPP гликанов, извлеченных из отходов сельскохозяйственной биомассы. Образцы включают в себя отходы кофейной мякоти (кофейная мякоть и кофейный пектин), кожура манго нескольких тайских сортов (AO, Aokrong; КО, Кам; РД, Рад; CH, Чоканан; М.А., Мамкамданг; ТЛ, Талабнак; MH, Махачанок; NG, Nga) и листьев черного чеснока (Garlic L), стебля (Garlic S), луковицы (Garlic BG) и корней (Garlic R) с использованием CDTA, NaOH и целлюлазы (Bacillus spp. cellulase 5A). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Таблица 1: Определены коммерческие полисахаридные стандарты, используемые в MAPP-анализе в качестве положительного контроля. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Гликан-направленные моноклональные антитела, отобранные для исследования экстрагированных микрочипов растительного гликана. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Discussion
Описанный здесь метод MAPP в настоящее время является хорошо зарекомендовавшим себя методом гликанового анализа. Основные принципы были впервые описаны в 2007году, но метод постоянно совершенствовался, чтобы извлечь выгоду из последних инноваций в технологии микрочипов, разработки молекулярных зондов и достижений в нашем понимании биохимии гликанов. В целом, гликаны, особенно полисахариды, сложнее анализировать, чем белки и нуклеотиды, из-за их структурной сложности и гетерогенности, а также из-за того, что они не могут быть легко секвенированы илисинтезированы1. Во многих случаях ни один метод не может окончательно расшифровать сложность гликанов; таким образом, MAPP часто используется с другими методами. Это одна из причин, по которой подготовка AIR обычно выбирается в качестве отправной точки для MAPP, поскольку AIR совместим с большинством других методов анализа гликанов34, облегчая последующее сравнение наборов данных.
Из-за гомогенизации образца перед подготовкой AIR неизбежно теряется некоторая пространственная информация. Однако, поскольку полисахариды последовательно высвобождаются из образцов, наличие эпитопов в полученных фракциях дает информацию о молекулярной архитектуре и составе этого образца17. Таким образом, выбор подходящего режима экстракции имеет решающее значение для успеха метода. Пригодность метода экстракции определяется несколькими параметрами: ячеистой структурой, временем, температурой, рН, давлением, ионной силой растворителя и тонкостью твердого образца твердых частиц49. Рекомендуется использовать ряд все более агрессивных растворителей, чтобы максимизировать вероятность успешного извлечения составляющих гликанов и построения репрезентативной композиционной картины образца. Для большинства образцов CDTA, NaOH и целлюлазы достаточно для удаления полисахаридов растительного происхождения и клеточной стенки 33,50,51,52. Для некоторых образцов тканей гибридный режим экстракции, который также включает CaCl2, HCl и Na2CO3, оказался успешным53, в то время как образцы морских микроводорослей могут потребовать добавления этилендиаминтетрауксусной кислоты (ЭДТА)10.
Микрочипы должны включать в себя ряд чистых, определенных гликановых стандартов, которые будут использоваться в качестве позитивного контроля5. Включенные стандарты должны быть изменены в соответствии с характером образца. После печати необходимо выбрать соответствующие GRMP. Генерация гибридомных мАТ в полисахаридные структуры представляет собой сложнуюзадачу 54; Гликан-связывающие антитела трудно вырастить и могут иметь низкое сродство55. К счастью, информация о последовательностях генов для ТПМ может быть получена с относительной легкостью для рекомбинантной экспрессии4 и инженерии их специфичности связывания56,57. Несмотря на то, что был разработан впечатляющий каталог GRMP, большинство из которых в настоящее время доступны из коммерческих источников, по сравнению с разнообразием гликановых структур, существующих в природе, только небольшая часть из них была произведена и успешно охарактеризована58. Это может ограничить способность обнаруживать и различать определенные структуры. Рекомендуется провести первоначальный эксперимент с использованием одного или двух зондов, представляющих каждую основную структуру гликанов, для которых специфичность связывания хорошо определена. В последующих экспериментах по зондированию список зондов может быть расширен, чтобы охватить более широкий диапазон гликанов и углубиться в тонкие структуры.
Несмотря на обыденность, тщательная промывка микрочипов после каждого этапа инкубации имеет основополагающее значение для успеха процедуры зондирования. Неэффективное удаление неспецифически связанных зондов, скорее всего, затмит результат, вызвав высокий фоновый сигнал после развития цвета. В этом случае необходимо повторить процедуру зондирования, начав с нового микрочипа. Кроме того, массивы следует трогать осторожно и только придерживая края щипцами; Нитроцеллюлозная мембрана хрупкая и легко повреждается. Раствор для проявки цвета скапливается в трещинах и складках, вызывая перенасыщение, что затрудняет анализ массива.
MAPP быстрый, адаптируемый и удобный. Этот метод совместим с гликанами животного, микробного или растительного происхождения, полученными из любой биологической или промышленной системы, при условии, что они могут быть экстрагированы и иммобилизованы на нитроцеллюлозе, и для этого имеются соответствующие молекулярные зонды. Полученные данные обеспечивают детальное, полуколичественное, композиционное понимание, которое не может быть легко получено с помощью других методов гликанового анализа.
Disclosures
Авторы заявляют об отсутствии конфликта интересов.
Acknowledgements
Авторы выражают благодарность компании ArrayJet за экспертные консультации по робототехнике с микрочипами. SS и JS выражают признательность за поддержку со стороны Фундаментального фонда 2022 (FF65/004), Чиангмайского университета.
Materials
| Name | Company | Catalog Number | Comments |
| 1,3:1,4-β-D-Glucan, Lichenan (icelandic moss) | Megazyme | P-LICHN | |
| 1,4-β-D-Mannan | Megazyme | P-MANCB | |
| 384-well microtiter plate | Greiner Bio-One | M1686 | |
| 5-bromo-4-chloro-3-indolyl-phosphate (BCIP) | Melford | B74100-1.0 | |
| Acetone | Sigma | 270725 | |
| Alkaline Phosphatase AffiniPure Goat Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 115-055-003 | |
| Alkaline Phosphatase AffiniPure Goat Anti-Rat IgG (H+L) | Jackson ImmunoResearch | 112-055-003 | |
| Alkaline Phosphatase AffiniPure Rabbit Anti-His Tag | Jackson ImmunoResearch | 300-055-240 | |
| Arabinoxylan (wheat) | Megazyme | P-WAXYL | |
| Array-Pro Analyzer Software | Media Cybernetics | Version 6.3 | |
| Bacillus sp. Cellulase 5A (BCel5A) | NZYTech | CZ0564 | |
| BAM antibodies | SeaProbes | Various | |
| Black drawing ink (indian ink) | Winsor & Newton | GWD030 | |
| Carbohydrate binding modules | NZYTech | Various | |
| CCRC antibodies | CarboSource | Various | |
| CDTA | Sigma | 319945 | |
| Chloroform | Sigma | PHR1552 | |
| Ethanol | Sigma | 1.11727 | |
| Galactan (potato) | Megazyme | P-GALPOT | |
| Galactomannan (carob) | Megazyme | P-GALML | |
| Glycerol solution | Sigma | 49781-5L | |
| Gum tragacanth (legumes) | Sigma-Aldrich | G1128 | |
| INCh antibodies | INRA | Various | |
| LM and JIM antibodies | PlantProbes | Various | |
| Marathon Argus Microarray Printer | ArrayJet | ||
| Methanol | Sigma | 34860 | |
| Monoclonal antibodies | Biosupplies Australia | Various | |
| NaBH4 | Sigma | 452882 | |
| NaOH | Sigma | S5881 | |
| Nitro-blue tetrazolium (NBT) | Melford | N66000-1.0 | |
| Nitrocellulose membrane | Thermo Fisher Scientific | 88018 | |
| Pectin (degree of methyl esterification 46%) | Danisco | NA | |
| ProClin 200 | Sigma | 48171-U | |
| Rhamnogalacturonan (soybean pectic fibre) | Megazyme | P-RHAGN | |
| Rotating mixer | Fisher Scientific | 88-861-050 | |
| Rotating/rocking Shaker | Cole-Parmer | ||
| Skimmed milk powder | Marvel | ||
| Spin filter | Costar Spin-X | 8160 | |
| Stainless steel beads | Qiagen | 69989 | |
| TissueLyser II | Qiagen | 85300 | |
| Tris | Sigma | 93362 | |
| Triton X-100 | Sigma | T8787-250ML | |
| Tween 20 | Sigma | P9416-100ML | |
| Xylan (beechwood) | Megazyme | P-XYLNBE | |
| Xyloglucan (tamarind) | Megazyme | P-XYGLN | |
| β-Glucan (oat) | Megazyme | P-BGOM |
References
- Amicucci, M. J., et al. A nonenzymatic method for cleaving polysaccharides to yield oligosaccharides for structural analysis. Nature Communications. 11 (1), 3963 (2020).
- Gagneux, P., Panin, V., Hennet, T., Aebi, M., Varki, A. Evolution of glycan diversity. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Willats, W. G. T., McCartney, L., Knox, J. P. Pectin cell biology: complexity in context. Advances in Pectin and Pectinase Research. , 147-157 (2003).
- Cummings, R. D., et al. Glycan-recognizing probes as tools. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Bakshani, C. R., et al. Analysis of glycans in a Burnt-on/Baked-on (BoBo) model food soil using Microarray Polymer Profiling (MAPP) and immunofluorescence microscopy. Food Chemistry. 410, 135379 (2023).
- Salmeán, A. A., Willats, W. G. T., Ribeiro, S., Andersen, T. J., Ellegaard, M. Over 100-year preservation and temporal fluctuations of cell wall polysaccharides in marine sediments. Frontiers in Plant Science. 13, 785902 (2022).
- Cid, M., et al. Recognition of the helical structure of β-1,4-galactan by a new family of carbohydrate-binding modules. Journal of Biological Chemistry. 285 (46), 35999-36009 (2010).
- Runavot, J. -. L., et al. Non-cellulosic polysaccharides from cotton fibre are differently impacted by textile processing. PLoS One. 9 (12), e115150 (2014).
- Ahl, L. I., et al. Analyses of aloe polysaccharides using carbohydrate microarray profiling. Journal of AOAC International. 101 (6), 1720-1728 (2018).
- Vidal-Melgosa, S., et al. Diatom fucan polysaccharide precipitates carbon during algal blooms. Nature Communications. 12 (1), 1150 (2021).
- Moller, I., et al. High-throughput mapping of cell-wall polymers within and between plants using novel microarrays. The Plant Journal. 50 (6), 1118-1128 (2007).
- Ruprecht, C., et al. A synthetic glycan microarray enables epitope mapping of plant cell wall glycan-directed antibodies. Plant Physiology. 175 (3), 1094-1104 (2017).
- Cummings, R. D., et al. Principles of glycan recognition. Essentials of Glycobiology [Internet]. 4th edition. , (2022).
- Gao, C., et al. Glycan microarrays as chemical tools for identifying glycan recognition by immune proteins. Frontiers in Chemistry. 7, 833 (2019).
- Vidal-Melgosa, S., et al. A new versatile microarray-based method for high throughput screening of carbohydrate-active enzymes. Journal of Biological Chemistry. 290 (14), 9020-9036 (2015).
- Willats, W. G. T., Rasmussen, S. E., Kristensen, T., Mikkelsen, J. D., Knox, J. P. Sugar-coated microarrays: A novel slide surface for the high-throughput analysis of glycans. Proteomics. 2 (12), 1666-1671 (2002).
- Sørensen, I., et al. The charophycean green algae provide insights into the early origins of plant cell walls. The Plant Journal. 68 (2), 201-211 (2011).
- Liu, D., Tang, W., Yin, J. -. Y., Nie, S. -. P., Xie, M. -. Y. Monosaccharide composition analysis of polysaccharides from natural sources: Hydrolysis condition and detection method development. Food Hydrocolloids. 116, 106641 (2021).
- Pattathil, S., et al. A comprehensive toolkit of plant cell wall glycan-directed monoclonal antibodies. Plant Physiology. 153 (2), 514-525 (2010).
- Verhertbruggen, Y., et al. Developmental complexity of arabinan polysaccharides and their processing in plant cell walls. The Plant Journal. 59 (3), 413-425 (2009).
- Rydahl, M. G., et al. Development of novel monoclonal antibodies against starch and ulvan - implications for antibody production against polysaccharides with limited immunogenicity. Scientific Reports. 7 (1), 9326 (2017).
- McCartney, L., Marcus, S. E., Knox, J. P. Monoclonal antibodies to plant cell wall xylans and arabinoxylans. The Journal of Histochemistry and Cytochemistry. 53 (4), 543-546 (2005).
- Marcus, S. E., et al. Pectic homogalacturonan masks abundant sets of xyloglucan epitopes in plant cell walls. BMC Plant Biology. 8, 60 (2008).
- Pedersen, H. L., et al. Versatile high resolution oligosaccharide microarrays for plant glycobiology and cell wall research. The Journal of Biological Chemistry. 287 (47), 39429-39438 (2012).
- Marcus, S. E., et al. Restricted access of proteins to mannan polysaccharides in intact plant cell walls. The Plant Journal. 64 (2), 191-203 (2010).
- Smallwood, M., Martin, H., Knox, J. P. An epitope of rice threonine-and hydroxyproline-rich glycoprotein is common to cell wall and hydrophobic plasma-membrane glycoproteins. Planta. 196 (3), 510-522 (1995).
- Smallwood, M., Yates, E. A., Willats, W. G. T., Martin, H., Knox, J. P. Immunochemical comparison of membrane-associated and secreted arabinogalactan-proteins in rice and carrot. Planta. 198 (3), 452-459 (1996).
- Wisniewski, J. P., Rathbun, E. A., Knox, J. P., Brewin, N. J. Involvement of diamine oxidase and peroxidase in insolubilization of the extracellular matrix: implications for pea nodule initiation by Rhizobium leguminosarum. Molecular Plant-Microbe Interactions. 13 (4), 413-420 (2000).
- Jones, L., Seymour, G. B., Knox, J. P. Localization of pectic galactan in tomato cell walls using a monoclonal antibody specific to (1[->]4)-β-D-galactan. Plant Physiology. 113 (4), 1405-1412 (1997).
- Willats, W. G., Marcus, S. E., Knox, J. P. Generation of a monoclonal antibody specific to (1→5)-α-L-arabinan. Carbohydrate Research. 308 (15), 149-152 (1998).
- Cornuault, V., et al. LM6-M: a high avidity rat monoclonal antibody to pectic α-1, 5-L-arabinan. BioRxiv. , 161604 (2017).
- Sutherland, P., Hallett, I., Jones, M. Probing cell wall structure and development by the use of antibodies: a personal perspective. New Zealand Journal of Forestry Science. 39, 197-205 (2009).
- Mikkelsen, M. D., et al. Ancient origin of fucosylated xyloglucan in charophycean green algae. Communications Biology. 4 (1), 754 (2021).
- Fangel, J. U., Jones, C. Y., Ulvskov, P., Harholt, J., Willats, W. G. T. Analytical implications of different methods for preparing plant cell wall material. Carbohydrate Polymers. 261, 117866 (2021).
- Moore, J. P., et al. Analysis of plant cell walls using high-throughput profiling techniques with multivariate methods. The Plant Cell Wall: Methods and Protocols. , 327-337 (2020).
- Gao, Y., Fangel, J. U., Willats, W. G. T., Moore, J. P. Tracking polysaccharides during white winemaking using glycan microarrays reveals glycoprotein-rich sediments. Food Research International. 123, 662-673 (2019).
- Solden, L. M., et al. Interspecies cross-feeding orchestrates carbon degradation in the rumen ecosystem. Nature Microbiology. 3 (11), 1274-1284 (2018).
- Fangel, J. U., et al. Tracking polysaccharides through the brewing process. Carbohydrate Polymers. 196, 465-473 (2018).
- Mravec, J., et al. Pea border cell maturation and release involve complex cell wall structural dynamics. Plant Physiology. 174 (2), 1051-1066 (2017).
- Wickham, H. . ggplot2: elegant graphics for data analysis. , (2009).
- Gu, Z. Complex heatmap visualization. iMeta. 1 (3), 43 (2022).
- Nasrollahzadeh, M., Nezafat, Z., Shafiei, N., Soleimani, F. . Polysaccharides in Food Industry. , (2021).
- Shao, P., et al. Recent advances in improving stability of food emulsion by plant polysaccharides. Food Research International. 137, 109376 (2020).
- Sanz, M. L., Martínez-Castro, I. Recent developments in sample preparation for chromatographic analysis of carbohydrates. Journal of Chromatography. A. 1153 (1-2), 74-89 (2007).
- Bethke, G., Glazebrook, J. Cyclohexane diamine tetraacetic acid (CDTA) extraction of plant cell wall pectin. Bio-Protocol. 4 (24), e1357 (2014).
- Lu, Y., He, Q., Fan, G., Cheng, Q., Song, G. Extraction and modification of hemicellulose from lignocellulosic biomass: A review. Green Processing and Synthesis. 10 (1), 779-804 (2021).
- Jayasekara, S., Ratnayake, R. Microbial cellulases: an overview and applications. Cellulose. 22, 92 (2019).
- Verhertbruggen, Y., Marcus, S. E., Haeger, A., Ordaz-Ortiz, J. J., Knox, J. P. An extended set of monoclonal antibodies to pectic homogalacturonan. Carbohydrate Research. 344 (14), 1858-1862 (2009).
- Villares, A., Mateo-Vivaracho, L., Guillamón, E. Structural features and healthy properties of polysaccharides occurring in mushrooms. Agriculture. 2 (4), 452-471 (2012).
- Kračun, S. K., et al. Carbohydrate microarray technology applied to high-throughput mapping of plant cell wall glycans using comprehensive microarray polymer profiling (CoMPP). Methods in Molecular Biology. 1503, 147-165 (2017).
- Rajasundaram, D., et al. Understanding the relationship between cotton fiber properties and non-cellulosic cell wall polysaccharides. PLoS One. 9 (11), e112168 (2014).
- Michalak, L., et al. Microbiota-directed fibre activates both targeted and secondary metabolic shifts in the distal gut. Nature Communications. 11 (1), 5773 (2020).
- Salmeán, A. A., Hervé, C., Jørgensen, B., Willats, W. G., Mravec, J. Microarray glycan profiling reveals algal fucoidan epitopes in diverse marine metazoans. Frontiers in Marine Science. 4, 293 (2017).
- Knox, J. P. Revealing the structural and functional diversity of plant cell walls. Current Opinion in Plant Biology. 11 (3), 308-313 (2008).
- Manimala, J. C., Roach, T. A., Li, Z., Gildersleeve, J. C. High-throughput carbohydrate microarray profiling of 27 antibodies demonstrates widespread specificity problems. Glycobiology. 17 (8), 17-23 (2007).
- Stephen, P., Tseng, K. -. L., Liu, Y. -. N., Lyu, P. -. C. Circular permutation of the starch-binding domain: inversion of ligand selectivity with increased affinity. Chemical Communications. 48 (20), 2612-2614 (2012).
- Gunnarsson, L. C., Dexlin, L., Karlsson, E. N., Holst, O., Ohlin, M. Evolution of a carbohydrate binding module into a protein-specific binder. Biomolecular Engineering. 23 (2-3), 111-117 (2006).
- Moller, I., et al. High-throughput screening of monoclonal antibodies against plant cell wall glycans by hierarchical clustering of their carbohydrate microarray binding profiles. Glycoconjugate Journal. 25 (1), 37-48 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved