בדיקה היסטולוגית של מורפולוגיה מיטוכונדריאלית במודל מחלת פרקינסון
* These authors contributed equally
In This Article
Summary
מחקר זה מציג שיטה לניתוח המורפולוגיה של המיטוכונדריה בהתבסס על אימונוסטיין וניתוח תמונה ברקמת מוח עכבר באתרה. הוא גם מתאר כיצד זה מאפשר לזהות שינויים במורפולוגיה המיטוכונדריאלית הנגרמים על ידי צבירת חלבונים במודלים של מחלת פרקינסון.
Abstract
מיטוכונדריה ממלאים תפקיד מרכזי בחילוף החומרים האנרגטי של תאים, ותפקודם חשוב במיוחד עבור תאי עצב בשל דרישת האנרגיה הגבוהה שלהם. לכן, תפקוד לקוי של המיטוכונדריה הוא סימן היכר פתולוגי של הפרעות נוירולוגיות שונות, כולל מחלת פרקינסון. הצורה והארגון של הרשת המיטוכונדריאלית הם פלסטיים מאוד, מה שמאפשר לתא להגיב לרמזים ולצרכים סביבתיים, וגם מבנה המיטוכונדריה קשור קשר הדוק לבריאותם. כאן, אנו מציגים פרוטוקול לחקר מורפולוגיה מיטוכונדריאלית באתרה המבוסס על אימונוסטיין של החלבון המיטוכונדריאלי VDAC1 וניתוח תמונה לאחר מכן. כלי זה יכול להיות שימושי במיוחד לחקר הפרעות נוירודגנרטיביות מכיוון שהוא יכול לזהות הבדלים עדינים בספירות מיטוכונדריאליות ובצורה הנגרמת על ידי צברים של α-סינוקלאין, חלבון נוטה לצבירה המעורב במידה רבה בפתולוגיה של מחלת פרקינסון. שיטה זו מאפשרת לדווח כי נוירונים דופמינרגיים בעלי נגעי pS129 מראים פיצול מיטוכונדריאלי (כפי שהוצע על ידי יחס גובה-רוחב מופחת שלהם, AR) בהשוואה לנוירונים שכנים בריאים שלהם במודל פרקינסון הזרקת פיבריל תוך גולגולתי שנוצר מראש.
Introduction
למערכת העצבים המרכזית יש ביקוש אינטנסיבי ל-ATP: תאי עצב משתמשים ב-ATP כדי לתמוך בשיפועים יוניים, סינתזת מוליכים עצביים, ניוד שלפוחית סינפטית, שחרור ומיחזור, וכדי לאפשר תרגום ופירוק מקומי של חלבונים. יותר מ-95% מה-ATP המשמש את המוח מיוצר על-ידי המיטוכונדריה1. לכן, אין זה מפתיע שתפקוד לקוי של המיטוכונדריה מזיק במיוחד לנוירונים. למעשה, ליקויים בתפקוד המיטוכונדריה ממלאים תפקיד חשוב במספר מחלות נוירולוגיות, כולל מחלות נוירודגנרטיביות, כגון מחלת פרקינסון (PD) ואלצהיימר (AD)2,3.
גנים מרובים קשורים באופן חד משמעי לחלבונים מקודדי PD הרלוונטיים לתפקוד המיטוכונדריה ולהומאוסטזיס, כגון פרקין 4,5,6, קינאז המושרה על ידי PTEN 1 (PINK1)7,8 ו- DJ-19. ראיות נוספות לתפקוד לקוי של המיטוכונדריה בפרקינסון הן שטיפולים במעכבי קומפלקס I של שרשרת הובלת האלקטרונים במיטוכונדריה (כגון רוטנון ו-MPTP) משחזרים מספר היבטים של פרקינסון במבחנה ו-in vivo10. עם זאת, חשוב לציין כי תהליכים פתולוגיים רבים עשויים לגרום לאובדן עצבי בפרקינסון, יחד עם ליקויים מיטוכונדריאליים: עקה חמצונית, שינוי הומאוסטזיס סידן, כישלון של יוביקוויטין-פרוטאזום ושל מערכות אוטופגיה-ליזוזומליות, וצבירת חלבונים הם בין הנחקרים ביותר (נסקרו ב 11,12,13 ו).
מיטוכונדריה הם הטרוגניים בצורתם: בנוסף ליחידות בודדות, הם נמצאים בדרך כלל כרשתות רשתית וצינורית מורחבות. המבנה והמיקום התאי של המיטוכונדריה קריטיים לתפקודם14; למעשה, רשתות מיטוכונדריאליות הן דינמיות ביותר, ועוברות תהליכים תכופים של ביקוע, איחוי ומיטופגיה על מנת לענות על צרכי התאים ולהגיב לרמזים סביבתיים15,16. בנוסף, המורפולוגיה של המיטוכונדריה קשורה קשר הדוק למצב הבריאותי שלהם. לדוגמה, באטרופיה אופטית אנושית, מוטציות גנטיות המפחיתות את פעילות המיטוכונדריה מובילות למיטוכונדריה חריגה, דקה והיפר-פיוזית17. מצד שני, מגוון מחלות אנושיות מציגות מורפולוגיה מיטוכונדריאלית חריגה, כולל פיצול מיטוכונדריאלי או איחוי מיטוכונדריאלי מוגזם, שיש להם השפעות מזיקות על תפקוד המיטוכונדריה (נסקר ב-18). בהקשר של פרקינסון, אנו ואחרים הראינו בעבר כי צורה מיטוכונדריאלית חריגה נמצאת בקורלציה עם תפקוד לקוי בתגובה לצברי α-סינוקלאין19. בעוד שמורפולוגיה מיטוכונדריאלית נחקרה בהרחבה במבחנה הן בהקשר של פרקינסון והן בהקשר של מחלות אחרות 20,21,22, חסרים פרוטוקולים להערכת מורפולוגיה מיטוכונדריאלית מקטעי in vivo. זה הופך את המחקר in vivo של מיטוכונדריה בהקשר של מחלות כגון PD תלוי מאוד בבעלי חיים טרנסגניים23 או הערכה של תמציות המוח התיכון שאינם יכולים לספק פתרון תאי.
כאן, מוצג פרוטוקול לחקר המורפולוגיה המיטוכונדריאלית באתרה כאינדיקטור למצבם התפקודי ובריאותם, בהתבסס על אימונוסטיין של החלבון המיטוכונדריאלי VDAC124 ואחריו ניתוח תמונה בקטעי רקמה משובצים פרפין. אנו גם מראים את התוצאות של פרוטוקול זה במודלים של PD in vitro ו-in vivo : תאי נוירובלסטומה בעלי ביטוי יתר של SNCA (Synuclein Alpha) ורקמת מוח מעכברים שנחשפו להזרקה תוך-גולגולתית של α-synuclein Pre-Formed Fibrils (PFFs). Co-immunostaining עם נוגדן נגד α-synuclein (בתאים) או phosphoSer129- α-synuclein pS129 (במוחות עכברים) אפשרה לנו לזהות תאים עם פתולוגיה מצטברת של חלבונים (ביטוי יתר של סיבי α-synuclein ו-α-synuclein, בהתאמה) בדגימות, בעוד שתאים שליליים שימשו כבקרה לא פתולוגית בתוך אותן דגימות. באמצעות ניתוח זה והנתונים המתוארים כאן, נצפה יחס גובה-רוחב מופחת, המצביע על פיצול מיטוכונדריה בתאים המבטאים יתר על המידה SNCA או מציגים נגעי pS129.
Protocol
כל ההליכים המתוארים בסעיף זה בוצעו על פי המסגרת האתית שסופקה על ידי אוניברסיטת ארץ הבסקים התייחסות M20/2022/212, ממשלת ארץ הבסקים, ממשלת ספרד והאיחוד האירופי.
1. ניתוח מורפולוגיה מיטוכונדריאלית בתאי SH-SY5Y בעלי ביטוי יתר של SNCA
הערה: כאן, תיאור קצר של הדור של חומר במבחנה עבור המחקר, אשר ישמש השוואה עבור התוצאות באתרו שהתקבלו, מסופק. מומלץ לבצע ניתוח מסוג זה לפני השקת ניסוי in vivo למורפולוגיה מיטוכונדריאלית, מכיוון שהוא יבטיח שכל מערכי ההדמיה והניתוח המתאימים נמצאים במקום.
- כדי להגביר את החיבור התאי ולהקל על היצמדות תאית על לוחות אופטיים שטוחים בעלי 96 בארות, יש להוסיף 25 μL/well של מטריצת ציפוי 1:1000 ב-DMEM F12 על ידי פיפטינג (ראה טבלת חומרים). לדגור על הצלחות במשך שעה אחת ב 37 ° C ו 5% CO2.
- ספירת SH-SY5Y באמצעות תא נויבאואר. הסר את מטריצת הציפוי על ידי פיפטינג, וזרע 10.000 תאים/באר על צלחת 96 בארות מצופה ב 50 μL / באר של DMEM F-12 בתוספת 10% FBS, 2 mM גלוטמין, פניצילין/סטרפטומיצין (ראה טבלת חומרים).
- לדגור על התאים ב 37 ° C ו 5% CO2במשך 24 שעות.
- הכינו תערובת של 250 ננוגרם של pcDNA3.1 הנושאת SNCA פראי אנושי, 0.250 מיקרוליטר של מגיב הטרנספקציה, 0.250 ליטר של אדג'ובנט טרנספקציה, ומדיום טרנספקציה עד 50 מיקרוליטר לכל באר (ראה טבלת חומרים). הכינו פתרון אב בהתחשב במספר הכולל של הבארות בניסוי.
- הסר את מדיום התרבית על ידי צנרת ידנית והוסף 50 μL / באר של התמיסה שהוכנה בשלב 1.4 על ידי pipetting. יש לדגור ב-37°C, 5% CO2.
- h לאחר הטרנספקציה, יש להסיר את מדיום הטרנספקציה על ידי פיפטינג ולהוסיף 25 μL/well של 4% paraformaldehyde (PFA) ב-PBS.
זהירות: Paraformaldehyde הוא קיבוע רעיל; השתמש בציוד הגנה אישי מתאים. - יש לדגור במשך 5 דקות בטמפרטורת החדר (R.T). הסר את פתרון התיקון על ידי צנרת ושטוף פעם אחת על ידי הוספת 50 μL / באר של PBS. הסר PBS על ידי pipetting.
- פיפטה 25 μL/well של TBS עם 0.05% Tween (TBS-T) ו-10% סרום חמור רגיל (NDS, ראה טבלת חומרים). יש לדגור במשך שעה אחת ב-R.T. כדי לחסום כל אות לא ספציפי.
- הכינו תמיסה של נוגדן ארנב-אנטי-α-סינוקלאין MJFR1 1:1000 יחד עם נוגדן עכבר-אנטי-TOMM20 1:100 ב-TBS-T (ראה טבלת חומרים) בהתאם למספר הבארות לניתוח.
- הסר את הפתרון החוסם משלב 1.8 על ידי צנרת והוסף 25 μL / well של תערובת הנוגדנים הראשוניים שהוכנה בשלב 1.9. לדגור לילה ב 4 °C (75 °F).
- הסר את תמיסת הנוגדנים העיקרית ושטוף שלוש פעמים על ידי הוספה והסרה של 50 μL / באר של TBS-T על ידי pipetting.
- הכינו תמיסה של נוגדן משני ירוק נגד עכבר 1:1000 יחד עם נוגדן משני אדום נגד ארנב 1:1000 ב-TBS-T (ראו טבלת חומרים) בהתאם למספר הבארות שיש לנתח.
- לאחר שאיפת PBS מהשטיפה האחרונה המתוארת בשלב 1.11, יש להוסיף 25 μL/well של תערובת הנוגדנים המשנית באמצעות פיפטה ולדגור על הצלחת למשך שעה אחת ב-R.T.
- הסר את תמיסת הנוגדנים המשנית על ידי פיפטינג והוסף 25 μL / well של 2 גרם / מ"ל DAPI ב- TBS-T. דוגרים על הצלחת במשך 5 דקות ב-R.T.
- הסר את תמיסת DAPI באמצעות פיפטה ושטוף שלוש פעמים על ידי הוספה והסרה של 50 μL / באר של TBS-T עם פיפטה.
- פיפטה 80 μL / באר של PBS עם 0.02% נתרן אזיד ולאחסן את הצלחת ב 4 ° C.
זהירות: נתרן אזיד הוא רעיל; השתמש בציוד הגנה אישי מתאים. - צלם תמונות באמצעות מיקרוסקופ פלואורסצנטי אוטומטי בעל תוכן גבוה או מערכת הדמיה קונפוקלית מקבילה המצוידת במטרה של 60x (ראה טבלת חומרים).
- בצע ניתוח של אות TOMM20 של תאים בודדים באמצעות פיג'י בצע שלבים 3.15-3.21. הימנעו מתאים שעוברים אפופטוזיס, נמק או מיטוזה.
הערה: לשם כך, אנו מוציאים מהניתוח את התאים המראים את התכונות המורפולוגיות של אפופטוזיס, נמק או מיטוזה הנראות מתחת למיקרוסקופ, כגון התכווצות תאים, התכווצות ממברנה, ניתוק תאים, עיבוי גרעיני, פיצול דנ"א וכרומטין גרעיני מעובה המאורגנים בגדילים עבים המיושרים במישור יחיד.
2. יצירת PFFs וזריקות PFF תוך גולגולתיות בעכברים
הערה: יצירת חומר ההזרקה ותהליך ההזרקה התוך גולגולתית מוצגים כאן. פרוטוקול זה נלקח מ Luk et al.25.
- כדי להשיג PFFs, הניחו צינור/בקבוק המכיל 0.5 מ"ל של α-Syn (5 מ"ג/מ"ל; פפטיד, ראו טבלת חומרים) על שייקר בטמפרטורה של 37°C ו-250 סל"ד למשך 7 ימים כדי לגרום לצבירה של α-synuclein.
- סוניק את α-סינוקלאין המצטבר באמפליטודה של 20% וחובת מחזור של 0.25 עד להשגת פיצול אופטימלי ונצפה על ידי צביעה שלילית של הדגימות במיקרוסקופ אלקטרונים תמסורת.
- כדי להכין עכברי בר זכרים ונקבות מסוג C57Bl/6 (בני 3 חודשים) לזריקות PFF סטריאטליות, יש לתת Meloxicam/Metacam (5 מ"ג/ק"ג) בתמיסת מלח תת-עורית. כמו כן לתת 1 מ"ל של תמיסת מלח סטרילית באמצעות שתי זריקות תת עוריות 0.5 מ"ל לכל חיה. טיפולים אלה מונעים התייבשות, דלקת וכאב.
- יש להשרות הרדמה עם 4% איזופלורן ו-0.7 ליטר/דקה O2 בתא זירוז. בדוק את עומק ההרדמה על ידי חוסר תגובת הדוושה.
- לגלח את החלק העליון של ראש העכבר ולהכניס בעדינות את החיה לתוך מסגרת המכשיר הסטריאוטקטי על שטיחון חום.
- שמור על מישור ההרדמה על ידי מתן הרדמה באינהלציה של בעלי חיים (1%-2% איזופלורן ב 0.7 ליטר / דקה O2) דרך מסכת פנים במהלך כל תהליך ההזרקה.
- הניחו את החיה על המסגרת הסטריאוטקטית. יש לחטא את אזור הניתוח בשלושה סבבים של פילינג כלורהקסידין לסירוגין ואתנול 70%. יש למרוח Marcaine/Bupivacaine באופן מקומי (סביב 100 μL) כהסננה תת עורית של 0.25%.
- בצע חתך של 0.5 ס"מ של העור כדי לחשוף את הגולגולת ולקדוח חור בקוטר 1 מ"מ לתוך הגולגולת כדי לחשוף את פני המוח, בקואורדינטות הבאות מברגמה: - 0.5 מ"מ קדמי, +/− 2.5 מ"מ בינוני.
- הזריקו 1.5 ליטר של PFFs שהתקבלו בשלב 2.2 על ידי העברה סטריאוטקטית לקואורדינטות שצוינו בשלב 2.8 מברגמה ו-2.7- מ"מ דורסו-ונטרלי (מהמוח העליון) בקצב זרימה של 100 nl/min עם מזרק המילטון 32-G. משוך את המזרק 5 דקות לאחר ההזרקה.
- תפר (גודל: 4-0, 45 ס"מ, ראה טבלת חומרים) את הפצע עם שלושה עד חמישה תפרים לפי הצורך, ולקשור כל אחד מהם עם 2 קשרים כפולים ולאחר מכן קשר אחד. עצור את שאיפת ההרדמה והסר את העכבר מהמסגרת.
- השאירו את העכבר להתאושש בכלוב התאוששות מתאים לפני החזרתו לכלוב הביתי שלו.
- במהלך השבוע שלאחר מכן, בצע בדיקות יומיות לאחר הניתוח. כאב, מצוקה או אי נוחות של כל בעל חיים צריכים לקבל מינון עם Meloxicam / Metacam כפי שמצוין בשלב 2.3 כל 24 שעות.
- שלושה חודשים לאחר מכן, הזריקו 300 μL של 200 מ"ג/מ"ל נתרן פנטוברביטל בתמיסת מלח באמצעות זריקה תוך צפקית. לאחר אובדן רפלקס הכאב, לבצע חתך (2-3 ס"מ) על החזה ולהרים את הצלעות כדי לחשוף את הלב.
- ניקוב טרנסקרדיאלי עם 10 מ"ל PBS ו-35 מ"ל של 4% פרפורמלדהיד ב-PBS בזה אחר זה ב-5 מ"ל/דקה באמצעות מזרק 50 מ"ל המחובר למחט פרפר 23 גרם.
- הסר את המוח ובצע postfix ב 4% PFA למשך 24 שעות נוספות ב 4 ° C. אחסנו אותו באתנול 70% בטמפרטורה של 4°C לאחר טיפול PFA.
- הכניסו את המוח לקופסאות פלסטיק מתאימות (ראו טבלת חומרים) ודגרו באתנול 95% למשך שעה אחת ב-R.T. חזרו על השלב באתנול טרי 95% ודגרו שוב למשך שעה.
- העבירו את המוח ל-100% אתנול למשך שעה אחת ב-R.T. חזרו על השלב באתנול טרי 100% ודגרו שוב למשך שעה.
- מעבירים את המוח לתחליף קסילן או קסילן למשך שעה אחת ב-R.T. חוזרים על הפעולה בתמיסה טרייה ודגרים שוב למשך שעה.
- מוציאים את תחליף הקסילן או הקסילן ודגרים על הדגימה בפרפין חם למשך שעה אחת. מחליפים את הפרפין ודגרים שעה נוספת.
- הרכיבו את המוח על קופסאות ההטבעה עם פרפין חם ותנו לו להתייבש במשך הלילה. הכינו מקטעים בגודל 5 מיקרומטר באמצעות מיקרוטום (ראו טבלת חומרים) והרכיבו אותם על שקופיות זכוכית.
3. ניתוח מורפולוגיה מיטוכונדריאלית על ידי אימונוהיסטוכימיה על פרוסות מוח משובצות פרפין מעכברים בהזרקת PFF
- לטבול את המגלשות על ידי טבילה בתחליף קסילן עשר פעמים. דוגרים על המגלשות במשך 2 דקות בתחליף קסילן. טובלים שוב עשר פעמים בתחליף קסילן.
הערה: שלב זה נחוץ כדי להסיר את הפרפין ולאפשר התייבשות של הדגימות. - התייבשות: חזור על התהליך המתואר בשלב 3.1 עם הפתרונות הבאים: 100% EtOH, 95% EtOH, 70% EtOH ופעמיים עם ddH2O לפי הסדר.
- בצע שליפת אנטיגן ו immunostaining בצע את השלבים הבאים.
- התחל על ידי העברת הדגימות למיכל microwavable עם ddH2O.
- חימום 100x ציטראט חיץ pH 6 (ראה טבלה של חומרים) מאוחסן ב 4 ° C (דטרגנטים עשויים לזרז) ולהכין 350 מ"ל של חיץ ציטראט טרי 1x. לאחר מכן יוצקים את מאגר הציטראט למיכל פלסטיק נוח עם מכסה.
- הכניסו את המגלשות למיכל חיץ הציטראט (קריטי: בדקו שהשקופיות נמצאות מתחת לגובה החיץ) והניחו את המכסה.
אזהרה: יש לוודא שהמכסה אינו סגור לחלוטין, אחרת המיכל עלול להתפוצץ במיקרוגל. - מיקרוגל ב 700 W: 4 דקות + 5 דקות מנוחה, 1.5 דקות + 5 דקות מנוחה. ממלאים את מאגר הציטראט ומחממים שוב במיקרוגל 1.5 דקות + 5 דקות מנוחה, 1.5 דקות + 5 דקות מנוחה, 1.5 דקות + 5 דקות מנוחה.
- מצננים את הדגימות במאגר ציטראט על קרח למשך 20 דקות. לשטוף את המדגם עם ddH2O.
הערה: שליפת האנטיגן עשויה להשתנות בהתאם לדרישות נוגדנים ספציפיות.
- יבש את שקופיות הדגימה עם מגבת נייר מבלי לגעת ברקמה. ציירו מלבנים בעזרת עט פאפ (ראו טבלת חומרים) סביב חלקי הרקמה.
- העבר את כל השקופיות לקופסה לצביעת מערכת החיסון ושטוף כמה פעמים בעדינות עם TBS + 0.05% TWEEN (TBS-T). בדקו שטיפות TBS-T נשארות בתוך מלבני עט הפאפ.
- הסר TBS-T מהדגימות על-ידי הקשה על מגבת נייר. הוסף 50 μL של תמיסת חסימה (10% NDS ב- TBS-T) לכל מלבן (מבלי לגעת ברקמה) ודגר במשך שעה אחת ב- RT.
הערה: הנפחים עשויים להשתנות בהתאם לגודל הרקמה; נסה לוודא כי: (1) האזור בעט פאפ דומה בין הדגימות, ו-(2) האזור מכוסה במלואו על-ידי נפח המאגר שנבחר. - הסר את פתרון החסימה מהדגימות על ידי הקשה על מגבת נייר. פיפטה עדינה 50 μL/מלבן של תערובת הנוגדנים העיקרית הבאה ב-TBS-T: אנטי-טירוזין הידרוקסילאז 1:250 יחד עם אנטי-VDAC1 1:100 ואנטי-pSer129 α-סינוקלאין EP1536Y 1:2000 (ראו טבלת חומרים).
- לדגור לילה ב 4 °C (75 °F).
- שטפו על ידי הדבקת TBS-T על השקופיות והוציאו אותה על ידי הקשה על מגבת נייר. חזור על הפעולה שלוש פעמים.
- הוסף על ידי pipetting 50 μL / מלבן של תערובת נוגדנים משניים: ירוק משני anti-Chicken, אדום משני anti-Mouse, ואדום אדום משני anti-Rabbit 1:1000 ב TBS-T (ראה טבלת חומרים). יש לדגור בטמפרטורה של 37°C למשך שעה אחת בחושך.
- יש לכבס שלוש פעמים באמצעות TBS-T כמתואר בשלב 3.13.
- יש לדגור עם DAPI 2 מיקרוגרם/מ"ל ב-TBS-T למשך דקה אחת. הסר את פתרון DAPI על-ידי הקשה על מגבת נייר. יש לכבס שלוש פעמים באמצעות TBS-T כמתואר בשלב 3.13.
- הרכיבו מכסה זכוכית על הדגימות באמצעות 2 טיפות/שקופית של מגיב הרכבה (ראו טבלת חומרים). לחץ על הכיסוי בעדינות כדי למנוע בועות ותן לדגימות להתייבש במשך שעה אחת ב- R.T. לאחר מכן, יש לאחסן ב- 4 ° C בחושך.
- צלם לפחות 50 תאים בתחומים שונים באמצעות מערכת הדמיה פלואורסצנטית של תאורה מובנית המצוידת בטכנולוגיית 60x שמן אובייקטיבי או קונפוקלית.
- בצע ניתוח של אות VDAC1 של תאים בודדים באמצעות פיג'י כפי שמצוין בשלבים הבאים.
- ראשית, בחר ובודד את אזור העניין (ROI) על-ידי ציור קווי מתאר סביב התא החיובי או השלילי (בהתאם לצורך) ושימוש בפונקציה "חיתוך". על מנת למנוע הטיה בבחירת החזר ההשקעה, בחרו בו על ידי התחשבות באות הפלואורסצנטי של סמן שאינו קשור לניתוח (כלומר, לא סמן מיטוכונדריאלי).
- אופציונלי: אם התמונה מפוקסלת יתר על המידה, השתמש בפונקציה "חלק" לקבלת הגדרת קצה גבוהה יותר.
הערה: אם הפונקציה חלקה מוחלת על תמונה, החל אותה על כל התמונות הבאות. - אופציונלי: השתמש בפונקציה "Convolve" (מצב ליבה, בתהליך > מסננים) כדי להקטין את הרקע.
הערה: זה אופציונלי ובדרך כלל לא הכרחי בעת שימוש במקטעים של 5 מ 'בשל האופי הדק יותר של המקטעים. - הפעל את מתארי הצורה והגביל לאפשרויות סף בפונקציה "הגדר מדידה" (ודא שהם מופעלים באמצעות הניתוח).
- בתפריט "התאמה", בחר את פונקציית הסף והתאם את רמת הסף. יש לשמור על הגדרות הסף עבור כל התאים באותה דגימה.
- נסו להבטיח הדמיה נאותה של הרשת המיטוכונדריאלית, כפי שמוצג בתמונות המייצגות של מאמר זה, תוך השלכת פיקסלים ברקע.
- השתמש בכלי ניתוח חלקיקים בכרטיסיה ניתוח. הגדר גודל מתאים כדי ללכוד את המיטוכונדריה. בדוגמה זו, גודל: 25-אינסוף, הפעל: יחידות פיקסלים ובחר: הצג: פקודות מסיכות שימשו להצגה חזותית של התוצאה. פיג'י תחשב ותציג את הספירות, יחס גובה-רוחב (AR) ופרמטרי צורה אחרים בחלונית חדשה.
- לבצע ניתוח סטטיסטי של הנתונים לפי הצורך. בניסוי זה, מבחן t שימש לניתוח ההבדל ביחס גובה-רוחב ממוצע (AR) וספירות שחושבו על ידי פיג'י בין קבוצות הניסוי לאחר בדיקת נורמליות עם מבחני הנורמליות של ד'אגוסטינו ופירסון.
Representative Results
על מנת להבטיח כי מתקיימים תנאי הדמיה וניתוח מתאימים להערכה באתרו של מורפולוגיה מיטוכונדריאלית ברקמות, מומלץ לחקור במבחנה את המורפולוגיה המיטוכונדריאלית בתגובה למודולטור ידוע של מורפולוגיה מיטוכונדריאלית (סעיף 1). לדוגמה, SNCA התבטא יתר על המידה גנטית בתאי SH-SY5Y כדי לגרום לשינויים במורפולוגיה של המיטוכונדריה כפי שתואר קודם לכן26. עלבונות אחרים שיכולים לשמש כבקרה להחמרת המורפולוגיה של המיטוכונדריה יהיו רעב או שימוש במעכבי פעילות מיטוכונדריאלית כגון MPP+. התאים עברו טרנספורמציה ונצבעו עבור α-סינוקלאין (AS) כדי להפריד בין תאי SNCA+ (AS+) ו-SNCA- (AS-). הם גם הוכתמו עם TOMM2027 כדי להמחיש את רשת התאים המיטוכונדריאלית. כדי להפוך את הניתוח הזה לדומה ככל האפשר לזה של חתך רקמה של 5 מיקרומטר, נותח מישור קונפוקלי אחד בניגוד להקרנה מקסימלית של מספר מישורים. ניתוח מורפולוגי של מישור קונפוקלי אחד של TOMM20 גילה שגם המספר הכולל של המיטוכונדריה וגם יחס הממדים שלהם או AR (שנמצא בקורלציה עם התארכות האברון) הופחתו בתגובה לביטוי יתר של SNCA (איור 1).
Immunostaining בוצע עבור חלבון מיטוכונדריאלי VDAC1 בקטעי מוח עכבר משובצים פרפין 5 מיקרומטר מבעלי חיים שהוזרקו עם PFFs כמתואר בסעיף הפרוטוקול לעיל. Substantia nigra pars compacta (SNc) נוירונים דופמינרגיים, שעוברים ניוון בפרקינסון, התגלו באמצעות קו-אימונוסטיין עם אנטי-טירוזין הידרוקסילאז (TH) והופרדו אזורית מאזור הטגמנטל הגחוני וה-substantia nigra pars lateralis. מצד שני, צביעה נגד פוספוסר 129-α-סינוקלאין (pS129) אפשרה לנו להבחין בין תאים שמכילים נגעי pS129 לבין תאים בריאים (pS129+ לעומת pS129-). צולמו תמונות SNc של שלוש חיות שונות, וניתוח תמונות עוקב של צביעת VDAC1 של תאי עצב חיוביים ל-TH גילה ירידה הן בספירת המספרים המיטוכונדריאליים והן ביחס הממדים בין תאי עצב הנושאים נגעי pS129 לבין תאי עצב החסרים אותם (איור 2). תוצאות אלה מצביעות על כך שהמורפולוגיה המיטוכונדריאלית של תאי עצב בעלי נגעי pS129 נפגעת בהשוואה לזו של תאים חסרי נגעי pS129.
בעוד שהניסוי הספציפי הזה מראה ירידה במציאות הרבודה, ובכך מדגיש ירידה בהתארכות המיטוכונדריה יחד עם ירידה בספירה העולמית, מה שמצביע על החמרה במורפולוגיה של המיטוכונדריה, הפרשנות של הנתונים צריכה להיות תלויה בניסוי. לדוגמה, ירידה במציאות רבודה ובספירות יכולה להצביע על ירידה גלובלית בתכולת המיטוכונדריה כמו גם פיצול, בעוד שירידה במציאות רבודה אך עלייה בספירה הגלובלית תצביע על פנוטיפ פיצול מיטוכונדריאלי. לכן, חשוב לפרש את הנתונים בהקשר של שני המדדים.
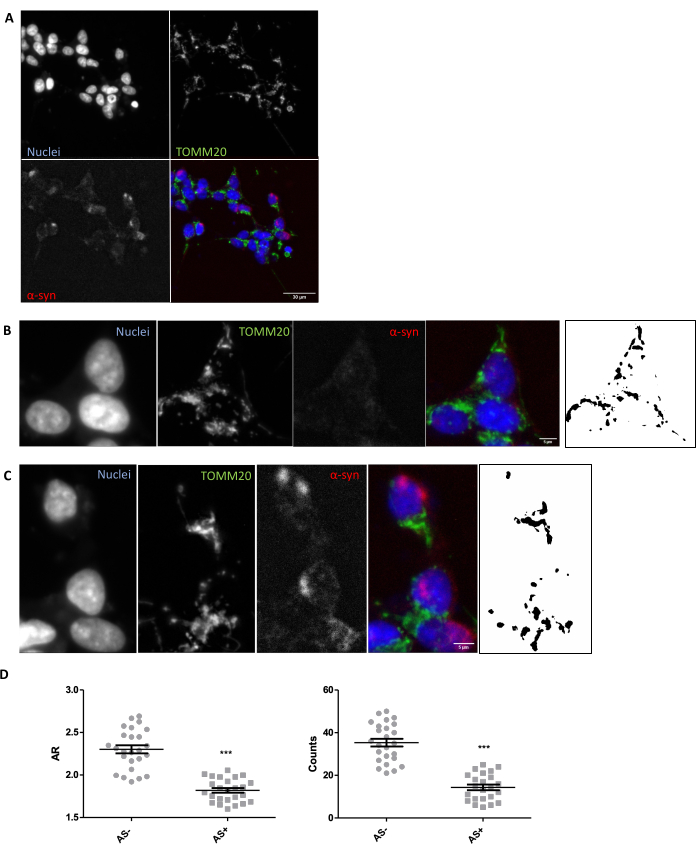
איור 1: מורפולוגיה מיטוכונדריאלית במודל SNCA-overexpressioning in vitro . Co-immunostaining עבור TOMM20 (ירוק), α-synuclein (AS, אדום) ו- DAPI (כחול) על SNCA-overexpressioning ולא overexpressing (AS+ ו- AS-, בהתאמה) תאים (A). פירוט של תא AS- (B) ותא AS+ (C). תמונות בשחור-לבן בחלוניות (B) ו-(C) מייצגות את המסיכות של אות TOMM20 לאחר החלת הפונקציה Fiji המתוארת בסעיף Protocol. מסיכה זו מאפשרת לכמת את צורת המבנים המתקבלים. ספירות מיטוכונדריאליות וערכי יחס גובה-רוחב (AR) של תאי AS- ו- AS+ (N = 25 תאים לכל תנאי) כומתו ויוצגו כערכים בודדים וכן כממוצע ± SEM; **ערך p < 0.05 t-test (D). הנורמליות הוערכה באמצעות מבחני הנורמליות של ד'אגוסטינו ופירסון. מוטות קנה מידה: A, 30 מיקרומטר; B,C, 5 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
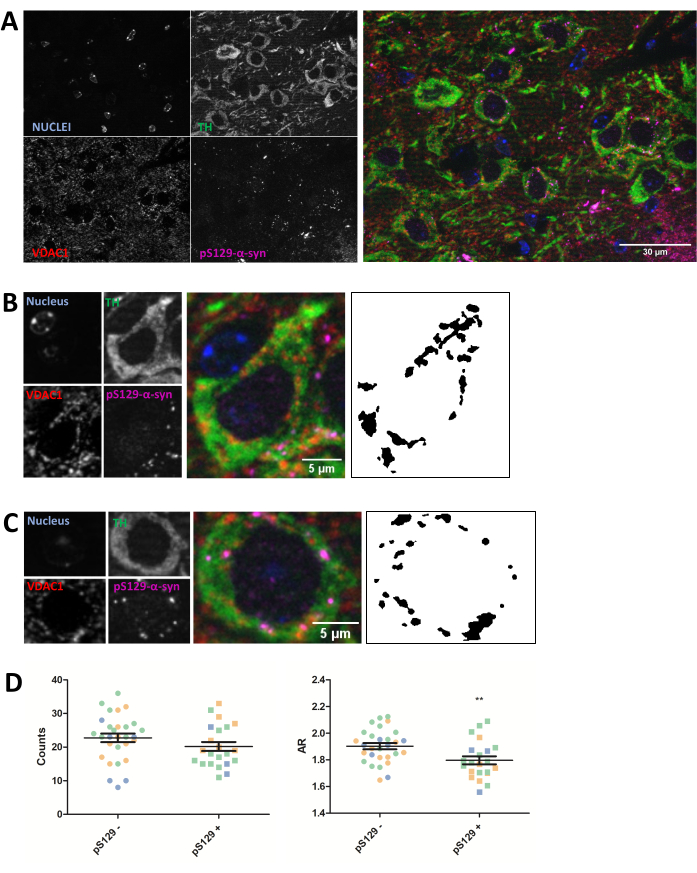
איור 2: מורפולוגיה מיטוכונדריאלית מושפעת בתאי עצב שמכילים נגעי pS129. Co-immunostaining עבור TH (ירוק), VDAC1 (אדום), phosphoS129-α-synuclein (מגנטה), ו- DAPI (כחול) של SNc של עכברים בהזרקת PFF (A). הפרטים של נוירון דופמינרגי פוספוס129-α-סינוקלאין-שלילי (pS129-) (B) ושל נוירון דופמינרגי פוספוס129-α-סינוקלאין-חיובי (pS129+) (C). תמונות בשחור-לבן בחלוניות (B) ו-(C) מייצגות את המסיכות של אות TOMM20 לאחר החלת הפונקציה Fiji המתוארת בסעיף Protocol. מסיכה זו מאפשרת לכמת את צורת המבנים המתקבלים. תאים שליליים וחיוביים נספרו בדגימות משלוש חיות שונות, כפי שמודגם על ידי הצבעים השונים של ערכי הגרפים הבודדים (כחול, ירוק וכתום). ספירות מיטוכונדריאליות וכימות AR של pS129- (N = 29) לעומת pS129+ (N = 22) בנוירונים דופמינרגיים יוצגו כממוצע ± SEM וכן כערכי תאים בודדים; **ערך p < 0.05 t-test (D). הנורמליות הוערכה באמצעות מבחני הנורמליות של ד'אגוסטינו ופירסון. מוטות קנה מידה: A, 30 מיקרומטר; B,C, 5 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
בסך הכל, מחקר זה מראה כי immunostaining בשילוב עם ניתוח תמונה היא שיטה אמינה לניתוח מורפולוגיה מיטוכונדריאלית. למעשה, הוא מאפשר לכמת את מספר המיטוכונדריה, כמו גם כמה פרמטרים מורפולוגיים כגון יחס גובה-רוחב הן בתרבית התא והן ברקמה. מספר המיטוכונדריה קשור ישירות למצב התפקודי של מנגנוני הביקוע והאיחוי של הדגימות, בעוד שערך AR מסתמך על התארכות האברון. שיטה זו עשויה להיות בעלת ערך רב במיוחד להערכה מהירה של הפרעות מיטוכונדריאליות במודלים של פרקינסון שבהם שינויים במורפולוגיה, דינמיקה ותפקודים של המיטוכונדריה הם מנגנונים פתולוגיים ידועים28,29. α-סינוקלאין ממלא תפקיד רלוונטי גם בפרקינסון: אכן, α-סינוקלאין הוא אחד המרכיבים של גופי לוי, אגרגטים ציטופלסמטיים פיברילריים המשמשים לאבחון לאחר המוות של חולי פרקינסון30. יתר על כן, מוטציות בגן SNCA נמצאו בחולים עם פרקינסון מוכר וספורדי כאחד (נסקר ב-31). זרחן של α-סינוקלאין ב-Ser129 הוכח בהרחבה כפתולוגיה דמוית גוף לוי, המתגלה לאחר עלבון PFF ומעוררת השפעות רעילות שונות32,26.
באמצעות הכלי שהוצג כאן, הצלחנו לזהות ירידה במספר המיטוכונדריה ובערכי AR בנוכחות α-סינוקלאין (תאים עם צביעה α-סינוקלאין ותאי עצב הנושאים נגעים חיוביים ל-phosphoSer129α-synuclein, בהתאמה) בהשוואה לתאים חסרי נגעים כאלה (תאים שליליים α-synuclein ו-phosphoS129α-synuclein). תוצאות אלה תואמות דיווחים קודמים המראים כיצד אינטראקציות ישירות של α-סינוקלאין-מיטוכונדריה מייצרות השפעות רעילות על תפקוד המיטוכונדריה והומאוסטזיס במחלת פרקינסון26,33 34. ואכן, דווח כי עכברים עם מוטציות α-סינוקלאין מפגינים נזק מוגבר לדנ"א מיטוכונדריאלי35 ומיטופגיה36,37. יתר על כן, תואר כי רמות מוגברות של α-סינוקלאין מקדמות ביקוע/פיצול מיטוכונדריאלי, גורמות למיני חמצן תגובתי במיטוכונדריה, ומווסתות את ביטוי החלבונים המיטוכונדריאליים בשורות תאים ובמודלים של עכברים המבטאים יתר על המידה α-סינוקלאין 26,38,39.
חשוב להדגיש כי כלי זה תלוי מאוד בנוגדנים המשמשים למחקר; הערכה מורפולוגית זהירה של כתם הנוגדנים המשמש היא הכרחית כדי לזהות את התא התת-תאי המתאים. מכיוון שטכניקה זו מבוססת על חתכים של 5 מיקרומטר ולכן דורשת מישורי מוקד בודדים לניתוח המבנים המיטוכונדריאליים, היעדר פנוטיפ לא ישלול את קיומו של פנוטיפ, שכן ייתכן שהבדלים עדינים במורפולוגיה המיטוכונדריאלית לא יתגלו בשיטה זו.
בעוד שעבודה זו ואחרות השתמשו בעבר בגישות דומות להערכת מורפולוגיה מיטוכונדריאלית in vivo40, יש צורך בפרוטוקול מפורט שיהיה נגיש לקהילת המחקר לצורך הערכה זו. משמעות מחקר זה היא שניתן ליישם שיטה זו על מודלים שונים של מחלות in vivo כדי להעריך הפרעות מורפולוגיות מיטוכונדריאליות ולזהות פתולוגיה פוטנציאלית, אשר עשויה בסופו של דבר להקל על סינון תרכובות עופרת לטיפול בהפרעות כאלה. בעוד ניתוח זה מוגבל כיום לרקמה משובצת פרפין, היתרון של השיטה הוא שניתן ליישם אותה על כל מודל מחלה לאחר איסוף רקמות סופניות, מה שהופך אותה לכלי רב-תכליתי מאוד.
Disclosures
אנו מבקשים לדווח על אי ניגוד עניינים.
Acknowledgements
ברצוננו להודות למממני מחקר זה, במיוחד Ikerbasque, משרד המדע והחדשנות הספרדי, קרן מייקל ג'יי פוקס, IBRO והמרכז הבאסקי אצ'וקרו למדעי המוח.
Materials
| Name | Company | Catalog Number | Comments |
| 32 G Hamilton syringe | Hamilton | 7632-01 | |
| 4',6-diamidino-2-fenilindol, dihidrocloruro (DAPI) | Invitrogen | D1306 | |
| 4/0 USP 45 cm suture | SSa90 pga | 32345n-36u | |
| Alexa fluor 488/594-Donkey anti-Mouse | Invitrogen | A21202; A21203 | green/red dye-Donkey anti-Mouse |
| Alexa fluor 594/647-Donkey anti-Rabbit | Invitrogen | A21207 A31573 | red/far red dye-Donkey anti-Rabbit |
| AlexaFluor 488-Donkey anti-Chicken | Jackson ImmunoResearch | 703-545-155 | green dye-Donkey anti-Chicken |
| Anti-PSer129 α-synuclein EP1536Y (Rabbit) antibody | Abcam | ab51253 | |
| Anti-TOM 20 (Mouse) antibody | Santa Cruz | sc-17764 | |
| Anti-Tyrosine Hydroxylase (Chicken) antibody | Abcam | ab76442 | |
| Anti-VDAC1 (Mouse) antibody | Santa Cruz | sc-390996 | |
| Anti-α-synuclein antibody MJFR1 (Rabbit) | Abcam | ab138501 | |
| Citrate buffer 100X stock: 120mM citrate buffer, 5% Tween in water (pH 6) | Home-made | ||
| Disposable base mold for tissue embedding | Fisher | 22-363-553 | Plastic embedding boxes |
| D-MEM F12 | Gibco | A321331020 | |
| EVOS M7000 Imaging System | ThermoFisher Scientific | High-content automated fluorescence microscope | |
| Fetal Bovine Serum | Gibco | 10270106 | |
| Flat optical bottom 96 well plates | Greiner | 675090 | |
| FluorSave Reagent | Millipore | 345789-20ML | Mounting reagent |
| Glutamine 200 mM | Gibco | 25030-024 | |
| ImmEdge Hydrophobic Barrier Pen | Vector Laboratories | H-4000 | PAP-pen |
| Lipofectamine and Plus Reagent | Invitrogen | 11668-019; 11514-015 | Transfection reagent and transfection adjuvant |
| Matrigel | Corning | 354230 | Coating matrix |
| Microtome | ThermoFisher Scientific | ||
| Normal Donkey Serum | Gibco | PCN5000 | |
| Opti-MEM | Gibco | 31985070 | Transfection medium |
| PCDNA4 plasmid (backbone) | Addgene | 41036 | |
| Penicillin/Streptomycin solution | Gibco | 15140-122 | |
| SH-SY5Y cells/well | ATCC | HTB-11 | |
| Xylene substitute | Labbox | 22L36504 | |
| Zeiss Axio Imager Apotome 2 | Carl Zeiss | Structured illumination fluorescence imaging system | |
| α-synuclein peptide | rpeptide | S-1010-2 |
References
- Yang, Y., Lu, B. Mitochondrial morphogenesis, distribution, and parkinson disease. Journal of Neuropathology and Experimental Neurology. 68 (9), 953-963 (2009).
- Schapira, A. H. Mitochondria in the aetiology and pathogenesis of Parkinson's disease. The Lancet Neurology. 7 (1), 97-109 (2008).
- Swerdlow, R. H. Mitochondria and mitochondrial cascades in alzheimer's disease. Journal of Alzheimer's Disease. 62 (3), 1403-1416 (2018).
- Hedrich, K., et al. type, and origin of Parkin mutations: Review and case studies. Movement Disorders. 19 (10), 1146-1157 (2004).
- Kahle, P. J., Haass, C. How does parkin ligate ubiquitin to Parkinson's disease. EMBO reports. 5 (7), 681-685 (2004).
- Dawson, T. M., Dawson, V. L. The role of parkin in familial and sporadic Parkinson's disease. Movement Disorders. 25, S32-S39 (2010).
- Pickrell, A. M., Youle, R. J. The Roles of PINK1, Parkin, and Mitochondrial Fidelity in Parkinson's Disease. Neuron. 85 (2), 257-273 (2015).
- Zhi, L., et al. Loss of PINK1 causes age-dependent decrease of dopamine release and mitochondrial dysfunction. Neurobiology of Aging. 75, 1-10 (2019).
- Bonifati, V., et al. DJ-1(PARK7), a novel gene for autosomal recessive, early onset parkinsonism. Neurological Sciences. 24 (3), 159-160 (2003).
- Chia, S. J., Tan, E. -. K., Chao, Y. -. X. Historical Perspective: Models of Parkinson's Disease. International Journal of Molecular Sciences. 21 (7), 2464 (2020).
- Wilson, D. M., Cookson, M. R., Den Bosch, L. V. a. n., Zetterberg, H., Holtzman, D. M., Dewachter, I. Hallmarks of neurodegenerative diseases. Cell. 186 (4), 693-714 (2023).
- Moore, D. J., West, A. B., Dawson, V. L., Dawson, T. M. Molecular pathophysiology of Parkinson's disease. Annual Review of Neuroscience. 28 (1), 57-87 (2005).
- Olanow, C. W., Tatton, W. G. Etiology and pathogenesis of Parkinson's disease. Annual Review of Neuroscience. 22 (1), 123-144 (1999).
- Nunnari, J., Suomalainen, A. Mitochondria: In sickness and in health. Cell. 148 (6), 1145-1159 (2012).
- Okamoto, K., Shaw, J. M. Mitochondrial Morphology and Dynamics in Yeast and Multicellular Eukaryotes. Annual Review of Genetics. 39 (1), 503-536 (2005).
- Malpartida, A. B., Williamson, M., Narendra, D. P., Wade-Martins, R., Ryan, B. J. Mitochondrial Dysfunction and Mitophagy in Parkinson's Disease: From Mechanism to Therapy. Trends in Biochemical Sciences. 46 (4), 329-343 (2021).
- Zou, W., et al. Nanoscopic quantification of sub-mitochondrial morphology, mitophagy and mitochondrial dynamics in living cells derived from patients with mitochondrial diseases. Journal of Nanobiotechnology. 19 (1), 136 (2021).
- Navaratnarajah, T., Anand, R., Reichert, A. S., Distelmaier, F. The relevance of mitochondrial morphology for human disease. The International Journal of Biochemistry & Cell Biology. 134, 105951 (2021).
- Zambon, F., et al. Cellular α-synuclein pathology is associated with bioenergetic dysfunction in Parkinson's iPSC-derived dopamine neurons. Human Molecular Genetics. 28 (12), 2001-2013 (2019).
- Cherubini, M., Lopez-Molina, L., Gines, S. Mitochondrial fission in Huntington's disease mouse striatum disrupts ER-mitochondria contacts leading to disturbances in Ca2+ efflux and Reactive Oxygen Species (ROS) homeostasis. Neurobiology of Disease. 136, 104741 (2020).
- Parihar, M. S., Parihar, A., Fujita, M., Hashimoto, M., Ghafourifar, P. Alpha-synuclein overexpression and aggregation exacerbates impairment of mitochondrial functions by augmenting oxidative stress in human neuroblastoma cells. The International Journal of Biochemistry & Cell Biology. 41 (10), 2015-2024 (2009).
- Wiemerslage, L., Lee, D. Quantification of mitochondrial morphology in neurites of dopaminergic neurons using multiple parameters. Journal of Neuroscience Methods. 262, 56-65 (2016).
- Liu, Y. -. T., et al. Mt-Keima detects PINK1-PRKN mitophagy in vivo with greater sensitivity than mito-QC. Autophagy. 17 (11), 3753-3762 (2021).
- Shoshan-Barmatz, V., Shteinfer-Kuzmine, A., Verma, A. VDAC1 at the intersection of cell metabolism, apoptosis, and diseases. Biomolecules. 10 (11), 1485 (2020).
- Luk, K. C., et al. Pathological α-Synuclein transmission initiates parkinson-like neurodegeneration in nontransgenic mice. Science. 338 (6109), 949-953 (2012).
- Ryan, B. J., et al. REST protects dopaminergic neurons from mitochondrial and α-synuclein oligomer pathology in an alpha synuclein overexpressing BAC-transgenic mouse model. The Journal of Neuroscience. 41 (16), 3731-3746 (2021).
- Yamamoto, H., et al. Dual role of the receptor Tom20 in specificity and efficiency of protein import into mitochondria. Proceedings of the National Academy of Sciences. 108 (1), 91-96 (2011).
- Exner, N., Lutz, A. K., Haass, C., Winklhofer, K. F. Mitochondrial dysfunction in Parkinson's disease: molecular mechanisms and pathophysiological consequences. The EMBO Journal. 31 (14), 3038-3062 (2012).
- Grünewald, A., Kumar, K. R., Sue, C. M. New insights into the complex role of mitochondria in Parkinson's disease. Progress in Neurobiology. 177, 73-93 (2019).
- Baba, M., et al. Aggregation of alpha-synuclein in Lewy bodies of sporadic Parkinson's disease and dementia with Lewy bodies. The American journal of pathology. 152 (4), 879-884 (1998).
- Vázquez-Vélez, G. E., Zoghbi, H. Y. Parkinson's disease genetics and pathophysiology. Annual Review of Neuroscience. 44 (1), 87-108 (2021).
- Mahul-Mellier, A. -. L., et al. The process of Lewy body formation, rather than simply α-synuclein fibrillization, is one of the major drivers of neurodegeneration. Proceedings of the National Academy of Sciences. 117 (9), 4971-4982 (2020).
- Ganguly, U., et al. Interaction of α-synuclein and Parkin in iron toxicity on SH-SY5Y cells: implications in the pathogenesis of Parkinson's disease. Biochemical Journal. 477 (6), 1109-1122 (2020).
- Ganjam, G. K., et al. Mitochondrial damage by α-synuclein causes cell death in human dopaminergic neurons. Cell Death & Disease. 10 (11), 865 (2019).
- Martin, L. J., et al. Parkinson's Disease α-synuclein transgenic mice develop neuronal mitochondrial degeneration and cell death. The Journal of Neuroscience. 26 (1), 41-50 (2006).
- Choubey, V., et al. Mutant A53T α-Synuclein induces neuronal death by increasing mitochondrial autophagy. Journal of Biological Chemistry. 286 (12), 10814-10824 (2011).
- Chen, L., Xie, Z., Turkson, S., Zhuang, X. A53T Human α-synuclein overexpression in transgenic mice induces pervasive mitochondria macroautophagy defects preceding dopamine neuron degeneration. The Journal of Neuroscience. 35 (3), 890-905 (2015).
- Kamp, F., et al. Inhibition of mitochondrial fusion by α-synuclein is rescued by PINK1, Parkin and DJ-1. The EMBO Journal. 29 (20), 3571-3589 (2010).
- Nakamura, K., et al. Direct membrane association drives mitochondrial fission by the parkinson disease-associated protein α-synuclein. Journal of Biological Chemistry. 286 (23), 20710-20726 (2011).
- Park, J., et al. Abnormal mitochondria in a non-human primate model of MPTP-induced Parkinson's disease: Drp1 and CDK5/p25 signaling. Experimental Neurobiology. 28 (3), 414-424 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved