Гистологическое исследование морфологии митохондрий на модели болезни Паркинсона
* These authors contributed equally
In This Article
Summary
В данном исследовании представлен метод анализа морфологии митохондрий, основанный на иммуноокрашивании и анализе изображений в тканях мозга мышей in situ. В ней также описывается, как это позволяет обнаруживать изменения в морфологии митохондрий, вызванные агрегацией белков в моделях болезни Паркинсона.
Abstract
Митохондрии играют центральную роль в энергетическом обмене клеток, и их функция особенно важна для нейронов из-за их высокой потребности в энергии. Поэтому митохондриальная дисфункция является патологическим признаком различных неврологических расстройств, в том числе и болезни Паркинсона. Форма и организация митохондриальной сети очень пластичны, что позволяет клетке реагировать на сигналы и потребности окружающей среды, а структура митохондрий также тесно связана с их здоровьем. Здесь мы представляем протокол изучения морфологии митохондрий in situ на основе иммуноокрашивания митохондриального белка VDAC1 и последующего анализа изображений. Этот инструмент может быть особенно полезен для изучения нейродегенеративных расстройств, поскольку он может обнаруживать тонкие различия в количестве и форме митохондрий, индуцированные агрегатами α-синуклеина, белка, склонного к агрегации, активно участвующего в патологии болезни Паркинсона. Этот метод позволяет сообщить, что дофаминергические нейроны черной субстанции pars compacta, содержащие повреждения pS129, демонстрируют фрагментацию митохондрий (о чем свидетельствует их сниженное соотношение сторон, AR) по сравнению с их здоровыми соседними нейронами в предварительно сформированной модели Паркинсона с внутричерепной инъекцией фибриллы.
Introduction
Центральная нервная система испытывает сильную потребность в АТФ: нейроны используют АТФ для поддержки ионных градиентов, синтеза нейротрансмиттеров, мобилизации, высвобождения и переработки синаптических везикул, а также для обеспечения локальной трансляции и деградации белков. Более 95% АТФ, используемого мозгом, вырабатывается митохондриями1. Поэтому неудивительно, что митохондриальная дисфункция особенно вредна для нейронов. Фактически, нарушения функции митохондрий играют важную роль в развитии нескольких неврологических заболеваний, включая нейродегенеративные состояния, такие как болезнь Паркинсона (БП) и болезнь Альцгеймера (БА)2,3.
Несколько генов однозначно связаны с белками, кодирующими PD, которые имеют значение для митохондриальной функции и гомеостаза, такими как паркин 4,5,6, PTEN-индуцированная киназа 1 (PINK1)7,8 и DJ-19. Еще одним доказательством роли митохондриальной дисфункции в развитии болезни Паркинсона является то, что лечение ингибиторами комплекса I митохондриальной цепи переноса электронов (такими как ротенон и МФТП) повторяет некоторые аспекты болезни Паркинсона in vitro и in vivo10. Тем не менее, важно отметить, что многие патологические процессы могут приводить к потере нейронов при болезни Паркинсона, наряду с митохондриальным дефицитом: окислительный стресс, изменение гомеостаза кальция, недостаточность убиквитин-протеасомы и аутофагии-лизосомальной систем, а также агрегация белков являются одними из наиболее изученных (рассмотрено в 11,12,13 и).
Митохондрии неоднородны по форме: помимо отдельных единиц, они обычно встречаются в виде протяженных ретикулярных и канальцевых сетей. Структура и расположение клеток митохондрий имеют решающее значение для их функционирования14; На самом деле, митохондриальные сети чрезвычайно динамичны, претерпевая частые процессы деления, слияния и митофагии, чтобы удовлетворить потребности клеток и реагировать на сигналы окружающей среды15,16. Кроме того, морфология митохондрий тесно связана с состоянием их здоровья. Например, при атрофии зрительного нерва человека генетические мутации, снижающие активность митохондрий, приводят к аномальным, тонким и гиперсросшимися митохондриям. С другой стороны, различные заболевания человека имеют аберрантную морфологию митохондрий, включая фрагментацию митохондрий или чрезмерное слияние митохондрий, которые оказывают вредное воздействие на функцию митохондрий (рассмотрено в18). В контексте болезни Паркинсона мы и другие ранее показали, что аномальная форма митохондрий коррелирует с дисфункцией в ответ на агрегаты α-синуклеина19. Несмотря на то, что морфология митохондрий была широко изучена in vitro как в контексте болезни Паркинсона, так и в контексте других заболеваний 20,21,22, протоколы оценки морфологии митохондрий из срезов in vivo отсутствуют. Это делает изучение митохондрий in vivo в контексте таких заболеваний, как болезнь Паркинсона, сильно зависимым от трансгенных животныхили оценки экстрактов среднего мозга, которые не могут обеспечить клеточное разрешение.
Представлен протокол изучения морфологии митохондрий in situ как показателя их функционального состояния и здоровья, основанный на иммуноокрашивании митохондриального белка VDAC124 с последующим анализом изображений на срезах тканей, залитых парафином. Мы также показываем результаты этого протокола in vitro и in vivo моделях БП: клетки нейробластомы с гиперэкспрессией SNCA (Synuclein Alpha) и ткани мозга мышей, подвергшихся внутричерепной инъекции α-синуклеиновых предварительно сформированных фибрилл (PFF). Совместное иммуноокрашивание с антителом к α-синуклеину (в клетках) или phosphoSer129-α-синуклеину pS129 (в мозге мышей) позволило идентифицировать в образцах клетки с агрегированной белковой патологией (гиперэкспрессия фибрилл α-синуклеина и α-синуклеина соответственно), в то время как отрицательные клетки служили непатологическим контролем в тех же образцах. Благодаря этому анализу и данным, описанным здесь, наблюдалось снижение соотношения сторон, что указывает на фрагментацию митохондрий в клетках с гиперэкспрессией SNCA или с поражениями pS129.
Protocol
Все процедуры, описанные в этом разделе, были выполнены в соответствии с этическими рамками, установленными Университетом Страны Басков M20/2022/212, правительством Страны Басков, правительством Испании и Европейским союзом.
1. Анализ морфологии митохондрий в SNCA-сверхэкспрессирующих клетках SH-SY5Y
ПРИМЕЧАНИЕ: Здесь приводится краткое описание генерации материала in vitro для исследования, которое будет служить сравнением для полученных результатов in situ . Рекомендуется проводить этот тип анализа перед запуском эксперимента по морфологии митохондрий in vivo , так как это обеспечит наличие всех соответствующих настроек визуализации и анализа.
- Для увеличения клеточного прикрепления и облегчения клеточной адгезии на плоских оптических 96-луночных планшетах добавьте 25 мкл/лунку матрицы покрытия 1:1000 в DMEM F12 путем пипетирования (см. таблицу материалов). Инкубируют планшеты в течение 1 ч при 37 °C и 5% CO2.
- Отсчитайте SH-SY5Y с помощью камеры Нойбауэра. Удалите матрицу покрытия с помощью пипетирования и засейте 10 000 клеток/лунку на покрытую 96-луночную пластину в 50 мкл/лунку DMEM F-12 с добавлением 10% FBS, 2 мМ глутамина и пенициллина/стрептомицина (см. таблицу материалов).
- Инкубируют клетки при 37 °C и 5% CO2в течение 24 ч.
- Приготовьте смесь из 250 нг pcDNA3.1, несущей человеческую SNCA дикого типа, 0,250 мкл реагента для трансфекции, 0,250 л адъюванта для трансфекции и среды для трансфекции до 50 мкл для каждой лунки (см. таблицу материалов). Приготовьте мастер-раствор с учетом общего количества лунок в эксперименте.
- Удалить питательную среду ручным пипетированием и добавить 50 мкл/лунку раствора, приготовленного на этапе 1.4, путем пипетирования. Инкубируют при 37 °C, 5%СО2.
- h после трансфекции удалить трансфекционную среду пипеткой и добавить 25 мкл/лунку 4% параформальдегида (PFA) в PBS.
ВНИМАНИЕ: Параформальдегид является токсичным фиксатором; использовать соответствующие СИЗ. - Выдерживать 5 мин при комнатной температуре. Удалите фиксирующий раствор пипеткой и промойте один раз, добавив 50 мкл/лунку PBS. Удалите PBS с помощью пипетки.
- Пипетка 25 мкл/лунка TBS с 0,05% твином (TBS-T) и 10% нормальной ослиной сыворотки (NDS, см. таблицу материалов). Инкубируйте в течение 1 часа при R.T., чтобы заблокировать любой неспецифический сигнал.
- Приготовьте раствор антитела Rabbit-anti-α-synuclein MJFR1 1:1000 вместе с антителом Mouse-anti-TOMM20 1:100 в TBS-T (см. Таблицу материалов) в соответствии с количеством лунок для анализа.
- Удаляют блокирующий раствор из стадии 1.8 пипетированием и добавляют 25 мкл/лунку смеси первичных антител, приготовленной на стадии 1.9. Инкубировать в течение ночи при температуре 4 °C.
- Удалите первичный раствор антител и промойте три раза, добавляя и удаляя 50 мкл/лунку TBS-T путем пипетирования.
- Приготовьте раствор зеленого вторичного антитела анти-Мышь 1:1000 вместе с красным вторичным антителом анти-Кролик 1:1000 в TBS-T (см. Таблицу материалов) в соответствии с количеством лунок для анализа.
- После аспирации PBS из последней промывки, описанной на этапе 1.11, добавьте 25 мкл/лунку смеси вторичных антител с помощью пипетки и инкубируйте планшет в течение 1 ч при R.T.
- Удалите раствор вторичных антител с помощью пипетирования и добавьте 25 мкл/лунку 2 г/мл DAPI в TBS-T. Инкубируйте планшет в течение 5 мин при R.T.
- Удалите раствор DAPI с помощью пипетки и промойте три раза, добавляя и удаляя 50 мкл/лунку TBS-T с помощью пипетки.
- Пипетку 80 мкл/лунку PBS с 0,02% азидом натрия и храните планшет при температуре 4 °C.
ВНИМАНИЕ: Азид натрия токсичен; использовать соответствующие СИЗ. - Получение изображений с помощью высокопроизводительного автоматизированного флуоресцентного микроскопа или эквивалентной системы конфокальной визуализации, оснащенной 60-кратным объективом (см. таблицу материалов).
- Выполните анализ сигнала TOMM20 одиночных ячеек с помощью Фиджи, выполнив шаги 3.15-3.21. Избегайте апоптоза, некроза или митоза клеток.
Примечание: Для этого мы исключаем из анализа клетки, демонстрирующие те морфологические особенности апоптоза, некроза или митоза, которые видны под микроскопом, такие как усадка клеток, блеббинг мембраны, отслоение клеток, ядерная конденсация, фрагментация ДНК и конденсированный ядерный хроматин, организованный в толстые нити, выровненные в одной плоскости.
2. Генерация ПФФ и внутричерепные инъекции ПФФ у мышей
ПРИМЕЧАНИЕ: Здесь представлена генерация инъекционного материала и процесс внутричерепной инъекции. Этот протокол адаптирован из Luk et al.25.
- Для получения PFF поместите пробирку/колбу, содержащую 0,5 мл α-Syn (5 мг/мл; Пептид, см. таблицу материалов) на шейкере при 37 °C и 250 об/мин в течение 7 дней, чтобы индуцировать агрегацию α-синуклеина.
- Агрегированный α-синуклеин подвергают ультразвуковой обработке с амплитудой 20% и режимом 0,25 цикла до тех пор, пока не будет достигнута оптимальная фрагментация, наблюдаемая при отрицательном окрашивании образцов с помощью просвечивающей электронной микроскопии.
- Для подготовки самцов и самок мышей дикого типа C57Bl/6 (в возрасте 3 месяцев) к инъекциям стриарной ПФФ вводят Мелоксикам/Метакам (5 мг/кг) в физиологическом растворе подкожно. Также вводят 1 мл стерильного физиологического раствора путем двух подкожных инъекций по 0,5 мл на животное. Эти процедуры предотвращают обезвоживание, воспаление и боль.
- Индуцируют анестезию 4% изофлураном и 0,7 л/минO2 в индукционной камере. Проверьте глубину анестезии по отсутствию отклика педали.
- Побрейте верхнюю часть головы мыши и аккуратно вставьте животное в каркас стереотаксического аппарата на тепловом коврике.
- Поддерживайте плоскость анестетика, обеспечивая ингаляционную анестезию животного (1%-2% изофлуран в 0,7 л/минO2) через маску для лица в течение всего процесса инъекции.
- Поместите животное на стереотаксическую рамку. Продезинфицируйте операционную зону тремя циклами чередующегося скраба с хлоргексидином и 70% этанолом. Применяют Маркаин/Бупивакаин локально (около 100 мкл) в виде подкожной инфильтрации 0,25%.
- Выполните разрез кожи диаметром 0,5 см, чтобы обнажить череп, и просверлите отверстие диаметром 1 мм в черепе, чтобы обнажить поверхность мозга, в следующих координатах от Bregma: - 0,5 мм переднезадняя, +/− 2,5 мм медиолатеральная.
- Ввести 1,5 л PFF, полученных на стадии 2.2, путем стереотаксической доставки по координатам, указанным на шаге 2.8 из Bregma и -2,7 мм дорсовентрально (из верхнего мозга) со скоростью потока 100 нл/мин с помощью шприца Hamilton 32G. Извлеките шприц через 5 минут после инъекции.
- Зашить (размер: 4-0, 45 см, см. Таблицу материалов) рану тремя-пятью швами по мере необходимости, и свяжите каждый из них 2 двойными узлами, а затем одинарным узлом. Прекратите ингаляцию анестетика и извлеките мышь из рамки.
- Оставьте мышь восстанавливаться в подходящей клетке, прежде чем возвращать ее в домашнюю клетку.
- В течение следующей недели проводите ежедневные послеоперационные осмотры. При любой боли, дистрессе или дискомфорте животного следует принимать Мелоксикам/Метакам, как указано в шаге 2.3, каждые 24 часа.
- Через три месяца введите 300 мкл пентобарбитала натрия в дозе 200 мг/мл в физиологическом растворе через внутрибрюшинную инъекцию. Как только болевой рефлекс потеряется, сделайте надрез (2-3 см) на грудной клетке и приподнимите ребра, чтобы обнажить сердце.
- Транскардиально перфузируют 10 мл PBS и 35 мл 4% параформальдегида в PBS один за другим со скоростью 5 мл/мин с помощью шприца объемом 50 мл, соединенного с иглой-бабочкой 23 G.
- Удалите мозг и введите 4% PFA в течение дополнительных 24 ч при 4 °C. Храните его в 70% этаноле при температуре 4 °C после обработки PFA.
- Поместите мозг в соответствующие пластиковые закладные коробки (см. таблицу материалов) и инкубируйте в 95% этаноле в течение 1 ч при R.T. Повторите этот шаг в свежем 95% этаноле и снова инкубируйте в течение 1 ч.
- Переложите мозги на 100% этанол в течение 1 ч при R.T. Повторите этот шаг в свежем 100% этаноле и снова инкубируйте в течение 1 ч.
- Пересадить мозги в ксилол или заменитель ксилола на 1 ч при р.Т. Повторить в свежем растворе и снова инкубировать в течение 1 ч.
- Извлеките ксилол или заменитель ксилола и инкубируйте образец в теплом парафине в течение 1 ч. Замените парафин и выдержите еще час.
- Установите мозг на закладные ящики с теплым парафином и дайте ему высохнуть в течение ночи. Подготовьте срезы размером 5 мкм с помощью микротома (см. Таблицу материалов) и закрепите их на предметных стеклах.
3. Анализ морфологии митохондрий методом иммуногистохимии на залитых парафином срезах мозга мышей, которым вводили PFF
- Удалите предметные стекла, окунув их в заменитель ксилола десять раз. Инкубируйте предметные стекла в течение 2 мин в заменителе ксилола. Снова десять раз окуните в заменитель ксилола.
ПРИМЕЧАНИЕ: Этот шаг необходим для удаления парафина и обеспечения регидратации образцов. - Регидратация: повторите процедуру, описанную в шаге 3.1, со следующими растворами: 100% EtOH, 95% EtOH, 70% EtOH и дважды с ddH2O по порядку.
- Выполните извлечение антигена и иммуноокрашивание, выполнив следующие действия.
- Начните с переноса образцов в контейнер для микроволновой печи с ddH2O.
- Разогреть 100-кратный цитратный буфер pH 6 (см. Таблицу материалов), хранить при 4 °C (моющие средства могли выпасть в осадок) и приготовить 350 мл свежего 1x цитратного буфера. Затем перелейте цитратный буфер в удобный пластиковый контейнер с крышкой.
- Поместите предметные стекла в контейнер с цитратным буфером (КРИТИЧНО: убедитесь, что слайды находятся ниже уровня буфера) и накройте крышкой.
ВНИМАНИЕ: Убедитесь, что крышка НЕ полностью закрыта, иначе контейнер может лопнуть в микроволновой печи. - Микроволновая печь на 700 Вт: 4 мин + 5 мин отдыха, 1,5 мин + 5 мин отдыха. Долейте цитратный буфер и снова разогрейте в микроволновой печи 1,5 мин + 5 мин отдыха, 1,5 мин + 5 мин отдыха, 1,5 мин + 5 мин отдыха.
- Образцы охлаждают в цитратном буфере на льду в течение 20 мин. Промыть образец ддН2О.
ПРИМЕЧАНИЕ: Извлечение антигена может варьироваться в зависимости от конкретных требований к антителам.
- Высушите предметные стекла бумажным полотенцем, не прикасаясь к салфетке. Нарисуйте прямоугольники ручкой (см. Таблицу материалов) вокруг кусочков ткани.
- Переложите все предметные стекла в коробку для иммунного окрашивания предметных стекол и пару раз аккуратно промойте TBS + 0,05 % TWEEN (TBS-T). Убедитесь, что капли TBS-T остаются внутри прямоугольников ручки.
- Удалите TBS-T из образцов, постукивая бумажным полотенцем. Добавляют 50 мкл блокирующего раствора (10% NDS в TBS-T) в каждый прямоугольник (не касаясь ткани) и инкубируют в течение 1 ч при RT.
ПРИМЕЧАНИЕ: Объемы могут варьироваться в зависимости от размера ткани; Постарайтесь убедиться в том, что: (1) область, написанная PAP, одинакова во всех образцах, и (2) область полностью покрыта выбранным буферным объемом. - Удалите блокирующий раствор с образцов, постукивая бумажным полотенцем. Осторожно пипетку 50 мкл/прямоугольник следующей смеси первичных антител в TBS-T: анти-тирозингидроксилаза 1:250 вместе с анти-VDAC1 1:100 и анти-pSer129 α-синуклеином EP1536Y 1:2000 (см. таблицу материалов).
- Инкубировать в течение ночи при температуре 4 °C.
- Вымойте пипеткой TBS-T на предметных стеклах и удалите его, постукивая бумажным полотенцем. Повторите три раза.
- Добавьте путем пипетирования 50 мкл/прямоугольник смеси вторичных антител: зеленый вторичный анти-Цыпленок, красный вторичный анти-Маус и дальний красный вторичный анти-Кролик 1:1000 в TBS-T (см. Таблицу материалов). Выдерживают при температуре 37 °C в течение 1 ч в темноте.
- Промойте три раза TBS-T, как описано в шаге 3.13.
- Инкубируют с DAPI 2 мкг/мл в TBS-T в течение 1 мин. Удалите раствор DAPI, постукивая бумажным полотенцем. Промойте три раза TBS-T, как описано в шаге 3.13.
- Установите стеклянный покровный стекло на образцы, используя 2 капли монтажного реагента на предметное стекло (см. таблицу материалов). Осторожно нажмите на покровное стекло, чтобы удалить пузырьки, и дайте образцам высохнуть в течение 1 ч при R.T. После этого храните при температуре 4 °C в темноте.
- Визуализируйте не менее 50 ячеек в различных областях с помощью системы флуоресцентной визуализации со структурированной подсветкой, оснащенной 60-кратным масляным объективом или конфокальной технологией.
- Выполните анализ сигнала VDAC1 одиночных ячеек с помощью Фиджи, как указано в следующих шагах.
- Сначала выделите и изолируйте область интереса (ROI), нарисовав контур вокруг положительной или отрицательной ячейки (в зависимости от ситуации) и используя функцию «Обрезка». Чтобы избежать систематической ошибки при выборе ROI, выбирайте его, учитывая сигнал флуоресценции маркера, не связанного с анализом (т.е. не митохондриального маркера).
- Необязательно: если изображение чрезмерно пикселизировано, используйте функцию «сглаживания» для получения более высокой четкости краев.
ПРИМЕЧАНИЕ: Если функция сглаживания применяется к изображению, пожалуйста, примените ее ко всем последующим изображениям. - Опционально: используйте функцию "Convolve" (режим ядра, в Process > Filters) для уменьшения фона.
ПРИМЕЧАНИЕ: Это не является обязательным и, как правило, не требуется при использовании секций длиной 5 м из-за более тонкого характера секций. - Активируйте дескрипторы формы и ограничьте пороговые значения в функции «Установить измерение» (убедитесь, что они активированы во время анализа).
- В меню «Регулировка» выберите функцию порога и отрегулируйте пороговый уровень. Пороговые значения должны быть сохранены для всех ячеек одной выборки.
- Постарайтесь обеспечить адекватную визуализацию митохондриальной сети, как показано на репрезентативных изображениях этой статьи, отбрасывая при этом фоновые пиксели.
- Используйте инструмент Анализ частиц на вкладке Анализ. Установите подходящий размер для захвата митохондрий. В этом примере size: 25-Infinity, activate: Pixel units и select: Show: Masks использовались команды для визуализации результата. Fiji рассчитает и отобразит счетчики, соотношение сторон (AR) и другие параметры фигуры на новой панели.
- При необходимости выполните статистический анализ данных. В этом эксперименте t-критерий был использован для анализа разницы в среднем соотношении сторон (AR) и количестве, рассчитанных Фиджи между экспериментальными группами после тестирования нормальности с помощью тестов нормальности Д'Агостино и Пирсона.
Representative Results
Для того, чтобы обеспечить наличие надлежащих условий визуализации и анализа для оценки морфологии митохондрий in situ в тканях, рекомендуется исследование морфологии митохондрий in vitro в ответ на известный модулятор морфологии митохондрий (раздел 1). Например, SNCA была генетически гиперэкспрессирована в клетках SH-SY5Y, чтобы индуцировать изменения в морфологии митохондрий, как было описано ранее26. Другими оскорблениями, которые могут быть использованы в качестве контроля для ухудшения морфологии митохондрий, могут быть голодание или использование ингибиторов митохондриальной активности, таких как MPP+. Клетки трансфицировали и окрашивали на α-синуклеин (AS) для разделения SNCA+ (AS+) и SNCA-(AS-) клеток. Они также были окрашены TOMM2027 для визуализации митохондриальной сети клеток. Чтобы сделать этот анализ максимально похожим на анализ среза ткани размером 5 мкм, была проанализирована одна конфокальная плоскость, а не максимальная проекция нескольких плоскостей. Морфологический анализ одной конфокальной плоскости TOMM20 показал, что как общее количество митохондрий, так и их соотношение сторон или AR (коррелирует с удлинением органеллы) снижались в ответ на гиперэкспрессию SNCA (рис. 1).
Иммуноокрашивание митохондриального белка VDAC1 проводилось на 5 мкм залитых парафином срезах мозга мышей животных, которым вводили PFF, как описано в разделе протокола выше. Дофаминергические нейроны черной субстанции pars compacta (SNc), которые подвергаются дегенерации при БП, были выявлены путем совместного иммуноокрашивания с антитирозингидроксилазой (ТГ) и регионально отделены от вентральной тегментальной области и черной субстанции pars lateralis. С другой стороны, окрашивание антифосфоSer129-α-синуклеином (pS129) позволило нам отличить клетки, которые содержали повреждения pS129, от здоровых клеток (pS129+ против pS129-). Были получены SNc-изображения трех разных животных, и последующий анализ изображений VDAC1-окрашивания TH-положительных нейронов выявил уменьшение как количества митохондрий, так и соотношения сторон между нейронами, несущими повреждения pS129, и нейронами, у которых их нет (рис. 2). Эти результаты указывают на то, что митохондриальная морфология нейронов, содержащих повреждения pS129, нарушена по сравнению с клетками, лишенными повреждений pS129.
Несмотря на то, что этот конкретный эксперимент показывает снижение АР, тем самым подчеркивая уменьшение удлинения митохондрий вместе с уменьшением глобального количества, что указывает на ухудшение морфологии митохондрий, интерпретация данных должна зависеть от эксперимента. Например, снижение количества АР может указывать на глобальное снижение содержания митохондрий, а также на фрагментацию, в то время как снижение АР, но увеличение глобального количества будет указывать на фенотип митохондриальной фрагментации. Поэтому важно интерпретировать данные в контексте обоих показателей.
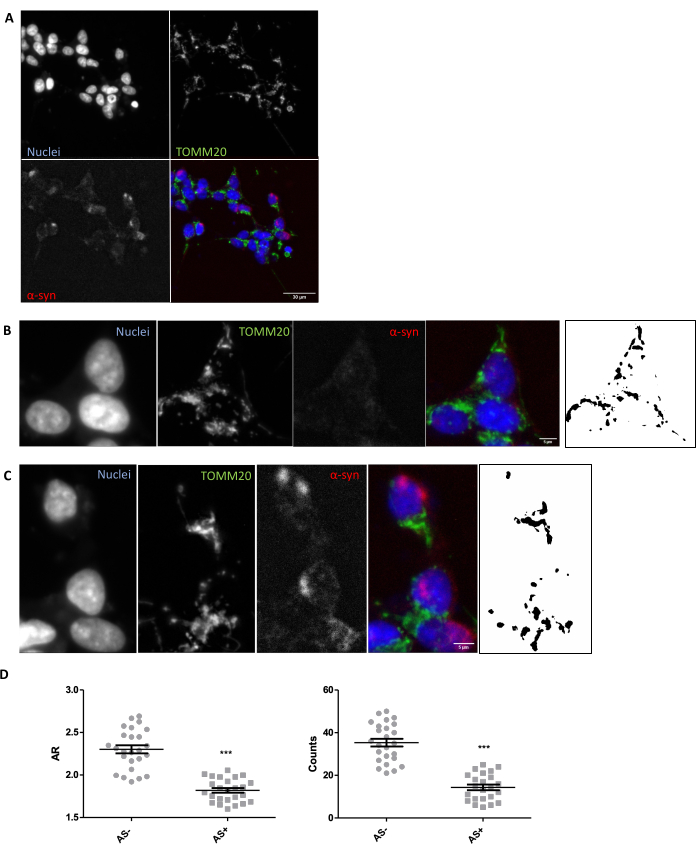
Рисунок 1: Морфология митохондрий в модели SNCA-сверхэкспрессии in vitro . Совместное иммуноокрашивание TOMM20 (зеленый), α-синуклеина (AS, красный) и DAPI (синий) на SNCA-гиперэкспрессирующих и не гиперэкспрессирующихся (AS+ и AS-, соответственно) клетках (A). Деталь ячейки AS- (B) и ячейки AS+ (C). Черно-белые изображения на панелях (B) и (C) представляют собой маски сигнала TOMM20 после применения функции Фиджи, описанной в разделе Протокол. Эта маска позволяет количественно оценить форму результирующих структур. Количество митохондрий и значения соотношения сторон (AR) клеток AS- и AS+ (N = 25 клеток на условие) были количественно оценены и представлены в виде индивидуальных значений, а также среднего ± SEM; **p-значение < 0,05 t-критерия (D). Нормальность оценивалась с помощью тестов нормальности Д'Агостино и Пирсона. Масштабные линейки: А, 30 мкм; B,C, 5 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
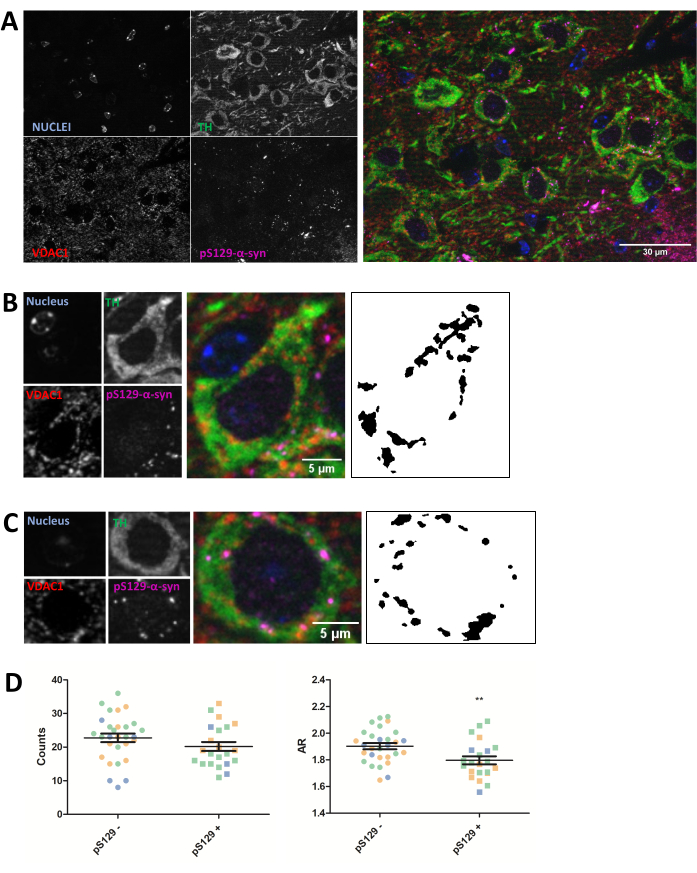
Рисунок 2: Морфология митохондрий нарушена в нейронах, содержащих повреждения pS129. Ко-иммуноокрашивание для TH (зеленый), VDAC1 (красный), phosphoS129-α-синуклеина (пурпурный) и DAPI (синий) SNc мышей, которым вводили PFF (A). Деталь фосфоS129-α-синуклеин-отрицательного (pS129-) дофаминергического нейрона (B) и фосфоS129-α-синуклеин-положительного (pS129+) дофаминергического нейрона (C). Черно-белые изображения на панелях (B) и (C) представляют собой маски сигнала TOMM20 после применения функции Фиджи, описанной в разделе Протокол. Эта маска позволяет количественно оценить форму результирующих структур. Отрицательные и положительные клетки были подсчитаны в образцах от трех разных животных, что проиллюстрировано различными цветами отдельных значений на графике (синий, зеленый и оранжевый). Митохондриальное количество и количественная оценка АР pS129- (N = 29) по сравнению с pS129+ (N = 22) в дофаминергических нейронах были представлены в виде средних значений ± SEM, а также отдельных клеточных значений; **p-значение < 0,05 t-критерия (D). Нормальность оценивалась с помощью тестов нормальности Д'Агостино и Пирсона. Масштабные линейки: А, 30 мкм; B,C, 5 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Discussion
В целом, это исследование показывает, что иммуноокрашивание в сочетании с анализом изображений является надежным методом анализа морфологии митохондрий. Фактически, он позволяет количественно определить количество митохондрий, а также некоторые морфологические параметры, такие как соотношение сторон как в клеточной культуре, так и в тканях. Количество митохондрий напрямую связано с функциональным состоянием механизмов деления и слияния образцов, в то время как величина AR зависит от удлинения органеллы. Этот метод может быть особенно ценным для быстрой оценки митохондриальных аномалий в моделях БП, в которых измененная морфология, динамика и функции митохондрий являются хорошо известными патологическими механизмами28,29. α-синуклеин также играет важную роль в развитии болезни Паркинсона: действительно, α-синуклеин является одним из компонентов телец Леви, цитоплазматических фибриллярных агрегатов, которые используются для посмертной диагностики пациентов с БП30. Кроме того, мутации в гене SNCA были обнаружены у пациентов как со знакомой, так и со спорадической болезнью Паркинсона (обзор в31). Было показано, что фосфорилирование α-синуклеина в Ser129 маркирует патологию, подобную тельцу Леви, которая возникает после инсульта PFF и вызывает различные токсические эффекты32,26.
С помощью представленного здесь инструмента нам удалось обнаружить снижение количества митохондрий и значений AR в присутствии как сверхэкспрессированных, так и агрегированных α-синуклеина (клеток с окрашиванием α-синуклеином и нейронов, несущих фосфоSer129α-синуклеин-положительные поражения, соответственно) по сравнению с клетками, лишенными таких повреждений (α-синуклеин- и фосфоS129α-синуклеин-отрицательных клеток). Эти результаты согласуются с предыдущими отчетами, показывающими, как прямые взаимодействия α-синуклеина-митохондрий оказывают токсическое воздействие на функцию митохондрий и гомеостаз при БД26,33 34. Действительно, сообщалось, что у мышей с мутациями α-синуклеина наблюдается повышенное повреждение митохондриальной ДНК35 и митофагия36,37. Кроме того, было описано, что повышенные уровни α-синуклеина способствуют делению/фрагментации митохондрий, индуцируют активные формы кислорода в митохондриях и нарушают регуляцию экспрессии митохондриальных белков в клеточных линиях и мышиных моделях с гиперэкспрессией α-синуклеина 26,38,39.
Важно подчеркнуть, что этот инструмент сильно зависит от антител, используемых для исследования; Тщательная морфологическая оценка используемого окрашивания антител является обязательным условием для обнаружения соответствующего субклеточного компартмента. Поскольку этот метод основан на срезах размером 5 мкм и, следовательно, требует одиночных фокальных плоскостей для анализа митохондриальных структур, отсутствие фенотипа не исключает существования фенотипа, так как возможно, что тонкие различия в морфологии митохондрий не могут быть обнаружены этим методом.
Несмотря на то, что в этой и других работах ранее использовались аналогичные подходы для оценки морфологии митохондрий in vivo40, существует необходимость в том, чтобы подробный протокол был доступен для исследовательского сообщества для этой оценки. Значимость данного исследования заключается в том, что этот метод можно применить к различным моделям заболеваний in vivo для оценки митохондриальных морфологических аномалий и выявления потенциальной патологии, что в конечном итоге может облегчить скрининг соединений свинца для лечения таких нарушений. Хотя этот анализ в настоящее время ограничен тканями, залитыми парафином, преимущество метода заключается в том, что он может быть применен к любой модели заболевания после забора терминальной ткани, что делает его очень универсальным инструментом.
Disclosures
Мы не хотим сообщать об отсутствии конфликта интересов.
Acknowledgements
Мы хотели бы выразить признательность спонсорам этого исследования, в частности, Икербаску, Министерству науки и инноваций Испании, Фонду Майкла Джей Фокса, IBRO и Баскскому центру неврологии Ачукарро.
Materials
| Name | Company | Catalog Number | Comments |
| 32 G Hamilton syringe | Hamilton | 7632-01 | |
| 4',6-diamidino-2-fenilindol, dihidrocloruro (DAPI) | Invitrogen | D1306 | |
| 4/0 USP 45 cm suture | SSa90 pga | 32345n-36u | |
| Alexa fluor 488/594-Donkey anti-Mouse | Invitrogen | A21202; A21203 | green/red dye-Donkey anti-Mouse |
| Alexa fluor 594/647-Donkey anti-Rabbit | Invitrogen | A21207 A31573 | red/far red dye-Donkey anti-Rabbit |
| AlexaFluor 488-Donkey anti-Chicken | Jackson ImmunoResearch | 703-545-155 | green dye-Donkey anti-Chicken |
| Anti-PSer129 α-synuclein EP1536Y (Rabbit) antibody | Abcam | ab51253 | |
| Anti-TOM 20 (Mouse) antibody | Santa Cruz | sc-17764 | |
| Anti-Tyrosine Hydroxylase (Chicken) antibody | Abcam | ab76442 | |
| Anti-VDAC1 (Mouse) antibody | Santa Cruz | sc-390996 | |
| Anti-α-synuclein antibody MJFR1 (Rabbit) | Abcam | ab138501 | |
| Citrate buffer 100X stock: 120mM citrate buffer, 5% Tween in water (pH 6) | Home-made | ||
| Disposable base mold for tissue embedding | Fisher | 22-363-553 | Plastic embedding boxes |
| D-MEM F12 | Gibco | A321331020 | |
| EVOS M7000 Imaging System | ThermoFisher Scientific | High-content automated fluorescence microscope | |
| Fetal Bovine Serum | Gibco | 10270106 | |
| Flat optical bottom 96 well plates | Greiner | 675090 | |
| FluorSave Reagent | Millipore | 345789-20ML | Mounting reagent |
| Glutamine 200 mM | Gibco | 25030-024 | |
| ImmEdge Hydrophobic Barrier Pen | Vector Laboratories | H-4000 | PAP-pen |
| Lipofectamine and Plus Reagent | Invitrogen | 11668-019; 11514-015 | Transfection reagent and transfection adjuvant |
| Matrigel | Corning | 354230 | Coating matrix |
| Microtome | ThermoFisher Scientific | ||
| Normal Donkey Serum | Gibco | PCN5000 | |
| Opti-MEM | Gibco | 31985070 | Transfection medium |
| PCDNA4 plasmid (backbone) | Addgene | 41036 | |
| Penicillin/Streptomycin solution | Gibco | 15140-122 | |
| SH-SY5Y cells/well | ATCC | HTB-11 | |
| Xylene substitute | Labbox | 22L36504 | |
| Zeiss Axio Imager Apotome 2 | Carl Zeiss | Structured illumination fluorescence imaging system | |
| α-synuclein peptide | rpeptide | S-1010-2 |
References
- Yang, Y., Lu, B. Mitochondrial morphogenesis, distribution, and parkinson disease. Journal of Neuropathology and Experimental Neurology. 68 (9), 953-963 (2009).
- Schapira, A. H. Mitochondria in the aetiology and pathogenesis of Parkinson's disease. The Lancet Neurology. 7 (1), 97-109 (2008).
- Swerdlow, R. H. Mitochondria and mitochondrial cascades in alzheimer's disease. Journal of Alzheimer's Disease. 62 (3), 1403-1416 (2018).
- Hedrich, K., et al. type, and origin of Parkin mutations: Review and case studies. Movement Disorders. 19 (10), 1146-1157 (2004).
- Kahle, P. J., Haass, C. How does parkin ligate ubiquitin to Parkinson's disease. EMBO reports. 5 (7), 681-685 (2004).
- Dawson, T. M., Dawson, V. L. The role of parkin in familial and sporadic Parkinson's disease. Movement Disorders. 25, S32-S39 (2010).
- Pickrell, A. M., Youle, R. J. The Roles of PINK1, Parkin, and Mitochondrial Fidelity in Parkinson's Disease. Neuron. 85 (2), 257-273 (2015).
- Zhi, L., et al. Loss of PINK1 causes age-dependent decrease of dopamine release and mitochondrial dysfunction. Neurobiology of Aging. 75, 1-10 (2019).
- Bonifati, V., et al. DJ-1(PARK7), a novel gene for autosomal recessive, early onset parkinsonism. Neurological Sciences. 24 (3), 159-160 (2003).
- Chia, S. J., Tan, E. -. K., Chao, Y. -. X. Historical Perspective: Models of Parkinson's Disease. International Journal of Molecular Sciences. 21 (7), 2464 (2020).
- Wilson, D. M., Cookson, M. R., Den Bosch, L. V. a. n., Zetterberg, H., Holtzman, D. M., Dewachter, I. Hallmarks of neurodegenerative diseases. Cell. 186 (4), 693-714 (2023).
- Moore, D. J., West, A. B., Dawson, V. L., Dawson, T. M. Molecular pathophysiology of Parkinson's disease. Annual Review of Neuroscience. 28 (1), 57-87 (2005).
- Olanow, C. W., Tatton, W. G. Etiology and pathogenesis of Parkinson's disease. Annual Review of Neuroscience. 22 (1), 123-144 (1999).
- Nunnari, J., Suomalainen, A. Mitochondria: In sickness and in health. Cell. 148 (6), 1145-1159 (2012).
- Okamoto, K., Shaw, J. M. Mitochondrial Morphology and Dynamics in Yeast and Multicellular Eukaryotes. Annual Review of Genetics. 39 (1), 503-536 (2005).
- Malpartida, A. B., Williamson, M., Narendra, D. P., Wade-Martins, R., Ryan, B. J. Mitochondrial Dysfunction and Mitophagy in Parkinson's Disease: From Mechanism to Therapy. Trends in Biochemical Sciences. 46 (4), 329-343 (2021).
- Zou, W., et al. Nanoscopic quantification of sub-mitochondrial morphology, mitophagy and mitochondrial dynamics in living cells derived from patients with mitochondrial diseases. Journal of Nanobiotechnology. 19 (1), 136 (2021).
- Navaratnarajah, T., Anand, R., Reichert, A. S., Distelmaier, F. The relevance of mitochondrial morphology for human disease. The International Journal of Biochemistry & Cell Biology. 134, 105951 (2021).
- Zambon, F., et al. Cellular α-synuclein pathology is associated with bioenergetic dysfunction in Parkinson's iPSC-derived dopamine neurons. Human Molecular Genetics. 28 (12), 2001-2013 (2019).
- Cherubini, M., Lopez-Molina, L., Gines, S. Mitochondrial fission in Huntington's disease mouse striatum disrupts ER-mitochondria contacts leading to disturbances in Ca2+ efflux and Reactive Oxygen Species (ROS) homeostasis. Neurobiology of Disease. 136, 104741 (2020).
- Parihar, M. S., Parihar, A., Fujita, M., Hashimoto, M., Ghafourifar, P. Alpha-synuclein overexpression and aggregation exacerbates impairment of mitochondrial functions by augmenting oxidative stress in human neuroblastoma cells. The International Journal of Biochemistry & Cell Biology. 41 (10), 2015-2024 (2009).
- Wiemerslage, L., Lee, D. Quantification of mitochondrial morphology in neurites of dopaminergic neurons using multiple parameters. Journal of Neuroscience Methods. 262, 56-65 (2016).
- Liu, Y. -. T., et al. Mt-Keima detects PINK1-PRKN mitophagy in vivo with greater sensitivity than mito-QC. Autophagy. 17 (11), 3753-3762 (2021).
- Shoshan-Barmatz, V., Shteinfer-Kuzmine, A., Verma, A. VDAC1 at the intersection of cell metabolism, apoptosis, and diseases. Biomolecules. 10 (11), 1485 (2020).
- Luk, K. C., et al. Pathological α-Synuclein transmission initiates parkinson-like neurodegeneration in nontransgenic mice. Science. 338 (6109), 949-953 (2012).
- Ryan, B. J., et al. REST protects dopaminergic neurons from mitochondrial and α-synuclein oligomer pathology in an alpha synuclein overexpressing BAC-transgenic mouse model. The Journal of Neuroscience. 41 (16), 3731-3746 (2021).
- Yamamoto, H., et al. Dual role of the receptor Tom20 in specificity and efficiency of protein import into mitochondria. Proceedings of the National Academy of Sciences. 108 (1), 91-96 (2011).
- Exner, N., Lutz, A. K., Haass, C., Winklhofer, K. F. Mitochondrial dysfunction in Parkinson's disease: molecular mechanisms and pathophysiological consequences. The EMBO Journal. 31 (14), 3038-3062 (2012).
- Grünewald, A., Kumar, K. R., Sue, C. M. New insights into the complex role of mitochondria in Parkinson's disease. Progress in Neurobiology. 177, 73-93 (2019).
- Baba, M., et al. Aggregation of alpha-synuclein in Lewy bodies of sporadic Parkinson's disease and dementia with Lewy bodies. The American journal of pathology. 152 (4), 879-884 (1998).
- Vázquez-Vélez, G. E., Zoghbi, H. Y. Parkinson's disease genetics and pathophysiology. Annual Review of Neuroscience. 44 (1), 87-108 (2021).
- Mahul-Mellier, A. -. L., et al. The process of Lewy body formation, rather than simply α-synuclein fibrillization, is one of the major drivers of neurodegeneration. Proceedings of the National Academy of Sciences. 117 (9), 4971-4982 (2020).
- Ganguly, U., et al. Interaction of α-synuclein and Parkin in iron toxicity on SH-SY5Y cells: implications in the pathogenesis of Parkinson's disease. Biochemical Journal. 477 (6), 1109-1122 (2020).
- Ganjam, G. K., et al. Mitochondrial damage by α-synuclein causes cell death in human dopaminergic neurons. Cell Death & Disease. 10 (11), 865 (2019).
- Martin, L. J., et al. Parkinson's Disease α-synuclein transgenic mice develop neuronal mitochondrial degeneration and cell death. The Journal of Neuroscience. 26 (1), 41-50 (2006).
- Choubey, V., et al. Mutant A53T α-Synuclein induces neuronal death by increasing mitochondrial autophagy. Journal of Biological Chemistry. 286 (12), 10814-10824 (2011).
- Chen, L., Xie, Z., Turkson, S., Zhuang, X. A53T Human α-synuclein overexpression in transgenic mice induces pervasive mitochondria macroautophagy defects preceding dopamine neuron degeneration. The Journal of Neuroscience. 35 (3), 890-905 (2015).
- Kamp, F., et al. Inhibition of mitochondrial fusion by α-synuclein is rescued by PINK1, Parkin and DJ-1. The EMBO Journal. 29 (20), 3571-3589 (2010).
- Nakamura, K., et al. Direct membrane association drives mitochondrial fission by the parkinson disease-associated protein α-synuclein. Journal of Biological Chemistry. 286 (23), 20710-20726 (2011).
- Park, J., et al. Abnormal mitochondria in a non-human primate model of MPTP-induced Parkinson's disease: Drp1 and CDK5/p25 signaling. Experimental Neurobiology. 28 (3), 414-424 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved