Análise de fluxo dual-reporter baseada em esferas fluorescentes magnéticas do bloqueio de anticorpos induzido pela vacina do peptídeo PDL1-Vaxx da interação PD-1/PD-L1
In This Article
Summary
Os inibidores de checkpoint são alvos importantes no desenvolvimento de terapias para a batalha contra o câncer. Este relatório apresenta uma nova vacina contra o câncer baseada em peptídeo PDL1, PDL1-Vaxx, que induz a produção de anticorpos policlonais neutralizantes que bloqueia a formação do complexo PD-1/PDL1. Este trabalho também detalha o desenvolvimento e teste de um ensaio baseado em esferas fluorescentes para análise desta atividade.
Abstract
A inibição dos receptores de checkpoint (PD-1, PD-L1 e CTLA-4) com anticorpos monoclonais tem mostrado grande benefício em ensaios clínicos para o tratamento de pacientes com câncer e tornou-se uma abordagem fundamental na imunoterapia moderna contra o câncer. No entanto, apenas um subgrupo de pacientes responde à imunoterapia com anticorpos monoclonais de checkpoint. Portanto, é urgente o desenvolvimento de novas estratégias terapêuticas contra o câncer. Uma nova vacina contra o câncer PDL1 (ligante de morte programada 1) do epítopo de células B foi desenvolvida, com aminoácidos 130-147 ligados ao peptídeo MVF (proteína de fusão do vírus do sarampo de células T "promíscua") através de um ligante GPSL. Testes pré-clínicos indicaram que esta vacina PDL1 (PDL1-Vaxx) estimula efetivamente anticorpos altamente imunogênicos em animais. Animais imunizados com PDL1-Vaxx apresentam carga tumoral reduzida e taxas de sobrevida prolongadas em vários modelos de câncer animal. Os mecanismos de ação indicam que os anticorpos induzidos pela vacina inibem a proliferação de células tumorais, induzem apoptose e bloqueiam a interação PD-1/PD-L1. Este manuscrito apresenta um ensaio baseado em esferas magnéticas que usa um sistema de análise de fluxo dual-reporter para avaliar a interação PD-1/PD-L1 e seu bloqueio pelos anticorpos anti-PDL1 levantados contra o PDL1-Vaxx.
Introduction
Nas células T, células B e checkpoints intracelulares do sistema imunológico, as vias de sinalização regulam as atividades imunológicas. Algumas células cancerosas se protegem do ataque imunológico estimulando alvos de checkpoint, que inibem a função imune e promovem a sobrevivência e proliferação neoplásica. A imunoterapia oncológica por inibição de checkpoints utiliza anticorpos para atingir e bloquear os pontos de verificação de sinalização e, assim, restaurar as funções antineoplásicas do sistema imune 1,2,3. Terapias antineoplásicas altamente eficazes atualmente incluem os anticorpos monoclonais nivolumab, que tem como alvo a proteína de morte programada 1 (PD-1)4, e atezolizumabe, que tem como alvo o ligante de morte programada 1 (PD-L1)5. Essa abordagem tem mostrado grande sucesso clínico no tratamento de pacientes oncológicos. No entanto, a utilidade clínica das atuais estratégias de inibição de checkpoints é atenuada por eventos adversos e resistência ao tratamento, especialmente na terapia com agente único6. Uma combinação de imunoterapia e estratégias terapêuticas mais efetivas com menor toxicidade é urgentemente necessária no tratamento do câncer 1,3,6.
Nos últimos 30 anos, o laboratório do Dr. Kaumaya desenvolveu vacinas peptídicas contra o câncer e agentes relacionados à mimética de peptídeos para a terapia do câncer, alguns dos quais estão em ensaios clínicos em andamento 1,2,7,8,9,10,11,12,13,14 . Por exemplo, a imunoterapia combinada B-Vaxx com HER-2 demonstrou benefícios para os pacientes contra tumores sólidos metastáticos e/ou recorrentes em ensaios clínicos12. As vacinas contra o câncer mais recentes do laboratório são PD1-Vaxx 2,13 e PDL1-Vaxx14, que têm mostrado grandes vantagens em estudos pré-clínicos, especialmente no tratamento combinado. O PD1-Vaxx concluiu ensaios clínicos de escalonamento de dose nos EUA e na Austrália. O PD1-Vaxx será combinado com atezolizumabe no ensaio de Fase 1b a ser iniciado em maio de 2023. Este relatório concentra-se em avaliar a capacidade dos anticorpos induzidos por PDL1-Vaxx de bloquear a interação PD-1/PD-L1.
A vacina contra o câncer PDL1-Vaxx é uma nova vacina de epítopo de peptídeo de células B com aminoácidos PD-L1 130-147 ligados ao peptídeo promíscuo de fusão do vírus do sarampo de células T (MVF) através de um ligante de peptídeo GPSL. Estudos pré-clínicos demonstraram que o PDL1-Vaxx é altamente imunogênico ao estimular a produção de anticorpos anticâncer em vários modelos animais, prolonga a sobrevida e reduz a carga tumoral14. Esses anticorpos gerados contra o peptídeo PD-L1 podem bloquear com sucesso a interação PD1/PD-L1, resultando em atividade antineoplásica. Este relato apresenta um ensaio que analisa o bloqueio da formação do complexo PD1/PD-L1 por anticorpos induzidos por PDL1-Vaxx usando um formato baseado em esferas magnéticas com uma leitura de dois repórteres em um instrumento de citometria de fluxo.
Protocol
1. Preparação experimental
NOTA: Os detalhes de todos os reagentes/equipamentos mencionados nesta etapa estão listados na Tabela de Materiais.
- Obter PD-1 humano recombinante (rhPD-1; poli-histidina marcada). Reconstituir rhPD1 liofilizado com solução salina tamponada com fosfato filtrado estéril (PBS), pH 7,4, antes do uso.
- Obter PD-L1 humano recombinante biotinilado (rhPD-L1). Reconstituir rhPD-L1 liofilizado com água deionizada estéril antes do uso.
- Obter reagente de detecção R-ficoeritrina conjugado com estreptavidina (SAPE). Armazene todas as soluções SAPE protegidas da luz em temperaturas de geladeira (ou seja, 2-8 °C).
- Obter microesferas magnéticas tingidas fluorescentemente (6,5 μm de diâmetro, poliestireno com magnetita incorporada) e o Bead Coupling Kit15 (se usado, consulte a Tabela de Materiais). O acoplamento covalente às microesferas requer sulfo-NHS (sulfo-N-hidrosuccinimida) e EDC (cloridrato de N-[3-dimetilaminopropil]-N′-etilcarbodiimida).
NOTA: Os conjuntos de contas magnéticas estão disponíveis com qualquer uma das 500 etiquetas fluorescentes exclusivas, o que permite a identificação e diferenciação de diferentes conjuntos de contas16. As contas são oferecidas em concentrações de estoque de 2,5 × 106 contas/mL e 12,5 × 106 contas/mL. Armazene as contas protegidas da luz em temperaturas de geladeira (ou seja, 2-8 °C). Não congele as suspensões de contas. - Obter anticorpos de controle positivo e negativo e anticorpos de detecção secundária marcados com Brilliant Violet 421 (BV421). Armazene todas as moléculas fluorescentes-conjugadas protegidas da luz.
- Realizar todas as reações de acoplamento em tubos de baixa ligação de proteínas e todas as reações de ensaio em placas de microtitulação de 96 poços de baixa ligação proteica, fundo redondo. Sele as placas com folha adesiva descartável ou tampas plásticas de microplacas de 96 poços para as etapas de incubação do ensaio. Use um separador magnético de placas para imobilizar as esferas durante as etapas de lavagem do ensaio.
NOTA: O sistema de análise de fluxo dual-reporter possui três lasers: (1) um que identifica e quantifica a fluorescência específica do conjunto de esferas (Canal de Classificação); (2) um que detecta e quantifica a fluorescência da ficoeritrina (PE) alvo-específica (Canal Repórter 1; excitação de 532 nm, emissão "laranja" de 565-585 nm); e (3) um que detecta e quantifica a fluorescência BV421 alvo-específica de um segundo analito alvo (Reporter Channel 2; excitação de 405 nm, emissão "azul" de 421-441 nm).
2. Acoplamento rhPD-1 a esferas magnéticas
NOTA: A proteína a ser acoplada deve estar isenta de albumina de soro bovino (BSA), azida sódica, glicina, glicerol, tris(hidroximetil)aminometano (Tris) ou aditivos contendo amina e deve ser suspensa em PBS em pH 7,4. Está disponível um kit de acoplamento comercial que inclui todos os reagentes e buffers necessários descritos aqui (consulte a Tabela de Materiais).
- Retire todos os reagentes de acoplamento do refrigerador e deixe-os se equilibrar à temperatura ambiente (TR, 18-22 °C) por 20-30 min.
- Ressuspenda as microesferas de estoque por vórtice breve, sonicação ou rotação (15 min a 15-30 rpm), de acordo com a folha de informações do produto.
- Transfira 1 × 106 esferas magnéticas para um tubo de microcentrífuga de ligação de 1,5 ml com baixo teor de proteínas (ver Tabela de Materiais).
- Lavar contas com 100 μL de tampão de ativação15: 0,1 M NaH2PO4 (monobásico), pH 6,2.
NOTA: O acoplamento também pode ser realizado usando um Kit de Acoplamento pré-configurado, que inclui ácido 2-morfolinoetanossulfônico (MES) 0,1 M, pH 6,0, como um buffer alternativo de ativação e acoplamento (consulte a Tabela de Materiais).- Coloque o tubo contendo as contas em um separador magnético por 1-2 min.
NOTA: Alternativamente, as esferas podem ser separadas por microcentrifugação a ≥8.000 × g por 1-2 min. - Aspirar o sobrenadante com uma pipeta das esferas imobilizadas ou peletizadas com ímã com o tubo ainda posicionado no separador magnético.
- Remova o tubo de microcentrífuga do ímã e adicione 80 μL de tampão de acoplamento (consulte a Tabela de materiais).
- Vórtice o tubo de reação suavemente e sonicate por 20 s para dispersar as contas.
- Coloque o tubo contendo as contas em um separador magnético por 1-2 min.
- Ativar as contas com sulfo-NHS e EDC.
NOTA: A solução-estoque de sulfo-NHS é de 50 mg/mL dissolvida em tampão de ativação. A solução-estoque de EDC também é 50 mg/mL dissolvida em tampão de ativação. Tanto o tampão de ativação quanto a umidade na atmosfera causam degradação do EDC. Não é aconselhável usar solução EDC armazenada. Faça apenas o suficiente de solução EDC fresca antes da etapa e use-a imediatamente quando a solução estiver pronta. Descarte o excesso de solução de EDC.
CUIDADO: O EDC causa irritação ocular grave e é irritante do trato respiratório e da pele.- Adicionar 10 μL de sulfo-NHS ao tubo de microfuga contendo as esferas lavadas e ativadas.
- Adicionar 10 μL de solução-mãe de EDC ao tubo de microfuga contendo as esferas e o sulfo-NHS.
- Proteger as microesferas fotossensíveis da luz e girar sobre o rotador por 20 min a 15-30 rpm, a TR (18-22 °C). Alternativamente, o tubo pode permanecer estacionário durante a etapa de ativação se for suavemente vórtice para redistribuir as contas em intervalos de 10 minutos.
- Lave o excesso de reagentes de acoplamento das contas.
- Coloque o tubo contendo as esferas ativadas em um separador magnético por 1-2 min.
- Aspirar o sobrenadante com uma pipeta de esferas imobilizadas ou peletizadas com ímã com o tubo ainda posicionado no separador magnético.
- Remova o tubo da microcentrífuga do ímã e adicione 100 μL de tampão de ativação.
- Vórtice o tubo de reação suavemente para dispersar as contas.
- Repita as etapas 2.6.1-2.6.4 duas vezes adicionais para um total de três lavagens. Ao final da lavagem, as esferas serão suspensas em 100 μL de tampão de ativação a uma concentração aproximada de 10 × 106 contas/mL.
- Junte o peptídeo rhPD-1 às esferas ativadas.
- Adicionar 390 μL de tampão de ativação ao tubo que contém as esferas ativadas para elevar o volume total da suspensão do cordão até 490 μL.
- Adicionar 1 μg de peptídeo PD-1 à suspensão de esferas ativadas adicionando 10 μL de solução peptídica PD-1 (1 mg/mL dissolvido em PBS) ao tubo contendo as esferas ativadas.
- Vórtice brevemente o tubo de microcentrífuga para distribuir uniformemente o PD-1 e as esferas ativadas.
- Incubar as esferas com PD-1 por 2 h no escuro em TR (18-22 °C) com rotação (15-30 rpm).
- Lavar as contas duas vezes (2x) usando Assay/Wash Buffer (PBS-TBN: 1x PBS, pH 7,4 + 0,1% BSA + 0,05% Tween-20 + 0,05% NaN315).
- Coloque o tubo contendo as esferas ativadas em um separador magnético por 1-2 min.
- Aspirar o sobrenadante com uma pipeta das esferas imobilizadas ou peletizadas com ímã com o tubo ainda posicionado no separador magnético.
- Remova o tubo da microcentrífuga do ímã e adicione 100 μL de tampão de ativação.
- Vórtice o tubo de reação suavemente para dispersar as contas.
- Repita as etapas 2.8.1-2.8.4 uma vez adicional para um total de duas lavagens. Ao final da lavagem, as esferas serão suspensas em 100 μL de tampão de ativação na concentração de 10 × 106 contas/mL.
NOTA: O tampão de ensaio/lavagem pode ser feito sem azida de sódio (conservante) se o tampão não for também usado como meio de armazenamento. - Conservar as esferas acopladas a rhPD-1 no escuro no frigorífico a 2-8 °C se não for utilizado imediatamente. As esferas acopladas à proteína são estáveis por até 18 meses.
3. Avaliação do sucesso do acoplamento rhPD-1 às esferas
NOTA: As microesferas acopladas a rhPD-1 reagem com rhPD-L1 biotinilado, sendo este último detectado por incubação com SAPE seguido de uma avaliação no citômetro de fluxo. Isso verifica tanto o acoplamento bem sucedido do PD-1 às esferas magnéticas quanto a interação funcional entre as proteínas rhPD-1 e rhPD-L1.
- Crie uma série de diluição em série de duas vezes de rhPD-L1 biotinilado em PBS-TBN (a solução de rhPD-L1 estoque é de 1 mg/mL). A faixa de concentração final de rhPD-L1 a ser testada é uma solução de 8 μg/mL até uma solução de 313 pg/mL. Crie volumes de 150 μL de cada diluição rhPD-L1: 50 μL para cada reação e duas reações por condição, além de excesso suficiente para acomodar perdas de pipetagem.
- Rotular os tubos de microfuge de diluição rhPD-L1 como 8 μg/mL, 4 μg/mL, 2 μg/mL, 1 μg/mL, 0,5 μg/mL, 0,25 μg/mL, 0,125 μg/mL, 0,063 μg/mL e 0,031 μg/mL. Um tubo de 0 μg/mL (somente PBS-TBN) serve como controle sem PD-L1.
- Pré-carregar 150 μL de PBS-TBN para todos os tubos de diluição marcados com rhPD-L1.
NOTA: A maior concentração final de rhPD-L1 a ser testada é de 8 μg/mL, e a rhPD-L1 será diluída 1:1 após a adição à mistura de reação, de modo que o tubo de diluição rotulado "8 μg/mL" refere-se à concentração final e realmente contém 16 μg/mL de rhPD-L1. Os rótulos de todos os tubos de diluição indicam a concentração final de rhPD-L1 após a adição à reação. - Crie a diluição rhPD-L1 de maior concentração (16 μg/mL real). Trata-se de uma diluição em duas etapas e 62,5 vezes da solução-estoque de 1 mg/mL de rhPD-L1 (1.000 μg/16 μg = 62,5).
- Combinar 84 μL de PBS-TBN com 16 μL de solução-estoque de rhPD-L1 (1 mg/mL, ou seja, 1.000 μL) em um tubo de microcentrífuga. Trata-se de uma diluição de 6,25 vezes, e a concentração resultante é de 160 μg/mL rhPD-L1.
- No tubo marcado com "8 μg/mL", combinar 270 μL de PBS-TBN com 30 μL da diluição rhPD-L1 criada na etapa anterior (160 μg/mL). Esta é uma diluição de 10 vezes, e a concentração resultante é na verdade 16 μg/mL. O rótulo do tubo "8 μg/mL" refere-se à sua concentração final após a adição à reação.
- Transferir 150 μL da diluição rhPD-L1 criada na etapa 3.1.3 ("8 μg/mL") para o tubo de "4 μg/mL", fechar a tampa do tubo da microcentrífuga e agitar brevemente o vórtice para misturar a solução.
- Repetir o passo 3.1.4 sequencialmente até completar a série de diluição rhPD-L1. Após a criação, todos os tubos entre "8 μg/mL" a "0,063 μg/mL", assim como o controle 0 μg/mL, devem conter 150 μL de solução, e o último tubo, "0,031 μg/mL", deve conter 300 μL de solução. Isso cria um volume suficiente de cada diluição para testar 50 μL de cada diluição rhPD-L1 biotinilada em reações duplicadas, com excesso suficiente restante para acomodar as perdas de pipetagem.
- Contagem das esferas acopladas a rhPD-1 utilizando hemocitômetro17.
- Diluir as esferas de estoque acopladas a rhPD-1 para 5 × 104 contas/mL, com volume suficiente para 2.500 contas/50 μL/reação.
- Vórtice a suspensão de 5 ×10 4 contas/mL de grânulos acoplados a rhPD-1 e pipetar 50 μL da suspensão em cada poço marcado/mapeado de uma placa de microtitulação de fundo redondo de 96 poços para que haja poços duplicados criados para cada diluição rhPD-L1 que está sendo testada.
- Adicionar 50 μL de cada tubo de diluição rhPD-L1 biotinilado criado na etapa 3.1 aos orifícios apropriados na placa de microtitulação.
- Cubra a placa de microtitulação com uma folha descartável ou seladora de placa adesiva plástica e incube a placa por 1 h no escuro em TR (18-22 °C) em um agitador orbital (600 rpm).
- Lave o excesso de rhPD-L1 biotinilado das contas.
- Transfira a placa selada do agitador orbital para o separador magnético de placas por 2 min para imobilizar as contas.
- Remova cuidadosamente o selador da placa adesiva, confirme se o ímã e a placa de microtitulação estão firmemente juntos, inverta a placa e despeje os sobrenadantes em uma pia ou recipiente de resíduos líquidos de risco biológico, conforme apropriado. Bata suavemente, mas rapidamente, a placa invertida em uma almofada de tecido de papel absorvente para remover o sobrenadante restante.
- Remova a placa de microtitulação do separador magnético da placa e pipete 150 μL de PBS-TBN em cada poço.
- Coloque a placa não selada no separador magnético por 2 min para imobilizar as contas.
- Confirme se o ímã e a placa de microtitulação estão firmemente juntos, inverta a placa e despeje os sobrenadantes em um recipiente de dissipação ou recipiente de resíduos líquidos de risco biológico, conforme apropriado. Bata suavemente, mas rapidamente, a placa invertida em uma almofada de tecido de papel absorvente para remover o sobrenadante restante.
- Repetir as etapas de lavagem da placa 3.7.3-3.7.5 duas vezes para um total de três lavagens com 150 μL de PBS-TBN cada. Certifique-se de que nenhum sobrenadante permaneça nos poços no final da última etapa de lavagem. Trabalhe firmemente para evitar a secagem das contas imobilizadas no fundo do poço.
- Adicione o SAPE Detection Reagent.
- Diluir a solução-mãe SAPE em PBS-TBN até uma concentração de trabalho de 6 μg/ml. Preparar um volume suficiente de solução de trabalho SAPE para que todos os poços de reação possam receber 100 μL/poço, com extra suficiente para acomodar perdas de pipetagem.
- Remova a placa de microtitulação do separador de placa magnética.
- Adicionar 100 μL de solução de trabalho SAPE em cada poço de reação e ressuspender as esferas lavadas por pipetagem.
- Sele a placa de microtitulação de 96 poços com um selador de folha ou placa adesiva plástica e incube por 1 h no escuro em RT (18-22 °C) em um agitador orbital a 600 rpm.
- Retirar a placa de microtitulação da incubadora, transferi-la para o separador magnético de placas para imobilizar as contas, remover o selador da placa adesiva e lavar as contas três vezes com 150 μL PBS-TBN, conforme descrito nas etapas 3.7.3-3.7.5.
- Após a remoção da lavagem final, remova a placa do separador magnético de placas e ressuspenda as esferas em 100 μL de PBS-TBN por poço.
- Analise os resultados.
- Leia a placa no instrumento de análise de fluxo (veja a Tabela de Materiais) para determinar a intensidade média de fluorescência (MFI) de cada reação usando as seguintes configurações do instrumento: volume de aspiração = 50 μL; contagem mínima de contas = 100 contas; configuração de tempo limite = 40 s; gating = 7.000-17.000; modo de operação = Repórter Único. Poços duplicados são executados para cada condição, e os dois valores de MFI de saída para cada condição são calculados em média antes de executar cálculos de dados adicionais e gráficos.
NOTA: O valor de IFM de cada diluição deve mostrar ligação dependente da concentração, indicando eficiência aceitável de acoplamento rhPD-1 às esferas e confirmando boa interação das proteínas recombinantes PD-1/PD-L1.
- Leia a placa no instrumento de análise de fluxo (veja a Tabela de Materiais) para determinar a intensidade média de fluorescência (MFI) de cada reação usando as seguintes configurações do instrumento: volume de aspiração = 50 μL; contagem mínima de contas = 100 contas; configuração de tempo limite = 40 s; gating = 7.000-17.000; modo de operação = Repórter Único. Poços duplicados são executados para cada condição, e os dois valores de MFI de saída para cada condição são calculados em média antes de executar cálculos de dados adicionais e gráficos.
4. PD-L1 ensaio de bloqueio PD-1/PD-L1 baseado em esferas magnéticas
NOTA: Este ensaio avalia a atividade de bloqueio de mediadores solúveis (por exemplo, anticorpos anti-PDL1-peptídeo) em interações PD1/PD-L1 recombinantes. Resumidamente, rhPD-L1 biotinilado é pré-incubado com anticorpos gerados em coelhos após diferentes inoculações do peptídeo PDL1-Vaxx. A mistura de anticorpos rhPD-L1 + anti-PDL1 é então capturada usando esferas magnéticas acopladas a rhPD-1, e a ligação de rhPD-L1 às esferas acopladas a rhPD-1 é quantificada pela adição de estreptavidina-PE. O sinal de fluorescência do PE correlaciona-se inversamente com a atividade bloqueadora dos anticorpos/inibidores anti-PDL1 testados. A ligação do anticorpo anti-peptídeo PDL1 é avaliada simultaneamente pela ligação de um anticorpo secundário anti-coelho acoplado a BV421 (para anticorpos antipeptídeo anti-PDL1) ou anti-humano (para anticorpos de controle) e pela avaliação da fluorescência BV421 no segundo canal do instrumento. As etapas do ensaio estão pictoricamente detalhadas na Figura 1.
- Preparar uma série de diluição em série de duas vezes dos anticorpos de teste, incluindo candidatos a anticorpos policlonais induzidos por PDL1-Vaxx, um anticorpo de controle negativo (trastuzumabe, Herceptin, anticorpo monoclonal anti-HER2 humanizado) e um anticorpo de controle positivo (atezolizumabe; anticorpo monoclonal anti-PDL1 IgG1 humanizado). Cada reação usará 25 μL da diluição de anticorpos atribuída, de modo que os volumes mostrados sejam suficientes para realizar cada reação em poços duplicados por condição (ou seja, 50 μL por condição), com algum excesso restante para acomodar as perdas de pipetagem.
- Para cada anticorpo anti-PDL1-peptídeo induzido pela vacina e anticorpo de controle, certifique-se de que o intervalo das concentrações finais de anticorpos testadas seja de 1.000 μg/mL até 8 μg/mL. Preparar soluções-mãe de todos os anticorpos a 2.000 μg/mL.
- Para cada anticorpo, rotular os tubos de diluição como 1.000 μg/mL, 500 μg/mL, 250 μg/mL, 125 μg/mL, 63 μg/mL, 31 μg/mL, 16 μg/mL e 8 μg/mL e incluir o nome do anticorpo. Para cada anticorpo, adicione também um tubo de "0 μg/mL", que será o controle somente do veículo (PBS-TBN).
NOTA: Quando adicionado à mistura de reação, a concentração de anticorpos será diluída 1:1. Os tubos de diluição de anticorpos são rotulados como a concentração final de anticorpos após a adição à reação e, na verdade, contêm o dobro da quantidade de anticorpos do que a marcada. - Adicionar 75 μL de PBS-TBN a todos os tubos de diluição de anticorpos rotulados como "500 μg/mL" e abaixo, incluindo os tubos de controle somente para veículos "0 μg/mL".
- Para cada anticorpo, pipetar 150 μL da solução-estoque de 2.000 μg/mL para o respectivo tubo rotulado como "1.000 μg/mL". Isso será usado para fazer todas as diluições subsequentes para cada anticorpo.
- Para cada anticorpo, crie uma série completa de diluição transferindo 75 μL por pipeta do tubo de "1.000 μg/mL" para o tubo com a próxima diluição mais baixa da série (ou seja, "500 μg/mL"). Feche o tubo de diluição recém-concluído, vomite-o brevemente e continue a construção da série de diluição transferindo 75 μL do tubo de "500 μg/mL" para o tubo de "250 μg/mL". Repita esse padrão até que a última diluição, "8 μg/mL", tenha sido feita para todos os anticorpos.
NOTA: Na série de diluição completa para cada anticorpo, deve haver um volume de 75 μL para todos os tubos, exceto a diluição mais baixa, 8 μg/mL, que deve conter um volume de 150 μL. Cada reação usará 25 μL de diluição de anticorpos, de modo que esses volumes sejam suficientes para realizar cada reação em poços duplicados por condição (ou seja, 50 μL por condição), com extra para acomodar as perdas de pipetagem.
- Colocar 25 μL dos anticorpos diluídos nos poços designados de uma placa de microtitulação de 96 poços.
- Diluir rhPD-L1 biotinilado para uma concentração de trabalho de 4 μg/mL em PBS-TBN em um volume suficiente para incluir 25 μL em poços duplicados por condição (ou seja, 50 μL por condição), com extra para acomodar perdas de pipetagem.
NOTA: Neste trabalho, rhPD-L1 biotinilado a 4 μg/mL resultou em aproximadamente 50% do sinal de IFM máximo medido na avaliação anterior do acoplamento e foi usado para a análise do bloqueio PD-1/PD-L1. - Adicionar 25 μL de rhPD-L1 biotinilado (4 μg/mL) a cada poço de reação, cobrir a placa de microtitulação com uma folha ou selo adesivo plástico e incubar em RT (18-22 °C) por 1 h com agitação em um agitador de placa orbital a 600 rpm.
- Diluir as esferas acopladas a rhPD-1 para 50.000 contas/mL, com um volume suficiente para 50 μL/poço (2.500 contas/poço) mais extra para acomodar as perdas de pipetagem.
- Remova a placa de reação de microtitulação de 96 poços do agitador e remova o selo da placa adesiva.
- Adicionar 50 μL da mistura de esferas acoplada a rhPD-1 a cada poço.
- Sele a placa e incube por 1 h no escuro em TR (18-22 °C) em um agitador orbital a 600 rpm.
- Transfira a placa selada do agitador orbital para o separador magnético de placas por 2 min para imobilizar as contas.
- Remova cuidadosamente o selador da placa adesiva, confirme se o ímã e a placa de microtitulação estão firmemente juntos, inverta a placa e despeje os sobrenadantes. Bata suavemente a placa invertida em uma almofada de papel absorvente para remover o excesso de sobrenadante.
- Lave o excesso de reagentes de reação das contas.
- Remova a placa de microtitulação do separador de placa magnética e adicione 150 μL de PBS-TBN a cada poço.
- Coloque a placa de microtitulação no separador magnético de placas por 2 min para imobilizar as contas.
- Confirme se o ímã e a placa de microtitulação estão firmemente juntos, inverta a placa e despeje os sobrenadantes. Bata suavemente a placa invertida em uma almofada de papel absorvente para remover o excesso de sobrenadante.
- Repetir as etapas de lavagem da placa 4.11.1-4.11.3 duas vezes, totalizando três lavagens com PBS-TBN. Certifique-se de que o reagente SAPE está preparado (abaixo) antes de remover a solução de lavagem final (terceira).
- Adicione o reagente de detecção SAPE.
- Diluir a solução-mãe SAPE para uma concentração de trabalho de 6 μg/mL em PBS-TBN; fazer um volume suficiente para 100 μL/poço, além de extra para acomodar perdas de pipetagem.
- Adicione 100 μL/poço da solução de trabalho SAPE em cada poço de reação e ressuspenda as esferas por pipetagem.
- Sele a placa e incube por 1 h no escuro em TR (18-22 °C) em um agitador orbital a 600 rpm.
- Decantar o excesso de SAPE da reação.
- Transfira a placa selada do agitador orbital para o separador magnético de placas por 2 min para imobilizar as contas.
- Remova cuidadosamente o selador da placa adesiva, confirme se o ímã e a placa de microtitulação estão firmemente juntos, inverta a placa e despeje o sobrenadante. Bata suavemente a placa invertida em uma almofada de tecido de papel absorvente para remover o sobrenadante que contém o excesso de SAPE.
- Lave o excesso de SAPE das contas.
- Remova a placa de microtitulação do suporte da placa magnética.
- Adicionar 150 μL de PBS-TBN a cada poço para ressuspender as contas.
- Coloque a placa de microtitulação no separador magnético de placas por 2 min para imobilizar as contas.
- Confirme se o ímã e a placa de microtitulação estão bem juntos, inverta a placa e despeje o sobrenadante. Bata suavemente a placa invertida em uma almofada de papel absorvente para remover o excesso de sobrenadante.
- Execute duas etapas de lavagem adicionais com PBS-TBN para um total de três lavagens repetindo as etapas 4.15.1-4.15.4. Preparar os anticorpos de detecção secundária congugados com BV421 (próxima etapa) antes de remover a solução de lavagem final (terceira).
- Adicione os anticorpos secundários congugados com BV421.
- IgG anti-humano congugiada com BV421 diluída (para detecção de anticorpos de controle humanizados) e IgG anti-coelho congugada com BV421 (para detecção de anticorpos policlonais induzidos por PDL1-Vaxx) (ver Tabela de Materiais) 1:400 em tampão de lavagem/ensaio em volumes suficientes para usar 100 μL/poço de cada, com extra para acomodar perdas de pipetagem.
- Adicionar 100 μL de IgG anti-humano conjugada com BV421 diluída ou IgG anti-coelho conjugada com BV421 aos poços apropriados.
- Sele a placa e incube por 1 h no escuro em TR (18-22 °C) em um agitador orbital a 600 rpm.
- Decantar o excesso de anticorpos secundários conjugados com BV421 das contas.
- Transfira a placa selada do agitador orbital para o separador magnético de placas por 2 min para imobilizar as contas.
- Remova cuidadosamente o selador da placa adesiva, confirme se o ímã e a placa de microtitulação estão firmemente juntos, inverta a placa e despeje o sobrenadante. Bata suavemente a placa invertida em uma almofada de tecido de papel absorvente para remover o sobrenadante que contém excesso de anticorpos secundários conjugados com BV421.
- Lave o excesso de anticorpos secundários conjugados com BV421 das contas.
- Adicionar 150 μL de PBS-TBN a cada poço para ressuspender as contas.
- Coloque a placa de microtitulação no separador magnético de placas por 2 min para imobilizar as contas.
- Confirme se o ímã e a placa de microtitulação estão bem juntos, inverta a placa e despeje o sobrenadante. Bata suavemente a placa invertida em uma almofada de papel absorvente para remover o excesso de sobrenadante.
- Execute três etapas de lavagem adicionais com PBS-TBN para um total de quatro lavagens repetindo as etapas 4.19.1-4.19.3.
- Após a remoção do último (quarto) tampão de lavagem, remova a placa de microtitulação do separador magnético de placas e ressuspenda as esferas em 100 μL PBS-TBN/poço com um pipetador.
- Analise os resultados.
- Leia a placa no sistema de análise de fluxo dual-reporter para determinar a MFI de cada reação usando as seguintes configurações do instrumento: volume de aspiração = 50 μL; contagem mínima de contas = 100 contas; configuração de tempo limite = 40 s; gating: 7.000-17.000; modo de operação = Dual Reporter.
- Com o sistema dual-reporter, certifique-se de que o Reporter Channel 1 mede a fluorescência de PE laranja (quantidade de rhPD-L1 anexada a esferas conjugadas a rhPD-1) e o Reporter Channel 2 mede a fluorescência BV421 azul (quantidade de anticorpo bloqueador ligado a rhPD-L1).
- Execute poços duplicados para cada condição e faça a média dos dois valores de MFI de saída para cada condição antes de executar cálculos e gráficos de dados adicionais.
- Padronizar o valor de IFM de cada amostra para o controle negativo e calcular a porcentagem de inibição para cada amostra:
Inibição% = (100 × [MFI de controle negativo − MFI de amostra])/MFI de controle negativo
NOTA: Os valores de IFM de controlo negativo (sem inibição) são os valores mais elevados; o sinal ligado PD-L1 MFI é de 100%, e a inibição da ligação de rhPD-L1 a rhPD-1 é definida como 0%.
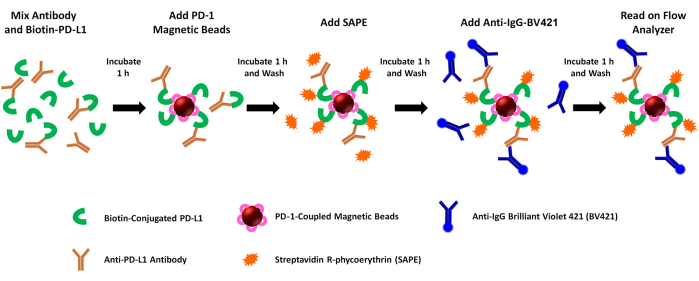
Figura 1: Esquema do ensaio de bloqueio PD-1/PD-L1 do repórter duplo. A PD-L1 humana recombinante biotinilada (rhPD-L1) é pré-incubada com anticorpos anti-PDL1 induzidos por PDL1-Vaxx selecionados antes de se combinar com esferas magnéticas acopladas a rhPD-1 para permitir a formação do complexo de pontos de verificação PD-1/PD-L1. A rhPD-L1 complexada é então detectada e marcada pela adição de ficoeritrina acoplada à estreptavidina (SAPE, fluoróforo de laranja). Os anticorpos contra os epítopos PDL1-Vaxx têm como alvo o rhPD-L1 que se complexou ao rhPD-1 pré-acoplado às esferas magnéticas, e eles são iluminados usando um anticorpo secundário conjugado Brilliant Violet 421 (BV421, fluoróforo azul). Tanto os anticorpos rhPD-L1 biotinilados que são complexados a PD-1 (sinal de PE) quanto os anticorpos anti-PDL1 que reconhecem e se ligam ao rhPD-L1 (sinal BV421) são analisados simultaneamente usando um instrumento de citometria de fluxo de repórter duplo que interroga amostras para ambos os fluoróforos em dois canais repórteres separados. Os valores de saída para cada amostra são a intensidade mediana da fluorescência de cada fluoróforo. A inibição da formação do complexo PD1/PD-L1 por diferentes anticorpos induzidos por PDL1-Vaxx é então extrapolada comparando-se os sinais experimentais com aqueles gerados usando um anticorpo monoclonal de controle negativo que não se liga a rhPD-L1 (0% de inibição). Clique aqui para ver uma versão maior desta figura.
Representative Results
O ensaio foi capaz de quantificar precisamente a inibição da interação PD-1/PD-L1 por quatro anticorpos policlonais únicos, gerados contra os peptídeos vacinais rhPD-L1, que estão sendo explorados como potenciais agentes terapêuticos do câncer. O esquema deste ensaio é fornecido na Figura 1. A quantidade de rhPD-L1 biotinilado que se ligou a esferas conjugadas com rhPD-1 e a inibição dessa ligação pelos quatro candidatos a anticorpos induzidos por PLD1-Vaxx foi medida no Canal Reporter 1 usando um reagente de detecção de estreptavidina-PE que ligou diretamente rhPD-L1 (Figura 2).
Todos os quatro anticorpos policlonais antipeptídeo PDL1 bloquearam a interação rhPD-L1 com PD-1 que havia sido imobilizada em microesferas em extensões variáveis. A porcentagem de inibição dos diferentes anticorpos antipeptídeos anti-PDL1 variou de 48% a 74% na concentração máxima testada de 1.000 μg/mL. O anticorpo monoclonal de controle positivo atezolizumabe obteve bloqueio de 92% da interação PD-1/PD-L1 na concentração máxima testada14 de 4 μg/mL (Figura 2). Todos os anticorpos PDL1-Vaxx experimentais mostraram inibição concentração-dependente da ligação de rhPD-L1 a esferas conjugadas de rhPD-1 em comparação com trastuzumabe, o anticorpo de controle negativo que não era esperado para interagir com o sistema PD-1/PD-L1.
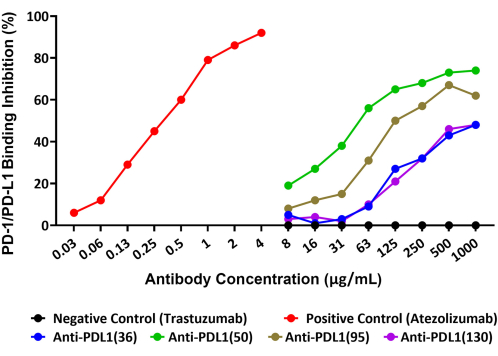
Figura 2: Bloqueio da interação rhPD-L1 com rhPD-1 acoplado a esferas magnéticas por anticorpos anti-PDL1-peptídeo, como mostrado por um novo imunoensaio baseado em esferas fluorescentes. PD-1 humano recombinante foi acoplado a microesferas magnéticas, e as esferas foram então incubadas com rhPD-L1 biotinilado que foi pré-incubado com diferentes anticorpos anti-PDL1-peptídeo. Um reagente de detecção de estreptavidina-ficoeritrina foi usado para ligar a biotina e, assim, avaliar a quantidade relativa de rhPD-L1 que estava disponível para se ligar à PD-1. Anticorpos policlonais criados em coelhos contra as vacinas do peptídeo PDL1 (anti-PDL1[36], anti-PDL1[50], anti-PDL1[95] e anti-PDL1[130]) foram testados quanto à atividade inibitória e mostraram bloqueio de 48%-74% das interações PD-1/PD-L1 recombinante na maior concentração testada. Atezolizumabe (outro anticorpo monoclonal anti-PDL1) foi utilizado como controle positivo. O anticorpo monoclonal comercial não relacionado trastuzumabe (anti-HER2) foi usado como controle negativo. Esse dado é adaptado de Guo et al.14. Clique aqui para ver uma versão maior desta figura.
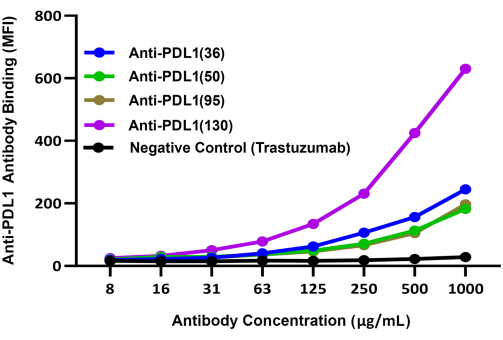
Figura 3: Ligação comparativa de diferentes anticorpos induzidos por PDL1-Vaxx a rhPD-L1 complexados a esferas magnéticas revestidas com rhPD1. O anticorpo de detecção secundária conjugado violeta brilhante 421 foi usado para comparar a ligação de diferentes anticorpos policlonais anti-PDL1-peptídeo de coelho a rhPD-L1 via esferas revestidas com rhPD-1. O sinal de fluorescência azul BV421 foi registrado no Canal Repórter 2 do instrumento dual-repórter; esse sinal correlaciona-se com a eficiência relativa de ligação dos anticorpos experimentais anti-PDL1-peptídeo. Trastezumab (anti-HER2), um anticorpo monoclonal que tem como alvo um checkpoint diferente de PD-1/PD-L1, foi usado como controle negativo. A MFI representa a intensidade média de fluorescência mediana do cordão, que foi medida em poços de reação duplicados por condição. Esse dado é adaptado de Guo et al.14. Clique aqui para ver uma versão maior desta figura.
As habilidades relativas dos quatro anticorpos candidatos experimentais induzidos por PDL1-Vaxx para se ligarem a rhPD-L1 foram comparadas usando um sistema de detecção separado (IgG anticoelho conjugado BV421) que foi avaliado no segundo canal repórter do instrumento. Esses resultados indicaram que todos os quatro anticorpos policlonais antipeptídeo PDL1 se ligaram à rhPD-L1 de forma concentração-dependente14 (Figura 3). O anticorpo anti-PDL1(130) mostrou o maior sinal de ligação rhPDL1 dos quatro candidatos a anticorpos induzidos por PDL1-Vaxx.
Discussion
O objetivo da imunoterapia do câncer relacionado a checkpoints é interromper a interação entre proteínas de checkpoint e seus ligantes importantes na sobrevivência e progressão tumoral2. Este grupo de pesquisa está desenvolvendo ativamente novas vacinas PD-1 e PD-L1 que provocam uma resposta de anticorpos que tem como alvo e interrompe o checkpoint PD-1/PD-L1 3,8,13,14. Previamente, duas variações de ensaios imunoenzimáticos (ELISAs) foram realizadas para avaliar os efeitos de anticorpos antipeptídeos anti-PDL1 na inibição da interação PD1/PD-L1 recombinante14. (1) Na primeira variante, rhPD-L1 foi revestida em uma placa de microtitulação e, em seguida, a placa foi incubada com anticorpos diluídos anti-PDL1 candidatos à vacina induzidos. A inibição da interação PD-1/PD-L1 recombinante pelos anticorpos foi então avaliada pela adição de rhPD-1 biotinilado e quantificação da ligação à rhPD-L1 imobilizada usando um conjugado estreptavidina-peroxidase de raiz forte e um substrato colorimétrico. Definimos isso como o ensaio de bloqueio direto. (2) Na segunda variante, PD-1 foi revestida na placa de microtitulação. rhPD-L1 biotinilado foi pré-incubado com cada um dos anticorpos policlonais induzidos por candidatos anti-PLD1 em tubos de reação separados. As misturas rhPDL1/anti-PDL1 foram então adicionadas aos poços de placas contendo rhPD-1 imobilizado e deixadas reagir. Qualquer rhPDL1 que reagiu com o rhPD-1 imobilizado na presença de anticorpos potencialmente bloqueadores induzidos por PDL1-Vaxx foi detectado com subsequente incubação de estreptavidina-HRP e substrato colorimétrico. Definimos isso como o ensaio de bloqueio reverso.
O bloqueio reverso da interação PD-1/PD-L1 recombinante por anticorpos antipeptídeos PDL1 mostrou inibição do sinal (i.e., bloqueio PD-1/PD-L1) de forma dependente da concentração de anticorpos14, enquanto a abordagem de bloqueio direto não forneceu resultados consistentes (não mostrados). O ensaio de bloqueio dual-reporter baseado em contas foi desenvolvido para verificar os resultados do ELISA e investigar o bloqueio da interação PD-1/PD-L1 em uma fase fluida, o que elimina os potenciais problemas de impedimento estérico/disponibilidade de epítopos de ligação associados à imobilização de proteínas recombinantes em fundos de poços. A análise da microesfera correlacionou-se diretamente com os resultados de bloqueio do ELISA pelo ensaio de bloqueio reverso (Figura 2). Além disso, os imunoensaios baseados em fluorescência podem fornecer melhor sensibilidade ao ensaio e uma faixa dinâmica ampliada em comparação com ELISAs colorimétricos18 e, além disso, o ensaio multiplexado baseado em esferas permite o desempenho simultâneo de dois imunoensaios independentes dentro de uma única reação. O sulfo-NHS e o EDC usados para o acoplamento covalente das microesferas ao rhPD-1 podem ter levado às diferenças de desempenho observadas entre os ensaios de bloqueio direto e bloqueio reverso e as diferenças observadas na sensibilidade entre os ensaios de interação PD-1/PD-L1 recombinante baseados em esferas ELISA e Luminex. Mais investigações em nível químico e molecular são necessárias para estudar os possíveis mecanismos responsáveis por essas diferenças.
Tanto o ELISA14 quanto os ensaios baseados em esferas demonstram que os anticorpos anti-PDL1-Vaxx-induzidos por PDL1 podem inibir a formação do complexo PD1/PD-L1. O PDL1-Vaxx baseado em peptídeo induz com sucesso anticorpos anti-PDL1 que podem bloquear a interação PD-1/PD-L1. Essa abordagem pode servir como uma nova estratégia terapêutica para o tratamento do câncer, como apoiado por estudos pré-clínicos em animais3,13,14. Ensaios clínicos planejados determinarão a eficácia do PDL1-Vaxx para imunoterapia de checkpoint e controle da doença em pacientes com câncer.
Disclosures
Pravin T.P. Kaumaya é consultor da Imugene, Ltd.
Acknowledgements
Os autores agradecem a Sherry Dunbar PhD, MBA da Luminex Corporation (Austin, TX) pelo apoio à pesquisa e Matthew Silverman PhD da Biomedical Publishing Solutions (Cidade do Panamá, FL; mattsilver@yahoo.com) pela assistência científica e de redação. Este trabalho foi apoiado por prêmios a Pravin T. P. Kaumaya do National Institutes of Health (R21 CA13508 e R01 CA84356) e Imugene Ltd, Sydney, Austrália (OSU 900600, GR110567 e GR124326).
Materials
| Name | Company | Catalog Number | Comments |
| Buffers | |||
| Activation Buffer: 0.1 M NaH2PO4, pH 6.2 | Millipore/Sigma | S3139 | |
| Assay/Wash Buffer: PBS-TBN (1x PBS, pH 7.4 + 0.1% BSA + 0.05 % (v/v) Tween-20; 0.05% NaN3) | Millipore/Sigma | P3563 (PBS+Tween20), A7888 (Bovine serum albumin), S8032 (sodium azide) | |
| Coupling Buffer: 50 mM 2-morpholinoethanesulfonic acid (MES), pH 5.0 | MilliporeSigma | M2933 | |
| Coupling Reagents | |||
| 1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride (EDC) | ThermoFisher Scientific (Waltham, MA) | 77149 | |
| xMAP Antibody Coupling Kit (if desired), includes: | Luminex Corp. (Austin, TX) | 40-50016 | |
| EDC, 10 mg | |||
| sNHS solution, 250 µL | |||
| Activation/Coupling Buffer: 0.1 M 2-morpholinoethanesulfonic acid (MES), pH 6.0 | |||
| Wash Buffer: 1x PBS, pH 7.4 + 0.1% BSA + 0.05 % (v/v) Tween-20; 0.05% NaN3 (PBS-TBN) | |||
| Sulfo-NHS (N-hydroxysulfosuccinimide) | ThermoFisher Scientific (Waltham, MA) | 24510 | |
| Instrumentation and Ancillary Lab Supplies | |||
| xMAP INTELLIFLEX (dual-reporter instrument) | Luminex Corp. (Austin, TX) | INTELLIFLEX-DRSE-RUO | |
| Low protein-binding round bottom 96-well plate | ThermoFisher Scientific (Waltham, MA) | 07-200-761 | |
| Luminex Magnetic Plate Separator (or comparable) | Luminex Corp. (Austin, TX) | CN-0269-01 | |
| Luminex Magnetic Tube Separator (or comparable) | Luminex Corp. (Austin, TX) | CN-0288-01 | |
| MagPlex Microspheres (magnetic, fluorescent, 6.5-µm-diameter beads) | Luminex Corp. (Austin, TX) | MC-1**** (varies by bead label) | |
| Protein LoBind microcentrifuge tubes | ThermoFisher Scientific (Waltham, MA) | 022431081 | |
| Peptides, Antibodies, & Detection Reagents | |||
| Atezolizumab (humanized anti-PDL1 IgG1 monoclonal antibody), positive control | Genentech/Roche (San Francisco, CA) | n/a (prescription medications) | |
| Biotinylated recombinant human PDL1 | Sino Biological (Wayne, PA) | 10084-H49H-B | |
| Brilliant Violet 421-congugated donkey anti-human IgG | Jackson Immunoresearch Laboratories Inc. (Westgrove, PA) | 709-675-149 | |
| Brilliant Violet 421-congugated donkey anti-rabbit IgG | Jackson Immunoresearch Laboratories Inc. (Westgrove, PA) | 711-675-152 | |
| Recombinant human PD-1 (poly-histidine tagged) | Acro Biosystems (Newark, DE) | PD1-H5256 | |
| Streptavidin-conjugated R-phycoerythrin (SAPE) | Agilent (Santa Clara, CA) | PJRS34-1 | |
| Trastuzumab (Herceptin, humanized anti-HER2 monoclonal antibody), negative control | Genentech/Roche (San Francisco, CA) | n/a (prescription medications) |
References
- Kaumaya, P. T. B-cell epitope peptide cancer vaccines: a new paradigm for combination immunotherapies with novel checkpoint peptide vaccine. Future Oncology. 16 (23), 1767-1791 (2020).
- Pandey, P., et al. Revolutionization in cancer therapeutics via targeting major immune checkpoints PD-1, PD-L1 and CTLA-4. Pharmaceuticals. 15 (3), 335 (2022).
- Guo, L., Overholser, J., Good, A. J., Ede, N. J., Kaumaya, P. T. P. Preclinical studies of a novel human PD-1 B-cell peptide cancer vaccine PD1-Vaxx from BALB/c mice to beagle dogs and to non-human primates (cynomolgus monkeys). Frontiers in Oncology. 12, 826566 (2022).
- Brahmer, J. R., Hammers, H., Lipson, E. J. Nivolumab: Targeting PD-1 to bolster antitumor immunity. Future Oncology. 11 (9), 1307-1326 (2015).
- Shah, N. J., Kelly, W. J., Liu, S. V., Choquette, K., Spira, A. Product review on the Anti-PD-L1 antibody atezolizumab. Human Vaccines & Immunotherapeutics. 14 (2), 269-276 (2018).
- Postow, M. A., Sidlow, R., Hellmann, M. D. Immune-related adverse events associated with immune checkpoint blockade. The New England Journal of Medicine. 378 (2), 158-168 (2018).
- Kaumaya, P. T. A paradigm shift: Cancer therapy with peptide-based B-cell epitopes and peptide immunotherapeutics targeting multiple solid tumor types: Emerging concepts and validation of combination immunotherapy. Human Vaccines & Immunotherapeutics. 11 (6), 1368-1386 (2015).
- Guo, L., Kaumaya, P. T. P. First prototype checkpoint inhibitor B-cell epitope vaccine (PD1-Vaxx) en route to human Phase 1 clinical trial in Australia and USA: Exploiting future novel synergistic vaccine combinations. British Journal of Cancer. 125 (2), 152-154 (2021).
- Dakappagari, N. K., Douglas, D. B., Triozzi, P. L., Stevens, V. C., Kaumaya, P. T. Prevention of mammary tumors with a chimeric HER-2 B-cell epitope peptide vaccine. Cancer Research. 60 (14), 3782-3789 (2000).
- Dakappagari, N. K., et al. Conformational HER-2/neu B-cell epitope peptide vaccine designed to incorporate two native disulfide bonds enhances tumor cell binding and antitumor activities. The Journal of Biological Chemistry. 280 (1), 54-63 (2005).
- Kaumaya, P. T., et al. Phase I active immunotherapy with combination of two chimeric, human epidermal growth factor receptor 2, B-cell epitopes fused to a promiscuous Tcell epitope in patients with metastatic and/or recurrent solid tumors. Journal of Clinical Oncology. 27 (31), 5270-5277 (2009).
- Bekaii-Saab, T., et al. Phase I immunotherapy trial with two chimeric HER-2 B-cell peptide vaccines emulsified in montanide ISA 720VG and Nor-MDP adjuvant in patients with advanced solid tumors. Clinical Cancer Research. 25 (12), 3495-3507 (2019).
- Kaumaya, P. T. P., Guo, L., Overholser, J., Penichet, M. L., Bekaii-Saab, T. Immunogenicity and antitumor efficacy of a novel human PD-1 B-cell vaccine (PD1-Vaxx) and combination immunotherapy with dual trastuzumab/pertuzumab-like HER-2 B-cell epitope vaccines (B-Vaxx) in a syngeneic mouse model. Oncoimmunology. 9 (1), 1818437 (2020).
- Guo, L., Overholser, J., Darby, H., Ede, N. J., Kaumaya, P. T. P. A newly discovered PD-L1 B_cell epitope peptide vaccine (PDL1-Vaxx) exhibits potent immune responses and effective anti-tumor immunity in multiple syngeneic mice models and (synergizes) in combination with a dual HER-2 B-cell vaccine (B-Vaxx). Oncoimmunology. 11 (1), 2127691 (2022).
- . Luminex Corporation. The xMAP® Cookbook, 5th edition Available from: https://info.luminexcorp.com/en-us/research/download-the-xmap-cookbook?utm_referrr=https%3A%2F%2Fwww.luminexcorp.com%2F (2022)
- MagPlex® Microspheres Documentation. Product information sheet. Luminex Corporation Available from: https://www.luminexcorp.com/magplex-microspheres/#overview (2014)
- Green, M. R., Sambrook, J. . Estimation of cell number by hemocytometry counting. 2019 (11), (2019).
- Selecting the Detection System - Colorimetric, Fluorescent, Luminescent Methods for ELISA Assays. Corning Inc Available from: https://www.corning.com/catalog/cls/documents/application-notes/CLS-DD-AN-458.pdf (2019)
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved