גרימת פסאודו-הריון בעכברות נקבות ללא צורך בזכרים שעברו כריתת כלי דם לפני החזרת עוברים לא ניתוחיים או הזרעה מלאכותית
In This Article
Summary
שיטת מניפולציית צוואר הרחם המוצגת יכולה לגרום לפסאודו-הריון בעכברים ללא צורך בגידול נקבות עם זכרים שעברו כריתת כלי דם. השראת פסאודו-הריון נדרשת להצלחת החזרת עוברים לא כירורגית והזרעה מלאכותית לא ניתוחית, שניהם מוצגים גם.
Abstract
כדי לשמור בהצלחה על הריון עם החזרת עוברים או הזרעה מלאכותית, עכברות מושתלות חייבות להיות מושרות למצב pseudopregnant. נקבות עכברים מזווגות באופן מסורתי בן לילה עם זכרים שעברו כריתת כלי דם, ולמחרת בבוקר מוערכת נוכחותו של פקק הזדווגות. כדי להגביר את היעילות של ייצור נקבות פסאודו-הרות, טכניקה מניפולציה צוואר הרחם כבר סטנדרטי לשימוש בשילוב עם העברת עוברים לא כירורגית או טכניקות הזרעה מלאכותית בעכברים. הקצה הקהה של מוט פלסטיק קטן מוכנס באופן נרתיקי כדי ליצור קשר עם צוואר הרחם והוא רוטט במשך 30 שניות על ידי מגע עם גוזם. ההליך מהיר ואינו דורש הרדמה או שיכוך כאבים. טכניקה זו מגדילה את האמינות ואת יכולת החיזוי של ייצור נקבות pseudopregnant ומבטל לחלוטין את הדרישה לזכרים vasectomized. עבור עכברי CD1, היעילות של השראת פסאודו-הריון באמצעות מניפולציה צווארית הייתה 83% עבור נקבות בייחום (N = 76), אך רק 38% מהנקבות בייחום היו מחוברות על ידי זכרים שעברו כריתת כלי דם (N = 24). הזרעה מלאכותית בעכברי CD1 בוצעה על ידי סנכרון ייחום עם הורמונים, מניפולציה צווארית והעברת זרע ברחם. למושתלי הזרעה מלאכותית שעברו מניפולציה בצוואר הרחם (N = 76) היה שיעור הריונות של 72% וגודל המלטה ממוצע של 8.3 גורים. שיטה זו יכולה לשמש גם לייצור נקבות פסאודו-הרות להחזרת עוברים לא כירורגיים. לכן, גרימת פסאודו-הריון על ידי מניפולציה צווארית היא חלופה נוחה ויעילה להזדווגות עם זכר שעבר כריתת כלי דם בעת ביצוע טכניקות רבייה בסיוע לא ניתוחי. שימוש במניפולציה צווארית מספק יתרונות 3Rs (החלפה, הפחתה ועידון) עבור טכניקות רבייה בסיוע על ידי הפחתת מספר בעלי החיים הדרושים וביטול הצורך בזכרים שעברו שינוי כירורגי.
Introduction
טכנולוגיות רבייה בסיוע משמשות לייצור מודלים של עכברים מהונדסים גנטית, כמו גם להתאוששות זנים משימור בהקפאה, לגזירה מחדש של זנים ממצב בריאותי בסיכון, וניהול ויבריום אסטרטגי, כולל ייצור קבוצות מותאמות גיל. כל טכניקות הרבייה בסיוע בעכברים דורשות שימוש בנשים מושתלות פסאודו-הרות להתפתחות עוברים. מבחינה היסטורית, מושתלי פסאודו-הריון נוצרו על ידי הזדווגות עם זכרים סטריליים, שעברו כריתת כלי דם כירורגית או עקרים גנטית, ונוכחותו של פקק הזדווגות מוערכת למחרת בבוקר1. לאחרונה פותח פרוטוקול לגירוי קולי בעכברים להעברה כירורגית של עוברי עכבר פרו-גרעיניים או דו-תאיים2. פיתחנו גם פרוטוקול מניפולציה צווארית (CM) לשימוש עם הזרעה מלאכותית והחזרת עוברים לא כירורגיים של בלסטוציסטים. הרציונל לשימוש בהליך הוא לספק הפחתה של 3Rs במספר בעלי החיים הנדרשים (שאינם זקוקים עוד לעכברים זכרים) ושכלול הטכניקות בהן נעשה שימוש (שאינו מצריך עוד הליך כירורגי לכריתת כלי דם עבור עכברים זכרים). התיאור של פרוטוקול זה כולל את טכניקת השכפול בסיוע המשויכת כדי לסייע בשילוב CM בזרימות עבודה רגילות. המטרה הכוללת של שיטת CM היא להחליף את השימוש בעכברים זכרים בדור של נקבות פסאודו-הרות לטכניקות רבייה בסיוע, כולל הזרעה מלאכותית והחזרת עוברים.
פרוטוקול CM המתואר כאן פותח לראשונה כדי לסייע בהזרעה מלאכותית בעכברים. פרוטוקול ההזרעה המלאכותית, כפי שתואר במקור, השיג שיעור הריון של 50%, עם גודל המלטה ממוצע של 7 גורים3. עכברים מושתלי CD1 היו מסונכרנים עם מינון נמוך של הורמונים, כולל גונדוטרופין בסרום סוסה בהריון (PMSG) וגונדוטרופין כוריוני אנושי (hCG), במרווח של 47 שעות לפני ההזרעה. יתרון של סנכרון אסטרוס היה בכך שהוא איפשר את השימוש בפרוטוקול בשעות העבודה הרגילות. הנקבות זווגו עם זכרים שעברו כריתת כלי דם מיד לאחר הזרעה מלאכותית, וההזדווגות אושרה על ידי נוכחות של פקק הזדווגות. חוסר עקביות בקצב ההזדווגות עם המושתלים דווח כקושי בהליך. לכן, חיפשו חלופות להזדווגות להשראת פסאודו-הריון.
המחקר הנוכחי מציג טכניקת CM סטנדרטית להגברת היעילות של ייצור נקבות פסאודו-הרות. עבור נקבות בייחום או בפרואסטרוס, הקצה הקהה של מוט פלסטיק קטן מוכנס באופן נרתיקי כדי ליצור קשר עם צוואר הרחם ורוטט במשך 30 שניות על ידי מגע עם גוזם. ההליך מבוצע על כלוב תיל. אין צורך בהרדמה או שיכוך כאבים. טכניקת CM נוחה לייצור נקבות פסאודו-הרות, אשר יכולות לייצר המלטות לאחר הזרעה מלאכותית ללא ניתוח ללא צורך בהזדווגות עם זכרים שעברו כריתת כלי דם. CM יכול לשמש גם לייצור של נקבות pseudopregnant כמושתלים של החזרת עוברים. באופן ספציפי, ניתן לשלב את טכניקת CM עם החזרת עוברים לא ניתוחית, כמתואר כאן. שיטות לא ניתוחיות הוכחו כיעילות להחזרת עוברים בשלב הבלסטוציסט בעכברים4,5 ובחולדות 6,7. מכיוון ששיטה לא כירורגית זו היא חלופה יעילה לשיטות כירורגיות, היא נחשבת לחידוד 3Rs של הטכניקה. בהתבסס על מחקרים קודמים, רמות קורטיקוסטרון צואתי, כמדד ללחץ, מצביעות על כך שהאופי הלא ניתוחי של ההליך אינו מגביר את רמות הלחץ במכרסמים 7,8. ההליכים פחות מאתגרים מבחינה טכנית מאשר החזרת עוברים כירורגית והם הרבה יותר מהירים לביצוע. כאשר העוברים מועברים לרחם, יש להעביר עוברים בשלב הנכון להתפתחות הרחם. עבור עכברים, בלסטוציסטים מועברים למושתלי פסאודו-הריון 2.5 ימים לאחר coitum (dpc).
עבור שתי הטכניקות הלא ניתוחיות המתוארות כאן, תזמון מתן ההורמונים וטכניקת CM שונה. העיתוי של הליך CM ביחס לייחום חשוב להצלחה, שכן הוא מחליף הזדווגות טבעית לייצור מושתלים מדומים. על ידי ביטול הצורך בזכרים שעברו כריתת כלי דם כדי לגרום להריון מדומה, הליך זה מספק יתרונות 3Rs הן על ידי הפחתת מספר בעלי החיים הדרושים והן על ידי ביטול הצורך בזכרים שהשתנו בניתוח. ההליך עצמו מהיר (30 שניות) ואינו דורש הרדמה או שיכוך כאבים. הטכניקה מגדילה מאוד את האמינות ואת יכולת החיזוי של ייצור נקבות פסאודו-הרות לרבייה בסיוע.
Protocol
כל ההנחיות הבינלאומיות, הלאומיות והמוסדיות הרלוונטיות לטיפול ולשימוש בבעלי חיים בוצעו. כל ההליכים שבוצעו במחקרים המערבים בעלי חיים היו בהתאם לסטנדרטים האתיים של הוועדה המוסדית לטיפול ושימוש בבעלי חיים של תאגיד ParaTechs ונערכו תחת הסטנדרטים המוכתבים על ידי המשרד לרווחת חיות מעבדה, המכונים הלאומיים לבריאות, שירות בריאות הציבור, מחלקת הבריאות ושירותי האנוש של ארצות הברית. זכרים ונקבות CD1 (ICR) ונקבות C57Bl / 6J עכברים בגילאי >8 שבועות שימשו במחקר הנוכחי. בעלי החיים התקבלו ממקורות מסחריים (ראו טבלת חומרים).
1. הליך מניפולציה צוואר הרחם לשימוש עם הזרעה מלאכותית בעכברי CD1
- ביוץ מסונכרן של נקבות עכברים ביום 1 וביום 3
- הזריקו לנקבות עכברים PMSG של 2.5 IU (ראו טבלת חומרים) על ידי הזרקה תוך צפקית (IP) ביום הראשון, 0.5 שעות לפני תחילת המחזור האפל של vivarium.
הערה: כל תורם זכר יספק מספיק זרע עבור 10 נשים מושתלות. - הזריקו לנקבות 2.5 IU hCG (ראו טבלת חומרים) על ידי הזרקת IP ביום 3, שעה לפני תחילת המחזור האפל של vivarium.
הערה: תזמוני הזריקות, העברת הזרע ומחזור האור ביחס זה לזה חשובים מאוד. הזמנים שצוינו עבור כל ההליכים בפרוטוקול זה מבוססים על מחזור אור/חושך של 12 שעות.
- הזריקו לנקבות עכברים PMSG של 2.5 IU (ראו טבלת חומרים) על ידי הזרקה תוך צפקית (IP) ביום הראשון, 0.5 שעות לפני תחילת המחזור האפל של vivarium.
- איסוף וקיבול של זרע טרי ביום 4
- הכינו טיפה של 500 μL של מדיום טרום דגירה של זרע (PM, ראו טבלת חומרים) בצלחת תרבית רקמה של 60 מ"מ תחת שמן פרפין. הכינו מנה אחת לכל תורם זכר. יש לאזן לפחות 30 דקות ב-37°C ו-5%CO2 לפני איסוף הזרע.
- בשעה אחת לאחר תחילת מחזור האור של הוויבריום, יש להרדים את הזכר(ים) בהתאם להנחיות המוסדיות. כל זכר יספק מספיק זרע ל-10 הזרעות מלאכותיות.
- לנתח במהירות את epididymides cauda מן העכבר. ביצוע חתך רוחבי בבטן מעל שלפוחית השתן באמצעות מספריים דיסקציה ומלקחיים שיניים.
- כריות שומן האשכים ממוקמות משני צדי שלפוחית השתן. אחזו באחת מכריות שומן האשכים במלקחיים מעוקלים, והסירו את האשכים והאפידידימיס מחלל הגוף. זהה את האפידידימיס קאודה כמבנה צינורי אליפטי שטוח ממש מתחת לאשכים.
- החזיקו את האפידידימיס קאודה במלקחיים מעוקלים, וכרתו בעזרת מספריים קטנים וזוויתיים. הסר את שני epididymides cauda, ולהעביר אותם לרקמה סופגת כדי להסיר שומן ודם תחת מיקרוסקופ ניתוח.
- מניחים שני אפידידימידים קאודה לתוך כל טיפה 500 μL של PM מאוזן תחת שמן פרפין ב 37 ° C. חותכים את הרקמה על ידי ביצוע שישה חתכים באמצעות מספריים קטנים. אם משתמשים ביותר מתורם זכר אחד, השתמש באפידידימיס אחד מכל תורם עבור כל דגימת זרע כדי להפחית את השונות בין הדגימות.
- מערבלים בעדינות את המנה, ומאפשרים לזרע לצאת מהרקמה למשך 3 דקות, תוך ערבול פעם בדקה. הסר את כל הרקמות.
- יש לדגור על דגימת הזרע למשך 45 דקות עד שעה אחת בטמפרטורה של 37°C ו-5% CO2 כדי לקלוט.
- אופציונלי: למדוד את ספירת הזרע, ולהעריך את תנועתיות תחת מיקרוסקופ באמצעות המוציטומטר. לספירה, יש לדלל את הזרע ב-PM לפי הצורך.
- אישור סנכרון מחזור הייחום על ידי הערכה ציטולוגית
- בעזרת מקלון קטן ולח מראש (ראו טבלת חומרים), אוספים בעדינות תאי נרתיק מדופן הנרתיק על ידי גלגול המקלון כנגד הרקמה, מורחים אותם לתוך טיפה של 20 μL מים סטריליים במגלשת מיקרוסקופ, ומייבשים אותם באוויר.
- תחת מיקרוסקופ באמצעות הגדלה 100x עם הארה שדה בהיר, להעריך את נוכחותם של תאי אפיתל cornified. נקבות בייחום או בפרואסטרוס מאוחר יהיו בעלות תאי אפיתל קורנים ויש לבחור בהן למניפולציה צווארית הרחם.
- אופציונלי: רשום את משקל הנשים המושתלות לפני ההזרעה.
- ביצוע מניפולציה צוואר הרחם (CM)
- כשעה וחצי לפני ההזרעה, הניחו את הנקבה המושתלת על ראש כלוב עם מתלה תיל, המאפשר לעכבר "לתפוס" את משטח מוט הכלוב. אחזו קרוב לבסיס הזנב באמצעות האגודל והאצבע וסובבו את הזנב כלפי מעלה תוך ייצוב החיה (איור 1).
הערה: העכבר יחזיק מעמד ללא תזוזה למשך ההליך כאשר טכניקת הטיפול מבוצעת כראוי. אם העכבר זז ממקומו, מקם מחדש בעדינות והמשך. אם בעל חיים תוקפני נבחר כנמען, מתן אפשרות לבעל החיים להיכנס למנהרת העשרה במהלך ההליך יכול להיות מרגיע. השימוש במנהרה הוא אופציונלי, אך הוא יכול לסייע לחוקרים בטיפול בבעלי החיים על ידי מתן הסחת דעת במהלך הליך זה. - יש להכניס את הקצה הקהה של מוט פלסטיק קטן (ראו טבלת חומרים) באופן נרתיקי כדי ליצור מגע עם צוואר הרחם, ולרטוט במשך 30 שניות על ידי מגע עם גוזם (ראו טבלת חומרים).
הערה: הניחו את המוט במקומו לפני הפעלת הגוזם שניהם מוחזקים ביד אחת במהלך ההליך. אין צורך בהרדמה או שיכוך כאבים.
- כשעה וחצי לפני ההזרעה, הניחו את הנקבה המושתלת על ראש כלוב עם מתלה תיל, המאפשר לעכבר "לתפוס" את משטח מוט הכלוב. אחזו קרוב לבסיס הזנב באמצעות האגודל והאצבע וסובבו את הזנב כלפי מעלה תוך ייצוב החיה (איור 1).
- העברת זרע לא ניתוחית להזרעה מלאכותית
- הניחו את מכשיר ההזרעה (ראו טבלת חומרים) על פיפטה P200 המוגדרת ל-40 מיקרוליטר, והסירו את כיסוי המגן.
- הסר aliquot של דגימת זרע capacitated מן הצלחת ב 37 ° C ו 5% CO2, ולהעביר אותו צלחת תרבית רקמה 35 מ"מ ללא שמן ב 37 ° C. דגימת הזרע תשמש באופן מיידי להעברה.
הערה: הזרע יאבד תנועתיות במהירות מחוץ לאינקובטור CO2 . שמור את דגימת הזרע הcapacitated ב 37 ° C ו 5% CO2 ככל האפשר. - לחץ על בוכנה פיפטה לתחנה הראשונה, הורד את קצה הצנתר לתוך דגימת הזרע ב 37 מעלות צלזיוס, וטען לאט את הזרע לתוך מכשיר ההעברה. הימנע מכל גושים. יש להסיר שאריות שמן מחלקו החיצוני של מכשיר ההזרעה באמצעות רקמה סופגת. מניחים בצד את הפיפטה.
הערה: יש להימנע מהעברת שמן פרפין לקרן הרחם. יש להסיר שאריות שמן מחלקו החיצוני של מכשיר ההזרעה באמצעות רקמה סופגת. - הניחו את נקבת הנמען על ראש כלוב מתלה התיל. החזק את העכבר במקומו באמצעות אותה טכניקת טיפול המשמשת עבור CM; אחזו קרוב לבסיס הזנב באמצעות האגודל והאצבע, וסובבו את הזנב כלפי מעלה תוך ייצוב החיה.
- הניחו את הספקולום הקטן (ראו טבלת חומרים) לתוך הנרתיק.
- הכנס את צנתר מכשיר ההזרעה לתוך ספקולום, דרך צוואר הרחם, לתוך הרחם. ברגע שרכזת המכשיר יוצרת קשר עם הספקולום, שחרר את הזרע על ידי לחיצה על בוכנה פיפטה לתחנה הראשונה. הימנע מהעברת אוויר נוסף לקרן הרחם.
הערה: אם הצנתר אינו ממוקם כראוי, הוא יפגע ברקמה המקיפה את צוואר הרחם, יגרום לו להתגמש ובסופו של דבר להתכופף. אם הצנתר אינו גולש דרך צוואר הרחם בניסיון הראשון, החזירו את הצנתר בעדינות החוצה, ונסו שוב עד להצלחה. מיקום מחדש של ספקולום עשוי להיות נחוץ. - הסר את המכשיר ואת ספקולום. אין צורך במעקב לאחר ההליך.
- אופציונלי: בדיקת הריון בימים 10-12
- השתמש בעלייה במשקל כדי לקבוע את מצב ההריון. עלייה במשקל תהיה תלויה במאמץ, אך עלייה של לפחות 1-2 גרם בקורלציה עם הריון.
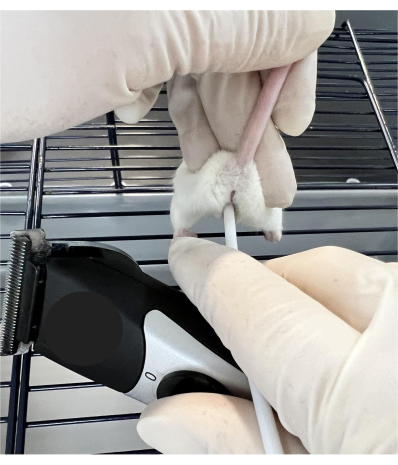
איור 1: טכניקת אחיזת עכבר למניפולציה של צוואר הרחם. העכבר נשען על ראש כלוב תיל ומיוצב בזנב ומשני הצדדים בקדמת הרגליים האחוריות. הקצה הקהה של מוט פלסטיק קטן מוכנס באופן נרתיקי כדי ליצור קשר עם צוואר הרחם והוא רוטט על ידי מגע עם גוזם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. הליך החזרת עוברים לא ניתוחי לשימוש עם מניפולציה צווארית בעכברי CD1
- ביוץ מסונכרן של נקבות העכברים ביום 1 וביום 3
- הזריקו לנקבות עכברים PMSG של 2.5 IU על ידי הזרקת IP ביום הראשון, כ-6 שעות לאחר תחילת מחזור האור של הוויבריום.
- הזריקו לנקבות 2.5 IU hCG על ידי הזרקת IP ביום השלישי, במרווח של 47 שעות לאחר הזרקת PMSG או כ -5 שעות לאחר תחילת מחזור האור vivarium.
- אישור סנכרון מחזור הייחום על ידי הערכה ציטולוגית
- ביום השלישי, כשעה לפני ה-CM, יש לבצע ציטולוגיה על המושתלים הפוטנציאליים. בעזרת מקלון קטן ולח מראש, אספו בעדינות תאי נרתיק מדופן הנרתיק על ידי גלגול המקלון כנגד הרקמה, מרחו אותם לתוך טיפה של 20 מיקרוליטר מים סטריליים במגלשת מיקרוסקופ, וייבשו אותם באוויר.
- תחת מיקרוסקופ באמצעות הגדלה 100x עם הארה שדה בהיר, להעריך את נוכחותם של תאי אפיתל cornified. נקבות בייחום או בפרואסטרוס מאוחר יהיו בעלות תאי אפיתל קורנים ויש לבחור בהן למניפולציה צווארית הרחם.
- אופציונלי: רשום את משקלן של מקבלי העוברים הפוטנציאליים.
- ביצוע CM
- ביום השלישי, שעה לפני תחילת המחזור האפל של הוויבריום, הניחו את הנקבה הנמענת על ראש כלוב עם מתלה תיל, המאפשר לחיה "לתפוס" את משטח מוט הכלוב. אחזו קרוב לבסיס הזנב באמצעות האצבע והאגודל, ואז כוונו את הזנב כלפי מעלה תוך ייצוב החיה (איור 1).
הערה: העכבר יחזיק מעמד ללא תזוזה למשך ההליך כאשר טכניקת הטיפול מבוצעת כראוי. אם העכבר זז ממקומו, מקם מחדש בעדינות והמשך. אם בעל חיים תוקפני נבחר כנמען, מתן אפשרות לבעל החיים להיכנס למנהרת העשרה במהלך ההליך יכול להיות מרגיע. - הכנס את הקצה הקהה של מוט פלסטיק קטן לנרתיק כדי ליצור מגע עם צוואר הרחם, והרטט אותו במשך 30 שניות על ידי מגע עם גוזם.
הערה: הניחו את המוט במקומו לפני הפעלת הגוזם שניהם מוחזקים ביד אחת במהלך ההליך. אין צורך בהרדמה או שיכוך כאבים.
- ביום השלישי, שעה לפני תחילת המחזור האפל של הוויבריום, הניחו את הנקבה הנמענת על ראש כלוב עם מתלה תיל, המאפשר לחיה "לתפוס" את משטח מוט הכלוב. אחזו קרוב לבסיס הזנב באמצעות האצבע והאגודל, ואז כוונו את הזנב כלפי מעלה תוך ייצוב החיה (איור 1).
- החזרת עוברים לא ניתוחיים ביום 6
- יש להניח טיפה של 20 μL של מדיום M2 (ראו טבלת חומרים) על מכסה צלחת תרבית רקמות.
הערה: המכסה נבחר מכיוון שיש לו שפה קצרה יותר, ולכן נוח לגישה לעוברים בטיפה. בשום שלב אין להניח שמן פרפין על טיפת M2, שכן החדרת שמן לקרן הרחם משפיעה לרעה על החזרת העוברים. - תחת מיקרוסקופ ובאמצעות תאורה רפלקטיבית, יש להעמיס 10-20 בלסטוציסטים לתוך הטיפה הבינונית באמצעות פיפטה סטנדרטית לטיפול בעוברים (ראו טבלת חומרים).
הערה: המספר האופטימלי של עוברים להעברה תלוי במאמץ העכבר ובכל מניפולציה שהעוברים עברו. עבור עוברים בריאים ללא מניפולציה, החזרת 10-15 עוברים אמורה להספיק. עבור rederivation או עוברים מהונדסים גנטית, החזרת עוברים נוספים מתאימה. - יש לאבטח את המכשיר להחזרת עוברים ללא ניתוח (ראו טבלת חומרים) על פיפטה P2 המוגדרת ל-1.8 μL. הסירו את מכסה הצנתר המגן.
- לחץ על הבוכנה של פיפטה לתחנה הראשונה, הורד את קצה הצנתר לתוך המדיום, ולאט לאט למשוך את העוברים לתוך קצה הצנתר של המכשיר. הסירו את החוד מהמדיום.
הערה: הדמיה של העוברים בהגדלה נמוכה תאפשר טעינה קלה יותר של העוברים לתוך המכשיר. אם העוברים מפוזרים בטיפה, נערו בעדינות את הכלי מצד לצד כדי לרכז את העוברים במרכז הטיפה, או מקמו אותם מחדש באמצעות פיפטה לטיפול בעוברים. - הגדר את נפח פיפטה ל 2.0 μL כדי ליצור בועת אוויר קטנה בקצה הצנתר. הניחו בעדינות את פיפטה עם העוברים טעונים ליד כלוב העכבר.
- הניחו את נקבת הנמען על ראש כלוב מתלה התיל. החזק את העכבר במקומו באמצעות אותה טכניקת טיפול המשמשת עבור CM; אחזו קרוב לבסיס הזנב באמצעות האצבע והאגודל, ולאחר מכן סובבו את הזנב כלפי מעלה תוך ייצוב החיה.
- הניחו ספקולום קטן (ראו טבלת חומרים) לתוך הנרתיק.
- הכנס את צנתר התקן ההעברה לתוך ספקולום, דרך צוואר הרחם, לתוך הרחם. לאחר שרכזת המכשיר יוצרת קשר עם הספקולום, שחרר את העוברים על ידי לחיצה על בוכנה פיפטה לתחנה הראשונה. הימנע מהעברת אוויר נוסף לקרן הרחם.
- מבלי לשחרר את בוכנה פיפטה, להסיר את המכשיר ספקולום. אין צורך במעקב לאחר ההליך.
- יש להניח טיפה של 20 μL של מדיום M2 (ראו טבלת חומרים) על מכסה צלחת תרבית רקמות.
Representative Results
מכיוון שגירוי צווארי חשמלי9 וקולי10 שימשו להשראת פסאודו-הריון בחולדות, עבודה זו מציגה הליך מכני סטנדרטי שניתן להשתמש בו בעכברים. ציטולוגיה נרתיקית יכולה לסייע בזיהוי נקבות בשלבים שונים של ייחום. כדי לאשר פסאודו-הריון אצל נקבות, נעשה שימוש באותה שיטה. ראשית, פרופילים ציטולוגיים של נקבות הושוו עבור עכברי CD1 ו- C57Bl/6 לאורך מחזורי הייחום, במהלך ההריון ובמהלך פסאודו-הריון המושרה על ידי הזדווגות או CM. מקלונים וגינליים נלקחו מהנקבות והוכתמו באמצעות מערכת צביעה Papanicolaou (ראה טבלת חומרים). התאים נצפו תחת הגדלה של פי 100 עם תאורת שדה בהיר. התאים שנצפו כללו לויקוציטים, תאי אפיתל בעלי גרעין ותאי אפיתל קורנים. קביעת שלב מחזור הייחום התבססה על האחוז היחסי של כל סוג תא11,12. אסטרוס מאופיין על ידי דומיננטיות של תאי אפיתל cornified. כאשר הייחום מסתיים, metestrus מתחיל, ו leukocytes מתחילים להופיע, בעוד תאי אפיתל cornified להיות פחות ברור. לדיסטרוס יש תאיות בינונית עד נמוכה, כאשר לויקוציטים שולטים ותאי אפיתל בעלי גרעין מתחילים להופיע. Proestrus הוא הבחין על ידי אובדן של לויקוציטים, עלייה בתאי אפיתל גרעין, ואת המראה של תאי אפיתל cornified. לאחר proestrus, הייחום מתחיל, ואת המחזור ממשיך.
כדי לפתח פרופיל בסיסי, ציטולוגיה נרתיקית נרשמה לפחות שני מחזורי ייחום מלאים עבור כל נקבה (N = 20 עבור CD1, N = 20 עבור C57Bl/6) לפני ההזדווגות. אורכי המחזור והפרופילים האישיים השתנו בין העכברים; עם זאת, נצפו מגמות כלליות צפויות. האורך הממוצע של מחזור ייחום עבור עכברי CD1 ו- C57Bl/6 היה 3.8 ימים, עם טווח של 3-5 ימים. יום לפני ההזדווגות הטבעית כל נקבות העכברים היו בפרואסטרוס. לאחר ההזדווגות, הציטולוגיה בוצעה שוב 1.5 ימים לאחר coitum (dpc) עד מחזור הייחום התחדש. איור 2 מראה את הפרופיל הציטולוגי של נקבות CD1 ו-C57Bl/6 שהזדווגו עם זכרים שעברו כריתת כלי דם.
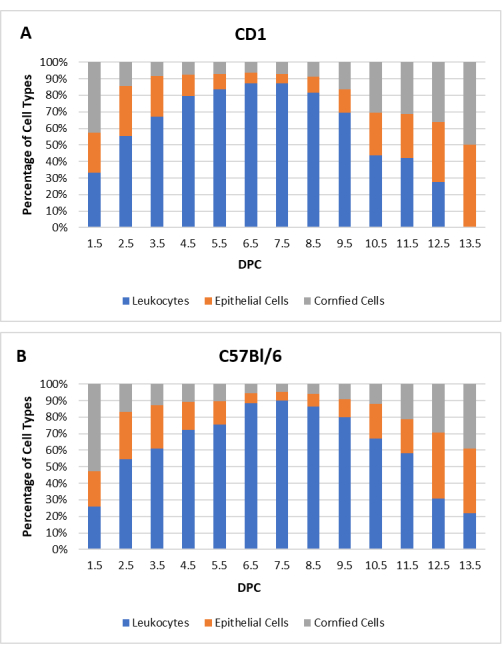
איור 2: פרופיל ציטולוגי של נקבות עכברות פסאודו-הרות. האחוזים הממוצעים של כל סוג תא עבור לויקוציטים, תאי אפיתל בעלי גרעין ותאי אפיתל קרניים מוצגים כפונקציה של ימים לאחר coitum (DPC) עבור (A) CD1 (N = 20) ו- (B) C57Bl/6 (N = 20) עכברים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
בעבודה זו, טכניקת CM כבר סטנדרטי כדי להגדיל את היעילות של ייצור נקבות pseudopregnant. עבור נקבות בייחום או בפרואסטרוס, הקצה הקהה של מוט פלסטיק קטן מוכנס באופן נרתיקי כדי ליצור קשר עם צוואר הרחם ורוטט במשך 30 שניות על ידי מגע עם גוזם. ההליך מבוצע על כלוב תיל. אין צורך בהרדמה או שיכוך כאבים. כדי לקבוע את היעילות של הליך CM, ציטולוגיה נרתיקית הושוותה עבור נקבות CD1 (N = 20) ו C57Bl/6 (N = 20) עכברים לאחר הזדווגות עם זכרים vasectomized ולאחר CM (סה"כ N = 40). הפרופיל הציטולוגי של פסאודו-הריון המושרה על-ידי CM היה דומה לפרופיל של פסאודו-הריון המושרה על-ידי הזדווגות, כפי שניתן לראות באיור 3.
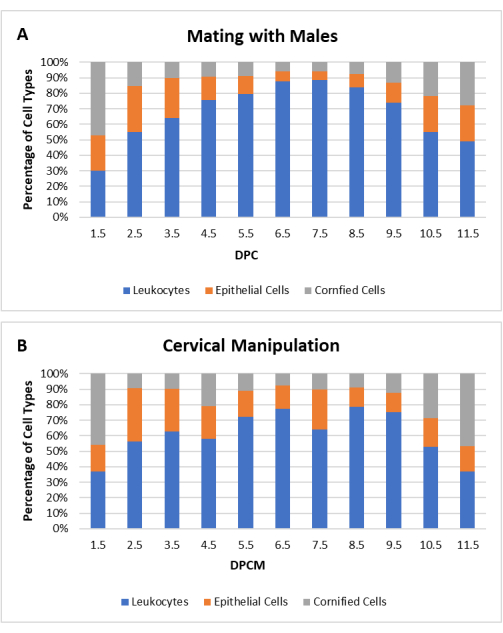
איור 3: פרופיל ציטולוגי של עכברות מדומות לאחר מניפולציה של צוואר הרחם (CM). האחוז של כל סוג תא עבור לויקוציטים, תאי אפיתל גרעין ותאי אפיתל קרניים מוצג כפונקציה של ימים לאחר coitum (DPC) או ימים לאחר מניפולציה צוואר הרחם (DPCM). אחוזי סוג התא הממוצעים מוצגים עבור עכברי CD1 ו- C57Bl/6 (N = 40) (A) שהזדווגו עם זכרים שעברו כריתת כלי דם או (B) לאחר CM. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כדי לקבוע אם טכניקת CM מספיקה כדי לבסס הריון לרבייה בסיוע, CM בוצע כחלק מפרוטוקול הזרעה מלאכותית לא כירורגית (NSAI) בנקבות CD1. פרוטוקול ההזרעה המלאכותית כלל סנכרון ייחום של הנקבות עם מינון נמוך של ההורמונים PMSG ו-hCG לפני העברת הזרע. CM בוצע ממש לפני העברת הזרע. עבור עכברי CD1, היעילות של השראת פסאודו-הריון באמצעות CM עבור נקבות בייחום (N = 76) בטכניקה זו הייתה 83%. בניסוי ביקורת, רק 38% מהנקבות בייחום היו מחוברות על ידי זכרים שעברו כריתת כלי דם (N = 24). למושתלי ההזרעה המלאכותית שקיבלו מניפולציה בצוואר הרחם (N = 76) היה שיעור הריונות של 72% וגודל המלטה ממוצע של 8.3 גורים. לפיכך, השראת פסאודו-הריון על ידי CM היא תחליף נוח ויעיל להזדווגות עם זכר vasectomized בעת ביצוע NSAI. שימוש ב- CM להכנת מושתלי CD1 (N = 4) בייחום להחזרת עוברים לא כירורגיים של בלסטוציסטים טריים CD1 הביא לשיעור הריון של 100%. החזרת 9-15 עוברים הניבה שלוש המלטות בריאות עם שיעור לידה של 45% וגודל המלטה ממוצע של 6 גורים. לשם השוואה, מושתלי CD1 (N = 20) שהזדווגו עם זכרים שעברו כריתת כלי דם כדי לגרום לפסאודו-הריון היו בעלי שיעור הריון של 80% ושיעור לידה של 46% לאחר העברת 20 בלסטוציסטים טריים מסוג B6C3F2.
התוצאות עבור טכניקות רבייה בסיוע יהיו ככל הנראה ספציפיות לזן, שכן משתנים כגון המינון והעיתוי של מתן הורמונים לביוץ יתר נמצאו כתלויים בזן13. בנוסף, גורמים כגון גיל הנמען ומשקל יכולים להשפיע על התגובה להורמונים14. בעבודה זו, בעת ביצוע הליך CM להזרעה מלאכותית, רק נקבות ב proestrus מאוחר או estrus נמצאו להיות מגיבים. באופן כללי, כדי להגדיל את מספר המושתלים הזמינים באוכלוסייה, הנקבות מסונכרנות תחילה עם מינון נמוך של הורמונים3. סנכרון אסטרוס עם 2.5 IU של PMSG ו- hCG היה יעיל ב -78% עבור נקבות CD1 בנות 11-14 שבועות (N = 27) ו -60% יעיל עבור נקבות C57Bl/6 בנות 18-32 שבועות (N = 22) בעבודה זו. היעילות של השראת פסאודו-הריון באמצעות מניפולציה צווארית על נקבות CD1 הייתה 83% עבור נקבות הייחום (N = 76) ו -82% (N = 100) עבור נקבות C57Bl/6 בייחום בטכניקה זו.
Discussion
ה-3Rs הוא מסגרת אתית לשימוש בבעלי חיים במחקר, כפי שתואר בשנת 1959 על ידי ראסל וברץ' ב"עקרונות הטכניקה הניסויית ההומאנית"15. ה-3Rs מייצגים החלפה, הפחתה ועידון בשימוש בבעלי חיים. הפרוטוקולים המודגשים כאן עולים בקנה אחד עם ה-3Rs. טכניקת המניפולציה של צוואר הרחם מפחיתה את מספר בעלי החיים הדרושים בכך שאינה דורשת עוד שימוש בזכרים כדי לייצר נקבות פסאודו-הרות. הטכניקה גם מבטלת את הצורך לבצע כריתת כלי דם על הזכרים, ובכך מספקת עידון על ידי הפחתת כאב ומצוקה. טכניקות הרבייה בסיוע המתוארות כאן (הזרעה מלאכותית והחזרת עוברים) אינן ניתוחיות, ולכן שתיהן מספקות עידון 3Rs על ידי הפחתת הכאב והמצוקה8הנגרמים על ידי חלופות הניתוח שלהם.
השימוש בנקבות פסאודו-הרות הכרחי להתאוששות הגורים בעת ביצוע רבייה בסיוע בעכברים1. הליך CM הוא שיטה יעילה לייצור נקבות פסאודו-הרות, אך סנכרון השלב של מחזור הייחום של הנקבות המקבלות הוא צעד ראשון קריטי בתהליך. סנכרון אסטרוס יכול להפחית באופן דרסטי את מספר הנקבות הדרושות במושבה כדי להכין מושתלים פוטנציאליים ולסייע בייצור נקבות פסאודו-הרות מתוזמנות לפי דרישה. שימוש במינון נמוך של הורמונים לא נראה לגרום להשפעות מזיקות על התאוששות של המלטות חיות בעכברי CD1. יש להקפיד על זנים אחרים כדי למצוא את שילוב ההורמונים והריכוז שמייצר את הנקבות המושתלות האיכותיות ביותר עבור העוברים או הזרע המוחזר. סנכרון יכול להיות מושג באמצעות PMSG ו hCG16, אבל מינונים המייצרים נקבות superovulated לא יכול להיות מתאים הריון מתמשך17.
כדי לקבוע אם נקבה נמצאת בייחום, בוצעה הערכה ציטולוגית בעבודה זו. שלב הייחום יכול להיות מוערך גם על ידי תצפית של פתח הנרתיק11,18. בעוד שיטה זו מועילה מאוד וניתן להשתמש בה בפני עצמה או כאישור, היא סובייקטיבית יותר מהשימוש בציטולוגיה. ציטולוגיה נרתיקית ללא כתמים היא גם מהירה וגם יעילה לבחירת נקבות בייחום מכיוון שניתן לזהות בקלות תאי אפיתל קורנים. בפרוטוקול זה, ההערכה הציטולוגית מבוצעת לפני CM כדי לקבוע מושתלים פוטנציאליים. חשוב לבצע ציטולוגיה לפני CM, שכן ההליך נוטה לפצל את התאים שנפלטו מאזור הנרתיק, ובכך להקשות על זיהוי. הערכה ציטולוגית להריון מדומה או הריון יכולה להתבצע ב 3.5-11.5 ימים לאחר CM (dpcm) במשך 3 ימים רצופים. הפרופיל של נקבה רוכבת על אופניים צריך להיות לפחות 1 יום עם חדירה ניכרת של תאי אפיתל cornified. נשים פסאודו-הרות/הרות צריכות להציג פרופיל דיסטרוס (בעיקר לויקוציטים עם מספר תאים נמוך) במשך 3 ימים רצופים.
באמצעות פיתוח טכניקת CM, חלק מהעכברים נמצאו פתוחים יותר להליך מאחרים. נקבות עכברי CD1 הן מועמדות מצוינות בגלל טבען הרגוע ואינסטינקט הטיפוח המצוין שלהן. זן זה קל לטיפול ומתפקד היטב במהלך CM וטכניקות רבייה בסיוע לא ניתוחי. עכברי C57Bl/6 נוטים להיות אגרסיביים יותר ומטפחים פחות. בעוד שפרוטוקול זה ייצר ביעילות נקבות C57Bl/6 שהשתמשו ב-CM, הן נטו פחות להיות מתירניות באופן עקבי כלפי ההליך. נראה שיש לכך מתאם מסוים עם שלב הייחום במהלך CM. נקבות הייחום או הפרואסטרוס היו פתוחות יותר. השימוש בצינור העשרה לכניסת בעל החיים איפשר גישה לנרתיק לצורך ההליך ועזר להרגיע את הנקבה. ההליך עצמו אינו מרסן לחלוטין את הנקבה, כך שהחיה יכולה להתרחק בכל עת. אם זה קורה, ניתן למקם מחדש את החיה, ולאחר מכן ניתן להמשיך בהליך. עיתוי ההליך נפסק אם הנקבה מתרחקת ומתחדש עם חידוש ההליך. קריטיים להצלחת ההליך הם שלב מחזור הייחום (פרואסטרוס מאוחר וייחום) והמגע של המוט עם צוואר הרחם. הרטט של הגוזם מספק CM סטנדרטי. כדי להבטיח מגע עם צוואר הרחם, מופעל לחץ עדין על המוט, ומיקום המוט כנגד צוואר הרחם מובטח עם תנועות קטנות קדימה ואחורה של המוט.
השימוש ב- CM שיפר את פרוטוקול NSAI מכיוון שניתן לבחור נקבות בשלב הנכון של מחזור הייחום לפני העברת הזרע, והפרוטוקול אינו מותנה עוד בהזדווגות עם זכרים שעברו כריתת כלי דם. סנכרון מחזור הייחום בהזרעה מלאכותית מתוזמן כך שהבשלת הביציות מתאימה להעברת זרע בבוקר היום הרביעי. קריטי להצלחת הפרוטוקול הוא התאמת עיתוי הביוץ כך שההפריה יכולה להתרחש. יש להקפיד על מתן hCG 15-17 שעות לפני העברת הזרע הצפויה, כפי שמוצע לגבי העיתוי המשמש להפריה חוץ גופית 1. איכות דגימת הזרע תשפיע ישירות על תוצאת ההזרעה המלאכותית. זרע טרי שעבר קיבול ישיג את הביצועים הטובים ביותר. זרע בהקפאה באיכות טובה יכול לייצר עוברים מופרים in vivo. עם זאת, יש להקפיד על העברה ישירה של זרע מופשר, שכן שאריות cryoprotectants המועברות לקרן הרחם עלול לעכב את ההשתלה (תצפיות שלא פורסמו).
השימוש ב-CM בשילוב עם החזרת עוברים הוא מבחינה קונספטואלית הסתגלות קלה. סנכרון מחזור אסטרוס מפחית את מספר הנקבות הדרושות ליצירת מאגר הנמענים. קביעת שלב הייחום לפני CM מגדילה את הסיכוי להשיג מושתלי פסאודו-הריון. חסרון אחד של השיטה הוא כי הציטולוגיה של הנמענים בזמן החזרת העוברים נמצאת בשלב של שטף. כל סוגי התאים קיימים אם הנקבה עוברת מהייחום לפרופיל הפסאודו-הריון, ופסאודו-הריון הופך ברור רק אם עוקבים אחר הציטולוגיה במשך מספר ימים. בהתבסס על ההצלחה (>80%) של המעבר מייחום לפסאודו-הריון עבור עכברי CD1 ו- C57Bl/6, שיטה זו צפויה להתאים למושתלי החזרת עוברים. התוצאות הראשוניות מראות הצלחה טובה עם החזרת עוברים מוגבלת שאינה ניתוחית. באופן כללי, היעילות של החזרת עוברים לא ניתוחית דומה לזו של הטכניקה הכירורגית4,5, והעברה לא ניתוחית יכולה להחליף החזרת עוברים כירורגית בשלב הבלסטוציסט. עבור עוברים בשלב מוקדם יותר, נדרשת תרבית עוברים לשלב הבלסטוציסט. עם זאת, אם עדיפות להעברה כירורגית, ניתן להתאים את טכניקת CM לתזמון הנכון הדרוש למושתלים פסאודו-הריוניים מתאימים2. באופן כללי, מקבלי העובר מתקדמים ביום אחד פחות מהעובר. לדוגמה, בלסטוציסטים נקצרים ב 3.5 dpc מתורמים ומועברים למושתלי 2.5 dpc. לכן, CM יהיה צורך להתבצע כך המושתל הוא במצב pseudopregnant פחות מפותח מאשר העוברים.
לסיכום, טכניקת CM המתוארת כאן מראה הבטחה מצוינת לשילוב עם טכניקות רבייה אחרות בסיוע עבור עכברים. סיפקנו פרוטוקולים מוצלחים להזרעה מלאכותית והחזרת עוברים בטכניקות לא ניתוחיות. בשילוב, טכניקת CM מספקת יתרונות 3Rs, כולל (1) הפחתה במספר בעלי החיים על ידי ביטול הצורך בזכרים שעברו כריתת כלי דם ו-(2) שכלול של טכניקות על ידי החלפת טכניקות כירורגיות בחלופות שאינן ניתוחיות.
Disclosures
ברברה סטון ושרה סרודולסקי מועסקות שתיהן בתאגיד ParaTechs, לקסינגטון, קנטקי, ארה"ב. ParaTechs מחזיקה בזכויות רישוי בלעדיות לייצור מכשיר mNSET לעכברים. ParaTechs Corp פיתחה ומוכרת את מכשירי mNSET ו-mC&I, שיכולים לשמש להחזרת עוברים לא כירורגיים והזרעה מלאכותית לא ניתוחית, בהתאמה.
Acknowledgements
המחקר המדווח בפרסום זה נתמך על ידי משרד מנהל המשרד לתוכניות תשתית מחקר, של המכונים הלאומיים לבריאות תחת פרס מספר R43OD020304 והמכון הלאומי לבריאות הנפש של המכונים הלאומיים לבריאות תחת פרס מספר R44MH122117. התוכן הוא באחריותם הבלעדית של המחברים ואינו מייצג בהכרח את הדעות הרשמיות של המכונים הלאומיים לבריאות.
Materials
| Name | Company | Catalog Number | Comments |
| Blastocyst stage embryos | |||
| CARD Fertiup Preincubation Medium (PM) | CosmoBio | KYD-002-EX | For sperm capacitation |
| Embryo handling pipette | Cook Medical | K-FPIP-1120-10BS | Flexipet is available in various diameters |
| Embryo handling pipette assembly | Paratechs | 90010 | |
| Female mice, Crl:CD1(ICR) | Charles River Laboratories | 22 | >8 weeks old |
| Forceps | Fine Science Tools | 11053-10 | Toothed, for dissection |
| Forceps | Fine Science Tools | 11052-10 | Curved, for dissection |
| Forceps | Fine Science Tools | Dumont #5 | Fine, for dissection |
| Hemocytometer | Fisher Scientific | 267110 | Optional |
| human Chorionic Gonadotropin (hCG) | Prospec | hor-250 | For estrus synchronization |
| Incubator, 37 °C 5% CO2 | Thermo Scientific | ||
| Incubator, 37 °C, benchtop | Cook | K-MINC-1000 | |
| Kimwipes | Kimberly-Clark | 34155 | Absorbant tissues |
| M2 medium | Millipore | MR-015-D | Embryo handling medium |
| Male mice, Crl:CD1(ICR) | Charles River Laboratories | 22 | >8 weeks old |
| mC&I device | ParaTechs | 60020 | For sperm transfer, specula included |
| mCM rod | ParaTechs | 90050 | Smooth, blunt, with a diameter @3 mm |
| Microscope | Olympus | SZX7 | 20x and 40x magnification with transmitted and reflected illumination source for embryo work and dissections |
| Microscope | ACCU-SCOPE | 3032 | 100x magnification with bright field illumination |
| Microscope slides | Fisher Scientific | 12-544-7 | |
| mNSET device | ParaTechs | 60010 | For embryo transfer, specula included |
| Needles, 26 G | Exel | 26402 | |
| Papanicolaou Staining System | VWR | 76265-730 | Optional |
| Paraffin oil | Sigma-Aldrich | 18512 | |
| Pipette, P200 | Corning | 4074 | Fits the C&I device for sperm transfer |
| Pipette, PR-2 | Rainin | 17008648 | Fits the NSET device for embryo transfer |
| Pregnant Mare Serum Gonadotropin (PMSG) | Prospec | hor-272 | For estrus synchronization |
| Scale | American Weigh Scales | LB-1000 | |
| Scissors | Fine Science Tools | 14068-12 | Dissection |
| Scissors | Fine Science Tools | 14081-09 | Angled, dissection |
| Swabs, Constix | Contec | SC-4 | For vaginal cytology |
| Syringes, 1 cc | Becton Dickenson and Company | 309659 | |
| Tissue culture dishes, 35 mm | Falcon | 353001 | |
| Tissue culture dishes, 60 mm | Falcon | 353004 | |
| Trimmer | Wahl | ChroMini T-Cut | |
| Wire bar topped mouse cage |
References
- Behringer, R., Gertsenstein, M., Nagy, K. V., Nagy, A. . Manipulating the Mouse Embryo: A Laboratory Manual, fourth edition. , (2014).
- Wake, Y., et al. Successful induction of pseudopregnancy using sonic vibration in mice. Scientific Reports. 13 (1), 3604 (2023).
- Stone, B. J., Steele, K. H., Fath-Goodin, A. A rapid and effective nonsurgical artificial insemination protocol using the NSET device for sperm transfer in mice without anesthesia. Transgenic Research. 24 (4), 775-781 (2015).
- Green, M., Bass, S., Spear, B. A device for the simple and rapid transcervical transfer of mouse embryos eliminates the need for surgery and potential post-operative complications. BioTechniques. 47 (5), 919-924 (2009).
- Bin Ali, R., et al. Improved pregnancy and birth rates with routine application of nonsurgical embryo transfer. Transgenic Research. 23 (4), 691-695 (2014).
- Men, H., Stone, B. J., Bryda, E. C. Media optimization to promote rat embryonic development to the blastocyst stage in vitro. Theriogenology. 151, 81-85 (2020).
- Stone, B. J., et al. A nonsurgical embryo transfer technique for fresh and cultured blastocysts in rats. Journal of the American Association for Laboratory Animal Science. 59 (5), 488-495 (2020).
- Steele, K. H., et al. Nonsurgical embryo transfer device compared with surgery for embryo transfer in mice. Journal of the American Association for Laboratory Animal Science. 52 (1), 17-21 (2013).
- Terkel, J., Witcher, J. A., Adler, N. T. Evidence for "memory" of cervical stimulation for the promotion of pregnancy in rats. Hormones and Behavior. 24 (1), 40-49 (1990).
- Kaneko, T., Endo, M., Tsunoda, S., Nakagawa, Y., Abe, H. Simple induction of pseudopregnancy by artificial stimulation using a sonic vibration in rats. Scientific Reports. 10 (1), 2729 (2020).
- Byers, S. L., Wiles, M. V., Dunn, S. L., Taft, R. A. Mouse estrous cycle identification tool and images. PLoS One. 7 (4), e35538 (2012).
- Cora, M. C., Kooistra, L., Travlos, G. Vaginal cytology of the laboratory rat and mouse: Review and criteria for the staging of the estrous cycle using stained vaginal smears. Toxicologic Pathology. 43 (6), 776-793 (2015).
- Luo, C., et al. Superovulation strategies for 6 commonly used mouse strains. Journal of the American Association for Laboratory Animal Science. 50 (4), 471-478 (2011).
- Gates, A. H. Viability and developmental capacity of eggs from immature mice treated with gonadotrophins. Nature. 177 (4512), 754-755 (1956).
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Hasegawa, A., et al. Efficient and scheduled production of pseudopregnant female mice for embryo transfer by estrous cycle synchronization. Journal of Reproduction and Development. 63 (6), 539-545 (2017).
- Beaumont, H. M., Smith, A. F. Embryonic mortality during the pre- and post-implantation periods of pregnancy in mature mice after superovulation. Journal of Reproduction and Fertility. 45 (3), 437-448 (1975).
- Champlin, A. K., Dorr, D. L., Gates, A. H. Determining the stage of the estrous cycle in the mouse by the appearance of the vagina. Biology of Reproduction. 8 (4), 491-494 (1973).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved