Индуцирование ложной беременности у самок мышей без необходимости вазэктомии самцов перед нехирургическим переносом эмбрионов или искусственным оплодотворением
In This Article
Summary
Представленный метод манипуляций с шейкой матки может индуцировать ложную беременность у мышей без необходимости скрещивания самок с самцами, подвергнутыми вазэктомии. Индукция ложной беременности необходима для успешного безоперационного переноса эмбрионов и безоперационного искусственного оплодотворения, которые также представлены.
Abstract
Для успешного сохранения беременности с помощью переноса эмбрионов или искусственного оплодотворения самки мышей-реципиентов должны быть выведены в состояние ложной беременности. Самок мышей традиционно объединяют в пары на ночь с самцами, подвергшимися вазэктомии, а на следующее утро оценивают наличие копулятивной пробки. Для повышения эффективности производства ложных беременных самок была стандартизирована техника манипуляций с шейкой матки для использования в сочетании с нехирургическим переносом эмбрионов или методами искусственного оплодотворения на мышах. Тупой конец маленького пластикового стержня вводится вагинально для контакта с шейкой матки и вибрируется в течение 30 с при контакте с триммером. Процедура проходит быстро и не требует анестезии или обезболивания. Этот метод повышает надежность и предсказуемость получения ложных беременных самок и полностью устраняет необходимость в вазэктомии самцов. Для мышей с CD1 эффективность индукции ложной беременности с использованием манипуляций на шейке матки составила 83% для самок в период течки (N = 76), но только 38% самок в период течки были заглушены самцами, подвергшимися вазэктомии (N = 24). Искусственную инсеминацию у мышей CD1 проводили путем синхронизации течки с гормонами, манипуляций на шейке матки и маточного переноса сперматозоидов. У реципиентов искусственного оплодотворения, получавших манипуляции с шейкой матки (N = 76), частота наступления беременности составила 72%, а средний размер помета составил 8,3 детеныша. Этот метод также может быть использован для получения ложных беременных самок для нехирургического переноса эмбрионов. Таким образом, индуцирование ложной беременности с помощью манипуляций на шейке матки является удобной и эффективной альтернативой спариванию с вазэктомированным самцом при выполнении нехирургических методов вспомогательной репродукции. Использование манипуляций на шейке матки обеспечивает 3R (замена, редукция и уточнение) преимуществ для вспомогательных репродуктивных технологий, уменьшая количество необходимых животных и устраняя необходимость в хирургически измененных самцах.
Introduction
Технологии вспомогательной репродукции используются для производства генетически модифицированных моделей мышей, а также для восстановления штаммов из криоконсервации, редеривации штаммов из скомпрометированного состояния здоровья и стратегического управления виварием, включая производство возрастных когорт. Все методы вспомогательной репродукции на мышах требуют использования ложнобеременных женщин-реципиентов для развития эмбриона. Исторически сложилось так, что реципиенты ложной беременности рождались в результате спаривания со стерильными самцами, которые либо подвергались хирургической вазэктомии, либо генетически бесплодны, и наличие копулятивной пробки оценивалось наследующее утро. Недавно был разработан протокол звуковой стимуляции у мышей для хирургического переноса пронуклеарных или двухклеточных эмбрионов мышей2. Мы также разработали протокол манипуляций с шейкой матки (КМ) для использования при искусственном оплодотворении и безоперационном переносе эмбрионов бластоцист. Обоснование использования процедуры заключается в том, чтобы обеспечить сокращение на 3R количества необходимых животных (больше не требуется самцов мышей) и усовершенствование используемых методов (больше не требующее хирургической процедуры вазэктомии для самцов мышей). Описание этого протокола включает в себя связанную с ним технику вспомогательной репродукции, которая помогает интегрировать КМ в обычные рабочие процессы. Общая цель метода КМ состоит в том, чтобы заменить использование самцов мышей в порождении ложнобеременных самок для вспомогательных репродуктивных методов, включая искусственное оплодотворение и перенос эмбрионов.
Описанный здесь протокол КМ был впервые разработан для помощи в искусственном оплодотворении мышей. Протокол искусственного оплодотворения, как первоначально описывалось, позволил достичь 50% беременности при среднем размере помета 7 детенышей3. У мышей-реципиентов CD1 течка была синхронизирована с низкой дозой гормонов, включая гонадотропин сыворотки крови беременных кобыл (ПМСГ) и хорионический гонадотропин человека (ХГЧ), с интервалом в 47 ч до инсеминации. Преимущество синхронизации течки заключалось в том, что она позволяла использовать протокол в обычное рабочее время. Самки спаривались с вазэктомированными самцами сразу после искусственного осеменения, и спаривание подтверждалось наличием копулятивной пробки. Непостоянство в частоте спаривания с реципиентами было отмечено как трудность процедуры. Поэтому были найдены альтернативы спариванию для индукции ложной беременности.
В настоящем исследовании представлена стандартизированная методика КМ для повышения эффективности получения ложнобеременных самок. У самок в течке или проэструсе тупой конец небольшого пластикового стержня вводится вагинально для контакта с шейкой матки и вибрируется в течение 30 с при контакте с триммером. Процедура проводится на клетке с проволочным верхом. Анестезия или обезболивание не требуются. Метод КМ удобен для получения ложнобеременных самок, которые могут производить пометы после нехирургического искусственного осеменения без необходимости спаривания с вазэктомированными самцами. КМ также может быть использован для производства ложных беременных самок в качестве реципиентов переноса эмбрионов. В частности, техника КМ может сочетаться с нехирургическим переносом эмбрионов, как описано здесь. Показано, что безоперационные методы эффективны при переносе эмбрионов стадии бластоцисты у мышей 4,5и крыс 6,7. Поскольку этот нехирургический метод является эффективной альтернативой хирургическим методам, он считается усовершенствованием техники 3R. Основываясь на предыдущих исследованиях, уровень кортикостерона в кале, как мера стресса, указывает на то, что нехирургический характер процедуры не повышает уровень стресса у грызунов 7,8. Эти процедуры менее технически сложны, чем хирургический перенос эмбрионов, и выполняются намного быстрее. По мере переноса эмбрионов в матку необходимо переносить эмбрионы правильной стадии развития матки. У мышей бластоцисты переносят реципиентам ложной беременности через 2,5 дня после коитума (ДПК).
Для двух нехирургических методов, описанных здесь, время введения гормона и техника КМ различаются. Время проведения процедуры КМ относительно течки имеет важное значение для успеха, так как она заменяет естественное спаривание для рождения реципиентов ложной беременности. Устраняя необходимость в вазэктомии самцов для индуцирования ложной беременности, эта процедура обеспечивает преимущества 3R как за счет уменьшения количества необходимых животных, так и за счет устранения необходимости в хирургически измененных самцах. Сама процедура проходит быстро (30 с) и не требует анестезии или обезболивания. Методика значительно повышает надежность и предсказуемость получения ложнобеременных самок для вспомогательной репродукции.
Protocol
Были соблюдены все применимые международные, национальные и институциональные рекомендации по уходу за животными и их использованию. Все процедуры, проводимые в исследованиях с участием животных, соответствовали этическим стандартам Институционального комитета по уходу за животными и их использованию корпорации ParaTechs и проводились в соответствии со стандартами, продиктованными Управлением по благополучию лабораторных животных, Национальными институтами здравоохранения, Службой общественного здравоохранения, Министерством здравоохранения и социальных служб США. Для настоящего исследования были использованы самцы и самки мышей с CD1(ICR) и самками C57Bl/6J в возрасте >8 недель. Животные были получены из коммерческих источников (см. Таблицу материалов).
1. Процедура манипуляций на шейке матки для использования с искусственным осеменением у мышей CD1
- Синхронизированная овуляция самок мышей на 1-й и 3-й день
- Самкам мышей вводят 2,5 МЕ ПМСГ (см. таблицу материалов) внутрибрюшинной инъекцией (ВП) на 1-й день, за 0,5 ч до начала темнового цикла вивария.
ПРИМЕЧАНИЕ: Каждый мужчина-донор предоставит достаточное количество спермы для 10 женщин-реципиентов. - Самкам вводят 2,5 МЕ ХГЧ (см. таблицу материалов) путем ВМ-инъекции на 3-й день, за 1 ч до начала темнового цикла вивария.
ПРИМЕЧАНИЕ: Время инъекций, переноса сперматозоидов и светового цикла относительно друг друга очень важно. Время, указанное для всех процедур в этом протоколе, основано на 12-часовом цикле света/темноты.
- Самкам мышей вводят 2,5 МЕ ПМСГ (см. таблицу материалов) внутрибрюшинной инъекцией (ВП) на 1-й день, за 0,5 ч до начала темнового цикла вивария.
- Забор и капацитация свежих сперматозоидов на 4 день
- Приготовьте 500 мкл капли прединкубационной среды сперматозоидов (PM, см. таблицу материалов) в 60-миллиметровой чашке для культуры тканей под парафиновым маслом. Приготовьте по одному блюду на одного мужчину-донора. Уравновешивайте в течение не менее 30 минут при температуре 37 °C и 5%CO2 перед сбором спермы.
- Через 1 ч после начала светового цикла вивария усыпьте самца (самцов) в соответствии с рекомендациями учреждения. Каждый самец обеспечит достаточное количество сперматозоидов для 10 искусственных оплодотворений.
- Быстро препарируют придатки хвоста у мыши. Выполните поперечный разрез живота над мочевым пузырем с помощью ножниц для препарирования и зубчатых щипцов.
- Жировые пакеты яичек расположены по обе стороны мочевого пузыря. Захватите одну из жировых комок яичек изогнутыми щипцами и извлеките яичко и придаток яичка из полости тела. Определите хвост придатка яичка как плоскую овальную трубчатую структуру чуть ниже яичка.
- Удерживайте придаток хвоста изогнутыми щипцами и резецируйте маленькими ножницами под углом. Удалите оба придатка хвоста и перенесите их в абсорбирующую ткань для удаления жира и крови под препарирующим микроскопом.
- Поместите два придатка хвоста в каждую каплю 500 мкл равновесной PM под парафиновым маслом при температуре 37 °C. Разрежьте ткань, сделав шесть надрезов с помощью маленьких ножниц. Если используется более одного донора-мужчины, используйте по одному придатку яичка от каждого донора для каждого образца спермы, чтобы уменьшить различия между образцами.
- Осторожно покрутите чашку и дайте сперматозоидам выйти из ткани в течение 3 минут, взбалтывая один раз в минуту. Удалите все ткани.
- Инкубируйте образец спермы от 45 мин до 1 ч при 37 °C и 5%CO2 до емкости.
- Дополнительно: Измерьте количество сперматозоидов и оцените их подвижность под микроскопом с помощью гемоцитометра. Для подсчета разведите сперму в ПМ по мере необходимости.
- Подтверждение синхронизации эстрального цикла с помощью цитологического исследования
- С помощью небольшого, предварительно смоченного тампона (см. таблицу материалов) аккуратно соберите клетки влагалища со стенки влагалища, прокатывая тампон по ткани, намажьте их в 20 мкл стерильной воды на предметном стекле микроскопа и высушите на воздухе.
- Под микроскопом с использованием 100-кратного увеличения при яркопольном освещении оцените наличие ороговевших эпителиальных клеток. У самок с течкой или поздним проэструсом будут присутствовать ороговевшие эпителиальные клетки, которые должны быть отобраны для манипуляций с шейкой матки.
- Необязательно: Запишите вес женщин-реципиентов перед оплодотворением.
- Проведение манипуляции на шейке матки (КМ)
- Примерно за 0,5 ч до осеменения поместите самку-реципиента на верхнюю часть клетки с решеткой, позволяя мыши «захватить» поверхность прутка клетки. Возьмитесь за основание хвоста большим и указательным пальцами и наклоните хвост вверх, стабилизируя животное (Рисунок 1).
ПРИМЕЧАНИЕ: Мышь будет оставаться неподвижной в течение всей процедуры, если техника обработки выполнена правильно. Если мышь смещается, осторожно измените положение и продолжите. Если в качестве реципиента выбрано агрессивное животное, разрешение животному войти в туннель обогащения во время процедуры может быть успокаивающим. Использование туннеля не является обязательным, но оно может помочь исследователям в обращении с животными, отвлекая внимание во время этой процедуры. - Введите тупой конец небольшого пластикового стержня (см. Таблицу материалов) вагинально для контакта с шейкой матки и вибрируйте в течение 30 с при контакте с триммером (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Перед запуском триммера установите стержень на место. Во время процедуры оба держатся в одной руке. Анестезия или обезболивание не требуются.
- Примерно за 0,5 ч до осеменения поместите самку-реципиента на верхнюю часть клетки с решеткой, позволяя мыши «захватить» поверхность прутка клетки. Возьмитесь за основание хвоста большим и указательным пальцами и наклоните хвост вверх, стабилизируя животное (Рисунок 1).
- Безоперационный перенос сперматозоидов для искусственного оплодотворения
- Поместите устройство для осеменения (см. Таблицу материалов) на пипетку P200 объемом 40 мкл и снимите защитную крышку.
- Извлеките аликвоту капативного образца сперматозоидов из чашки при 37 °C и 5% CO2 и перенесите его в чашку для культивирования тканей диаметром 35 мм без масла при 37 °C. Образец спермы будет немедленно использован для переноса.
ПРИМЕЧАНИЕ: Сперматозоиды быстро теряют подвижность вне инкубатораCO2 . По возможности храните образец сперматозоидов при температуре 37 °C и 5%CO2 . - Нажмите на поршень пипетки до первого упора, опустите наконечник катетера в образец спермы при температуре 37 °C и медленно загрузите сперму в устройство для переноса. Избегайте комков. Удалите остатки масла с внешней стороны осеменительного устройства с помощью впитывающей салфетки. Отложите пипетку в сторону.
ПРИМЕЧАНИЕ: Следует избегать попадания парафинового масла в рог матки. Удалите остатки масла с внешней стороны осеменительного устройства с помощью впитывающей салфетки. - Поместите самку-реципиента на верхнюю часть клетки решетки. Удерживайте мышь в нужном положении, используя ту же технику обращения, что и для CM; Возьмитесь за основание хвоста большим и указательным пальцами и наклоните хвост вверх, стабилизируя животное.
- Поместите маленькое зеркальце (см. Таблицу материалов) во влагалище.
- Введите катетер устройства для инсеминации в зеркало, через шейку матки и в матку. Как только концентратор устройства коснется зеркала, выдавите сперму, нажав на поршень пипетки до первого упора. Избегайте попадания лишнего воздуха в рог матки.
ПРИМЕЧАНИЕ: Если катетер расположен неправильно, он ударяется о ткани, окружающие шейку матки, заставляя ее сгибаться и, в конечном итоге, сгибаться. Если катетер не скользит через шейку матки с первой попытки, осторожно вытащите катетер и повторите попытку до тех пор, пока она не увенчается успехом. Может потребоваться изменение положения зеркала. - Снимите прибор и зеркало. Мониторинг после процедуры не требуется.
- Факультативно: проверка на беременность на 10-12 день
- Используйте прибавку в весе для определения статуса беременности. Прибавка в весе будет зависеть от штамма, но увеличение хотя бы на 1-2 г коррелирует с беременностью.
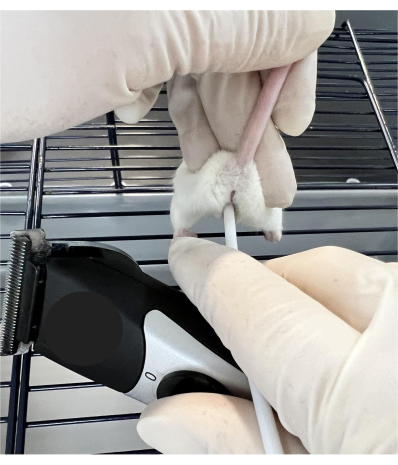
Рисунок 1: Техника удержания мыши для манипуляций с шейкой матки. Мышь опирается на проволочную клетку и стабилизируется на хвосте и с обеих сторон на передней части задних лап. Тупой конец маленького пластикового стержня вводится вагинально для контакта с шейкой матки и вибрирует при контакте с триммером. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
2. Безоперационная процедура переноса эмбрионов для использования при манипуляциях на шейке матки у мышей CD1
- Синхронизированная овуляция самок мышей на 1-й и 3-й день
- Самкам мышей вводят 2,5 МЕ PMSG путем инъекции ВМ на 1-й день, примерно через 6 ч после начала светового цикла вивария.
- Вводят самкам дозу 2,5 МЕ ХГЧ путем внутримышечной инъекции на 3-й день, с интервалом 47 ч после инъекции ПМСГ или примерно через 5 ч после начала светового цикла вивария.
- Подтверждение синхронизации эстрального цикла с помощью цитологического исследования
- На 3-й день, примерно за 1 ч до КМ, проводят цитологическое исследование потенциальных реципиентов. С помощью маленького предварительно смоченного тампона аккуратно соберите клетки влагалища со стенки влагалища, прокатывая тампон по ткани, намажьте их в 20 мкл стерильной воды на предметном стекле микроскопа и высушите на воздухе.
- Под микроскопом с использованием 100-кратного увеличения при яркопольном освещении оцените наличие ороговевших эпителиальных клеток. У самок с течкой или поздним проэструсом будут присутствовать ороговевшие эпителиальные клетки, которые должны быть отобраны для манипуляций с шейкой матки.
- Необязательно: Запишите вес потенциальных реципиентов эмбрионов женского пола.
- Выполнение КМ
- На 3-й день, за 1 ч до начала темного цикла вивария, поместите самку-реципиента на верхнюю часть клетки с помощью решетки, позволив животному «захватить» поверхность прутка клетки. Возьмитесь за основание хвоста указательным и большим пальцами, а затем наклоните хвост вверх, стабилизируя животное (Рисунок 1).
ПРИМЕЧАНИЕ: Мышь будет оставаться неподвижной в течение всей процедуры, если техника обработки выполнена правильно. Если мышь смещается с места, осторожно измените положение и продолжите. Если в качестве реципиента выбрано агрессивное животное, разрешение животному войти в туннель обогащения во время процедуры может быть успокаивающим. - Введите тупой конец маленького пластикового стержня вагинально, чтобы он соприкоснулся с шейкой матки, и вибрируйте его в течение 30 секунд при контакте с триммером.
ПРИМЕЧАНИЕ: Перед запуском триммера установите стержень на место. Во время процедуры оба держатся в одной руке. Анестезия или обезболивание не требуются.
- На 3-й день, за 1 ч до начала темного цикла вивария, поместите самку-реципиента на верхнюю часть клетки с помощью решетки, позволив животному «захватить» поверхность прутка клетки. Возьмитесь за основание хвоста указательным и большим пальцами, а затем наклоните хвост вверх, стабилизируя животное (Рисунок 1).
- Безоперационный перенос эмбрионов на 6-й день
- Поместите каплю 20 мкл среды M2 (см. таблицу материалов) на крышку чашки для культуры тканей.
ПРИМЕЧАНИЕ: Крышка выбрана потому, что она имеет более короткий ободок и, таким образом, удобна для доступа к эмбрионам в капле. Ни в коем случае не наносите парафиновое масло на каплю М2, так как введение масла в рог матки, по-видимому, отрицательно влияет на перенос эмбриона. - Под микроскопом и с помощью отражающего освещения загрузите 10-20 бластоцист в каплю среды с помощью стандартной пипетки для работы с эмбрионами (см. таблицу материалов).
ПРИМЕЧАНИЕ: Оптимальное количество эмбрионов для переноса зависит от линии мыши и любых манипуляций, которым подвергались эмбрионы. Для здоровых необработанных эмбрионов достаточно переноса 10-15 эмбрионов. Для редеривации или генетически модифицированных эмбрионов целесообразн перенос большего количества эмбрионов. - Закрепите нехирургическое устройство для переноса эмбрионов (см. Таблицу материалов) на пипетку P2 объемом 1,8 мкл. Снимите защитную крышку катетера.
- Прижмите поршень пипетки до первого упора, опустите кончик катетера в среду и медленно втяните эмбрионы в наконечник катетера устройства. Снимите наконечник со среды.
ПРИМЕЧАНИЕ: Визуализация эмбрионов при малом увеличении облегчит загрузку эмбрионов в устройство. Если эмбрионы разбросаны в капле, осторожно встряхните чашку из стороны в сторону, чтобы сконцентрировать эмбрионы в центре капли, или переместите их с помощью пипетки для обработки эмбрионов. - Установите объем пипетки на 2,0 мкл, чтобы на кончике катетера образовался небольшой пузырь воздуха. Аккуратно положите пипетку с загруженными эмбрионами рядом с клеткой мыши.
- Поместите самку-реципиента на верхнюю часть клетки решетки. Удерживайте мышь в нужном положении, используя ту же технику обращения, что и для CM; Возьмитесь за основание хвоста указательным и большим пальцами, а затем наклоните хвост вверх, стабилизируя животное.
- Поместите во влагалище небольшое зеркало (см. Таблицу материалов).
- Введите катетер для переноса в зеркало, через шейку матки и в матку. Как только концентратор устройства коснется зеркала, выдавите эмбрионы, нажав поршень пипетки до первого упора. Избегайте попадания лишнего воздуха в рог матки.
- Не отпуская поршень пипетки, снимите прибор и зеркало. Мониторинг после процедуры не требуется.
- Поместите каплю 20 мкл среды M2 (см. таблицу материалов) на крышку чашки для культуры тканей.
Representative Results
Поскольку электрическаястимуляция шейки матки 9 и10 была использована для индуцирования ложной беременности у крыс, в этой работе представлена стандартизированная механическая процедура, которая может быть использована на мышах. Цитология влагалища может помочь в выявлении самок на различных стадиях течки. Для подтверждения ложной беременности у самок использовали этот же метод. Во-первых, сравнивали цитологические профили самок у мышей с CD1 и C57Bl/6 в течение эстральных циклов, во время беременности и во время ложной беременности, индуцированной спариванием или КМ. Мазки из влагалища были взяты у самок и окрашены с помощью системы окрашивания Папаниколау (см. таблицу материалов). Клетки наблюдались при 100-кратном увеличении при освещении в светлом поле. Наблюдаемые клетки включали лейкоциты, клетки ядра эпителия и ануклеатные ороговевшие эпителиальные клетки. Определение стадии эстрального цикла основывалось на относительном процентном соотношении каждого типа клеток11,12. Течка характеризуется преобладанием ороговевших эпителиальных клеток. По мере того, как течка заканчивается, начинается метэструс и начинают появляться лейкоциты, в то время как ороговевшие эпителиальные клетки становятся менее заметными. Диэструс имеет умеренную или низкую клеточность, с преобладанием лейкоцитов и началом появления эпителиальных клеток с ядрами. Проэструс отличается потерей лейкоцитов, увеличением ядросодержащих эпителиальных клеток, появлением ороговевших эпителиальных клеток. После проэструса начинается течка, и цикл продолжается.
Для разработки исходного профиля вагинальная цитология регистрировалась по крайней мере в течение двух полных эстральных циклов для каждой самки (N = 20 для CD1, N = 20 для C57Bl/6) до спаривания. Продолжительность цикла и индивидуальные профили варьировались у разных мышей; Тем не менее, ожидаемые общие тенденции наблюдались. Средняя продолжительность эстрального цикла у мышей CD1 и C57Bl/6 составила 3,8 дня с диапазоном 3-5 дней. За день до естественного спаривания все самки мышей находились в проэструсе. После спаривания цитологическое исследование проводили повторно через 1,5 дня после коитума (ДПК) до возобновления эстрального цикла. На рисунке 2 представлен цитологический профиль ложнобеременных самок CD1 и C57Bl/6, спаренных с вазэктомированными самцами.
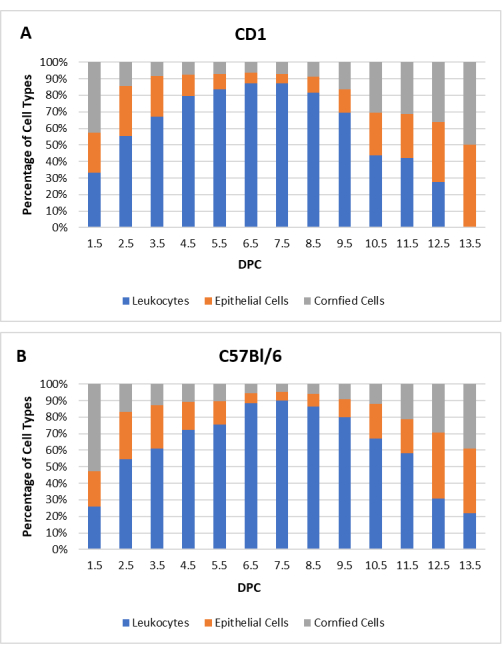
Рисунок 2: Цитологический профиль ложнобеременных самок мышей. Среднее процентное соотношение каждого типа клеток для лейкоцитов, клеток ядра эпителия и ороговевших эпителиальных клеток показано в зависимости от дней после коитума (DPC) для мышей (A) CD1 (N = 20) и (B) C57Bl/6 (N = 20). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
В данной работе была стандартизирована методика КМ для повышения эффективности получения ложнобеременных самок. У самок в течке или проэструсе тупой конец небольшого пластикового стержня вводится вагинально для контакта с шейкой матки и вибрируется в течение 30 с при контакте с триммером. Процедура проводится на клетке с проволочным верхом. Анестезия или обезболивание не требуются. Для определения эффективности процедуры КМ сравнивали цитологию влагалища у самок мышей CD1 (N = 20) и C57Bl/6 (N = 20) после спаривания с самцами, подвергшимися вазэктомии, и после КМ (всего N = 40). Цитологический профиль ложной беременности, индуцированной КМ, был сходен с профилем ложной беременности, индуцированной спариванием, как показано на рисунке 3.
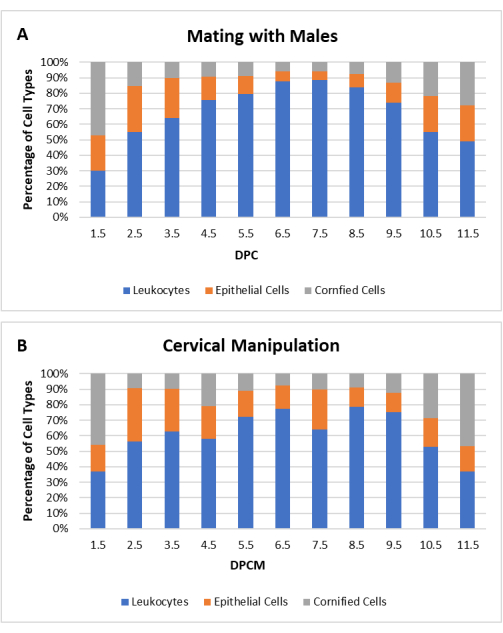
Рисунок 3: Цитологический профиль ложнобеременных самок мышей после манипуляции на шейке матки (СМ). Процентное соотношение лейкоцитов, клеток ядра эпителия и ороговевших эпителиальных клеток каждого типа показано в зависимости от дней после коитума (DPC) или дней после манипуляций с шейкой матки (DPCM). Среднее процентное соотношение типов клеток показано для мышей CD1 и C57Bl/6 (N = 40) (A), спаренных с самцами, подвергшимися вазэктомии, или (B) после CM. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Чтобы определить, является ли техника КМ достаточной для установления беременности для вспомогательной репродукции, КМ была проведена в рамках протокола нехирургического искусственного оплодотворения (НСАИ) у женщин с CD1. Протокол искусственного оплодотворения включал синхронизацию течки самок с низкой дозой гормонов ПМСГ и ХГЧ перед переносом сперматозоидов. КМ проводилась непосредственно перед переносом сперматозоидов. Для мышей с CD1 эффективность индукции ложной беременности с использованием КМ для самок в течку (N = 76) с помощью этой методики составила 83%. В контрольном эксперименте только 38% самок в период течки были заткнуты вазэктомированными самцами (N = 24). Реципиенты искусственного оплодотворения, получавшие манипуляции с шейкой матки (N = 76), имели 72% случаев беременности и средний размер помета 8,3 детенышей. Таким образом, индукция ложной беременности с помощью КМ является удобной и эффективной заменой спариванию с вазэктомированным самцом при проведении НСАИ. Использование КМ для подготовки реципиентов CD1 (N = 4) в период течки к нехирургическому переносу эмбрионов свежих бластоцист CD1 привело к 100% наступлению беременности. Перенос 9-15 эмбрионов дал три здоровых помета с 45% рождаемостью и средним размером помета 6 детенышей. Для сравнения, у реципиентов CD1 (N = 20), которым спаривали вазэктомию самцов для индуцирования ложной беременности, частота наступления беременности составила 80%, а рождаемость – 46% после переноса 20 свежих бластоцист B6C3F2.
Результаты для вспомогательных репродуктивных технологий, вероятно, будут специфичными для штамма, поскольку было обнаружено, что такие переменные, как доза и время введения гормонов для суперовуляции,зависят от штамма. Кроме того, такие факторы, как возраст и вес реципиента, могут влиять на реакцию на гормоны14. В данной работе при выполнении процедуры КМ для искусственного оплодотворения было обнаружено, что восприимчивыми были только самки в позднем проэструсе или течке. В целом, чтобы увеличить число доступных реципиентов в популяции, у женщин сначала синхронизируют течку с низкой дозойгормонов3. Синхронизация течки с 2,5 МЕ ПМСГ и ХГЧ была эффективна на 78% для 11-14-недельных самок с CD1 (N = 27) и 60% для 18-32-недельных самок C57Bl/6 (N = 22). Эффективность индукции ложной беременности с помощью манипуляций на шейке матки у самок с CD1 составила 83% для самок в течку (N = 76) и 82% (N = 100) для самок C57Bl/6 в течку с помощью этой методики.
Discussion
3R — это этическая основа для использования животных в исследованиях, описанная в 1959 году Расселом и Берчем в книге «Принципы гуманной экспериментальной техники»15. 3R представляют собой замену, сокращение и усовершенствование в использовании животных. Протоколы, выделенные здесь, соответствуют 3R. Техника манипуляций с шейкой матки уменьшает количество необходимых животных, так как больше не требует использования самцов для получения ложных беременных самок. Этот метод также устраняет необходимость проведения вазэктомии у мужчин, тем самым обеспечивая утонченность за счет уменьшения боли и дистресса. Описанные здесь методы вспомогательной репродукции (искусственное оплодотворение и перенос эмбрионов) являются нехирургическими, и, таким образом, оба обеспечивают уточнение 3R, уменьшая боль и дистресс, вызванныеих хирургическими альтернативами.
Использование ложнобеременных самок необходимо для восстановления детенышей при проведении вспомогательной репродукции у мышей1. Процедура КМ является эффективным методом получения ложных беременных самок, но синхронизация фазы эстрального цикла самок-реципиентов является критически важным первым шагом в этом процессе. Синхронизация течки может резко сократить количество самок, необходимых в колонии для подготовки потенциальных реципиентов, и помогает производить ложных беременных самок по требованию. Использование низких доз гормонов, по-видимому, не оказывает какого-либо вредного воздействия на восстановление живых пометов у мышей с CD1. При работе с другими штаммами необходимо соблюдать осторожность, чтобы найти комбинацию гормона и концентрации, которая дает наиболее качественных женщин-реципиентов для переносимых эмбрионов или сперматозоидов. Синхронизация может быть достигнута с помощью ПМСГ и ХГЧ16, но дозы, вызывающие суперовуляцию самок, могут быть неподходящими для длительной беременности17.
Чтобы определить, есть ли у самки течка, в данной работе была проведена цитологическая оценка. Фазу течки можно оценить также по наблюдению за входом во влагалище11,18. Хотя этот метод чрезвычайно полезен и может быть использован сам по себе или в качестве подтверждения, он более субъективен, чем использование цитологии. Цитология влагалища без окрашивания является быстрой и эффективной для отбора самок в период течки, поскольку ороговевшие эпителиальные клетки могут быть легко идентифицированы. В этом протоколе цитологическое исследование проводится перед КМ для определения потенциальных реципиентов. Важно провести цитологию перед КМ, так как процедура имеет тенденцию фрагментировать клетки, отшелушивающиеся из области влагалища, что затрудняет идентификацию. Цитологическое исследование на ложную беременность или беременность может быть выполнено через 3,5-11,5 дней после КМ (dpcm) в течение 3 дней подряд. Профиль женщины с циклической течкой должен иметь не менее 1 суток со значительной инфильтрацией ороговевших эпителиальных клеток. У ложнобеременных/беременных самок в течение 3 дней подряд должен наблюдаться диэструсный профиль (в основном лейкоциты с потенциально низким числом клеток).
В ходе разработки метода КМ было обнаружено, что некоторые мыши более восприимчивы к процедуре, чем другие. Самки мышей CD1 являются отличными кандидатами из-за их спокойного характера и отличных инстинктов кормления. Этот сорт прост в обращении и хорошо показывает себя при КМ и нехирургических методах вспомогательной репродукции. Мыши C57Bl/6, как правило, более агрессивны и менее заботливы. Несмотря на то, что этот протокол эффективно производил ложные беременные женщины C57Bl/6 с помощью КМ, они с меньшей вероятностью были последовательно разрешены к процедуре. Это, по-видимому, в некоторой степени коррелировало с фазой течки во время КМ. Самки в период течки или проэструса были более восприимчивы. Использование обогащающей трубки для входа животного обеспечило доступ к влагалищу для процедуры и помогло успокоить самку. Сама процедура не полностью сдерживает самку, поэтому животное может отстраниться в любой момент. Если это происходит, животное можно переместить, и процедуру можно продолжить. Время процедуры останавливается, если самка уходит, и возобновляется, когда процедура возобновляется. Решающее значение для успеха процедуры имеют фаза эстрального цикла (поздний проэструс и течка) и контакт стержня с шейкой матки. Вибрацию триммера обеспечивает стандартизированный КМ. Чтобы обеспечить контакт с шейкой матки, на стержень оказывается мягкое давление, а положение стержня относительно шейки матки обеспечивается небольшими возвратно-поступательными движениями стержня.
Использование КМ улучшило протокол NSAI, так как самки в правильной фазе эстрального цикла могут быть выбраны до переноса сперматозоидов, и протокол больше не зависит от спаривания с самцами, прошедшими вазэктомию. Синхронизация эстрального цикла искусственного оплодотворения рассчитана таким образом, чтобы созревание яйцеклеток соответствовало переносу сперматозоидов утром на 4-й день. Решающее значение для успеха протокола имеет адаптация времени овуляции таким образом, чтобы могло произойти оплодотворение. Необходимо соблюдать осторожность при введении ХГЧ за 15-17 ч до предполагаемого переноса сперматозоидов, как это рекомендуется для времени, используемого для экстракорпорального оплодотворения1. Качество образца спермы напрямую влияет на исход искусственного оплодотворения. Свежие сперматозоиды, которые были очищены, будут работать лучше всего. Криоконсервированная сперма хорошего качества может производить оплодотворенные эмбрионы in vivo. Тем не менее, следует соблюдать осторожность при прямом переносе размороженных сперматозоидов, так как остаточные криопротекторы, перенесенные в рог матки, могут препятствовать имплантации (неопубликованные наблюдения).
Использование КМ в сочетании с переносом эмбрионов концептуально является легкой адаптацией. Синхронизация эстрального цикла уменьшает количество самок, необходимых для создания пула реципиентов. Определение стадии течки до КМ повышает вероятность получения реципиентов ложной беременности. Одним из недостатков метода является то, что цитология реципиентов на момент переноса эмбрионов находится в стадии изменения. Все типы клеток присутствуют, если самка переходит от течки к профилю ложной беременности, и ложная беременность становится очевидной только при отслеживании цитологии в течение нескольких дней. Основываясь на успешности (>80%) перехода от течки к ложной беременности у мышей CD1 и C57Bl/6, этот метод должен быть подходящим для реципиентов переноса эмбрионов. Предварительные результаты показывают хорошие результаты при ограниченном безоперационном переносе эмбрионов. В целом, эффективность безоперационного переноса эмбрионов сопоставима с эффективностью хирургического метода4,5, а безоперационный перенос может заменить хирургический перенос эмбрионов на стадии бластоцисты. Для эмбрионов на ранних стадиях требуется культивирование эмбриона до стадии бластоцисты. Тем не менее, если предпочтительна хирургическая пересадка, можно адаптировать технику КМ к правильному времени, необходимому для соответствующих реципиентов ложной беременности2. Как правило, реципиенты эмбрионов развиваются на 1 день медленнее, чем эмбрион. Например, бластоцисты забирают при 3,5 дпк у доноров и передают реципиентам 2,5 дпк. Поэтому КМ нужно будет проводить так, чтобы реципиент находился в менее развитом состоянии ложной беременности, чем эмбрионы.
В заключение, метод КМ, описанный здесь, показывает отличные перспективы для интеграции с другими методами вспомогательной репродукции у мышей. Мы предоставили успешные протоколы искусственного оплодотворения и переноса эмбрионов с использованием безоперационных методов. В комбинации метод КМ обеспечивает преимущества 3R, в том числе (1) сокращение поголовья животных за счет устранения необходимости в вазэктомии самцов и (2) совершенствование методов путем замены хирургических методов нехирургическими альтернативами.
Disclosures
Барбара Стоун и Сара Сродульски работают в ParaTechs Corporation, Лексингтон, штат Кентукки, США. Компания ParaTechs обладает эксклюзивными лицензионными правами на производство устройства mNSET для мышей. Компания ParaTechs Corp разработала и продает устройства mNSET и mC&I, которые могут быть использованы для нехирургического переноса эмбрионов и нехирургического искусственного оплодотворения соответственно.
Acknowledgements
Исследование, представленное в данной публикации, было поддержано Канцелярией директора Управления программ исследовательской инфраструктуры Национальных институтов здравоохранения под номером R43OD020304 и Национальным институтом психического здоровья Национальных институтов здравоохранения под номером R44MH122117. Содержание является исключительной ответственностью авторов и не обязательно отражает официальную точку зрения Национальных институтов здравоохранения.
Materials
| Name | Company | Catalog Number | Comments |
| Blastocyst stage embryos | |||
| CARD Fertiup Preincubation Medium (PM) | CosmoBio | KYD-002-EX | For sperm capacitation |
| Embryo handling pipette | Cook Medical | K-FPIP-1120-10BS | Flexipet is available in various diameters |
| Embryo handling pipette assembly | Paratechs | 90010 | |
| Female mice, Crl:CD1(ICR) | Charles River Laboratories | 22 | >8 weeks old |
| Forceps | Fine Science Tools | 11053-10 | Toothed, for dissection |
| Forceps | Fine Science Tools | 11052-10 | Curved, for dissection |
| Forceps | Fine Science Tools | Dumont #5 | Fine, for dissection |
| Hemocytometer | Fisher Scientific | 267110 | Optional |
| human Chorionic Gonadotropin (hCG) | Prospec | hor-250 | For estrus synchronization |
| Incubator, 37 °C 5% CO2 | Thermo Scientific | ||
| Incubator, 37 °C, benchtop | Cook | K-MINC-1000 | |
| Kimwipes | Kimberly-Clark | 34155 | Absorbant tissues |
| M2 medium | Millipore | MR-015-D | Embryo handling medium |
| Male mice, Crl:CD1(ICR) | Charles River Laboratories | 22 | >8 weeks old |
| mC&I device | ParaTechs | 60020 | For sperm transfer, specula included |
| mCM rod | ParaTechs | 90050 | Smooth, blunt, with a diameter @3 mm |
| Microscope | Olympus | SZX7 | 20x and 40x magnification with transmitted and reflected illumination source for embryo work and dissections |
| Microscope | ACCU-SCOPE | 3032 | 100x magnification with bright field illumination |
| Microscope slides | Fisher Scientific | 12-544-7 | |
| mNSET device | ParaTechs | 60010 | For embryo transfer, specula included |
| Needles, 26 G | Exel | 26402 | |
| Papanicolaou Staining System | VWR | 76265-730 | Optional |
| Paraffin oil | Sigma-Aldrich | 18512 | |
| Pipette, P200 | Corning | 4074 | Fits the C&I device for sperm transfer |
| Pipette, PR-2 | Rainin | 17008648 | Fits the NSET device for embryo transfer |
| Pregnant Mare Serum Gonadotropin (PMSG) | Prospec | hor-272 | For estrus synchronization |
| Scale | American Weigh Scales | LB-1000 | |
| Scissors | Fine Science Tools | 14068-12 | Dissection |
| Scissors | Fine Science Tools | 14081-09 | Angled, dissection |
| Swabs, Constix | Contec | SC-4 | For vaginal cytology |
| Syringes, 1 cc | Becton Dickenson and Company | 309659 | |
| Tissue culture dishes, 35 mm | Falcon | 353001 | |
| Tissue culture dishes, 60 mm | Falcon | 353004 | |
| Trimmer | Wahl | ChroMini T-Cut | |
| Wire bar topped mouse cage |
References
- Behringer, R., Gertsenstein, M., Nagy, K. V., Nagy, A. . Manipulating the Mouse Embryo: A Laboratory Manual, fourth edition. , (2014).
- Wake, Y., et al. Successful induction of pseudopregnancy using sonic vibration in mice. Scientific Reports. 13 (1), 3604 (2023).
- Stone, B. J., Steele, K. H., Fath-Goodin, A. A rapid and effective nonsurgical artificial insemination protocol using the NSET device for sperm transfer in mice without anesthesia. Transgenic Research. 24 (4), 775-781 (2015).
- Green, M., Bass, S., Spear, B. A device for the simple and rapid transcervical transfer of mouse embryos eliminates the need for surgery and potential post-operative complications. BioTechniques. 47 (5), 919-924 (2009).
- Bin Ali, R., et al. Improved pregnancy and birth rates with routine application of nonsurgical embryo transfer. Transgenic Research. 23 (4), 691-695 (2014).
- Men, H., Stone, B. J., Bryda, E. C. Media optimization to promote rat embryonic development to the blastocyst stage in vitro. Theriogenology. 151, 81-85 (2020).
- Stone, B. J., et al. A nonsurgical embryo transfer technique for fresh and cultured blastocysts in rats. Journal of the American Association for Laboratory Animal Science. 59 (5), 488-495 (2020).
- Steele, K. H., et al. Nonsurgical embryo transfer device compared with surgery for embryo transfer in mice. Journal of the American Association for Laboratory Animal Science. 52 (1), 17-21 (2013).
- Terkel, J., Witcher, J. A., Adler, N. T. Evidence for "memory" of cervical stimulation for the promotion of pregnancy in rats. Hormones and Behavior. 24 (1), 40-49 (1990).
- Kaneko, T., Endo, M., Tsunoda, S., Nakagawa, Y., Abe, H. Simple induction of pseudopregnancy by artificial stimulation using a sonic vibration in rats. Scientific Reports. 10 (1), 2729 (2020).
- Byers, S. L., Wiles, M. V., Dunn, S. L., Taft, R. A. Mouse estrous cycle identification tool and images. PLoS One. 7 (4), e35538 (2012).
- Cora, M. C., Kooistra, L., Travlos, G. Vaginal cytology of the laboratory rat and mouse: Review and criteria for the staging of the estrous cycle using stained vaginal smears. Toxicologic Pathology. 43 (6), 776-793 (2015).
- Luo, C., et al. Superovulation strategies for 6 commonly used mouse strains. Journal of the American Association for Laboratory Animal Science. 50 (4), 471-478 (2011).
- Gates, A. H. Viability and developmental capacity of eggs from immature mice treated with gonadotrophins. Nature. 177 (4512), 754-755 (1956).
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Hasegawa, A., et al. Efficient and scheduled production of pseudopregnant female mice for embryo transfer by estrous cycle synchronization. Journal of Reproduction and Development. 63 (6), 539-545 (2017).
- Beaumont, H. M., Smith, A. F. Embryonic mortality during the pre- and post-implantation periods of pregnancy in mature mice after superovulation. Journal of Reproduction and Fertility. 45 (3), 437-448 (1975).
- Champlin, A. K., Dorr, D. L., Gates, A. H. Determining the stage of the estrous cycle in the mouse by the appearance of the vagina. Biology of Reproduction. 8 (4), 491-494 (1973).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved