Un modello di criolesione per lo studio della rigenerazione muscolare scheletrica del peduncolo caudale nel pesce zebra adulto
In This Article
Summary
Questo protocollo descrive un modello di criolesione per indurre un danno profondo di diversi miomeri caudali nei pesci zebra adulti. Questo metodo fornisce un nuovo approccio per studiare la rigenerazione del muscolo scheletrico dopo una grave perdita di tessuto in vertebrati non mammiferi.
Abstract
Il muscolo scheletrico subisce il rinnovamento e il ripristino dopo lesioni minori attraverso l'attivazione di cellule staminali simili a satelliti. Gravi lesioni della muscolatura spesso portano alla fibrosi negli esseri umani. Rispetto ai mammiferi, i pesci zebra possiedono una maggiore capacità innata di rigenerazione degli organi, fornendo un potente modello per studiare il ripristino dei tessuti dopo un esteso danno all'organo. Qui, viene descritto un modello di criolesione per indurre danni profondi a quattro miomeri del peduncolo caudale nel pesce zebra adulto. Una criosonda su misura è stata progettata per adattarsi alla forma del corpo e ferire in modo riproducibile la muscolatura laterale dalla pelle alla linea mediana. È importante sottolineare che l'integrità del corpo è rimasta intatta e i pesci hanno continuato la loro attività di nuoto. Le modifiche al muscolo scheletrico sono state valutate mediante colorazione istologica e colorazione a fluorescenza delle proteine sarcomeriche su sezioni di tessuto. Questo metodo aprirà nuove strade di ricerca volte a comprendere come la degenerazione del muscolo scheletrico induca risposte riparative e, quindi, la riattivazione del programma miogenico nel pesce zebra adulto.
Introduction
Nei vertebrati, le parti danneggiate di vari tessuti subiscono il rinnovamento omeostatico e il restauro durante la durata della vita. Questa capacità di rinnovamento e ripristino dipende tipicamente dalla presenza di cellule staminali competenti o dalla capacità proliferativa delle cellule mature 1,2. Il muscolo scheletrico comprende miofibre post-mitotiche, che sono associate a cellule staminali locali, chiamate cellule satelliti 3,4,5,6. Pertanto, questo tessuto contiene fonti cellulari per la sigillatura efficiente di aree di continuità interrotta o per la riparazione di ferite minori. Tuttavia, maggiori perdite volumetriche nel muscolo scheletrico dei mammiferi sono spesso seguite da riparazioni non rigenerative, come la fibrosi7. I modelli animali potrebbero fornire nuove informazioni sui meccanismi biologici che promuovono la rigenerazione di organi ampiamente danneggiati.
Il pesce zebra è un organismo modello ben consolidato con un'elevata capacità rigenerativa. Il pesce zebra adulto può rigenerare una parte amputata della pinna caudale o l'apice resecato del ventricolo cardiaco 8,9,10,11. Inoltre, un metodo di criolesione è stato precedentemente applicato per studiare la rigenerazione delle pinne e del cuore nel pesce zebra12,13,14,15. Nel caso degli organi interni, il metodo della criolesione ha il vantaggio di indurre la morte cellulare senza interrompere l'integrità dell'organo, imitando così le condizioni fisiologiche16,17. I detriti tissutali vengono disintegrati dalla clearance naturale durante la guarigione delle ferite, seguita dai processi riparativi. Tuttavia, resta da stabilire se questo metodo possa essere applicato al muscolo scheletrico.
Nei pesci, la muscolatura laterale consente la flessione laterale del tronco durante il nuoto18. I muscoli scheletrici sono organizzati in unità metameriche, chiamate miomeri, che sono separate dal tessuto connettivo 5,19. I pesci zebra possono rigenerare il loro muscolo dopo piccole interruzioni tissutali, come quelle causate dall'ablazione laser o da una ferita da taglio 20,21,22,23,24, ma non è noto se i miomeri interi possano rigenerarsi dopo lesioni estese. Questa lacuna nella conoscenza è probabilmente dovuta alla mancanza di un modello di lesione adatto. Questo protocollo stabilisce un nuovo approccio per indurre lesioni estese del muscolo scheletrico, che abbracciano più miomeri. Il metodo di criolesione descritto si basa sul rapido congelamento e scongelamento delle miofibre con uno strumento in acciaio inossidabile preraffreddato. Nonostante gli ingenti danni, il benessere del pesce non è stato gravemente compromesso. Interi miomeri potrebbero essere ripristinati e, quindi, questo lavoro fornisce un nuovo sistema modello per studiare i meccanismi di rigenerazione della muscolatura nei pesci zebra adulti.
Protocol
Questo studio è stato condotto in accordo con tutte le normative etiche pertinenti. Il pesce zebra è stato allevato, allevato e mantenuto in conformità con le linee guida della Federazione delle associazioni europee di scienza degli animali da laboratorio (FELASA)25. La stabulazione degli animali e tutte le procedure sperimentali sono state approvate dall'ufficio veterinario cantonale di Friburgo, in Svizzera.
1. Attrezzatura e configurazione
- Organizzare la produzione di una criosonda in acciaio inossidabile in un'officina tecnica in grado di produrre strumenti per la ricerca.
NOTA: Fornire un disegno dello strumento con le dimensioni specifiche (Figura 1A). - Per evitare il congelamento durante la manipolazione della sonda durante la procedura, inserire la maniglia in una punta della pipetta e avvolgerla con del nastro adesivo.
- Preparare un becher per la soluzione di lavoro dell'anestesia, un cucchiaio per maneggiare il pesce, una spugna umida e un serbatoio con acqua di sistema per consentire al pesce di riprendersi dopo la procedura.
- Preparare la soluzione di lavoro prima di ogni esperimento. Per preparare la soluzione di lavoro, aggiungere 4 ml di soluzione madre di tricaina a 100 ml di acqua di sistema in un becher.
NOTA: La soluzione madre di anestesia consiste di 4 g di tricaina sciolta in 980 ml di acqua distillata. Dopo aver regolato il pH a 7 con 1 M Tris-HCl, pH 9, riempire la soluzione a 1 L con acqua distillata. La soluzione madre è sensibile alla luce e deve essere conservata a 4 °C in un flacone ambrato.
2. Procedura di criolesione muscolare
- Iniziare la procedura immergendo la sonda in azoto liquido per un minimo di 3 min. Bagnare la spugna in acqua di sistema e posizionarla su una superficie piana.
- Trasferire un singolo pesce zebra adulto nella soluzione di lavoro della tricaina e confermare la sua mancanza di risposta toccando delicatamente il pesce con il cucchiaio dopo 1 minuto o 2 minuti. Se il pesce è ancora reattivo, aspetta ancora un po '.
- Posizionare il pesce anestetizzato sulla spugna bagnata. Localizzare il peduncolo caudale posteriore alla pinna anale e anteriore alla pinna caudale.
- Rimuovere la criosonda dall'azoto liquido. Agitare delicatamente la sonda per assicurarsi che non rimanga azoto liquido residuo sulla punta.
- Posizionare il bordo della spatola perpendicolarmente al corpo sul peduncolo caudale (Figura 1C). Mantenere la sonda in questa posizione per 6 secondi senza applicare pressione (Figura 1D).
NOTA: Il peso della criosonda è sufficiente a garantire il contatto tra lo strumento e il tessuto. - Rilasciare la criosonda dal tessuto e trasferire il pesce nella vasca con acqua di sistema.
- Monitora il pesce mentre riprende a respirare e nuotare dopo essersi svegliato dall'anestesia. Se i movimenti opercolari non si verificano dopo 30 s, stimolare il pesce pipettando l'acqua del sistema nelle branchie fino a quando l'animale inizia la respirazione da solo.
NOTA: Il pesce dovrebbe riprendere a nuotare entro pochi minuti nella vasca di recupero.
NOTA: Nei giorni successivi, i pesci possono essere filmati per monitorare la loro attività di nuoto (Video 1 e Video 2). Prima della registrazione video, trasferire il controllo e i pesci feriti in una vasca di accoppiamento traslucida e lasciarli abituare per almeno 1 minuto.
3. Raccolta e fissazione del peduncolo caudale
- Preparare 2 ml di formalina al 4% o altro fissativo adatto per i test successivi, una piastra di Petri, una pinza e forbici chirurgiche.
- Eutanasia del pesce in un momento selezionato dopo la criolesione secondo il permesso legale dato dall'ufficio veterinario regionale.
NOTA: L'eutanasia viene eseguita da un sovradosaggio di soluzione di tricaina (300 mg / L) per circa 10 minuti. La perdita del movimento branchiale e il riflesso del pizzicamento della pinna caudale confermano la morte. I punti temporali dell'eutanasia dovrebbero essere selezionati in base alla fase di rigenerazione: ad esempio, da 1 giorno post-criolesione (dpci) a 3 dpci per la rimozione della ferita; da 3 dpci a 10 dpci per l'inizio della rigenerazione muscolare; da 10 dpci a 30 dpci per la rigenerazione progressiva; e dopo 30 dpci per il completamento del ripristino dei tessuti. Pertanto, per valutare le diverse fasi e i processi biologici di degenerazione e rigenerazione muscolare, i gruppi di pesci devono essere eutanizzati in vari momenti dopo la criolesione. - Metti il pesce eutanasia in una capsula di Petri contenente acqua deionizzata. Utilizzare le forbici per eseguire un taglio attraverso il corpo anteriormente e posteriormente al peduncolo caudale (Figura 1E). Lascia che il tessuto sanguini nell'acqua deionizzata della capsula di Petri.
- Raccogliere il peduncolo caudale e trasferirlo con una pinza nella soluzione fissativa preparata in un tubo di microcentrifuga.
NOTA: Capovolgere con attenzione i tubi più volte e tenerli per una notte a 4 °C.
4. Montare il peduncolo caudale
- Lavare il fazzoletto fisso in 1x PBS per 10 minuti su un bilanciere. Quindi, trasferirlo in una provetta da microcentrifuga da 2 ml con saccarosio preraffreddato al 30% in acqua deionizzata a 4 °C e capovolgere delicatamente il tubo più volte. Lasciare le provette della microcentrifuga per un minimo di 24 ore a 4 °C in posizione verticale.
NOTA: Il peduncolo caudale galleggerà sopra la soluzione di saccarosio e inizierà ad affondare mentre il tessuto si disidrata. - Riempire uno stampo incorporante con uno strato di 5 mm di supporto di montaggio O.C.T. Utilizzare una pinza per regolare il peduncolo caudale nel mezzo. Posizionalo nella parte inferiore dello stampo e regola il suo orientamento per le sezioni trasversali o coronali (Figura 1F).
- Lasciare congelare il mezzo in una scatola di ghiaccio secco. Non appena il tessuto è stabilizzato nella posizione desiderata, riempire il resto dello stampo prima che l'O.C.T. si congeli completamente. Conservare lo stampo per almeno 1 h a -80 °C.
NOTA: In queste condizioni, i tessuti possono essere conservati per molti mesi.
5. Taglio delle sezioni con un criostato
- Impostare un criostato con uno spessore di taglio di 25 μm. Regolare la temperatura della camera a -26 °C, la temperatura del campione a -24 °C e l'angolo di taglio a 12°.
- Posizionare il blocco congelato con il campione nel criostato e fissare il suo orientamento per tagliare parallelamente al fondo del blocco. Tagliare fino a raggiungere il campione, quindi tagliare il blocco per facilitare la raccolta del campione.
- Preparare sei vetrini di adesione. Etichettare le diapositive con numeri consecutivi per preparare le repliche del campione.
- Inizia a tagliare e raccogli le sezioni di tessuto sui vetrini di adesione etichettati. Disporre le sezioni sulle diapositive secondo le ulteriori richieste sperimentali.
- Lasciare asciugare i vetrini per 1 ora a temperatura ambiente. Conservarli in scatole chiuse a -20 °C.
NOTA: I vetrini possono essere conservati in modo sicuro in queste condizioni per un massimo di 1 anno.
Representative Results
Monitoraggio del pesce dopo criolesione
Per determinare l'effetto della criolesione dei miomeri sugli animali, è stata eseguita una registrazione video del controllo e dei pesci crioferiti a 1 giorni dopo la criolesione (dpci) e 5 dpci. Ogni gruppo conteneva cinque pesci. A 1 dpci, i pesci crioferiti nuotavano meno attivamente, ma non mostravano movimenti anomali, come vortice, convoluzione o equilibrio ridotto (Video 1). Nel sistema di allevamento, la loro posizione nella vasca e l'assunzione di cibo erano simili a quelle dei pesci illesi. Il comportamento normale persisteva nei giorni successivi, come esemplificato dal video a 5 dpci (Video 2). In conclusione, la procedura di criolesione del peduncolo caudale non ha gravemente influenzato il benessere degli animali.
Analisi istologica delle sezioni del peduncolo caudale
Per valutare l'entità della lesione, è stato selezionato il punto temporale di 4 dpci, poiché questo è quando i detriti di miofibra sono stati completamente riassorbiti nella ferita. Per analizzare gli effetti della criolesione lungo gli assi dorso-ventrale e antero-posteriore del corpo, sono stati utilizzati due gruppi di pesci (cioè sezioni coronali e trasversali del peduncolo caudale, rispettivamente) (Figura 1F).
Le sezioni sono state analizzate mediante colorazione tricromatica composta da blu anilina, fucsin acido e arancione G (AFOG). Usando questa combinazione di reagenti, i muscoli intatti sono stati mostrati in arancione, il midollo spinale in rosso scuro e la matrice collagenosa in blu. Per determinare il numero di miomeri danneggiati, che sono le unità metameriche della muscolatura del pesce, sono state analizzate una serie di sezioni (Figura 2). I confini dei miomeri, chiamati miocommata, sono stati identificati dalla deposizione di collagene, come rilevato dalla colorazione blu. Le aree danneggiate sono state determinate dall'assenza di colorazione arancione. Un esame più attento di esemplari con evidenti miocommati ha rivelato che circa quattro miomeri consecutivi erano danneggiati, come dedotto dalla mancanza di colorazione arancione (n, numero di pesci = 4; Figura 3A,A'). Il lato illeso dello stesso pesce serviva come riferimento interno.
Per esaminare la profondità della ferita perpendicolare all'asse del corpo, sono state preparate sezioni trasversali utilizzando zebrafish a 4 dpci e 7 dpci. Quest'ultimo punto temporale corrisponde all'attivazione del programma miogenico e, quindi, all'inizio della rigenerazione muscolare. La colorazione AFOG di questi campioni ha mostrato un'ampia mancanza di colorazione arancione nel fianco criolesionato del corpo, delimitando la zona del muscolo scheletrico degenerato (Figura 3B,C). A 4 dpci e 7 dpci, l'area della ferita si estendeva sui tessuti dalla pelle verso il setto verticale. Ciò dimostra che il metodo di criolesione ha colpito profondamente una metà laterale del peduncolo caudale, che è rimasto privo di muscolo funzionale per 7 giorni dopo la procedura. Presi insieme, quattro miomeri erano profondamente danneggiati su un lato del peduncolo caudale.
Analisi di immunofluorescenza delle sezioni trasversali
Per valutare la dinamica della rigenerazione muscolare, gruppi sperimentali di pesci sono stati eutanizzati a 4 dpci, 7 dpci, 10 dpci e 30 dpci. Le sezioni trasversali del peduncolo caudale sono state marcate mediante colorazione a fluorescenza multicolore usando falloidina (che si lega all'actina filamentosa [F-actina]), l'anticorpo tropomiosina-1, che rileva una proteina sarcomera, e DAPI, che etichetta i nuclei. In tutti i punti temporali, la metà illesa del corpo forniva un controllo interno; sia la F-actina che la tropomiosina 1 sono state fortemente rilevate nelle parti di controllo non danneggiate, indicando tessuto non danneggiato (Figura 4).
A 4 dpci, il lato leso del peduncolo caudale conteneva abbondanti cellule DAPI-positive, ma è stata osservata poca o nessuna immunofluorescenza di F-actina e tropomiosina 1, indicando la zona della ferita con muscoli degenerati (Figura 4A-B'). A 7 dpci, la tropomiosina 1 e la F-actina potrebbero essere rilevate in una parte della ferita vicino alla linea mediana verticale del corpo (Figura 4C-D'). Questo modello di espressione delimita la posizione in cui inizia la formazione di nuove miofibre nel peduncolo caudale. A 10 dpci, entrambi i marcatori muscolari si sono espansi verso la superficie del corpo, suggerendo una progressiva rigenerazione del muscolo scheletrico (Figura 4E-F'). A 30 dpci, entrambi i lati del corpo mostravano una distribuzione simile della colorazione F-actina (Figura 4G-H'). Questa scoperta indica che il muscolo scheletrico è stato ripristinato in modo efficiente dopo la criolesione del peduncolo caudale.
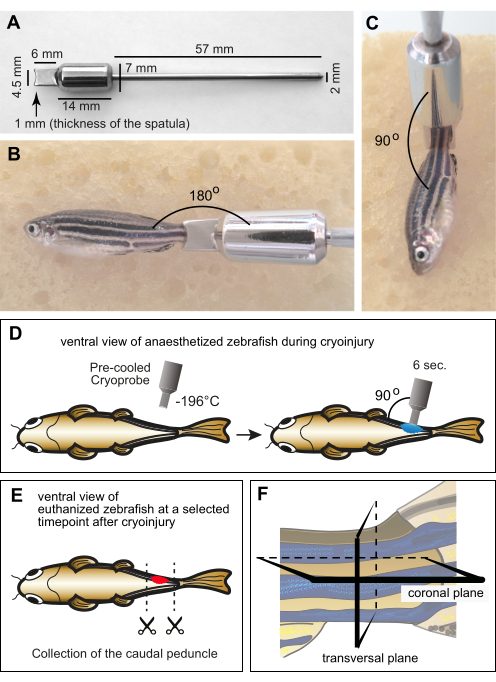
Figura 1: Configurazione sperimentale per la criolesione dei miomeri. (A) Dimensioni della criosonda fabbricata su misura in acciaio inossidabile. La parte distale dello strumento è costituita da una spatola con un bordo concavo alla profondità di 1 mm per tenere conto della curvatura del corpo del pesce zebra. La parte centrale dello strumento comprende un cilindro che funge da peso e un serbatoio per mantenere la bassa temperatura della spatola durante la procedura. L'estremità prossimale dello strumento ha la forma di un sottile manico di metallo. (B,C) Pesce adulto anestetizzato su una spugna umida con la criosonda sul peduncolo caudale. La sonda era a temperatura ambiente. (B) Il margine della sonda è posto orizzontalmente in prossimità del peduncolo caudale per visualizzare la dimensione relativa tra il pesce e l'utensile. (C) Per la criolesione, la punta dell'utensile è posizionata perpendicolarmente al pesce. (D) Illustrazione schematica della procedura di criolesione dal lato ventrale del pesce per mostrare le manipolazioni in modo completo. La criosonda è stata preraffreddata in azoto liquido e immediatamente posizionata su un lato del pesce per 6 s. (E) In un momento specifico dopo la criolesione, i pesci sono stati eutanizzati e i loro peduncoli caudali sono stati raccolti per la fissazione. (F) Il materiale fisso è stato lavorato istologicamente e sezionato lungo i piani coronale o trasversale. Fare clic qui per visualizzare una versione ingrandita di questa figura.
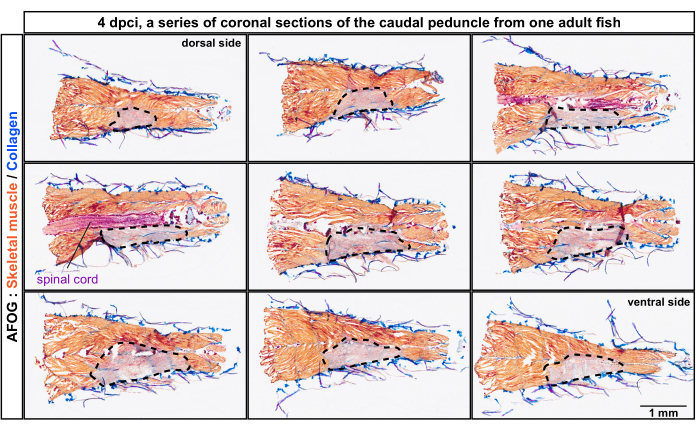
Figura 2: Analisi istologica dei miomeri danneggiati nel peduncolo caudale dalla posizione dorsale a quella ventrale del corpo. Colorazione AFOG di una serie di sezioni coronali a 4 giorni dopo la criolesione (dpci). Le sezioni sono dalla dorsale verso il lato ventrale, come indicato sulla parte superiore del primo e dell'ultimo pannello. Le sezioni non sono adiacenti, con un intervallo di circa 150 μm tra loro. Il muscolo illeso viene rilevato dalla colorazione arancione del muscolo, mentre il tessuto danneggiato manca di questa colorazione e appare grigiastro (area circondata da una linea tratteggiata). I tessuti contenenti collagene, come la pelle, sono colorati in blu. Il midollo spinale appare come una struttura a forma di bastoncino ed è colorato di rosso. Numero di pesci, n = 4. Fare clic qui per visualizzare una versione ingrandita di questa figura.
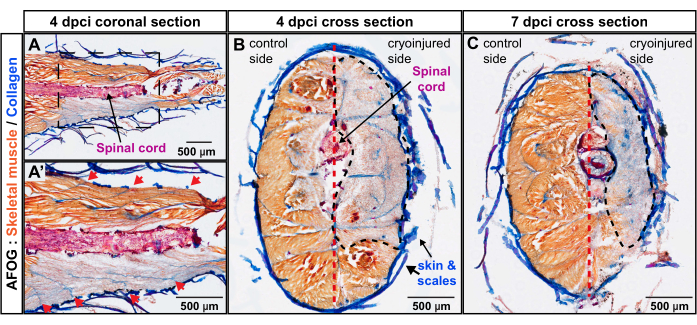
Figura 3: Valutazione della profondità della lesione nel peduncolo caudale mediante colorazione AFOG. (A,A') La sezione coronale è a livello del midollo spinale (un'asta orizzontale macchiata di rosso). L'immagine in basso mostra un'area ingrandita racchiusa da una cornice nell'immagine superiore. I confini sequenziali dei miomeri appaiono come strisce collagene (blu) posizionate obliquamente al midollo spinale (frecce rosse nell'immagine ingrandita A'). (B,C) Le sezioni trasversali mostrano il fianco illeso con muscoli macchiati di arancione e il fianco crioferito con colorazione grigiastra. L'area danneggiata è circondata da una linea tratteggiata nera. Il setto verticale (raffigurato con una linea tratteggiata rossa) suddivide il corpo nei lati di controllo e criolesioni. Numero di pesci, n = 4 per punto temporale. Fare clic qui per visualizzare una versione ingrandita di questa figura.
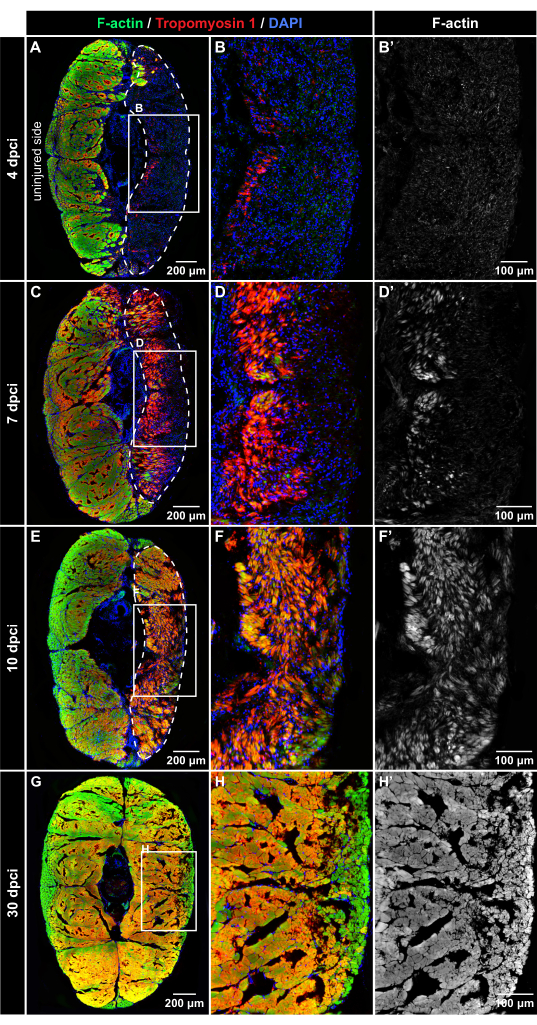
Figura 4: Rilevazione immunofluorescente delle proteine muscolari dopo criolesione. Colorazione a fluorescenza delle sezioni trasversali a 4 dpci, 7 dpci, 10 dpci e 30 dpci, come indicato sul lato sinistro e sulla parte superiore dei pannelli (A-B'). A 4 dpci, il tessuto danneggiato (circondato dalla linea tratteggiata) è DAPI-positivo (blu) ma privo di colorazione falloidina (verde) o immunoreattività della tropomiosina-1 (rosso), suggerendo la degenerazione delle fibre muscolari dopo la criolesione. (C-D') A 7 dpci, entrambi i marcatori muscolari emergono progressivamente nell'area ferita, indicando il processo rigenerativo. La tropomiosina-1 appare più intensa della F-actina nelle fibre appena formate. (E-F') A 10 dpci, la zona di lesione è piena di nuove miofibre che mostrano una maggiore intensità di immunoreattività della tropomiosina-1 rispetto alla F-actina. (G-H') A 30 dpci, un modello simile di miofibre viene rilevato in entrambi i lati del corpo. I fotogrammi nei pannelli A, C, E e H comprendono le aree ingrandite nelle immagini adiacenti a destra. Le squame dermiche, che emanano fluorescenza al di fuori del miomero, sono state cancellate dalle immagini utilizzando Adobe Photoshop. Numero di pesci, n = 4 per punto temporale. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussion
Il pesce zebra fornisce un organismo modello di vertebrato anamniote per studiare i meccanismi di rigenerazione muscolare. La maggior parte dei metodi di lesione esistenti, come l'ablazione laser o la ferita da arma da taglio, provocano una rottura tissutale relativamente minore20,21,22,23. Le resezioni maggiori sono state condotte sul muscolo extraoculare26. Tuttavia, questo approccio chirurgico sarebbe probabilmente meno appropriato per la muscolatura laterale a causa dei rischi per la salute del taglio della parete del corpo. Per evitare tali procedure invasive, questo protocollo descrive una forma più lieve di lesione che, tuttavia, provoca un profondo danno al peduncolo caudale. Questo approccio si basa su una manipolazione superficiale che consente di mirare in modo molto preciso alcuni miomeri su un lato del corpo. I punti di forza del modello di criolesione risiedono nella sua riproducibilità e capacità di produrre un'estesa degenerazione muscolare; Sulla base di questi punti di forza, questo modello fornisce un nuovo percorso per studiare come il corpo reagisce a una significativa perdita muscolare.
L'applicazione del freddo estremo porta a uno shock termico, che distrugge la membrana plasmatica e gli organelli nel tessuto muscolare interessato27. Di conseguenza, le miofibre danneggiate subiscono una morte cellulare "accidentale"28. Di conseguenza, il tessuto danneggiato può essere riassorbito da meccanismi naturali di rimozione della ferita. Il pesce zebra tollera bene la procedura di criolesione, poiché il tasso di sopravvivenza in questo studio era quasi del 100%, dato che la sonda preraffreddata era posizionata correttamente sul corpo per la durata esatta. Tuttavia, se la ferita è troppo estesa (ad esempio, se viene applicata troppa pressione o la durata della criolesione è troppo lunga), il pesce può mostrare movimenti aberranti di nuoto poco dopo la procedura e l'animale dovrebbe essere eutanasia come endpoint umano. Per altre specie ittiche, il tempo di esposizione alla criosonda deve essere regolato in base alle dimensioni del corpo.
Dopo la criolesione, il pesce può riprendere la sua attività di nuoto senza alcun sintomo di movimento anormale. Tuttavia, i pesci crioferiti nuotano meno dinamicamente dei pesci di controllo, il che indica alcune lievi menomazioni. Sarà necessaria un'ulteriore quantificazione del comportamento dei pesci in diversi punti temporali dopo la criolesione per determinare i cambiamenti temporali nelle prestazioni di nuoto.
L'effetto del metodo di criolesione su altri tessuti non muscolari del peduncolo caudale rimane da chiarire. Ovviamente, lo strato corporeo più esterno (cioè la pelle) è danneggiato dalla procedura. In questo contesto, il metodo della criolesione può fornire una nuova strategia per studiare la guarigione delle ferite, la rigenerazione delle incrostazioni e il ripristino del modello di pigmentazione. Inoltre, anche la vascolarizzazione e l'innervazione dei miomeri potrebbero essere influenzate dalla criolesione, e questi argomenti richiedono ulteriori indagini.
Il modello di criolesione è stato precedentemente utilizzato per studiare la rigenerazione del cuore del pesce zebra13,14,15,29. Questo metodo ha mostrato alcuni vantaggi rispetto al metodo di resezione ventricolare10 a causa della deposizione transitoria di una cicatrice ricca di collagene, che imita meglio la risposta di guarigione dell'infarto nell'uomo30. Sorprendentemente, il pesce zebra può rigenerare il loro cuore dopo più criolesioni31. È interessante notare che la criolesione è stata applicata anche alla pinna zebrafish, con conseguenti processi istolitici12. A differenza della classica amputazione delle pinne, il moncone criolesionato rimanente contiene un margine distorto con una miscela di materiale morto e cellule sane. Studi con entrambi gli organi zebrafish, il cuore e la pinna, hanno rivelato la potente capacità del pesce zebra di ripristinare i loro componenti funzionali originali anche dopo un esteso danno tissutale. Se il muscolo scheletrico criolesionato attiva un'interazione tra processi riparativi e rigenerativi giustifica studi futuri.
Disclosures
Gli autori non hanno nulla da rivelare.
Acknowledgements
Ringraziamo V. Zimmermann per la cura dei pesci, così come il Dr. Thomas Bise, la Dr. Catherine Pfefferli e Lea Gigon per l'avvio di questo progetto e i loro risultati preliminari. Questo lavoro è stato sostenuto dal Fondo nazionale svizzero per la ricerca scientifica, numero di sovvenzione 310030_208170.
Materials
| Name | Company | Catalog Number | Comments |
| Program | |||
| ImageJ | National Institutes of Health (NIH) | ||
| Photoshop Version 23.5.3 | Adobe | ||
| Material/ Equipment | |||
| 35/10 mm Petri Dish | Greiner Bio-one | Item No.: 627102 | |
| Camera | Sony | / | HDR-PJ410 |
| Cryostat | Histcom | HRA C50 | |
| Formaldehyde ~36% | Sigma-Aldrich | 47630 | |
| Macro 50 mm f/2.8 EX DG lens | Sigma | / | Discontinued lense |
| Peel-A-Way Embedding Truncated Molds T8 | Polyscience, Inc. | 18985 | |
| Slides Superfrost Plus | Fisher Scientific | 12-550-15 | |
| Sponge | any | any | flat sponge, c.a. 7cm x 3 cm x 1 cm |
| Stainless steel cryoprobe | Custom-made | / | specifics in the article |
| Sucrose | Sigma-Aldrich | 84100 | |
| Surgical scissors | Any | / | |
| TCS SP2 | Leica | / | Discontinoued product |
| Tissue-Tek O.C.T. compound | Sakura Finetek | 4583 | |
| Tricaine (Anestethic) | Sigma | E10521 | |
| Dyes and Antibodies | |||
| Dapi | Sigma | 10236276001 | Concentration: 1/2000 |
| Phalloidin-Atto-565 (F-actin) | Sigma | 94072 | Concentration: 1 / 500 |
| Tropomyosin (TPM1) | DHSB | CH1 | Concentration: 1 / 50 |
| Recipies/Solutions | |||
| 1x PBS | 123 mM NaCl | Sigma | |
| 2.7 mM KCl | Sigma | ||
| 10 mM Na2HPO4 | Sigma | ||
| 1.8 mM KH2PO4 | Sigma | ||
| AFOG solution | 3 g Fuchsin | Fisher Scientific | |
| 2 g Orange G | Sigma | ||
| 1 g Anilin blue | Fulka AG | ||
| 200 ml acifidied distilled H2O (pH 1.1) |
References
- Muneoka, K., Allan, C. H., Yang, X., Lee, J., Han, M. Mammalian regeneration and regenerative medicine. Birth Defects Research Part C: Embryo Today: Reviews. 84 (4), 265-280 (2008).
- Carlson, B. M. Some principles of regeneration in mammalian systems. Anatomical Record. Part B, New Anatomist. 287 (1), 4-13 (2005).
- Dumont, N. A., Bentzinger, C. F., Sincennes, M. -. C., Rudnicki, M. A. Satellite cells and skeletal muscle regeneration. Comprehensive Physiology. 5 (3), 1027-1059 (2015).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692 (2021).
- Tulenko, F. J., Currie, P., Cartner, S. C. Zebrafish myology. The Zebrafish in Biomedical Research. , 115-121 (2020).
- Siegel, A. L., Gurevich, D. B., Currie, P. D. A myogenic precursor cell that could contribute to regeneration in zebrafish and its similarity to the satellite cell. The FEBS Journal. 280 (17), 4074-4088 (2013).
- Corona, B. T., Wenke, J. C., Ward, C. L. Pathophysiology of volumetric muscle loss injury. Cells Tissues Organs. 202 (3-4), 180-188 (2016).
- Pfefferli, C., Jaźwińska, A. The art of fin regeneration in zebrafish. Regeneration. 2 (2), 72-83 (2015).
- Sehring, I. M., Weidinger, G. Recent advancements in understanding fin regeneration in zebrafish. WIREs Developmental Biology. 9 (1), 367 (2020).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298 (5601), 2188-2190 (2002).
- Sanz-Morejón, A., Mercader, N. Recent insights into zebrafish cardiac regeneration. Current Opinion in Genetics & Development. 64, 37-43 (2020).
- Chassot, B., Pury, D., Jaźwińska, A. Zebrafish fin regeneration after cryoinjury-induced tissue damage. Biology Open. 5 (6), 819-828 (2016).
- Chablais, F., Veit, J., Rainer, G., Jaźwińska, A. The zebrafish heart regenerates after cryoinjury-induced myocardial infarction. BMC Developmental Biology. 11, 21 (2011).
- Schnabel, K., Wu, C. C., Kurth, T., Weidinger, G. Regeneration of cryoinjury induced necrotic heart lesions in zebrafish is associated with epicardial activation and cardiomyocyte proliferation. PLoS One. 6 (4), e18503 (2011).
- Gonzalez-Rosa, J. M., Martin, V., Peralta, M., Torres, M., Mercader, N. Extensive scar formation and regression during heart regeneration after cryoinjury in zebrafish. Development. 138 (9), 1663-1674 (2011).
- Ryan, R., Moyse, B. R., Richardson, R. J. Zebrafish cardiac regeneration-Looking beyond cardiomyocytes to a complex microenvironment. Histochemistry and Cell Biology. 154 (5), 533-548 (2020).
- Jaźwińska, A., Sallin, P. Regeneration versus scarring in vertebrate appendages and heart. Journal of Pathology. 238 (2), 233-246 (2016).
- Alexander, R. The orientation of muscle fibres in the myomeres of fishes. Journal of the Marine Biological Association of the United Kingdom. 49, 163-290 (1969).
- Morin-Kensicki, E. M., Melancon, E., Eisen, J. S. Segmental relationship between somites and vertebral column in zebrafish. Development. 129 (16), 3851-3860 (2002).
- Berberoglu, M. A., et al. Satellite-like cells contribute to pax7-dependent skeletal muscle repair in adult zebrafish. Developmental Biology. 424 (2), 162-180 (2017).
- Montandon, M., Currie, P. D., Ruparelia, A. A. Examining muscle regeneration in zebrafish models of muscle disease. Journal of Visualized Experiments. (167), e62071 (2021).
- Pipalia, T. G., et al. Cellular dynamics of regeneration reveals role of two distinct Pax7 stem cell populations in larval zebrafish muscle repair. Disease Models & Mechanisms. 9 (6), 671-684 (2016).
- Ratnayake, D., et al. Macrophages provide a transient muscle stem cell niche via NAMPT secretion. Nature. 591 (7849), 281-287 (2021).
- Kaliya-Perumal, A. -. K., Ingham, P. W. Musculoskeletal regeneration: A zebrafish perspective. Biochimie. 196, 171-181 (2022).
- Aleström, P., et al. Zebrafish: Housing and husbandry recommendations. Laboratory Animals. 54 (3), 213-224 (2019).
- Saera-Vila, A., et al. Myocyte dedifferentiation drives extraocular muscle regeneration in adult zebrafish. Investigative Ophthalmology & Visual Science. 56 (8), 4977-4993 (2015).
- Baust, J. G., Gage, A. A. The molecular basis of cryosurgery. BJU International. 95 (9), 1187-1191 (2005).
- Galluzzi, L., et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death and Differentiation. 25 (3), 486-541 (2018).
- Chablais, F., Jaźwińska, A. Induction of myocardial infarction in adult zebrafish using cryoinjury. Journal of Visualized Experiments. (62), e3666 (2012).
- Chablais, F., Jaźwińska, A. The regenerative capacity of the zebrafish heart is dependent on TGFbeta signaling. Development. 139 (11), 1921-1930 (2012).
- Bise, T., Sallin, P., Pfefferli, C., Jaźwińska, A. Multiple cryoinjuries modulate the efficiency of zebrafish heart regeneration. Scientific Reports. 10 (1), 11551 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved