Криотравмационная модель для изучения регенерации скелетных мышц хвостовой ножки у взрослых рыбок данио-рерио
In This Article
Summary
В этом протоколе описывается модель криотравмы, вызывающая глубокое повреждение нескольких каудальных миомеров у взрослых рыбок данио. Этот метод обеспечивает новый подход к изучению регенерации скелетных мышц после тяжелой потери ткани у позвоночных, не относящихся к млекопитающим.
Abstract
Скелетные мышцы претерпевают обновление и восстановление после незначительной травмы за счет активации сателлитных стволовых клеток. Тяжелые травмы мускулатуры часто приводят к фиброзу у человека. По сравнению с млекопитающими, рыбки данио-рерио обладают более высокой врожденной способностью к регенерации органов, обеспечивая мощную модель для изучения восстановления тканей после обширного повреждения органа. Здесь описана модель криотравмы, вызывающая глубокое повреждение четырех миомеров хвостового цветоноса у взрослых рыбок данио. Изготовленный по индивидуальному заказу криозонд был разработан таким образом, чтобы соответствовать форме тела и воспроизводимо травмировать боковую мускулатуру от кожи до средней линии. Важно отметить, что целостность тела осталась нетронутой, и рыбы продолжили свою плавательную деятельность. Изменения скелетной мускулатуры оценивали с помощью гистологического окрашивания и флуоресцентного окрашивания саркомерных белков на срезах тканей. Этот метод откроет новые направления исследований, направленных на понимание того, как дегенерация скелетных мышц вызывает репаративные реакции и, таким образом, реактивацию миогенной программы у взрослых рыбок данио.
Introduction
У позвоночных поврежденные части различных тканей в течение жизни подвергаются гомеостатическому обновлению и восстановлению. Эта способность к обновлению и восстановлению обычно зависит от наличия компетентных стволовых клеток или пролиферативной способности зрелых клеток 1,2. Скелетные мышцы состоят из постмитотических миоволокон, которые связаны с локальными стволовыми клетками, называемыми сателлитными клетками 3,4,5,6. Таким образом, эта ткань содержит клеточные источники для эффективной герметизации областей прерванной непрерывности или для заживления мелких ран. Однако большие объемные потери в скелетных мышцах млекопитающих часто сопровождаются нерегенеративным восстановлением, таким как фиброз7. Животные модели могут дать новое представление о биологических механизмах, которые способствуют регенерации сильно поврежденных органов.
Рыбка данио-рерио является хорошо зарекомендовавшим себя модельным организмом с высокой регенеративной способностью. Взрослые рыбки данио-рерио могут регенерировать ампутированную часть хвостового плавника или резецированную верхушку сердечного желудочка 8,9,10,11. Кроме того, метод криотравмы ранее применялся для изучения регенерации плавников и сердца у рыбок данио-рерио 12,13,14,15. В случае внутренних органов метод криотравмы имеет то преимущество, что вызывает гибель клеток без нарушения целостности органа, тем самым имитируя физиологические условия16,17. Тканевый мусор распадается естественным клиренсом во время заживления раны, за которым следуют репаративные процессы. Однако еще предстоит выяснить, может ли этот метод быть применен к скелетным мышцам.
У рыб боковая мускулатура позволяет сгибать туловище из стороны в сторону во время плавания18. Скелетные мышцы организованы в метамерные единицы, называемые миомерами, которые разделены соединительной тканью 5,19. Рыбки данио-рерио могут регенерировать свои мышцы после незначительных повреждений тканей, таких как вызванные лазерной абляцией или ножевым ранением 20,21,22,23,24, но могут ли целые миомеры регенерировать после обширной травмы, остается неизвестным. Этот пробел в знаниях, вероятно, связан с отсутствием подходящей модели травмы. Этот протокол устанавливает новый подход к индуцированию обширной травмы скелетных мышц, охватывающей несколько миомеров. Описанный метод криотравмы основан на быстром замораживании и размораживании миоволокон предварительно охлажденным инструментом из нержавеющей стали. Несмотря на обширные повреждения, самочувствие рыб не сильно пострадало. Целые миомеры могут быть восстановлены, и, таким образом, эта работа предоставляет новую модельную систему для изучения механизмов регенерации мускулатуры у взрослых рыбок данио.
Protocol
Это исследование было проведено в соответствии со всеми соответствующими этическими нормами. Рыбки данио-рерио были выведены, выращены и содержались в соответствии с руководящими принципами Федерации европейских ассоциаций лабораторных животных (FELASA)25. Содержание животных и все экспериментальные процедуры были одобрены кантональным ветеринарным управлением Фрибурга, Швейцария.
1. Оборудование и настройка
- Организовать производство криозонда из нержавеющей стали в технической мастерской, которая может изготовить приборы для исследований.
ПРИМЕЧАНИЕ: Предоставьте конструкцию прибора с конкретными размерами (рис. 1А). - Чтобы избежать обморожения при обращении с зондом во время процедуры, вставьте ручку в наконечник пипетки и обмотайте его скотчем.
- Подготовьте стакан для анестезиологического рабочего раствора, ложку для работы с рыбой, влажную губку и резервуар с системной водой, чтобы рыба могла прийти в себя после процедуры.
- Готовьте рабочий раствор свежо перед каждым экспериментом. Для приготовления рабочего раствора добавьте 4 мл исходного раствора трикаина на 100 мл системной воды в стакане.
ПРИМЕЧАНИЕ: Исходный раствор для анестезии состоит из 4 г трикаина, растворенного в 980 мл дистиллированной воды. После регулировки рН до 7 с 1 М Tris-HCl, рН 9, залейте раствор до 1 л дистиллированной водой. Исходный раствор светочувствителен и должен храниться при температуре 4 ° C в янтарной бутылке.
2. Процедура криотравмы мышц
- Начните процедуру с погружения зонда в жидкий азот минимум на 3 минуты. Смочите губку в системной воде и положите ее на ровную поверхность.
- Перенесите одну взрослую рыбку данио-рерио в рабочий раствор трикаина и подтвердите ее невосприимчивость, осторожно прикоснувшись к рыбе ложкой через 1 или 2 минуты. Если рыба все еще реагирует, подождите еще немного.
- Поместите обезболиваемую рыбу на влажную губку. Расположите хвостовой цветонос кзади от анального плавника и спереди от хвостового плавника.
- Извлеките криозонд из жидкого азота. Осторожно встряхните зонд, чтобы убедиться, что на наконечнике не осталось остатков жидкого азота.
- Расположите край шпателя перпендикулярно телу на хвостовом цветоносе (рисунок 1В). Удерживайте зонд в таком положении в течение 6 с, не оказывая давления (рис. 1D).
ПРИМЕЧАНИЕ: Вес криозонда достаточен для обеспечения контакта между инструментом и тканью. - Освободите криозонд от ткани и перенесите рыбу в резервуар с системной водой.
- Следите за рыбой, пока она возобновляет дыхание и плавание после пробуждения от наркоза. Если оперкулярные движения не происходят через 30 с, стимулируйте рыбу пипеткой системы воды в жабры до тех пор, пока животное не начнет дыхание самостоятельно.
ПРИМЕЧАНИЕ: Рыба должна возобновить плавание в течение нескольких минут в резервуаре для восстановления.
ПРИМЕЧАНИЕ: В последующие дни рыб можно снимать на видео, чтобы следить за их плавательной активностью (Видео 1 и Видео 2). Перед видеозаписью перенесите контрольную и раненую рыбу в полупрозрачный брачный резервуар и дайте им привыкнуть не менее 1 минуты.
3. Сбор и фиксация хвостового цветоноса
- Приготовьте 2 мл 4% формалина или другого фиксатора, подходящего для последующих анализов, чашку Петри, щипцы и хирургические ножницы.
- Усыпьте рыбу в выбранный момент времени после криотравмы в соответствии с юридическим разрешением, выданным региональным ветеринарным управлением.
ПРИМЕЧАНИЕ: Эвтаназия проводится путем передозировки раствора трикаина (300 мг / л) в течение примерно 10 минут. Потеря жаберного движения и рефлекс защемления хвостового плавника подтверждают смерть. Временные моменты эвтаназии следует выбирать в соответствии с фазой регенерации: например, от 1 дня после криотравмы (ДПКИ) до 3 ДПКИ для очищения раны; от 3 dpci до 10 dpci для инициации регенерации мышц; от 10 dpci до 30 dpci для прогрессирующей регенерации; и после 30 dpci для завершения восстановления тканей. Таким образом, чтобы оценить различные этапы и биологические процессы мышечной дегенерации и регенерации, группы рыб должны быть усыплены в разные моменты времени после криотравмы. - Поместите усыпленную рыбу в чашку Петри, содержащую деионизированную воду. С помощью ножниц выполните разрез тела спереди и сзади хвостовой ножки (рис. 1E). Дайте ткани просочиться в деионизированной воде чашки Петри.
- Соберите хвостовую ножку, и перенесите ее щипцами в приготовленный фиксирующий раствор в микроцентрифужной пробирке.
ПРИМЕЧАНИЕ: Осторожно переверните пробирки несколько раз и оставьте их на ночь при температуре 4 ° C.
4. Монтаж хвостового цветоноса
- Постирайте неподвижную салфетку в 1x PBS в течение 10 минут на коромысле. Затем переложите его в микроцентрифужную пробирку объемом 2 мл с предварительно охлажденной 30% сахарозой в деионизированной воде при 4 ° C и осторожно переверните пробирку несколько раз. Оставьте микроцентрифужные пробирки минимум на 24 часа при температуре 4 °C в вертикальном положении.
ПРИМЕЧАНИЕ: Хвостовой цветонос будет плавать поверх раствора сахарозы и начнет опускаться по мере обезвоживания ткани. - Заполните форму для встраивания 5-миллиметровым слоем монтажной среды O.C.T. С помощью щипцов отрегулируйте хвостовой цветонос в среде. Поместите его в нижнюю часть формы и отрегулируйте его ориентацию для поперечных или корональных сечений (рис. 1F).
- Дайте среде застыть в коробке с сухим льдом. Как только ткань стабилизируется в желаемом положении, заполните остальную часть формы до того, как O.C.T. полностью замерзнет. Храните форму не менее 1 часа при температуре -80 °C.
ПРИМЕЧАНИЕ: При таких условиях ткани могут храниться в течение многих месяцев.
5. Резка срезов криостатом
- Установите криостат с толщиной резки 25 мкм. Отрегулируйте температуру камеры до −26 °C, температуру образца до −24 °C и угол резания до 12°.
- Поместите замороженный блок с образцом в криостат и зафиксируйте его ориентацию, чтобы разрезать параллельно нижней части блока. Разрежьте, пока не дойдете до образца, а затем обрежьте блок, чтобы облегчить сбор образцов.
- Подготовьте шесть предметных стекол для адгезии. Пометьте слайды последовательными номерами, чтобы подготовить повторы образца.
- Начните резку и соберите срезы ткани на маркированных адгезионных предметах. Расположите разделы на слайдах в соответствии с дальнейшими экспериментальными требованиями.
- Дайте предметным стеклам высохнуть в течение 1 ч при комнатной температуре. Хранят в закрытых ящиках при температуре −20 °C.
ПРИМЕЧАНИЕ: Предметные стекла можно безопасно хранить в таком состоянии до 1 года.
Representative Results
Наблюдение за рыбой после криотравмы
Для определения влияния миомерной криотравмы на животных была выполнена видеозапись контрольной и криотравмированной рыб через 1 сутки после криотравмы (dpci) и 5 dpci. Каждая группа содержала по пять рыб. При 1 dpci криотравмированные рыбы плавали менее активно, но они не проявляли каких-либо аномальных движений, таких как завихрение, свертка или снижение равновесия (Видео 1). В системе животноводства их положение в аквариуме и потребление пищи были аналогичны положениям неповрежденных рыб. Нормальное поведение сохранялось в течение следующих дней, о чем свидетельствует видео с разрешением 5 dpci (Видео 2). В заключение, процедура криотравмы хвостового цветоноса не сильно повлияла на самочувствие животных.
Гистологический анализ срезов хвостовой ножки
Для оценки степени травмы был выбран временной момент 4 dpci, так как именно в это время обломки миоволокна полностью рассасывались в ране. Для анализа эффектов криотравмы вдоль дорсо-вентральной и передне-задней осей тела были использованы две группы рыб (т.е. корональный и поперечный срезы хвостовой ножки соответственно) (рис. 1F).
Срезы анализировали методом трихромного окрашивания, состоящего из анилинового синего, кислотного фуксина и оранжевого G (AFOG). Используя эту комбинацию реагентов, интактные мышцы были показаны оранжевым цветом, спинной мозг - темно-красным, а коллагеновый матрикс - синим. Для определения количества поврежденных миомеров, являющихся метамерными единицами мускулатуры рыб, был проанализирован ряд срезов (рис. 2). Границы миомеров, называемые миокомматами, были идентифицированы по отложению коллагена, что было обнаружено по синей окраске. Поврежденные участки определяли по отсутствию оранжевого окрашивания. Более тщательное изучение образцов с явными миокомматами показало, что было повреждено примерно четыре последовательных миомера, о чем свидетельствует отсутствие оранжевого окрашивания (n, количество рыб = 4; Рисунок 3А,А'). Неповрежденная сторона той же рыбы служила внутренним ориентиром.
Для исследования глубины раны, перпендикулярной оси тела, были подготовлены поперечные срезы с использованием рыбок данио-рерио при 4 dpci и 7 dpci. Последний временной отрезок соответствует активации миогенной программы и, таким образом, началу регенерации мышц. Окрашивание этих образцов AFOG показало обширное отсутствие оранжевого окрашивания в криоповрежденной боковой части тела, разграничив зону дегенерированных скелетных мышц (рис. 3B, C). При 4 dpci и 7 dpci область раны охватывала ткани от кожи до вертикальной перегородки. Это свидетельствует о том, что метод криотравмы был глубоко нацелен на одну боковую половину хвостовой ножки, которая оставалась лишенной функциональной мышцы в течение 7 дней после процедуры. Взятые вместе, четыре миомера были глубоко повреждены с одной стороны хвостового цветоноса.
Иммунофлуоресцентный анализ поперечных срезов
Для оценки динамики регенерации мышц экспериментальные группы рыб были усыплены при 4 dpci, 7 dpci, 10 dpci и 30 dpci. Поперечные срезы каудальной ножки были помечены многоцветным флуоресцентным окрашиванием с использованием фаллоидина (который связывается с нитевидным актином [F-актин]), антитела тропомиозина-1, которое обнаруживает белок саркомера, и DAPI, который мечет ядра. Во все моменты времени неповрежденная половина тела обеспечивала внутренний контроль; как F-актин, так и тропомиозин 1 были сильно обнаружены в неповрежденных контрольных частях, что указывает на неповрежденную ткань (рис. 4).
При 4 dpci поврежденная сторона хвостовой ножки содержала обильные DAPI-положительные клетки, но практически не наблюдалось иммунофлуоресценции F-актина и тропомиозина 1, что указывает на раневую зону с дегенерированными мышцами (рис. 4A-B'). При 7 dpci тропомиозин 1 и F-актин могут быть обнаружены в части раны, близкой к вертикальной средней линии тела (рис. 4C-D'). Этот паттерн экспрессии разграничивает положение, в котором начинается образование новых миоволокон в хвостовой ножке. При 10 dpci оба мышечных маркера расширялись к поверхности тела, что свидетельствует о прогрессирующей регенерации скелетных мышц (рис. 4E-F'). При 30 dpci обе стороны тела демонстрировали одинаковое распределение окрашивания F-актином (рис. 4G-H'). Это открытие указывает на то, что скелетная мышца была эффективно восстановлена после криотравмы хвостовой ножки.
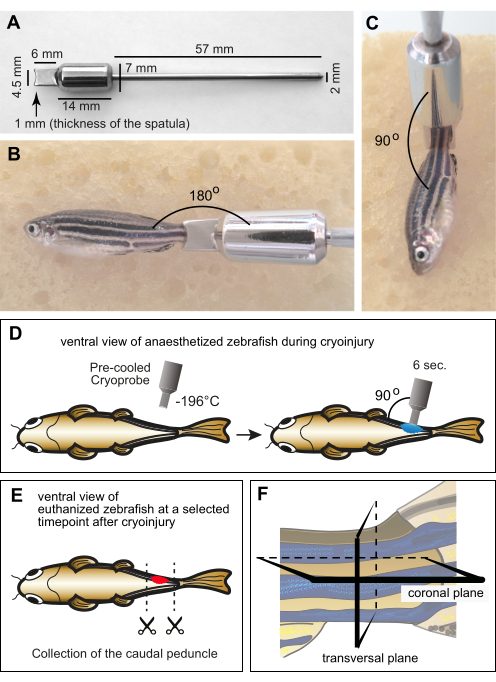
Рисунок 1: Экспериментальная установка для криотравмы миомер. (A) Размеры изготовленного по индивидуальному заказу криозонда из нержавеющей стали. Дистальная часть прибора состоит из шпателя с вогнутым краем на глубине 1 мм для учета кривизны тела рыбки данио. Средняя часть инструмента содержит цилиндр, который функционирует как груз и резервуар для поддержания низкой температуры шпателя во время процедуры. Проксимальный конец инструмента выполнен в виде тонкой металлической рукоятки. (В,В) Взрослую рыбу обезболивают влажной губкой с помощью криозонда на хвостовом цветоносе. Зонд находился при комнатной температуре. (B) Край зонда размещается горизонтально в непосредственной близости от хвостового цветоноса для отображения относительного размера между рыбой и инструментом. (C) При криотравме наконечник инструмента располагается перпендикулярно рыбе. (D) Схематическая иллюстрация процедуры криотравмы с брюшной стороны рыбы, чтобы показать манипуляции всесторонним образом. Криозонд предварительно охлаждали в жидком азоте и сразу же помещали на одну сторону рыбы на 6 с. (E) В определенный момент времени после криотравмы рыб усыпляли, а их хвостовые цветоносы собирали для фиксации. (F) Фиксированный материал был гистологически обработан и разрезан вдоль корональной или поперечной плоскостей. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
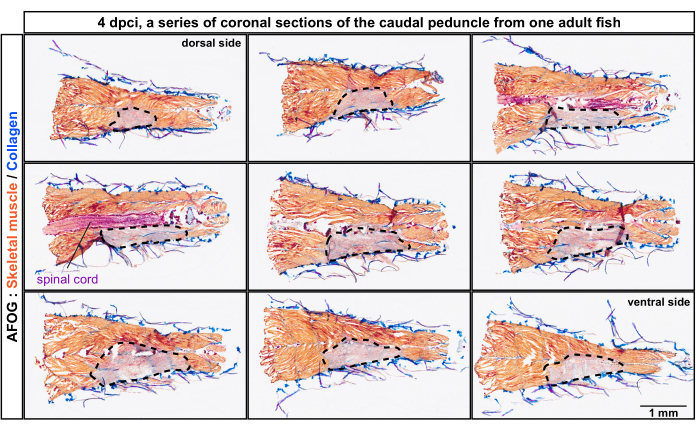
Рисунок 2: Гистологический анализ поврежденных миомеров в хвостовой ножке от дорсального до вентрального положения тела. Окрашивание AFOG серии корональных срезов через 4 дня после криотравмы (dpci). Срезы расположены от дорсальной к брюшной стороне, как показано в верхней части первой и последней панели. Срезы несмежные, с интервалом примерно 150 мкм между ними. Неповрежденная мышца обнаруживается по оранжевому окрашиванию мышцы, тогда как поврежденная ткань не имеет этого окрашивания и выглядит сероватой (область, обведенная пунктирной линией). Коллагенсодержащие ткани, такие как кожа, окрашиваются в синий цвет. Спинной мозг выглядит как палочковидная структура и окрашен в красный цвет. Количество рыб, n = 4. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
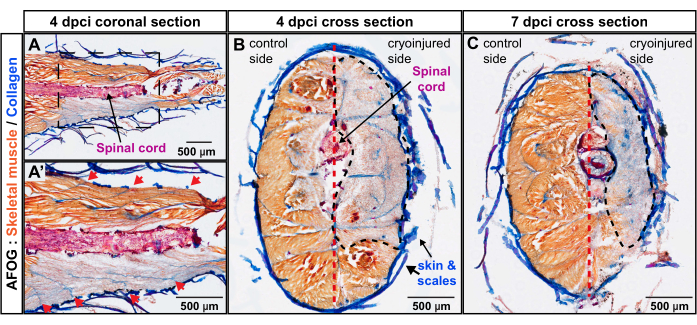
Рисунок 3: Оценка глубины повреждения хвостового цветоноса с помощью окрашивания AFOG. (А,А') Коронковый отдел находится на уровне спинного мозга (окрашенный в красный цвет горизонтальный стержень). На нижнем изображении показана увеличенная область, окруженная рамкой на верхнем изображении. Последовательные границы миомер выглядят как коллагеновые полосы (синие), расположенные наискось к спинному мозгу (красные стрелки на увеличенном изображении A'). (В,В) Поперечные срезы показывают неповрежденный бок с оранжевыми мышцами и криотравмированный бок с сероватым окрашиванием. Поврежденный участок обведен черной пунктирной линией. Вертикальная перегородка (изображена красной пунктирной линией) подразделяет тело на контрольную и криотравмированную стороны. Количество рыб, n = 4 за момент времени. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
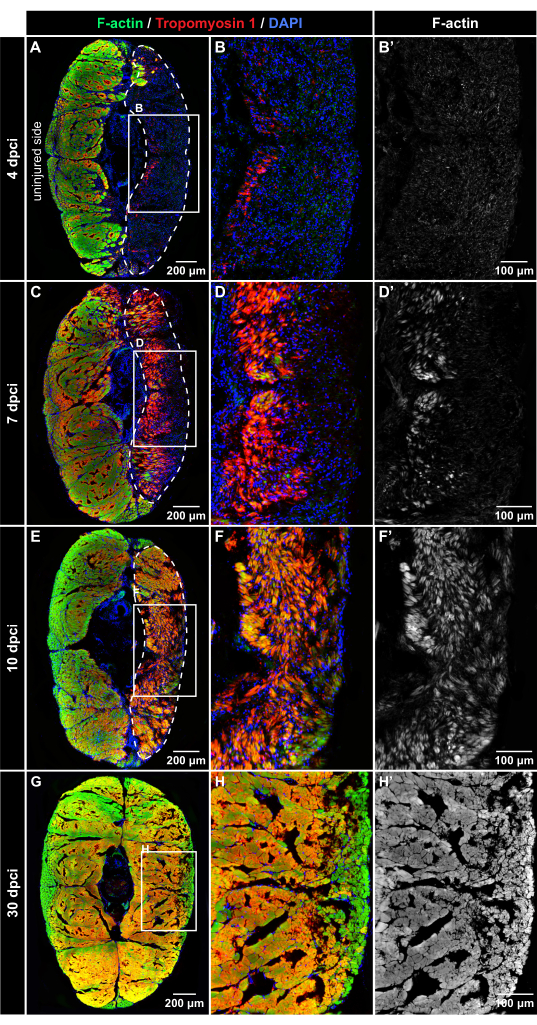
Рисунок 4: Иммунофлюоресцентное обнаружение мышечных белков после криотравмы. Флуоресцентное окрашивание поперечных сечений при 4 dpci, 7 dpci, 10 dpci и 30 dpci, как указано на левой стороне и верхней части панелей (A-B'). При 4 dpci поврежденная ткань (обведенная пунктирной линией) является DAPI-положительной (синий), но лишен окрашивания фаллоидином (зеленый) или иммунореактивности тропомиозина-1 (красный), что указывает на дегенерацию мышечных волокон после криотравмы. (К-Д') При 7 dpci оба мышечных маркера постепенно появляются в раненой области, что указывает на регенеративный процесс. Тропомиозин-1 проявляется более интенсивно, чем F-актин во вновь образованных волокнах. (Е-Ж') При 10 dpci зона повреждения заполняется новыми миоволокнами, которые проявляют более высокую интенсивность иммунореактивности тропомиозина-1 по сравнению с F-актином. (Б-Г') При 30 dpci обнаруживается одинаковая картина миоволокон с обеих сторон тела. Кадры на панелях A, C, E и H охватывают области, увеличенные на соседних изображениях справа. Кожные чешуйки, излучающие флуоресценцию за пределами миомера, были стерты с изображений с помощью Adobe Photoshop. Количество рыб, n = 4 за момент времени. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Discussion
Рыбка данио-рерио представляет собой модельный организм позвоночных для изучения механизмов регенерации мышц. Большинство существующих методов травматизма, таких как лазерная абляция или колотые ранения, приводят к относительно незначительному разрушению тканей20,21,22,23. Были проведены обширные резекции экстраокулярной мышцы26. Тем не менее, этот хирургический подход, вероятно, будет менее подходящим для боковой мускулатуры из-за опасности для здоровья разрезания стенки тела. Чтобы избежать таких инвазивных процедур, в этом протоколе описывается более легкая форма травмы, которая, тем не менее, приводит к глубокому повреждению хвостовой ножки. Этот подход основан на поверхностной манипуляции, которая позволяет очень точно нацелиться на несколько миомеров на одной стороне тела. Сильные стороны модели криотравмы заключаются в ее воспроизводимости и способности вызывать обширную мышечную дегенерацию; Основываясь на этих сильных сторонах, эта модель открывает новый путь для изучения того, как организм реагирует на значительную потерю мышечной массы.
Применение сильного холода приводит к тепловому удару, который разрушает плазматическую мембрану и органеллы в пораженной мышечной ткани27. В результате поврежденные миоволокна подвергаются «случайной» гибели клеток28. Следовательно, поврежденная ткань может быть резорбирована естественными механизмами очищения раны. Рыбки данио-рерио хорошо переносят процедуру криотравмы, так как выживаемость в этом исследовании составила почти 100%, учитывая, что предварительно охлажденный зонд был правильно расположен на теле в течение точного времени. Однако, если рана слишком обширна (например, если применяется слишком большое давление или продолжительность криотравмы слишком велика), рыба может проявлять аберрантные плавательные движения вскоре после процедуры, и животное должно быть усыплено в качестве гуманной конечной точки. Для других видов рыб время воздействия криозонда должно быть скорректировано в соответствии с размером тела.
После криотравмы рыба может возобновить свою плавательную деятельность без каких-либо симптомов аномального движения. Однако криотравмированные рыбы плавают менее динамично, чем контрольные рыбы, что указывает на некоторые легкие нарушения. Дальнейшая количественная оценка поведения рыб в разные моменты времени после криотравмы будет необходима для определения временных изменений в плавательных характеристиках.
Влияние метода криотравмы на другие немышечные ткани хвостовой ножки еще предстоит выяснить. Очевидно, что самый внешний слой тела (т.е. кожа) повреждается процедурой. В этом контексте метод криотравмы может обеспечить новую стратегию изучения заживления ран, регенерации чешуи и восстановления рисунка пигментации. Кроме того, сосудистая сеть и иннервация миомеров также могут быть затронуты криотравмой, и эти темы требуют дальнейшего изучения.
Модель криотравмы ранее использовалась для исследования регенерации сердца рыбок данио-рерио13,14,15,29. Этот метод показал некоторые преимущества по сравнению с методом резекции желудочков10 из-за преходящего отложения богатого коллагеном рубца, который лучше имитирует реакцию заживления инфаркта у человека30. Примечательно, что рыбки данио-рерио могут регенерировать свое сердце после множественных криотравм31. Интересно, что криотравма также была применена к плавнику рыбки данио, что привело к гистолическим процессам12. В отличие от классической ампутации плавника, оставшаяся криотравмированная культя содержит искаженный край со смесью мертвого материала и здоровых клеток. Исследования обоих органов рыбок данио, сердца и плавника, показали мощную способность рыбок данио-рерио восстанавливать свои первоначальные функциональные компоненты даже после обширного повреждения тканей. Вопрос о том, активирует ли криотравмированная скелетная мышца взаимодействие между репаративными и регенеративными процессами, требует будущих исследований.
Disclosures
Авторам раскрывать нечего.
Acknowledgements
Мы благодарим В. Циммермана за уход за рыбами, а также доктора Томаса Бизе, доктора Кэтрин Пфефферли и Леа Гигон за инициирование этого проекта и их предварительные результаты. Эта работа была поддержана Швейцарским национальным научным фондом, грант No 310030_208170.
Materials
| Name | Company | Catalog Number | Comments |
| Program | |||
| ImageJ | National Institutes of Health (NIH) | ||
| Photoshop Version 23.5.3 | Adobe | ||
| Material/ Equipment | |||
| 35/10 mm Petri Dish | Greiner Bio-one | Item No.: 627102 | |
| Camera | Sony | / | HDR-PJ410 |
| Cryostat | Histcom | HRA C50 | |
| Formaldehyde ~36% | Sigma-Aldrich | 47630 | |
| Macro 50 mm f/2.8 EX DG lens | Sigma | / | Discontinued lense |
| Peel-A-Way Embedding Truncated Molds T8 | Polyscience, Inc. | 18985 | |
| Slides Superfrost Plus | Fisher Scientific | 12-550-15 | |
| Sponge | any | any | flat sponge, c.a. 7cm x 3 cm x 1 cm |
| Stainless steel cryoprobe | Custom-made | / | specifics in the article |
| Sucrose | Sigma-Aldrich | 84100 | |
| Surgical scissors | Any | / | |
| TCS SP2 | Leica | / | Discontinoued product |
| Tissue-Tek O.C.T. compound | Sakura Finetek | 4583 | |
| Tricaine (Anestethic) | Sigma | E10521 | |
| Dyes and Antibodies | |||
| Dapi | Sigma | 10236276001 | Concentration: 1/2000 |
| Phalloidin-Atto-565 (F-actin) | Sigma | 94072 | Concentration: 1 / 500 |
| Tropomyosin (TPM1) | DHSB | CH1 | Concentration: 1 / 50 |
| Recipies/Solutions | |||
| 1x PBS | 123 mM NaCl | Sigma | |
| 2.7 mM KCl | Sigma | ||
| 10 mM Na2HPO4 | Sigma | ||
| 1.8 mM KH2PO4 | Sigma | ||
| AFOG solution | 3 g Fuchsin | Fisher Scientific | |
| 2 g Orange G | Sigma | ||
| 1 g Anilin blue | Fulka AG | ||
| 200 ml acifidied distilled H2O (pH 1.1) |
References
- Muneoka, K., Allan, C. H., Yang, X., Lee, J., Han, M. Mammalian regeneration and regenerative medicine. Birth Defects Research Part C: Embryo Today: Reviews. 84 (4), 265-280 (2008).
- Carlson, B. M. Some principles of regeneration in mammalian systems. Anatomical Record. Part B, New Anatomist. 287 (1), 4-13 (2005).
- Dumont, N. A., Bentzinger, C. F., Sincennes, M. -. C., Rudnicki, M. A. Satellite cells and skeletal muscle regeneration. Comprehensive Physiology. 5 (3), 1027-1059 (2015).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692 (2021).
- Tulenko, F. J., Currie, P., Cartner, S. C. Zebrafish myology. The Zebrafish in Biomedical Research. , 115-121 (2020).
- Siegel, A. L., Gurevich, D. B., Currie, P. D. A myogenic precursor cell that could contribute to regeneration in zebrafish and its similarity to the satellite cell. The FEBS Journal. 280 (17), 4074-4088 (2013).
- Corona, B. T., Wenke, J. C., Ward, C. L. Pathophysiology of volumetric muscle loss injury. Cells Tissues Organs. 202 (3-4), 180-188 (2016).
- Pfefferli, C., Jaźwińska, A. The art of fin regeneration in zebrafish. Regeneration. 2 (2), 72-83 (2015).
- Sehring, I. M., Weidinger, G. Recent advancements in understanding fin regeneration in zebrafish. WIREs Developmental Biology. 9 (1), 367 (2020).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298 (5601), 2188-2190 (2002).
- Sanz-Morejón, A., Mercader, N. Recent insights into zebrafish cardiac regeneration. Current Opinion in Genetics & Development. 64, 37-43 (2020).
- Chassot, B., Pury, D., Jaźwińska, A. Zebrafish fin regeneration after cryoinjury-induced tissue damage. Biology Open. 5 (6), 819-828 (2016).
- Chablais, F., Veit, J., Rainer, G., Jaźwińska, A. The zebrafish heart regenerates after cryoinjury-induced myocardial infarction. BMC Developmental Biology. 11, 21 (2011).
- Schnabel, K., Wu, C. C., Kurth, T., Weidinger, G. Regeneration of cryoinjury induced necrotic heart lesions in zebrafish is associated with epicardial activation and cardiomyocyte proliferation. PLoS One. 6 (4), e18503 (2011).
- Gonzalez-Rosa, J. M., Martin, V., Peralta, M., Torres, M., Mercader, N. Extensive scar formation and regression during heart regeneration after cryoinjury in zebrafish. Development. 138 (9), 1663-1674 (2011).
- Ryan, R., Moyse, B. R., Richardson, R. J. Zebrafish cardiac regeneration-Looking beyond cardiomyocytes to a complex microenvironment. Histochemistry and Cell Biology. 154 (5), 533-548 (2020).
- Jaźwińska, A., Sallin, P. Regeneration versus scarring in vertebrate appendages and heart. Journal of Pathology. 238 (2), 233-246 (2016).
- Alexander, R. The orientation of muscle fibres in the myomeres of fishes. Journal of the Marine Biological Association of the United Kingdom. 49, 163-290 (1969).
- Morin-Kensicki, E. M., Melancon, E., Eisen, J. S. Segmental relationship between somites and vertebral column in zebrafish. Development. 129 (16), 3851-3860 (2002).
- Berberoglu, M. A., et al. Satellite-like cells contribute to pax7-dependent skeletal muscle repair in adult zebrafish. Developmental Biology. 424 (2), 162-180 (2017).
- Montandon, M., Currie, P. D., Ruparelia, A. A. Examining muscle regeneration in zebrafish models of muscle disease. Journal of Visualized Experiments. (167), e62071 (2021).
- Pipalia, T. G., et al. Cellular dynamics of regeneration reveals role of two distinct Pax7 stem cell populations in larval zebrafish muscle repair. Disease Models & Mechanisms. 9 (6), 671-684 (2016).
- Ratnayake, D., et al. Macrophages provide a transient muscle stem cell niche via NAMPT secretion. Nature. 591 (7849), 281-287 (2021).
- Kaliya-Perumal, A. -. K., Ingham, P. W. Musculoskeletal regeneration: A zebrafish perspective. Biochimie. 196, 171-181 (2022).
- Aleström, P., et al. Zebrafish: Housing and husbandry recommendations. Laboratory Animals. 54 (3), 213-224 (2019).
- Saera-Vila, A., et al. Myocyte dedifferentiation drives extraocular muscle regeneration in adult zebrafish. Investigative Ophthalmology & Visual Science. 56 (8), 4977-4993 (2015).
- Baust, J. G., Gage, A. A. The molecular basis of cryosurgery. BJU International. 95 (9), 1187-1191 (2005).
- Galluzzi, L., et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death and Differentiation. 25 (3), 486-541 (2018).
- Chablais, F., Jaźwińska, A. Induction of myocardial infarction in adult zebrafish using cryoinjury. Journal of Visualized Experiments. (62), e3666 (2012).
- Chablais, F., Jaźwińska, A. The regenerative capacity of the zebrafish heart is dependent on TGFbeta signaling. Development. 139 (11), 1921-1930 (2012).
- Bise, T., Sallin, P., Pfefferli, C., Jaźwińska, A. Multiple cryoinjuries modulate the efficiency of zebrafish heart regeneration. Scientific Reports. 10 (1), 11551 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved