Обнаружение двухцепочечных разрывов ДНК в ооцитах мышей
In This Article
Summary
Поддержание целостности генома ооцита необходимо для обеспечения генетической верности полученного эмбриона. Здесь мы представляем точный протокол обнаружения двухцепочечных разрывов ДНК в половых клетках самок млекопитающих.
Abstract
Ооциты являются одними из самых больших и долгоживущих клеток в женском организме. Они образуются в яичниках во время эмбрионального развития и остаются задержанными в профазе мейоза I. Состояние покоя может длиться годами, пока ооциты не получат стимул к росту и не приобретут способность возобновить мейоз. Это затяжное состояние остановки делает их чрезвычайно восприимчивыми к накоплению повреждений ДНК, которые влияют на генетическую целостность женских гамет и, следовательно, на генетическую целостность будущего эмбриона.
Следовательно, разработка точного метода обнаружения повреждений ДНК, что является первым шагом к установлению механизмов реагирования на повреждение ДНК, имеет жизненно важное значение. В данной работе описан общий протокол проверки наличия и прогресса повреждения ДНК в ооцитах, остановленных профазой, в течение 20 ч. В частности, мы препарируем яичники мышей, извлекаем кумулюс-ооцитарные комплексы (КОК), удаляем кумулюсные клетки из КОК и культивируем ооциты в среде Μ2, содержащей 3-изобутил-1-метилксантин, для поддержания состояния остановки. После этого ооциты обрабатывают цитотоксическим противоопухолевым препаратом этопозидом, чтобы вызвать двухцепочечные разрывы (DSB).
Используя иммунофлуоресценцию и конфокальную микроскопию, мы обнаруживаем и количественно определяем уровни основного белка γH2AX, который является фосфорилированной формой гистона H2AX. H2AX фосфорилируется в местах DSB после повреждения ДНК. Неспособность восстановить целостность ДНК после повреждения ДНК в ооцитах может привести к бесплодию, врожденным дефектам и увеличению частоты самопроизвольных абортов. Таким образом, понимание механизмов реакции на повреждение ДНК и, в то же время, создание интактного метода изучения этих механизмов имеют важное значение для исследований в области репродуктивной биологии.
Introduction
Процесс мейоза в женских половых клетках млекопитающих запускается в яичниках еще до рождения. Общее количество ооцитов устанавливается в яичниках преимущественно в процессе эмбриогенеза. Ооциты вступают в мейоз и остаются задержанными в профазе I1. После наступления полового созревания и выработки эндокринного действия фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ) ооциты могут повторно инициировать и завершить мейоз2. У человека остановка профазы может длиться до 50 лет3. Деления клеток после вступления в мейоз I асимметричны, что приводит к образованию небольшого полярного тельца и ооцита, который сохраняет свой размер. Таким образом, большинство цитоплазматических компонентов накапливается в ооплазме в период раннего эмбриогенеза4. Затем ооциты вступают в мейоз II, не преобразуя ядро и не деконденсируя хромосомы, и остаются задержанными в метафазе II до оплодотворения5.
Уникальной характеристикой, которая отличает ооциты от соматических клеток, является состояние остановки в профазе I, когда ооцит обладает неповрежденным ядром (остановка зародышевого везикула [GV]), называемая стадией GV6. В зависимости от организации хроматина ооциты стадии GV подразделяются на две категории: неокруженные ядрышки (NSN) и окруженные ядрышки (SN)7,8. В ооцитах стадии NSN GV хроматин распространяется по всей ядерной области, и транскрипция активна, в то время как в ооцитах SN хроматин образует компактное кольцо, окружающее ядрышко, и транскрипция проходит молча. Оба типа ооцитов стадии GV демонстрируют мейотическую компетентность; они входят в мейоз с одинаковой скоростью, но ооциты NSN обладают низкой способностью к развитию и не могут развиваться дальше двухклеточного эмбриона10.
Затяжное состояние остановки профазы I увеличивает частоту накопления повреждений ДНК11. Таким образом, механизмы реакции на повреждение ДНК в ооцитах необходимы для производства гамет с генетической целостностью и для обеспечения того, чтобы полученный эмбрион имел физиологическое хромосомное содержимое.
Центральным аспектом реакции на повреждение ДНК является репарация ДНК. Основные пути репарации DSB в эукариотических клетках включают негомологичное концевое соединение (NHEJ), гомологичную рекомбинацию (HR) и альтернативный NHEJ 12,13,14,15. NHEJ — это более быстрый, но более подверженный ошибкам механизм, в то время как HR требует больше времени для завершения, но имеет высокую точность16.
Недостаточно знаний о механизмах, которые ооциты используют для восстановления повреждений ДНК. Исследования показали, что повреждение ДНК, индуцированное в полностью взрослых ооцитах млекопитающих при использовании генотоксических агентов, таких как этопозид, доксорубицин, UVB или ионизирующее излучение, не влияет на сроки и скорость выхода из профазы Iостановки. Ооциты могут подвергаться распаду ВГ (ГВБД) даже при наличии повышенного уровня повреждения. Это повреждение может быть определено путем наблюдения γH2AX. Эта фосфорилированная форма H2AX (γΗ2ΑΧ) представляет собой маркер DSB, который расположен в месте разрывов и функционирует как каркас, помогая факторам репарации и белкам накапливаться на сломанных концах18.
Отсутствие остановки клеточного цикла после повреждения ДНК связано с недостаточной контрольной точкой повреждения ДНК, которая позволяет ооцитам с нерепарированной ДНК снова войти в мейоз. После высокого уровня повреждения ДНК контрольная точка может поддерживать остановку профазы за счет активации ATM/Chk1-зависимого пути. Ограниченная реакция контрольно-пропускных пунктов на DSB связана с ограниченной активацией банкоматов17,19. Исследования показали, что в М-фазе мейоза I повреждение ДНК может активировать контрольную точку сборки веретена (SAC), индуцированную контрольной точкой мейоза I, которая предотвращает активацию комплекса/циклосомы, способствующей анафазе убиквитинлигазы E3 (APC/C) и, следовательно, выход из М-фазы. Кроме того, абляция белков SAC преодолевает состояние остановки М-фазы, тем самым подчеркивая важность SAC в установлении мейоза I контрольной точки20.
Как ясно показывают предыдущие исследования, DSB не могут индуцировать надежную контрольную точку профазы в ооцитах мышей. Если такое повреждение не будет устранено, это может привести к тому, что эмбрионы будут нести хромосомные аномалии. Поэтому важно изучить реакцию на повреждение ДНК на разных этапах женского гаметогенеза, чтобы лучше понять уникальные пути, которые ооциты используют, чтобы справиться с потенциальными генетическими повреждениями.
Protocol
Все эксперименты на мышах были одобрены местными властями (регион Янина, Греция) и проведены в соответствии с Директивами Совета Европейских сообществ 2010/63/EU. Эксперименты проводились в отношении принципов 3R. Все мыши CD-1, использованные для экспериментов, содержались в животноводческом помещении Университета Янины, Греция, в помещении с контролируемой температурой (22 °C) и влажностью (60%) и кормились вволю. Животноводческий комплекс имеет лицензию на эксплуатацию объекта по разведению (EL33-BIObr01), снабжению (EL33-BIOsup01) и проведению экспериментов (EL33BIO-exp01).
1. Приготовление реагентов
- Разбавить порошок 3-изобутил-1-метилксантина (IBMX) (см. таблицу материалов) в диметилсульфоксиде (ДМСО) (см. таблицу материалов) до конечной концентрации 200 мМ. Заварить 10 мкл аликвот и хранить при температуре −20 °C. Используйте раствор в течение 1 месяца.
ПРИМЕЧАНИЕ: Порошок IBMX хранится при температуре −20 °C. - Подготовьте все иммунофлуоресцентные буферы и храните их при температуре 4 °C.
- Приготовьте стерильный фосфатно-солевой буфер (PBS), разведя одну таблетку PBS (см. таблицу материалов) в 200 мл ddH2Ο.
- Сделайте буфер PHEM, добавив 80 мл ddH2Ο, 0,59575 г HEPES, 1,81422 г PIPES, 0,38035 г EGTA и 0,04066 г MgCl2 (см. Таблицу материалов) при перемешивании с помощью магнитной мешалки (см. Таблицу материалов), и одновременно добавьте NaOH (см. Таблицу материалов) до тех пор, пока pH не достигнет 6,9(проверьте с помощью измерителя pH/ОВП [см. Таблицу материалов]). Затем добавьте ddH2Ο к конечному объему в 100 мл.
- Приготовьте буфер параформальдегид-Тритон-Х-100 (PFA-Tx-100) путем разбавления порошка PFA (см. Таблицу материалов) в буфере PHEM при перемешивании с помощью магнитной мешалки при нагревании до конечной концентрации 4% PFA. Затем отфильтруйте буфер с помощью шприца и фильтра 0,2 мкм (см. Таблицу материалов) и добавьте 0,5% Tx-100 (см. Таблицу материалов). Приготовьте примерно 10 мл PFA-Tx-100 (0,4 г PFA, 50 мкл Tx-100), чего достаточно для одного эксперимента. Хранить при температуре 4 °C не более 1 недели.
ВНИМАНИЕ: Надевайте перчатки для работы с PFA и избегайте контакта с кожей и глазами. - Приготовьте промывочный буфер, добавив бычий сывороточный альбумин (конечная концентрация: 0,5% с БСА) (см. таблицу материалов) в ПБС и механически перемешайте. Добавьте 10% буфера NaN3 (азид натрия) в разведении 1:1000, чтобы свести к минимуму риск грибкового и бактериального загрязнения. Сделайте 10%-ный буферNaN3 , добавив 1 г порошка NaN3 (см. таблицу материалов) к 10 мл ddH2O; Храните буфер NaN3 при комнатной температуре.
- Приготовьте блокирующий буфер, добавив BSA (конечная концентрация: 3% w/v) в PBS и механически перемешав. Добавьте 10% буфера NaN3 в разбавлении 1:1 000.
2. Забор ооцитов GV из рассеченных яичников и индукция DSB
ПРИМЕЧАНИЕ: Все инструменты и растворы должны быть стерильными. Обработка ооцитов проводится с помощью ротовой пипетки под стереомикроскопом (см. таблицу материалов), а все капли покрываются минеральным маслом (см. таблицу материалов и рисунок 1E).
- Вводят мышам внутрибрюшинно 7 международных единиц (МЕ) гонадотропина (ПМСГ) сыворотки крови беременной кобылы (ПМСГ) (см. таблицу материалов) за 46-48 ч до выбраковки мышей при вывихе шейки матки.
ПРИМЕЧАНИЕ: Все используемые мыши должны быть в возрасте 8-12 недель. - Отфильтруйте питательную среду М2 (см. таблицу материалов) с помощью шприца и фильтра 0,2 мкм и добавьте IBMX 200 мМ до конечной концентрации 200 мкМ в пробирку с круглым дном объемом 14 мл (см. таблицу материалов), чтобы удерживать ооциты в профазе I. Затем приготовьте капли среды M2-IBMX в пластиковой чашке для культивирования тканей (см. Таблицу материалов) и поместите ее на горячий блок (см. Таблицу материалов) при температуре 37 °C не менее чем за 30 минут до выделения ооцитов. Храните M2 при температуре 4 °C.
- Принесите мышей в жертву вывихом шейки матки, препарируйте яичники и поместите их в пробирку с круглым дном объемом 5 мл (см. таблицу материалов) с M2-IBMX.
- Перенесите яичники в пластиковую крышку, содержащую 1,5 мл M2-IBMX, удалите периовариальную жировую ткань или сегменты маточных труб и выпустите КОК путем механической перфорации яичников иглой 27 G (см. таблицу материалов и рисунок 1A-C).
- Перенесите КОК в культуральную чашку с каплями M2-IBMX (примерно по 25-30 мкл каждая) и удалите кумулюсные клетки путем повторного пипетирования с помощью узкопроходной стеклянной пипетки Пастера (см. таблицу материалов и рисунок 1D).
- Отобрать ооциты стадии SN GV и перенести их в каплю (25 мкл) среды M2-IBMX на горячий блок при 37 °C, защищенный от света (рис. 1F).
- Ищите ооциты SN на основе их большего размера и центрально расположенных ядер в отличие от ооцитов NSN, в которых ядра расположены периферически21. В любом случае, понаблюдайте за конфигурацией ДНК под конфокальным микроскопом, прежде чем принимать окончательное решение о типе ооцита GV (SN или NSN).
- Индуцируют DSB с помощью этопозида (см. таблицу материалов). Помещают ооциты стадии ГВ в капли (по 25 мкл) генотоксического агента на 1 ч на горячий блок при 37 °С в темных условиях.
ПРИМЕЧАНИЕ: Этопозид является ингибитором топоизомеразы II, который вводит DSB в ДНК22. Этопозид хранят в 10 мкл аликвотах по 20 мг/мл при комнатной температуре в защищенном от света месте. Были протестированы концентрации 5 мкг/мл, 20 мкг/мл и 50 мкг/мл. - Для удержания ооцитов стадии ГВ в течение длительного периода времени помещают ооциты в капли питательной среды М16 (см. таблицу материалов) с добавлением 400 мкМ IBMX в инкубатор (см. таблицу материалов) при 37 °C и 5% CO2. Храните M16 при температуре 4 °C, отфильтруйте среду с помощью шприца и фильтра 0,2 мкм и инкубируйте не менее 1 ч перед использованием.
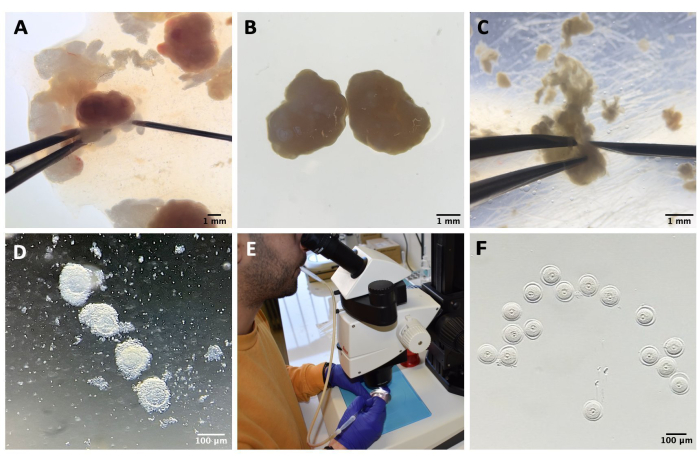
Рисунок 1: Процесс выделения ооцитов . (А) Удаление периовариальной жировой ткани и оставшихся сегментов маточных труб из яичников в среде М2 с помощью IBMX. Фотография получена с помощью стереомикроскопа окуляров. Масштабная линейка = 1 мм. (B) Изолированные яичники в среде M2 с IBMX. Изображение получено с помощью стереомикроскопа окуляров. Масштабная линейка = 1 мм. (C) Механическая перфорация яичников иглой 27 G в среде M2 с IBMX. Изображение получено с помощью стереомикроскопа окуляров. Масштабная линейка = 1 мм. (D) КОК, высвобождающиеся из яичников после перфорации в среде М2 с помощью IBMX. Изображение получено с помощью стереомикроскопа окуляров. Масштабная линейка = 100 мкм. (E) Забор ооцитов с помощью ротовой пипетки. (F) Оголенные ооциты после удаления окружающих кумулюсных клеток в среде М2 с IBMX. Изображение получено с помощью стереомикроскопа окуляров. Масштабная линейка = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Фиксация ооцитов и иммунофлюоресценция
ПРИМЕЧАНИЕ: Обработка ооцитов осуществляется с помощью ротовой пипетки под стереомикроскопом, а все капли покрыты минеральным маслом.
- Контрольные и этопозидные ооциты GV помещают в различные пластиковые чашки для культивирования тканей с буфером PFA-Tx-100 на 40 мин при комнатной температуре.
- Промойте ооциты в трех разных каплях буфера для промывки (по 50 мкл каждая) при комнатной температуре. Оставьте ооциты на 5 минут в каждой капле.
- Поместите ооциты в капли блокирующего буфера (по 25 мкл каждая) на 1 ч на горячий блок при 37 °C.
- Приготовьте первичное антитело, которое распознает γH2AX (кроличий фосфо-Η2ΑΧ) (Ser139) (см. таблицу материалов) (исходный раствор: 1 мг/мл). Используйте разведение 1:200 в блокирующем буфере и поместите ооциты в капли первичного антитела (по 15 мкл каждая) при температуре 4 °C на ночь.
ПРИМЕЧАНИЕ: Фосфо-Η2ΑΧ (γH2AX) является распространенным маркером для обнаружения DSB как в соматических клетках, так и в ооцитах GV18,23. - На следующий день промойте яйцеклетки тремя разными каплями промывочного буфера (по 50 мкл каждая) при комнатной температуре. Оставьте ооциты на 5 минут в каждой капле.
- Приготовьте вторичное антитело, конъюгированное козье антитело Alexa Fluor 488 (см. таблицу материалов) (исходный раствор: 2 мг/мл). Используйте разведение 1:200 в блокирующем буфере и помещают ооциты в капли вторичных антител (по 15 мкл каждая) на 1 ч на горячий блок при 37 °C, защищенный от света.
- Пересадите ооциты в капли DRAQ7 (по 25 мкл каждая) (исходный раствор: 0,3 мМ; см. таблицу материалов), который представляет собой флуоресцентный краситель ДНК дальнего красного цвета, который окрашивает ДНК только в пермеабилизированных клетках. Используйте разбавление 1:250 в буфере для стирки в течение 10 минут при комнатной температуре в темное время суток.
- Промойте ооциты в трех разных каплях буфера для промывки (по 50 мкл каждая) при комнатной температуре. Оставьте их на 5 минут в каждой капле, а затем переложите в небольшие капли (примерно по 5 мкл каждая) промывочного буфера в чашку Петри со стеклянным дном диаметром 35 мм (см. таблицу материалов) для конфокальной микроскопии (рис. 2А).
ПРИМЕЧАНИЕ: Промывка красителя ДНК и вторичных антител выполняется одновременно.
4. Конфокальная микроскопия
ПРИМЕЧАНИЕ: Конфокальную микроскопию следует проводить немедленно, чтобы избежать снижения интенсивности флуоресценции после помещения ооцитов в чашки со стеклянным дном. Требуется доступ к конфокальному микроскопу (см. Таблицу материалов) с моторизованным столиком.
- Настройка микроскопа
- В конфокальной системе включите лазерный контроллер, лазеры, контроллер микроскопа, лампы для проходящего света и ПК (рис. 2B, D).
- Откройте конфокальное программное обеспечение и выберите масляный объектив с 40-кратным увеличением.
- Поместите чашку в держатель образца и попробуйте сфокусироваться на ооцитах, перемещая столик по осям XY и Z с помощью джойстика (рис. 2C).
- Сканирование ооцитов
- Устанавливайте мощность лазера, усиление и размер отверстия независимо для каждого эксперимента, чтобы свести к минимуму любое насыщение.
- Для каждого ооцита задайте интересующую область, в частности, ядро на участке ДНК. Определите границы области ДНК и установите размер шага z на 3 мкм. Затем запустите сканирование.
- Сохраните изображения для каждой ячейки в выбранной папке.
- Когда сканирование будет завершено, выйдите из программного обеспечения, выключите компьютер и лазерный контроллер, лазеры, контроллер микроскопа и лампы для проходящего света.
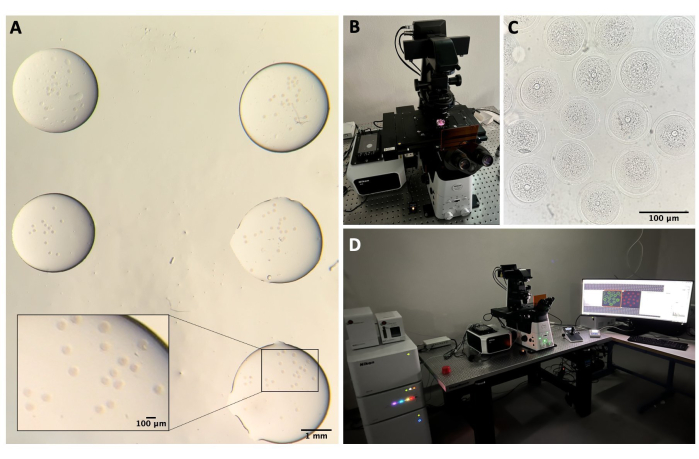
Рисунок 2: Конфокальная микроскопия. (А) Фиксированные ооциты после выполнения протокола иммунофлюоресценции и окрашивания ДНК, которые находятся в отдельных каплях промывочного буфера, покрытых минеральным маслом, помещенных в чашку со стеклянным дном и подготовленных для конфокальной микроскопии. Каждый дроп содержит отдельную экспериментальную категорию. Изображение получено с помощью стереомикроскопа окуляров. Масштабная линейка = 1 мм/100 мкм для увеличенной части. (B) Пластина со стеклянным дном, помещенная на предметный столик конфокального микроскопа. (C) Светлопольное изображение ооцитов, полученное с помощью конфокальной микроскопии. Масштабная линейка = 100 мкм. (D) Система конфокальной микроскопии. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
5. Визуализирующий анализ
- Загрузите Fiji ImageJ-win64 в браузере (https://imagej.net/software/fiji/downloads), откройте его и импортируйте данные в виде файлов стека TIFF.
ПРИМЕЧАНИЕ: Откройте каждый файл ооцита отдельно. - Нажмите на изображение | Цвет | Разделить каналы, чтобы разделить все каналы.
- Нажмите на LUT (Look up Table) и выберите предпочтительные цвета для каждого канала.
- Нажмите на изображение | Цвет | Merge Channels (Объединить каналы ) для слияния каналов γΗ2ΑΧ и ДНК. Оставьте канал светлого поля необъединенным.
- В ооцитах NSN и в ооцитах SN с низким уровнем повреждения ДНК γΗ2ΑΧ обнаруживается в виде очагов в области ДНК. В этом случае нажмите на команду «Многоточечный» или «Точка» и выделите каждый фокус γΗ2ΑΧ, совпадающий с ДНК. Повторите этот шаг для всех стеков.
- В ооцитах SN с высоким уровнем повреждения ДНК сигнал γΗ2ΑΧ распределяется по всему участку ДНК. В этом случае нажмите на Изображение | Стеки | Z и с помощью команды « Произвольные выборки » выделите всю область ДНК.
- Чтобы измерить флуоресценцию γΗ2ΑΧ, нажмите « Анализировать | Измерьте и скопируйте измерения в файл .xlsx. Затем вычислите среднюю флуоресценцию, нормализуйте значения и подсчитайте количество фокусов, прежде чем строить какие-либо графики.
- Нажмите « Анализировать» | Задать масштаб , чтобы задать масштаб, а затем выберите Анализ | Инструменты | Масштабная линейка для добавления масштабной линейки к каналам.
Representative Results
С помощью процедуры, показанной здесь, были рассечены яичники мышей, удален жир и собраны полностью выращенные ооциты стадии GV. Затем кумулюсные клетки удаляли путем повторяющегося пипетирования с помощью узкой пипетки и помещали в свежие капли среды M2-IBMX и покрывали минеральным маслом на горячем блоке (37 °C) (рис. 1A-F). Три различные концентрации этопозида (5 мкг/мл, 20 мкг/мл и 50 мкг/мл) были приготовлены с использованием исходной концентрации этопозида 20 мг/мл. Ооциты стадии GV помещали в три различные концентрации этопозида в течение 1 ч в каплях, покрытых минеральным маслом и защищенных от света при 37 °C. Затем следовали протоколу иммунофлюоресценции, подробно описанному в разделе протокола, и ооциты помещали в чашки со стеклянным дном и наблюдали с помощью конфокальной микроскопии (рис. 2).
В ооцитах стадии SN GV сразу после повреждения ДНК присутствие γH2AX увеличивалось при всех концентрациях этопозида (5 мкг/мл, 20 мкг/мл и 50 мкг/мл), а γH2AX распределялся по всему участку ДНК (рис. 3). Количественную оценку и оценку DSB проводили путем наблюдения интенсивности флуоресценции γH2AX в сайтах ДНК. Флуоресценция γH2AX усиливалась пропорционально увеличению концентрации этопозидов. Более того, после длительной остановки профазы (через 20 ч после обработки этопозидами) ооциты стадии GV показали способность снижать количество и интенсивность очагов γH2AX, что свидетельствует о наличии активных процессов репарации в ооцитах, задержанных на стадии GV (рис. 3E).
В отличие от ооцитов SN, в которых флуоресценция γH2AX распространялась через ДНК, в ооцитах NSN γH2AX был показан в очагах сразу после обработки этопозидом в концентрации 20 мкг/мл. Мы оценили количество очагов, совпадающих с участком ДНК, рассчитали флуоресценцию каждого очага и представили среднюю флуоресценцию всех ооцитов. Как флуоресценция, так и количество очагов показали статистически значимые различия между двумя категориями ооцитов (рис. 4).
Конфокальная микроскопия дает информацию о количестве и интенсивности очагов в различных Z-стеках, что помогает определить наличие повреждений ДНК и динамику репарации в разные моменты времени. Сканирование Galvano обеспечивает прецизионное сканирование с низким фоном и лучший анализ сканируемых изображений.
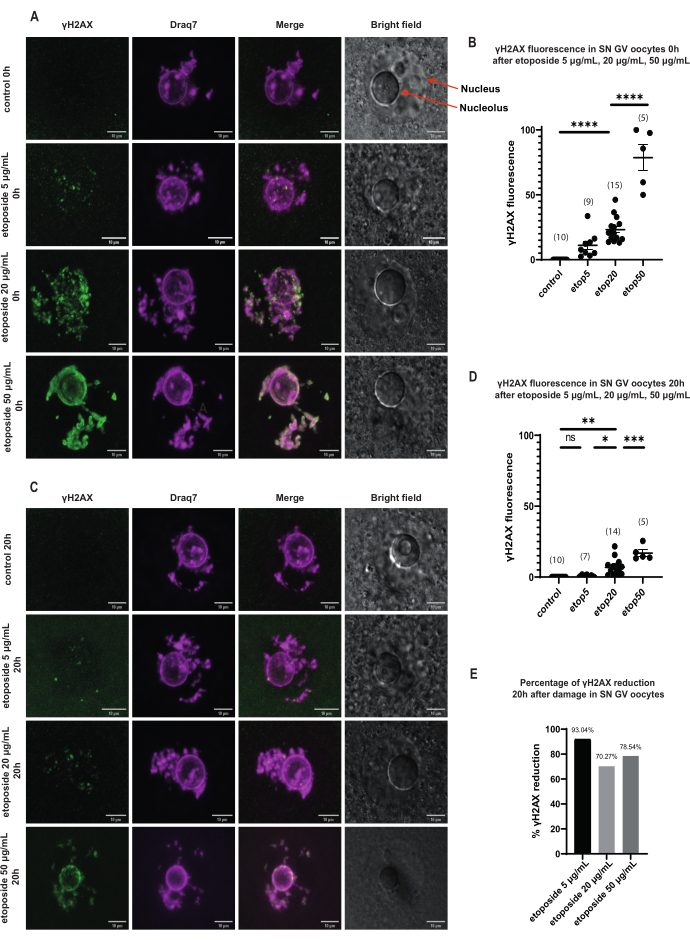
Рисунок 3: Снижение γH2AX в ооцитах стадии SN GV, обработанных тремя различными концентрациями этопозида после длительного купирования ВГ. (A) Флуоресценция γH2AX в ооцитах стадии SN GV через 0 ч после обработки этопозидами. γH2AX увеличивается сразу после воздействия при всех концентрациях этопозидов, и это увеличение зависит от концентрации (зеленый: γΗ2ΑΧ, пурпурный: ДНК). Изображения представляют собой Z-стековые проекции, а яркость/контрастность были настроены для каждого канала с помощью Fiji / ImageJ. Масштабная линейка = 10 мкм. (B) График флуоресценции γH2AX в ооцитах стадии SN GV через 0 ч после обработки с различными концентрациями этопозидов. Данные представляют собой среднее значение ± SEM. Каждая точка представляет один ооцит (количество ооцитов показано на графике), (ns = незначимый, ** p < 0,005, **** p < 0,0001, односторонний ANOVA с тестом множественных сравнений Тьюки). (C) Флуоресценция γH2AX в ооцитах стадии SN GV через 20 ч после обработки этопозидами. γH2AX снижается через 20 ч после экспозиции при всех концентрациях этопозида (зеленый: γΗ2ΑΧ, пурпурный: ДНК). Изображения представляют собой проекции Z-стека, а яркость/контрастность были настроены для каждого канала с помощью Fiji/ImageJ. Масштабная линейка = 10 мкм. (D) График флуоресценции γH2AX в ооцитах стадии SN GV через 20 ч после обработки с отчетливыми концентрациями этопозидов. Данные представляют собой среднее значение ± SEM. Каждая точка представляет одну яйцеклетку (количество ооцитов показано на графике), (ns = незначимый, * p < 0,05, ** p < 0,005 , *** p < 0,0005, **** p < 0,0001, односторонний ANOVA с тестом множественных сравнений Тьюки). (E) Гистограмма снижения флуоресценции γH2AX в ооцитах стадии SN GV после остановки профазы в ооцитах, обработанных этопозидами. Число над каждым столбцом указывает процентное снижение флуоресценции γH2AX. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
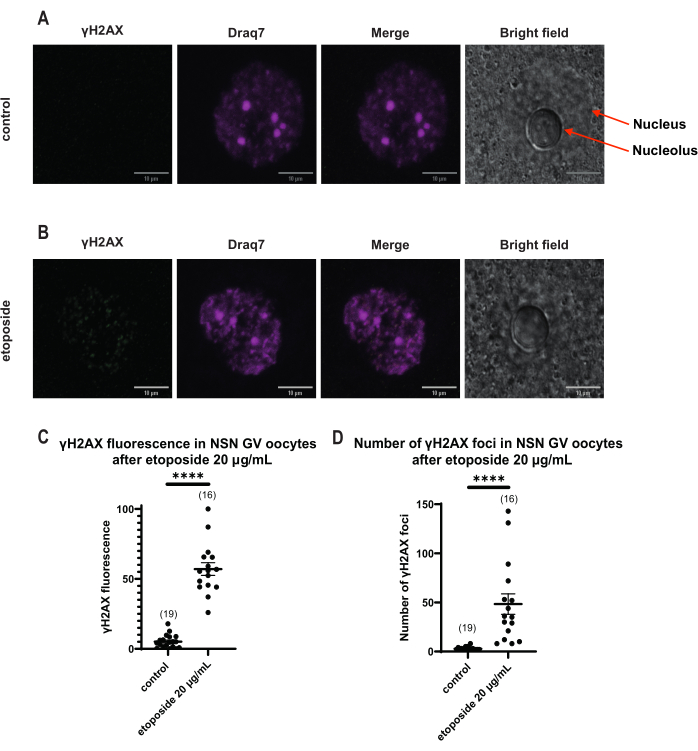
Рисунок 4: Фосфорилирование Η2ΑΧ в ооцитах стадии NSN GV после обработки этопозидом в дозе 20 мкг/мл. (A) Репрезентативные конфокальные изображения одного контрольного ооцита стадии NSN GV (зеленый: γΗ2ΑΧ, пурпурный: ДНК). Изображения представляют собой проекции Z-стека, а яркость/контрастность были настроены для каждого канала с помощью Fiji/ImageJ. Масштабная линейка = 10 мкм. (B) Репрезентативные конфокальные изображения одного этопозидного ооцита стадии NSN GV (зеленый: γΗ2ΑΧ, пурпурный: ДНК). Ооциты фиксировали через 0 ч после обработки этопозидом. Изображения представляют собой Z-стековые проекции, а яркость/контрастность были настроены для каждого канала с помощью Fiji/ImageJ. Масштабная линейка = 10 мкм. (C) Нормализованная флуоресценция γΗ2ΑΧ в ооцитах стадии NSN GV после обработки этопозидом 20 мкг/мл. Данные представляют собой среднее значение ± SEM. Каждая точка представляет собой один ооцит (количество ооцитов показано на графике), взятый из двух независимых экспериментов (**** p < 0,0001, непарный непараметрический t-критерий, U-критерий Манна-Уитни). (D) Количество γΗ2ΑΧ очагов в ооцитах стадии NSN GV после обработки этопозидами в дозе 20 мкг/мл. Данные представляют собой среднее значение ± SEM. Каждая точка представляет собой один ооцит (количество ооцитов показано на графике), взятый из двух независимых экспериментов (**** p < 0,0001, непарный непараметрический t-критерий, U-критерий Манна-Уитни). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Discussion
Используя описанный здесь метод, мы обнаружили DSB в ооцитах млекопитающих. Этот метод позволяет обнаружить и изучить процесс репарации ДНК в ооцитах. Этот же протокол может быть использован и для анализа других белков, участвующих в физиологических процессах в ооцитах млекопитающих. Важно изучить, как ооциты реагируют на потенциальное повреждение ДНК, чтобы лучше понять причину женской субфертильности у людей.
Изучение реакции на повреждение ДНК в ооцитах млекопитающих может быть сложной задачей из-за чувствительности ооцитов. Работа с ооцитами требует определенных температур и концентрацийСО2 иО2 . При этом ооциты должны быть защищены от света. Всю обработку следует проводить с использованием стеклянных пипеток, которые не являются узкими, так как это может быть вредно для ооцитов, но и не широкими, так как это может привести к разбавлению среды и, таким образом, негативно повлиять на процедуру фиксации. На каждом этапе фиксации используется несколько капель буферов, чтобы свести к минимуму эффект разбавления. Альтернативным способом наблюдения DSB является кометный анализ24. Несмотря на то, что эта техника более чувствительна, она более сложна. В то же время, используя кометный анализ, невозможно обнаружить точный участок ДНК, где происходит повреждение, а в клетках с большим количеством молекул РНК, таких как ооциты25 стадии GV, фон может быть повышен, что приводит к ложному сигналу повреждения ДНК26.
Используя описанный здесь протокол иммунофлуоресценции, мы можем с точностью обнаруживать DSB и оценивать прогресс репарации в ооцитах стадии GV, на что указывает снижение флуоресценции γH2AX с течением времени. Тем не менее, одним из ограничений этого метода является то, что определенные антитела могут представлять неспецифическое распределение по всей ооплазме, что приводит к получению изображений с высокой фоновой флуоресценцией. Буфер PFA-Tx-100 используется вместо последовательных PFA и Tx-100, так как мы заметили, что он улучшает процесс фиксации, позволяя обнаруживать меньшую фоновую и неспецифическую флуоресценцию. Вторым ограничением использования γH2AX для обнаружения DSB является то, что ущерб не может быть оценен после GVBD из-за спонтанного фосфорилирования γH2AX в мейозе23.
В этом протоколе иммунофлюоресценции ооциты остаются в жидком буфере и не могут храниться в предметных стеклах. Этот факт затрудняет сохранение фиксированных клеток в течение нескольких дней после добавления вторичного антитела. Чтобы получить качественные изображения и не потерять сигнал, предпочтительно проводить визуализацию в течение нескольких часов после добавления вторичного антитела. Следует также отметить, что сканирование ядер по оси Z может привести к ослаблению сигнала из-за передержки. По этой причине предпочтительнее снизить мощность лазера и увеличить скорость сканирования.
Наконец, еще одним ограничением протокола иммунофлюоресценции является то, что его можно использовать только для фиксированных/неживых клеток. Поэтому мы можем оценить только наличие и отсутствие факторов в определенные моменты времени, не зная, есть ли какие-либо колебания в их концентрации или изменения в их поведении во времени. Эта проблема может быть решена с помощью визуализации живых клеток и флуоресцентно меченных маркеров.
Disclosures
Конфликт интересов у авторов отсутствует.
Acknowledgements
Мы выражаем признательность за поддержку этой работы со стороны проекта «Создание инфраструктур по наращиванию потенциала в области биомедицинских исследований (BIOMED-20)» (MIS 5047236), который реализуется в рамках Мероприятия «Укрепление инфраструктуры исследований и инноваций», финансируемого Оперативной программой «Конкурентоспособность, предпринимательство и инновации» (NSRF 2014-2020) и софинансируемого Грецией и Европейским союзом (Европейский фонд регионального развития).
Materials
| Name | Company | Catalog Number | Comments |
| 3 mL Pasteur pipettes in LDPE, graduated | APTACA | 1502 | |
| 10 cc syringes | SoftCare | 114.104.21 | |
| Alexa Fluor 488-conjugated goat anti-rabbit Secondary Ab | Biotium | 20012 | |
| Anti-phospho-H2A.X (Ser139) | Merck Millipore | 07-164 | |
| ARE Heating Magnetic Stirrer | VELP Scientifica | F20500162 | |
| BD FALCON 5 mL Polystyrene Round-Bottom Tubes | BD Biosciences | 352054 | |
| BD Microlance 3 Needles 27 G - 0.40 x 13 mm | Becton Dickinson | 300635 | |
| Bovine Serum Albumin Fraction V | Roche | 10735078001 | |
| DMSO Anhydrous | Biotium | 90082 | |
| DRAQ7 DNA dye | BioStatus | DR71000 | |
| EGTA | Sigma-Aldrich | E4378-25G | |
| EMSURE MgCl2. 6H2O | Merck Millipore | 1058330250 | |
| Etoposide | CHEMIPHARM | L01CB01 | |
| FALCON 14 mL Polystyrene Round-Bottom Tubes | Corning Science | 532057 | |
| FALCON Tissue Culture Dishes, Easy-Grip, 35 x 10 mm Style | Corning Science | 353001 | |
| Glass Bottom Culture Dishes (35 mm Petri dish/ 14 mm Microwell, No. 0 coverglass) | MatTek Corporation | P35G-0-14-C | |
| HEPES | Sigma-Aldrich | H6147-25G | |
| HERACELL 150i CO2 Incubator | ThermoFisher Scientific | 50116048 | |
| IBMX powder | Sigma-Aldrich | I5879-100MG | |
| Leica M125 Stereo Microscope | Leica Microsystems | ||
| M16 Medium | Sigma-Aldrich | M7292 | |
| M2 Medium | Sigma-Aldrich | M7167 | |
| Mineral Oil | Sigma-Aldrich | M5310 | |
| NaN3 | Honeywell | 13412H | |
| NaOH | Merck Millipore | 1064981000 | |
| Nikon AX ECLIPSE Ti2 Confocal Microscope | Nikon Corporation | ||
| Nikon SMZ800N Stereo Microscope | Nikon Corporation | ||
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Pasteur pippettes, glass, long form 230 mm | DURAN WHEATON KIMBLE | 357335 | |
| pH/ORP meter | Hanna Instruments Ltd | HI2211 | |
| Phosphate buffered saline tablets | Sigma-Aldrich | P4417-100TAB | |
| PIPES | Sigma-Aldrich | P1851 | |
| PMSG Protein Lyophilised | Genway Biotech (now AVIVA Systems Biology) | GWB-2AE30A (now OPPA01037) | |
| QBD4 Dry block heater | Grant Instruments (Cambridge) Ltd | A25218 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Whatman Puradisc 25 mm 0.2 μm filters | GE Healthcare | 6780-2502 |
References
- Wang, X., Pepling, M. E. Regulation of meiotic prophase one in mammalian oocytes. Frontiers in Cell and Developmental Biology. 9, 667306 (2021).
- Filatov, M., Khramova, Y., Semenova, M. Molecular mechanisms of prophase I meiotic arrest maintenance and meiotic resumption in mammalian oocytes. Reproductive Sciences. 26 (11), 1519-1537 (2019).
- Adhikari, D., et al. Inhibitory phosphorylation of Cdk1 mediates prolonged prophase I arrest in female germ cells and is essential for female reproductive lifespan. Cell Research. 26 (11), 1212-1225 (2016).
- Sun, S. C., Kim, N. H. Molecular mechanisms of asymmetric division in oocytes. Microscopy and Microanalysis. 19 (4), 883-897 (2013).
- Jones, K. T. Mammalian egg activation: From Ca2+ spiking to cell cycle progression. Reproduction. 130 (6), 813-823 (2005).
- Solc, P., Schultz, R. M., Motlik, J. Prophase I arrest and progression to metaphase I in mouse oocytes: comparison of resumption of meiosis and recovery from G2-arrest in somatic cells. Molecular Human Reproduction. 16 (9), 654-664 (2010).
- Parfenov, V., Potchukalina, G., Dudina, L., Kostyuchek, D., Gruzova, M. Human antral follicles: oocyte nucleus and the karyosphere formation (electron microscopic and autoradiographic data). Gamete Research. 22 (2), 219-231 (1989).
- Zuccotti, M., Piccinelli, A., Giorgi Rossi, P., Garagna, S., Redi, C. A. Chromatin organization during mouse oocyte growth. Molecular Reproduction and Development. 41 (4), 479-485 (1995).
- Sun, X., et al. Comprehensive analysis of nonsurrounded nucleolus and surrounded nucleolus oocytes on chromatin accessibility using ATAC-seq. Molecular Reproduction and Development. 90 (2), 87-97 (2023).
- Zuccotti, M., Bellone, M., Longo, F., Redi, C. A., Garagna, S. Fully-mature antral mouse oocytes are transcriptionally silent but their heterochromatin maintains a transcriptional permissive histone acetylation profile. Journal of Assisted Reproduction and Genetics. 28 (12), 1193-1196 (2011).
- Winship, A. L., Stringer, J. M., Liew, S. H., Hutt, K. J. The importance of DNA repair for maintaining oocyte quality in response to anti-cancer treatments, environmental toxins and maternal ageing. Human Reproduction Update. 24 (2), 119-134 (2018).
- Lieber, M. R. The mechanism of human nonhomologous DNA end joining. The Journal of Biological Chemistry. 283 (1), 1-5 (2008).
- Chiruvella, K. K., Liang, Z., Wilson, T. E. Repair of double-strand breaks by end joining. Cold Spring Harbor Perspectives in Biology. 5 (5), 012757 (2013).
- Chang, H. H. Y., Pannunzio, N. R., Adachi, N., Lieber, M. R. Non-homologous DNA end joining and alternative pathways to double-strand break repair. Nature Reviews. Molecular Cell Biology. 18 (8), 495-506 (2017).
- Shibata, A., Jeggo, P. A. Roles for the DNA-PK complex and 53BP1 in protecting ends from resection during DNA double-strand break repair. Journal of Radiation Research. 61 (5), 718-726 (2020).
- Mohiuddin, I. S., Kang, M. H. DNA-PK as an emerging therapeutic target in cancer. Frontiers in Oncology. 9, 635 (2019).
- Marangos, P., Carroll, J. Oocytes progress beyond prophase in the presence of DNA damage. Current Biology. 22 (11), 989-994 (2012).
- Paull, T. T., et al. A critical role for histone H2AX in recruitment of repair factors to nuclear foci after DNA damage. Current Biology. 10 (15), 886-895 (2000).
- Bakkenist, C. J., Kastan, M. B. DNA damage activates ATM through intermolecular autophosphorylation and dimer dissociation. Nature. 421 (6922), 499-506 (2003).
- Marangos, P., et al. DNA damage-induced metaphase I arrest is mediated by the spindle assembly checkpoint and maternal age. Nature Communications. 6, 8706 (2015).
- Lavrentyeva, E. A., Shishova, K. V., Zatsepina, O. V. Differences in nuclear dynamics in mouse GV oocytes with a diverse chromatin configuration. Biology Bulletin Russian Academy of Sciences. 46, 332-341 (2019).
- Montecucco, A., Zanetta, F., Biamonti, G. Molecular mechanisms of etoposide. EXCLI Journal. 14, 95-108 (1998).
- Mayer, A., et al. DNA damage response during mouse oocyte maturation. Cell Cycle. 15 (4), 546-558 (2016).
- Olive, P., Banáth, J. The comet assay: A method to measure DNA damage in individual cells. Nature Protocols. 1, 23-29 (2006).
- Wu, D., Dean, J. EXOSC10 sculpts the transcriptome during the growth-to-maturation transition in mouse oocytes. Nucleic Acids Research. 48 (10), 5349-5365 (2020).
- Simon, L., Emery, B., Carrell, D., Agarwal, A., Henkel, R., Majzoub, A. DNA damage: COMET assay. Manual of Sperm Function Testing in Human Assisted Reproduction. , 202-212 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved