Utilizzo dell'imaging STED su cellule vive per visualizzare l'ultrastruttura della membrana interna mitocondriale in modelli di cellule neuronali
In questo articolo
Riepilogo
Questo protocollo presenta un flusso di lavoro per la propagazione, la differenziazione e la colorazione di cellule SH-SY5Y in coltura e neuroni ippocampali primari di ratto per la visualizzazione e l'analisi dell'ultrastruttura mitocondriale utilizzando la microscopia a deplezione di emissione stimolata (STED).
Abstract
I mitocondri svolgono molti ruoli essenziali nella cellula, tra cui la produzione di energia, la regolazione dell'omeostasi di Ca2+ , la biosintesi dei lipidi e la produzione di specie reattive dell'ossigeno (ROS). Questi processi mediati dai mitocondri assumono ruoli specializzati nei neuroni, coordinando il metabolismo aerobico per soddisfare le elevate richieste energetiche di queste cellule, modulando la segnalazione di Ca2+ , fornendo lipidi per la crescita e la rigenerazione degli assoni e regolando la produzione di ROS per lo sviluppo e la funzione neuronale. La disfunzione mitocondriale è quindi un fattore centrale nelle malattie neurodegenerative. La struttura e la funzione mitocondriale sono indissolubilmente legate. La membrana interna morfologicamente complessa con pieghe strutturali chiamate cristae ospita molti sistemi molecolari che eseguono i processi di firma del mitocondrio. Le caratteristiche architettoniche della membrana interna sono ultrastrutturali e quindi troppo piccole per essere visualizzate dalla microscopia tradizionale a risoluzione limitata alla diffrazione. Pertanto, la maggior parte delle intuizioni sull'ultrastruttura mitocondriale sono venute dalla microscopia elettronica su campioni fissi. Tuttavia, le tecnologie emergenti nella microscopia a fluorescenza a super-risoluzione ora forniscono una risoluzione fino a decine di nanometri, consentendo la visualizzazione delle caratteristiche ultrastrutturali nelle cellule vive. L'imaging a super-risoluzione offre quindi una capacità senza precedenti di visualizzare direttamente i dettagli fini della struttura mitocondriale, delle distribuzioni proteiche su scala nanometrica e delle dinamiche delle cristae, fornendo nuove intuizioni fondamentali che collegano i mitocondri alla salute e alle malattie umane. Questo protocollo presenta l'uso della microscopia a super-risoluzione a deplezione di emissione stimolata (STED) per visualizzare l'ultrastruttura mitocondriale di cellule vive di neuroblastoma umano e neuroni primari di ratto. Questa procedura è organizzata in cinque sezioni: (1) crescita e differenziazione della linea cellulare SH-SY5Y, (2) isolamento, placcatura e crescita dei neuroni primari dell'ippocampo di ratto, (3) procedure per la colorazione delle cellule per l'imaging di STED vive, (4) procedure per esperimenti STED su cellule vive utilizzando un microscopio STED come riferimento e (5) guida per la segmentazione e l'elaborazione delle immagini utilizzando esempi per misurare e quantificare le caratteristiche morfologiche della membrana interna.
Introduzione
I mitocondri sono organelli eucariotici di origine endosimbiotica responsabili della regolazione di diversi processi cellulari chiave, tra cui il metabolismo intermedio e la produzione di ATP, l'omeostasi ionica, la biosintesi lipidica e la morte cellulare programmata (apoptosi). Questi organelli sono topologicamente complessi, contengono un sistema a doppia membrana che stabilisce più sottocompartimenti1 (Figura 1A). La membrana mitocondriale esterna (OMM) si interfaccia con il citosol e stabilisce contatti diretti tra gli organelli 2,3. La membrana mitocondriale interna (IMM) è una membrana a risparmio energetico che mantiene i gradienti ionici immagazzinati principalmente come potenziale elettrico di membrana (ΔΨm) per guidare la sintesi di ATP e altri processi che richiedono energia 4,5. L'IMM è ulteriormente suddiviso nella membrana limite interna (IBM), che è strettamente appressata all'OMM, e strutture sporgenti chiamate cristae che sono legate dalla membrana cristae (CM). Questa membrana delinea il compartimento più interno della matrice dallo spazio intracristallino (ICS) e dallo spazio intermembrana (IMS).
I mitocondri hanno una morfologia dinamica basata su processi continui ed equilibrati di fissione e fusione che sono governati da meccanoenzimi della superfamiglia delle dinamine6. La fusione consente una maggiore connettività e formazione di reti reticolari, mentre la fissione porta alla frammentazione mitocondriale e consente la rimozione dei mitocondri danneggiati dalla mitofagia7. La morfologia mitocondriale varia in base al tipo di tessuto8 e allo stadio di sviluppo9 ed è regolata per consentire alle cellule di adattarsi a fattori quali i bisogni energetici 10,11 e i fattori di stress 12. Le caratteristiche morfometriche standard dei mitocondri, come l'estensione della formazione della rete (interconnessa vs. frammentata), il perimetro, l'area, il volume, la lunghezza (rapporto d'aspetto), la rotondità e il grado di ramificazione, possono essere misurate e quantificate dalla microscopia ottica standard perché le dimensioni di queste caratteristiche sono maggiori del limite di diffrazione della luce (~200 nm)13.
L'architettura di Cristae definisce la struttura interna dei mitocondri (Figura 1B). La diversità delle morfologie delle cristae può essere ampiamente classificata come piatta (lamellare o discoidale) o tubolare-vescicolare14. Tutte le cristae si attaccano all'IBM attraverso strutture tubolari o a fessura chiamate giunzioni cristae (CJ) che possono servire a compartimentare l'IMS dall'ICS e l'IBM dal CM15. La morfologia di Cristae è regolata da complessi proteici chiave dell'IMM, tra cui (1) il sito di contatto mitocondriale e il sistema organizzativo delle cristae (MICOS) che risiede a CJs e stabilizza i contatti IMM-OMM 16, (2) l'atrofia ottica 1 (OPA1) GTPasi che regola il rimodellamento delle cristae17,18,19 e (3) F1FO ATP sintasi che forma assemblaggi oligomerici stabilizzanti alle punte delle cristae (CT)20, Ore 21. Inoltre, l'IMM è arricchito con fosfolipidi non a doppio strato fosfatidiletanolammina e cardiolipina che stabilizzano l'IMM22 altamente curvo. I cristae sono anche dinamici, dimostrando cambiamenti morfologici in varie condizioni, come diversi stati metabolici 23,24, con diversi substrati respiratori 25, sotto fame e stress ossidativo 26,27, con apoptosi 28,29 e con invecchiamento 30. Recentemente è stato dimostrato che le cristae potrebbero subire importanti eventi di rimodellamento su una scala temporale di pochi secondi, sottolineando la loro natura dinamica31. Possono essere quantificate diverse caratteristiche delle cristae, tra cui le dimensioni delle strutture all'interno delle singole cristae (ad esempio, larghezza CJ, lunghezza e larghezza delle cristae) e parametri che mettono in relazione le singole crista con altre strutture (ad esempio, la spaziatura intra-cristae e l'angolo incidente delle cristae rispetto all'OMM)32. Questi parametri quantificabili mostrano una correlazione diretta con la funzione. Ad esempio, l'entità della produzione di ATP mitocondriale è positivamente correlata all'abbondanza di cristae, quantificata come densità di cristae o numero di cristae normalizzato a un'altra caratteristica (ad esempio, cristae per area OMM)33,34,35. Poiché la morfologia dell'IMM è definita da caratteristiche su scala nanometrica, comprende l'ultrastruttura mitocondriale, che richiede tecniche di imaging che forniscono una risoluzione superiore al limite di diffrazione della luce. Come descritto di seguito, tali tecniche includono la microscopia elettronica e la microscopia a super-risoluzione (nanoscopia).
Le cellule neurali e gliali del sistema nervoso centrale (SNC) dipendono in particolare dalla funzione mitocondriale. In media, il cervello costituisce solo il 2% del peso corporeo totale, ma utilizza il 25% del glucosio corporeo totale e rappresenta il 20% del consumo di ossigeno corporeo, rendendolo vulnerabile a disturbi del metabolismo energetico36. Le malattie neurodegenerative progressive (ND), tra cui il morbo di Alzheimer (AD), la sclerosi laterale amiotrofica (SLA), la malattia di Huntington (HD), la sclerosi multipla (SM) e il morbo di Parkinson (PD), sono alcune delle patologie più studiate fino ad oggi, con sforzi di ricerca che vanno dalla comprensione delle basi molecolari di queste malattie alla ricerca di potenziali prevenzione e interventi terapeutici. I ND sono associati a un aumento dello stress ossidativo originato in parte dalle specie reattive dell'ossigeno (ROS) generate dalla catena di trasporto degli elettroni mitocondriale (ETC)37, nonché da un'alterata gestione del calcio mitocondriale 38 e dal metabolismo lipidico mitocondriale39. Queste alterazioni fisiologiche sono accompagnate da difetti noti nella morfologia mitocondriale che sono associati a AD 40,41,42,43,44, ALS45,46, HD47,48,49, MS 50 e PD 51,52,53. Questi difetti strutturali e funzionali possono essere accoppiati da complesse relazioni di causa-effetto. Ad esempio, dato che la morfologia delle cristae stabilizza gli enzimi OXPHOS54, i ROS mitocondriali non solo sono generati dall'ETC, ma agiscono anche per danneggiare l'infrastruttura in cui risiede l'ETC, promuovendo un ciclo di ROS feed-forward che aumenta la suscettibilità al danno ossidativo. Inoltre, è stato dimostrato che la disorganizzazione delle cristae innesca processi come il rilascio di DNA mitocondriale (mtDNA) e le vie infiammatorie collegate a disturbi autoimmuni, metabolici e legati all'età55. Pertanto, l'analisi della struttura mitocondriale è la chiave per una piena comprensione delle ND e delle loro basi molecolari.
I metodi più diffusi di visualizzazione delle cristae, tra cui la microscopia elettronica a trasmissione, la tomografia elettronica e la tomografia crioelettronica (cryo-ET) e la tomografia a raggi X, in particolare la tomografia a raggi X crio-molli, hanno rivelato importanti risultati e funzionano con una varietà di tipi di campioni 56,57,58,59,60 . Nonostante i recenti progressi verso una migliore osservazione dell'ultrastruttura organellare, questi metodi hanno ancora l'avvertenza di richiedere la fissazione del campione e, quindi, non possono catturare direttamente le dinamiche in tempo reale delle cristae. La microscopia a fluorescenza a super-risoluzione, in particolare nelle forme di microscopia a illuminazione strutturata (SIM), microscopia a ricostruzione ottica stocastica (STORM), microscopia a localizzazione fotoattivata (PALM), microscopia ad espansione (ExM) e microscopia a deplezione di emissione stimolata (STED), sono diventati modi popolari di visualizzare strutture che richiedono una risoluzione inferiore al limite di diffrazione che vincola i metodi classici di microscopia ottica. Quando ExM viene utilizzato in combinazione con un'altra tecnica di super-risoluzione, i risultati sono impressionanti, ma il campione deve essere fissato e colorato in un gel61. In confronto, SIM, PALM/STORM e STED sono stati tutti utilizzati con successo con campioni vivi e nuovi e promettenti coloranti che generalmente colorano l'IMM forniscono un approccio nuovo e semplice per l'imaging dal vivo delle dinamiche 62,63,64,65,66 dei mitocondri. I recenti progressi nei coloranti vivi per l'imaging STED hanno migliorato la luminosità e la fotostabilità del colorante e questi coloranti mirano all'IMM con un grado di specificità più elevato rispetto ai loro predecessori. Questi sviluppi consentono la raccolta di esperimenti a lungo termine di timelapse e z-stack con imaging a super-risoluzione, aprendo la porta a una migliore analisi su cellule vive dell'ultrastruttura e della dinamica mitocondriale.
In questo documento, vengono forniti protocolli per l'imaging di cellule vive di cellule SH-SY5Y indifferenziate e differenziate colorate con il colorante PKmito Orange (PKMO) utilizzando STED63. La linea cellulare SH-SY5Y è un derivato tre volte subclonato della linea cellulare parentale, SK-N-SH, generata da una biopsia del midollo osseo del neuroblastoma metastatico67,68,69,70. Questa linea cellulare è un modello in vitro comunemente usato nella ricerca sulla ND, in particolare con malattie come AD, HD e PD, in cui la disfunzione mitocondriale è fortemente implicata 10,43,71,72,73. La capacità di differenziare le cellule SH-SY5Y in cellule con un fenotipo simile a quello dei neuroni attraverso la manipolazione dei terreni di coltura si è dimostrata un modello adatto per la ricerca neuroscientifica senza fare affidamento sulle cellule neuronali primarie10,74. In questo protocollo, l'acido retinoico (RA) è stato aggiunto al terreno di coltura cellulare per indurre la differenziazione delle cellule SH-SY5Y. L'artrite reumatoide è un derivato della vitamina A ed è stato dimostrato che regola il ciclo cellulare e promuove l'espressione dei fattori di trascrizione che regolano la differenziazione neuronale75. Viene inoltre fornito un protocollo per la coltura e l'imaging di cellule vive di neuroni isolati dall'ippocampo di ratto. È stato dimostrato che l'ippocampo è influenzato dalla degenerazione mitocondriale e, insieme alla corteccia, svolge un ruolo importante nell'invecchiamento e nella ND 76,77,78,79,80.
Protocollo
1. Propagazione e differenziamento delle cellule SH-SY5Y
- Preparazione di terreni per la crescita e il mantenimento delle cellule
- Preparare il terreno di coltura modificato di Dulbecco completo e ad alto contenuto di glucosio (DMEM, 4,5 g/L di D-glucosio, 4 mM di L-glutammina, 110 mg/L di piruvato di sodio) integrato con un antibiotico-antimicotico finale all'1% (v/v) (10.000 unità/mL di penicillina, 10.000 μg/mL di streptomicina e 25 μg/mL di amfotericina B) e quantità variabili di siero fetale bovino (FBS) (vedere Tabella dei materiali). Le quantità di FBS nei mezzi di differenziazione variano tra il 10%, il 5% o il 2% (v/v) finale di FBS.
- Manutenzione delle celle
- Mantenere le cellule in DMEM integrate con il 10% (v/v) di FBS e posizionarle a 37 °C e 5% di CO2, quindi seminare in DMEM contenente il 5% (v/v) di FBS per la differenziazione. I campioni di cellule congelate sono stati conservati in FBS con il 10% (v/v) di dimetilsolfossido (DMSO) a 1-2 x 107 cellule/mL.
- Preparazione dell'acido retinoico (RA)
- Sciogliere 7,51 mg di all-trans-RA (vedere Tabella dei materiali) in 5 mL di etanolo al 95% appena preparato per ottenere 5 mM di soluzione madre. Verificare la concentrazione con assorbanza a 350 nm (ɛ = 44.300 M-1 cm-1), ottenuta dalla scheda informativa del prodotto del protocollo81 del fabbricante, utilizzando una diluizione della soluzione madre a 5 μM in etanolo. Conservare una scorta da 5 mM al riparo dalla luce a 4 °C per un massimo di 6 settimane.
- Preparazione della poli-D-lisina per il rivestimento di vetrini coprioggetto
NOTA: Il protocollo del prodotto poli-D-lisina (PDL), disponibile nella sezione Documenti e download del sitodel fornitore 82, fornisce informazioni per il rivestimento di una varietà di recipienti di coltura.- Questo protocollo include volumi basati su un recipiente a 2 pozzetti con un'area di 4 cm2 per pozzetto con fondo sterile in vetro di copertura borosilicato #1,5 (vedi Tabella dei materiali). Diluire la soluzione madre di PDL due volte a 50 μg/mL con PBS di Dulbecco (DPBS; senza calcio, senza magnesio).
NOTA: Il vetro di copertura #1.5 o #1.5H sono entrambi spessori accettabili, essenziali per la qualità dell'immagine. Altri spessori indurranno aberrazione sferica e dovrebbero essere evitati.
- Questo protocollo include volumi basati su un recipiente a 2 pozzetti con un'area di 4 cm2 per pozzetto con fondo sterile in vetro di copertura borosilicato #1,5 (vedi Tabella dei materiali). Diluire la soluzione madre di PDL due volte a 50 μg/mL con PBS di Dulbecco (DPBS; senza calcio, senza magnesio).
- Rivestimento vetrino coprioggetto con PDL
NOTA: I vetrini coprioggetti possono essere esposti alla luce ultravioletta (UV) per 10-15 minuti in una cabina di biosicurezza per un'ulteriore sterilizzazione.- Applicare 1,2 mL di soluzione PDL da 50 μg/mL a ciascun pozzetto di vetrini coprioggetti sterili in una camera di coltura cellulare e incubare a temperatura ambiente per 1 ora. Rimuovere la soluzione PDL e risciacquare tre volte con 3,6 mL di acqua distillata. Dopo aver completato il lavaggio finale, lasciare asciugare la camera rivestita per 2 ore esposta all'aria prima di risciacquare e utilizzare immediatamente o conservare in un contenitore ermetico a 4 °C per un massimo di 2 settimane.
NOTA: Sciacquare accuratamente i vetrini coprioggetti poiché l'eccesso di PDL può essere tossico per le cellule.
- Applicare 1,2 mL di soluzione PDL da 50 μg/mL a ciascun pozzetto di vetrini coprioggetti sterili in una camera di coltura cellulare e incubare a temperatura ambiente per 1 ora. Rimuovere la soluzione PDL e risciacquare tre volte con 3,6 mL di acqua distillata. Dopo aver completato il lavaggio finale, lasciare asciugare la camera rivestita per 2 ore esposta all'aria prima di risciacquare e utilizzare immediatamente o conservare in un contenitore ermetico a 4 °C per un massimo di 2 settimane.
- Differenziamento delle cellule SH-SY5Y con AR
NOTA: Non utilizzare celle sopra il passaggio 15. Le cellule vengono fatte passare all'80%-90% di confluenza. Le procedure di differenziazione differiscono ma seguono passaggi simili. Un'ulteriore differenziazione dai neuroblastomi ai neuroni maturi è stata ottenuta con un ulteriore trattamento con il fattore neurotrofico derivato dal cervello (BDNF)68,83,84,85, ma non è stato eseguito in questo protocollo.
FACOLTATIVO: Stabilire le celle per almeno 24 ore prima della semina sul vetro di copertura. Per preparare le cellule da scorte congelate, scongelare rapidamente 1 mL di flaconcino congelato di cellule e aggiungerlo a 9 mL di terreno preriscaldato integrato con FBS al 10%, quindi centrifugare a 350 x g per 10 minuti (a temperatura ambiente) ed eliminare il surnatante per rimuovere il DMSO. Risospendere il pellet cellulare in 5 mL di terreno preriscaldato e le cellule seme in un matraccio T-25. Una volta che le cellule raggiungono l'80%-90% di confluenza, le cellule passano contandole e seminandole per la differenziazione, quando applicabile.- Giorno 0: Cellule del seme.
- Seminare le cellule su un vetro di copertura camerato da brodi congelati o da un pallone di lavoro. Utilizzare una densità di semina di 1,5 x 104 celle/cm2.
NOTA: Un singolo pozzetto in un vetro di copertura standard a 2 pozzetti con 4 cm2 di area di coltura richiederà 6,0 x 104 cellule. Le cellule che rimarranno indifferenziate devono essere seminate con DMEM integrato con FBS al 10% (v/v) e le cellule che saranno differenziate devono essere seminate con DMEM integrato con FBS al 5% (v/v).
- Seminare le cellule su un vetro di copertura camerato da brodi congelati o da un pallone di lavoro. Utilizzare una densità di semina di 1,5 x 104 celle/cm2.
- Giorno 1: Iniziare il trattamento di differenziazione dell'artrite reumatoide.
- Preparare DMEM integrato con FBS al 5% (v/v), antibiotico-antimicotico all'1% (v/v) e una concentrazione finale di 10 μM RA o etanolo dello stesso volume di additivo che funga da controllo del veicolo per questa procedura di differenziazione. Rimuovere il terreno nel vetro di copertura camerato utilizzato per la semina, risciacquare con 1x PBS e aggiungere il nuovo DMEM ai pozzetti.
- Giorno 3: Sostituire i terreni con terreni freschi contenenti RA o etanolo.
- Rimuovere i terreni dal giorno 1 e sostituirli con terreni freschi integrati con FBS al 2% (v/v), antibiotico-antimicotico all'1% (v/v) e 10 μM RA o etanolo al 95% dello stesso volume di additivo per fungere da controllo del veicolo per questa procedura di differenziazione. Rimuovere il terreno nel vetro di copertura camerato utilizzato per la semina, risciacquare con 1x PBS e aggiungere nuovo terreno ai pozzetti.
- Giorno 6: Eseguire l'imaging delle cellule.
NOTA: I tempi di differenziazione cellulare variano a seconda del protocollo, ma sei giorni di esposizione all'artrite reumatoide sono sufficienti per indurre un fenotipo simile a quello dei neuroni nelle cellule SH-SY5Y86.- Eseguire l'imaging in tempo reale, con i dettagli nelle sezioni 3 e 4 (Figura 2).
- Giorno 0: Cellule del seme.
2. Coltura primaria di neuroni ippocampali di ratto
- Preparazione dei materiali per l'isolamento dei neuroni dell'ippocampo di ratto.
- Preparare DMEM fresco integrato.
- Sterilizzare con filtro una miscela di DMEM (alto contenuto di glucosio, senza piruvato di sodio) integrata con FBS inattivato al calore al 10% (v/v), soluzione di piruvato di sodio all'1% (v/v) e penicillina-streptomicina all'1% (v/v) (10.000 U/mL). Conservare fino a 2 settimane a 4 °C.
- Preparare terreni di crescita neuronale freschi integrati.
- Sterilizzare con filtro una miscela di terreni di crescita neuronale integrati con un integratore di vitamina B27 al 2% (v/v), un integratore di glutammina allo 0,25% (v/v) e una penicillina-streptomicina all'1% (v/v) (vedere la tabella dei materiali). Conservare fino a 2 settimane a 4 °C.
- Preparare DMEM fresco integrato.
- Preparare la coltura primaria dei neuroni dell'ippocampo.
- Preparare la coltura primaria dei neuroni ippocampali seguendo il lavoro precedentemente pubblicato87 e dal protocollo del prodotto sul sito del produttore da cui è stato ottenuto l'ippocampo di ratto E18 sezionato88 (vedi Tabella dei materiali). Questo protocollo si traduce in una popolazione prevalentemente neuronale con il <2% di astrociti.
NOTA: I terreni di ibernazione con cui viene spedito questo tessuto verranno utilizzati per le fasi future di questo protocollo. Non gettarlo. - Preparare materiali e terreni per la dissociazione dei tessuti.
- Accendere una pipetta Pasteur per diminuire il diametro dell'apertura e conservarla in un foglio di alluminio per evitare contaminazioni fino all'uso. Preriscaldare il DMEM preparato, la soluzione salina tamponata 1X Hank (HBSS) e i terreni di crescita neuronale a 37 °C. Aggiungere 2 scaglie di DNAasi con una pinzetta sterile in una provetta conica da 15 ml.
- Eseguire la dissociazione dei tessuti.
- Rimuovere il più possibile il terreno di ibernazione in cui è conservato l'ippocampo di ratto E18 sezionato prima di inserire il tessuto nella provetta conica da 15 mL contenente DNAasi e incubare brevemente a 37 °C. Aggiungere 900 μL di 1X HBSS seguiti da 100 μL di tripsina allo 0,5%. Incubare il tessuto a 37 °C per 15 min.
NOTA: Le piastre rivestite in PDL possono essere rimosse dalla conservazione e riposte in un'incubatrice fino all'uso durante questo periodo di incubazione.
- Rimuovere il più possibile il terreno di ibernazione in cui è conservato l'ippocampo di ratto E18 sezionato prima di inserire il tessuto nella provetta conica da 15 mL contenente DNAasi e incubare brevemente a 37 °C. Aggiungere 900 μL di 1X HBSS seguiti da 100 μL di tripsina allo 0,5%. Incubare il tessuto a 37 °C per 15 min.
- Eseguire l'omogeneizzazione dei tessuti e il conteggio delle cellule.
- Dopo l'incubazione con tripsina, rimuovere il terreno e aggiungere 1 mL di media-DNAasi di ibernazione preriscaldata dal passaggio precedente al tessuto e omogeneizzare con la pipetta Pasteur. I media appariranno opachi e poi gradualmente chiari man mano che l'omogeneizzazione continua.
- Aggiungere i neuroni dissociati in una nuova provetta con 4 mL di DMEM preriscaldato e quindi contare le cellule utilizzando un contatore di cellule.
- Eseguire la placcatura cellulare e la crescita delle cellule primarie.
- Celle a piastra con una densità di circa 1,65 x 104 cellule/cm2 in DMEM. Per un vetro di copertura a 2 pozzetti (4 cm 2), seminare 65.000 – 70.000 cellule per pozzetto con2 mL di DMEM. Incubare le cellule a 37 °C e 5% di CO 2 per2 ore prima di verificarne l'aderenza. Una volta che le cellule iniziano ad aderire, rimuovere 1 mL di terreno e sostituirlo con lo stesso volume di terreno di ibernazione, quindi agitare delicatamente per mescolare. Una volta che il terreno è mescolato, ripetere questo processo e rimuovere metà del terreno presente e sostituirlo con lo stesso volume di terreno di crescita neuronale, quindi mescolare delicatamente.
NOTA: Il giorno della placcatura è considerato giorno in vitro (DIV) 0 e le cellule sono pronte per l'immagine a DIV 7 (Figura 2).
- Celle a piastra con una densità di circa 1,65 x 104 cellule/cm2 in DMEM. Per un vetro di copertura a 2 pozzetti (4 cm 2), seminare 65.000 – 70.000 cellule per pozzetto con2 mL di DMEM. Incubare le cellule a 37 °C e 5% di CO 2 per2 ore prima di verificarne l'aderenza. Una volta che le cellule iniziano ad aderire, rimuovere 1 mL di terreno e sostituirlo con lo stesso volume di terreno di ibernazione, quindi agitare delicatamente per mescolare. Una volta che il terreno è mescolato, ripetere questo processo e rimuovere metà del terreno presente e sostituirlo con lo stesso volume di terreno di crescita neuronale, quindi mescolare delicatamente.
- Preparare la coltura primaria dei neuroni ippocampali seguendo il lavoro precedentemente pubblicato87 e dal protocollo del prodotto sul sito del produttore da cui è stato ottenuto l'ippocampo di ratto E18 sezionato88 (vedi Tabella dei materiali). Questo protocollo si traduce in una popolazione prevalentemente neuronale con il <2% di astrociti.
3. Preparazione di cellule per l'imaging di cellule vive
NOTA: I tipi di cellule e l'origine (ad esempio, cellule coltivate e primarie) possono differire nei requisiti di colorazione; Per maggiori dettagli, vedere i rapporti pubblicati62,63.
- Preparazione di PKmito Orange
NOTA: Altri coloranti che generalmente macchiano l'IMM sono stati segnalati64,65,66 e sono disponibili in commercio. PKMO è l'unico utilizzato in questo protocollo.- Sospendere la polvere PKMO (vedere la tabella dei materiali) in DMSO secondo le istruzioni del produttore89. Aspirare il terreno dalle cellule e lavarlo in un terreno privo di rosso fenolo preriscaldato. Preparare una scorta di PKMO in DMEM preriscaldato, privo di rosso fenolo, integrato con FBS al 2% (v/v) o al 10% (v/v) a seconda dello stato di differenziazione, HEPES a una concentrazione finale di 20 mM e antibiotico-antimicotico all'1% (v/v) prima di colorare le cellule seguendo le istruzioni del produttore. Questa formulazione, senza PKMO, è il terreno di imaging delle cellule vive.
- Colorazione cellulare con PKMO
- Incubare le cellule con il colorante a 37 °C e 5% di CO2 per 30 min. Lavare le cellule tre volte con terreni di imaging di cellule vive e, per il lavaggio finale, incubare per 30 minuti a 37 °C, 5% di CO2 .
- Aggiungere terreni di imaging per cellule vive freschi e preriscaldati. Le cellule sono ora pronte per l'imaging.
NOTA: I trattamenti acuti (ad es. farmaci e/o fattori di stress), se utilizzati, vengono aggiunti prima dell'imaging dal vivo; vedere la sezione Discussione e la Figura 1 supplementare.
4. Imaging di cellule vive mediante microscopia STED
NOTA: Questo protocollo utilizza un sistema STED costruito attorno a un microscopio invertito, con il sistema specificato nella Tabella dei materiali. Questo sistema è dotato di laser ad eccitazione pulsata (laser da 561 nm con potenza nominale ~300 μW) e di un laser a svuotamento STED pulsato da 775 nm (potenza nominale 1,2 W), di uno scanner galvano a regolazione continua e di un rilevatore a fotodiodo da valanga (APD) basato su filtro da 615/20 nm. In questo caso viene utilizzata una lente a immersione in olio 100x/1,40 per STED. Il software Lightbox viene utilizzato per l'acquisizione delle immagini. Tutti i dettagli forniti sono direttamente correlati a questo software e alla configurazione del sistema.
- Linee guida generali e passaggi per l'imaging
- Utilizzare un incubatore o una camera ambientale per mantenere la vitalità cellulare, ma sono accettabili anche esperimenti a breve termine a temperatura ambiente. Questi passaggi sono specifici per la configurazione STED descritta in precedenza.
- Selezionare i set di laser e filtri per l'imaging.
- Utilizzare i parametri per un colorante arancione selezionando il colorante o i coloranti utilizzati nella colorazione dall'elenco dei coloranti o quello con proprietà spettrali più vicine al colorante o ai coloranti utilizzati. Per renderli attivi, fai doppio clic o trascinali nell'elenco dei campioni, dove viene visualizzato il messaggio "Trascina qui i coloranti".
- Selezionare un'area di cui creare l'immagine.
- In una panoramica, creare una regione di interesse (ROI) attorno a un mitocondrio di interesse selezionando il pulsante ROI rettangolare e facendo clic e trascinando per modellare la regione. La ROI può essere ridimensionata e ruotata utilizzando gli angoli ROI o i bordi curvi che appaiono quando si passa il mouse su un angolo.
NOTA: Un riepilogo dei parametri di imaging suggeriti è disponibile nella Tabella 1. Questi parametri sono stati aggiustati empiricamente utilizzando quelli precedentemente riportati per questa configurazione STED e combinazione di coloranti63.
- In una panoramica, creare una regione di interesse (ROI) attorno a un mitocondrio di interesse selezionando il pulsante ROI rettangolare e facendo clic e trascinando per modellare la regione. La ROI può essere ridimensionata e ruotata utilizzando gli angoli ROI o i bordi curvi che appaiono quando si passa il mouse su un angolo.
- Impostare il gating.
- Accanto al menu Generale , seleziona il menu Gating o fai clic e tieni premuto per aggiungere il menu alla vista. Si raccomanda di regolare il gating del rivelatore STED da 1-1,05 a 7,8-7,85 ns, come presentato qui. I tempi di iniezione possono variare ed essere brevi da 1-1,05 a 7-7,05 ns.
- Regolare l'intensità in modo appropriato in base al campione.
NOTA: Generalmente, la potenza di eccitazione utilizzata per STED è 2-3 volte la potenza utilizzata per la confocale, quindi un campione che richiede una potenza laser di eccitazione del 5% per la confocale può utilizzare una potenza laser di eccitazione del 10%-15% durante l'acquisizione STED.- Impostare il laser di eccitazione per STED al 15%-20% e il laser di svuotamento STED al 20%-25% con 10 accumuli di linee. Utilizzare un tempo di permanenza dei pixel di 4 μs con una dimensione dei pixel di 20-25 nm. Il foro stenopeico è stato mantenuto a 1,0 UA per le cellule in coltura e a 0,7 UA per le cellule ippocampali primarie di ratto al fine di migliorare il sezionamento ottico nei mitocondri più densamente impacchettati.
NOTA: Le immagini confocali e STED possono essere acquisite per il confronto fianco a fianco (Figura 3A, B, Figura 4A) oppure è possibile acquisire solo STED.
- Impostare il laser di eccitazione per STED al 15%-20% e il laser di svuotamento STED al 20%-25% con 10 accumuli di linee. Utilizzare un tempo di permanenza dei pixel di 4 μs con una dimensione dei pixel di 20-25 nm. Il foro stenopeico è stato mantenuto a 1,0 UA per le cellule in coltura e a 0,7 UA per le cellule ippocampali primarie di ratto al fine di migliorare il sezionamento ottico nei mitocondri più densamente impacchettati.
- Informazioni aggiuntive per le serie temporali/serie z
- Selezionare la serie temporale.
- Seleziona il menu a discesa Ora. Definire il numero di iterazioni (5 utilizzate qui) e l'intervallo di tempo (25 o 30 s utilizzato qui) desiderato per un timelapse (Figura 3C, D, Figura 4B).
NOTA: Se l'intervallo è più breve del tempo di acquisizione, le iterazioni continueranno senza alcun ritardo. Quando si esegue un timelapse, si consiglia vivamente di attivare un'unità di messa a fuoco perfetta o un tracciamento della messa a fuoco simile per evitare potenziali derive.
- Seleziona il menu a discesa Ora. Definire il numero di iterazioni (5 utilizzate qui) e l'intervallo di tempo (25 o 30 s utilizzato qui) desiderato per un timelapse (Figura 3C, D, Figura 4B).
- Impostare l'intervallo del volume.
- Impostare l'intervallo del volume z come desiderato abilitando l'opzione Volume e regolando le due estremità dell'intervallo. Le dimensioni dei passi utilizzate in questo protocollo per l'imaging 2D erano di 150-200 nm. La dimensione del passo raccomandata rispetto al campionamento di Nyquist richiesto per la deconvoluzione di STED grezzi può essere calcolata con gli strumenti online90.
NOTA: La potenza del laser di esaurimento STED e il numero di piani ripresi possono aumentare il fotosbiancamento del colorante e l'esposizione alla luce della cellula a livelli dannosi. Verificare la presenza di segni di fototossicità e fotodanneggiamento dopo l'acquisizione.
- Impostare l'intervallo del volume z come desiderato abilitando l'opzione Volume e regolando le due estremità dell'intervallo. Le dimensioni dei passi utilizzate in questo protocollo per l'imaging 2D erano di 150-200 nm. La dimensione del passo raccomandata rispetto al campionamento di Nyquist richiesto per la deconvoluzione di STED grezzi può essere calcolata con gli strumenti online90.
- Selezionare la serie temporale.
5. Strumenti di elaborazione e analisi per l'ultrastruttura mitocondriale
NOTA: L'elaborazione delle immagini (cioè la deconvoluzione) è facoltativa, ma in genere viene utilizzata durante la creazione e l'analisi di immagini STED per la pubblicazione. La deconvoluzione per migliorare il contrasto e ridurre il rumore è altamente consigliata per una segmentazione ottimale delle singole cristae, come descritto di seguito (Figura 2).
- Deconvoluzione dell'immagine STED
NOTA: Il software utilizzato per la deconvoluzione in questo protocollo è fornito nella Tabella dei materiali.- Impostare i parametri microscopici dell'immagine.
NOTA: Assicurarsi che i metadati del microscopio siano inseriti correttamente nei parametri microscopici dell'immagine. Ciò include il montaggio di un indice di rifrazione medio; mezzo di immersione; dimensione dei pixel; lunghezze d'onda di eccitazione, emissione e svuotamento; e qualsiasi altra informazione pertinente. I modelli con questi parametri possono essere salvati per essere riutilizzati. - Deconvoluzione delle immagini STED grezze con l'algoritmo software.
- L'accesso agli algoritmi di deconvoluzione automatizzati nel software di deconvoluzione consente l'elaborazione delle immagini di deconvoluzione senza interruzioni. Selezionare il pulsante Express e impostare il tipo di deconvoluzione su Veloce, Standard, Aggressivo o Conservativo per vari gradi di potenza di deconvoluzione. Vengono mostrate immagini rappresentative che utilizzano Express Deconvolution con impostazioni aggressive (Figura 3, Figura 4 e Figura 5).
- Salvare le immagini dal software di deconvoluzione in formato ICS2.
- Per la deconvoluzione manuale, attenersi alla seguente procedura.
- In breve, quando si esegue la deconvoluzione manuale, salvare i modelli della procedura guidata di deconvoluzione per coerenza e avere la possibilità di caricare un modello all'avvio della procedura guidata. Utilizzare le informazioni della funzione di diffusione del punto di misura (PSF) se generate con l'impostazione e i parametri di acquisizione.
- Ritaglia l'immagine STED raw, se necessario, prima che il software di deconvoluzione stabilizzi automaticamente l'immagine. I componenti aggiuntivi ai pacchetti software di deconvoluzione consentono una compensazione specifica di possibili artefatti di imaging come la deriva termica e le aberrazioni cromatiche.
- Successivamente, genera un istogramma logaritmico per eseguire manualmente o automaticamente la sottrazione dello sfondo. Selezionare l'algoritmo di deconvoluzione CMLE (Maximum Likelihood Estimation) classico.
NOTA: Per la deconvoluzione, i valori chiave da regolare sono la soglia del rapporto segnale/rumore, il numero di iterazioni e la soglia di qualità. Questi valori possono essere regolati e la deconvoluzione può essere visualizzata in anteprima per determinare le impostazioni ottimali.
- Impostare i parametri microscopici dell'immagine.
- Segmentazione e analisi particellare
NOTA: Questo protocollo utilizza FIJI (Is Just ImageJ), un software open source (vedere Tabella dei materiali), per la segmentazione e l'analisi. A questi scopo sono disponibili altri software comparabili, tra cui CellProfiler, Icy, Ilastik e QuPath.- Preparare le immagini per la segmentazione.
- Aprire le immagini STED raw .obf o i file .ics2 dal software di deconvoluzione selezionando File → Apri o facendo clic e trascinando i file sulla barra degli strumenti di ImageJ. Da qui, qualsiasi elaborazione che renda le immagini più facili da segmentare può essere eseguita prima della segmentazione.
- Per mantenere coerenti le modifiche, registra le funzioni utilizzando Plugin → Macro → Registra e copia e incolla i comandi da tastiera in una nuova macro, da Plugin → Nuova macro →. Assicurarsi di selezionare l'immagine da elaborare prima di eseguire la macro.
NOTA: le modifiche comunemente accettabili per la quantificazione delle dimensioni e della forma includono il ritaglio, la proiezione di una pila z e la sottrazione dello sfondo con l'arrotondamento disabilitato. Le alterazioni devono essere eseguite in modo coerente tra le immagini all'interno di un set di dati e segnalate.
- Regola le impostazioni di segmentazione Weka addestrabili
NOTA: Sono stati pubblicati ulteriori dettagli con istruzioni dettagliate per l'utilizzo dello strumento di segmentazione semiautomatica e delle analisi a valle per i mitocondri91.- Apri le immagini STED deconvolse nel plug-in Trainable Weka Segmentation (TWS)92 , che si trova in Plugins → Segmentation → Trainable Weka Segmentation. Nelle impostazioni di segmentazione, selezionare le funzioni Sfocatura gaussiana, Proiezioni a membrana e Filtro Sobel . Il valore predefinito dello spessore della membrana è 1 e il valore predefinito della dimensione della patch della membrana è 19.
- Etichettare la classe 1 o 2 come "Cristae" e l'altra come "Background" (Figura 2). I modelli possono anche essere salvati con il pulsante Salva classificatore . Selezionare il classificatore Carica per riutilizzare queste impostazioni per altre immagini.
- Eseguire le tracce della classe TWS.
- Usa lo strumento linea o altre forme per evidenziare alcune delle cristae o dello sfondo. Almeno alcune selezioni di sfondo dovrebbero includere spazi tra le cristae. Disegna una linea sulla struttura da assegnare a una delle classi, quindi seleziona il pulsante Aggiungi a sul lato destro per le cristae o lo sfondo. Fare doppio clic su una traccia per rimuovere la struttura dall'etichetta.
- Eseguire l'addestramento alla classificazione TWS.
- Seleziona il pulsante Train classifier sul lato sinistro per generare una mappa in base alle informazioni fornite al plug-in. La sovrapposizione di classi segmentate può essere attivata e disattivata con il pulsante Attiva/disattiva sovrapposizione e l'opacità della sovrapposizione può essere regolata in Impostazioni. È possibile ripetere il training del classificatore con etichette aggiuntive. Una volta soddisfatto, seleziona il pulsante Ottieni probabilità.
- Misura le particelle.
- Usando la mappa di probabilità cristae, sospendi l'immagine per generare una maschera e poi vai su Analizza → Analizza particelle. In genere, è possibile utilizzare il tipo di soglia predefinito e regolare l'intervallo per garantire che vengano prese in considerazione tutte le cristae. Le misurazioni fornite dall'analisi delle particelle possono essere regolate da Analizza → Imposta misurazioni.
NOTA: Esempi di parametri di dimensioni e forma come l'area, il perimetro, la circolarità e il rapporto d'aspetto delle cristae vengono misurati e visualizzati in base alle misurazioni selezionate (Figura 2, Figura 5A, Tabella supplementare 1). - FACOLTATIVO: selezionare l'immagine STED raw con le stesse dimensioni dell'immagine deconvoluta e applicare le ROI dal manager, quindi selezionare Measure nel ROI manager per ottenere i valori di intensità.
- Usando la mappa di probabilità cristae, sospendi l'immagine per generare una maschera e poi vai su Analizza → Analizza particelle. In genere, è possibile utilizzare il tipo di soglia predefinito e regolare l'intervallo per garantire che vengano prese in considerazione tutte le cristae. Le misurazioni fornite dall'analisi delle particelle possono essere regolate da Analizza → Imposta misurazioni.
- Ottenere grafici lineari.
- I grafici lineari sono stati generati dalle immagini STED deconvolve. Disegnare una linea a più punti, regolare lo spessore della linea su diversi pixel di larghezza per mediare il rumore e scanalatura della linea per adattarla ai mitocondri (Figura 2, Figura 5B). Il grafico a linee risultante generato viene utilizzato per misurare le distanze da picco a picco per riportare la periodicità e la distribuzione delle cristae in un determinato intervallo.
NOTA: Correlativamente, la densità delle cristae può essere riportata come il conteggio delle cristae indipendenti all'interno di una data area determinata misurando la parte esterna dei mitocondri. L'area mitocondriale può essere determinata applicando un filtro all'immagine STED deconvoluta o grezza per generare una maschera. Assicurarsi che la maschera si adatti accuratamente al contorno dei mitocondri prima di misurare l'area.
- I grafici lineari sono stati generati dalle immagini STED deconvolve. Disegnare una linea a più punti, regolare lo spessore della linea su diversi pixel di larghezza per mediare il rumore e scanalatura della linea per adattarla ai mitocondri (Figura 2, Figura 5B). Il grafico a linee risultante generato viene utilizzato per misurare le distanze da picco a picco per riportare la periodicità e la distribuzione delle cristae in un determinato intervallo.
- Preparare le immagini per la segmentazione.
Risultati
Questo protocollo descrive le condizioni di crescita cellulare per cellule in coltura e primarie con particolare attenzione all'imaging di cellule STED vive e alle successive analisi delle cristae mitocondriali. Le proiezioni effettuate con ImageJ dei mitocondri di cellule SH-SY5Y indifferenziate (Figura 3A) e SH-SY5Y differenziate con RA (Figura 3B) possono essere raccolte come z-stack con confocali e STED tradizionali e le immagini STED grezze possono quindi essere deconvolute. È anche possibile eseguire l'imaging timelapse e successivamente deconvolgerlo (Figura 3C,D). Utilizzando parametri di imaging leggermente diversi per i neuroni primari dell'ippocampo di ratto (Tabella 1), le immagini STED confocali e grezze possono essere acquisite come z-stack e le immagini STED grezze possono essere deconvolse (Figura 4A). È anche possibile l'imaging timelapse dei mitocondri dai neuroni primari (Figura 4B). In generale, le immagini time-lapse dovrebbero essere in grado di mostrare eventi dinamici mitocondriali.
Quando le proiezioni dello z-stack STED grezzo e STED deconvolse dei campioni utilizzati per la segmentazione appaiono coerenti, vengono eseguite misurazioni quantitative. Il plug-in TWS utilizza l'immagine STED deconvoluta per segmentare per creare una maschera di probabilità, che viene quindi utilizzata per creare una maschera binaria delle cristae per ottenere i parametri di dimensione e forma (Figura 5A). Le regioni di questa maschera vengono salvate in Gestione ROI e, se lo si desidera, possono essere applicate all'immagine STED grezza per misurare le differenze di intensità relativa. Le proiezioni STED deconvolse possono essere utilizzate anche per determinare la periodicità e la densità delle cristae in una data area (Figura 5B).
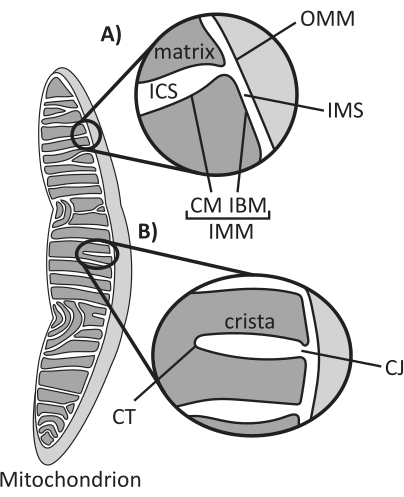
Figura 1: Morfologia mitocondriale. I mitocondri hanno un sistema a due membrane che definisce diversi sottocompartimenti (A). Le criste sono pieghe della membrana interna con caratteristiche definite (B). Abbreviazioni: OMM, membrana mitocondriale esterna; ICS, spazio intracristale; IMS, spazio intermembrana; CM, membrana cristae; IBM, membrana perimetrale interna; IMM, membrana mitocondriale interna; CT, punta cristae; CJ, giunzione cristae. Fare clic qui per visualizzare una versione più grande di questa figura.
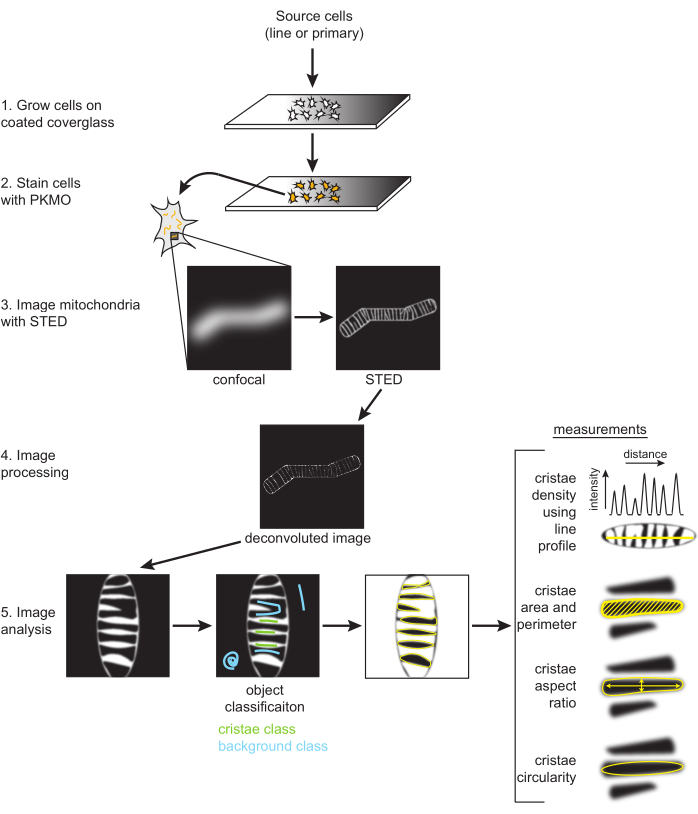
Figura 2: Schema del flusso di lavoro. Le cellule SH-SY5Y o i neuroni primari dell'ippocampo di ratto vengono coltivati su un vetro di copertura rivestito in PDL. Le cellule SH-SY5Y vengono coltivate in parallelo per rimanere indifferenziate o sottoposte a differenziamento dell'artrite reumatoide nel corso di sei giorni. I neuroni primari dell'ippocampo di ratto sono stati coltivati su un vetro di copertura rivestito di PDL dopo essere stati isolati da sezioni ippocampali per sette giorni. Una volta pronte per essere sottoposte a imaging, le cellule sono state colorate con PKMO e sottoposte a imaging con STED. Le immagini STED grezze vengono quindi deconvolute e le immagini deconvolute vengono elaborate in FIJI per ottenere misure di dimensioni e forma, come la densità delle cristae, l'area, il perimetro, la circolarità e le proporzioni. Fare clic qui per visualizzare una versione più grande di questa figura.
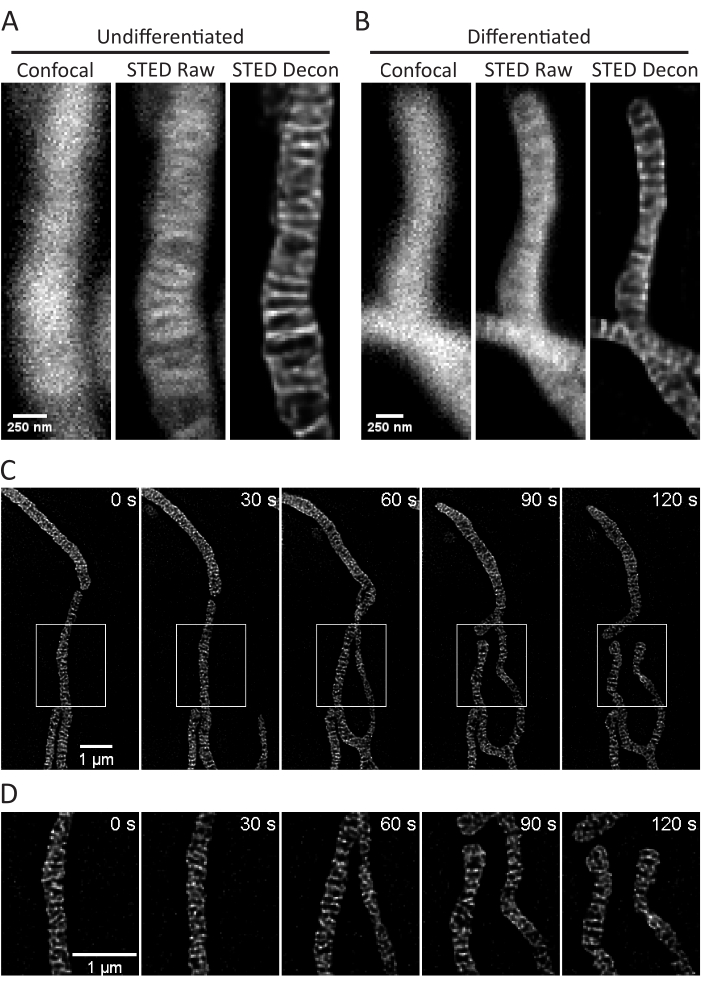
Figura 3: Imaging dei mitocondri nelle cellule SH-SY5Y. Sono mostrate proiezioni rappresentative confocali (a sinistra), STED grezze (al centro) e immagini STED deconvolse di Huygens (a destra) di mitocondri di cellule SH-SY5Y non differenziate (A) e RA-differenziate (B) con colorazione PKMO. Viene mostrato un timelapse con intervalli di 30 secondi e 5 iterazioni di cellule SH-SY5Y differenziate con AR (C) con le regioni selezionate (caselle bianche) espanse (D) utilizzando immagini in scala di quelle regioni senza interpolazione. Barre della scala: A,B, 250 nm; C,D, 1 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
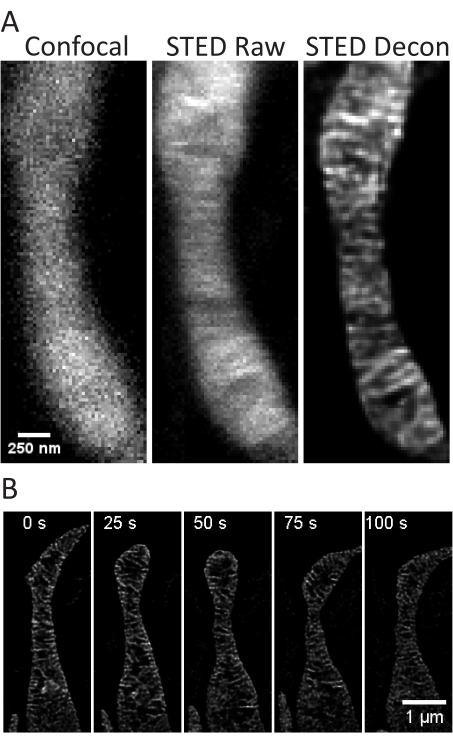
Figura 4: Imaging dei mitocondri nei neuroni primari dell'ippocampo di ratto. Vengono mostrate le proiezioni rappresentative confocali (a sinistra), STED grezze (al centro) e STED deconvolse di Huygens (a destra) dei mitocondri dei neuroni ippocampali primari del ratto (A). Viene mostrato un timelapse con intervalli di 25 s e 5 iterazioni di mitocondri in questi neuroni (B). Barre della scala: A, 250 nm; B, 1 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
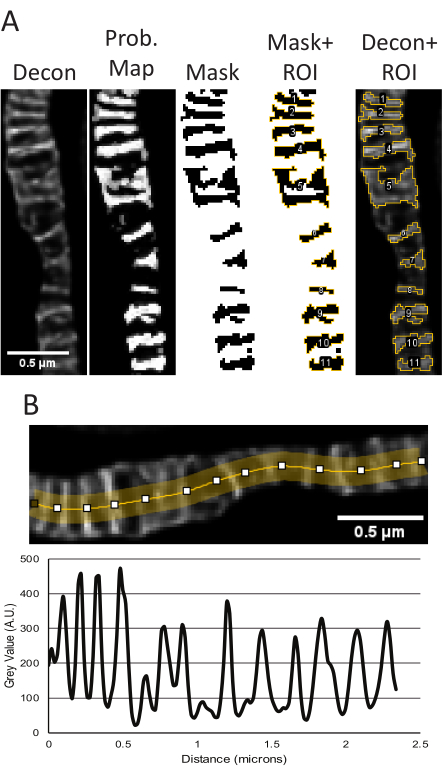
Figura 5: Elaborazione di immagini STED deconvolse in ImageJ. Viene mostrato l'uso rappresentativo del plug-in Trainable Weka Segmentation per misurare le dimensioni e la forma delle cristae (A). Da sinistra a destra, vengono mostrate le seguenti immagini: l'immagine STED deconvoluta, la mappa di probabilità basata sulla segmentazione dal plug-in TWS, la maschera di soglia in FIJI utilizzando la mappa di probabilità come input, la maschera con le ROI delineate e le ROI sovrapposte all'immagine STED deconvoluta originale. Le misurazioni risultanti di area, perimetro, circolarità e rapporto d'aspetto corrispondenti a questi oggetti sono riportate nella Tabella supplementare 1. Viene mostrato un grafico a linee che utilizza l'immagine STED deconvoluta per misurare le distanze picco-picco come lettura della densità delle cristae (B). Barre della scala: 0,5 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
| Dimensione dei pixel (nm) | Tempo di permanenza (μs) | Linea acc. | Eccitazione a 561 nm durante l'acquisizione STED (%) | 775 nm Potere di svuotamento STED (%) | Dimensione del passo (nm) | Foro stenopeico (AU) | Intervallo timelapse (s) | Iterazioni timelapse | |
| SH-SY5Y indifferenziato | 20 | 4 | 10 | 15 | 20 | 200 | 1.0 | 30 | 5 |
| RA-Differenziato SH-SY5Y | 20-25 | 4 | 10-12 | 15 | 20-22 | 150-200 | 1.0 | 30 | 5 |
| Neuroni primari | 20-25 | 4 | 10 | 10 | 25 | 200 | 0.7 | 30 | 5 |
| NOTA: la dimensione dei pixel può variare in base ai requisiti di imaging e all'intenzione di deconvolgere le immagini. Per la deconvoluzione è necessario un campionamento adeguato. Le dimensioni dei pixel per le immagini STED grezze senza deconvoluzione possono arrivare fino a 30 nm. | |||||||||
Tabella 1: Riepilogo dei parametri di acquisizione STED. Vengono visualizzate le impostazioni utilizzate per l'imaging STED 2D per ciascun tipo di cellula, SH-SY5Y indifferenziato, SH-SY5Y differenziato con AR e neuroni ippocampali primari di ratto. Per tutti i time-lapse, sono state effettuate 5 iterazioni con intervalli variabili in base alle dimensioni del ROI.
Figura 1 supplementare: Imaging di cellule SH-SY5Y con aggiunta di β amiloide (Aβ). Sono mostrate immagini rappresentative confocali (a sinistra), STED grezze (al centro) e STED deconvolse (a destra) di cellule SH-SY5Y differenziate con AR con colorazione PKMO (in alto) e Aβ-HiLyte647 (in basso) (A). Vengono mostrate le proiezioni z-stack unite di STED PKMO grezzo (verde) con STED Aβ grezzo (magenta) (B) o PKMO STED deconvolato (verde) con STED Aβ deconvolato (magenta) (C). Barre graduate: 0,5 μm. Clicca qui per scaricare questo file.
Tabella supplementare 1: Misure delle dimensioni e della forma delle cristae segmentate. Vengono mostrate le misure di dimensioni e forma dell'area (μm2), del perimetro (μm), della circolarità e delle proporzioni, corrispondenti agli oggetti delineati nella Figura 5A dai mitocondri segmentati. Fare clic qui per scaricare il file.
Tabella supplementare 2: Riepilogo dei parametri di acquisizione con campioni β amiloide. Vengono visualizzate le impostazioni utilizzate per l'imaging STED 2D di PKMO e Aβ-HiLyte647 in cellule SH-SY5Y indifferenziate e differenziate con AR. Il confocale di Aβ-HiLyte647 può essere utilizzato da solo in quanto non esiste una struttura specifica da risolvere; Le immagini STED di Aβ-HiLyte647 sono mostrate qui per le dimensioni delle particelle più piccole. Fare clic qui per scaricare il file.
File supplementare 1: Protocollo di trattamento β amiloide. Fare clic qui per scaricare il file.
Discussione
Questo protocollo presenta l'uso della linea cellulare di neuroblastoma umano SH-SY5Y e dei neuroni primari dell'ippocampo di ratto con il nuovo colorante PKMO mirato all'IMM per l'imaging di cellule STED vive. A causa della novità del PKMO, attualmente è stato pubblicato poco sull'uso di questo colorante per l'imaging di STED vive. L'uso di questi tipi di cellule per l'imaging delle malattie sessualmente trasmissibili pone delle sfide, in particolare perché le cellule neuronali hanno mitocondri più stretti. Una limitazione di questo protocollo è il colorante PKMO utilizzato, in quanto può essere tossico per le cellule. Diverse cellule e linee cellulari rispondono in modo diverso al colorante, quindi possono essere necessari aggiustamenti della concentrazione del colorante e del tempo di incubazione per ottimizzare i risultati per un segnale forte senza danneggiare le cellule. Una soluzione suggerita è quella di abbassare la concentrazione e aumentare il tempo di colorazione63; Tuttavia, ciò può comportare una colorazione più scadente senza aumentare la vitalità cellulare.
Analogamente al PKMO, anche il colorante commerciale Live Orange mito (Table of Materials) presenta una certa tossicità cellulare. Questo colorante è stato utilizzato per una varietà di cellule in coltura, ma non è stato in grado di mostrare una colorazione comparabile nelle cellule SH-SY5Y differenziate con AR con successo con gli stessi parametri delle loro controparti indifferenziate (nostre osservazioni non pubblicate). Tuttavia, i protocolli di colorazione amabili possono essere ottimizzati per questa sonda e per i tipi di cellule scelti. Con questo colorante, sono stati utilizzati tempi di gating del rivelatore da 1-1,05 a 7-7,05 ns, mentre tutti gli altri parametri nella Tabella 1 sono rimasti invariati. Generalmente, la colorazione delle cellule con 200-250 nM di Live Orange mito per 45 minuti ha prodotto risultati comparabili a quelli mostrati dai risultati di PKMO. La colorazione a concentrazione più elevata per meno tempo o la colorazione a concentrazione più bassa per lo stesso periodo di tempo o leggermente più a lungo possono produrre risultati diversi e possono essere favorevoli ad altri tipi di cellule o condizioni di crescita.
L'imaging dei neuroni primari dell'ippocampo di ratto differisce dalle cellule immortalizzate a causa della natura delle proiezioni dell'assone e del dendrite, nonché della distribuzione mitocondriale al momento dell'imaging. Una difficoltà in questa parte del protocollo è che la densità di semina determina se le colture primarie saranno in grado di aderire e crescere in modo sano e, a densità più elevate, le proiezioni tendono a crescere eccessivamente entro DIV 10. Pertanto, i mitocondri visualizzati da questi neuroni primari proverranno probabilmente dal corpo cellulare e non dalle proiezioni; Tuttavia, una crescita di successo da una densità cellulare iniziale inferiore produce migliori risultati di imaging in tempi di crescita successivi. La chiave è garantire uno sfondo basso e una luce sfocata per avere il miglior contrasto per STED. Per affrontare le preoccupazioni relative alla popolazione cellulare, la coltura di cellule ippocampali primarie in terreni di crescita neuronali integrati con B27 impedisce la crescita delle cellule gliali e la fonte riferisce che il <5% delle cellule sono astrociti e l'assenza di supplemento di NbActiv1 nei mezzi di crescita riduce il numero di astrociti nelle colture al <2%87. Sia per le cellule SH-SY5Y in coltura che per i neuroni primari dell'ippocampo di ratto, il rivestimento PDL utilizzato per la crescita contribuisce alla foschia di fondo nelle immagini. Con le impostazioni riportate nella Tabella 1 si ottiene un rapporto segnale/rumore sufficiente e la deconvoluzione rimuove la maggior parte dello sfondo osservato.
Oltre all'imaging trattato qui, è anche possibile aggiungere trattamenti o stress alle cellule prima o durante l'imaging. Ad esempio, l'aggiunta di perossido di idrogeno terz-butile (tBHP) induce stress ossidativo ed è possibile monitorare i cambiamenti nei mitocondri nel tempo dopo l'aggiunta. L'aggiunta di β amiloide (Aβ) con un tag fluorescente consente di monitorare la distribuzione di questo peptide in relazione ai mitocondri e la struttura mitocondriale nel tempo. La salute mitocondriale è stata fortemente implicata nell'AD ed è ampiamente supportata per svolgere un ruolo nella tossicità dell'Aβ 43,71,72. In particolare, lo stato di differenziazione delle cellule SH-SY5Y influenza la localizzazione del precursore della proteina Aβ (AβPP)85 e gli esperimenti che utilizzano AβPP devono essere costruiti con attenzione.
Come esempio di come questo protocollo possa essere adattato, è stato dimostrato che la variante fluorescente Aβ(1-42)-HiLyte 647 può essere aggiunta alle cellule colorate con PKMO 15 minuti prima dell'imaging (Figura 1 supplementare). I parametri di imaging sono simili (Tabella supplementare 2), con la differenza principale che è necessario un foro stenopeico più piccolo quando si visualizzano mitocondri più stretti. L'imaging di Aβ-HiLyte647 con STED richiede una minore potenza laser di eccitazione complessiva (6%-8%) e deplezione di STED (10%-12%) e meno accumuli (sei). Anche il gating del rivelatore è esteso da 0,1 a 10 ns. Sebbene la risoluzione STED di Aβ non sia necessaria, il rapporto segnale-rumore complessivo e la dimensione delle particelle Aβ di STED grezzo erano migliori di quelli delle immagini confocali, e può anche essere eseguita la successiva deconvoluzione. La raccolta di immagini STED e la deconvoluzione delle proiezioni z-stack STED grezze di Aβ sembrano particolarmente utili quando si fondono con immagini STED grezze o STED deconvolse della colorazione PKMO (Figura supplementare 1B,C). Entrambi i canali sono stati raccolti in un unico frame step. Misure di localizzazione dipendente dal tempo, simili a quelle elencate nella Figura 2 e mostrate nella Figura 5, ove applicabile, e le differenze nell'architettura delle cristae possono essere ottenute dopo il trattamento delle sollecitazioni o altre aggiunte.
Altri possibili metodi per la doppia marcatura in cellule vive STED di mitocondri non riportati qui, ma che sono stati riportati da altri, includono l'uso di proteinemarcate con SNAP 93, proteine con alogeno e l'uso di altri coloranti permeabili alle cellule con bersagli generici, come il mtDNA63. In particolare, la strategia di etichettatura di SNAP e Halo influenza l'intensità e la longevità del segnale di fluorescenza risultanti durante l'imaging94. Inoltre, mentre questo protocollo presenta diversi esempi di analisi che possono essere applicate ai mitocondri segmentati, ci sono molte altre analisi che i pacchetti software possono eseguire su queste immagini.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
I neuroni primari dell'ippocampo di ratto sono stati forniti dal Dr. George Lykotrafitis e Shiju Gu del Dipartimento di Ingegneria Biomedica dell'Università del Connecticut (Storrs, CT, USA). Lo strumento Abberior STED ospitato nell'Advanced Light Microscopy Facility del Center for Open Research Resources and Equipment è stato acquisito con la sovvenzione NIH S10OD023618 assegnata a Christopher O'Connell. Questa ricerca è stata finanziata dalla sovvenzione NIH R01AG065879 assegnata a Nathan N. Alder.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | Gibco | 25300054 | |
| 0.4% Trypan blue | Invitrogen | T10282 | |
| 0.5% Trypsin-EDTA, no phenol red | Gibco | 15400054 | |
| 100 X antibiotic-antimycotic | Gibco | 15240062 | |
| 100 X/1.40 UPlanSApo oil immersion lens | Olympus | Equipped in Olympus IX83 microscope for STED setup described in Section 4 | |
| All-trans-retinoic acid | Sigma | R2625 | |
| Amyloid-β (1-42, HiLyte Fluor647, 0.1 mg) | AnaSpec | AS-64161 | Other fluorescent conjugates available |
| B27 supplement (50 X), serum free | Gibco | 17504044 | |
| Cell Counter (Countess II FL) | Life Technologies | AMQAF1000 | |
| Centrifuge | Eppendorf | 5804-R | |
| Counter slides | Invitrogen | C10283 | |
| Conical tubes (15 mL) | Thermo Fisher Scientific | 339650 | |
| Cuvettes (Quartz Cells) | Starna Cells, Inc. | 9-Q-10 | Used with Spectrometer as described in Section 1.3 |
| DMEM (high glucose with sodium pyruvate) | Gibco | 11995073 | Used for SH-SY5Y cell materials as described in Section 1 |
| DMEM (high glucose no sodium pyruvate) | Gibco | 11965092 | Used for primary cell materials as described in Section 2 |
| DMEM (phenol red-free) | Gibco | 31053028 | Used for imaging as described in Section 3 |
| DMSO | Sigma | D8418 | |
| DNAase I from bovine pancreas | Sigma | DN25 | Used for primary cell materials as described in Section 2.2.1 and 2.2.2 |
| DPBS (no calcium, no magnesium) | Gibco | 14190144 | |
| E18 Rat Hippocampus | Transnetyx Tissue | SDEHP | |
| Ethanol (200 proof) | Fisher Bioreagents | BP28184 | |
| Fetal bovine serum (FBS), not heat-inactivated | Gibco | 26140079 | For cultured cells, in Section 1 |
| Fetal bovine serum (heat inactivated) | Gibco | 10082147 | For primary cell culture, Section 2 |
| Filter sterilization unit (0.1 µm, 500 mL) | Thermo Fisher Scientific | 5660010 | |
| FIJI (Is Just ImageJ) and Trainable Weka Segmentation (TWS) plug-in | -- | -- | Free, open-source image analysis software that includes plug-ins including Trainable Weka Segmentation described in Section 5; TWS plug-in from ref. 90 of the main text |
| GlutaMAX supplement (100 X) | Gibco | 35050061 | Glutamine supplement used for primary cell materials described in Section 2.1.2 |
| Hausser Scientific bright-Line and Hy-Lite Counting Chambers | Hausser Scientific | 267110 | |
| HBSS (no calcium, no magnesium) | Gibco | 14170120 | Used for primary cell materials described in Section 2.2.1 and 2.2.2 |
| HEPES | Gibco | 15630080 | |
| Huygens Professional deconvolution software (V. 20.10) | Scientific Volume Imaging (SVI) | -- | The deconvolution software used in this protocol and described in Section 5 |
| IX83 inverted microscope with Continuous Autofocus | Olympus | -- | This paper uses a STED Infinity Line system built around an Olympus IX83 inverted microscope, described in Section 4 |
| Lightbox software (V. 16.3.16118) | Abberior | -- | Vendor software used for STED image acquisition, described in Section 4 |
| Live Orange Mito dye | Abberior | LVORANGE-0146-30NMOL | Live cell imaging IMM-targeting dye described in Discussion |
| Neurobasal media | Gibco | 21103049 | Used for primary cell materials referred to in Section 2.1.2 |
| Nunc Lab-Tek II 2-well chambered coverglass | Nunc | 155379 | Can purchase a variety of chambers but make sure the coverglass is #1.5 |
| Pasteur Pipets (Fisherbrand) | Thermo Fisher Scientific | 22183632 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| PKmito Orange dye | Spirochrome | SC053 | |
| Poly-D-lysine | Gibco | A3890401 | |
| SH-SY5Y Cell line | ATCC | CRL2266 | |
| Sodium pyruvate (100 mM) | Gibco | 11360070 | Used for primary cell materials described in Section 2 |
| Spectrometer (GENESYS 180 UV-Vis) | Thermo Fisher Scientific | 840309000 | |
| STED Expert Line microscope | Abberior | -- | STED setup can be customized, but at time of purchase instrument was considered Abberior’s Expert Line; brief description of setup is available in Section 4 of protocol |
| T25 flask (TC-treated, filter cap) | Thermo Fisher Scientific | 156367 | Other culture vessels and sizes available |
Riferimenti
- Iovine, J. C., Claypool, S. M., Alder, N. N. Mitochondrial compartmentalization: emerging themes in structure and function. Trends in Biochemical Sciences. 46 (11), 902-917 (2021).
- Gupta, A., Becker, T. Mechanisms and pathways of mitochondrial outer membrane protein biogenesis. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1862 (1), 148323 (2021).
- Gordaliza-Alaguero, I., Cantó, C., Zorzano, A. Metabolic implications of organelle-mitochondria communication. EMBO Reports. 20 (9), e47928 (2019).
- Klecker, T., Westermann, B. Pathways shaping the mitochondrial inner membrane. Open Biology. 11 (12), 210238 (2021).
- Navarro, A., Boveris, A. The mitochondrial energy transduction system and the aging process. American Journal of Physiology-Cell Physiology. 292 (2), C670-C686 (2007).
- Yu, R., Lendahl, U., Nistér, M., Zhao, J. Regulation of mammalian mitochondrial dynamics: opportunities and challenges. Frontiers in Endocrinology. 11, 374 (2020).
- Horn, A., Raavicharla, S., Shah, S., Cox, D., Jaiswal, J. K. Mitochondrial fragmentation enables localized signaling required for cell repair. The Journal of Cell Biology. 219 (5), e201909154 (2020).
- Glancy, B., Kim, Y., Katti, P., Willingham, T. B. The functional impact of mitochondrial structure across subcellular scales. Frontiers in Physiology. 11, 541040 (2020).
- Bahat, A., et al. MTCH2-mediated mitochondrial fusion drives exit from naïve pluripotency in embryonic stem cells. Nature Communications. 9 (1), 5132 (2018).
- Detmer, S. A., Chan, D. C. Functions and dysfunctions of mitochondrial dynamics. Nature Reviews Molecular Cell Biology. 8, 870-879 (2007).
- Bertholet, A. M., et al. Mitochondrial fusion/fission dynamics in neurodegeneration and neuronal plasticity. Neurobiology of Disease. 90, 3-19 (2016).
- Zemirli, N., Morel, E., Molino, D. Mitochondrial dynamics in basal and stressful conditions. International Journal of Molecular Sciences. 19 (2), 564 (2018).
- Harwig, M. C., et al. Methods for imaging mammalian mitochondrial morphology: a prospective on mitograph. Analytical Biochemistry. 552, 81-99 (2018).
- Pánek, T., Eliáš, M., Vancová, M., Lukeš, J., Hashimi, H. Returning to the fold for lessons in mitochondrial crista diversity and evolution. Current Biology. 30 (10), R575-R588 (2020).
- Gottschalk, B., Madreiter-Sokolowski, C. T., Graier, W. F. Cristae junction as a fundamental switchboard for mitochondrial ion signaling and bioenergetics. Cell Calcium. 101, 102517 (2022).
- Khosravi, S., Harner, M. E. The MICOS complex, a structural element of mitochondria with versatile functions. Biological Chemistry. 401 (6-7), 765-778 (2020).
- Frezza, C., et al. OPA1 controls apoptotic cristae remodeling independently from mitochondrial fusion. Cell. 126 (1), 177-189 (2006).
- Meeusen, S., et al. Mitochondrial inner-membrane fusion and crista maintenance requires the dynamin-related GTPase Mgm1. Cell. 127 (2), 383-395 (2006).
- Patten, D. A., et al. OPA1-dependent cristae modulation is essential for cellular adaptation to metabolic demand. The EMBO Journal. 33 (22), 2676-2691 (2014).
- Paumard, P., et al. The ATP synthase is involved in generating mitochondrial cristae morphology. The EMBO Journal. 21 (3), 221-230 (2002).
- Strauss, M., Hofhaus, G., Schröder, R. R., Kühlbrandt, W. Dimer ribbons of ATP synthase shape the inner mitochondrial membrane. The EMBO Journal. 27 (7), 1154-1160 (2008).
- Basu Ball, W., Neff, J. K., Gohil, V. M. The role of nonbilayer phospholipids in mitochondrial structure and function. FEBS Letters. 592 (8), 1273-1290 (2018).
- Hackenbrock, C. R. Ultrastructural bases for metabolically linked mechanical activity in mitochondria. I. Reversible ultrastructural changes with change in metabolic steady state in isolated liver mitochondria. The Journal of Cell Biology. 30 (2), 269-297 (1966).
- Dlasková, A., et al. Mitochondrial cristae narrowing upon higher 2-oxoglutarate load. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1860 (8), 659-678 (2019).
- Pérez-Hernández, C. A., et al. Mitochondrial ultrastructure and activity are differentially regulated by glycolysis-, krebs cycle-, and microbiota-derived metabolites in monocytes. Biology. 11 (8), 1132 (2022).
- Mannella, C. A. Structural diversity of mitochondria: functional implications. Annals of the New York Academy of Sciences. 1147, 171-179 (2008).
- Plecitá-Hlavatá, L., Ježek, P. Integration of superoxide formation and cristae morphology for mitochondrial redox signaling. The International Journal of Biochemistry & Cell Biology. 80, 31-50 (2016).
- Scorrano, L., et al. A distinct pathway remodels mitochondrial cristae and mobilizes cytochrome c during apoptosis. Developmental Cell. 2 (1), 55-67 (2002).
- Heath-Engel, H. M., Shore, G. C. Mitochondrial membrane dynamics, cristae remodelling and apoptosis. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1763 (5-6), 549-560 (2006).
- Brandt, T., et al. Changes of mitochondrial ultrastructure and function during ageing in mice and Drosophilia. eLife. 6, e24662 (2017).
- Kondadi, A. K., et al. Cristae undergo continuous cycles of membrane remodelling in a MICOS-dependent manner. EMBO Reports. 21, e49776 (2020).
- Quintana-Cabrera, R., Mehrotra, A., Rigoni, G., Soriano, M. E. Who and how in the regulation of mitochondrial cristae shape and function. Biochemical and Biophysical Research Communications. 500 (1), 94-101 (2018).
- Nielsen, J., et al. Plasticity in mitochondrial cristae density allows metabolic capacity modulation in human skeletal muscle: Enlarged mitochondrial cristae density in athletes. The Journal of Physiology. 595 (9), 2839-2847 (2017).
- Afzal, N., Lederer, W. J., Jafri, M. S., Mannella, C. A. Effect of crista morphology on mitochondrial ATP output: A computational study. Current Research in Physiology. 4, 163-176 (2021).
- Heine, K. B., Parry, H. A., Hood, W. R. How does density of the inner mitochondrial membrane influence mitochondrial performance. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 324 (2), R242-R248 (2023).
- Wang, W., Zhao, F., Ma, X., Perry, G., Zhu, X. Mitochondria dysfunction in the pathogenesis of Alzheimer's disease: recent advances. Molecular Neurodegeneration. 15, 30 (2020).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative stress: a key modulator in neurodegenerative diseases. Molecules. 24, 1583 (2019).
- Pchitskaya, E., Popugaeva, E., Bezprozvanny, I. Calcium signaling and molecular mechanisms underlying neurodegenerative diseases. Cell Calcium. 70, 87-94 (2018).
- Estes, R. E., Lin, B., Khera, A., Davis, M. Y. Lipid metabolism influence on neurodegenerative disease progression: is the vehicle as important as the cargo. Frontiers in Molecular Neuroscience. 14, 788695 (2021).
- Calkins, M. J., Manczak, M., Mao, P., Shirendeb, U., Reddy, P. H. Impaired mitochondrial biogenesis, defective axonal transport of mitochondria, abnormal mitochondrial dynamics and synaptic degeneration in a mouse model of Alzheimer's disease. Human Molecular Genetics. 20 (23), 4515-4529 (2011).
- Petersen, C. A. H., et al. The amyloid beta-peptide is imported into mitochondria via the TOM import machinery and localized to mitochondrial cristae. Proceedings of the National Academy of Sciences of the United States of America. 105 (35), 13145-13150 (2008).
- Gan, X., et al. Inhibition of ERK-DLP1 signaling and mitochondrial division alleviates mitochondrial dysfunction in Alzheimer's disease cybrid cell. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1842 (2), 220-231 (2014).
- Baloyannis, S. J., Costa, V., Michmizos, D. Mitochondrial alterations Alzheimer's disease. American Journal of Alzheimer's Disease & Other Dementias. 19 (2), 89-93 (2004).
- Tillement, L., Lecanu, L., Papadopoulos, V. Alzheimer's disease: Effects of β-amyloid on mitochondria. Mitochondrion. 11 (1), 13-21 (2011).
- Choi, S. Y., et al. C9ORF72-ALS/FTD-associated poly(GR) binds Atp5a1 and compromises mitochondrial function in vivo. Nature Neuroscience. 22 (6), 851-862 (2019).
- Smith, E. F., Shaw, P. J., De Vos, K. J. The role of mitochondria in amyotrophic lateral sclerosis. Neuroscience Letters. 710, 132933 (2019).
- Costa, V., et al. Mitochondrial fission and cristae disruption increase the response of cell models of Huntington's disease to apoptotic stimuli. EMBO Molecular Medicine. 2 (12), 490-503 (2010).
- Costa, V., Scorrano, L. Shaping the role of mitochondria in the pathogenesis of Huntington's disease: Mitochondrial and Huntington's disease. The EMBO Journal. 31 (8), 1853-1864 (2012).
- Vanisova, M., et al. Mitochondrial organization and structure are compromised in fibroblasts from patients with Huntington's disease. Ultrastructural Pathology. 46 (5), 462-475 (2022).
- de Barcelos, I. P., Troxell, R. M., Graves, J. S. Mitochondrial dysfunction and multiple sclerosis. Biology. 8 (2), 37 (2019).
- Park, J., et al. Mitochondrial dysfunction in Drosophila PINK1 mutants is complemented by parkin. Nature. 441, 1157-1161 (2006).
- Meng, H., et al. Loss of Parkinson's disease-associated protein CHCHD2 affects mitochondrial crista structure and destabilizes cytochrome c. Nature Communications. 8, 15500 (2017).
- Lu, L., et al. CHCHD2 maintains mitochondrial contact site and cristae organizing system stability and protects against mitochondrial dysfunction in an experimental model of Parkinson's disease. Chinese Medical Journal. 135 (13), 1588-1596 (2022).
- Cogliati, S., et al. Mitochondrial Cristae shape determines respiratory chain supercomplexes assembly and respiratory efficiency. Cell. 155 (1), 160-171 (2013).
- He, B., et al. Mitochondrial cristae architecture protects against mtDNA release and inflammation. Cell Reports. 41 (10), 111774 (2022).
- Polo, C. C., et al. Three-dimensional imaging of mitochondrial cristae complexity using cryo-soft X-ray tomography. Scientific Reports. 10, 21045 (2020).
- Rybka, V., et al. Transmission electron microscopy study of mitochondria in aging brain synapses. Antioxidants. 8 (6), 171 (2019).
- Mannella, C. A. Structure and dynamics of the mitochondrial inner membrane cristae. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1763 (5-6), 542-548 (2006).
- Fry, M. Y., et al. In situ architecture of Opa1-dependent mitochondrial cristae remodeling. biorxiv. , (2023).
- Barad, B. A., Medina, M., Fuentes, D., Wiseman, R. L., Grotjahn, D. A. Quantifying organellar ultrastructure in cryo-electron tomography using a surface morphometrics pipeline. The Journal of Cell Biology. 222 (4), 202204093 (2023).
- Kunz, T. C., Götz, R., Gao, S., Sauer, M., Kozjak-Pavlovic, V. Using expansion microscopy to visualize and characterize the morphology of mitochondrial cristae. Frontiers in Cell and Developmental Biology. 8, 617 (2020).
- Yang, Z., et al. Cyclooctatetraene-conjugated cyanine mitochondrial probes minimize phototoxicity in fluorescence and nanoscopic imaging. Chemical Science. 11 (32), 8506-8516 (2020).
- Liu, T., et al. Multi-color live-cell STED nanoscopy of mitochondria with a gentle inner membrane stain. Proceedings of the National Academy of Sciences. 119 (52), e2215799119 (2022).
- Yang, X., et al. Mitochondrial dynamics quantitatively revealed by STED nanoscopy with an enhanced squaraine variant probe. Nature Communications. 11, 3699 (2020).
- Zheng, S., et al. Long-term, super-resolution HIDE imaging of the inner mitochondrial membrane in live cells with a cell-permeant lipid probe. biorxiv. , (2022).
- Wang, C., et al. A photostable fluorescent marker for the superresolution live imaging of the dynamic structure of the mitochondrial cristae. Proceedings of the National Academy of Sciences of the United States of America. 116 (32), 15817-15822 (2019).
- Feles, S., et al. Streamlining culture conditions for the neuroblastoma cell line sh-sy5y: a prerequisite for functional studies. Methods and Protocols. 5 (4), 58 (2022).
- Shipley, M. M., Mangold, C. A., Szpara, M. L. Differentiation of the SH-SY5Y human neuroblastoma cell line. Journal of Visualized Experiments. (108), e53193 (2016).
- Kovalevich, J., Langford, D., Amini, S., White, M. K. Considerations for the use of SH-SY5Y neuroblastoma cells in neurobiology. Neuronal Cell Culture. 1078, 9-21 (2013).
- Biedler, J. L., Helson, L., Spengler, B. A. Morphology and growth, tumorigenicity, and cytogenetics of human neuroblastoma cells in continuous culture. Cancer Research. 33 (11), 2643-2652 (1973).
- Swerdlow, R. H. Mitochondria and mitochondrial cascades in alzheimer's disease. Journal of Alzheimer's Disease. 62 (3), 1403-1416 (2018).
- Wang, W., Zhao, F., Ma, X., Perry, G., Zhu, X. Mitochondria dysfunction in the pathogenesis of Alzheimer's disease: recent advances. Molecular Neurodegeneration. 15, 30 (2020).
- Reddy, P. H. Mitochondrial dysfunction in aging and alzheimer's disease: strategies to protect neurons. Antioxidants & Redox Signaling. 9 (10), 1647-1658 (2007).
- Horn, A., Raavicharla, S., Shah, S., Cox, D., Jaiswal, J. K. Mitochondrial fragmentation enables localized signaling required for cell repair. Journal of Cell Biology. 219 (5), e201909154 (2020).
- Korecka, J. A., et al. Phenotypic characterization of retinoic acid differentiated SH-SY5Y cells by transcriptional profiling. PLoS ONE. 8 (5), e63862 (2013).
- Baghel, M. S., Thakur, M. K. Vdac1 downregulation causes mitochondrial disintegration leading to hippocampal neurodegeneration in scopolamine-induced amnesic mice. Molecular Neurobiology. 56 (3), 1707-1718 (2019).
- Jiang, S., et al. Mfn2 ablation causes an oxidative stress response and eventual neuronal death in the hippocampus and cortex. Molecular Neurodegeneration. 13 (1), 5 (2018).
- Mu, Y., Gage, F. H. Adult hippocampal neurogenesis and its role in Alzheimer's disease. Molecular Neurodegeneration. 6, 85 (2011).
- Rao, Y. L., et al. Hippocampus and its involvement in Alzheimer's disease: a review. 3 Biotech. 12 (2), 55 (2022).
- Weerasinghe-Mudiyanselage, P. D. E., Ang, M. J., Kang, S., Kim, J. -. S., Moon, C. Structural Plasticity of the hippocampus in neurodegenerative diseases. International Journal of Molecular Sciences. 23 (6), 3349 (2022).
- . Poly-D-Lysine Available from: https://www.thermofisher.com/order/catalog/product/A3890401 (2023)
- Dravid, A., Raos, B., Svirskis, D., O'Carroll, S. J. Optimised techniques for high-throughput screening of differentiated SH-SY5Y cells and application for neurite outgrowth assays. Scientific Reports. 11, 23935 (2021).
- Hromadkova, L., et al. Brain-derived neurotrophic factor (BDNF) promotes molecular polarization and differentiation of immature neuroblastoma cells into definitive neurons. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1867 (9), 118737 (2020).
- Riegerová, P., et al. Expression and Localization of AβPP in SH-SY5Y cells depends on differentiation state. Journal of Alzheimer's Disease. 82 (2), 485-491 (2021).
- Hoffmann, L. F., et al. Neural regeneration research model to be explored: SH-SY5Y human neuroblastoma cells. Neural Regeneration Research. 18 (6), 1265-1266 (2022).
- Abiraman, K., Tzingounis, A. V., Lykotrafitis, G. K. Ca 2 channel localization and regulation in the axon initial segment. The FASEB Journal. 32 (4), 1794-1805 (2018).
- E18 Rat Hippocampus. Transnetyx Tissue Available from: https://tissue.transnetyx.com/E18-Rat-Hippocampus_4 (2023)
- Kmito ORANGE - Probe for live cell imaging of mitochondria. Spirochrome Available from: https://spirochrome.com/product/pkmito_orange/ (2023)
- Nyquist Calculator. Scientific Volume Imaging Available from: https://svi.nl/Nyquist-Calculator (2023)
- Segawa, M., et al. Quantification of cristae architecture reveals time-dependent characteristics of individual mitochondria. Life Science Alliance. 3 (7), e2019000620 (2020).
- Arganda-Carreras, I., et al. Trainable Weka Segmentation: a machine learning tool for microscopy pixel classification. Bioinformatics. 33 (15), 2424-2426 (2017).
- Stephan, T., Roesch, A., Riedel, D., Jakobs, S. Live-cell STED nanoscopy of mitochondrial cristae. Scientific Reports. 9, 12419 (2019).
- Erdmann, R. S., et al. Labeling strategies matter for super-resolution microscopy: A comparison between HaloTags and SNAP-tags. Cell Chemical Biology. 26 (4), 584-592 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Tutti i diritti riservati
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.