Indução de lesão de córnea e límplice alcalino pela técnica punch-trephine em modelo murino
In This Article
Summary
Este protocolo descreve um método para induzir uma lesão córnea e límbica precisa e reprodutível em um modelo de camundongo. O protocolo é vantajoso, pois permite uma lesão uniformemente distribuída na córnea e no limbo de camundongos altamente curvos.
Abstract
A córnea é fundamental para a visão, e a cicatrização corneana após trauma é fundamental para manter sua transparência e função. Através do estudo de modelos de lesão corneana, os pesquisadores pretendem melhorar sua compreensão de como a córnea cura e desenvolver estratégias para prevenir e gerenciar opacidades corneanas. A lesão química é um dos modelos de lesão mais populares que tem sido extensivamente estudado em camundongos. A maioria dos pesquisadores anteriores usou um papel plano embebido em hidróxido de sódio para induzir lesão na córnea. No entanto, a indução de lesão corneana e límbica usando papel de filtro plano não é confiável, uma vez que a córnea de camundongos é altamente curvada. Aqui, apresentamos um novo instrumento, um punch de biópsia modificado, que permite aos pesquisadores criar uma lesão alcalina bem circunscrita, localizada e uniformemente distribuída na córnea e no limbo murinos. Este método punch-trephine permite aos pesquisadores induzir uma queimadura química precisa e reprodutível para toda a córnea murina e limbo, deixando outras estruturas, como as pálpebras, não afetadas pelo produto químico. Além disso, este estudo introduz uma técnica de enucleação que preserva a carúncula medial como um ponto de referência para a identificação do lado nasal do globo ocular. A conjuntiva bulbar, palpebral e a glândula lacrimal também são mantidas intactas por esta técnica. Os exames oftalmológicos foram realizados via biomicroscópio com lâmpada de fenda e coloração com fluoresceína nos dias 0, 1, 2, 6, 8 e 14 pós-lesão. Os achados clínicos, histológicos e imuno-histoquímicos confirmaram a deficiência de células-tronco do limbo e a falha na regeneração da superfície ocular em todos os camundongos experimentais. O modelo de lesão corneana alcalina apresentado é ideal para estudar deficiência de células-tronco límbicas, inflamação corneana e fibrose. Este método também é adequado para investigar a eficácia pré-clínica e clínica de medicamentos oftalmológicos tópicos na superfície corneana murina.
Introduction
A córnea é fundamental para a visão e exibe características únicas, incluindo transparência, que é um pré-requisito para uma visão clara. Além de desempenhar um importante papel protetor, a córnea é responsável por 2/3 do poder refrativo do olho1. Devido ao seu importante papel na visão, as lesões e opacidade corneanas causam declínio visual significativo e são responsáveis pela segunda maior causa de cegueira evitável em todo o mundo 2,3. Nas lesões corneanas com disfunção limbal grave, a função de barreira do limbo diminui, resultando na migração das células conjuntivais em direção à superfície corneana e conjuntivalização corneana 4,5, o que compromete drasticamente a visão. Portanto, são necessárias estratégias preventivas e terapêuticas eficazes para lidar com o fardo global da cegueira corneana e da incapacidade relacionada.
O entendimento atual do processo de cicatrização da córnea humana é baseado em estudos anteriores que investigaram as respostas da córnea a diversas lesões. Diversas técnicas e modelos animais têm sido empregados para induzir diversas lesões químicas ou mecânicas na córnea6,7,8,9 e investigar vários aspectos do processo de cicatrização da córnea.
O modelo de queimadura alcalina é um modelo de lesão bem estabelecido que é realizado pela aplicação direta de hidróxido de sódio (NaOH) sobre a superfície da córnea ou pelo uso de papel de filtro plano10. Uma lesão alcalina resulta na liberação de mediadores pró-inflamatórios e infiltração de polimorfonucleares não só na córnea e câmara anterior do olho, mas também na retina. Isso induz apoptose não intencional das células ganglionares da retina e ativação das células CD45+ 11. Portanto, é fundamental localizar o local da lesão precisamente para evitar lesões excessivas não intencionais usando um modelo de lesão alcalina.
O comprimento axial do globo ocular murino é de aproximadamente 3 mm12. Devido a essa curta distância entre a córnea e a retina, existe uma curvatura corneana íngreme para fornecer alto poder refrativo para focalizar a luz na retina (Figura 1A). Como relatamosanteriormente13, a indução de lesão química nessa superfície altamente curva com o uso de papel de filtro plano é difícil, principalmente no limbo (Figura 1B). A indução de lesão do limbo requer a inclinação do papel de filtro, que tem o potencial de causar lesão não intencional no fórnice e conjuntivaadjacente14. Outra abordagem envolve a aplicação direta do agente químico como gotas na superfície da córnea. No entanto, esse método não tem controle sobre o tempo de exposição, e há um risco potencial de induzir lesão da conjuntiva, fórnice e pálpebras devido à difusão do líquido para essas áreas.
Para superar essas limitações, este estudo apresenta um novo método punch-trephine para induzir lesão. Esta técnica tem várias vantagens, incluindo (i) induzir uma lesão química efetiva em toda a superfície corneana e limbo em modelo de camundongo, (ii) induzir uma lesão localizada e bem circunscrita na córnea, (iii) a capacidade de aplicar qualquer líquido de interesse por um período pré-determinado e (iv) a capacidade de induzir diferentes tamanhos de lesões na córnea selecionando punções de biópsia apropriadas. Este método também é viável para modelos de lesões em ratos e coelhos, que também exibem uma superfície corneana curva e são modelos animais comuns usados para estudar a cicatrização de feridas na superfície ocular.
Protocol
Todos os procedimentos foram realizados de acordo com o número 33420 do laboratório de cuidados com animais de Stanford, uso de animais para fins científicos e a Declaração ARVO para o uso de animais em pesquisas oftalmológicas e de visão. Um total de 10 camundongos C57BL/6 machos e fêmeas com idades entre 8 e 12 semanas foram generosamente fornecidos pelo laboratório Irving L. Weissman. Os animais foram aclimatados a um ciclo claro-escuro de 12 h e receberam água e ração ad libitum. A lesão foi induzida em um olho do animal.
1. Preparação para o experimento
- Preparação de materiais
NOTA: Todos os reagentes devem ser mantidos à temperatura ambiente.- Prepare o punch-trephine: Prepare um punch de biópsia com diâmetro de 3,5 mm e marque a haste do punch a 5 mm de distância de sua borda distal. Afixe o puncionador firmemente e corte a parte distal marcada de seu eixo usando uma ferramenta giratória de duas velocidades. Use proteção ocular durante este processo. Corte o eixo a 3,5 mm de profundidade e deixe o 1,5 mm final fixado. Dobre a ponta em 90°, como mostra a Figura 1.
- Preparar a solução de NaOH 0,5 M dissolvendo 1 g de NaOH em 50 ml de água destilada.
- Preparar 10 mL de coquetel anestésico combinando 2 mL de 100 mg/mL de ketamina e 1 mL de 20 mg/mL de xilazina. Antes da injeção, diluir esta mistura com 7 mL de NaCl a 0,9% (soro fisiológico).
- Preparar solução de fluoresceína sódica a 0,1% adicionando 0,1 mL de líquido fluorescente AK-Fluor a 10% em 9,9 mL de solução salina tamponada com fosfato estéril (1x PBS).
- Preparar PBS (1x) dissolvendo 8 g de NaCl, 0,2 g de KCl, 1,44 g de Na2HPO4 e 0,23 g de NaH2PO4em 900 mL de água destilada. Ajustar o pH da solução para 7.4. Levar a solução a um volume final de 1 L adicionando água destilada.
- Preparar solução de paraformaldeído (PFA) a 4% para fixação. Sob um capuz químico, dissolver 2 g de PFA em 45 mL de PBS. Aquecer a mistura a 65 °C e titular o seu pH até 7,4. Uma vez dissolvido o PFA, levar a solução a um volume final de 50 mL.
2. Preparação dos animais
- Pesar o rato para determinar o volume adequado de cocktail anestésico injetável para injeção. Após manusear e conter adequadamente o camundongo, conforme descrito em Machholz et al.15, administrar o coquetel anestésico por via intraperitoneal (IP) na dose de 0,01 mL/g16,17. Direcione os quadrantes abdominais inferiores para injeção IP para evitar danos ao órgão.
- Injetar buprenorfina em suspensão injetável de liberação prolongada (3,25 mg/kg) por via subcutânea para analgesia adicional durante e após a cirurgia, pois a lesão de álcalis corneanos é extremamente dolorosa.
- Aguarde até que um plano profundo de anestesia seja alcançado. Verifique se há falta de resposta ao pinçamento do dedo do pé como indicação de um plano profundo de anestesia bem-sucedido. Aplique pomada ocular simples para o olho contralateral para evitar que ele ressece antes de iniciar a cirurgia.
- Após a anestesia, colocar o mouse sobre a mesa cirúrgica preparada de acordo com os princípios padrão da cirurgia de roedores18. Coloque um travesseiro de 5 mm de altura sob a cabeça do roedor, posicionado em decúbito lateral. O travesseiro ajuda a apoiar a cabeça do roedor durante a cirurgia.
- Administrar colírio de cloridrato de tetracaína (0,5%) para posterior anestesia. Seque adequadamente a superfície ocular com uma lança ocular cirúrgica e corte os cílios.
3. Indução de lesão alcalina
- Antes de iniciar a cirurgia, organizar a mesa cirúrgica de acordo com os princípios padrão da cirurgia de roedores18,19 e manter o campo cirúrgico estéril durante a cirurgia. Posicionar o microscópio cirúrgico para visualizar adequadamente o camundongo anestesiado e ajustar o temporizador para 30 s. Coloque uma toalha de papel torcida no focinho do animal para evitar aspiração nasal involuntária durante o processo de enxágue.
- Determine a circunferência da área limbal usando o microscópio cirúrgico, garantindo que as pálpebras do mouse estejam bem abertas usando os dedos polegar e indicador. Segure suavemente a trefina de punção limpa paralela ao eixo do olho, sem aplicar qualquer pressão descendente. Evite girar o instrumento e mantenha o eixo do punch-trephine paralelo ao eixo do globo.
- Peça ao assistente cirúrgico para soltar 3 gotas de solução de NaOH (igual a 40 μL) no orifício do punch-trephine's para preencher a ferramenta e cobrir a superfície da córnea adequadamente. A tensão superficial do líquido evita qualquer vazamento para fora do instrumento (Figura 1).
NOTA: Utilizamos uma seringa de 1 mm com agulha 27G com ponta achatada angulada a 50° para soltar cuidadosamente a solução de NaOH. - Após 30 s, enxaguar imediatamente a córnea e o fórnice com 5 mL de PBS (1x). O vídeo 1 demonstra o procedimento para induzir lesões químicas.
- Use um papel indicador de pH universal para garantir um pH de 7 - 7,5 na superfície da córnea do olho lesionado. Em seguida, aplique a pomada oftálmica triplo-antibiótico sobre a superfície ocular quimicamente lesada.
NOTA: O movimento da cauda durante a cirurgia é um sinal de baixa profundidade anestésica. Aplicar coquetel anestésico adicional (ketamina + xilazina) injetando um anestésico [IP em bolus (50% do volume inicial)]. - Após a cirurgia, confirme se o rato está em uma condição estável. Administrar a segunda buprenorfina se o animal estiver com dor. Utilizar a mesma técnica de manuseamento do ponto 2.2. Iniciar o exame pós-operatório enquanto o animal estiver sob anestesia.
- Após o procedimento, lavar, secar e higienizar a trefina puncionada e a mesa cirúrgica com etanol 70%.
4. Avaliação clínica
- Para exame, anestesiar o camundongo conforme descrito anteriormente na etapa 2.1.
- Examine os olhos (feridos e não feridos) sob um biomicroscópio com lâmpada de fenda. Use uma câmera para capturar fotos (neste estudo, uma câmera de telefone no modo Cinematic foi usada).
- Escore de opacidade corneana de acordo com o sistema de graduação de Yoeruek20: 0 = córnea normal, clara; 1 = opacidade leve; 2 = maior opacidade, mas a íris e a pupila são facilmente distinguíveis; 3 = íris e pupila são pouco distinguíveis; 4 = a córnea é completamente opaca com uma pupila invisível.
- Aplicar colírio fluoresceína a 0,1%. Secar o excesso de líquido fluorescente com aplicador de algodão e avaliar a presença de defeitos epiteliais corneanos utilizando o filtro azul de cobalto. Capture fotos.
- Monitorar o animal até que ele recupere a consciência suficiente para manter a decúbito esternal. Não reintroduza o animal a outros animais até que ele tenha se recuperado completamente.
5. Enucleação
- Eutanásia de camundongos 2 semanas após a indução de lesão química por luxação cervical em 3-5 s21.
- Enuclear o olho preservando a carúncula medial e toda a conjuntiva palpebral na seguinte ordem, como mostra o Vídeo 2.
- Sob o microscópio cirúrgico, dissecar cuidadosamente a junção da carúncula e da pele. Com pinças dentárias, retrair a carúncula e guiar a ponta da tesoura cirúrgica sob a conjuntiva palpebral em direção à sua junção com a placa tarsal.
- Cortar a conjuntiva ao longo da linha de adesão em direção ao canto lateral. Em seguida, gire a tesoura cirúrgica para a junção da conjuntiva com a placa tarsal inferior no plano subconjuntival.
- Após completar a dissecção conjuntival, retrair as pálpebras superior e inferior do lado nasal com os dedos polegar e indicador. Ao retrair, guie a ponta de uma pinça de ponta curva atrás da haste lacrimal saliente em direção ao nervo óptico. Segure firmemente o nervo óptico e extraia o globo ocular (Figura 2).
- Enxaguar o globo com PBS (1x) e transferi-lo para a solução de fixação.
6. Coloração por hematoxilina e eosina (H&E) e ácido periódico de Schiff (PAS)
- Fixe os globos em solução de formalina a 10% durante a noite à temperatura ambiente.
- Desidratar os tecidos usando uma série sequencial de álcool graduado com concentrações de 70% de etanol, 80% de etanol, 90% de etanol e 100% de etanol, cada uma por 10-15 min. Em seguida, mergulhe os olhos em xileno por 10 min. Por fim, envolva os olhos em parafina.
- Seccionar os blocos de parafina em cortes de 6 μm de espessura e montá-los em lâminas de microscópio de vidro para coloração de hematoxilina e eosina (H&E) e ácido periódico de Schiff (PAS), conforme descrito no Arquivo Suplementar 1.
7. Imagem e análise por imunofluorescência
- Para estudos de imunohistoquímica (IHQ), fixar os olhos em 1 mL de PBS (1x) contendo PFA a 4% a 4 °C durante a noite. Lavar a amostra 3x em 1 mL de PBS (1x) por 5 min cada.
- Para prevenir a formação de cristais de gelo e proteger as estruturas moleculares das proteínas, realizar saturação seriada de sacarose com concentrações de 10% de sacarose, 20% de sacarose e 30% de sacarose em PBS. Embutir os globos em solução de tomografia de coerência óptica (OCT; Figura 2) e armazená-los a -80 °C.
- Seccionar o bloco OCT em fatias de 12 μm de espessura e montar em lâminas de microscópio de vidro para coloração IHQ.
- Permeabilizar cortes teciduais em lâminas de microscópio em Triton X −100 a 0,1% em PBS (1x) por 15 min. Em seguida, bloquear antígenos inespecíficos com BSA a 5% em PBS (1x) por mais 1 h à temperatura ambiente.
- Incubar cortes de tecido em lâminas de microscópio a 4 °C durante a noite no coquetel dos anticorpos primários direcionados preparados em PBS (1x) contendo 1% de BSA. Neste experimento, os anticorpos primários foram anticorpos antiqueratina 13 (K13) e antiqueratina 12 (K12) diluídos em coelho 1:100 (K12) com concentração de 2,24 μg/mL e 1,56 μg/mL, respectivamente.
- Após a incubação, lavar os cortes de tecido em lâminas de microscópio 3x com PBS (1x). Posteriormente, detectar anticorpos primários ligados com 1:500 diluídos de jumento anti-IgG de coelho. Incubar com o anticorpo secundário a 4 °C durante 1 h no escuro. Em seguida, lave em PBS (1x) 3x por 5 min cada.
- Aplique uma gota de meio de montagem de fluorescência anti-fade contendo DAPI sobre as seções de tecido no microscópio e cubra com uma lamínula. Deixe as amostras secarem no escuro e examine-as sob um microscópio fluorescente com a mesma configuração de laser para olhos normais e lesionados.
Representative Results
A eficácia do método na indução da deficiência de células-tronco do limbo (DCLS) foi avaliada por meio da avaliação dos sinais clínicos e histológicos da DCLS. A avaliação clínica foi feita por microscopia com lâmpada de fenda e tomografia de coerência óptica do segmento anterior (AS-OCT) (Figura 3 e Figura 4).
A reepitelização ocorreu de forma centrípeta e mais rápida na parte temporal da córnea em relação à parte nasal. Os olhos lesados desenvolveram 2+-3+ névoa corneana imediatamente após a lesão química (Figura 3). As células epiteliais migraram da conjuntiva para a superfície corneana após lesão límbica. O grande defeito epitelial corneano foi reepitelizado completamente nos dias 12-14, o que levou mais tempo em comparação com uma lesão epitelial corneana de tamanho semelhante e membrana basal e estroma intactos que tipicamente cicatrizaram dentro de 5 dias pós-lesão8,9. Devido à LSCD, 50% dos olhos lesados desenvolveram defeitos epiteliais persistentes ao final da segunda semana (Figura 3). O edema corneano foi mais proeminente nos primeiros dias (Figura 3, Figura 4), enquanto a fibrose corneana foi significativa na segunda semana, resultando em 4+ opacidade corneana em 100% dos olhos lesados.
Sinais precoces de neovascularização (NV) foram observados clínica e histologicamente, 24 h após a indução da lesão química, conforme ilustrado na Figura 5, consistente com a linha do tempo de NV identificada pelo estudo de Kvanta e col. que mostrou sinal de NV limbal 24 h após alesão22. Durante o processo de cicatrização, novos vasos amadureceram e, no 14º dia após a lesão, a VN atravessou o limbo e atingiu a córnea central. O limbo, que define o limite entre a conjuntiva e a córnea, foi destruído.
Evidências histológicas de deficiência e conjuntivalização de células-tronco límbicas foram observadas pelo aparecimento de células caliciformes PAS+ e vasos sanguíneos estromais 23,24,25,26. As células caliciformes foram observadas no presente modelo de lesão e indicadas pela seta na Figura 6.
Os epitélios conjuntival e corneano expressam principalmente queratinas únicas, K13 e K12, respectivamente27. Após a lesão límbica, novas células epiteliais originadas da conjuntiva cobriram a córnea desnudada, e K12 não foi expresso na superfície corneana de nenhum animal lesado durante 2 semanas após a lesão. Esse achado, consistente com outrosestudos28, indicou DCL completa e ausência de células epiteliais corneanas na superfície corneana. Entretanto, no estudo de Park et al.29, detectaram expressão de K12 20 e 32 semanas após a lesão, sugerindo uma possível transdiferenciação das células epiteliais.
Consequentemente, observamos que a lesão química destruiu o limbo e as células-tronco límbicas, o que resultou na migração de células epiteliais conjuntivais para o centro da córnea para cobrir a superfície corneana desnudada. Isso é validado pelo marcador de células epiteliais da conjuntiva, K13, que foi expresso em toda a superfície da conjuntiva e córnea, como mostra a Figura 7.

Figura 1: Olho direito de camundongo normal e trefina punch para indução de lesão corneana e límbica. (A) Vista lateral mostrando olho de camundongo com córnea altamente curvada (setas indicam o limbo). (B) A imagem demonstra que mesmo um papel de filtro grande é insuficiente para cobrir adequadamente a área limbal. O diâmetro limbo-limbo do olho de camundongo é de quase 4 mm e uma biópsia por punch com diâmetro externo de 4,5 mm e diâmetro interno de 3,5 mm (painéis D e H), cobre adequadamente a córnea e a superfície limbal como mostrado nos painéis (C) e (E). (F) O punch-trephine é adequadamente mantido sobre o globo ao redor da área do limbo. (G) Para garantir que não haja vazamento através da borda do punch-trephine, após o posicionamento adequado do punch-trephine em um eixo paralelo com o globo, o orifício é preenchido com azul de metileno. Não é detectado vazamento de azul de metileno. Barra de escala = 1 mm. Clique aqui para ver uma versão maior desta figura.
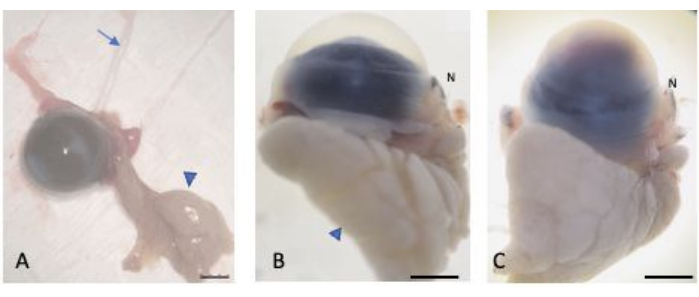
Figura 2: Olhos enucleados. (A) Os olhos foram enucleados preservando-se a conjuntiva bulbar e palpebral, a glândula lacrimal (cabeça de seta) e o nervo óptico (seta). Os olhos normal (B) e lesado (C) foram saturados em sacarose a 30% para proteção contra a formação de criocristais. A parte nasal do globo ocular é reconhecível através da carúncula nasal (marcada N). Barra de escala = 1 mm. Clique aqui para ver uma versão maior desta figura.
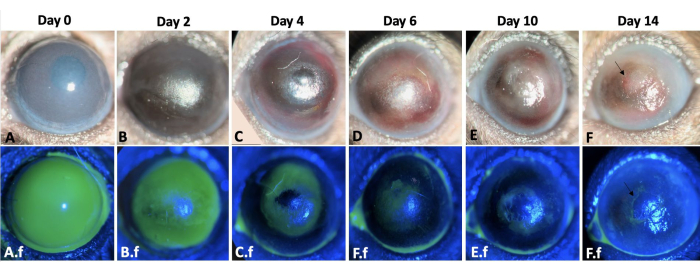
Figura 3: Cicatrização de feridas do olho esquerdo. O processo de cicatrização do olho esquerdo do camundongo ao longo de 2 semanas após lesão de córnea e límpido alcalino em um modelo de camundongo é mostrado aqui (A-F). O exame da lâmpada de fenda do olho. O edema da córnea é mais proeminente nos dias 0 e 2 (A,B), enquanto a fibrose é mais evidente na segunda semana pós-lesão (E-F). A.f-F.f mostram o processo de reepitelização do mesmo olho. Defeito epitelial total da córnea e limbo imediatamente após a indução da lesão é observado em A.f. O defeito epitelial cicatrizou pela migração de células epiteliais conjuntivais em padrão centrípeto por 12-14 dias (A.f-F.f). No entanto, 50% dos olhos lesados desenvolveram defeito epitelial persistente no final da segunda semana, como mostrado pelas setas nas imagens de F e F.f. Barra de escala = 1 mm (painel C). Clique aqui para ver uma versão maior desta figura.
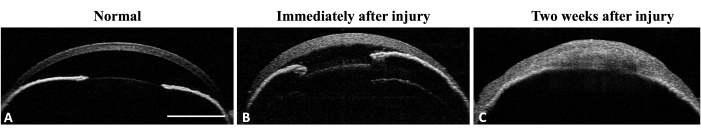
Figura 4: OCT do segmento anterior do olho do ratinho. (A) A AS-OCT ilustra a curvatura corneana normal e a câmara anterior. A estrutura da íris é bem definida e reconhecível. Nenhuma adesão iridocorneana é detectável na periferia média da íris. (B) Imediatamente após a lesão, a espessura corneana aumenta devido à formação de edema e a adesão iridocorneana se desenvolve na periferia média da íris. (C) Duas semanas após a lesão, a curvatura corneana alterou-se e a adesão iridocorneana total com destruição da câmara anterior é visível. Barra de escala = 1 mm. Clique aqui para ver uma versão maior desta figura.
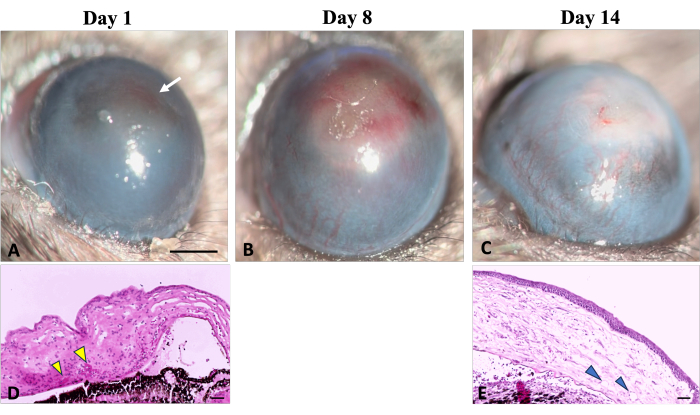
Figura 5: Neovascularização da córnea. Sinais clínicos e histológicos de neovascularização corneana podem ser observados durante o processo de cicatrização após lesão por hidróxido de sódio (NaOH). (A) Os sinais iniciais de neovascularização tornam-se detectáveis no primeiro dia após a lesão, caracterizados por uma coloração avermelhada da córnea (indicada por seta branca). Essa descoloração resulta da agregação de hemácias no estroma, conforme ilustrado na imagem histológica correspondente (D) (indicada pelas pontas de setas amarelas). (B) Ao longo da primeira semana de regeneração, novos vasos aumentam progressivamente e se espalham por toda a córnea. (C) Ao final de 2 semanas, a área do limbo é destruída e os novos vasos continuam a evoluir. (E) O corte histológico da córnea ilustra ainda mais a presença de neovascularização estromal profunda (mostrada por cabeças de setas). Lâmpada de fenda Barra de escala de imagem = 1 mm, barra de escala de imagem histológica = 50 μm. Clique aqui para ver uma versão maior desta figura.
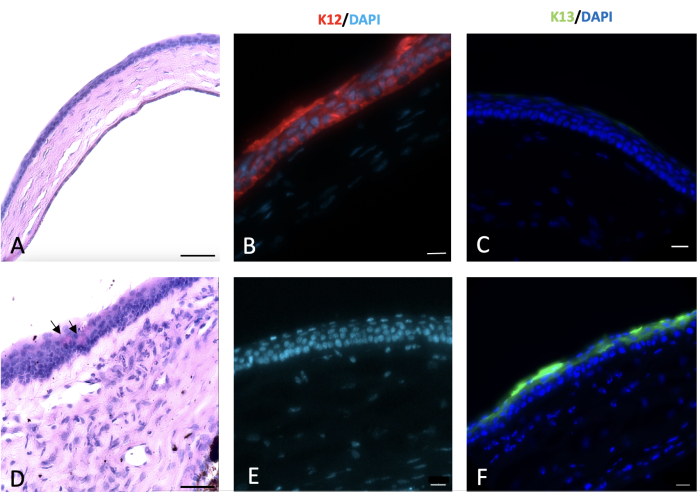
Figura 6: Coloração por ácido periódico de Schiff e imunohistoquímica (IHQ) da córnea. A coloração por ácido periódico de Schiff e imuno-histoquímica da córnea normal e lesada foi realizada 2 semanas após a lesão. Epitélio corneano normal de camundongo composto por 4-5 camadas de células (A). A lesão alcalina da córnea e do limbo levou à conjuntivalização da córnea com aparecimento de células caliciformes na superfície da córnea, como mostrado pelas setas pretas em (D). As células epiteliais normais da córnea expressam K12 (B), que não é expressa pelas células conjuntivais que recobrem a córnea lesada (E). K13, um marcador característico de células epiteliais conjuntival, não é expresso nas células epiteliais normais da córnea (C). No entanto, está presente na superfície corneana lesada por hidróxido de sódio (NaOH), o que é um sinal de conjuntivalização corneana (F). Barra de escala de imagem histológica = 50 μm, barra de escala de imagem corada por IHQ = 20 μm. Clique aqui para ver uma versão maior desta figura.
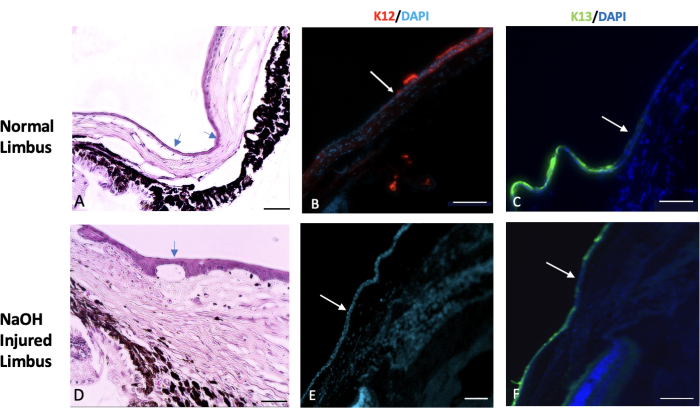
Figura 7: Hematoxilina e eosina e coloração imunoistoquímica. Hematoxilina e eosina (H&E) e coloração imunoistoquímica do tecido do limbo normal e lesado foram realizadas. (A) O limbo normal marca a área de transição entre o final da esclera e o início da córnea. Esta região é tipicamente coberta por uma ou duas camadas de células epiteliais conjuntivais (indicadas pelas setas). Em um olho saudável, a expressão de um marcador epitelial corneano específico chamado K12 começa no limbo e se estende até a superfície da córnea (mostrado na imagem B). Por outro lado, a expressão de um marcador conjuntival conhecido como K13 é restrita ao limbo e não se estende além dele (indicada pela seta branca na imagem C). Em olhos lesados por hidróxido de sódio (NaOH), os limites do limbo são rompidos. Isso leva à migração das células conjuntivais em direção à córnea lesada. (D) As imagens do limbo lesado por NaOH demonstram a presença de neovascularização tanto abaixo da camada epitelial quanto dentro do tecido estromal. Após a lesão, a superfície corneana lesada não possui a presença de K12 (E), enquanto K13 é abundantemente expressa na superfície corneana (F). Barra de escala de imagem histológica = 50 μm, barra de escala de imagem corada por IHQ = 100 μm. Clique aqui para ver uma versão ampliada desta figura.
Arquivo Suplementar 1: Protocolo de coloração. Clique aqui para baixar este arquivo.
Vídeo 1: Lesão corneana e límbica de NaOH em modelo de camundongo com punch-trephine. O vídeo demonstra o procedimento de indução de lesão corneana e límbica de NaOH em um modelo de camundongo com punch-trephine. É crucial segurar o punch-trephine em um eixo paralelo com o globo e aplicar pressão mínima no limbo. Essa técnica adequada é essencial para evitar vazamentos e alcançar os melhores resultados. Clique aqui para baixar este vídeo.
Vídeo 2: Ilustração da técnica de enucleação preservando a conjuntiva bulbar. Para diferenciar o lado nasal do globo do lado temporal, a carúncula nasal é preservada juntamente com o globo ocular. Toda a conjuntiva é dissecada a partir de sua junção com a placa tarsal. Com pressão mínima, o conteúdo orbital se projeta para fora. Ao guiar as pinças em direção à parte de trás do globo, o nervo óptico é agarrado e o tecido é extraído. O tecido enucleado inclui o globo ocular, a gordura orbitária e a glândula lacrimal orbitária. Clique aqui para baixar este vídeo.
Discussion
Este estudo propõe um dispositivo inovador, o punch-trephine, que pode ser usado para induzir com sucesso uma lesão corneana e límbica efetiva e reprodutível em um modelo de camundongo. Este modelo de deficiência de células-tronco do limbo é ideal para investigar a dinâmica da cicatrização e conjuntivalização da córnea após lesão.
Evidências sugerem que tanto o nicho limbal quanto a parte central da córnea murina contêm células-tronco30. Portanto, uma lesão corneana e límbica eficiente é necessária para produzir um modelo de deficiência de células-tronco, e o modelo de lesão aqui apresentado permite a exposição do limbo corneano curvo a um agente químico por um período específico. Para determinar a melhor concentração e duração da lesão de NaOH, lesões foram infligidas com várias concentrações e durações de NaOH. Concentrações mais elevadas de NaOH ou maior duração da exposição resultaram em aumento do dano tecidual e fibrose. Portanto, os pesquisadores podem ajustar esses parâmetros com base nos objetivos específicos de seu estudo e na gravidade desejada da lesão.
Para reproduzir com sucesso esse modelo de lesão da córnea e do limbo, várias considerações importantes devem ser consideradas. Primeiro, é imperativo medir o diâmetro limbo-limbal do olho alvo para determinar o tamanho apropriado do punch. Recomenda-se selecionar um punch de biópsia com diâmetro externo de 0,5 a 1 mm maior que esse diâmetro.
A tensão superficial do líquido utilizado é um fator importante na prevenção de vazamento na interface entre a superfície ocular e a borda da trefina do punch, como mostra a Figura 1G. Portanto, não há necessidade de aplicar pressão na ponta da biópsia por punch.
Para evitar causar danos mecânicos ao tecido, é fundamental segurar a trefina de punção em um eixo paralelo com o olho e abster-se de aplicar pressão no limbo. O ajuste inadequado do eixo trefina do punch pode aumentar o risco de vazamento e resultar em um local descentrado da lesão e resultados imprecisos.
Algumas limitações potenciais dessa técnica incluem a necessidade de selecionar o tamanho apropriado do punch, adquirir proficiência em segurar a trefina do punch e o risco potencial de causar lesão mecânica. No entanto, essas limitações podem ser superadas por meio da prática e seguindo as instruções descritas neste protocolo. A linhagem e a faixa etária dos camundongos são outros fatores que afetam o processo de reepitelização e devem ser considerados no estudo.
Além disso, o protocolo proposto é vantajoso, pois detalha um método de enucleação que preserva a conjuntiva bulbar e palpebral e permite a determinação da parte nasal do globo ocular sem a aplicação de suturas cirúrgicas como marcador. Pesquisas anteriores indicaram que a região nasal do olho possui a menor inervação neural em comparação com outras áreas da córnea, o que a torna mais vulnerável à neovascularização e reduzida eficácia regenerativa31,32.
Em resumo, os sinais clínicos de LSCD, como opacidade corneana (DC), defeitos epiteliais persistentes e neovascularização corneana (NV), juntamente com as alterações histológicas observadas, incluindo metaplasia de células caliciformes, expressão de K13 na superfície corneana e ausência de K12 na superfície corneana, confirmam a presença de LSCD neste modelo. Esses achados fornecem evidências de que essa nova técnica é eficaz na indução de LSCD. Este modelo de lesão química pode ser empregado em estudos pré-clínicos para investigar novos medicamentos e tratamentos farmacêuticos no campo da lesão e regeneração corneana.
Disclosures
Nenhum dos autores tem interesse financeiro em nenhuma das empresas ou produtos descritos neste estudo. Os autores declaram não haver outros conflitos de interesse.
Acknowledgements
Reconhecemos que o NEI P30-EY026877 apoia esta pesquisa. Agradecemos imensamente a Charlene Wang e ao Laboratório Dr. Irv Weissman do Instituto de Biologia de Células-Tronco e Medicina Regenerativa da Universidade de Stanford por toda a assistência gentil no fornecimento de animais experimentais. Agradecemos a ajuda de Hirad Rezaeipoor na preparação e edição das imagens.
Materials
| Name | Company | Catalog Number | Comments |
| Anti-K12 antibody | ABCAM | ab185627 | |
| Anti-K13 antibody | ABCAM | ab92551 | |
| Bovine serum albumin (BSA) | ThermoFisher Scientific | B14 | |
| C57BL/6 mice | Dr Weissman Lab, Stanford University | ||
| Curved forceps | Storz | E1885 | |
| Disposable 90 degree bent needle | |||
| Disposable biopsy punch | Med blades | ||
| Donkey anti-rabbit IgG H&L | ABCAM | ab150073 | |
| Ethanol | ThermoFisher Scientific | T038181000CS | |
| Ethiqa XR (Buprenorphine extended-release injectable suspension) | Fidelis Animal Health | ||
| Heating pad for mouse | |||
| Ketamine hydrochloride | Ambler | ANADA 200-055 | |
| OCT | Tissue-Tek 4583 | ||
| Ophthalmic surgical scissors | |||
| pH Indicator Sticks | Whatman | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | AM9624 | |
| Prolong gold antifade reagent with DAPI | Invitrogen | P36935 | |
| Slit-lamp microscope | NIDEK | SL-450 | |
| Sodium fluorescein AK-fluor 10% | Dailymed | NDC17478-253-10 | |
| Sterile irrigation solution (BSS) | Alcon | 9017036-0119 | |
| Sterile syringe, 1 and 5 ml | |||
| Straight forceps | Katena K5 | 4550- Storz E1684 | |
| Surgical eye spears | American White 17240 Cross | ||
| Surgical microscope | Zeiss S5 microscope | ||
| Tetracaine ophthalmic drop | Alcon | NDC0065-0741-14 | |
| Timer | |||
| Triple antibiotic ophthalmic ointment | Bausch and Lomb | ||
| TritonX -100 | Fisher Scientific | 50-295-34 | |
| Two-speed rotary tool | 200-1/15 Two Speed Rotary Toolkit | ||
| Xylazine | AnaSed | NADA#139-236 |
References
- Sridhar, M. S. Anatomy of cornea and ocular surface. Indian Journal of Ophthalmology. 66 (2), 190-194 (2018).
- Robaei, D., Watson, S. Corneal blindness: a global problem. Clinical & experimental Ophthalmology. 42 (3), 213-214 (2014).
- Lamm, V., Hara, H., Mammen, A., Dhaliwal, D., Cooper, D. K. C. Corneal blindness and xenotransplantation. Xenotransplantation. 21 (2), 99-114 (2014).
- Danjo, S., Friend, J., Thoft, R. A. Conjunctival epithelium in healing of corneal epithelial wounds. Investigative Ophthalmology & Visual Science. 28 (9), 1445-1449 (1987).
- Shapiro, M. S., Friend, J., Thoft, R. A. Corneal re-epithelialization from the conjunctiva. Investigative Ophthalmology & Visual Science. 21 (1 Pt 1), 135-142 (1981).
- Shah, D., Aakalu, V. K., Das, H. Murine Corneal Epithelial Wound Modeling. Wound Regeneration: Methods and Protocols. , 175-181 (2021).
- Rittié, L., Hutcheon, A. E., Zieske, J. D. Mouse models of corneal scarring. Fibrosis: Methods and Protocols. 1627, 117-122 (2017).
- Stepp, M. A., et al. Wounding the cornea to learn how it heals. Experimental Eye Research. 121, 178-193 (2014).
- Akowuah, P. K., De La Cruz, A., Smith, C. W., Rumbaut, R. E., Burns, A. R. An Epithelial Abrasion Model for Studying Corneal Wound Healing. Journal of Visualized Experiments. (178), 63112 (2021).
- Bai, J. Q., Qin, H. F., Zhao, S. H. Research on mouse model of grade II corneal alkali burn. International journal of Ophthalmology. 9 (4), 487-490 (2016).
- Paschalis, E. I., et al. The Role of Microglia and Peripheral Monocytes in Retinal Damage after Corneal Chemical Injury. The American Journal of Pathology. 188 (7), 1580-1596 (2018).
- Jiang, M., et al. Single-Shot Dimension Measurements of the Mouse Eye Using SD-OCT. Ophthalmic Surgery, Lasers and Imaging Retina. 43 (3), 252-256 (2012).
- Shadmani, A., Razmkhah, M., Jalalpoor, M. H., Lari, S. Y., Eghtedari, M. Autologous Activated Omental versus Allogeneic Adipose Tissue-Derived Mesenchymal Stem Cells in Corneal Alkaline Injury: An Experimental Study. Journal of Current Ophthalmology. 33 (2), 136-142 (2021).
- Swarup, A., et al. PNP Hydrogel Prevents Formation of Symblephara in Mice After Ocular Alkali Injury. Translational Vision Science & Technology. 11 (2), 31-31 (2022).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. Journal of Visualized Experiments. (67), 2771 (2012).
- Jaber, S. M., et al. Dose Regimens, Variability, and Complications Associated with Using Repeat-Bolus Dosing to Extend a Surgical Plane of Anesthesia in Laboratory Mice. Journal of the American Association for Laboratory Animal Science. 53 (6), 684-691 (2014).
- Navarro, K. L., et al. Mouse Anesthesia: The Art and Science. ILAR Journal. 62 (1-2), 238-273 (2021).
- Hoogstraten-Miller, S. L., Brown, P. A. Techniques in Aseptic Rodent Surgery. Current Protocols in Immunology. 1, 1.12.1-1.12.14 (2008).
- ACLAM Medical Records Committee. Medical Records for Animals Used in Research, Teaching, and Testing: Public Statement from the American College of Laboratory Animal Medicine. ILAR Journal. 48 (1), 37-41 (2007).
- Yoeruek, E., et al. Safety, penetration and efficacy of topically applied bevacizumab: evaluation of eyedrops in corneal neovascularization after chemical burn. Acta Ophthalmologica. 86 (3), 322-328 (2008).
- Shomer, N. H., et al. Review of rodent euthanasia methods. Journal of the American Association for Laboratory Animal Science. 59 (3), 242-253 (2020).
- Kvanta, A., Sarman, S., Fagerholm, P., Seregard, S., Steen, B. Expression of Matrix Metalloproteinase-2 (MMP-2) and Vascular Endothelial Growth Factor (VEGF) in Inflammation-associated Corneal Neovascularization. Experimental Eye Research. 70 (4), 419-428 (2000).
- Tseng, S. C., Hirst, L. W., Farazdaghi, M., Green, W. R. Goblet cell density and vascularization during conjunctival transdifferentiation. Investigative Ophthalmology & Visual Science. 25 (10), 1168-1176 (1984).
- Huang, A. J., Tseng, S. C. Corneal epithelial wound healing in the absence of limbal epithelium. Investigative ophthalmology & visual science. 32 (1), 96-105 (1991).
- Rama, P., et al. Limbal stem-cell therapy and long-term corneal regeneration. New England Journal of Medicine. 363 (2), 147-155 (2010).
- Deng, S. X., et al. Global consensus on the definition, classification, diagnosis and staging of limbal stem cell deficiency. Cornea. 38 (3), 364-375 (2019).
- Wei, Z. G., Wu, R. L., Lavker, R. M., Sun, T. T. In vitro growth and differentiation of rabbit bulbar, fornix, and palpebral conjunctival epithelia: Implications on conjunctival epithelial transdifferentiation and stem cells. Investigative Ophthalmology and Visual Science. 34 (5), 1814-1828 (1993).
- Kao, W. W. Y. Keratin expression by corneal and limbal stem cells during development. Experimental Eye Research. 200, 108206 (2020).
- Park, M., et al. Plasticity of ocular surface epithelia: Using a murine model of limbal stem cell deficiency to delineate metaplasia and transdifferentiation. Stem Cell Reports. 17 (11), 2451-2466 (2022).
- Li, J., et al. Identification for Differential Localization of Putative Corneal Epithelial Stem Cells in Mouse and Human. Scientific Reports. 7 (1), 5169 (2017).
- McKenna, C. C., Lwigale, P. Y. Innervation of the Mouse Cornea during Development. Investigative Ophthalmology & Visual Science. 52 (1), 30-35 (2011).
- He, J., Bazan, H. E. P. Neuroanatomy and Neurochemistry of Mouse Cornea. Investigative Ophthalmology & Visual Science. 57 (2), 664-674 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved