פרוטוקול פשוט, מהיר ואוטומטי חלקית לבידוד גרעינים בודדים מרקמות יונקים קפואים לצורך ריצוף גרעין יחיד
In This Article
Summary
המחקר מתאר פרוטוקול פשוט, מהיר ואוטומטי חלקית לבידוד גרעינים איכותיים מרקמות יונקים קפואים לצורך ריצוף RNA של גרעינים בודדים במורד הזרם.
Abstract
ריצוף RNA חד-תאי וחד-גרעין הפכו ליישומי מעבדה נפוצים בשל שפע המידע השעתוק שהם מספקים. ריצוף RNA של גרעין יחיד, במיוחד, שימושי לחקר ביטוי גנים ברקמות קשות לניתוק. יתר על כן, גישה זו תואמת גם חומר קפוא (ארכיוני). במאמר זה אנו מתארים פרוטוקול לבידוד גרעינים בודדים באיכות גבוהה מרקמות יונקים קפואים לצורך ריצוף RNA של גרעין בודד במורד הזרם באופן אוטומטי חלקית באמצעות מכשירים וריאגנטים הזמינים מסחרית. באופן ספציפי, דיסוציאטור רובוטי משמש כדי להפוך הומוגניזציה של רקמות לאוטומטיות ולתקנות, ואחריו שיפוע כימי אופטימלי כדי לסנן את הגרעינים. לבסוף, אנו סופרים באופן מדויק ואוטומטי את הגרעינים באמצעות מונה תאים פלואורסצנטי אוטומטי. הביצועים של פרוטוקול זה מודגמים במוח עכבר, בכליות של חולדה וברקמת כבד וטחול של צינומולגוס. פרוטוקול זה הוא פשוט, מהיר וניתן להתאמה בקלות לרקמות יונקים שונות ללא צורך באופטימיזציה נרחבת ומספק גרעינים באיכות טובה לריצוף RNA של גרעינים בודדים במורד הזרם.
Introduction
ריצוף RNA חד-תאי (sc) וגרעין יחיד (sn) הפכו לפרוטוקולים נפוצים בביולוגיה מולקולרית ותאית בשל הרזולוציה המוגברת של ביטוי גנים בהשוואה לריצוף RNA בתפזורת. עם זאת, הבידוד של תכשירי תא בודד וגרעינים בודדים באיכות טובה מרקמות מוצקות נותר אתגר ולעתים קרובות הוא השלב מגביל הקצב בניסויי sc/sn-RNAseq. ואכן, פותחו שפע של פרוטוקולים המשתמשים בפרוצדורות כימיות ומכניות שונות כדי להשיג תרחיפים של תאים/גרעינים 1,2,3,4,5,6,7,8,9,10,11,12,13,14,15 . יתר על כן, אסטרטגיות לניקוי תכשירים כאלה מפסולת/גושים וכו', נעות בין מיון זרימה, סינון ושטיפה. פרוטוקולים כאלה הם לעתים קרובות ידניים (מה שמוביל לשונות הקשורה למשתמש), יכולים לגזול זמן רב (מה שמוביל לירידה בכדאיות התא/הגרעין), ו / או עשויים לדרוש גישה לציטומטר זרימה למיון התא / הגרעין. מחקר זה התמקד בפיתוח פרוטוקול בידוד גרעינים בודדים פשוט, מהיר ואוטומטי חלקית מרקמות יונקים קפואים עבור יישומי ריצוף RNA במורד הזרם. התמקדנו במיוחד בבידוד גרעינים לעומת בידוד תאים מכיוון שהוא תואם לשימוש ברקמות קפואות, מה שהופך את איסוף / עיבוד הדגימות למעשי יותר ומאפשר אצווה בלתי משוחדת של דגימות, במיוחד בניסויים במסלול זמן. יתר על כן, למרות שהשעתוק הגרעיני אינו משקף באופן מלא את התעתיק התאי, מספר מחקרים הראו כעת כי נתוני ריצוף RNA של גרעינים בודדים דומים לנתוני ריצוף RNA של תא בודד לזיהוי סוג תא, למרות שהפרופורציות של סוגי תאים יכולות לנועבין 6,16,17,18,19.
בידוד גרעינים מורכב ממספר שלבים: 1) שיבוש מכני או כימי של הרקמה כדי לשחרר את הגרעינים, 2) ניקוי של פסולת וגושים, 3) ספירה מדויקת של גרעינים להכנה ליישומים במורד הזרם. במספר פרוטוקולים, שלב 1 כולל לעתים קרובות שימוש בהומוגנייזר Dounce על מנת לשבש את הרקמה 3,20. לחלופין, שיטות כימיות ניתן להשתמש, אם כי אלה לעתים קרובות צריך להיות אופטימלי עבור רקמות שונות 2,5,6. חווינו כי הליך שיבוש רקמות ידני נוטה לשונות הקשורה למפעיל, מה שמוביל לאיכות משתנה ותשואה של גרעינים. על מנת למזער את השונות הטכנית וליצור פרוטוקול עקבי יותר וניתן לשחזור הפועל על פני רקמות, פותח פרוטוקול המשתמש בדיסוציאטור רקמות רובוטי זמין מסחרית21. עבור שלב 2, למרות שחילופי חיץ הם בדרך כלל האמצעי הפשוט ביותר לשטיפת גרעינים, אימצנו את השימוש בשלב צנטריפוגה הדרגתי קצר יחסית של סוכרוז כדי לבצע הסרה יסודית יותר של פסולת. עבור רקמת המוח באופן ספציפי, אנו משתמשים בשיפוע קולואיד סיליקה במקום בשיפוע סוכרוז להסרת מיאלין יעילה יותר. לבסוף, עבור ספירה, השימוש hemocytometer הוא תקן הזהב לספירה ובדיקה חזותית של הגרעינים. בפרוטוקול שלנו, שלב זה יכול להיות אוטומטי באופן אמין באמצעות מונה תא פלואורסצנטי אוטומטי זמין מסחרית22. פרוטוקול זה נבדק והוא תואם למספר רקמות יונקים קפואים, כולל מוח, כליות, טחול וכבד, ממיני יונקים שונים (חולדה, עכבר ופרימט לא אנושי) ומספק גרעינים באיכות טובה לריצוף RNA של גרעינים בודדים במורד הזרם עם פלטפורמה מסחרית מבוססת טיפות. הפרוטוקול אורך כ-75 דקות מהכנת הרקמה ועד לתחילת תהליך ריצוף ה-RNA של הגרעינים הבודדים.
Protocol
כל המחקרים בבעלי חיים נערכו באישור הרשות הווטרינרית הקנטונלית של בזל-שטאדט תוך שמירה קפדנית על התקנות הפדרליות השווייצריות להגנה על בעלי חיים או באישור הוועדה המוסדית לטיפול ושימוש בבעלי חיים בהתאם לחוק רווחת בעלי החיים הגרמני.
1. הכנת רקמות וריאגנטים/מכשירים
- ניקוי והכנת מכשירים
- נקו ספסלים ופינצטה עם 70% אתנול ותמיסת טיהור RNase. מצננים מראש את הצנטריפוגות ל-4°C.
- קררו מראש את מחסניות בידוד הגרעינים במקרר בטמפרטורה של 4°C למשך 30 דקות לפחות.
- הפעל את הדיסוציאטור הרובוטי והפעל את הקירור על ידי הגדרת המחוון בפינה השמאלית העליונה של המסך להתקרר ועל ידי לחיצה עליו כדי להתחיל בקירור כך שהמחוון יופיע כתום. בדוק שלבקבוק מגיב אחסון הגרעינים המצורף (NSR) ולבקבוק מאגר בידוד הגרעינים (NIB) נותרו מספיק נוזלים והם מקוררים כראוי.
- הכינו קופסת קצף פוליסטירן מלאה בקרח יבש וצלחות פטרי ולהבי אזמל קרים מראש על קרח יבש.
- הכנת חיץ
- הכינו את תמיסת כרית הסוכרוז (SCS) באורך 1.5 מ' כפי שמוצג בטבלה 1. הפץ את ה- SCS ל- 500 μL aliquots ב- 2 מ"ל צינורות DNase/RNase כדי לקבל ארבעה אליציטוטים SCS של 500 μL לכל דגימה. יש לשמור את האליציטוטים על קרח עד לשימוש נוסף.
- במקרה של עיבוד רקמת מוח, הכינו במקום זאת תמיסת קולואיד סיליקה 18% כמתואר בטבלה 2, על ידי דילול תמיסת מלאי קולואיד סיליקה ב- NSR והוספת מעכב RNase. הכינו 3 מ"ל של תמיסת קולואיד סיליקה 18% לכל דגימה ושמרו אותה על קרח.
2. הומוגניזציה של רקמות ובידוד גרעינים
- הוציאו את הדגימה מהמקפיא בטמפרטורה של -80°C והניחו אותה מיד על קרח יבש.
- חותכים את הדגימה על צלחת פטרי מקוררת מראש או צלחת מתכת על קרח יבש עם אזמל מקורר מראש לחתיכה של 15-50 מ"ג (אם זה עדיין לא בגודל הנכון). הקפד לחתוך את המדגם בכיוון הנכון, כך שהמדגם עדיין מייצג את מבני האיברים המעניינים.
הערה: עם פרוטוקול זה, 15-50 מ"ג הוא גודל הדגימה האופטימלי למיצוי גרעיני. כדי להשיג תשואה טובה לאחר הניקוי, מומלץ גודל מדגם של לפחות 25 מ"ג. עבור דוגמאות קטנות יותר, מחסניות מיוחדות זמינות הממוטבות לעיבוד קלט קטן עם הדיסוציאטור הרובוטי. מחסניות קטנות לבידוד גרעיני קלט שימשו לניתוק דגימות רקמה במשקל של 4 מ"ג בלבד עם תפוקה מספקת לריצוף RNA של גרעינים בודדים במורד הזרם. דוגמה לתפוקת גרעינים באמצעות מחסנית הקלט הנמוך מרקמת כבד חולדה מוצגת בטבלה 3. - הוציאו את מחסנית בידוד הגרעינים מהמקרר, פרקו אותה, הוציאו את המטחנה ופיפטה 15 μL של מעכב RNase (40 U/μL) לתחתית המחסנית.
הערה: במהלך חילוץ הגרעינים, הדיסוציאטור הרובוטי יוסיף NIB ו- NSR למחסנית לנפח כולל של 3 מ"ל (עם פרוטוקול חילוץ גרעינים בנפח נמוך). על ידי הוספת 15 μL של מעכב RNase (40 U/μL) למחסנית לפני החילוץ, המתלה יהיה בעל ריכוז מעכבי RNAse הרצוי של 0.2 U/μL. - הניחו את דגימת הרקמה בתחתית המחסנית באמצעות פינצטה. אל תניח את הדגימה בדיוק במרכז המחסנית כדי לקבל יעילות הפרעה אופטימלית.
- בחר הפעל פרוטוקול במכשיר ולחץ על האפשרות Nuclei בפינה השמאלית העליונה.
- מהתפריט, בחר את פרוטוקול בידוד גרעיני עוצמת קול נמוכה וודא שמהירות ההפרעה מוגדרת למהירה על ידי לחיצה על שנה. טען את המחסנית למכשיר על ידי פתיחת הדלת והחלקה החוצה מהבמה על ידי הרמת הידית האדומה.
- הכנס את המחסנית למיקום המיועד, סובב את מנעול המחסנית והחלק בשלב עד שהכפתור האדום ייכנס למקומו. סגור את הדלת והתחל את ריצת חילוץ הגרעינים במכשיר על ידי לחיצה על הבא. משך הריצה כ-7 דקות.
- לאחר סיום הריצה, הסר את המחסנית מהמכשיר על ידי הרמת הידית האדומה ומשיכת הבמה. הנח מיד את המחסנית על קרח.
- עבור כל הרקמות, למעט המוח, המשך לשלב 3.1. עבור דגימות מוח, המשך ישירות לשלב 3.2.
3. ניקוי גרעינים
- ניקוי הדרגתי סוכרוז
הערה: עבור רקמת המוח, דלג על שלב זה ועבור ישירות לשלב 3.2. כל שלבי הניקוי מבוצעים על קרח על מנת למזער את התפרקות הרנ"א. חוצצים וצינורות, כמו גם הצנטריפוגות, צריכים להיות מקוררים מראש. כל שלבי המתלה והערבוב מבוצעים על ידי פיפטינג זהיר בלבד, שכן מערבולות עלולות לפגוע באיכות ובשלמות הגרעינים.- נקבו בזהירות את נייר הכסף העגול על מחסנית הדיסוציאטור עם קצה פיפטה.
הערה: לאחר דיסוציאציה, השעיית הגרעינים המתקבלת היא בעלת נפח משוער של 2 מ"ל. כדי להקל על ניקוי הדרגתי של סוכרוז, חלקו את תרחיף הגרעינים לשני אליציטוטים של 900 מיקרוליטר, וכתוצאה מכך נעשה שימוש בנפח כולל של 1.8 מ"ל של תרחיף גרעינים במהלך הניקוי. - הסר את 900 μL aliquot הראשון של השעיית גרעינים מהמחסנית והוסף אותו ל- 500 μL SCS aliquot שהוכן בעבר בצינור 2 מ"ל. מערבבים היטב על ידי pipetting עד תערובת הומוגנית.
- הסר את 1400 μL של תרחיף גרעינים - תערובת SCS ושכב אותו בזהירות על aliquot SCS חדש של 500 μL על-ידי החזקת הצינור בזווית והוספת התערובת כלפי מטה, יצירת הפרדת פאזה נראית בבירור (ראה איור 1A).
- סגור בזהירות את הצינור והחזיר אותו לקרח מבלי להפריע להפרדת הפאזה.
- חזור על שלבים 3.1.2-3.1.4 עם aliquot 900 μL השני של השעיה ו- aliquot SCS חדש כדי לקבל שני צינורות 2 מ"ל לכל דגימה עם הפרדת פאזה נראית בבירור עבור צנטריפוגה הדרגתית.
- הוסף בזהירות את הצינורות לצנטריפוגה מקוררת מראש וסחרר במהירות של 13,000 x גרם במשך 15 דקות ב- 4 ° C.
- בינתיים, הכינו את ה-NSR המתואר בטבלה 4, על ידי הוספת מעכב RNase לאליציטוט של NSR. הכן 1 מ"ל של NSR לכל דגימה.
הערה: בשלב זה, ניתן להסיר את חרוזי הג'ל מגיב ביטוי גנים של תא בודד מהמקפיא -80 °C, מה שמאפשר להם להתאזן לטמפרטורת החדר (RT), וניתן להשעות מחדש את אוליגו מתג התבנית במאגר TE נמוך. - לאחר הצנטריפוגה, הסר את הסופרנאטנט משני הצינורות מבלי להפריע לגלולה והשהה בזהירות את הגלולה ב -50 מיקרוליטר של NSR קר כקרח בהתאם להמלצת היצרן. אגרו את שני הכדוריות של אותה דגימה בצינור חדש של 1.5 מ"ל והוסיפו 900 מיקרוליטר של NSR קר כקרח לנפח כולל של 1 מ"ל. מערבבים היטב על ידי pipetting.
- צנטריפוגה הדגימה ב 500 x גרם במשך 5 דקות ב 4 ° C עם צנטריפוגת רוטור דלי מתנדנדת.
הערה: מומלץ מאוד להשתמש ברוטור דלי מתנדנד כדי למזער אובדן גרעינים, במיוחד כאשר תפוקת הגרעינים צפויה להיות נמוכה או כאשר מתחילים עם כמויות קטנות של רקמות. - בינתיים, הכינו 500 μL לכל דגימה של 1x PBS (ללא Ca2+ ו-Mg2+) עם אלבומין בסרום בקר 0.04% (BSA) ומעכב U/μL RNase 0.2 כמתואר בטבלה 5.
- בזהירות להסיר את supernatant מבלי להשליך את הגלולה להשעות מחדש את הגלולה ב 100 μL של פתרון PBS כפי שהוכן לעיל (1x PBS + 0.04% BSA + מעכב RNase ב 0.2 U / μL).
הערה: עבור דגימות רקמה קטנות, ריכוז הגרעינים עשוי להיות נמוך, ולכן מומלץ להשהות מחדש את הגלולה בתמיסת PBS של 50 מיקרוליטר בלבד כדי להבטיח ריכוזים גבוהים מספיק לריצוף RNA של גרעינים בודדים. - המשך ישירות לשלב 4.
- נקבו בזהירות את נייר הכסף העגול על מחסנית הדיסוציאטור עם קצה פיפטה.
- ניקוי שיפוע קולואיד סיליקה
הערה: עבור רקמת המוח, שיפוע קולואיד סיליקה מתאים יותר מאשר שיפוע סוכרוז כדי להסיר מיאלין ופסולת מתרחיף הגרעינים. כל שלבי הניקוי מבוצעים על קרח כדי למזער את התפרקות הרנ"א. חוצצים וצינורות, כמו גם הצנטריפוגות, צריכים להיות מקוררים מראש. כל שלבי המתלה והערבוב מבוצעים על ידי פיפטינג זהיר בלבד, שכן מערבולות עלולות לפגוע באיכות ובשלמות הגרעינים.- נקבו בזהירות את נייר הכסף העגול על מחסנית הדיסוציאטור עם קצה פיפטה.
- הסר את מתלה הגרעינים מהמחסנית והוסף אותו לצינור 5 מ"ל.
- צנטריפוגה ב 500 x גרם במשך 5 דקות ב 4 ° C בצנטריפוגה מקוררת מראש.
- בזהירות להסיר את supernatant מבלי להפריע את הגלולה להשהות מחדש את הגלולה ב 1 מ"ל של 18% תמיסת קולואיד סיליקה קר כקרח.
- הוסף 2 מ"ל נוספים של תמיסת קולואיד סיליקה 18% לקבלת נפח כולל של 3 מ"ל וערבב היטב על ידי פיפט.
- צנטריפוגה את הדגימה ב 700 x גרם במשך 5 דקות ב 4 ° C ברוטור דלי מתנדנד עם הבלם מופעל.
- בינתיים, הכינו את ה-NSR המתואר בטבלה 4 על ידי הוספת מעכב RNase לאליציטוט של NSR. הכן 1 מ"ל של NSR לכל דגימה.
הערה: בשלב זה, ניתן להסיר את חרוזי הג'ל מגיב ביטוי גנים של תא בודד מהמקפיא -80 °C, מה שמאפשר לו להתאזן ל- RT וניתן להשהות מחדש את אוליגו מתג התבנית במאגר TE נמוך. - הוציאו בזהירות את הדגימה מהצנטריפוגה מבלי להפריע לשכבת המיאלין הצפה מעליה.
- ראשית, להסיר את שכבת המיאלין מהחלק העליון ולהשליך; לאחר מכן, בזהירות להסיר את כל supernatant מבלי להפריע את הכדור.
הערה: ניתן להסיר את שכבת המיאלין בקלות על ידי כריכת מגבון סטרילי ללא סיבים סביב קצה פיפטה של 1 מ"ל כדי לשאוף את שכבת המיאלין יחד עם 1-2 מ"ל של הסופרנטנט. - יש להשהות מחדש את הגלולה ב-1 מ"ל של NSR קר כקרח בהתאם להמלצת היצרן.
- צנטריפוגה הדגימה ב 500 x גרם במשך 5 דקות ב 4 ° C בצנטריפוגה עם רוטור דלי מתנדנד.
הערה: מומלץ מאוד להשתמש ברוטור דלי מתנדנד כדי למזער אובדן גרעינים, במיוחד כאשר תפוקת הגרעינים צפויה להיות נמוכה או כאשר מתחילים עם כמויות קטנות של רקמות. - בינתיים, הכינו 500 μL לכל דגימה של 1x PBS (ללא Ca2+ ו-Mg2+) עם אלבומין בסרום בקר 0.04% (BSA) ומעכב U/μL RNase 0.2 כמתואר בטבלה 5.
- בזהירות להסיר את supernatant מבלי להפריע את הגלולה ו resuspend את הדגימה ב 100 μL של פתרון PBS כפי שהוכן לעיל (1x PBS + 0.04% BSA + מעכב RNase ב 0.2 U / μL).
הערה: עבור דגימות רקמה קטנות, ריכוז הגרעינים עשוי להיות נמוך, ולכן מומלץ להשהות מחדש את הגלולה בתמיסת PBS של 50 מיקרוליטר בלבד כדי להבטיח ריכוזים גבוהים מספיק לריצוף RNA של גרעינים בודדים.
4. ספירה
- כדי שכל דגימה תיספר, יש לדלל 10 μL של תרחיף גרעינים ב-20 μL של תמיסת PBS כדי לקבל דילול של 1:3.
- לספירה, הוסף 25 μL של תמיסת צביעה של פרופידיום יודיד (PI) לבאר ערבוב של צלחת ספירת מונה פלואורסצנטי. מוסיפים 25 μL של תרחיף גרעינים מדולל ומערבבים היטב על ידי pipetting. מעבירים את הדגימה המוכתמת 50 μL מבאר הערבוב לבאר הטעינה.
- טען את צלחת הספירה על מונה התא והתחל את הספירה.
הערה: ספירת הגרעינים נלקחת מהתעלה הפלואורסצנטית האדומה עם זמן חשיפה של 700 אלפיות השנייה. תעלה זו הותאמה לקבלת ספירת גרעינים מדויקת על ידי הצלבה לספירה ידנית עם תא נויבאואר וצביעה כחולה טריפאן מתחת למיקרוסקופ. בריכוזים גבוהים, הגרעינים קרובים מאוד זה לזה, מה שמקשה על התוכנה להפריד ביניהם. במקרה זה, מומלץ לספר את הדגימה בדילול מתאים. שלמות הגרעינים, כמו גם הניקיון, ניתנים להערכה מתמונת השדה הבהיר או תחת מיקרוסקופ. - לדלל את הדגימות עם PBS (1x PBS + 0.04% BSA + מעכב RNase ב 0.2 U / μL) לריכוז הרצוי עבור ריצוף RNA גרעיני יחיד.
הערה: ריכוזים בין 700-1,200 גרעינים/μL נחשבים אופטימליים לריצוף RNA של גרעינים בודדים. ריכוזי תאים נמוכים יותר, כגון 700 גרעינים/μL, עלולים לגרום לזיהום רקע מופחת מרנ"א סביבתי.
5. הכנת הספרייה
- בצע ריצוף RNA של גרעינים בודדים עם ריאגנטים לביטוי גנים של תא בודד באמצעות פרוטוקול היצרן המכוון לשחזור גרעינים של 8000-10,000 גרעינים לדגימה.
6. רצף
- רצף את הספריות עם עומק הרצף הרצוי עם אינדקס זוגי, כפול, והרצף הבא קורא: קרא 1: 28 מחזורים, i7 מדד: 10 מחזורים, i5 אינדקס: 10 מחזורים וקריאה 2: 90 מחזורים.
Representative Results
הביצועים והרבגוניות של פרוטוקול זה מודגמים על ידי ביצוע ריצוף RNA גרעיני יחיד על רקמת קליפת המוח העורפית הקפואה הטרייה משלושה עכברי B6, רקמת כליות טרייה קפואה חתוכה רוחבית משלוש חולדות וויסטאר, רקמת כבד ארכיונית (בת 11) וטחול משלושה קופי מקוק Cynomolgus מאוריציני. כל בעלי החיים לא היו מבולבלים.
כפי שניתן לראות באיורים 1B,C, התקבלו גרעינים באיכות טובה שהיו נקיים מסימנים של ניפוח, פסולת וגושים. הסינון המבוסס על שיפוע סוכרוז עבר אופטימיזציה לסילוק רוב הפסולת על-ידי בדיקת צפיפויות, מהירויות סיבוב וזמנים שונים, והערכת טוהר/שלמות הגרעין תחת מיקרוסקופ, כמו גם הערכת גודל הגרעינים, התפלגות ותפוקתם (איור 1D). זה איפשר לנו לבחור צפיפות שיפוע סוכרוז של 1.5 מ 'ולהשתמש בזמן סחיטה קצר של 15 דקות. לאחר מכן, כדי להעריך עוד יותר את איכות הגרעינים, הנתונים עובדו מראש באמצעות 10X Cell Ranger, וניתוח נתונים במורד הזרם בוצע באמצעות Besca23. גרעינים עם >5% אחוז תכולת מיטוכונדריה (מכיוון שהם נוטים להיות גרעינים פגומים/לחוצים) סוננו החוצה, וגרעינים עם 500-7,000 גנים (כדי למזער טיפות ריקות וכפולות) נשמרו. כללנו רק גנים שהיו קיימים בלפחות 30 גרעינים. התמקדנו ב-8,000 גרעינים לכל דגימה של קליפת המוח וב-10,000 גרעינים לכל דגימת כליה, כבד וטחול. לאחר הסינון התקבלו 10,644 גרעינים איכותיים משלוש דגימות המוח, 14,960 גרעינים איכותיים משלוש דגימות הכליה, 18,795 גרעינים איכותיים משלוש דגימות הכבד ו-13,882 גרעינים איכותיים משלוש דגימות הטחול. איור 2A,D,G,J מראה חלקות כינור המייצגות את התפלגות ספירות UMI, ספירת גנים ותכולת מיטוכונדריה בכל דגימה. המספר החציוני של ספירות בכל דגימות המוח היה 7,563 UMI/גרעין ו-3,208 גנים/גרעין. המספר החציוני של ספירות בכל דגימות הכליה היה 3,841 UMI/גרעין ו-1,915 גנים/גרעין. המספר החציוני של ספירות בכל דגימות הכבד היה 2,649 UMI/גרעינים ו-1,676 גנים/גרעינים. המספר החציוני של ספירות בכל דגימות הטחול היה 1,609 UMI/גרעינים ו-1,138 גנים/גרעינים. לאחר מכן יצרנו אשכולות באמצעות גנים משתנים מאוד והוספנו להם ביאורים באמצעות גנים ידועים של סמן 17,24,25,26. כפי שניתן לראות באיור 2B,E,H,K, הצלחנו לזהות את סוגי התאים הצפויים מכל רקמה. יתר על כן, כפי שניתן לראות באיור 2B,E,H,K, כל בעלי החיים תרמו לכל האשכולות, מה שמצביע על שונות טכנית נמוכה הכוללת שהציג הפרוטוקול. יתר על כן, הפרופורציות התאיות היו דומות בכל שלוש הדגימות לכל סוג רקמה, וכך גם ספירת ה-UMI וספירת הגנים (איור 2A,C,D,F,F,G,I,J,L). יוצא דופן בולט הוא הכבד, שבו אוכלוסיות הפטוציטים בין שלוש דגימות הכבד היו שונות בפרופורציות ובפרופיל. זה כנראה בגלל הבדלים ביולוגיים בין בעלי החיים (מין, גיל, מצב מטבולי).
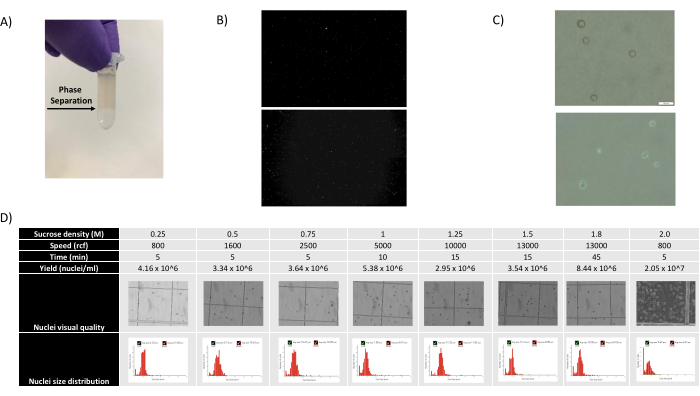
איור 1: הערכת איכות גרעינים ואופטימיזציה של שיפוע סוכרוז. (A) הפרדת הפאזה הצפויה במהלך צנטריפוגת גרדיאנט סוכרוז מוצגת בחץ. (B) תמונות פלואורסצנטיות מייצגות של גרעיני חולדה מוכתמים ביודיד פרופידיום (למעלה) וטחול צינומולגוס (תחתון) שהתקבלו עם הפרוטוקול. (C) תמונות מייצגות של מיקרוסקופ שדה בהיר של גרעינים שבודדו מכבד עכבר (למעלה) וממוח עכבר (למטה), סרגל קנה מידה 500 מיקרומטר. שימו לב למשטח החלק הרגיל של הגרעינים המעיד על איכות גרעינית טובה. (D) אופטימיזציה של שיפוע סוכרוז. נבדקו מספר צפיפויות סוכרוז, מהירויות סחיטה וזמני סחרור. תמונות מיקרוסקופיות שדה בהיר של גרעינים, התפלגות גודל גרעינים ותפוקת גרעינים מוצגות עבור כל תנאי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
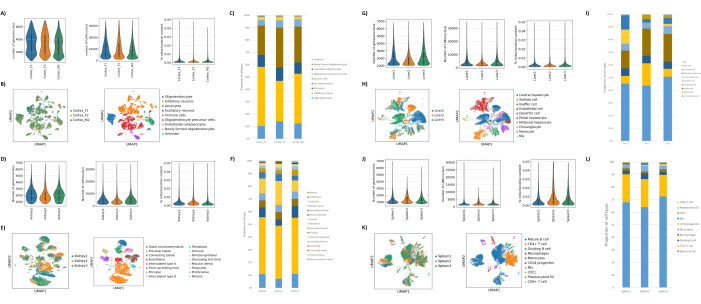
איור 2: נתונים מייצגים מ-snRNAseq על קליפת המוח העורפית של עכבר, כליה של חולדה (קליפת המוח ומדולה) וכבד וטחול של מקוק צינומולגוס. (A) תרשימי כינור המראים את התפלגות הגנים/הגרעין, UMIs/גרעין ואחוז התוכן המיטוכונדריאלי לכל דגימת מוח. (B) פאנל שמאלי: תרשים UMAP המציג את תרומתה של כל דגימה לצבירים שזוהו במוח. פאנל ימני: UMAP המציג את זהויות הצבירים המבוארים בהתבסס על גני סמן ברקמת המוח. (C) פרופורציות תאיות שנצפו ב-3 דגימות המוח. (D) תרשימי כינור המראים את התפלגות הגנים/גרעין, UMIs/גרעין, ואחוז התוכן המיטוכונדריאלי לכל דגימת כליה. (E) לוח שמאלי: תרשים UMAP המציג את תרומתה של כל דגימה לצבירים שזוהו בכליה. לוח ימני: UMAP המציג את זהויות הצבירים המבוארים בהתבסס על גני סמן ברקמת כליה. (F) פרופורציות תאיות שנצפו ב-3 דגימות הכליה. (G) תרשימי כינור המראים את התפלגות הגנים/גרעין, UMIs/גרעין, ואחוז התוכן המיטוכונדריאלי לכל דגימת כבד. (H) לוח שמאלי: תרשים UMAP המציג את תרומתה של כל דגימה לצבירים שזוהו בכבד. פאנל ימני: UMAP המציג את זהויות הצבירים המבוארים בהתבסס על גני סמן ברקמת הכבד. (I) פרופורציות תאיות שנצפו ב-3 דגימות הכבד. (J) תרשימי כינור המראים את התפלגות הגנים/גרעין, UMIs/גרעין, ואחוז התוכן המיטוכונדריאלי לכל דגימת טחול. (K) לוח שמאלי: תרשים UMAP המציג את תרומתה של כל דגימה לצבירים שזוהו בטחול. פאנל ימני: UMAP המציג את זהויות הצבירים המבוארים בהתבסס על גני סמן ברקמת הטחול. (L) פרופורציות תאיות שנצפו ב-3 דגימות הטחול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| רכיבים | ריכוז מלאי | נפח לדגימה | ריכוז סופי |
| פתרון כרית סוכרוז | 2 מטר | 1500 מיקרוליטר | 1.5 מטר |
| חיץ כרית סוכרוז | - | 500 μL | - |
| Dithiothreitol (DTT) | 1 מטר | 2 μL | 1 מ"מ |
| מעכב RNAse | 40 U/μL | 10 מיקרוליטר | 0.2 U/μL |
טבלה 1: הכנת תמיסת כרית סוכרוז 1.5 מ' (SCS). פתרון זה משמש לצנטריפוגה הדרגתית סוכרוז במהלך הניקוי בשלב 3.1 ויש להכין אותו טרי בכל פעם לפני תחילת הפרוטוקול. שמור תמיד את ה-SCS על קרח במהלך הפרוטוקול. הפתרונות המוזכרים בטבלה זו מוזכרים בטבלת החומרים.
| רכיבים | ריכוז מלאי | נפח לדגימה | ריכוז סופי |
| פתרון מלאי קולואיד סיליקה | 90% | 600 מיקרוליטר | 18% |
| מגיב אחסון גרעינים (גנומיקה S2) | - | 2400 מיקרוליטר | - |
| מעכב RNAse | 40 U/μL | 15 מיקרוליטר | 0.2 U/μL |
טבלה 2: הכנת תמיסת קולואיד סיליקה 18%. פתרון זה משמש עבור צנטריפוגה הדרגתית קולואיד סיליקה במהלך ניקוי בשלב 3.2 ויש להכין אותו טרי בכל פעם לפני תחילת הפרוטוקול. שמור תמיד את תמיסת קולואיד הסיליקה 18% על קרח במהלך הפרוטוקול.
| טישו | משקל לדוגמה | מחסנית | תשואה |
| כבד עכברוש | 25 מ"ג | מחסנית בידוד גרעינים | 65,000 גרעינים למ"ג רקמה |
| כבד עכברוש | 4 מ"ג | מחסנית בידוד גרעיני קלט קטנה | 32,000 גרעינים למ"ג רקמה |
טבלה 3: תפוקת גרעינים ממחסנית בידוד גרעיני הקלט הנמוך לעומת מחסנית בידוד הגרעינים לאחר ניקוי הדרגתי סוכרוז.
| רכיבים | ריכוז מלאי | נפח לדגימה | ריכוז סופי |
| מגיב אחסון גרעינים | - | 1000 מיקרוליטר | - |
| מעכב RNAse | 40 U/μL | 5 מיקרוליטר | 0.2 U/μL |
טבלה 4: הכנת מגיב אחסון גרעינים (NSR). פתרון זה משמש במהלך בידוד גרעינים בשלבים 3-5 וכן במהלך הניקוי בשלב 3.1.8. זה יכול להיות מאוחסן ב 4 °C עד 4 חודשים. הכינו aliquot טרי עם מעכב RNase במהלך שלב הצנטריפוגה בשלב הניקוי 6. הפתרונות המוזכרים בטבלה זו מוזכרים בטבלת החומרים.
| 1x PBS + 0.04% BSA פתרון מניות | |||
| רכיבים | ריכוז מלאי | נפח למלאי | ריכוז סופי |
| PBS (ללא Ca2+, ללא Mg2+) | 1x | 30 מ"ל | - |
| אלבומין בסרום בקר (BSA) | 30% | 40 מיקרוליטר | 0.04% |
| 1x PBS + 0.04% BSA + מעכב U/μL RNAse 0.2 | |||
| רכיבים | ריכוז מלאי | נפח לדגימה | ריכוז סופי |
| 1x PBS + 0.04% BSA פתרון מניות | - | 500 μL | - |
| מעכב RNAse | 40 U/μL | 2.5 מיקרוליטר | 0.2 U/μL |
טבלה 5: הכנת PBS + 0.04% BSA. פתרון זה משמש בסוף הניקוי בשלב 3.1.10 ולאחר הספירה כדי לדלל את תרחיף הגרעינים לריכוז הרצוי עבור ריצוף RNA של גרעינים בודדים פי 10 (שלב ספירה 4.4). ניתן לאחסן את פתרון המלאי ב -4 מעלות צלזיוס למשך עד חודש אחד. הכינו aliquot טרי עם מעכב RNase במהלך שלב הצנטריפוגה בשלב הניקוי 6.
Discussion
פיתחנו פרוטוקול רב-תכליתי ואוטומטי חלקית להשגת גרעינים בודדים באיכות גבוהה מרקמות יונקים קפואים והדגמנו את הפרוטוקול על מוח עכבר, כליות חולדה ורקמת כבד וטחול צינומולגוס.
כאשר משווים את הביצועים של פרוטוקול זה לזה של פרוטוקולים אחרים שפורסמו עבור ריצוף RNA של גרעין יחיד ברקמת המוח, הכליות, הטחול והכבד 6,7,20,24,25,26, אנו רואים שאנו מסוגלים לזהות מספר דומה של גנים וספירות UMI לכל גרעין ומסוגלים לשחזר את סוגי התאים הצפויים. בהשוואה לשיטות הקיימות, ישנם מספר יתרונות לפרוטוקול זה. ראשית, הפרוטוקול במחקר זה הופך הומוגניזציה של רקמות לאוטומטיות ובידוד של גרעינים בודדים. זה מושג באמצעות משבש רקמות רובוטי21. ברוב הפרוטוקולים, הרקמה הומוגנית עם הומוגנייזר Dounce על מנת לשחרר גרעינים בודדים 3,20. עם זאת, שמנו לב כי צעד ידני זה יכול להוביל לשונות ניסיונית בתפוקת הגרעינים ובשלמותם בהתאם לכמות הכוח המופעל במהלך הומוגניזציה, ולפגוע ביכולת השחזור של הניסויים. כאן, על ידי שימוש במטחנת רקמות אוטומטית עם הגדרות קבועות, איכות גרעינים טובה ותשואה עם עקביות רבה יותר הושגו על פני ניסויים. יתר על כן, אוטומציה של שלב זה גם מפחיתה את זמן הידיים של הפרוטוקול (שלב שיבוש הרקמה לוקח בערך 7 דקות), ומאפשר למשתמש להתכונן לשלבים הבאים. שנית, הפרוטוקול המתואר במחקר זה הוא רב-תכליתי, כלומר תואם לרקמות שונות ממינים שונים. זה מאפשר לנו להימנע מאופטימיזציה ארוכה של פרוטוקולים, למשל, לזהות מאגרי הומוגניזציה / דטרגנטים עבור רקמות שונות 2,5,6. שלישית, פרוטוקול זה אינו תלוי בגישה לממיין זרימה על מנת לקבל גרעינים נקיים, ולכן הוא נגיש יותר עבור מעבדות שאין להן את הציוד/המומחיות הנדרשים למיון זרימה. במקום זאת, ביצענו אופטימיזציה של סינון מבוסס שיפוע סוכרוז כדי להסיר את רוב הפסולת. עם זאת, עבור רקמת המוח בפרט, מומלץ להשתמש בשיפוע קולואיד סיליקה במקום שיפוע סוכרוז להסרת מיאלין יעילה יותר. מצאנו גם כי השימוש ברוטור דלי מתנדנד בקצה שלב הצנטריפוגה ההדרגתית של קולואיד סוכרוז/סיליקה ממזער את אובדן הגרעינים. לפיכך, השימוש ברוטור כזה מומלץ מאוד. רביעית, לאחר בדיקת מספר שיטות לספירת גרעינים (ספירה ידנית תחת המיקרוסקופ, שימוש במספר מונים אוטומטיים), מומלץ להשתמש במונה אוטומטי של תאים פלואורסצנטיים22. השימוש בצבע אינטרקלציה של DNA, כגון יודיד פרופידיום, מגביר את הדיוק של ספירת הגרעין. חמישית, פרוטוקול זה לוקח בערך 75 דקות מתחילתו ועד טעינת השבב microfluidic. זה עוזר להבטיח ששלמות הגרעינים תישאר גבוהה בעת עיבוד דגימות מרובות. לבסוף, מצאנו שהפרוטוקול תואם גם לרקמה משובצת בתרכובת טמפרטורת חיתוך אופטימלית (OCT). אם משתמשים בחומר כזה, ניתן להסיר את הרקמה מבלוק OCT באמצעות אזמל לפני הומוגניזציה.
אחד האתגרים השכיחים במערכי נתונים של ריצוף RNA גרעיני יחיד הוא נוכחותו של RNA סביבתי, שיכול להיות לא גרעיני (למשל, מיטוכונדריאלי) כמו גם נגזר גרעיני27,28. בפרוטוקול שלנו, RNA מיטוכונדריאלי (פרוקסי לרנ"א סביבתי שאינו גרעיני) נמוך אפילו לפני הסינון (0.1-1.6% עבור הרקמות המוצגות). עם זאת, בדומה לפרוטוקולים ומערכי נתונים אחרים, זיהום RNA סביבתי מגנים בעלי ביטוי גבוה בגרעינים של סוגי תאים שופעים (כגון הפטוציטים בכבד, נוירונים במוח וכו ') עדיין קיים27. קיימים מספר כלים ביואינפורמטיקה, כגון CellBender, SoupX וכו ', שיכולים להסיר זיהום RNA סביבתי כזה לפני ביאור גרעינים 29,30,31. מגבלה נוספת של פרוטוקול זה היא שלמרות ששלבי שיבוש הרקמות ובידוד הגרעינים הם אוטומטיים, התפוקה של שלב זה עדיין מגבילה מכיוון שניתן לעבד רק דגימה אחת בכל פעם. עם זאת, מכיוון ששלב זה לוקח רק כ -7 דקות לכל פיסת רקמה, עדיין ניתן לעבד דגימות מרובות באצווה. בדרך כלל אנו מעבדים ארבע דגימות בכל אצווה, אך ביצענו עד שש דגימות בכל אצווה עם תוצאות טובות. שיפורים אחרונים בדיסוציאטור הרובוטי כדי לאפשר עיבוד מקבילי של שתי דגימות בו זמנית יאפשרו עיבוד של 8-12 דגימות לאצווה, התואם את התפוקה של השבב המיקרופלואידי המשמש לאנקפסולציה של גרעינים בודדים.
למרות שלא השתמשנו בגרעינים שבודדו על ידי פרוטוקול זה עבור יישומים אחרים במורד הזרם, כגון ATAC-seq או snRNAseq באמצעות פלטפורמות אחרות, בהתבסס על איכות הנתונים המתקבלים עם ריאגנטים לביטוי גנים המשמשים כאן, אנו מאמינים שהפרוטוקול שלנו צריך להיות תואם ליישומים נוספים במורד הזרם. עם זאת, עבודה עתידית תכלול בדיקת פרוטוקול זה עם יישומים אחרים במורד הזרם, כגון ATAC-seq.
לסיכום, פיתחנו פרוטוקול בידוד גרעינים מהיר, פשוט ואוטומטי חלקית לריצוף RNA של גרעין בודד במורד הזרם, שהוכח כתואם לסוגים שונים של רקמות יונקים קפואים.
Disclosures
כל המחברים הם/היו עובדים של F. Hoffmann-La Roche במהלך עריכת המחקר.
Acknowledgements
המחברים רוצים להודות לפיליפ בוכנר, מריון ריצ'רדסון, פטרה שטאובל ומתיאס סלהאוזן על שסיפקו את רקמות בעלי החיים שנותחו בכתב יד זה. ברצוננו להודות גם לפטרה שוואלי, קלאס האטג'ה, רולנד שמוקי ומרטין אבלינג על תמיכתם בביואינפורמטיקה.
Materials
| Name | Company | Catalog Number | Comments |
| 1 M DTT | Thermo Fisher Scientific | P2325 | |
| 10% Tween 20 | Bio-Rad | 1662404 | |
| 10x Magnetic Separator | 10x genomics | PN-120250 | |
| 10x Vortex Adapter | 10x genomics | PN-120251 | |
| 1x DPBS (10x), no calcium, no magnesium | Thermo Fisher Scientific | 14190144 | stored at 4°C |
| 30% Bovine Serum Albumin | Sigma-Aldrich | A9576_50ML | |
| 400 mM Tris-HCl, pH 8.0 | Thermo Fisher Scientific | 15568025 | |
| 40U/μl RNaseOUT Recombinant Ribonuclease Inhibitor | Thermo Fisher Scientific | 10777019 | Stored at -20 °C |
| Agilent High Sensitivity DNA Kit | Agilent | 5067-4626 | |
| Cellaca MX High-throughput Automated Cell Counter | Nexcelom Bioscience | CELMXSYSF2 | Automated fluorescent cell counter |
| Chromium Next GEM Chip G Single Cell Kit, 16 rxns | 10x genomics | PN-1000127 | Single cell gene expression reagent, stored at room temperature |
| Chromium Next GEM Secondary Holder | 10x genomics | PN-1000195 | |
| Chromium Next GEM Single Cell 3' Gel Bead Kit v3.1, 4 rxns | 10x genomics | PN-1000129 | Single cell gene expression reagent, stored at -80 °C |
| Chromium Next GEM Single Cell 3' GEM, Library & Gel Bead Kit v3.1, 4 rxns | 10x genomics | PN-1000128 | Single cell gene expression reagent |
| Chromium Next GEM Single Cell 3' Library Kit v3.1 4 rxns | 10x genomics | PN-1000158 | Single cell gene expression reagent, stored at -20 °C |
| Chromium Next GEM Single Cell 3'GEM Kit v3.1 4 rxns | 10x genomics | PN-1000130 | Single cell gene expression reagent, stored at -20 °C |
| Divided Polystyrene Reservoirs | VWR | 41428-958 | |
| DNA LoBind Tubes 1.5ml Eppendorf | Sigma-Aldrich | EP0030108051 | |
| DNA LoBind Tubes 2ml Eppendorf | Sigma-Aldrich | EP0030108078 | |
| Dry ice | - | - | |
| Dynabeads MyOne SILANE | 10x genomics | PN-2000048 | Single cell gene expression reagent, stored at 4 °C |
| Ethanol Pure | Sigma-Aldrich | E7023 | |
| Glycerin (Glycerol), 50% (v/v) | Ricca Chemical Company | 3290-16 | |
| Heatblock | |||
| High-Throughput Nexcelom Counting Plates | Nexcelom Bioscience | CHM24-A100-001 | Cell counter counting plate |
| Low TE Buffer (10 mM Tris-HCl pH 8.0, 0.1 mM EDTA) | Thermo Fisher Scientific | 12090015 | |
| Mini Centrifuge | - | - | |
| NovaSeq 6000 SP Reagent Kit v1.5 (100 cycles) | Illumina | 2002840 | |
| Nuclei Isolation Buffer | S2 Genomics | 100-063-396 | Stored at 4 °C |
| Nuclei Isolation Cartridge | S2 Genomics | 100-063-287 | Precooled at 4 °C before use |
| Nuclei PURE 2 M Sucrose Cushion Solution | Sigma-Aldrich | NUC201-1KT | Sucrose cushion solution |
| Nuclei PURE Sucrose Cushion Buffer | Sigma-Aldrich | NUC201-1KT | |
| Nuclei Storage Reagent | S2 Genomics | 100-063-405 | Stored at 4 °C |
| PCR Tubes 0.2 ml 8-tube strips | Eppendorf | 30124359 | |
| Percoll | GE Healthcare | 17-0891-02 | Silica colloid solution |
| PhiX Control v3 | Illumina | FC-110-3001 | |
| Qiagen Buffer EB | Qiagen | 19086 | |
| Qubit dsDNA HS Assay Kit | Thermo Fisher Scientific | Q32854 | |
| Refrigerated Centrifuge (Eppendorf 5804R) | Eppendorf | 5805000010 | |
| Refrigerated Centrifuge with Swinging-Bucket Rotor (Eppendorf 5810R) | Eppendorf | 5811000015 | |
| RNAseZap | Ambion | AM9780 | RNAse decontamination solution |
| Round cell culture petri dish | SPL | 330005 | |
| Scalpel disposable | Aesculap AG | BA210 | pre-cooled on dry ice before use |
| Single Index Kit T Set A, 96 rxns | 10x genomics | PN-1000213 | Single cell gene expression reagent, stored at -20 °C |
| Singulator 100 System | S2 Genomics | - | Commercially available robotic tissue dissociator |
| Sodium Hydroxide 1M | Sigma-Aldrich | 72068 | |
| SPRIselect Reagent Kit | Beckman Coulter | b23318 | |
| Sterile tweezers | - | - | |
| UltraPure DNase/RNase-Free Distilled Water | Thermo Fisher Scientific | 10977049 | |
| ViaStain PI Staining Solution | Nexcelom Bioscience | CS1-0109-5mL | Propidium iodide staining solution |
| Vortex Mixer+A2:D44 | VWR | - |
References
- Burja, B., et al. An Optimized Tissue Dissociation Protocol for Single-Cell RNA Sequencing Analysis of Fresh and Cultured Human Skin Biopsies. Front Cell Dev Biol. 10, 872688 (2022).
- Kimbley, L. M., et al. Comparison of optimized methodologies for isolating nuclei from esophageal tissue. Biotechniques. 72 (3), 104-109 (2022).
- Maitra, M., et al. Extraction of nuclei from archived postmortem tissues for single-nucleus sequencing applications. Nature Protocols. 16 (6), 2788-2801 (2021).
- Nadelmann, E. R., et al. Isolation of nuclei from mammalian cells and tissues for single-nucleus molecular profiling. Current Protocols. 1 (5), e132 (2021).
- Rousselle, T. V., et al. An optimized protocol for single nuclei isolation from clinical biopsies for RNA-seq. Scientific Reports. 12, 9851 (2022).
- Slyper, M., et al. A single-cell and single-nucleus RNA-Seq toolbox for fresh and frozen human tumors. Nature Medicine. 26 (5), 792-802 (2020).
- Leiz, J., et al. Nuclei isolation from adult mouse kidney for single-nucleus RNA-sequencing. Journal of Visualized Experiments: JoVE. (175), 62901 (2021).
- Alvarez, M., et al. Isolation of nuclei from human snap-frozen liver tissue for single-nucleus RNA sequencing. Bio-Protocol. 13 (3), e4601 (2023).
- Ayhan, F., Douglas, C., Lega, B. C., Konopka, G. Nuclei isolation from surgically resected human hippocampus. STAR Protocols. 2 (4), 100844 (2021).
- Joshi, N., Misharin, A. Single-nucleus isolation from frozen human lung tissue for single-nucleus RNA-seq. Protocols.io. , (2019).
- Martelotto, L. G., Luciano Martelotto, L. 'Frankenstein' protocol for nuclei isolation from fresh and frozen tissue for snRNAseq. Protocols.io. , (2020).
- Masilionis, I., Chaudhary, O., Chaligne, R., Mazutis, L. Nuclei extraction for single-cell RNAseq from frozen tissue using Singulator™ 100. Protocols.io. , (2022).
- Matson, K. J. E., et al. Isolation of adult spinal cord nuclei for massively parallel single-nucleus RNA sequencing. Journal of Visualized Experiments: JoVE. (140), 58413 (2018).
- Mendelev, N., et al. Multi-omics profiling of single nuclei from frozen archived postmortem human pituitary tissue. STAR Protocols. 3 (2), 101446 (2022).
- Soule, T. G., et al. A protocol for single nucleus RNA-seq from frozen skeletal muscle. Life Science Alliance. 6 (5), e202201806 (2023).
- Bakken, T. E., et al. Single-nucleus and single-cell transcriptomes compared in matched cortical cell types. PLoS One. 13 (12), e0209648 (2018).
- Ding, J., et al. Systematic comparison of single-cell and single-nucleus RNA-sequencing methods. Nature Biotechnology. 38, 737-746 (2020).
- Hu, P., et al. Single-nucleus transcriptomic survey of cell diversity and functional maturation in postnatal mammalian hearts. Genes & Development. 32 (19-20), 1344-1357 (2018).
- Lake, B. B., et al. A comparative strategy for single-nucleus and single-cell transcriptomes confirms accuracy in predicted cell-type expression from nuclear RNA. Scientific Reports. 7, 6031 (2017).
- Narayanan, A., et al. Nuclei Isolation from Fresh Frozen Brain Tumors for Single-Nucleus RNA-seq and ATAC-seq. Journal of Visualized Experiments: JoVE. (162), 61542 (2020).
- Jovanovich, S., et al. . Automated processing of solid tissues into single cells or nuclei for genomics and cell biology applications with the Singulator™ 100 and 200 systems. , (2022).
- Bell, J., et al. Characterization of a novel high-throughput, high-speed and high-precision plate-based image cytometric cell counting method. Cell & Gene Therapy Insights. 7 (4), 427-447 (2021).
- Madler, S. C., et al. Besca, a single-cell transcriptomics analysis toolkit to accelerate translational research. NAR Genomics and Bioinformatics. 3 (4), lqab102 (2021).
- Wu, H., et al. Mapping the single-cell transcriptomic response of murine diabetic kidney disease to therapies. Cell Metabolism. 34 (7), 1064-1078 (2022).
- Han, L., et al. Cell transcriptomic atlas of the non-human primate Macaca fascicularis. Nature. 604 (7907), 723-731 (2022).
- Madissoon, E., et al. scRNA-seq assessment of the human lung, spleen, and esophagus tissue stability after cold preservation. Genome Biology. 21 (1), 1 (2019).
- Caglayan, E., Liu, Y., Konopka, G. Neuronal ambient RNA contamination causes misinterpreted and masked cell types in brain single-nuclei datasets. Neuron. 110 (24), 4043-4056 (2022).
- Luecken, M. D., Theis, F. J. Current best practices in single-cell RNA-seq analysis: a tutorial. Molecular Systems Biology. 15 (6), e8746 (2019).
- Fleming, S. J., et al. Unsupervised removal of systematic background noise from droplet-based single-cell experiments using CellBender. bioRxiv. , (2022).
- Yang, S., et al. Decontamination of ambient RNA in single-cell RNA-seq with DecontX. Genome Biology. 21 (1), 57 (2020).
- Young, M. D., Behjati, S. SoupX removes ambient RNA contamination from droplet-based single-cell RNA sequencing data. Gigascience. 9 (12), giaa151 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved