Подготовка образцов для криотомографии клеток млекопитающих in situ
In This Article
Summary
Этот метод обеспечивает доступный и гибкий протокол подготовки сеток электронной микроскопии (ЭМ) для клеточной криотомографии in situ и коррелятивной световой и электронной микроскопии (КЛЭМ).
Abstract
Клеточная криотомография in situ является мощным методом для изучения сложных объектов в их естественном замороженно-гидратированном клеточном контексте, что делает ее очень актуальной для клеточной биологии и вирусологии. Потенциал сочетания криотомографии с другими методами микроскопии делает ее идеальным методом для интегративной и коррелятивной визуализации. Тем не менее, подготовка образцов для клеточной томографии in situ не является простой задачей, поскольку клетки не прикрепляются и не растягиваются по сетке электронной микроскопии. Кроме того, сетки сами по себе хрупкие и могут сломаться при слишком сильном обращении, что приведет к потере видимых областей. Геометрия чашек для культур тканей также может представлять проблему при манипулировании сетками с помощью пинцета. В этой статье мы опишем советы и рекомендации по преодолению этих (и других) проблем и подготовке высококачественных образцов для клеточной криотомографии in situ и корреляционной визуализации адгезивных клеток млекопитающих. Благодаря постоянному прогрессу в технологии криомикроскопии, этот метод имеет огромные перспективы для углубления нашего понимания сложных биологических систем.
Introduction
Клеточная криотомография in situ является мощным методом, позволяющим изучать биологически значимые структуры в клетках без химической фиксации. При присоединении клеток к электромагнитным сеткам и замораживании решеток в криогене интересующие объекты замораживаются в их естественном клеточном контексте без образования кристаллического льда из внутриклеточной воды 1,2. Как химическая фиксация, так и образование кристаллического льда могут нарушать структуры соответствующих молекул, таких как белки и липиды, снижая биологическую точность изображений, полученных с помощью этих методов 3,4. В томографии сетки получают изображения под пошаговыми углами с помощью электронной микроскопии, и эти изображения затем используются для построения трехмерных представлений целевой области, изображенной5. Криотомография in situ может использоваться наряду с другими методами микроскопии для интегративной и коррелятивной визуализации, такими как криофлюоресцентная визуализация, мягкая рентгеновская томография и криоFIB/SEM (криогенная сфокусированная ионная пучок/сканирующая электронная микроскопия)6,7,8,9,10,11 . Интеграция нескольких методов позволяет получить больше информации о структуре или процессе, чем любой отдельный метод микроскопии.
Несмотря на все преимущества клеточной криотомографии in situ, подготовка образцов может оказаться сложной задачей по целому ряду причин. Из-за их хрупкости силовые манипуляции с электронными микроскопическими сетками могут привести к их повреждению, при этом тонкий углеродный слой, в частности, хрупкий и склонный к разрыву, что уменьшает видимую площадь сеток. Сетками для электронной микроскопии также трудно манипулировать из-за их небольшого размера, и они склонны отделяться от поверхности лунок или микрослайдов, используемых для выращивания клеток. Манипуляции с решетками внутри лунок или микропредметными стеклами могут оказаться сложными из-за их геометрии. Неправильная подготовка сеток (например, возможность их плавания) может привести к низкой плотности ячеек и уменьшению количества потенциальных областей визуализации, особенно когда клетки не склонны прикрепляться к самим сеткам. При прямой клеточной криотомографии клетки должны распространяться очень тонким слоем, что может быть нарушено по многим причинам, включая неправильную температуру или грубое обращение с решетками.
Методы, представленные в этой статье, призваны справиться с этими наиболее распространенными ошибками, возникающими при подготовке сеток электронной микроскопии для криотомографии. Использование пинцета с углом 5/15 позволяет манипулировать сетками в луночных планшетах или микропредметных стеклах. Раствор фибронектина, нанесенный на обе стороны сеток перед нанесением покрытия, снижает вероятность появления плавающих сеток, что полезно для обеспечения того, чтобы сетки имели достаточную плотность клеток и что решетки с меньшей вероятностью будут повреждены из-за манипуляций. Сохраняя решетки в инкубационном состоянии при температуре 37°C непосредственно перед замораживанием, мы также гарантируем, что клетки хранятся в комфортных условиях, чтобы предотвратить втягивание тонких краев клеток. Промокание сеток с тыльной стороны также предотвращает повреждение клеток механическим воздействием. В совокупности эти меры повышают успешность подготовки образцов для исследований клеточной криотомографии in situ , повышая доступность этого подхода к визуализации.
Protocol
1. Подготовка сетки
ПРИМЕЧАНИЕ: В экспериментальном проекте запланируйте максимум 8-12 решеток на сеанс погружного замораживания и 4-5 решеток на скважину. Более того, это приведет к очень длительному сеансу замораживания, что может вызвать повышенный стресс клеток, загрязнение льдом и ошибки пользователя.
- Тлеющий разряд
- Загрузите соответствующее количество решеток перфорированной углеродной поддерживающей пленкой, которая будет разряжаться при давлении 15 мА в течение 45 с при атмосфере 0,39 мбар в устройстве тлеющего разряда.
- Убедитесь, что карбоновая сторона решетки обращена вверх. Когда закончите, переложите решетки в чистый контейнер, выстланный фильтровальной бумагой (Рисунок 1A 1).
ПРИМЕЧАНИЕ: Другие сетки могут использоваться при условии, что материал не токсичен для клеток (что исключает любую медную сетку). Сетки поиска полезны для корреляционных исследований. Также возможны решетки из других материалов. Многие лаборатории показали хорошие результаты при выращивании клеток на основе опорных решетокSiO2 8,9.
- Адгезивное лечение
- Перенесите сетки, фибронектин, PBS, пластины и пинцет в шкаф биобезопасности. Обработайте обе стороны решетки 20 мкг/мл бычьим фибронектином путем микропипетирования двух больших точек адгезивного раствора на стерильной поверхности, например, на крышке 6-луночного планшета. Убедитесь, что точки достаточно велики, чтобы охватить всю сетку (рекомендуется около 100 мкл).
ПРИМЕЧАНИЕ: Перед обработкой выбранным адгезивным раствором существует возможность фотомикроструктурирования сетки для оптимизации прикрепления клеток к центру квадратов сетки. Уменьшение способности ячеек прикрепляться к стержням приведет к увеличению количества визуализируемых ячеек. Это идеально подходит для экспериментов, связанных с измельчением cryoFIB. - Используйте пинцет 5/15 для манипуляций с сетками. Обязательно обработайте обе стороны сетки в растворе.
ПРИМЕЧАНИЕ: Могут быть использованы другие адгезивные растворы (фибриноген, коллаген, другие компоненты внеклеточного матрикса и т.д.). Здесь используется фибронектин, так как он дает хорошие результаты с самыми разнообразными клеточными линиями. (U2OS, HeLa, Vero, Calu-3, Tzm-bl). Пинцет 5/15 полезен, так как его геометрия обеспечивает улучшенную маневренность вокруг 6-луночных планшетов, 35-миллиметровых тарелок и микропредметных стекол. Это приводит к снижению механической нагрузки на решетки и более неповрежденной углеродной пленке. Перед началом работы убедитесь, что все необходимые материалы помещены в шкаф биобезопасности, так как это снижает вероятность загрязнения сети.
- Перенесите сетки, фибронектин, PBS, пластины и пинцет в шкаф биобезопасности. Обработайте обе стороны решетки 20 мкг/мл бычьим фибронектином путем микропипетирования двух больших точек адгезивного раствора на стерильной поверхности, например, на крышке 6-луночного планшета. Убедитесь, что точки достаточно велики, чтобы охватить всю сетку (рекомендуется около 100 мкл).
- Крепление сеток
- После обработки бычьим фибронектином сетка станет липкой. Пинцетом 5/15 осторожно прикоснитесь неуглеродистой поверхностью решетки ко дну пустой тарелки/тарелки и откройте пинцет. Сетка должна легко крепиться к новой поверхности (рис. 1А, 2).
ПРИМЕЧАНИЕ: Старайтесь не размещать решетки прямо по центру или по краям тарелки. При добавлении ячеек наблюдается тенденция к накоплению плотности клеток в центре пластины. Это может привести к появлению сеток с чрезмерной плотностью ячеек. В качестве альтернативы здесь можно использовать напечатанные на 3D-принтере держатели сетки вместо того, чтобы прикреплять ячейки непосредственно к поверхности тарелки/тарелки12.
- После обработки бычьим фибронектином сетка станет липкой. Пинцетом 5/15 осторожно прикоснитесь неуглеродистой поверхностью решетки ко дну пустой тарелки/тарелки и откройте пинцет. Сетка должна легко крепиться к новой поверхности (рис. 1А, 2).
- Инкубация
- Инкубируют сетки в течение 30 мин в адгезивном растворе фибронектина (20 мкг/мл). Чтобы гарантировать, что решетки не станут сухими во время этого процесса, микропипетки по 1-2 капли более адгезивного раствора непосредственно поверх решеток каждые 15 мин (рис. 1А3).
ПРИМЕЧАНИЕ: Инкубационный период будет варьироваться в зависимости от используемого адгезивного раствора. Для бычьего фибронектина рекомендуемое время составляет 30 мин.
- Инкубируют сетки в течение 30 мин в адгезивном растворе фибронектина (20 мкг/мл). Чтобы гарантировать, что решетки не станут сухими во время этого процесса, микропипетки по 1-2 капли более адгезивного раствора непосредственно поверх решеток каждые 15 мин (рис. 1А3).
- Стирка
- После инкубационного периода удалите излишки адгезивного раствора с помощью микропипетирования. Вымойте решетки, микропипетируя капли PBS непосредственно поверх решеток. Повторите это 2-3 раза. (Рисунок 1А4).
- Стерилизация
- Используйте ультрафиолетовый свет для стерилизации решеток в шкафу биобезопасности в течение 1 часа. Разместите решетки как можно ближе к источнику УФ-излучения, чтобы обеспечить максимальную стерилизацию (Рисунок 1A5). Чтобы убедиться, что сетки не становятся сухими во время этого процесса, каждые 10 минут наносите микропипетку по 1-2 капли PBS непосредственно поверх сеток.
ПРИМЕЧАНИЕ: Шаги 1.4-1.6 можно выполнять одновременно.
- Используйте ультрафиолетовый свет для стерилизации решеток в шкафу биобезопасности в течение 1 часа. Разместите решетки как можно ближе к источнику УФ-излучения, чтобы обеспечить максимальную стерилизацию (Рисунок 1A5). Чтобы убедиться, что сетки не становятся сухими во время этого процесса, каждые 10 минут наносите микропипетку по 1-2 капли PBS непосредственно поверх сеток.
2. Посевные решетки
- Количество ячеек:
- Отделите и подсчитайте клетки, используя механические или ферментативные методы. Определите оптимальное количество ячеек, которые будут использоваться для посева перед подсчетом. Для U2OS, высеваемого в 6-луночную пластину, используйте от 6 x 104 до 1,6 x 105 ячеек на лунку (Рисунок 1B1).
ПРИМЕЧАНИЕ: Количество засеянных ячеек будет варьироваться в зависимости от типа ячейки, площади поверхности лунки, используемой чашки или микропредметного стекла, времени между посевом и погружным замораживанием, а также дизайна эксперимента. Протестируйте диапазон номеров ячеек, чтобы определить условия, которые приведут к 0,25-1 ячейке на квадрат сетки во время погружного замораживания. Важно отметить, что высокая плотность клеток снижает скорость теплопередачи и может повлиять на процесс витрификации. Для борьбы с этим некоторые лаборатории успешно используют клеточные сетчатые фильтры, которые предотвращаютобразование клеточных скоплений. Наконец, этот протокол приводит к случайному прикреплению клеток к углеродному слою. Если необходимо целенаправленное прикрепление, можно использовать фотомикроузоры (см. шаг 1.3)14.
- Отделите и подсчитайте клетки, используя механические или ферментативные методы. Определите оптимальное количество ячеек, которые будут использоваться для посева перед подсчетом. Для U2OS, высеваемого в 6-луночную пластину, используйте от 6 x 104 до 1,6 x 105 ячеек на лунку (Рисунок 1B1).
- Добавление клеток и питательной среды: Добавляйте клетки с помощью микропипетки в лунки, избегая пузырьков (Рисунок 1B2). В 6-луночном планшете рекомендуется общий объем лунки 1,5-2,0 мл.
ПРИМЕЧАНИЕ: Рекомендуется тщательно намочить сетки, прежде чем добавлять весь объем. Это поможет предотвратить отслоение и всплытие сеток в растворе. Осторожно перемещайте пластину из стороны в сторону, чтобы обеспечить равномерное распределение клеток по лунке. Не вращайте пластину круговыми движениями, так как это приведет к чрезмерной плотности ячеек в центре лунки. - Инкубация: Инкубируйте предметные стекла при температуре 37 °C в течение соответствующего времени в соответствии с планом эксперимента, который будет зависеть от последующих применений. В этом примере (трансфекция молекулярных клонов ВИЧ) инкубируют в течение 16-24 ч (рис. 1B3).
ПРИМЕЧАНИЕ: Более длительное время инкубации приведет к большему количеству циклов деления клеток. Поэтому соответствующим образом отрегулируйте стартовое количество ячеек для посева.
3. Трансфекция
- Приготовление смеси для трансфекции:
- Подготовьте соответствующий катионный липосомный реагент для трансфекции плазмиды в выбранную клеточную линию.
- В этом примере трансфекции используют 1 мкг общей плазмидной ДНК на лунку (в 6-луночном планшете) для трансфиции в соотношении 1:3 плазмиды HIViΔEnv к плазмиде psPAX2. Для каждой лунки разводят 1 мкг ДНК в 50 мкл безсывороточного DMEM. Гомогенизируйте смесь с помощью многократного микропипетирования или легкого вращения планшета.
- Для каждой лунки разведите 3 мкл реагента для трансфекции в безсывороточном DMEM, затем снова гомогенизируйте смесь с помощью микропипетирования или мягкого закручивания. Добавьте всю разбавленную смесь реагентов для трансфекции в разбавленную смесь ДНК (шаг 3.1.2) и инкубируйте при комнатной температуре (RT) в течение 15 мин (рис. 1C 1).
ПРИМЕЧАНИЕ: Пока эта смесь инкубируется, замените среду в лунках 1,5 мл свежего DMEM. Будьте осторожны, чтобы не сбить решетки со дна колодца.
- Для нанесения смеси для трансфекции пипеткой 100 мкл смеси из стадии 3.1.3 по каплям в каждую лунку, концентрируя капли по сеткам для обеспечения контакта (рис. 1C2). Смените питательную среду через 16-24 ч после трансфекции (рис. 1С3).
4. Погружная заморозка
ПРИМЕЧАНИЕ: Храните клетки при температуре 37 °C до тех пор, пока они не понадобятся для промокания. Кроме того, обязательно обратите внимание на углеродную сторону решеток на протяжении всего процесса.
- Плотность ячеек
- Проверьте сетки в инвертированном оптическом микроскопе и отметьте плотность клеток на каждой сетке.
ПРИМЕЧАНИЕ: Сетки с менее чем 0,25 ячейками на квадрат сетки (или одна ячейка на каждые 4 квадрата сетки) считаются пустыми. Сетки с 0,25-1 ячейкой на квадрат сетки считаются «нормальными». Сетки с более чем 1 ячейкой на квадрат сетки считаются «полными». - Обратите внимание на плотность ячеек на каждой сетке, чтобы можно было установить время промокания позже во время погружного замораживания. Добавьте 2-3 мл PBS в пустую тарелку/блюдо и нагрейте до 37 °C.
- Проверьте сетки в инвертированном оптическом микроскопе и отметьте плотность клеток на каждой сетке.
- Подготовка реперных знаков
- Чтобы подготовить реперные точки золота для последующей криотомографии, пипетку 50 мкл раствора коллоидных золотых шариков 10 нм в чистую пробирку объемом 1,5 мл. Добавьте в пробирку 2 мкл 1 мг/мл БСА и гомогенизируйте путем многократного микропипетирования.
- Центрифугируйте пробирку при 15 000-20 000 x g в течение 15 мин. Микропипетка для удаления как можно большего количества надосадочной жидкости, не повреждая гранулы.
ПРИМЕЧАНИЕ: Гранула будет очень рыхлой. - Добавьте 50 мкл PBS к грануле и ресуспендируйте ее. Снова центрифугируйте пробирку при 15 000-20 000 x g в течение 15 мин.
- С помощью наконечника объемом 10 мкл непосредственно аспирируйте 4 мкл гранулы и перелейте ее в чистую пробирку объемом 1,5 мл (рис. 1D 1). Используйте 1 мкл промытого и концентрированного золота на сетку.
ПРИМЕЧАНИЕ: Тип используемых реперных точек зависит от последующих применений. Для ПЭМ-томографии используйте золотые шарики 10 нм. Для мягкой рентгеновской томографии используйте золотые шарики размером 200 нм. Для корреляционной микроскопии используют флуоресцентные латексные шарики. Реперные точки, как правило, не нужны для экспериментов, связанных с измельчением криоFIB, так как процесс измельчения разрушит их.
- Потеря резкости
- Установите климатическую камеру на влажность 95% и температуру 30°C (Рисунок 1D 1). Выделите сетку пинцетом 5/15.
- Промойте решетки PBS и переложите их на погружной пинцет (рис. 1D2). После фиксации извлеките пинцет 5/15 и сдвиньте зажим на погружающийся пинцет.
- Вставьте решетку в погружную морозильную камеру, надежно закрепив зажим (Рисунок 1D3). Добавьте 1 мкл золотых реперных знаков на обратную сторону сетки (рис. 1D4). Добавьте 2-3 мкл PBS на углеродную сторону сетки. Используйте автоматическое промокание, чтобы промокнуть тыльную сторону сетки и погрузить замерзшую жидкость в жидкий этан (рис. 1D5).
ПРИМЕЧАНИЕ: Для оптимального блоттинга рекомендуется иметь от 3 до 4 мкл объема на сетку. Решетки могут удерживать различное количество PBS после промывки. Отрегулируйте добавленный объем PBS с учетом ранее существовавшей задержки жидкости в сети. Рекомендуется, чтобы золотые реперные знаки были добавлены в заднюю часть сетки. Добавление спереди может привести к образованию пул золотых реперных знаков вблизи места вставки, в то время как добавление сзади приводит к более гомогенизированному раствору. Продолжительность блоттинга зависит от клеточной стоматологии сетки. 2 с для пустой сетки, 3 с для нормальной и 4 с для полной сетки соответственно. Тип погружной морозильной камеры может определять подход к промоканию: погружная морозильная камера Leica GP2 используется в этом протоколе и по умолчанию способна к автоматическому одностороннему промоканию. Компания Thermo Fisher Vitrobot выполняет автоматизированное двустороннее блоттинг, хотя это часто повреждает клетки, прикрепленные к углеродной стороне. Также возможно ручное промокание в Vitrobot, а также ручные гравитационные плунжеры.
Representative Results
После котрансфекции HIViGFPΔEnv и psPAX2 все решетки имели минимальный разрыв углеродного слоя. Сетки визуализировали с помощью фазовой световой микроскопии и флуоресцентной световой микроскопии через 24 ч после инкубации с трансфекционным реагентом (рис. 2). Ячейки как на фиктивных сетках, так и на котрансфицированных сетках содержали жизнеспособные ячейки в нескольких квадратах сетки.
psPAX2 кодирует все структурные и ферментативные белки ВИЧ-1 без флуоресцентного мечения. HIViGFPΔEnv похож на psPAX2, но имеет коды для GFP-меченого белка ВИЧ Gag. Обе плазмиды являются ΔEnvelope. Котрансфекция приводит к нативной сборке и почкованию флуоресцентных частиц ВИЧ-1, что делает эту систему отличной для CLEM-исследований ВИЧ в условиях 1-го уровня биобезопасности. Котрансфицированные сетки показали подмножество клеток, демонстрирующих зеленую флуоресценцию, что указывает на успешную котрансфекцию. Ни одна клетка на макетной сетке не продемонстрировала флуоресценции, что еще раз подтвердило котрансфекцию с использованием HIViGFPΔEnv и psPAX2. После просмотра сеток с помощью световой микроскопии решетки были погружены в замороженную и перемещены на длительное хранение в жидком азоте.
На рисунке 3 показаны результаты, полученные с помощью сеток, полученных с использованием того же экспериментального метода, но с использованием несколько отличающихся плазмидных конструкций. U2OS-содержащие сетки совместно трансфицировали с использованием различных клонов ВИЧ (HIVmCherryΔEnv и NL4-3ΔEnvGFP в соотношении 1:6). Поскольку использовалась более высокая масса флуоресцентно меченных плазмид, эти сетки позволили наблюдать большее количество трансфицированных клеток, обеспечивая преимущество при получении изображений с помощью cryoCLEM и cryoET. С помощью cryoCLEM для каждой сетки с помощью криофлюоресцентной микроскопии были созданы полные сетчатые атласы для записи местоположения всех котрансфицированных клеток. Когда расположение клеток было известно, была проведена криоЭТ. Был собран полный атлас сетки с малым увеличением и наложен на флуоресцентный атлас, собранный при криофлюоресценции (рис. 3A). Криотомограммы были собраны на клеточных участках, фиксирующих сложные детали жизненного цикла вируса, включая сборку и почкование ВИЧ из клеток (рис. 3B).
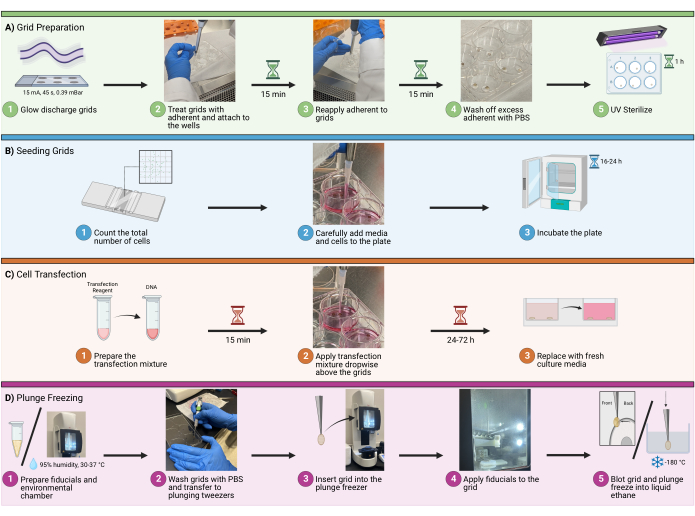
Рисунок 1: Рабочий процесс заполнения ячеек на сетках. Схема, изображающая общую процедуру засеивания клеток на криоЭМ-решетки. Процесс разделен на четыре основных этапа, включая (A) подготовку сеток в лунках для посева, (B) добавление соответствующего количества клеток в каждую лунку, (C) дополнительную трансфекцию клеток для флуоресцентной визуализации и (D) замораживание сеток для витрификации образца. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 2: Котрансфекция U2OS с использованием HIViGFPΔEnv и psPAX2. Клетки U2OS совместно трансфицировали с GFP-содержащими HIViGFPΔEnv и psPAX2 в соотношении 1:3. Сетки визуализировали методами фазово-контрастной и флуоресцентной микроскопии. Клетки, которые имеют экспрессию GFP, указывают на успешную котрансфекцию. Масштабная линейка: 500 мкм. Масштабная линейка (вставки): 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
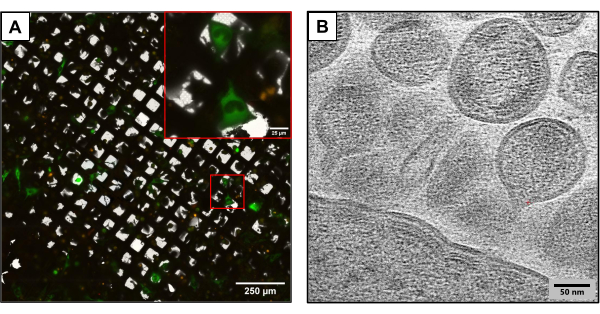
Рисунок 3: Потенциальные последующие криометоды . (A) Изображение cryoCLEM с котрансфицированными клетками U2OS. Клетки, выделенные зеленым цветом, представляют собой ВИЧ-продуцирующие клетки и используются для измерения успешности котрансфекции. Красные пункты обозначают mCherry с меткой ВИЧ-1 Gag. Масштабная линейка: 250 мкм. Масштабная линейка (вставка): 25 мкм (B) КриоЭТ-изображение нескольких частиц ВИЧ, отпочковывающихся от плазматической мембраны клеток U2OS. Масштабная линейка: 50 нм Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Discussion
Здесь мы предоставили доступный, гибкий и воспроизводимый протокол для посева клеток на сетках электронной микроскопии для криоэлектронной томографии in situ . Этот метод может быть легко адаптирован к потребностям последующих применений и/или экспериментальным требованиям. В дополнение к большой гибкости мы описали рабочий процесс, который оптимизирует и уменьшает распространенные ошибки при засеивании сетки, в частности, обширное повреждение углеродного слоя, низкую плотность ячеек и плохую структурную целостность выступов тонких ячеек.
Несмотря на то, что описанный здесь протокол предоставляет несколько альтернатив, есть несколько важных шагов, которые необходимо выполнить для оптимизации общих результатов. Одной из самых больших проблем при засеве ячейками сетки является отделение и всплытие решеток из лунки или микрослайда. Поэтому важно полностью смочить сетку адгезивным раствором с обеих сторон и не допустить ее высыхания в течение инкубационного периода. При использовании напечатанных на 3D-принтере держателей сеток имейте в виду, что многократная смена носителя в этих держателях может привести к образованию плавающих сеток, поскольку воздух, попавший под решетку, может вытолкнуть ее из держателя.
Наш выбор пинцета также улучшает качество сетки, обеспечивая геометрически выгодный способ манипулирования сетками без значительного изгиба сетки, который может повредить углеродный слой. Поддержание клеток при температуре 37 °C в течение как можно более длительного времени перед погружением уменьшает страдания клеток и увеличивает количество тонких визуальных клеток на сетке. Наконец, промокание с золотой стороны защитит клетки от агрессивных механических сил, которые могут привести к повреждению хрупких клеточных структур.
Несмотря на то, что сетка не включена в этот протокол, было показано, что фотомикроструктурирование сетки увеличивает количество визуализируемых ячеек за счет оптимизации их прикрепления к центру квадратов сетки14. Наконец, напечатанные на 3D-принтере держатели сетки недавно стали использоваться для уменьшения повреждения сетки за счет ограничения прямых манипуляций с сеткой12.
Важно отметить, что этот протокол оптимизирован для визуализации тонких краев и выступов клеток для применения криотомографии. Мы предлагаем устранить различные условия из наших рекомендаций в протоколе, чтобы найти наилучший результат для выбранных последующих приложений. В целом, этот протокол обеспечивает надежный, но универсальный метод засева ячеек на сетках, который можно настроить под конкретные нужды.
Disclosures
Авторы заявляют об отсутствии конкурирующих интересов.
Acknowledgements
Благодарим лабораторию «Манский» за доступ к оборудованию для погружной заморозки. Часть этой работы была проведена в центре определения характеристик Университета Миннесоты, который получает частичную поддержку от Национального научного фонда (NSF) через Научно-инженерный центр исследования материалов (MRSEC; Номер гранта DMR-2011401) и Национальная инициатива по учебным программам в области неврологии (NNCI; Номер гранта ECCS-2025124). Мы хотели бы поблагодарить за финансирование Центр «Поведение ВИЧ в вирусной среде» (B-HIVE; 1U54AI170855-01) и Центр структурной биологии ВИЧ Дьюка (DCHSB; U54AI170752) центр.
Materials
| Name | Company | Catalog Number | Comments |
| 10 nm colloidal gold bead solution | Sigma-Aldrich | 741957 | |
| 6 well multidish, 100/CS | Fisher Scientific | FB012927 | |
| Allegra V-15R Benchtop Centrifuge, IVD 120 V 60 Hz | Beckman-Coulter | C63125 | |
| Au G300F1 with R2/2 Quantifoil carbon | Quantifoil | TEM-G300F1-AU | |
| Bovine serum albumin | MilliporeSigma | A9647 | |
| BRAND counting chamber BLAUBRAND Neubauer improved | Sigma-Aldrich | BR717805-1EA | |
| DMi1 Inverted Microscope | Leica | 22A00G119 | |
| Dulbecco's modified eagle's medium - high glucose, no glutamine | Gibco | 11-960-044 | |
| Dumont 5/15 tweezer | Electron Microscopy Sciences | 0103-5/15-PO | |
| EM GP2 | Leica | 587085 | Automated plunge freezer |
| Fetal Bovine Serum | Gibco | A5209 | |
| Fibronectin from bovine plasma, cell culture grade | MilliporeSigma | F1141 | |
| GenJet version II in vitro DNA transfection reagent | SignaGen Laboratories | SL100489 | |
| GlutaMAX I 100x | Fisher Scientific | 35050061 | Media supplement |
| Neslab EX-211 Heating Circulator | Neslab | Out of production | Water bath for media warming |
| Original Portable Pipet-Aid Pipette Controller | Drummond Scientific | 4-000-100 | |
| PBS, pH 7.4 | Gibco | 10010023 | |
| Pelco easyGlow device | Pelco | 91000S | Glow discharge device |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | Media supplement |
| Pipetman P1000, 100–1000 µL, Metal Ejector | Gilson | F144059M | |
| Pipetman P2, 0.2–2 µL, Metal Ejector | Gilson | F144054M | |
| Pipetman P20, 2–20 µL, Metal Ejector | Gilson | F144056M | |
| Whatman number 2 filter paper, 55 mm | Whatman | 28455-041 | Blotting paper |
References
- Zhang, P., Mendonça, L. Analysis of Viruses in the Cellular Context by Electron Tomography. Encyclopedia of Virology. 1, 242-247 (2021).
- Fäßler, F., Dimchev, G., Hodirnau, V. -. V., Wan, W., Schur, F. K. M. Cryo-electron tomography structure of Arp2/3 complex in cells reveals new insights into the branch junction. Nature Communications. 11, 6437 (2020).
- McDowall, A. W., et al. Electron microscopy of frozen hydrated sections of vitreous ice and vitrified biological samples. Journal of Microscopy. 131 (Pt 1), 1-9 (1983).
- Stewart, M., Vigers, G. Electron microscopy of frozen-hydrated biological material. Nature. 319 (6055), 631-636 (1986).
- Gan, L., Jensen, G. J. Electron tomography of cells. Quarterly Reviews of Biophysics. 45 (1), 27-56 (2012).
- Yang, J. E., Larson, M. R., Sibert, B. S., Shrum, S., Wright, E. R. CorRelator: Interactive software for real-time high precision cryo-correlative light and electron microscopy. Journal of Structural Biology. 213 (2), 107709 (2021).
- Mendonça, L., et al. Correlative multi-scale cryo-imaging unveils SARS-CoV-2 assembly and egress. Nature Communications. 12 (1), 4629 (2021).
- Klumpe, S., et al. A modular platform for automated cryo-FIB workflows. eLife. 10, e70506 (2021).
- Wagner, F. R., et al. Preparing samples from whole cells using focused-ion-beam milling for cryo-electron tomography. Nature Protocols. 15 (6), 2041-2070 (2020).
- Klein, S., et al. IFITM3 blocks influenza virus entry by sorting lipids and stabilizing hemifusion. Cell Host & Microbe. 31 (4), 616.e20-633.e20 (2023).
- Shah, P. N. M., et al. Characterization of the rotavirus assembly pathway in situ using cryoelectron tomography. Cell Host & Microbe. 31 (4), 604.e4-615.e4 (2023).
- Fäßler, F., Zens, B., Hauschild, R., Schur, F. K. M. 3D printed cell culture grid holders for improved cellular specimen preparation in cryo-electron microscopy. Journal of Structural Biology. 212 (3), 107633 (2020).
- Hoffmann, P. C., et al. Electron cryo-tomography reveals the subcellular architecture of growing axons in human brain organoids. eLife. 10, e70269 (2021).
- Toro-Nahuelpan, M., et al. Tailoring cryo-electron microscopy grids by photo-micropatterning for in-cell structural studies. Nature Methods. 17 (1), 50-54 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved