Визуализация кальция в электрически стимулированной плоской сетчатке
In This Article
Summary
Протезы сетчатки обладают способностью генерировать зрительное восприятие. Для продвижения разработки новых протезов необходимы методы ex vivo для тестирования устройств перед имплантацией. В данной статье представлен комплексный протокол исследования активности кальция в слое ганглиозных клеток сетчатки при электростимуляции.
Abstract
Дистрофии сетчатки являются основной причиной слепоты во всем мире. В настоящее время предпринимаются обширные усилия по разработке усовершенствованных протезов сетчатки, которые могут обходить поврежденные светочувствительные фоторецепторные клетки в дегенеративной сетчатке, с целью частичного восстановления зрения путем индуцирования зрительных восприятий. Одним из распространенных направлений исследований является разработка и производство имплантируемых устройств с гибкой физической структурой, содержащих большое количество электродов. Это позволяет эффективно и точно генерировать визуальные восприятия. Тем не менее, с каждым технологическим достижением возникает потребность в надежном и управляемом методе ex vivo для проверки функциональности устройства, прежде чем переходить к экспериментам in vivo , где в игру вступают факторы, выходящие за рамки производительности устройства. В данной статье представлен комплексный протокол исследования активности кальция в слое ганглиозных клеток сетчатки (ГКЛ) после электростимуляции. В частности, описаны следующие этапы: (1) флуоресцентная маркировка сетчатки крысы с использованием генетически кодируемых кальциевых индикаторов, (2) захват флуоресцентного сигнала с помощью инвертированного флуоресцентного микроскопа с применением различных паттернов электрической стимуляции и (3) извлечение и анализ следов кальция из отдельных клеток внутри ГКЛ. Следуя этой процедуре, исследователи могут эффективно тестировать новые протоколы стимуляции перед проведением экспериментов in vivo .
Introduction
Сетчатка содержит фоторецепторы, которые являются клетками, отвечающими за восприятие света. Они улавливают фотоны и преобразуют их в нервные импульсы. Затем эти импульсы обрабатываются в сетчатке и передаются в зрительную кору, в результате чего формируется зрительный образ. Пигментный ретинит (РП) и возрастная макулярная дегенерация (ВМД) являются дегенеративными заболеваниями, характеризующимися прогрессирующей потерей фоторецепторов. Эти ретинопатии являются одной из ведущих причин слепоты во всеммире1, затрагивая миллионы людей и имея значительные медицинские, личные и социально-экономические последствия для пациентов, систем здравоохранения и общества в целом. Кроме того, в связи со старением населения прогнозируется, что к 2050 г. число случаев заболевания ВМД увеличится на 15%2.
В настоящее время проводятся многочисленные исследования по восстановлению зрения у пациентов, страдающих этими состояниями3. Одним из перспективных подходов является использование протезов сетчатки, которые продемонстрировали эффективность в частичном восстановлении зрения 4,5. Эти устройства улавливают свет из визуальной сцены и преобразуют его в электрические импульсы. Эти импульсы доставляются через электроды внутри микроэлектродной матрицы (МЭА), имплантированной в глаз, стимулируя выжившие нейроны и обходя функцию потерянных фоторецепторов. Активированные ганглиозные клетки сетчатки (RGC) передают выходные данные в мозг, где они интерпретируются как зрительное восприятие. Однако основные ограничения современных имплантатов заключаются в разрешении интерфейсаэлектрод-ткань 6 и неселективной стимуляции различных типов клеток. Поэтому для оптимизации конструкции новых имплантируемых устройств для более эффективного восстановления зрения крайне важно понять, как можно разработать парадигмы стимуляции для селективной активации клеток в непосредственной близости от электродов.
Визуализация кальция является широко используемым методом изучения нейронной активности, имеющим ряд преимуществ по сравнению с неоптическими методами 7,8. Во-первых, он обеспечивает клеточное и субклеточное разрешение. Во-вторых, кальциевые маркеры могут быть нацелены на определенные типы клеток. В-третьих, это позволяет осуществлять долгосрочное отслеживание, и, в-четвертых, позволяет наблюдать за целыми клеточными популяциями, различая активные и неактивные клетки. Этот метод дает косвенные доказательства клеточной активности с временным разрешением в диапазоне сотен миллисекунд. Генетически кодируемые флуоресцентные индикаторы кальция, такие как датчики GCaMP, претерпевают конформационные изменения при связывании с кальцием, что приводит к увеличению флуоресценции9. Рекомбинантные аденоассоциированные вирусные векторы (ААВ) являются эффективным средством трансдуцирования клеток сетчатки с помощью GCaMP10.
Этот протокол представляет собой эффективный метод, который использует визуализацию кальция для тестирования протоколов стимуляции имплантатов сетчатки. В частности, мы фокусируемся на тканях сетчатки крыс ex vivo и предоставляем подробные пошаговые инструкции, от сбора образцов до анализа данных. Предложив это подробное руководство, исследователи из разных областей могут с уверенностью приступить к экспериментам с электростимуляцией.
Protocol
Все процедуры с животными проводились в соответствии со стандартными этическими нормами для животных (Директива Европейских сообществ 86/609/EU) и одобрены местными комитетами по этике животных. Для настоящего исследования были использованы 8-недельные крысы породы Лонг Эванс. Животные были получены из коммерческого источника (см. Таблицу материалов).
1. Подготовка носителя и плоская монтажная сборка
- Ames' Medium (1 л)
- В стеклянной бутылке объемом 1 л смешайте порошок Ames' Medium, 1,9 г/л NaHCO3, 10 мл пенициллина/стрептомицина 100x и 1 л деионизированной воды (см. таблицу материалов). Отрегулируйте pH до 7,4 и осмолярность до 280 мОсм с помощью деионизированной воды или NaHCO3. Простерилизуйте раствор, процедив его через фильтр с размером пор 0,2 мкм под колпаком.
ПРИМЕЧАНИЕ: Храните стерилизованную среду при температуре 4 °C. Этот раствор остается стабильным и может использоваться до 1 месяца.
- В стеклянной бутылке объемом 1 л смешайте порошок Ames' Medium, 1,9 г/л NaHCO3, 10 мл пенициллина/стрептомицина 100x и 1 л деионизированной воды (см. таблицу материалов). Отрегулируйте pH до 7,4 и осмолярность до 280 мОсм с помощью деионизированной воды или NaHCO3. Простерилизуйте раствор, процедив его через фильтр с размером пор 0,2 мкм под колпаком.
- Монтаж мембран
- Прикрепите одну пористую мембрану из ПТФЭ (см. Таблицу материалов) к шайбе с помощью небольших капель клея. Дайте ему высохнуть не менее 15 минут.
- Для достижения прозрачности погрузите мембраны в 70% этанол на 1 мин.
- Дважды промойте мембраны деионизированной водой, чтобы полностью удалить этанол. Храните их в деионизированной воде, чтобы предотвратить помутнение.
2. Маркировка GCL и плоское крепление сетчатки крысы
ПРИМЕЧАНИЕ: Этот метод мечения не дифференцирует RGC от вытесненных амакриновых клеток. Если требуется селективное мечение RGC, рассмотрите возможность использования AAV с RGC-специфичными промоторами11 и/или ретроградным мечением через зрительный нерв12. Для различения классов ON- и OFF-center RGC классифицируйте RGC на основе их светового отклика13,14 и используйте новые версии генетически кодируемых индикаторов кальция, которые обеспечивают повышенную чувствительность и способность измерять одиночные потенциалы действия15.
- Интравитреальные инъекции
- Обезболивайте 8-недельную крысу Лонга Эванса 2% изофлураном/1%О2 до тех пор, пока педальный рефлекс не исчезнет, и поддерживайте анестезию с помощью носовой маски крысы (см. таблицу материалов).
ПРИМЕЧАНИЕ: Во время анестезии положите животное на грелку, чтобы поддерживать температуру тела. - Введите одну каплю имеющихся в продаже глазных капель (см. таблицу материалов), чтобы расширить зрачок.
- Прежде чем приступить к операции, осмотрите глаз на наличие аномалий с помощью глазного дна и оптической когерентной томографии (ОКТ) с системой визуализации сетчатки in vivo . Нанесите одну каплю Метоцеля 2% для облегчения контакта с роговицей (см. Таблицу материалов).
ПРИМЕЧАНИЕ: При обнаружении каких-либо аномалий не приступайте к дальнейшим действиям для этого глаза. - Применяют одну каплю Прескаина в качестве местного анестетика. Зафиксируйте веко и лимбальную конъюнктиву с помощью имеющейся в продаже шовной нити (см. Таблицу материалов). Создайте склеротомию 1 мм в 4 мм от лимба с помощью иглы 30 G.
- Прикрепите тупую иглу 36 G к прецизионному шприцу и введите частицы AAV, несущие генетически закодированный кальциевый индикатор, в стекловидное тело в течение 30 секунд под углом 45°. В данном исследовании мы использовали AAV2-CAG-GCaMP5G (7,5 x 1011 GC/мл в HBSS) (см. таблицу материалов).
ПРИМЕЧАНИЕ: Конструкции AAV, которые не кодируют потенциально опухолегенные генные продукты или молекулы токсинов и производятся без вируса-помощника, могут обрабатываться на объектах уровня биобезопасности 1 (BSL-1). В противном случае, если он считается биологически опасным материалом в условиях содержания BSL-2, должны быть приняты надлежащие меры предосторожности16. AAV, кодирующие GCaMP, считаются BSL-1 и не требуют манипуляций под шкафами биобезопасности.
- Прикрепите тупую иглу 36 G к прецизионному шприцу и введите частицы AAV, несущие генетически закодированный кальциевый индикатор, в стекловидное тело в течение 30 секунд под углом 45°. В данном исследовании мы использовали AAV2-CAG-GCaMP5G (7,5 x 1011 GC/мл в HBSS) (см. таблицу материалов).
- Применяют одну каплю Тобрадекса (см. Таблицу материалов) для предотвращения воспаления и в качестве антибиотикопрофилактики.
- При желании повторите шаги 2, 3 и 4 с другим глазом.
ПРИМЕЧАНИЕ: Осмотрите животных через 12-24 часа после операции, чтобы убедиться в отсутствии побочных реакций. - Через три дня после инъекции исследуйте структуру сетчатки с помощью фундоскопии и ОКТ с помощью системы визуализации сетчатки in vivo (см. таблицу материалов).
- Через две недели после инъекции ГКЛ должен излучать флуоресценцию. Оценка структуры сетчатки и экспрессии AAV с помощью флуоресцентной фундоскопии с использованием системы визуализации сетчатки in vivo .
ПРИМЕЧАНИЕ: По данным Weitz et al.12, флуоресценция от AAV2-CAG-GCaMP5G становится заметной через 1 неделю после инъекции и усиливается через 2 недели. Начиная с четвертой недели, гиперэкспрессия GCaMP индуцирует цитоморбидность. Умирающие клетки демонстрируют высокий базовый сигнал флуоресценции в ядре и цитоплазме, который не колеблется в ответ на стимуляцию. В здоровых клетках экспрессия GCaMP ограничена цитоплазмой и исключена из ядра 7,8,12,17,18. Эти особенности можно наблюдать ex vivo во время микроскопической визуализации. Окно экспрессии гена может варьироваться в зависимости от вирусного вектора и выбранного промотора.
- Обезболивайте 8-недельную крысу Лонга Эванса 2% изофлураном/1%О2 до тех пор, пока педальный рефлекс не исчезнет, и поддерживайте анестезию с помощью носовой маски крысы (см. таблицу материалов).
- Иссечение сетчатки и плоское крепление
ПРИМЕЧАНИЕ: Через две-три недели после инъекции крыс, получивших интравитреальные инъекции, усыпляют непосредственно перед началом протокола электрофизиологии в соответствии со стандартными этическими рекомендациями (Директива Европейского сообщества 86/609/EU) и одобрены местными этическими комитетами. В качестве метода эвтаназии в этом протоколе используется ингаляция углекислого газа (СО2).- Энуклеация глаз
- Осторожно надавите на внешнюю сторону глазницы с помощью пары изогнутых щипцов, чтобы слегка вытоптать глаз из глазницы.
- Используйте пружинные ножницы, чтобы разрезать мышцы, удерживающие глаз, и энуклеировать его, стараясь не проколоть глазное яблоко.
ПРИМЕЧАНИЕ: Начиная с этого этапа, препарируйте сетчатку под стереомикроскопом в оксигенированной (95% O2 / 5% CO2) среде Эймса.
- Иссечение сетчатки
- Используйте небольшие изогнутые щипцы и тонкие пружинные ножницы, чтобы удалить все окружающие ткани из глазного яблока.
- Возьмите кусок фильтровальной бумаги размером примерно 3 см х 3 см и положите его на крышку посуды диаметром 3,5 см. Смочите бумагу средством Эймса.
- Поместите глазное яблоко поверх бумаги так, чтобы передний сегмент был обращен к оператору. Используйте прямые щипцы, чтобы удерживать глазное яблоко, расположив их поверх ora serrata под углом примерно 45° от поверхности чашки. Сделайте небольшой надрез лезвием, используя пространство между прямыми щипцами в качестве ориентира.
- Возместите глазное яблоко в медиуме Эймса. Используйте прямые щипцы и тонкие пружинные ножницы, чтобы разделить передний и задний сегменты глаза.
- Осторожно извлеките линзу с помощью двух пар прямых щипцов. Затем отделите сетчатку от склеры.
- Разрежьте склеру по направлению к зрительному нерву тонкими пружинными ножницами до тех пор, пока сетчатка не будет изолирована от наглазника.
- Используйте флуоресцентный стереомикроскоп, чтобы определить область сетчатки с наилучшей индикаторной экспрессией кальция.
ПРИМЕЧАНИЕ: Степень распространения вируса зависит от успешности интравитреальной инъекции. Достижение флуоресценции на больших участках сетчатки может потребовать практики. Опыт исследователя играет решающую роль в получении оптимальных результатов. - С помощью пластиковой пипетки с обрезанным наконечником перенесите выбранный кусочек сетчатки на монтажную мембрану (этапы установки мембран). Используйте прямые щипцы, чтобы прикрепить сетчатку плоской поверхностью вверх.
- С помощью пластиковой пипетки, прикрепленной к наконечнику для пипетки на 100 мкл, извлеките носитель, чтобы кусочек сетчатки прилип к пористой мембране. Переверните узел на MEA так, чтобы GCL опирался на электроды.
- Наполните ванну с образцом насыщенной кислородом средой Эймса.
- Энуклеация глаз
3. Визуализация кальция ex vivo при электростимуляции
ПРИМЕЧАНИЕ: В этой работе для экспериментов ex vivo был использован экспериментальный МЭА. Изготовленные на заказ МЭА были изготовлены из пористых электродов на основе графена диаметром 25 мкм на боросиликатном стекле толщиной 500 мкм с следами Ti/Au, а затем изолированы нитридом кремния и фоторезистомSU-8 12. Тем не менее, методы визуализации кальция эффективны независимо от материала электрода, используемого для стимуляции.
- Настройте систему перфузии таким образом, чтобы насыщенная кислородом среда Эймса постоянно перфузирует ванну с образцом при температуре 33 °C при постоянном расходе 5 мл/мин.
- С помощью инвертированного флуоресцентного микроскопа, оснащенного люминесцентной лампой, кубом-фильтром FITC и КМОП-камерой, осмотрите сетчатку на предмет области, где видны стимулирующие электроды и флуоресценция клеток, экспрессирующих GCaMP. Для этого исследования был использован 20-кратный воздушный объектив NA 0.75.
ПРИМЕЧАНИЕ: Для эффективной стимуляции (и регистрации) клеток с помощью электродов сетчатка и электрод должны находиться в тесном контакте. Таким образом, ячейки визуально находятся в той же фокальной плоскости, что и электроды. Если это не так, повторите шаги по удалению сетчатки, начиная с шага 8. При использовании сетчатки на здоровых животных моделях (с функционирующими фоторецепторами) обратите внимание, что каждый раз, когда люминесцентная лампа включается, свет генерирует некоторые вызванные отклики, поскольку сетчатка светочувствительна к длине волны, используемой для возбуждения датчика GCaMP. Эти изменения кальция, вызванные светом, могут быть использованы для оценки состояния здоровья тканей. Чтобы избежать смешивания света с электрическими реакциями, включите люминесцентную лампу не менее чем за 1 минуту до начала получения изображения. - Чтобы вызвать электрические отклики в ГКЛ, выберите электрод для отправки импульсов, управляемых током. Задайте параметры электростимуляции в программном обеспечении генератора импульсов, такие как: форма, амплитуда, длительность, фазовая задержка и частота подаваемых импульсов.
ПРИМЕЧАНИЕ: Эффективные параметры стимула могут варьироваться в широких пределах от длительности импульса от 50 мкс до 100 мс с амплитудами от 0,1 мкА до 10 мкА. Эти параметры, наряду с частотой стимулов, полярностью стимулов, числом импульсов и межфазными задержками, могут влиять на пространственно-временную реакцию, наблюдаемую при визуализации кальция 19,20,21,22. Последовательность из 40 двухфазных импульсов, обеспечивающих стимуляцию 1 мс, 2 мкА, часто вызывает видимый отклик в меченых нейронах. - Чтобы синхронизировать получение изображения с подачей стимуляции, используйте генератор импульсов в качестве внешнего триггера для управления началом получения изображения. Подключите камеру (см. Таблицу материалов) к генератору импульсов с помощью выходного сигнала запуска и установите для параметра «Режим съемки» программного обеспечения фотокамеры значение «Запуск внешнего запуска». Нажмите кнопку Старт в программном обеспечении камеры, чтобы дождаться запуска внешнего триггера. Начните получение изображения с помощью программного обеспечения генератора импульсов.
ПРИМЕЧАНИЕ: Внешний триггер может быть настроен по-разному для разных камер. В этом исследовании обычно получали изображения (512 x 512 пикселей, 16-битные оттенки серого) с частотой 10 кадров в секунду в течение 1 минуты, обеспечивая при этом всплески двухфазных импульсов каждые 10 с. Подача импульса начинается через 10 с, поэтому первые кадры во всех экспериментах соответствуют спонтанной активности. В зависимости от датчика GCaMP и анализа, который он будет выполнять, может потребоваться отрегулировать скорость записи в соответствии со временем нарастания и затухания вашего кальциевого индикатора8. Учитывают чувствительность для обнаружения потенциалов одиночного действия кальциевого индикатора15. - Сохраните изображения с именем файла, содержащим примененные параметры электростимуляции, например [Номер электрода]_[Амплитуда импульса]_[Длительность импульса]_[Частота импульса]_Image001.
4. Анализ данных
- ImageJ/FIJI для извлечения профиля интенсивности флуоресценции во времени и пространственных координат из сом клеток
- Сегментируйте область интереса (ROI) с помощью «Инструментов выбора области» и добавьте ее в Диспетчер ROI (Analyze > Tools > ROI Manager > Add). В меню ROI Manager сохраните его в папке .zip (Дополнительно > Сохранить).
ПРИМЕЧАНИЕ: Как правило, одни и те же ROI могут быть применены ко всем экспериментам по стимуляции, поскольку они соответствуют одному и тому же FOV. - Выберите «Среднее значение серого» в качестве параметра для извлечения (Анализ > Установка измерений).
- Извлеките «Среднее значение серого» из сомы ячейки, нажав кнопку «Еще» > «Мультимера». Появится диалоговое окно. Включите параметры Измерить все 600 срезов и Одна строка на срез , чтобы получить единую таблицу, в которой столбцы соответствуют рентабельности инвестиций, а строки — временным рамкам. Сохраните созданную таблицу в виде .xls электронной таблицы.
- Выберите "Centroid" в качестве параметра для извлечения (Analyze > Set measurements).
- Извлеките «Центроид» из ROI, нажав кнопку Measure. Сгенерированная таблица соответствует координатам (X,Y) ROI. Сохраните его как .xls электронную таблицу.
- Сегментируйте область интереса (ROI) с помощью «Инструментов выбора области» и добавьте ее в Диспетчер ROI (Analyze > Tools > ROI Manager > Add). В меню ROI Manager сохраните его в папке .zip (Дополнительно > Сохранить).
- Специально разработанный сценарий для идентификации клеток, реагирующих на стимулы
ПРИМЕЧАНИЕ: Здесь был использован MATLAB (см. Таблицу материалов), но описанные шаги могут быть выполнены на любом языке программирования. Пользователи могут получить наш пользовательский скрипт, запросив соответствующего автора.- Коррекция эффекта фотообесцвечивания: Чтобы смягчить эффект фона и фотообесцвечивания, возьмите 15-20 кадров из нестимулирующих периодов перед каждой серией и подгоните их к линейной кривой [Подгонка (поли1)].
ПРИМЕЧАНИЕ: В этом случае для 600-кадрового фильма, в котором периодические всплески импульсных последовательностей посылались каждые 10 с, кадры 1:90, 170:190, 270:290, 370:390, 470:490, 570:590 считались нестимулирующими периодами. - Нормализуйте по формуле: (Х-мин) / (макс-мин)
- Идентификация реагирующих клеток
- Вычислите среднеквадратичное значение (RMS) нестимулирующих периодов по нормализованным данным. Это будет считаться базовым сигналом.
- Вычислите максимум стимулирующих периодов (промежутков между нестимулирующими периодами). В этом случае для 600-кадрового фильма, в котором периодические всплески импульсов посылались каждые 10 с, кадры 91:169, 191:269, 291:369, 391:469, 491:569 считались стимулирующими периодами.
- Если максимальное значение превышает базовый сигнал в 2,5 раза для определенного ROI, пометьте ячейку как отвечающую на этот стимулирующий период. Если клетка реагирует на три из пяти стимулирующих периодов, классифицируйте ее как реагирующую клетку.
- Коррекция эффекта фотообесцвечивания: Чтобы смягчить эффект фона и фотообесцвечивания, возьмите 15-20 кадров из нестимулирующих периодов перед каждой серией и подгоните их к линейной кривой [Подгонка (поли1)].
Representative Results
Протокол, описанный в этом исследовании, основан на исследованиях флуоресцентной визуализации и электростимуляции, проведенных Weitz et al.12. Протокол состоит из трех основных частей: (1) флуоресцентное мечение ГКЛ и плоское крепление сетчатки на МЭА (рис. 1-слева), (2) визуализация активности кальция в ГКЛ во время электростимуляции (рис. 1-середина) и (3) извлечение, обработка и интерпретация данных визуализации (рис. 1-справа).
Во-первых, как показано на рисунке 1 слева, крысам Лонга Эванса интравитреально вводят AAV2-CAG-GCaMP5G перед сеансом визуализации. Оптимальная вирусная экспрессия для этого вектора наступает через 2-3 недели после инъекции12,18. После полной анестезии животного с помощью иглы 30 G делается пилотное отверстие, а затем 5 мкл AAV2-CAG-GCaMP5G медленно вводятся в стекловидное тело с помощью тупой иглы 36 G, прикрепленной к точному шприцу, для предотвращения рефлюкса. Во время экспрессии вируса для оценки состояния сетчатки после операции используется система визуализации сетчатки in vivo, при этом ОКТ-изображения обеспечивают детальную визуализацию слоев сетчатки. После того, как экспрессия генов достигнута, сетчатка осторожно извлекается из наглазника с помощью стереомикроскопа и высокоточных инструментов для препарирования. С этого момента ткань обрабатывается в насыщенной кислородом среде, чтобы сохранить образец. Затем иссеченная сетчатка GCL направляется вверх на платформу, предназначенную для плоского монтажа, чтобы обеспечить стабильность и предотвратить всплытие образца. Образец устанавливается на поверхность МЭА ГКЛ лицевой стороной к электродам.
Далее МЭА монтируется на его интерфейсной плате на инвертированном флуоресцентном микроскопе (рис. 1-середина). Образец сетчатки перфузии кислородонасыщенной средой при 33 °C с помощью перфузионной системы. Образец может поддерживаться в такой конфигурации в течение нескольких часов. Запрограммирована нужная схема стимуляции, и изображения получаются со скоростью 10 кадров в секунду. Рекомендуется называть фильмы в соответствии с применяемыми параметрами электростимуляции. Получение изображения должно начинаться до начала стимуляции для получения некоторых базовых кадров без стимуляции, которые будут служить отрицательным контролем.
Наконец, как показано на рисунке 1-справа, данные извлекаются из интервальных изображений путем сегментации сомы клеток. Эффекты фотообесцвечивания корректируются путем подгонки данных, и идентифицируются чувствительные клетки. Чувствительные клетки определяются как те, у которых пики флуоресценции во время стимуляции превышают их исходный уровень в 2,5 раза. Если клетка реагирует на три из пяти всплесков стимуляции, считается, что она реагирует на этот конкретный цикл стимуляции.
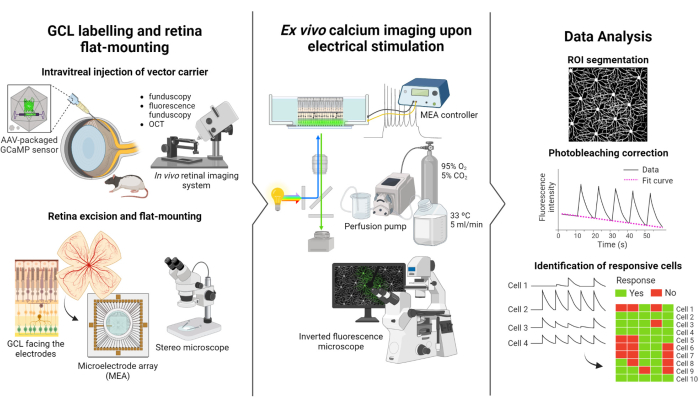
Рисунок 1: Обзор исследования. Схематическое изображение протокола (слева) флуоресцентного мечения GCL сетчатки и установки образца, (в центре) подготовки к записям ex vivo с помощью электрической стимуляции, предоставляемой MEA, и (справа) анализа данных визуализации кальция для классификации чувствительных клеток. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Интравитреал-инъекционная сетчатка
Частота осложнений, связанных с интравитреальными инъекциями, очень низкая. Однако существуют некоторые осложнения, которые могут возникнуть из-за самой операции, независимо от вводимого компонента. К таким осложнениям относятся образование катаракты, кровоизлияние в стекловидное тело, повышение внутриглазного давления и эндофтальмит23. Чтобы определить, вызваны ли эти осложнения хирургическим вмешательством, животное должно пройти обследование перед процедурой с помощью фундускопии и ОКТ. Через три дня после инъекции за животными следует наблюдать. На рисунке 2A-D показана сетчатка здорового животного, которому была сделана инъекция. Через две недели после инъекции RGC начинают проявлять флуоресценцию, которую можно визуализировать с помощью флуоресцентной фундоскопии (рис. 2B, C). ОКТ-изображения обеспечивают детальную визуализацию расположения и толщины слоев сетчатки (рис. 2D), обеспечивая более высокое разрешение по сравнению с глазным дном, особенно при оценке отслойки сетчатки. После того, как сетчатка установлена плоско и визуализирована с помощью инвертированного флуоресцентного микроскопа, становится возможным различить клетки и пучки аксонов. В отличие от других кальциевых индикаторов, индикатор GCaMP ограничен цитоплазмой7, а флуоресценция исключена из ядра (рис. 2E).
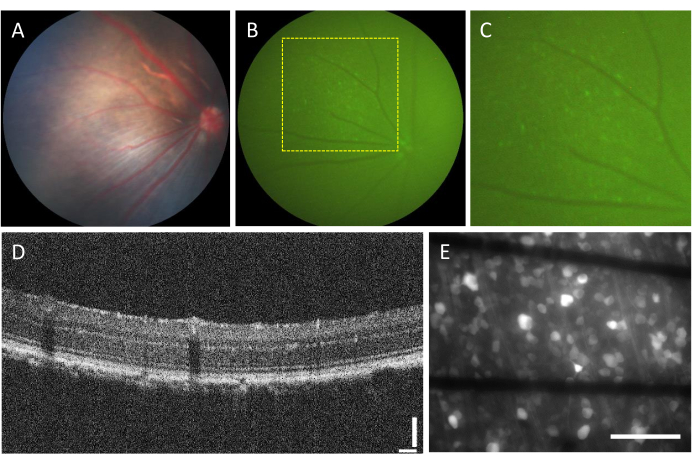
Рисунок 2: Репрезентативные изображения сетчатки с интравитреальными инъекциями. (A) Фундоскопия, (B) флуоресцентная фундоскопия, (C) увеличение флуоресцентного фундоскопа, (D) ОКТ-изображение и (E) эпифлуоресцентное изображение иссеченной сетчатки, установленное на специальном МЭА с помощью электродов на основе графена на боросиликатном стекле толщиной 500 мкм. На рисунке (E) черные линии соответствуют следам Ti/Au. Масштабные линейки: 115 мкм (D) и 100 мкм (E). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Электроды и контакт GCL
Для того, чтобы эффективно вызывать нейронные реакции, крайне важно убедиться, что плоская сетчатка находится в тесном контакте с поверхностью МЭА. Простой способ проверить это — визуально проверить, расположены ли ячейки и электроды в одной и той же фокальной плоскости (рис. 3A). Если клетки не находятся в той же фокальной плоскости, что и электроды (рис. 3B), это указывает на то, что контакт неоптимален, что приведет к менее эффективной стимуляции.
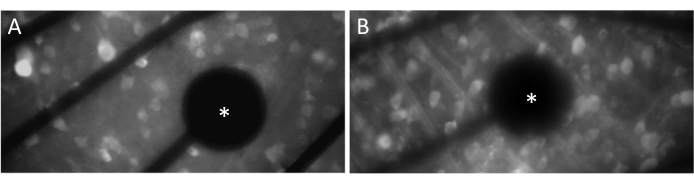
Рисунок 3: Электроды и контакт GCL. (A) Ячейки и электрод (звездочка) в одной фокальной плоскости. (B) Ячейки и электроды не находятся в одной и той же фокальной плоскости, что указывает на неоптимальный контакт для электростимуляции в этой области. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Визуализация кальция ex vivo при электростимуляции, проводимой МЭА
Данные, полученные в результате визуализации кальция, состоят из покадровых изображений, которые отслеживают нейронную активность сотен клеток в ответ на электрическую стимуляцию. Надпороговые раздражители вызывают приток кальция в сомы клеток, что приводит к резкому изменению интенсивности флуоресценции (Видео 1). Этот протокол позволяет определить, вызывает ли электрод, МЭА и/или алгоритм стимуляции желаемую реакцию в нервной ткани. Размер и шаг электродов на МЭА, а также доля исследуемой ткани определяют выбор соответствующего объективного увеличения. Как правило, для исследований с помощью одноэлектродной стимуляции диаметром от 5 мкм до 100 мкм подходит 20-25-кратное увеличение объектива (рис. 4A), обеспечивающее угол обзора примерно 600 мкм x 600 мкм. Для экспериментов, включающих стимуляцию несколькими электродами, может потребоваться 4-10-кратное увеличение объектива для оценки более широкой области примерно 2 мм x 2 мм. Чувствительные ячейки можно легко идентифицировать, создав проекцию изображения со стандартным отклонением интервального видеоролика (рис. 4B и видео 1).
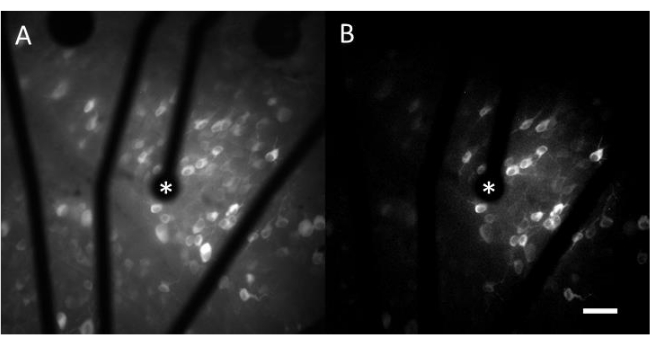
Рисунок 4: Кальциевая визуализация ГКЛ с помощью электрода, обеспечиваемого электродом диаметром 25 мкм. (A) Максимальная проекция покадрового видеоролика продолжительностью 60 с и (B) проекция стандартного отклонения, четко отображающая клетки, реагирующие на электрические стимулы от пористого электрода на основе графена диаметром 25 мкм. Стимулирующий электрод обозначен звездочкой. Масштабная линейка: 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Анализ динамики кальция во времени при контролируемой стимуляции
Для каждой идентифицированной клеточной сомы были извлечены средние значения интенсивности с течением времени. На рисунке 5А показаны скорректированные после фотообесцвечивания следы кальция из чувствительных клеток. В этом примере пять серий двухфазных импульсов (катодные, 40 циклов, длительность 1 мс, амплитуда 2 мкА) подавались каждые 10 с (обозначены черными линиями) во время получения изображения в течение 60 секунд. В рамках данного эксперимента применяются одни и те же пять последовательностей импульсов для проверки согласованности отклика. Кадры, снятые в нестимулирующие периоды (выделены красным цветом), используются для линейной подгонки с поправкой на эффект фотообесцвечивания.
После того, как реагирующие клетки идентифицированы и известны их координаты (x,y) относительно стимулирующего электрода, можно исследовать соотношение между током, необходимым для активации клеток, и расстоянием от стимулирующего электрода (рис. 5B). Как и ожидалось, ячейки, расположенные ближе к стимулирующему электроду, требуют более низких значений тока, чтобы вызвать ответную реакцию.
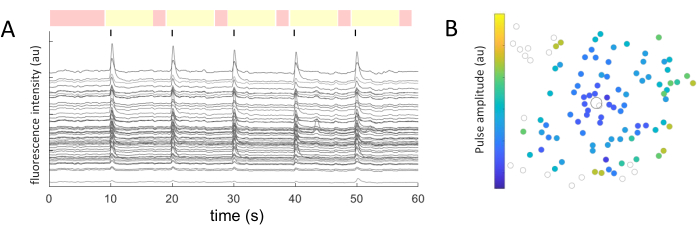
Рисунок 5: Представление электрически вызванных откликов. (A) Кальциевые следы клеточных сом при 5 сериях импульсов (двухфазных, катодных, 40 циклов, длительность 1 мс, амплитуда 2 мкА) каждые 10 с (черные линии) во время получения изображения в течение 60 секунд. Показаны нестимулирующие (красные кадры) и стимулирующие периоды (желтые рамки). Трассы, превышающие исходный сигнал (среднеквадратичное значение нестимулирующих периодов) в 2,5 раза, считаются вызванными откликами. Клетки, реагирующие в трех из пяти стимулирующих периодов, классифицируются как реагирующие клетки. (B) Карта распределения активности кальция с изображением стимулирующего электрода (черный обведенный круг) и ячеек (серый обведенный круг). Цветовой код представляет собой минимальную амплитуду импульса, необходимую для вызова клеточного ответа. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Видео 1: Кальциевая визуализация ГКЛ с помощью электростимуляции, обеспечиваемой электродом диаметром 25 мкм. На видео показаны различия в интенсивности флуоресценции из-за электрической стимуляции от пористого электрода на основе графена диаметром 25 мкм. В левой части показан исходный фильм, а в правой — проекция стандартного отклонения, в которой можно легко идентифицировать отвечающие ячейки. Масштабная линейка: 50 мкм. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Discussion
Описанный здесь протокол служит для изучения динамики кальция, происходящей в ГКЛ сетчатки крысы при электростимуляции с помощью МЭА. Это надежный и управляемый метод, но он требует некоторой подготовки, в частности, для равномерной эффективной маркировки GCL и правильной установки сетчатки для обеспечения оптимального контакта ткани с электродом. Этот протокол специфичен для грызунов и должен быть адаптирован при применении к другим лабораторным видам. Подробно представлены критические моменты, модификации и ограничения методологии.
Интравитреальные инъекции
Инъекции широко используются для доставки глазных генов, при этом интравитреальные инъекции являются предпочтительной процедурой. Было доказано, что они более безопасны и менее инвазивны по сравнению с субретинальными инъекциями, которые вводят интересующие молекулы непосредственно между фоторецепторами и пигментным эпителием сетчатки (РПЭ), рискуя отслойкой сетчатки10. Однако существуют ограничения, особенно при выполнении этих инъекций на моделях грызунов. Стекловидное тело желеобразное, препятствующее распространению вируса. Более того, хрусталик в глазах грызунов большой, что делает нетривиальным введение иглы, не поцарапав ее. Иглы прецизионных шприцев чувствительны и нуждаются в частой замене. Чтобы предотвратить засорение, мойте их деионизированной водой до и после каждого использования и регулярно заменяйте. Кроме того, вводите содержимое медленно, чтобы предотвратить рефлюкс раствора и изменения внутриглазного давления. Для достижения большой и равномерной флуоресценции по всей сетчатке может потребоваться практика.
Трансдукция клеток сетчатки
Вирусные векторы являются отличным методом доставки генов in vivo, а AAV широко используются для трансдукции клеток сетчатки10. Они были одобрены в качестве лечения некоторых ретинопатий, вызывающих слепоту человека24. Однако их несущая емкость ограничена 5 кб, включая необходимые регулирующие элементы (например, промоутер)10,25. Существует несколько серотипов, каждый из которых обладает различным тропизмом. Выберите наиболее подходящий AAV в зависимости от генов, которые необходимо доставить, и клеток, которые необходимо трансдуцировать26. Для маркировки RGC рекомендуется использовать AAV227.
Окно экспрессии генов
Оптимальная вирусная экспрессия для AAV2-CAG-GCaMP5G составляет 2-3 недели после инъекции12,18. По истечении этого времени ядра трансфицированных клеток становятся флуоресцентными, клетки перестают реагировать на стимулы и, в конечном счете, погибают. Это связано с гиперэкспрессией индикатора GCaMP, который транслоцируется в ядро. Временное окно для оптимальной экспрессии гена будет варьироваться в зависимости от вирусного вектора и выбранного промотора30 и должно быть определено экспериментально, прежде чем приступить к этому протоколу.
Тканево-электродный контакт
Для достижения оптимальных и воспроизводимых результатов решающее значение имеет достижение хорошего контакта между тканью и электродом. Плохой контакт, как правило, обусловлен естественной кривизной сетчатки. Один из подходов заключается в том, чтобы разрезать сетчатку на четвертинки, смонтировать и сделать снимок по одному участку за раз. Небольшие участки сетчатки могут быть лучше уплощены, что приводит к более эффективному контакту с поверхностью МЭА. Еще одной потенциальной причиной плохого контакта является наличие стекловидного тела. При проведении экспериментов по стимуляции, имитирующей эпиретинальный имплантат, важно осторожно удалить стекловидное тело во время иссечения сетчатки, так как оно может действовать как изолятор для тока. Здесь описан простой метод проверки достаточности контакта путем визуализации электрода и ячеек в одной фокальной плоскости.
Альтернативой измерениям на сетчатке ex vivo является выращивание нейронов непосредственно на поверхности электродов. Первичная культура нейронов, таких как нейроны гиппокампа31, может быть полезна для первоначальных тестов для оценки функциональности нового стимулирующего устройства. Однако этот подход по-прежнему требует использования лабораторных животных и не отражает сложность сети сетчатки, которая важна для оценки синаптических реакций на стимуляцию.
Для визуализации ячеек под электродом и электродных дорожек можно использовать МЭА, изготовленные из прозрачных материалов, таких как оксид индия-олова (ИТО) 19,20,32. В дополнение к оптическим измерениям, активность GCL при электростимуляции может быть оценена с помощью электрических записей. МЭА может быть использован для регистрации потенциала локального поля (LFP) ткани. Однако это ставит под угрозу пространственное разрешение, так как каждый электрод захватывает активность нескольких ячеек одновременно (в зависимости от размеров электрода). Оптическая запись преодолевает это ограничение и обеспечивает картографирование с более высоким пространственным разрешением. Его основным преимуществом является способность различать активные и неактивные ячейки при измерении большого поля зрения с разрешением одной ячейки. Среди всех исследователей клеточной активности индикаторы кальция хорошо описаны и наиболее часто используются33.
Disclosures
Авторы не имеют никаких разглашений, которые могли бы добавить к рукописи.
Acknowledgements
Мы благодарны Мерше Ривасу, Анхелю Сандовалю, Хесусу Планагуме, Жорди Кортесу, Сандре Ортонобес Лара и Алине Хиршманн (ICFO-Institut de Ciències Fotòniques) за их техническую поддержку, Анне Дуарри (VHIR, Научно-исследовательский институт Валь д'Эброн) из исследовательской группы офтальмологии за их поддержку в интравитреальных инъекциях и визуализации сетчатки in vivo .
Финансирующие организации, которые поддержали эту работу: Fundació CELLEX; Fundació Mir-Puig; Ministerio de Economía y Competitividad - Программа Северо Очоа для центров передового опыта в области НИОКР (CEX2019-000910-S, [MCIN/AEI/10.13039/501100011033]); Женералитат Каталонии по программе CERCA; Laserlab-Europe (EU-H2020 GA No 871124); Фонд La Caixa (LCF/HR19/52160003); и Fondo Social Europeo (PRE2020-095721, M.C.).
Materials
| Name | Company | Catalog Number | Comments |
| 20x NA 0.75 S Fluor air objective | Nikon | CFI Super Fluor 20X | - |
| 3.5 cm Cell culture dish | Nunc | 12-565-90 | - |
| 30 G needle | VWR | 613-5373 | - |
| 36 G blunt needle | World Precision Instruments | NF36BL-2 | - |
| 6 cm Cell culture dish | Nunc | 12-565-94 | - |
| AAV2-CAG-GCaMP5G | Vector Biolabs | - | - |
| Ames' Medium | Sigma Aldrich | A1420 | - |
| Blade | Swann-morton | 0308 | - |
| Camera | Hamamatsu | ORCA Flash v4.0 | - |
| Carbogen | Air liquide | - | - |
| Curved-forceps | - | - | - |
| Fine spring-scissors | FST | 91501-09 | - |
| FITC filter cube | Nikon | Standard series | - |
| Fluorescent lamp | Nikon | C-HGFI | - |
| Fluorescent stereomicroscope | Nikon | SMZ25 | - |
| HBSS | Capricorn | HBSS-1A | - |
| ImageJ/FIJI | NIH | v1.50i | - |
| In vivo retinal imaging system | Phoenix Research Laboratories | Micron III | - |
| Inverted fluorescence microscope | Nikon | Eclipse Ti | - |
| Isofluorane | Arrane Baxter Laboratories | - | - |
| Long-Evans rat | Janvier | - | - |
| MATLAB (Version R2021b) | Mathworks | - | - |
| Media filters | Merckmillipore | SCGPS02RE | - |
| Methocel 2% | Omni Vision | - | - |
| Microelectrode array (MEA) | - | Custom-made | |
| NaHCO3 | Thermofisher | 42427 | - |
| Penicillin/Streptomycin 100x | Thermofisher | 15140122 | - |
| Phenylephrine | Alcon Cusí Laboratories | 653437.3 | 100 mg/mL |
| Plastic pipette | VWR | 612-1793 | - |
| Porous membrane | Merckmillipore | #JVWP01300 | - |
| Precision syringe | World Precision Instruments | 10 µl Nanofil | - |
| Prescaina | Llorens | - | Oxybuprocaine chlorhydrate (2 mg/mL), local anesthetic |
| Rat nasal mask | Xenotec | XRK-RA | - |
| Small curved-forceps | Bbraun | AESCBD311R | - |
| Spring-scissors | FST | 15040-11 | - |
| Stereo microscope | Zeiss | Stemi 2000 | - |
| Straight forceps | FST | 11252-20 | - |
| Suture filament | Vitrex Medical | 4328 | Nilon monofilament, 7/0, DS12 |
| Tobradex | Alcon Cusí Laboratories | - | Tobramycin (3 mg/mL) and dexamethasone (1 mg/mL) |
| Tropicamide | Alcon Cusí Laboratories | 653486 | 10 mg/mL |
| Washer | Thorlabs | W8S038 | - |
References
- Bourne, R. R. A., et al. Prevalence and causes of vision loss in high-income countries and in Eastern and Central Europe in 2015: Magnitude, temporal trends and projections. British Journal of Ophthalmology. 102 (5), 575-585 (2018).
- Li, J. Q., et al. Prevalence and incidence of age-related macular degeneration in Europe: a systematic review and meta-analysis. British Journal of Ophthalmology. 104 (8), 1077-1084 (2020).
- Roska, B., Sahel, J. A. Restoring vision. Nature. 557 (7705), 359-367 (2018).
- Hornig, R., Velikay-Parel, M. Retina implants. Implantable Sensor Systems for Medical Applications. , 469-496 (2013).
- Lewis, P. M., et al. Advances in implantable bionic devices for blindness: a review. ANZ Journal of Surgery. 86 (9), 654-659 (2016).
- Weiland, J. D., Walston, S. T., Humayun, M. S. Electrical stimulation of the retina to produce artificial vision. Annual Review of Vision Science. 2, 273-294 (2016).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6, 875-881 (2009).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499, 295-300 (2013).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca2+ probe composed of a single green fluorescent protein. Nature Biotechnology. 19, 137-141 (2001).
- Sahu, B., Chug, I., Khanna, H. The ocular gene delivery landscape. Biomolecules. 11 (8), 1135 (2021).
- Hanlon, K. S., et al. A novel retinal ganglion cell promoter for utility in AAV vectors. Frontiers in Neuroscience. 11, (2017).
- Weitz, A. C., et al. Imaging the response of the retina to electrical stimulation with genetically encoded calcium indicators. Journal of Neurophysiology. 9 (7), 1979-1988 (2013).
- Briggman, K. L., Euler, T. Bulk electroporation and population calcium imaging in the adult mammalian retina. Journal of Neurophysiology. 105 (5), 2601-2609 (2011).
- Baden, T., Berens, P., Franke, K., Román Rosón, M., Euler, T. The functional diversity of retinal ganglion cells in the mouse. Nature. 529, 345-350 (2016).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615, 884-891 (2023).
- Meyer, E. L., Jenkins, C., Rengarajan, K. NIH Guidelines April 2019. Applied Biosafety. 24, (2019).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chang, Y. -. C., Walston, S. T., Chow, R. H., Weiland, J. D. GCaMP expression in retinal ganglion cells characterized using a low-cost fundus imaging system. Journal of Neural Engineering. 14 (5), 056018 (2017).
- Weitz, A. C., et al. Improving the spatial resolution of epiretinal implants by increasing stimulus pulse duration. Science Translational Medicine. 7 (318), 1-12 (2015).
- Chang, Y. C., Ghaffari, D. H., Chow, R. H., Weiland, J. D. Stimulation strategies for selective activation of retinal ganglion cell soma and threshold reduction. Journal of Neural Engineering. 16 (2), 026017 (2019).
- Im, M., Fried, S. I. Temporal properties of network-mediated responses to repetitive stimuli are dependent upon retinal ganglion cell type. Journal of Neural Engineering. 13 (2), 025002 (2016).
- Jensen, R. J., Ziv, O. R., Rizzo, J. F. Thresholds for activation of rabbit retinal ganglion cells with relatively large, extracellular microelectrodes. Investigative Ophthalmology & Visual Science. 46 (4), 1486-1496 (2005).
- Ramos, M. S., et al. Patient-reported complications after intravitreal injection and their predictive factors. Ophthalmology Retina. 5 (7), 625-632 (2021).
- Vandenberghe, L. H., Auricchio, A. Novel adeno-associated viral vectors for retinal gene therapy. Gene Therapy. 19 (2), 162-168 (2012).
- Zin, E. A., Ozturk, B. E., Dalkara, D., Byrne, L. C. Developing new vectors for retinal gene therapy. Cold Spring Harbor Perspectives in Medicine. , a041291 (2023).
- Haggerty, D. L., Grecco, G. G., Reeves, K. C., Atwood, B. Adeno-associated viral vectors in neuroscience research. Molecular Therapy-Methods & Clinical Development. 17, 69-82 (2020).
- Hellström, M., et al. Cellular tropism and transduction properties of seven adeno-associated viral vector serotypes in adult retina after intravitreal injection. Gene Therapy. 16 (4), 521-532 (2009).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nature Protocols. 11, 566-597 (2016).
- Yang, Y., et al. Improved calcium sensor GCaMP-X overcomes the calcium channel perturbations induced by the calmodulin in GCaMP. Nature Communications. 9, 1504 (2018).
- Nieuwenhuis, B., et al. Improving adeno-associated viral (AAV) vector-mediated transgene expression in retinal ganglion cells: comparison of five promoters. Gene Therapy. 30, 503-519 (2023).
- Cunquero, M., Aguilar, E., Loza-Alvarez, P., Planagumà, J. Hippocampal neuronal cultures to detect and study new pathogenic antibodies involved in autoimmune encephalitis. Journal of Visualized Experiments. 184, e63829 (2022).
- Behrend, M. R., Ahuja, A. K., Humayun, M. S., Chow, R. H., Weiland, J. D. Resolution of the epiretinal prosthesis is not limited by electrode size. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 19 (4), 436-442 (2011).
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved