Estudando a Dinâmica Transcricional Muscular em Escalas de Molécula Única em Drosophila
In This Article
Summary
Drosophila é um modelo bem estabelecido para estudar moléculas-chave que regulam a miogênese. No entanto, os métodos atuais são insuficientes para determinar a dinâmica transcricional do RNAm e a distribuição espacial dentro dos sincícios. Para resolver essa limitação, otimizamos um método de hibridização in situ por fluorescência de RNA, permitindo a detecção e quantificação de mRNAs em escala de molécula única.
Abstract
Os músculos esqueléticos são grandes sincícios formados por muitas miofibras agrupadas que produzem forças e permitem o movimento do corpo. Drosophila é um modelo clássico para estudar a biologia muscular. A combinação da genética de Drosophila e abordagens ômicas avançadas levou à identificação de moléculas conservadas chave que regulam a morfogênese e regeneração muscular. Entretanto, a dinâmica transcricional dessas moléculas e a distribuição espacial de seu RNA mensageiro dentro dos sincícios não podem ser avaliadas por métodos convencionais. Aqui, otimizamos um método existente de hibridização in situ de fluorescência de RNA de molécula única (smFISH) para permitir a detecção e quantificação de moléculas individuais de mRNA dentro de músculos de voo adultos e suas células-tronco musculares. Como prova de conceito, analisamos a expressão e distribuição de RNAm de dois fatores de transcrição conservados evolutivamente, Mef2 e Zfh1/Zeb. Mostramos que este método pode detectar e quantificar eficientemente moléculas de RNAm individuais para ambos os transcritos nas células precursoras musculares, músculos adultos e células-tronco musculares.
Introduction
Os músculos esqueléticos adultos são constituídos por miofibras multinucleadas diferenciadas cujas propriedades contráteis geram movimentos. O crescimento, a manutenção e a regeneração muscular dependem de progenitores musculares e células-tronco musculares (MuSCs) que são especificadas durante o desenvolvimento embrionário1. O programa miogênico é finamente controlado por um conjunto de fatores de transcrição miogênicos (FTs) centrais (por exemplo, Pax3/7, MYOD, Mef2 e ZEB)2,3,4. Decifrar os mecanismos moleculares que regulam a biologia muscular é importante para elucidar questões fundamentais relacionadas à miologia e para possível uso terapêutico no tratamento de doenças músculo-degenerativas.
A drosófila tem uma longa história como modelo genético para o estudo da miogênese5. Recentemente, surgiu como um novo modelo para investigar a regeneraçãomuscular6,7,8. A estrutura muscular e os programas miogênicos centrais são altamente conservados entre moscas e mamíferos. Por exemplo, os FTs Mef2 e Zfh1/ZEB têm função conservada na regulação do desenvolvimento e regeneração muscular 3,9,10,11. Os músculos adultos de Drosophila, como os Músculos de Voo Indireto (MIFs), são formados a partir de uma população específica de MuSCs, conhecidos como Progenitores Musculares Adultos (AMPs)12. Esses AMPs são especificados durante a embriogênese e se associam a estruturas epiteliais como discos de asa e perna. Ao longo dos estágios embrionário e larval, os AMPs permanecem indiferenciados até a metamorfose, quando se envolvem em diferenciação e fusão para formar as MIFs13,14. O TF Spalt major (spalt, salm) é expresso durante o desenvolvimento muscular de voo e é necessário para determinar sua identidade estrutural15. O Mef2 é outro importante FT miogênico essencial para a formação muscular do adulto16,17. É expressa nos AMPs e mantida nos MIFs adultos10,18. Enquanto a maioria dos AMPs se diferencia em músculos funcionais, um subgrupo escapa à diferenciação e forma os MuSCs adultos11. Assim como os vertebrados, o TF Zfh1/ZEB é necessário para prevenir a diferenciação prematura das MuSCs adultas e manter sua caule 9,10.
A dinâmica da expressão gênica tem sido comprovada por regular vários processos biológicos musculares19,20. O advento de técnicas de sequenciamento de RNA unicelular e de núcleo único de alto rendimento permitiu uma exploração abrangente dessas dinâmicas transcricionais21,22. Uma limitação notável dessas abordagens é sua incapacidade de fornecer a distribuição espacial de moléculas de RNAm nas fibras musculares multinucleadas. Essas características podem ser investigadas por hibridização in situ de fluorescência de molécula única (smFISH) que revela dois tipos de corpos de mRNA: 1. Moléculas individuais de mRNA espalhadas no citoplasma e representando o RNA maduro e 2. Um máximo de dois focos nucleares brilhantes correspondem ao transcrito nascente e revelam os alelos transcricionalmente ativos23. Portanto, o smFISH é um método de escolha para quantificação de moléculas individuais de RNAm, investigando sua distribuição espacial e fornecendo instantâneos da dinâmica transcricional do gene.
O método smFISH baseia-se em um conjunto de sondas curtas de oligonucleotídeos fluorescentes especificamente projetadas para serem complementares ao transcrito alvo. Após o recozimento, gera fontes pontuais de alta intensidade, permitindo a detecção de RNAm em nível de molécula única por microscopiaconfocal24. Este método é cada vez mais aplicado para uma grande variedade de tipos celulares, incluindo tecidos musculares de mamíferos19,20. No entanto, em Drosophila, como em outros modelos animais, a maior parte do conhecimento sobre a expressão gênica muscular adulta é derivada de ensaios moleculares em massa, que carecem de informações quantitativas sobre a localização espacial das moléculas de RNAm. Aqui otimizamos um método para a realização de SMFISH em células precursoras musculares e músculos adultos de Drosophila 23,25. Este protocolo inclui um pipeline de análise totalmente automatizado para segmentação de núcleos e contagem e localização de mRNA.
Protocol
1. Dissecção e preparação do disco da asa e do músculo adulto
OBS: Limpar a bancada de dissecção e todos os instrumentos de dissecção com solução inibidora de RNAse (Tabela de Materiais). Luvas de laboratório devem ser usadas durante todo o procedimento experimental.
- Disco de asa
- Colocar as larvas em L3 em solução salina fria 1x tamponada com fosfato (PBS) (Figura 1A).
- Enxágue as larvas 3x com 1x PBS e mantenha-as nesta solução por 5 min.
- Usando dois pares de pinças afiadas, segure a larva da parte anterior e puxe e descarte o restante dos tecidos do corpo (em torno de 2/3).
- Segure o primeiro 1/3 da larva com um par de pinças e os ganchos de boca com o outro par. Retraia os ganchos da boca dentro da larva até que ela esteja totalmente invertida.
OBS: Dissecar aproximadamente 30 larvas por experimento, para garantir tamanho de amostra adequado para análise. - Observe que os discos alares estão intimamente associados com os dois ramos primários das traqueias, que correm ao longo de cada lado da larva.
- Remova todos os outros componentes larvais (discos da perna e cérebro) para obter uma carcaça de larva invertida limpa com um par de discos alares presos à traqueia (Figura 1B).
- Colocar as amostras em um tubo centrífugo de 1 mL e fixá-las em paraformaldeído (PFA) a 4% diluído em PBS 1x por 45 min à temperatura ambiente sob agitação.
NOTA: A agitação da amostra é obtida por um agitador oscilante (Tabela de Materiais). - Lavar as amostras 3 x 5 min com etanol a 70% (EtOH, diluído em água sem RNAse) e armazená-las na mesma solução de lavagem a 4 °C durante, pelo menos, 2 dias e até 1 semana.
- Músculos de voo indireto
- Anestesiar as moscas adultas em uma almofada de mosca CO2 e remover as cabeças, abdômen, pernas e asas.
- Colocar os tórax dissecados em PBS 1x frio e continuar assim até que todas as amostras sejam dissecadas (Figura 1D).
- Prefixar os tórax em PFA a 4%, (Tritão 1%) por 20 min à temperatura ambiente sob agitação.
- Enxaguar as amostras 3 x 5 min com 1x solução de lavagem PBT (1% Triton em 1x PBS).
- Posicionar os tórax sobre uma fita dupla face (Tabela de Materiais) sobre uma lâmina de vidro e bissetrizá-los com uma lâmina de micrótomo afiado para produzir dois hemitórax (Figura 1E,F).
- Fixar as amostras em PFA a 4% (Triton a 1%) durante 45 minutos à temperatura ambiente sob agitação.
- Lavar 2 x 20 min com 1x solução de lavagem PBT (1% Triton, 1x PBS) à temperatura ambiente sob agitação.
- Coloque os hemitórax em PBS 1x frio e use a pinça para isolar suavemente os MIFs do hemitórax (Figura 1G).
OBS: Para conseguir isso, é importante remover a cutícula o mais completamente possível. - Para permeabilizar as amostras, armazenar os IFMs isolados em solução de EtOH a 70% por pelo menos 2 dias e até 1 semana a 4 °C.
NOTA: Isolar os IFMs de aproximadamente 10 tórax por experimento para garantir o tamanho adequado da amostra para análise.
2. Hibridização, imunomarcação e montagem
NOTA: Procedimento de hibridização semelhante é aplicado para ambos os discos de asa e amostras de IFMs. É fundamental isolar os discos alares das carcaças das larvas e colocá-los em 200 μL de Buffer A antes de iniciar a hibridização.
- Ressuspender as sondas em 400 μL de tampão TE (Tris-HCl 10 mM, EDTA 1 mM, pH 8,0) para uma solução estoque final de 12,5 μM.
- Transferir as amostras para um tubo centrífugo de 0,5 mL contendo o tampão A (Tabela de Materiais).
OBS: Ao diminuir o volume do recipiente, fica mais fácil visualizar as amostras e evitar perdê-las durante o processo de lavagem. - Lave as amostras 2 x 20 min com Buffer A.
- Aspirar o tampão A, substituí-lo por 400 μL do tampão de hibridização (Tabela de Materiais) e pré-hibridizar as amostras por 30 min a 37 °C em misturador térmico (Tabela de Materiais).
- Diluir as sondas até uma concentração final de 125 nM para discos alares e 200 nM para músculos adultos, no tampão de hibridização e adicionar o anticorpo primário.
NOTA: A diluição do anticorpo varia dependendo do anticorpo específico que está sendo usado (Tabela de Materiais). A adição de anticorpos é opcional. Os usuários podem optar por renunciar à coloração de proteína e, em vez disso, usar um protocolo smFISH semelhante que não inclui a adição de anticorpos. - Aspirar o tampão de hibridização e substituí-lo por 100 μL de tampão de hibridização contendo a sonda e o anticorpo.
- Incubar as amostras no escuro a 37 °C durante, pelo menos, 16 h sob agitação de 300 rpm num misturador térmico.
- Aquecer uma alíquota do tampão A a 37 °C.
- Lavar as amostras durante 3 x 10 minutos no misturador térmico a 37 °C sob agitação de 300 rpm.
- Durante a última lavagem, diluir o anticorpo secundário (1/200) e o DAPI (1/10.000) no tampão A e incubar as amostras nesta solução a 37 °C durante, pelo menos, 1 h.
- Lave as amostras por 3 x 20 min com Buffer B (Tabela de Materiais).
- Transfira cuidadosamente as amostras em uma lâmina de microscópio, limpe o Buffer B residual e adicione 30 μL de meio de montagem e cubra com uma lamínula de 18 x 18 mm. Use um esmalte para selar a preparação.
- Conservar as amostras até 1 semana a 4 °C.
NOTA: No entanto, recomenda-se realizar a imagem o mais rápido possível para evitar a degradação do sinal da sonda.
3. Exames por imagem
- Adquira imagens com um modo de aquisição xyz usando um microscópio confocal equipado com objetivas de imersão em óleo de 40x e 63x (Tabela de Materiais). O sinal smFISH é detectado pelo detector HyD através de um modo de contagem de fótons.
- Localize as amostras usando o sinal DAPI e a lâmpada UV.
- Para obter imagens dos progenitores musculares associados ao disco asal e IFMs (Figura 2 e Figura 3), aplique a seguinte configuração para linhas de laser e filtros de emissão: selecione DAPI (excitação (ex.) 405 nm, emissão (em.) 450 nm), Alexa Fluor 488 (ex. 496 nm, em. 519 nm) e Quasar 670 para as sondas smFISH (ex. 647 nm, em. 670 nm).
- Para obter imagens dos MuSCs adultos (Figura 2D), aplique a seguinte configuração para linhas de laser e filtros de emissão: selecione DAPI (ex. 405 nm, em. 450 nm), Alexa Fluor 488 (ex. 496 nm, em. 519 nm), Alexa Fluor 555 (ex. 555 nm, em. 565 nm) e Quasar 670 para as sondas smFISH (ex. 647 nm, em. 670 nm).
NOTA: Para a imagem, os comprimentos de onda podem ser adaptados de acordo com os corantes associados com anticorpos secundários e sondas. - Salve as imagens confocais como . Arquivos TIFF.
4. Análise pós-imagem
- Para começar, inicie o ImageJ e navegue até o menu Plug-ins . A partir daí, selecione Macros | Edite para abrir o código-fonte das macros.
Observação : isso permitirá o ajuste dos parâmetros conforme necessário e, se necessário, modificar o diretório de pasta para cada canal dentro do código-fonte da macro. - Para seguir este protocolo e quantificar os pontos de Mef2 smFISH em larvas, use as seguintes configurações: Log_radius = 3,0 e Log_quality = 20,0. Núcleos Segement Mef2-positivos com borrão = 2; nucleus_scale_parameter = 30; nucleus_threshold = -8,0; nucleus_size = 300.
- Nas fibras musculares, utilizar os seguintes parâmetros: Log_radius = 2,5; Log_quality = 60,0; borrão = 2; nucleus_scale_parameter = 100; nucleus_threshold = 0,0; nucleus_size = 300.
- Para iniciar a macro, basta executar o comando run e aguardar que a macro carregue automaticamente todas as imagens da pasta designada e quantifique-as de forma sequencial.
NOTA: Observe que a duração desse processo pode variar de alguns segundos a várias horas, dependendo do volume de dados que está sendo analisado. - Procure os resultados exibidos em dois novos arquivos .csv: file_FISH_results e file_nuclei_results. A primeira mostra o número de pontos transcricionais e suas intensidades média e máxima. O segundo fornece tanto o número total de núcleos quanto o número de pontos dentro de cada núcleo.
Representative Results
Neste protocolo, foram utilizadas sondas produzidas comercialmente visando o mRNA de Mef2 e zfh1 . Projetamos as sondas com o projetista de sondas FISH do fabricante (Tabela de Materiais). O conjunto Mef2 tem como alvo os éxons comuns a todas as isoformas de RNA Mef2 (do éxon 3 ao éxon 10). O conjunto zfh1 tem como alvo o terceiro exon comum às isoformas zfh1-RB e zfh1-RE 10. Ambas as sondas são conjugadas ao corante fluorescente Quasar 670.
Geramos internamente uma macro compatível com o software ImageJ para analisar automaticamente os dados brutos .tif. A macro permite a segmentação 3D dos núcleos pelo Cellpose26 com o plugin Fiji BIOP e a quantificação do ponto transcricional por um laplaciano de Gaussian como implementado no plugin Trackmate27. MorpholibJ plugin28 é usado para pós-processamento (Arquivo Suplementar 1).
Como primeiro passo, realizamos o smFISH em discos imaginários alais, onde Mef2 e zfh1 são conhecidos por serem expressos nos AMPs. Esses dados mostram que ambos os transcritos são uniformemente detectados na população de AMPs co-corados com anticorpos Mef2 ou Zfh1 (Figura 2A,B). Os sítios de transcrição ativos (ST) podem ser revelados e distinguidos do RNAm maduro pelo smFISH, pois tendem a ser maiores e ter sinais mais intensos do que transcritos citoplasmáticos individuais ou transcritos nucleares maduros. Consistentemente, aumentos mais altos de AMPs distinguem entre focos de ST e mRNA maduro espalhados no citoplasma (Figura 2A',B'), validando a sensibilidade deste protocolo de SMfish. Deve-se, no entanto, mencionar que observamos uma ST ativa por núcleo tanto para zfh1 quanto para Mef2 (Figura 2A',B'). Esses dados validam ainda mais a acurácia do desenho da sonda, uma vez que os padrões transcricionais Mef2 e zfh1 nos AMPs colocalizam com a detecção de suas respectivas proteínas (Figura 2).
Em uma segunda etapa, examinamos o sítio de transcrição e a distribuição dos mRNAs Mef2 e zfh1 em IFMs adultos diferenciados e células-tronco associadas (Figura 2C,D). Esses dados ilustram claramente as TSs Mef2 nos núcleos musculares sinciciais e a distribuição do RNAm Mef2 ao longo do citoplasma (Figura 2C,C'). Zfh1 marca especificamente a população de MuSCs 10,11. Usando este protocolo smFISH, detectamos com sucesso a transcrição zfh1 em MuSCs marcados por Zfh1-Gal4 > expressão de GFP. Maior magnificação ilustra a detecção tanto de zfh1 TS quanto de RNAm únicos citoplasmáticos (Figura 2D').
Finalmente, usamos nossa macro ImageJ construída internamente para analisar quantitativamente a dinâmica transcricional e a distribuição espacial do Mef2. O pipeline computacional pode detectar e segmentar eficientemente pontos Mef2 e núcleos musculares (Figura 3A-C). No entanto, devido a problemas de relação sinal-ruído, alguns pontos podem não ser detectados em certos casos (Figura 3A',B'). Usamos este método automatizado para investigar se a abundância de mRNA Mef2 varia entre células precursoras musculares (AMPs) e IFMs adultos diferenciados. Nossa análise mostra que o número de mRNA de Mef2 por núcleo em IFMs adultos e AMPs não são significativamente diferentes (Figura 3D).
Para obter informações sobre a distribuição espacial dos transcritos Mef2 em músculos adultos IFM, quantificamos a fração de pontos de mRNA Mef2 citoplasmáticos versus nucleares (Figura 3E,F). Usando nosso programa, contamos o número total de pontos de mRNA Mef2 e o número de pontos de mRNA Mef2 sobrepostos com a coloração de núcleos (Mef2). A subtração do mRNA associado aos núcleos do número total de RNAm fornece o número de pontos de RNAm citoplasmático. Nossos achados revelam que aproximadamente 92% do RNAm de Mef2 está presente no citoplasma, enquanto os 8% restantes estão associados a núcleos musculares, como mostrado na Figura 3E,F.
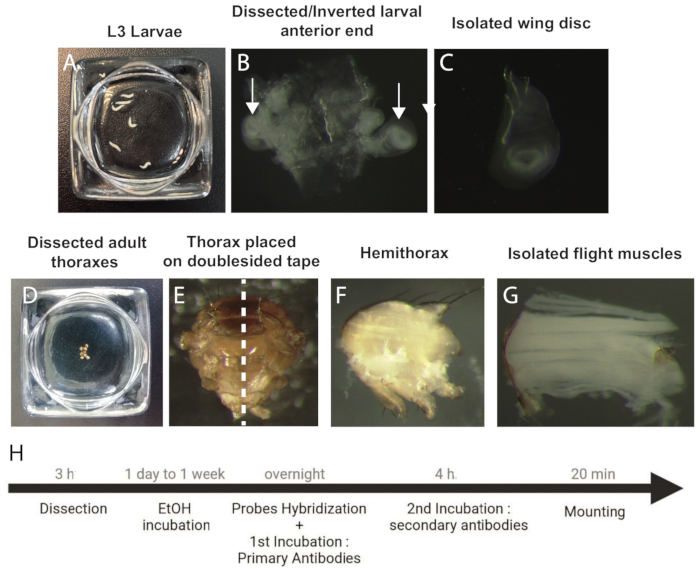
Figura 1: Procedimento para dissecar e preparar discos de asa e amostras de IFM para SMFISH. (A) Larvas em estádio L3. (B) Extremidade anterior da larva dissecada e invertida. As setas indicam os discos das asas. (C) Disco alar isolado (D) Tórax adulto dissecado. (E) Tórax adulto orientado por fita dupla face antes da bissecção (linha pontilhada). (F) Hemitórax adulto. g) MIF isolados. (H) Fluxo de trabalho do protocolo smFISH. Abreviações: IFMs = músculos de voo indireto; smFISH = hibridação in situ por fluorescência de RNA de molécula única; EtOH = etanol. Clique aqui para ver uma versão maior desta figura.
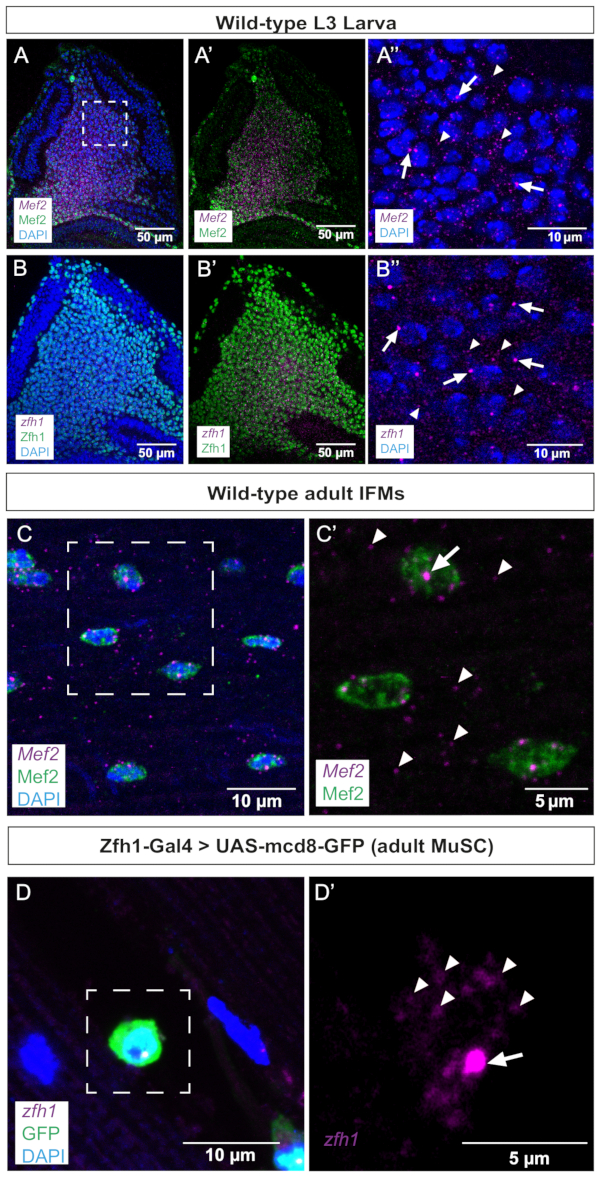
Figura 2: Imagens representativas de Mef2 e zfh1 smFISH em discos alares e IFMs adultos. (A,B) Mef2 e zfh1 mRNAs (roxo) são detectados uniformemente em AMPs e co-localizam com (A,A') Mef2 e (B,B') proteínas Zfh1 (verde), respectivamente. (A'',B'') Maior ampliação dos AMPs. (C) Os mRNAs Mef2 e a proteína Mef2 são detectados em IFMs adultos. (C') Maior magnificação da região encaixotada em C. (D) Zfh1-Gal4 >UAS-mCD8GFP expressão (verde) rotula MuSCs adultos. ZFH1 O RNA é detectado em MuSCs adultos. (D') Maior magnificação da região encaixotada em D. Os sítios de início da transcrição Zfh1 e os RNAm únicos são indicados por setas e pontas de setas, respectivamente. Coloração DAPI (azul). Barras de escala = 50 μm (A,B,A',B'), 10 μm (A",B",C,D), 5 μm (C',D'). Abreviações: IFMs = músculos de voo indireto; smFISH = hibridação in situ por fluorescência de RNA de molécula única; AMPs = progenitores musculares adultos; MuSCs = células-tronco musculares; DAPI = 4',6-diamidino-2-fenilindol; GFP = proteína fluorescente verde. Clique aqui para ver uma versão maior desta figura.
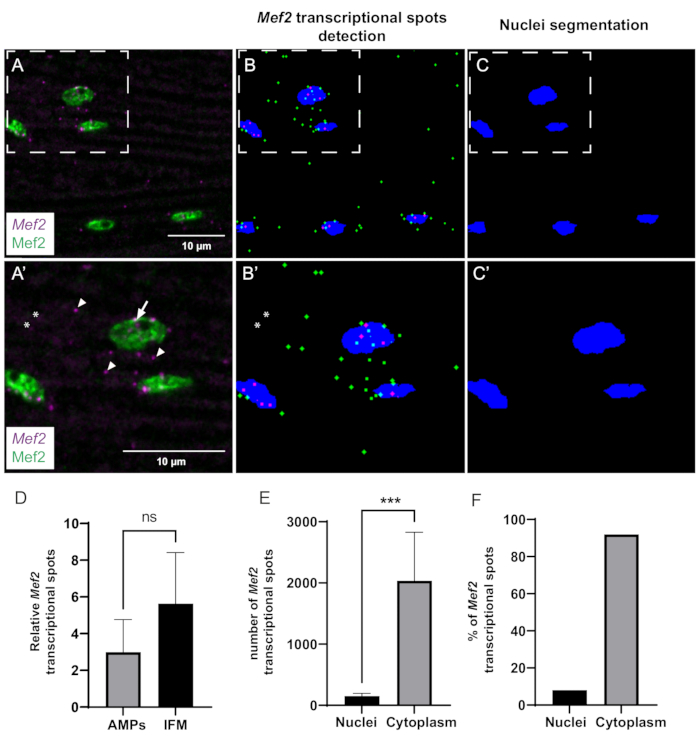
Figura 3: Quantificação da transcrição de Mef2 e acúmulo de RNAm citoplasmático por smFISH. (A) Distribuição dos transcritos Mef2 (roxo) e proteína Mef2 (verde) em IFMs adultos selvagens. (A') Maior ampliação da região encaixotada em A. Os sítios de início da transcrição e os RNAm únicos são indicados por setas e pontas de seta, respectivamente. (B,C) Detecção automática de pontos Mef2 e segmentação nuclear. Os mRNAs Mef2 citoplasmáticos e nucleares são indicados em verde e magenta, respectivamente. (B',C') Maiores ampliações das regiões encaixotadas em B e C. Asteriscos indicam manchas que não são contadas pelo macro. (D) Exemplo de quantificação do ponto Mef2 em AMPs e MIFs adultos, em relação ao número total de núcleos. (p = 0,0785, teste t de Student, discos alares (n = 4), MIFs (n = 11)). (E) Exemplo de quantificação da distribuição de pontos Mef2 em MIF adultos. (*** p< 0,0007, teste t de Student, n = 5). (F) Porcentagem de manchas de mRNA Mef2 detectadas dentro e fora dos núcleos (n = 5). Barras de escala = 10 μm (A,A'). Abreviações: IFMs = músculos de voo indireto; smFISH = hibridação in situ por fluorescência de RNA de molécula única; AMPs = progenitores musculares adultos. Clique aqui para ver uma versão maior desta figura.
Arquivo suplementar 1: Macro usada para pós-processamento. Clique aqui para baixar este arquivo.
Discussion
A aplicação do método smFISH ganhou popularidade nos últimos tempos, com seu uso se estendendo a vários tipos de células e organismos modelo. No entanto, no caso de Drosophila, a maior parte do conhecimento sobre a expressão gênica muscular adulta é derivada de ensaios moleculares em massa, que falham em fornecer informações quantitativas sobre a localização espacial precisa de moléculas de RNAm. Para resolver essa lacuna, otimizamos um método para realizar SMFISH em células precursoras musculares e músculos adultos de Drosophila . Esta abordagem foi adaptada de um protocolo previamentepublicado23 e otimizada para tecidos musculares de Drosophila .
O principal obstáculo na obtenção de imagens de alta qualidade do SMFISH é a espessura dos músculos adultos, o que dificulta a penetração ideal das sondas. Por isso, é fundamental separar os músculos adultos dos demais tecidos do animal e realizar o processo de hibridização com leve agitação. Esta etapa em particular garante a permeabilização eficaz dos tecidos.
Outro aspecto crítico é que a relação sinal-ruído pode fazer com que o pipeline computacional falhe na detecção de certos pontos de mRNA. Verificamos que o aumento da relação sinal-ruído pode ser alcançado encontrando-se a concentração ideal de sondas. A diluição ótima pode diferir dependendo da composição de cada conjunto de sondas, incluindo o corante conjugado e a composição de oligonucleotídeos. Recomendamos tentar diluições diferentes; uma diluição final de 200 nM produziu a melhor relação sinal-ruído para tecidos adultos nesses experimentos.
Com o método smFISH, é possível quantificar o número de RNAs recém-sintetizados nos focos de ST. Quando um gene é ativamente transcrito, vários RNAs nascentes são produzidos simultaneamente na ST. Como resultado, a intensidade da ST superará a do RNA citoplasmático maduro, e essa característica, combinada com sua localização nuclear, poderá diferenciar a ST dos RNAs citoplasmáticos individuais. No contexto da biologia muscular, a detecção e quantificação da ST são particularmente importantes para determinar a sincronização da transcrição de um gene específico entre núcleos musculares dentro de um mesmo sincício. No entanto, esse pipeline computacional não foi projetado para diferenciar entre sinais de RNAm citoplasmático e TS. Como alternativa, sugerimos combinar este método de SMFISH com outras ferramentas de análise de SMFISH bem estabelecidas, como BayFISH ou FISH-quant29,30. Essas ferramentas têm provado facilitar a segmentação automatizada e os cálculos de intensidade de fluorescência de agregados de RNA com notável precisão.
Finalmente, enquanto o smFISH detecta moléculas de mRNA com alta resolução espacial, ele se limita a analisar um pequeno número de mRNA ao mesmo tempo. Métodos multiescala como o merFISH (multiplexed error-robust fluorescence in situ hybridization) permitem a análise simultânea de um grande número de diferentes RNAm31. Ao combinar sondas de oligonucleotídeos e códigos de correção de erros, este método facilita a detecção de centenas de espécies de RNA em células únicas.
Disclosures
Os autores não têm conflitos de interesse a declarar.
Acknowledgements
Agradecemos a Alain Vincent por sua leitura crítica do manuscrito. Agradecemos a Ruth Lehmann pelo fornecimento do anticorpo Zfh1. Agradecemos a ajuda de Stephanie Dutertre e Xavier Pinson para microscopia confocal na MRic Imaging Platform. EL é apoiado por bolsa de doutorado do ministère de l'enseignement supérieur et de la recherche scientifique. NA é apoiado pela bolsa de doutorado AFM-Telethon 23846. A TP é financiada por uma subvenção da Chan Zuckerberg Initiative DAF à T.P. (2019-198009). O HB é apoiado pelo CNRS, pelo programa Atip Avenir e pela bolsa de trampolim AFM-Teleton 23108.
Materials
| Name | Company | Catalog Number | Comments |
| Confocal microscope SP8 | Leica | SP8 DMI 6000 | |
| DAPI | ThermoFisher | 62248 | |
| Double-sided tape | Tesa | 57910-00000 | |
| Dumont #55 Forceps | Fine Science Tools | 11255-20 | |
| Formaldehyde 16% | Euromedex | EM-15710 | |
| Mef2 antibody | DHSB | NA | |
| PBS 10x | Euromedex | ET330 | |
| RNaseZAP | Sigma-Aldrich | R2020 | |
| Stellaris probes | LGC | NA | |
| Stellaris RNA FISH Hybridization Buffer | LGC | SMF-HB1-10 | |
| Stellaris RNA FISH Wash Buffer A | LGC | SMF-WA1-60 | |
| Stellaris RNA FISH Wash Buffer B | LGC | SMF-WB1-20 | |
| Swann-Morton Blades | Fisher scientific | 0210 | |
| ThermoMixer | Eppendorf | 5382000015 | |
| Triton X-100 | Euromedex | 2000 | |
| UAS-mCD8::GFP line | Bloomington | RRID:BDSC_5137 | |
| Ultrapure water | Sigma-Aldrich | 95284 | |
| Watch Glass, Square, 1 5/8 in | Carolina | 742300 | |
| Zfh1 antibody | Gifted by Ruth Leahman | ||
| Zfh1-Gal4 | Bloomington | BDSC: 49924, FLYB: FBtp0059625 |
References
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692 (2021).
- Chal, J., Pourquie, O. Making muscle: skeletal myogenesis in vivo and in vitro. Development. 144 (12), 2104-2122 (2017).
- Taylor, M. V., Hughes, S. M. Mef2 and the skeletal muscle differentiation program. Seminars in Cell and Developmental Biology. 72, 33-44 (2017).
- Siles, L., et al. ZEB1 imposes a temporary stage-dependent inhibition of muscle gene expression and differentiation via CtBP-mediated transcriptional repression. Molecular and Cellular Biology. 33 (7), 1368-1382 (2013).
- Weitkunat, M., Schnorrer, F. A guide to study Drosophila muscle biology. Methods. 68 (1), 2-14 (2014).
- Boukhatmi, H. Drosophila, an integrative model to study the features of musclestem cells in development and regeneration. Cells. 10 (8), 2112 (2021).
- Bothe, I., Baylies, M. K. Drosophila myogenesis. Current Biology. 26 (17), R786-R791 (2016).
- Catalani, E., et al. RACK1 is evolutionary conserved in satellite stem cell activation and adult skeletal muscle regeneration. Cell Death Discovery. 8 (1), 459 (2022).
- Siles, L., Ninfali, C., Cortes, M., Darling, D. S., Postigo, A. ZEB1 protects skeletal muscle from damage and is required for its regeneration. Nature Communications. 10 (1), 1364 (2019).
- Boukhatmi, H., Bray, S. A population of adult satellite-like cells in Drosophila is maintained through a switch in RNA-isoforms. Elife. 7, e35954 (2018).
- Chaturvedi, D., Reichert, H., Gunage, R. D., VijayRaghavan, K. Identification and functional characterization of muscle satellite cells in Drosophila. Elife. 6, e30107 (2017).
- Gunage, R. D., Reichert, H., VijayRaghavan, K. Identification of a new stem cell population that generates Drosophila flight muscles. Elife. 3, e03126 (2014).
- Figeac, N., Daczewska, M., Marcelle, C., Jagla, K. Muscle stem cells and model systems for their investigation. Developmental Dynamics. 236 (12), 3332-3342 (2007).
- Aradhya, R., Zmojdzian, M., Da Ponte, J. P., Jagla, K. Muscle niche-driven insulin-Notch-Myc cascade reactivates dormant adult muscle precursors in Drosophila. Elife. 4, e08497 (2015).
- Schonbauer, C., et al. Spalt mediates an evolutionarily conserved switch to fibrillar muscle fate in insects. Nature. 479 (7373), 406-409 (2011).
- Bryantsev, A. L., Baker, P. W., Lovato, T. L., Jaramillo, M. S., Cripps, R. M. Differential requirements for Myocyte Enhancer Factor-2 during adult myogenesis in Drosophila. Developmental Biology. 361 (2), 191-207 (2012).
- Soler, C., Han, J., Taylor, M. V. The conserved transcription factor Mef2 has multiple roles in adult Drosophila musculature formation. Development. 139 (7), 1270-1275 (2012).
- Soler, C., Taylor, M. V. The Him gene inhibits the development of Drosophila flight muscles during metamorphosis. Mechanisms of Development. 126 (7), 595-603 (2009).
- Pinheiro, H., et al. mRNA distribution in skeletal muscle is associated with mRNA size. Journal of Cell Science. 134 (14), jcs256388 (2021).
- Denes, L. T., Kelley, C. P., Wang, E. T. Microtubule-based transport is essential to distribute RNA and nascent protein in skeletal muscle. Nature Communications. 12 (1), 6079 (2021).
- Li, H., et al. Fly Cell Atlas: A single-nucleus transcriptomic atlas of the adult fruit fly. Science. 375 (6584), eabk2432 (2022).
- Santos, M. D., et al. Extraction and sequencing of single nuclei from murine skeletal muscles. STAR Protocols. 2 (3), 100694 (2021).
- Raj, A., van den Bogaard, P., Rifkin, S. A., van Oudenaarden, A., Tyagi, S. Imaging individual mRNA molecules using multiple singly labeled probes. Nature Methods. 5 (10), 877-879 (2008).
- Femino, A. M., Fay, F. S., Fogarty, K., Singer, R. H. Visualization of single RNA transcripts in situ. Science. 280 (5363), 585-590 (1998).
- Raj, A., Tyagi, S. Detection of individual endogenous RNA transcripts in situ using multiple singly labeled probes. Methods in Enzymology. 472, 365-386 (2010).
- Stringer, C., Wang, T., Michaelos, M., Pachitariu, M. Cellpose: a generalist algorithm for cellular segmentation. Nature Methods. 18 (1), 100-106 (2021).
- Tinevez, J. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Legland, D., Arganda-Carreras, I., Andrey, P. MorphoLibJ: integrated library and plugins for mathematical morphology with ImageJ. Bioinformatics. 32 (22), 3532-3534 (2016).
- Mueller, F., et al. FISH-quant: automatic counting of transcripts in 3D FISH images. Nature Methods. 10 (4), 277-278 (2013).
- Gomez-Schiavon, M., Chen, L. F., West, A. E., Buchler, N. E. BayFish: Bayesian inference of transcription dynamics from population snapshots of single-molecule RNA FISH in single cells. Genome Biology. 18 (1), 164 (2017).
- Chen, K. H., Boettiger, A. N., Moffitt, J. R., Wang, S., Zhuang, X. RNA imaging. Spatially resolved, highly multiplexed RNA profiling in single cells. Science. 348 (6233), aaa6090 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved