הכנה איכותית של גרעיני מוח ומח עצם לבדיקות מולטיום של גרעינים בודדים
In This Article
Summary
ההצלחה של תעתיק חד-תאי/חד-גרעיני ומולטי-אומיקה תלויה במידה רבה באיכות התאים/גרעינים. לכן, בידוד תאים/גרעינים מרקמה וטיהורם חייבים להיות סטנדרטיים ביותר. פרוטוקול זה מתאר את הכנת הגרעינים מהמוח וממח העצם לבדיקת מולטיום-גרעינים חד-גרעיניים במורד הזרם.
Abstract
אנליזה של תא בודד הפכה לגישה המועדפת לפענוח מורכבותם של תהליכים ביולוגיים הדורשים להעריך את השונות של תגובות תאיות בודדות לטיפול או זיהום ברזולוציה של תא יחיד.
טכניקות רבות ליצירת פרופיל מולקולרי של תא בודד פותחו במהלך 10 השנים האחרונות, ומספר טכנולוגיות ייעודיות מוסחרו. פרופיל חד-תאי מבוסס טיפות 10X Genomics הוא טכנולוגיה נפוצה המציעה ריאגנטים מוכנים לשימוש עבור פרופיל חד-תאי שעתוק ורב-אומי. הטכנולוגיה כוללת תהליכי עבודה לריצוף RNA של תא בודד ושל גרעין בודד (scRNA-Seq ו-snRNA-Seq, בהתאמה), scATAC-Seq, פרופיל חיסוני של תא בודד (ריצוף BCR/TCR) ומולטיום. האחרון משלב שעתוק (scRNA-Seq) ומידע אפיגנטי (scATAC-Seq) המגיע מאותו תא.
האיכות (כדאיות, שלמות, טוהר) של מתלים חד-תאיים או גרעינים בודדים שבודדו מרקמות ונותחו על ידי כל אחת מהגישות הללו היא קריטית ליצירת נתונים באיכות גבוהה. לכן, יש להתאים את פרוטוקולי הכנת הדגימה למאפיינים של כל רקמה ביולוגית ולהבטיח יצירת תרחיפים איכותיים של תאים וגרעינים.
מאמר זה מתאר שני פרוטוקולים להכנת דגימות מוח ומח עצם עבור צינור הגנומיקה Multiome 10X במורד הזרם. הפרוטוקולים מבוצעים בהדרגה ומכסים דיסוציאציה של רקמות, מיון תאים, בידוד גרעינים ובקרת איכות של תרחיף גרעינים מוכן המשמש כחומר מוצא לחלוקת תאים וקידוד, הכנת ספרייה וריצוף. פרוטוקולים סטנדרטיים אלה מייצרים ספריות גרעינים באיכות גבוהה ונתונים חזקים ומהימנים.
Introduction
במשך שנים רבות, טכניקות חד-תאיות היו תקן הזהב לניתוח תהליכים ביולוגיים. הם הוגבלו בתחילה לפנוטיפ של תא בודד באמצעות מיקרוסקופיה, ציטומטריית זרימה ובדיקות דומות. פריצת דרך באנליזה של תא בודד הגיעה עם פיתוח גישות לפרופיל מולקולרי של תא בודד, בפרט ריצוף RNA של תא בודד (scRNA-Seq) שאיפשר לאפיין את כל התעתיק של תאים בודדים. scRNA-Seq רב עוצמה מייצר מידע על מצב השעתוק של תא במצב מסוים ובנקודת זמן ספציפית. עם זאת, הוא אינו מספק נראות על בקרת הגנים המניעה שעתוק, או על השינויים המולקולריים המתרחשים לאורך זמן. כדי להתגבר על מגבלה זו, הושקעו מאמצים רבים בפיתוח מבחני מולטי-אומיקה חד-תאיים המאפשרים ניתוח של גורמים ותהליכים מרובים מאותו תא 1,2,3,4. המדידה המוצלחת הראשונה של שתי שיטות בתוך תאים בודדים הגיעה באמצעות קישור דפוסי ביטוי חלבונים מרובי פני שטח עם התעתיק המלא של תאים בודדים בגישת CITE-Seq5. התפתחויות מאוחרות יותר משלבות ביטוי גנים עם נגישות הכרומטין (Assay for Transposase-Accessible Chromatin using sequencing, ATAC-Seq), ובכך לוכדות בו זמנית שיטות שעתוק ואפיגנומיות באותם תאים (למשל, sci-CAR)6. הפתרונות המסחריים הראשונים שאפשרו שיוך שעתוק לפנוטיפ התא או לשינויים אפיגנטיים של אותו תא הגיעו מ-10X Genomics.
ניסויים עבור פרופיל מולקולרי של תא יחיד מכילים את השלבים הבאים: (1) דיסוציאציה של רקמות או הכנה של תרחיפים חד-תאיים; (2) טיהור תאים ו/או בידוד גרעינים; (3) חלוקה וקידוד; (4) בניית ספרייה ובקרת איכות; (5) ריצוף הדור הבא; (6) ניתוח נתונים. בעוד ששלבים (3)-(6) עשויים להשתנות באופן משמעותי בהתאם לטכנולוגיה בה נעשה שימוש, השלבים הראשונים משותפים בדרך כלל לכולם. איכות תרחיף התא/גרעינים המוכן תקבע את התוצאה הכוללת של הניסוי. בהתאם לסוג הרקמה, השגת מתלים חד-תאיים/גרעינים באיכות גבוהה עשויה להיות מאתגרת. המאפיינים של רקמות מסוימות, כגון הלב, השריר, המוח, הריאה, המעי ועוד, דורשים שיטות לשיבוש רקמות ובידוד גרעינים המותאמים לכל סוג דגימה על מנת להבטיח ייצור גרעינים איכותיים לאנליזה מולקולרית 7,8,9,10 . שיטות שיבוש הרקמה ופרוטוקולי הדיסוציאציה יכולים להיות מכניים, אנזימטיים (למשל, תערובת של collagenases ו- DNase), או שילוב של השניים, ויכולים להתבצע באופן ידני או על ידי מכשירים (למשל, Qiagen DSC-400, gentleMACS).
טכניקות חד-תאיות הפכו לכלי בחירה למחקר ביו-רפואי. בנוירוביולוגיה, מגוון התאים במוח ומורכבות תפקודיהם דורשים ניתוח ברזולוציה גבוהה ובתפוקה גבוהה להדמיה של אוכלוסיות תאים נדירות ולהערכת ההטרוגניות שלהם 11,12,13,14. קישור הזהות התאית ומנגנוני הבקרה הגנטיים של תאים בודדים מספק תובנות על התפתחות המוח והפיזיולוגיה. דוגמה נוספת היא מחקרים על תגובה חיסונית בהקשר של מחלות זיהומיות, אוטואימוניות או סרטן, אשר מסתמכים במידה רבה על אנליזות של תאים בודדים. ההטרוגניות של תת-קבוצות תאי מערכת החיסון ומורכבות פעילותם ויחסי הגומלין שלהם עם סוגי תאים אחרים מחייבים רזולוציה של תא בודד בפענוח המנגנונים העומדים בבסיס התגובה החיסונית. מקורם של תאי החיסון הוא במוח העצם, שם אבות המטופויטיים מורכבים מתאים מתמיינים בהדרגה הרוכשים ומאבדים סמני פני השטח של התא בתהליך הדרגתי לפני היציאה ממח העצם לבית בפריפריה. אנליזה של תא בודד מאפשרת אפיון דק של שלבי התפתחות התא. זה יכול להיות מושגת באמצעות פנוטיפ תא יחיד, המבוצע באופן קונבנציונלי על ידי ציטומטריית זרימה מרובת פרמטרים. עם זאת, חתימות שעתוק של תא בודד הוכחו כחושפות זיהוי מדויק יותר של תת-סוגים של תאי אב, שכן תאים אלה מפוזרים בצבירים הנופלים זה לזה ולכן ניתן לזהותם בטעות בעת שימוש בסמן פני שטח גס של התא המתקרב15. מספר גדל והולך של מחקרים חושפים את השינויים האפיגנטיים שתאי גזע ותאי אב המטופויטיים (HSPCs) יכולים לרכוש מחשיפה לחומרים שונים, מה שמוביל להשפעה משמעותית על ההיענות ארוכת הטווח של מערכת החיסון 16,17,18,19. טכנולוגיות המולטי-אומיקה החדשות מאפשרות לחקור תהליכים אלה ברזולוציה של תא יחיד.
פרוטוקולים רבים לבידוד תאים וגרעינים תוארו עבור מוח 11,20,21,22 ודגימות מח עצם 23,24. כדי למזער את ההטיה הנובעת משונות ניסויית, יש צורך לאמת פרוטוקולי הכנה אופטימליים של גרעינים בודדים לריצוף שעתוק ואפיגנומי של תא יחיד, ובכך להבטיח את יכולת השחזור של בדיקות מולטיומיות חד-תאיות.
כאן מתוארים שני פרוטוקולים חזקים להכנת גרעינים מ-(1) רקמת מוח טרייה קפואה ו-(2) HSPCs מח עצם טרי לניתוח מולטיומים חד-תאיים במורד הזרם (איור 1).
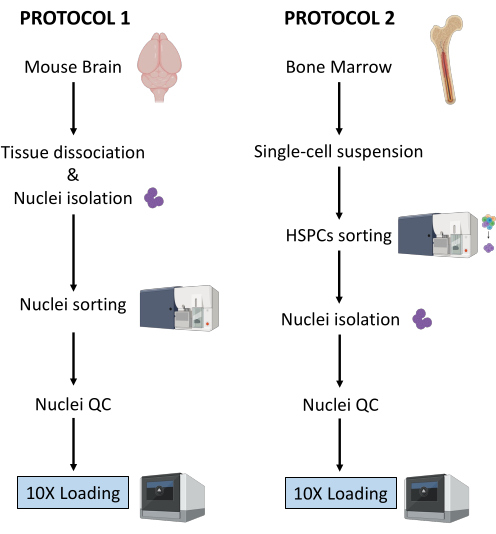
איור 1: ייצוג סכמטי של פרוטוקולים לבידוד גרעינים מרקמות מוח ומח עצם טריות וקפואות. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
הליכי הניסוי נערכו תחת ציות רגולטורי קפדני לפרוטוקולים שאושרו על ידי ועדת האתיקה בניסויים בבעלי חיים (CETEA). לבידוד גרעיני המוח נעשה שימוש בעכברי C57BL/6 בני 3 חודשים. לצורך בידוד מח העצם נעשה שימוש בנקבות עכברי C57BL/6J בנות 8 שבועות במשקל 18 גרם.
1. טיהור גרעינים ממוח העכבר
הערה: יש ללבוש כפפות לטקס או ניטריל בכל עת במהלך ההליך. מומלץ מאוד ששני אנשים יבצעו את הניסוי, ששלבים 1 עד 3 (כלומר, הכנת תרחיף הגרעינים היחיד) יבוצעו על ידי אדם אחד, ושלב 4 (כלומר, הכנת המיון) יבוצעו במקביל על ידי אדם אחר. מכיוון שהפרוטוקול רגיש מאוד לזמן, קריטי למזער את זמן עיבוד הדגימה על ידי הכנת הממיין מיד עם הכנת מתלה הגרעינים היחיד.
- הכנת ריאגנטים וחומרים
- בזהירות לעקר את כלי הדיסקציה על ידי autoclave (ב 121 ° C במשך 20 דקות) ולשטוף אותם עם אתנול 70% ממש לפני השימוש. הכינו צלחת פטרי אחת בכל דגימה, מלאה ב-2-3 מ"ל של מלח חוצץ פוספט (DPBS) קר כקרח (DPBS).
- מצננים את המיקרוצנטריפוגה ל -4 מעלות צלזיוס, ממלאים דלי בקרח, ומניחים את הזכוכית מקפיצה הומוגנייזר על קרח.
- הכן חיץ ליזה גרעיני על ידי הוספת digitonin לריכוז סופי של 0.01%, 10 מ"ל לדגימה.
- הכן את מאגר הצביעה על ידי הוספת מעכבי RNase למאגר צביעת התא לקבלת ריכוז סופי של 0.2 U/μL, 20 מ"ל לדגימה.
- הכן DPBS 0.04% BSA על ידי הוספת מעכבי RNase לריכוז סופי של 0.2 U/μL, 2 מ"ל לדגימה.
- הכינו 1 מ"ל של חיץ גרעינים מדולל בהתאם לפרוטוקול Multiome25.
- שמור את כל הריאגנטים והדגימות על קרח.
- דיסקציה של רקמות
- להקריב עכברים באמצעות פרוטוקולים שאושרו על ידי המוסד. בפרוטוקול זה, ראשם של העכברים נערף לאחר מנת יתר של קטמין/קסילזין.
- חתכו את ראש העכבר במספריים והוציאו את המוח מהגולגולת כמתואר ב-Meyerhoff et al.26. העבירו מיד את המוח לצלוחית פטרי שהוכנה עם DPBS 1x קר כקרח תחת מיקרוסקופ סטריאופוני פולט אור (LED).
- חתכו את רקמת המוח בעזרת אזמל כדי להפריד בין אזורי עניין במוח (למשל, קליפת המוח האנטורינלית, ההיפוקמפוס, קליפת המוח הקדם-מצחית) והעבירו כל אזור לצלחת פטרי נפרדת המכילה DPBS 1x קר כקרח. שמור על קרח.
- בעזרת אזמל, לטחון את הרקמה לחתיכות <0.5 ס"מ כדי להקל על הומוגניזציה בשלב הבא.
- בעזרת מיקרופיפטה P1000, העבירו את הרקמה הטחונה ואת ה-DPBS 1x מצלחת הפטרי לצינור של 1.5 מ"ל. הקפידו להשתמש בצינורות העשויים מפלסטיק בעל קישור נמוך לחלבון. אפשרו לחתיכות הרקמה להיפרד על ידי כוח הכבידה. בזהירות להסיר את עודף של 1x DPBS באמצעות micropipette P1000.
הערה: לאחר שלב זה, ניתן להקפיא את הרקמה הטחונה על ידי העברת צינורות החלבון בעלי הקישור הנמוך לקרח יבש ולאחר מכן לאחסן ב -80 ° C עד להמשך בידוד גרעינים.
- בידוד גרעינים
- מלאו את מדף הזכוכית ב-2 מ"ל של חיץ גרעינים קרים כקרח בליזיס עם 0.01% דיגיטונין. מוסיפים את חתיכות הטישו בקפיצה.
הערה: אם אתה עובד עם רקמה קפואה טרייה, הוסף את הרקמה הקפואה הטחונה ישירות למאגר הגרעינים ליזה 0.01% דיגיטונין; אל תתנו לרקמה להפשיר לפני. - הומוגניזציה באמצעות זכוכית להקפיץ רקמות homogenizer 25 פעמים עם pestle A ולאחר מכן 25 פעמים עם pestle B. להעביר את homogenate לתוך צינור 15 מ"ל.
- הוסיפו עוד 2 מ"ל של חיץ גרעינים קרים כקרח עם 0.01% דיגיטונין ודגרו על קרח למשך 5 דקות. גרעיני צנטריפוגות ב 500 x גרם במשך 5 דקות ב 4 ° C.
- הסר את supernatant עם micropipette ולהוסיף 4 מ"ל של חיץ גרעינים קר כקרח ליזה עם 0.01% digitonin. דוגרים על קרח במשך 5 דקות ומסננים דרך מסננת תאים בגודל 40 מיקרומטר.
- גרעיני צנטריפוגות ב 500 x גרם במשך 5 דקות ב 4 ° C ולהסיר את supernatant עם micropipette.
- הוסף 4 מ"ל של חיץ צביעה כדי לשטוף את הגרעינים והצנטריפוגה ב 500 x גרם במשך 5 דקות ב 4 ° C. הסר את supernatant עם micropipette ו resuspend את הגלולה ב 4 מ"ל של חיץ צביעה.
- סנן דרך מסננת תאים 40 מיקרומטר וצנטריפוגה ב 500 x גרם במשך 5 דקות ב 4 ° C. השעיה מחדש ב 1 מ"ל של PBS עם 0.04% BSA.
- ספירת גרעינים כדי להבטיח עקביות של הכנת רקמות/גרעינים בין דגימות שונות. הוא צפוי לקבל ספירות גרעינים דומות מאותם אזורי מוח:
- הוסף 10 μL של 0.4% טריפאן כחול לצינור ריק של 0.5 מ"ל. מוסיפים 10 μL של הגרעינים ומערבבים 5x על ידי pipetting.
- ספור גרעינים באמצעות מונה תאים אוטומטי בהתאם להמלצות הספק. שמור את הגרעינים על קרח.
- מכינים גרעינים למיון.
הערה: הגרעינים שחולצו משלבים 7-AAD, וצביעה זו משמשת לטיהורם על ידי ממיין תאים המופעל על ידי פלואורסצנטיות (FACS).- העבר 100 μL של גרעינים לצינור FACS לבקרה לא מוכתמת. הוסף 10 μL של 7-AAD לגרעינים הנותרים, ולשמור 5 דקות על 4 ° C.
- מיין לפחות 0.5 x 106 גרעינים לפי FACS כדי לסלק כפילויות ולכלוך.
- מלאו את מדף הזכוכית ב-2 מ"ל של חיץ גרעינים קרים כקרח בליזיס עם 0.01% דיגיטונין. מוסיפים את חתיכות הטישו בקפיצה.
- מיון גרעינים באמצעות FACS
הערה: בעוד שניתן לבצע מיון גרעינים במגוון רחב של ממייני תאים, הליך השימוש במכשירי BD FACSAria Fusion או BD FACSAria III מתואר כאן. מומלץ מאוד שהכיול וההתקנה של ממיין התאים יבוצעו תחת פיקוח, או על ידי משתמש מנוסה במכשיר. כדי לקצר את זמן עיבוד הדגימה, קריטי להכין את הממיין ברגע שמתלה הגרעינים הבודדים מוכן.- כיול מכשיר FACS
- הפעל את סדרן התאים ואת המחשב. לאחר חיבור התוכנה למכשיר, הפעל את הליך ההפעלה הנוזלי. בחר Cytometer > Fluidic startup-up בתפריט הראשי ובצע את ארבעת השלבים. לחץ על בוצע לאחר השלמת כל אחד מהם.
- הכנס את פיית 70 מיקרומטר, הפעל את הזרם, והשאר את הזרם להתייצב למשך 15 דקות. התאם את המשרעת כדי לקבל היווצרות טיפה ולחץ על נקודה מתוקה.
- שים את מסנן הצפיפות הניטרלית (N.D) 1.0 ופתח את ממשק ההגדרה והמעקב אחר ציטומטר (CST).
- בקרת איכות יומית: לדלל חרוזי CST בתווך FACS (ראה המלצות ספק) ולבצע בקרת CST. לאחר השלמתו, החלף את N.D 1.0 ב- N.D 2.0.
- לדלל Accudrops בתווך FACS (ראה המלצות ספק) ולבצע עיכוב נפילה כמתואר בשלבים 6 עד 10.
- בתבנית הניסוי, בחר את הניסוי Accudrop Drop Delay ופתח את פריסת המיון עבור הצינור.
- בתוך חלון המצלמה התחתון, לחץ על מתח ולאחר מכן על מסנן אופטי כדי לאפשר הפעלת מטען על לוחות ההסטה ושימוש במסנן אופטי ספציפי מול המצלמה. ודא כי הרביע בצד ימין מציין 100. במידת הצורך, כוונן את בורג הלייזר האדום כדי למטב את פגיעת הלייזר.
- התאם את קצב הזרימה כדי להגיע למהירות של 1,000 עד 3,000 אירועים בשנייה.
- לחץ על מיין ובטל. ודא שהרביע השמאלי שווה ל- 100, והרביע הימני הוא 0. אם הרביע השמאלי נמוך מ- 95, בצע עיכוב אוטומטי.
- לחץ על מתח ולאחר מכן בדוק מיון. בקרה על איכות הפקדת הזרמים הצדדיים בצינורות האיסוף. במידת הצורך, התאימו את מיקום הזרמים הצדדיים באמצעות הזזת המחוונים.
- הגדרת מכשיר FACS למיון גרעינים.
- התחל את רכישת הגרעינים הבלתי מוכתמים. אלה משמשים להגדרת פיזור קדימה וצד, ואת מתח הגלאי עבור הפרמטר 7-ADD. הגדר את הפרמטרים כך שהאות 7-AAD של המדגם הלא מוכתם ייפול בתוך העשור הראשון של סולם היומן בתרשים הנקודות.
- התחל לרכוש את הצינור של גרעינים מוכתמים ב-7-AAD והגדר את אוכלוסיות הגרעינים באמצעות אסטרטגיית gating המבוססת על (1) FSC-A/SCC-A ולאחר מכן FSC-H/SSC-H עבור גודל וגרעיניות, (2) FSC-H/FSC-A עבור אפליית כפילויות, ו-(3) SSC-A/7-AAD עבור גרעינים חיוביים של 7-AAD (ראה איור 2A).
- ודא שהזרם והסטייה יציבים.
- במצלמת הזרם הצדדי, הפעל את מיון הבדיקה, הפעלת מתח ואשר את מיון הטיפות המדויק בצינור 1.5 מ"ל המותקן בצד שמאל.
- בחלון פריסת מיון , בחר את אוכלוסיית העניין, כפי שהוגדרה בשלב 2 (לעיל). באירועי יעד, בחר את הסף ברציף כדי לקבל לפחות 0.5 x 106 גרעינים לדגימה. תחת Precision, בחר 4-Way Purity.
- לאחר שתהיה מוכן, לחץ על מיין ואישור כדי להתחיל במיון גרעינים.
- כיול מכשיר FACS
- בקרת איכות וספירה של גרעינים מטוהרים
הערה: שלב זה ייעשה רק במהלך ניסוי הפיילוט לאופטימיזציה של שלבי הכנת הדגימה, במטרה לבדוק את טוהר הגרעינים הממוינים שיוטענו על שבב הכרום 10X. לאחר אופטימיזציה מלאה של הפרוטוקול, לא מומלץ לבצע שלב בקרת איכות זה בניסויי המעקב כדי למנוע בזבוז מיותר של גרעינים שנאספו שעשויים להיות זמינים במספרים נמוכים.- בקרת טוהר על ידי ציטומטריית זרימה
- העבר 10 μL של הגרעינים הממוינים לתוך צינור FACS חדש המכיל 90 μL של DPBS עם 2% סרום בקר עוברי מומת בחום (HI-FBS).
- רכוש ותעד נתונים לאחר המיון כדי לאמת את טוהר המיון ואת הכדאיות. ודא שלפחות 98% מהגרעינים מופיעים בשער הריבית, כהגדרתו ב-4.2 (ראה איור 2B).
- ספירת הגרעינים המטוהרים
- צנטריפוגות ממוינות גרעינים במשך 5 דקות ב 500 x גרם וב 4 ° C בזהירות להסיר לחלוטין את supernatant באמצעות micropipette. השהה מחדש ב 100 μL של מאגר גרעינים מדולל.
- הוסף 10 μL של 0.4% טריפאן כחול לצינור ריק של 0.5 מ"ל. מוסיפים 10 μL מהגרעינים הממוינים ומערבבים פי 5 על ידי פיפטציה.
- ספור גרעינים באמצעות מונה תאים אוטומטי בהתאם להמלצות הספק. כוונן את ריכוז הגרעינים ל 3.5 x 106/mL, כלומר, 16,000 גרעינים לכל 5 μL.
- בקרת איכות של גרעינים מטוהרים באמצעות מיקרוסקופ
הערה: שלב זה ייעשה רק במהלך ניסוי הפיילוט לאופטימיזציה של שלבי הכנת הדגימה לבדיקת איכות הגרעינים שיוטענו על שבב הכרום 10X. לאחר אופטימיזציה מלאה של הפרוטוקול, לא מומלץ לבצע שלב בקרת איכות זה בניסויי המעקב כדי למנוע בזבוז מיותר של גרעינים שנאספו שעשויים להיות זמינים במספרים נמוכים.- ודא שהחלקות המיקרוסקופ והחלקות הכיסוי נקיות ונטולות אבק. במידת הצורך, שטפו ושטפו את הכיסויים באתנול מוחלט וייבשו אותם במגבונים ללא מוך.
- מפזרים 25 μL של פולי-ל-ליזין בבארות המגלשה שישמשו וידגרור במשך 10 דקות בטמפרטורת החדר (RT), מוגן מפני אבק.
- הסר את עודף פולי-L-ליזין ולהוסיף 10 μL של השעיית גרעינים מטוהרים. יש לדגור במשך 5 דקות ב-RT, מוגן מאבק.
- הוסיפו טיפה של מדיום הרכבה לכל באר, והימנעו מבועות.
- הניחו מכסה על גבי בארות הזרעים. כסו במגבוני נייר ולחצו בחוזקה על הכיסוי כדי להסיר את אמצעי ההרכבה העודפים. היזהרו לא להזיז את הכיסוי, ואל תנקו את אמצעי ההרכבה העודפים.
- צלם מספר תמונות עם מיקרוסקופ הפוך עם אור שדה בהיר והגדלה מינימלית של 40x.
- בקרת טוהר על ידי ציטומטריית זרימה
- בצע בדיקת multiome.
- המשך מיד אל Chromium Next GEM Single Cell Multiome ATAC + Gene Expression מדריך למשתמש (CG000338 - Rev F)25.
2. טיהור גרעינים מתאי גזע ואב המטופויטיים של מח עצם עכבר (HSPCs)
הערה פרוטוקול זה מתאר את טיהור הגרעינים משלוש תת-קבוצות של מח עצם HSPCs: שושלת-c-Kit+Sca-1+ תאי גזע המטופויטיים (HSC), שושלת-c-Kit+Sca-1-CD34+FcγR- אבות מיאלואידים נפוצים (CMP), ושושלת- c-Kit+Sca-1-CD34+FcγR+ אבות גרנולוציטים-מונוציטים (GMP). יש ללבוש כפפות לטקס או ניטריל בכל עת במהלך ההליך. פרוטוקול זה הוא אדפטציה של פרוטוקול 10X Genomics Demonstrated - בידוד גרעינים עבור Multiome ATAC + GEX sequencing (CG000365 - Rev C)27. שינויים הוכנסו בפרוטוקול המקורי כדי למקסם את התאוששות הגרעינים. מומלץ מאוד שיהיו שני אנשים שיבצעו את הניסוי, שיהיו להם שלבים 1. ל-3. (כלומר, הכנת התמיסה החד-תאית) המבוצעת על ידי אדם אחד, ושלב 4 (כלומר, הכנת המיון) המבוצע במקביל על ידי אדם אחר. מכיוון שהפרוטוקול רגיש מאוד לזמן, קריטי למזער את זמן עיבוד הדגימה על ידי הכנת הממיין מיד עם הכנת המתלה החד-תאי.
- הכנת ריאגנטים וחומרים
- ממלאים דלי בקרח.
- הכן את מאגר FACS: DPBS עם פתרון HI-FBS 2% (כ-500 מ"ל עבור 6 דגימות) וסנן דרך מסנן 0.2 מיקרומטר.
- הכן את אמצעי האיסוף: DPBS עם תמיסת 10% HI-FBS (500 מיקרוליטר לדגימה), וסנן דרך מסנן 0.2 מיקרומטר.
- בידוד תאי מח עצם
- להקריב עכברים באמצעות פרוטוקולים שאושרו על ידי המוסד. בניסוי זה, העכברים הוקרבו על ידי פריקת צוואר הרחם לאחר מנת יתר של קטמין/קסילזין.
- רססו את הבטן והרגליים האחוריות של העכברים באתנול 70%.
- השתמשו במלקחיים סטריליים ובמספריים כדי לבצע חתך קטן באמצע הבטן התחתונה ולפתוח את הצפק מבסיס הרגליים האחוריות לסרעפת (איור משלים 1).
- בצעו חתך נוסף עבור כל רגל אחורית בניצב לצפק הפתוח, ואז תפסו את אחד הצדדים של אחד החתכים הנוספים האלה ומשכו אותו בנפרד כדי לקלף את העור משתי הרגליים האחוריות מעבר למפרק הקרסול כדי לחשוף את השרירים של שתי הרגליים האחוריות (איור משלים 1A).
- רפדו את המספריים לאורך עמוד השדרה במפרק הירך של רגל אחורית אחת כדי לחתוך את הרגל מבלי לחתוך דרך עצם הירך (איור משלים 1B, C). חזור על אותו הדבר עבור הרגל השנייה.
- כדי לבודד את עצם הירך, חתכו את רוב רקמת השריר החוצה, ואז החזיקו את עצם הירך ואת השוקה בכל יד עם קצות האצבעות במפרק (איור משלים 1D, E). קפלו בעדינות את הרגל כנגד העיקול הטבעי כדי לנתק את השוקה מעצם הירך (איור משלים 1E) ולאחר מכן חתכו בזהירות את רקמת החיבור עם מספריים כדי להפריד בין עצם הירך לשוקה.
- השתמשו במספריים בתנועות פיתול קלות כדי להזיז את פיסת עמוד השדרה מהקצה העליון של עצם הירך (איור משלים 1E).
- נקו את עצם הירך המבודדת עם נייר טישו כדי להסיר את השריר ורקמת החיבור שנותרו.
- יש לשמור קר על קרח בצלחת בת 12 בארות מלאה היטב ב-2 מ"ל DMEM (1x) + GlutaMAX-I.
- לאחר שכל עצם הירך נאספת, ודא כי רקמות שריר וסיביות מוסרים לחלוטין מן העצם. אין לחתוך את העצם פתוחה כדי (א) לשמור על המח בתוך סטרילי ו-(ב) להימנע מאיבוד תאים בבאר. השתמש בשלבים הבאים לשטיפת התאים משתי עצמות הירך של עכבר אחד, המותאמות מהאג ומורטי28.
- הכינו צינור אחד של 1.5 מ"ל וצינור אחד של 0.5 מ"ל. הוסף 150 μL של חיץ FACS לצינור 1.5 מ"ל, ולאחר מכן תקע חור בתחתית הצינור של 0.5 מ"ל באמצעות מחט 18 G והכנס את הצינור 0.5 מ"ל לצינור 1.5 מ"ל.
- פתחו את החלק הדיסטלי של כל עצם הירך באמצעות מספריים כירורגיים של עכברים (איור משלים 1F): נעלו את האפיפיזה הדיסטלית בין הלהבים והפעילו לחץ עדין תוך כדי היפוך המספריים כדי לנתק בצורה חלקה את האפיפיזה הדיסטלית מבלי לפתוח את העצם בחוזקה. אם זה מצליח, 4 בליטות אמורות להיראות בקצה הפיזי החשוף כעת (איור משלים 1G).
- התאימו את שתי עצם הירך כשהקצה הפתוח פונה כלפי מטה לתוך צינור 0.5 מ"ל מוכן הממוקם בתוך צינור של 1.5 מ"ל המכיל חיץ FACS (איור משלים 1H).
- הניחו מסננת תאים של 70 מיקרומטר על צינור של 50 מ"ל והרטיבו מראש את המסננת עם 2 מ"ל של חיץ FACS.
- כדי לשטוף את מח העצם, צנטריפוגה את הצינורות (כובעים פתוחים) ב 12,000 x גרם עד הצנטריפוגה מגיע לערך 12,000 x גרם , ואז מיד לעצור את הצנטריפוגה.
- ודאו שתאי מח העצם מכווננים בצינור של 1.5 מ"ל ושעצם הירך לבנה (לפני שטיפת התאים היא אדומה) (איור משלים 1I). יש להשליך את צינורות ה-0.5 מ"ל עם 2 עצם הירך.
- השליכו את הסופרנאטנט 150 μL באמצעות פיפטה.
- יש להשהות מחדש את הגלולה עם מיקרופיפטה ב-1 מ"ל של חיץ שוכב אמוניום-כלוריד-אשלגן (ACK) למשך 1-2 דקות ב-RT כדי לליז תאי דם אדומים. הימנעו מזמני דגירה ארוכים יותר מכיוון שהם עלולים לגרום לירידה בכדאיות של תאים בעלי גרעין.
- מעבירים לצינור 50 מ"ל דרך מסננת התאים 70 מיקרומטר שהורטבה מראש.
- הוסף 10 מ"ל של חיץ FACS כדי לדלל את מאגר ACK שוכב ובכך להפסיק את הליזיס.
- צנטריפוגה ב 400 x גרם במשך 5 דקות ב 4 ° C. השהה מחדש במאגר FACS של 10 מ"ל על ידי השעיה מחדש תחילה ב- 1 מ"ל ולאחר מכן מילוי ב- 9 מ"ל.
- הכן את התאים לספירה כמתואר ב- 1.3.8.
- ספור את התאים באמצעות מונה תאים אוטומטי בהתאם להמלצות הספק. הוא צפוי לאסוף כ-40 מיליון תאים מ-2 עצם הירך.
- צביעת מח עצם HSPC
- צנטריפוגה את התאים ב 400 x גרם במשך 5 דקות ב 4 ° C ו resuspend את הגלולה עם micropipette במאגר FACS לריכוז סופי של 1 x 107 תאים / מ"ל.
- עם מיקרופיפטה P1000, העבר את המתלה לתוך צינור FACS, סינון דרך מכסה מסננת תאים 35 מיקרומטר.
- הכינו דגימות מבחנה של כתמים בודדים עבור כל נוגדן המופיע בטבלה 1 כדי להגדיר פיצויים של פלואורוכרום על ממיין התאים:
- הכינו צינור FACS אחד לכל נוגדן ומלאו את הצינורות ב-200 מיקרוליטר של PBS.
- הוסף 15 μL של חרוזי פיצוי פלואורוכרום בכל צינור FACS של נוגדן מצומד פלואורוכרום. בצינורות FACS עבור תאים מוכתמים לא מוכתמים ועבור תאים מוכתמים בודדים חיים/מתים, הוסף 500,000 תאים במקום חרוזים.
- הוסף 1 μL של כל נוגדן מצומד פלואורוכרום (ראה טבלה 1) לתוך צינור FACS המתאים לו. הוסף 0.5 μL של כתם חי/מת לצינור FACS של כתם יחיד חי/מת.
- יש לשמור על קרח למשך 15 דקות כשהוא מוגן מאור.
- הכינו תערובות 1 ו-2 כמצוין בטבלה 2.
הערה: נפחי הנוגדנים המצוינים בטבלה 2 תקפים עבור הנוגדנים המוזכרים בטבלת החומרים. הם צריכים להיות מותאמים לכל התייחסות נוגדנים חדשה או הרבה שונה של אותה התייחסות נוגדנים. - הוסיפו 300 μL של Mix 1 לצינור הדגימה, השהו מחדש ושמרו למשך 15 דקות על קרח מוגן מפני אור.
- הוסיפו 300 μL של Mix 2 לצינור הדגימה, השהו מחדש ושמרו למשך 20 דקות על קרח מוגן מפני אור.
- הוסף 3 מ"ל של מאגר FACS לצינורות המוכתמים הבודדים ולצינורות הדגימה המוכתמים במיקס. יש לסחור כלפי מטה במהירות של 400 x גרם למשך 5 דקות ב-4°C.
- בזהירות להשליך את supernatant באמצעות micropipette ו resuspend את הגלולה ב 500 μL של מאגר FACS.
- הכינו צינור של 1.5 מ"ל ממולא מראש ב-500 מיקרוליטר של אמצעי איסוף.
הערה: מיקס 1 מוכן ב-DPBS מכיוון שהוא מכיל את הכתם חי/מת המושפע באופן משמעותי מ-HI-FBS. לאחר שהתאים מוכתמים על ידי Live/Dead, מתווסף Mix 2, המכיל נוגדנים מצומדים פלואורוכרום התלויים מחדש במאגר FACS המכיל HI-FBS. היוצא מן הכלל היחיד הוא נוגדן אנטי CD16/32 הכלול ב- Antibody Mix 1 כדי לשמש כחוסם קולטן Fc המונע קשירה לא ספציפית של נוגדנים אחרים שנוספו בשלב הבא.
- מיון תאים באמצעות FACS
הערה: בעוד שניתן לבצע מיון תאים במגוון רחב של ממייני תאים, כאן מתואר הליך השימוש במכשירי BD FACSAria Fusion או BD FACSAria III. מומלץ מאוד לבצע את הכיול וההתקנה של ממיין התאים תחת פיקוח או על ידי משתמש מנוסה במכשיר.- כיול מכשיר FACS: עיין בפרוטוקול 1 שלב 4.1.
- הגדרת מכשיר FACS למיון תאים:
- התחל את רכישת התאים המוכתמים. אלה משמשים להגדרת הפיזורים קדימה וצידית ואת מתח הגלאי עבור כל פלואורופור. הגדר את הפרמטרים כך שהאות הפלואורסצנטי של כל פלואורופור ייפול בתוך העשור הראשון של סולם היומן בתרשים הנקודות.
- רכוש פקדי צבע בודדים כדי להגדיר פיצויים באופן ידני (יש ליישר חציון של אוכלוסיות חיוביות ושליליות) או השתמש בתוכנת החישוב האוטומטית (מדידות שיפוע). ודא שבקרות הפיצוי תואמות את פלואורוכרומי הניסוי ואת הגדרות הגלאים. הקלט 10,000 אירועים עבור תאים ו- 5,000 אירועים עבור חרוזים.
- השתמשו בצינורית הדגימה (כלומר, תאים מרובי מוכתמים) כדי להגדיר אוכלוסיות תאים מעניינות באמצעות אסטרטגיית ה-gating שמוצגת באיור 3A. בצע את שלבים 4 - 6 (להלן).
- כדי לזהות את שלושת מח העצם HSPCs של עניין (HSC, CMP, ו GMP), להתחיל את gating באמצעות גודל (FSC-A) וגרעיניות (SSC-A) כדי שער על לויקוציטים, ולאחר מכן FSC-H/FSC-A כדי להפלות כפולים.
- מבוסס על סמן SSC-A/תא מת, שער תאים חיים. השתמש ב- Lineage/c-Kit כדי לבחור תאים שליליים לשושלת ומבטאים רמות ביניים עד גבוהות של c-Kit. באמצעות c-Kit/Sca-1, שער על שושלת c-Kit+ Sca-1+ (LKS+) HSCs, אחת משלוש האוכלוסיות המעניינות.
- בין האבות המיאלואידים (שושלת-c-Kit+Sca-1-), השתמש ב- FcγR/CD34 כדי לא לכלול CD34-FcγR- מגה-קריוציטים ואבות אריתרואידים (MEP), תוך הכללת CD34+ FcγR- CMP, כמו גם CD34+FcγR+ GMP באוכלוסיות התאים שיש למיין.
- ודא שהזרם והסטייה יציבים.
- במצלמת הזרם הצדדי, הפעל את מיון הבדיקה, הפעל מתח ואשר את מיון הטיפות המדויק בצינור 1.5 מ"ל המותקן בצד שמאל.
- בחלון פריסת מיון , בחר את האוכלוסיות המעניינות (כלומר, "LKS+" ו- "CD34+ אבות מיאלואידים" המוצגים בדוגמה זו). תחת התקן, בחר 2 צינור. תחת דיוק, בחר טוהר. באירועי יעד, בחר רציף כדי למיין בין 160,000 ל- 200,000 אבות מיאלואידים LKS+ ו- CD34+ .
- הוסף 500 μL של מאגר FACS לתרחיף התא והעבר את 1 מ"ל הדגימה על ידי סינון לתוך צינור FACS חדש של 35 μm מסננת תאים כדי להבטיח שכל התאים נמצאים בתרחיף יחיד ממש לפני הרכישה. זה מבטל גושי תאים שעלולים לסתום את המכשיר.
- לאחר שתהיה מוכן, לחץ על מיין ואישור כדי להתחיל במיון. התאם את קצב הזרימה כדי לשמור על מהירות מתחת ל-10,000 אירועים בשנייה.
הערה: היחס הצפוי בין אבות מיאלואידים LKS+ ל- CD34+ הוא 1:3 עבור עכבר נקבה C57BL/6J בוגר (בן 8-12 שבועות) במצב יציב. מספרי התאים הממוינים הממוקדים מגיעים בדרך כלל תוך 30 דקות מהמיון.
- בקרת איכות וספירה של תאים ממוינים
הערה: שלב זה ייעשה רק במהלך ניסוי הפיילוט לאופטימיזציה של שלבי הכנת הדגימה, במטרה לבדוק את טוהר התאים הממוינים שישמשו לבידוד גרעינים. לאחר אופטימיזציה מלאה של הפרוטוקול, לא מומלץ לבצע שלב בקרת איכות זה בניסויי המעקב כדי למנוע בזבוז מיותר של חומר מוצא שעשוי להיות זמין במספרים נמוכים לבידוד גרעינים.- בקרת טוהר על ידי ציטומטריית זרימה
- העבר 10 μL של התאים הממוינים לתוך צינור FACS חדש המכיל 90 μL של מאגר FACS.
- רכוש ותעד נתונים לאחר המיון כדי לאמת את טוהר המיון ואת הכדאיות. ודא שלפחות 95% מהתאים מופיעים בשער העניין, כפי שהוגדר ב-3-6 וכפי שמודגם באיור 3B.
- בקרת טוהר על ידי ציטומטריית זרימה
- בידוד גרעינים ממח עצם ממוין HSPCs
- השתמש בפרוטוקול "בידוד גרעיני קלט תאים נמוך" של הנספח מתוך פרוטוקול 10X Genomics Proven Protocol - בידוד גרעינים עבור ריצוף ATAC + GEX Multiome של תא בודד (CG000365 - Rev C)27, עם השינויים הבאים שבוצעו כדי לייעל את התאוששות הגרעינים:
- זמן ליזיס: הפעל ניסוי פיילוט עבור פרוטוקול זה כדי לזהות את זמן הליזיס הטוב ביותר לבידוד גרעינים. הקפד להשיג ליזה שלמה של התא תוך שמירה על גרעינים שלמים.
הערה: שלב f של פרוטוקול 10X Genomics27 שהוזכר לעיל מורה "לדגור [במאגר Lysis] במשך 3-5 דקות על קרח". במהלך ניסוי הפיילוט, בדקו לפחות 3 דקות, 4 דקות ו-5 דקות והעריכו את כמות הגרעינים המשוחזרים על ידי ספירה ואיכות על ידי ציטומטריית זרימה והדמיית מיקרוסקופיה כדי לבחור את משך הליזה האופטימלי (ראו תיאור של בדיקות בקרת איכות אלה להלן). כדי לחסוך ריאגנטים, החלף את מאגר הגרעינים המדולל ב- PBS 0.04% BSA בניסוי הפיילוט. עבור מח עצם HSPCs, 3 דקות זוהו כמשך הליזה האופטימלי. - צנטריפוגות תאים: עבור כל הצנטריפוגות התלויות תאים, צנטריפוגה ב 300 x גרם במשך 7 דקות (במקום 5 דקות CG000365 - Rev C)27 ב 4 ° C.
- צנטריפוגות גרעינים: בצע את כל צנטריפוגות תרחיף הגרעינים ב 500 x גרם במשך 5 דקות לפי CG000365 - Rev C27.
- איסוף גרעינים: בשלב b, לאחר השעיה מחדש של 50 μL של PBS 0.04% BSA והעברה לצינור 0.2 מ"ל, הוסף 50 μL של PBS 0.04% BSA לצינור המקורי ותערובת פיפטה כדי לאסוף את שאריות התאים. מעבירים לצינור 0.2 מ"ל כדי להגיע לנפח כולל של 100 מיקרוליטר.
- מעתה, הנפח הכולל יהיה 100 μL במקום 50 μL של הפרוטוקול. התאם את השלבים במורד הזרם בהתאם (לדוגמה, עבור שלב d, הסר 90 μL במקום 45 μL; עבור שלב e, הוסף 90 μL של חיץ ליזיס במקום 45 μL).
- עבור שלב m, השהה מחדש את גלולת הגרעינים ב- 12 μL של מאגר גרעינים מדוללים במקום 7 μL.
- ספרו את הגרעינים המבודדים. לתוך צינור ריק 0.5 מ"ל, להוסיף 10 μL של 0.4% כחול טריפאן ו 8 μL של PBS 0.04% BSA.
- הוסף 2 μL של גרעינים לצינור וספור גרעינים כמתואר ב- 1.3.8. השתמש במונה תאים אוטומטי בהתאם להמלצות הספק.
- זמן ליזיס: הפעל ניסוי פיילוט עבור פרוטוקול זה כדי לזהות את זמן הליזיס הטוב ביותר לבידוד גרעינים. הקפד להשיג ליזה שלמה של התא תוך שמירה על גרעינים שלמים.
- השתמש בפרוטוקול "בידוד גרעיני קלט תאים נמוך" של הנספח מתוך פרוטוקול 10X Genomics Proven Protocol - בידוד גרעינים עבור ריצוף ATAC + GEX Multiome של תא בודד (CG000365 - Rev C)27, עם השינויים הבאים שבוצעו כדי לייעל את התאוששות הגרעינים:
- בקרת טוהר על ידי ציטומטריית זרימה
הערה: שלב זה ייעשה רק במהלך ניסוי הפיילוט לאופטימיזציה של שלבי הכנת הדגימה לבדיקת טוהר הגרעינים שיש לטעון על שבב 10X Chromium. לאחר אופטימיזציה מלאה של הפרוטוקול, לא מומלץ לבצע שלב בקרת איכות זה בניסויי המעקב כדי למנוע בזבוז מיותר של גרעינים שנאספו שעשויים להיות זמינים במספרים נמוכים.- לאחר השלמת בידוד גרעינים, העבירו 6 μL של תרחיף גרעינים בצינור FACS חדש שמולא מראש ב-150 μL של מאגר FACS. מוסיפים 3 μL של 7-AAD ודגרים במשך 5 דקות על קרח.
- רכוש ותעד נתונים לאחר המיון כדי לאמת את טוהר המיון ואת הכדאיות. יש לוודא שלפחות 95% מהגרעינים מופיעים בשער העניין, כהגדרתו בפרוטוקול 1 שלב 4.2 (ראה איור 4).
- בקרת איכות של גרעינים מטוהרים במיקרוסקופיה:
הערה: שלב זה ייעשה רק במהלך ניסוי הפיילוט לצורך אופטימיזציה של שלבי הכנת הדגימה לבדיקת איכות הגרעינים שיש לטעון על שבב 10X Chromium. לאחר אופטימיזציה מלאה של הפרוטוקול, לא מומלץ לבצע שלב בקרת איכות זה בניסויי המעקב כדי למנוע בזבוז מיותר של גרעינים שנאספו שעשויים להיות זמינים במספרים נמוכים.- המשך כמתואר בשלב 1.5.3.
- ביצוע בדיקת מולטיום
- המשך מיד אל Chromium Next GEM Single Cell Multiome ATAC + Gene Expression מדריך למשתמש (CG000338 - Rev F)25.
Representative Results
שני הפרוטוקולים שתוארו לעיל מפרטים את בידודם של גרעינים החל משני סוגים שונים של רקמות. ההבדלים והדמיון בין שני הפרוטוקולים מיוצגים באופן סכמטי באיור 1.
טיהור גרעינים ממוח העכבר
בפרוטוקול המתואר כאן, אנו מציעים שיטה עדינה להכנת גרעינים מדגימות מוח. זה מתחיל בדיסוציאציה מכנית של רקמת המוח במאגר ליזיס, ואחריו שלבי שטיפה וסינון מסננת המסירים את הרקמה הנותרת מהמתלה. ההסרה הבאה של פסולת, תאים שאינם בליזה וחלקיקים קטנים מושגת על ידי FACS כדי להבטיח שרק גרעינים מטוהרים נטענים לפרוטוקול Multiome במורד הזרם. איור 2 מראה את פרופיל הגרעינים לפני ואחרי המיון. לאחר הסינון ולפני מיון הגרעינים, הדגימה מכילה כמות גבוהה של פסולת, כאשר יותר מ-99% מה"סינגלטים" חיוביים לכתם גרעיני (7-AAD), מה שמצביע על ליזה אופטימלית של התא (איור 2A). גרעינים ממוינים על בסיס השער החיובי 7-AAD. חלק קטן של חומר ממוין נרכש כדי לאמת את טוהר הגרעינים המוכנים. איור 2B מראה את הפרופיל של גרעיני המוח לאחר המיון. מיון הגרעינים אפשר עלייה בטוהר הגרעינים מ-36% ראשוניים (איור 2A) לכמעט 100% (איור 2B).
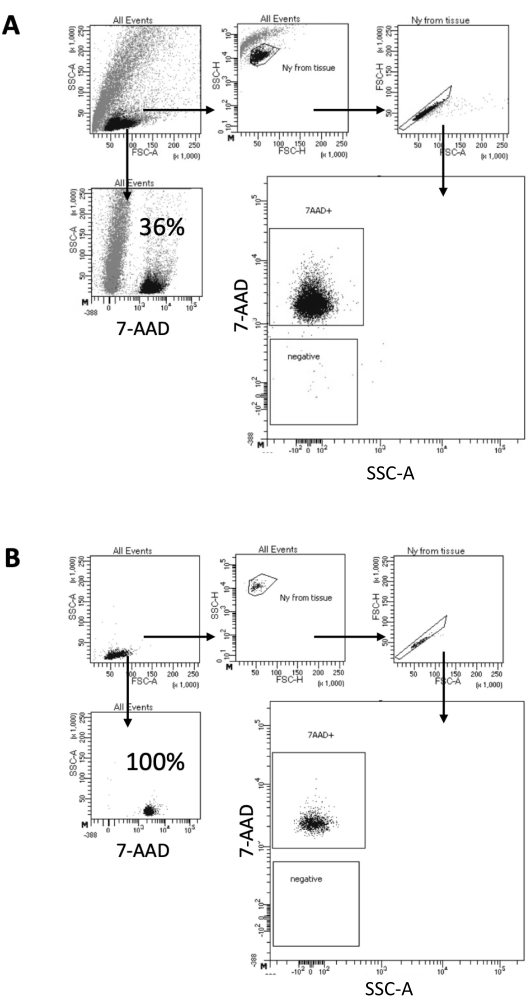
איור 2: אסטרטגיית Gating למיון גרעינים ובדיקת טוהר לאחר מיון. גרעינים הוכתמו ב-7-AAD ונרכשו על ידי ממיין התאים. (A) גרעינים מגודרים תחילה בהתבסס על גודלם וגרעיניותם (FSC-A ו-SSC-A, בהתאמה). חלקיקים בודדים נבחרים לאחר מכן על סמך תכונות FSC-A/FSC-H שלהם וצביעת 7-AAD. (B) לאחר מיון תאים, חלק קטן מהגרעינים מצינור האיסוף נבדק לטוהר באמצעות אותה אסטרטגיית gating כמו ב-A. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טיהור אבות תאי גזע המטופויטיים של מח עצם עכבר (HSPCs)
לאחר הבידוד ממח העצם, עד 2 x 105 HSPCs ממוינים לפי FACS, בהתאם לאסטרטגיית ה-gating שמוצגת באיור 3A. יעילות המיון וטוהר הדגימה מוערכים (איור 3B).
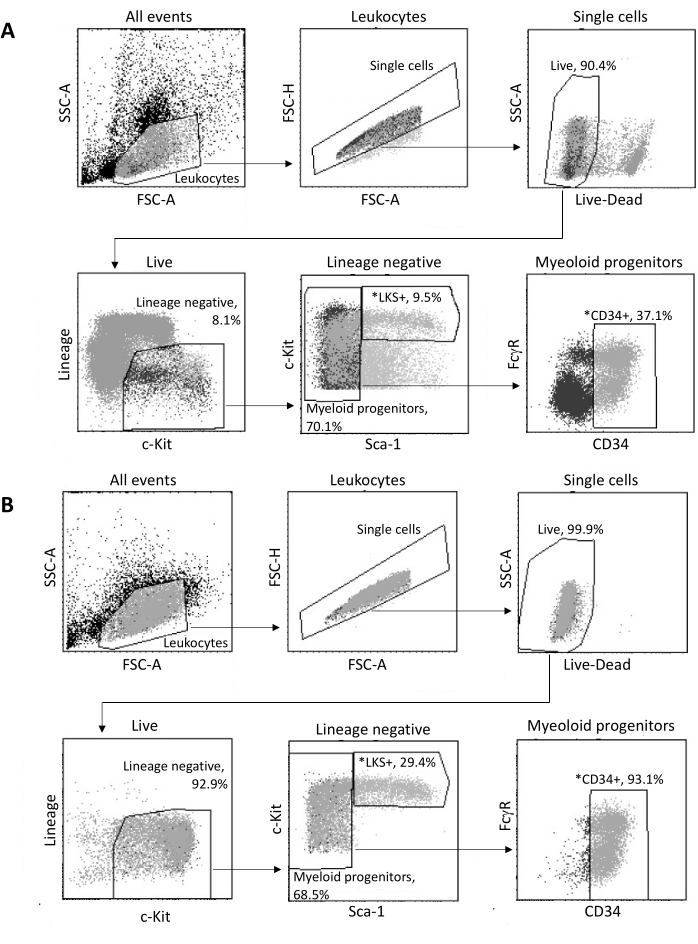
איור 3: אסטרטגיית Gating למיון מח עצם HSPCs. (A) אסטרטגיית FACS gating מייצגת למיון תאי גזע המטופויטיים בני קיימא LKS+ ואבות מיאלואידים CD34+ לבידוד גרעינים. (B) חלקות FACS מייצגות המשמשות לאימות טוהר אוכלוסיית תאים ממוינים. מוצגים הפרופורציות של תת-קבוצות תאים שונות ביחס לאוכלוסיית האב. *שתי האוכלוסיות הממוינות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
פרוטוקול "בידוד גרעיני קלט תאים נמוך" מאפשר בידוד גרעינים מדגימות עם מקסימום של 105 תאים. הוא כולל מספר נמוך של שלבי צנטריפוגה, ובכך ממזער את אובדן התא/גרעינים. התאמנו את נפח הליזה ומאגרי השטיפה באופן פרופורציונלי לקלט התא והגדלנו את זמן הצנטריפוגה להתאוששות גרעינים מקסימלית. ביצענו ניסוי פיילוט להערכת כמות הגרעינים המשוחזרים על ידי ספירה ואיכותם על ידי ציטומטריית זרימה והדמיית מיקרוסקופיה. איור 4 מראה את דגימת HSPCs לאחר ליזה של תאים. פרוטוקול זה יצר גרעינים באיכות גבוהה, כפי שנצפה באיור 5A, ללא פסולת שיכולה להשפיע על פרוטוקול המולטיומה במורד הזרם.
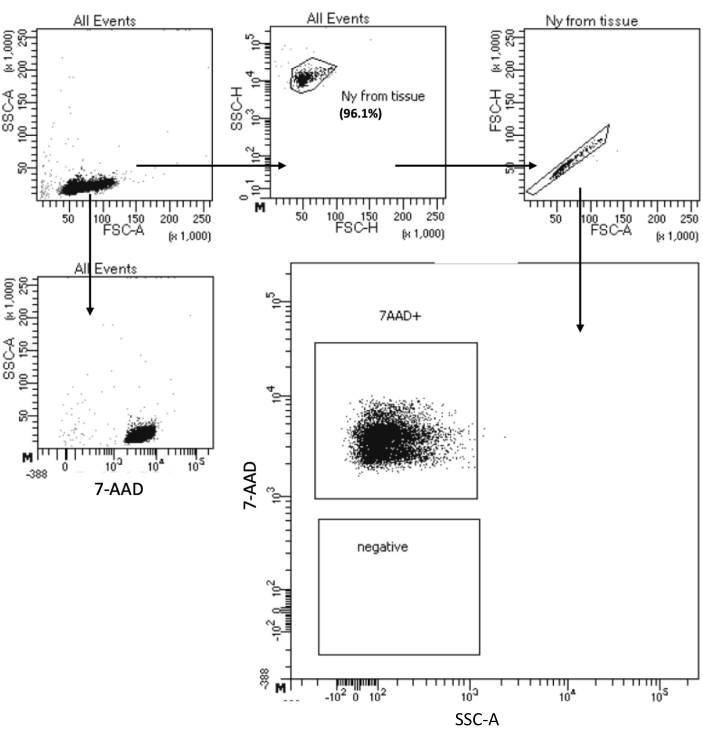
איור 4: מיון בדיקת טוהר של גרעיני HSPC מבודדים של מח עצם. גרעינים הוכתמו ב-7-AAD ונרכשו על ידי ממיין התאים. גרעינים גודרו תחילה על סמך גודלם וגרעיניותם (FSC-A ו-SSC-A, בהתאמה) כדי להעריך את טוהר הדגימה. חלקם של הגרעינים מצוין ביחס לאוכלוסיית ההורים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| מספר צינור | שם הצינור | ישות מוכתמת | כמות הישות המוכתמת | נוגדן/צבע (μL) | מאגר איסוף (μL) |
| 1 | לא מוכתם | תאים | 5,00,000 | לא ישים | 200 |
| 2 | LIVE/DEAD כתם תא מת אקווה ניתן לתיקון | תאים | 5,00,000 | 0.5 | |
| 3 | APC/ציאנין 7 נגד עכבר CD16/32 (FcγR) | OneComp eBeads | 15 מיקרוליטר | 1 | |
| 4 | קוקטייל שושלת נגד עכברים כחול פסיפי | OneComp eBeads | 15 מיקרוליטר | 1 | |
| 5 | PE נגד עכבר Ly-6A/E (Sca-1) | OneComp eBeads | 15 מיקרוליטר | 1 | |
| 6 | APC נגד עכבר CD117 (c-Kit) | OneComp eBeads | 15 מיקרוליטר | 1 | |
| 7 | FITC נגד עכבר CD34 | OneComp eBeads | 15 מיקרוליטר | 1 |
טבלה 1: פקדי כתם יחיד להגדרות פיצוי בציטומטר הזרימה. מסומנים פקדי הכתם היחיד הנדרשים, מספר התאים או החרוזים שיש להכתים וכמויות הנוגדנים.
| מאסטר מיקס | מגיב | דילול סופי | נוגדן/צבע (μL) | סוג מאגר | חיץ (μL) |
| ערבוב 1 | APC/ציאנין 7 נגד עכבר CD16/32 (FcγR) | 1/500 | 1.2 | DPBS | 300 |
| LIVE/DEAD כתם תא מת אקווה ניתן לתיקון | 1/250 | 2.4 | |||
| מיקס 2 | קוקטייל שושלת נגד עכברים כחול פסיפי | 1/20 | 30 | מאגר FACS | 300 |
| PE נגד עכבר Ly-6A/E (Sca-1) | 1/200 | 3 | |||
| APC נגד עכבר CD117 (c-Kit) | 1/200 | 3 | |||
| FITC נגד עכבר CD34 | 1/50 | 12 | |||
| נפח צביעה כולל | 600 |
טבלה 2: הרכב תערובת הצביעה עבור מח עצם HSPCs. מוצגים נפחים של ריאגנטים הדרושים לצביעה של דגימה אחת המכילה 40 מיליון תאים. לצביעת מספר גדול יותר של דגימות, הכפילו את הנפח המצוין במספר הדגימות הנדרש והוסיפו חצי מנפח הדגימה הנוסף כדי להבטיח נפח מספיק של תערובת האב.
איור משלים 1: פרוטוקול בידוד תאי מח עצם. (A) פתח את הצפק. קווים לבנים מנוקדים מציינים את הקו שיש לחתוך לאורכו. (B) לאחר קילוף העור מהרגל האחורית, רפדו את המספריים לאורך עמוד השדרה במפרק הירך כדי לחתוך את הרגל מבלי לחתוך דרך עצם הירך. (C) מראה הרגל המופרדת מהגוף לפני הסרת השריר. (D) הופעת הרגל לאחר הסרת שריר. (ה) הליך הפרדת עצם הירך במפרק הברך, ולאחר מכן במפרק הירך, תוך הקפדה שלא לפתוח את עצם הירך. חצים לבנים מעוקלים מציגים את התנועה הנדרשת. חצים לבנים מנוקדים מציינים את האזור שיש להפריד בעדינות באמצעות מספריים כדי לצבוט. (F) הליך לפתיחת החלק הדיסטלי של עצם הירך (כלומר, החלק שהיה מחובר בעבר לשוקה, במפרק הברך) על ידי אחיזה בטוחה בסחוס ובאפיפיזה דיסטלית עם מספריים והפיכתו לאחור כדי לחשוף את מח העצם. (G) ארבע בליטות, המסומנות בחצים שחורים, צריכות להיראות בקצה הפיזי החשוף. (H) מראה של עצם הירך כאשר הקצה הפתוח פונה כלפי מטה לתוך צינור 0.5 מ"ל מוכן הממוקם בתוך צינור 1.5 מ"ל המכיל 150 μL של חיץ FACS. (I) הופעתם של תאי מח העצם הכדוריים ועצם הירך הלבנה לאחר צנטריפוגה מהירה במהירות של 12,000 x גרם. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
הכנת תרחיף תאים או גרעינים באיכות גבוהה היא בעלת חשיבות מכרעת להצלחה של RNA-Seq חד-תאי או חד-גרעיני ואנליזות רב-אומיות חד-תאיות 29,30,31. במאמר זה תיארנו פרוטוקולים להכנת דגימות ובידוד גרעינים לבדיקות מולטיום משני סוגי רקמות: מוח ומח עצם.
פרוטוקול המוח המתואר במאמר זה מאפשר התאוששות של גרעינים באיכות גבוהה מרקמת מוח טרייה וקפואה. הוא כולל את השלבים הבאים: הפרעה לרקמות קפואות, בידוד גרעינים, טיהור גרעינים ובקרת איכות של החומר המוכן. רקמת המוח מורכבת מסוגי תאים רבים ושונים, והליך הדיסוציאציה של הרקמה ובידוד הגרעינים אמור לשמר את הפרופורציות של אוכלוסיות התאים כפי שהן קיימות ברקמה הראשונית. כאן, הרכב חיץ הליזה וזמן הדגירה הותאמו כדי לאפשר ליזה מלאה ועדינה של כל אוכלוסיות התאים המרכיבות את הרקמה.
פרוטוקול HSPCs של מח העצם שונה במקצת, שכן הוא דורש צעד נוסף בתחילת הניסוי כדי לבודד את אוכלוסיית התאים המעניינת מתרחיף תאי הטרוגני. לאחר איסוף של רקמה טרייה, תאי דם אדומים הם lysed, ואת הדגימה מועשר עבור תת קבוצה התא של עניין. התאים הממוקדים עוברים ליזה, הגרעינים מבודדים ואיכות החומר המוכן מבוקרת.
10X Genomics מספקת מספר פרוטוקולים מאומתים לבידוד גרעינים ברקמות רבות ושונות32,33. החברה גם ממסחרת ערכת בידוד גרעינים עם צנרת פשוטה לבידוד גרעינים מרקמותמאומתות 34. עם זאת, פרוטוקולים אלה זקוקים לאופטימיזציה נוספת כדי להתאים את המאפיינים של דגימות מסוימות. דוגמה לכך היא הדגימות הדורשות עבודה עם קלט תאים נמוך. עבור דגימות אלה, השלבים המאתגרים ביותר הם צנטריפוגות שצריכות להיות מחמירות מספיק כדי לנקות את הדגימה ועדינות מספיק כדי למנוע אובדן תא/גרעינים. עם הפרוטוקול המתואר כאן, התאמנו את 10X Genomics Demonstrated Protocol - בידוד גרעינים עבור Multiome ATAC + GEX Sequencing (CG000365 - Rev C)27 כדי למצוא איזון עדין בין שתי הדרישות הללו. כפי שהודגם בדוגמה של הכנת גרעינים מ-HSPCs ממוינים, שיפרנו את התאוששות הגרעינים ללא השפעה על איכות הדגימה.
אתגר נוסף הוא שלב הליזה של תאים מטוהרים לבידוד גרעינים. תנאי ליזה קשים יותר וזמני דגירה ארוכים יותר עלולים לפגוע בגרעינים ובכך להשפיע על איכות נתוני הריצוף. איור 5 מראה דימות גרעינים מייצג מדגימות מח עצם בזמני דגירה שונים עם חיץ ליזיס, ומדגים עד כמה שונה יכול להיות מצב הגרעינים בהתאם לליזה של התא. בדוגמה של HSPCs, זיהינו ליזה של 3 דקות כמצב שמביא לשיעור הגבוה ביותר של גרעינים בריאים למראה ושלמים ולשיעור הנמוך ביותר של גרעינים פגומים. זמני הדגירה של ליזיס צריכים להיות אופטימליים עבור כל סוג חדש של דגימה.
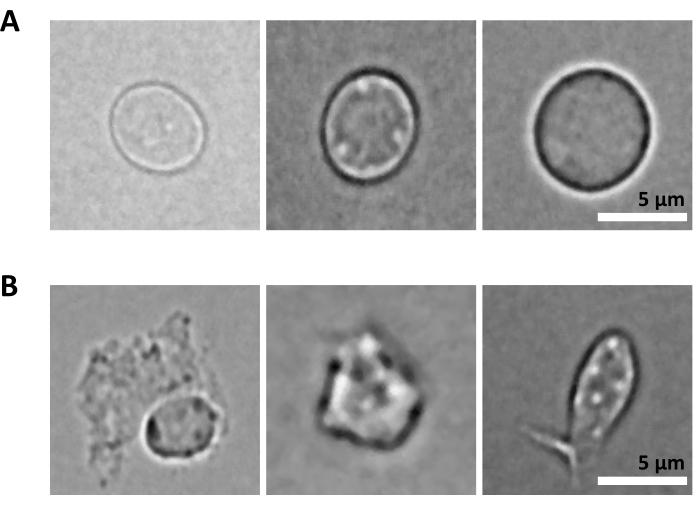
איור 5: בקרת איכות גרעינים באמצעות מיקרוסקופיה. מוצגות תמונות שדה בהיר מייצגות של גרעינים מבודדים ממח עצם עכבר עם (A) שלמים ו-(B) גרעינים פגומים. סרגל קנה מידה 5 מיקרומטר. התמונות צולמו במיקרוסקופ הפוך באמצעות מטרה 40x ELWD NA 0.60 וזום דיגיטלי 1.5x. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
שני הפרוטוקולים המפורטים בעבודה זו מסתמכים על טיהור תאים או גרעינים ממוקדים על ידי מכשירי FACS בעלי תפוקה גבוהה. שלב זה הוא בעל חשיבות מכרעת עבור פרוטוקולי הכנה של תא יחיד/גרעינים שבהם יש לבודד תת-קבוצות נדירות של תאים מתרחיפים הטרוגניים. באלה, כמו בדוגמה המוצגת כאן עבור מיון HSPCs, ייתכן שיהיה צורך בלוח ציטומטריית זרימה בעל ממד גבוה כדי לאפשר "גיטוט" על אוכלוסיית התאים המעניינים. המיון מהיר ומדויק ביותר, ומוביל לטוהר של מעל 95% של תת-קבוצות התאים הממוינות. גישה זו חושפת את התרחיף התאי ללחץ של עד 70 psi ולכן עשויה להיות מגבילה למיון תאים שבירים (למשל, תאים דנדריטיים, נויטרופילים) מכיוון שהיא עלולה לגרום לקרע בקרום התא שלהם. במקרים אלה, יש לבחור פתרונות חלופיים לטיהור תאים, כולל מיון מגנטי, יישום של מכשירים מהדור החדש (למשל, CellenOne, Cellenion; MACSQuant Tyto, Miltenyi)35,36, או מערכות מבוססות טיפות (למשל, ODIN, Sensific)37. עם זאת, מהירות המיון האיטית של טכנולוגיות אלה, עם מיון תאים שנמשך שעות במקום דקות, היא גורם מגביל חזק ליישום גישות אלה בהכנת תאים בני קיימא עבור Multiome ויישומים חד-תאיים אחרים המבוססים על ניתוח של מספרי תאים גדולים.
לטיהור גרעינים מבודדים מהרקמה, FACS היא שיטת הבחירה בשל התפוקה שלה ואת טוהר החומר המבודד. גרעינים אינם רגישים ללחץ, וניתן לטהר בקלות רקמות מסוננות באמצעות ממיין התא. אם המעבדה אינה מצוידת במכשיר FACS, קיימות חלופות אחרות, קצת פחות יעילות אך טובות מספיק. דוגמאות לכך כוללות אולטרה-צנטריפוגה או שימוש בציוד קטן כגון MARS (Applied Cell) המפריד חלקיקים על סמך ההבדל בגודלם, באמצעות גלים אקוסטיים; מכונת כביסה למינרית CURIOX המשתמשת בתכונות הידרופוביות של מתלי תאים/גרעינים; או LEVITAS bio המסתמך על תכונות פיזיקליות של תאים (ריחוף) כדי להפריד אותם מן הפסולת.
כאן, אנו מתארים פרוטוקולים להשגת מספר גבוה של גרעינים ואת הטוהר הטוב ביותר עבור פרוטוקול Multiome במורד הזרם. מיון FACS ושלבי צנטריפוגה חוזרים ונשנים גורמים לאובדן משמעותי של החומר הראשוני. מסיבה זו, בפרוטוקול להכנת גרעינים מהמוח שאנו מתארים כאן דורש חומר מוצא בשפע מספיק כדי להביא לאיסוף של לפחות 500,000 גרעינים לאחר מיון FACS. יש ליישם פרוטוקולים חלופיים אם לא ניתן להתאים קריטריון זה. כאשר עובדים עם אוכלוסיות תאים נדירות או חלקי רקמות קטנות, הכמות הזמינה של החומר הראשוני יכולה להיות גורם מגביל. כדי לטפל בבעיה זו, ניתן לשפר את התאוששות הגרעינים על ידי (א) הפחתת נפח הליזה, (ב) הפחתת נפח הכביסה, (ג) שימוש בשטיפה אחת עם זמן צנטריפוגה ממושך כדי לנסות לשפר את ההתאוששות כפי שמצוין בפרוטוקולי גנומיקה 10X לבידוד גרעיני קלט תאים נמוך. לניתוח מולטיומי של חומר בעל תוכן נמוך, כדאי לשקול יישומים מבוססי לוחות כגון scNMT, SNARE-seq ו- Paired-seq38 הדורשים הרבה פחות דגימות קלט.
לסיכום, תיארנו שני פרוטוקולים חזקים להכנת גרעינים מהמוח ומח עצם HSPCs לניתוח מולטיומים במורד הזרם. פרוטוקולים אלה ישימים בכל פרויקט מדעי הדורש תרחיפים באיכות גבוהה של גרעינים בודדים משני סוגי רקמות אלה, ללא קשר לשאלה המדעית שהוצגה. הקבוצה שלנו מיישמת את פרוטוקול בידוד גרעיני המוח במחקרים על התפתחות המוח עם השבתה של גנים ממוקדים שונים ובמחקרים על תגובה חיסונית בהקשר של מחלות נוירולוגיות. אנו משתמשים בפרוטוקול בידוד גרעיני מח עצם לפענוח השתתפותן של תת-אוכלוסיות המטופויטיות שונות בהקמת מערכת החיסון.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנה ג'מין צ'וי נתמכה על ידי מלגה מתוכנית הדוקטורט הבינלאומית של פסטר - אוניברסיטת פריז (PPU).
Materials
| Name | Company | Catalog Number | Comments |
| 18 G x 1 ½ (1.2 mm x 38 mm) Agani needles | Terumo | AN*1838S1 | |
| 15 mL tubes | Falcon | 352097 | |
| 5 mL round bottom FACS tube with cell strainer cap 35 µm | falcon | 352235 | |
| 50 mL tubes | Falcon | 352070 | |
| 7-AAD | BD pharmagen | 559925 | |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| APC anti-mouse CD117 (c-Kit) | BioLegend | 105812 | Clone: 2B8 |
| APC/Cyanine 7 anti-mouse CD16/32 (FcγR) | BioLegend | 101328 | Clone: 93 |
| BD FACSAria III | BD Biosciences | non-applicable | |
| BD FACSDiva Software v8.0.1 | BD Biosciences | non-applicable | |
| Bovine Serum Albumin stock solution 10% | Miltenyi Biotec | 130-091-376 | |
| Cell staining buffer | Biolegend | 420201 | |
| CFI Suprplan Fluor ELWD 40XC ON 0.6 | Nikon | non-applicable | |
| CMOS camera Prime 95B 25 mm | Photometrix | non-applicable | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | |
| Countess cell counting chamber slide | Invitrogen | C10283 | |
| Coverglass 24 mm x 24 mm 0.13-0.17 mm | Brand | BR470819 | |
| Digitonine 5% | Invitrogen | BN2006 | |
| Disposable Scalpels | Swann-Morton | 0508 | |
| DMEM (1x) + GlutaMAX-I | Gibco | 31966-021 | |
| DPBS (10x) | Gibco | 14200-067 | |
| DTT | Sigma aldrich | 646563 | |
| Epifluorescence inverted microscope Nikon Ti2 -E | Nikon | non-applicable | |
| Eppendorf Safe-Lock Tubes 0.5 mL | Eppendorf | 30123603 | |
| Ethanol 70% | VWR | 83801.290 | |
| FITC anti-mouse CD34 | Invitrogen | 11-0341-85 | Clone: RAM34 |
| Forceps for dissection | FST | 11152-10 | |
| Heat-inactivated Fetal Bovine Serum (FBS) | Gibco | 11533387 | |
| Dounce Homogeniser 2 mL | Bellco glass | 1984-10002 | Pestle “A” Large Clearance: .0030-.0050″ and Pestle “B” Small Clearance: .0005-.0025″ |
| LIVE/DEAD fixable aqua dead cell stain kit | Invitrogen | L34957 | |
| Magnesium chloride solution 1 M | Sigma aldrich | M1028 | |
| Microcentrifuge | Eppendorf | 5424R | |
| Mounting medium Fluoromount-G | invitrogen | 00-4958-02 | |
| Nonidet P40 substitute | Sigma aldrich | 74385 | |
| Nuclease free water | ThermoFischer | AM9932 | |
| Nuclei buffer 20x | 10X Genomics | 2000153/2000207 | |
| Nuclei isolation kit EZ prep | Sigma Aldrich | NUC-101 | |
| OneComp eBeads compensation beads | Invitrogen | 01-1111-41 | |
| Pacific Blue anti-mouse lineage cocktail (including anti-mouse CD3, Ly-6G/Ly-6C, CD11b, CD45R/B220, TER-119) | BioLegend | 133310 | Clones (in the same order as the antibodies listed): 17A2, RB6-8C5, M1/70, RA3-6B2, Ter-119 |
| PCR Tube Strips 0.2 mL | Eppendorf | 951010022 | |
| PE anti-mouse Ly-6A/E (Sca-1) | BioLegend | 122507 | Clone: E13-161.7 |
| Petri dish 100 mm x 20 mm OPTILUX | Falcon | 353003 | |
| Ply-L-lysine 0.01% sterile-filtered suitable for cell culture | Sigma | P4707 | |
| Printed microscope slides 8 well 6 mm numbered | Epredia | ER-301B-CE24 | |
| Protein LoBind Tubes 1.5 mL | Eppendorf | 30108116 | |
| Recombinant Rnase inhibitor 5000 U | Takara | 2313A | |
| Scissors for dissection | FST | 14090-09 | |
| Sodium chloride solution 5 M | Sigma aldrich | 59222C | |
| Syringe filters, PES, 0.2 µm | Fisher Scientific | 15206869 | |
| Transparent nail polish | any | non-applicable | |
| Trizma Hydrochloride solution pH 7.4 | Sigma aldrich | T2194 | |
| Trypan Blue 0.4% | gibco | 15250061 | |
| Tween 20 | Biorad | 1662404 | |
| UltraPure Distilated Water Dnase/Rnase Free | Invitrogen | 10977-035 |
References
- Clark, S. J., et al. scNMT-seq enables joint profiling of chromatin accessibility DNA methylation and transcription in single cells. Nature Communications. 9 (1), 781 (2018).
- Lee, J., Hyeon, D. Y., Hwang, D. Single-cell multiomics: technologies and data analysis methods. Experimental & Molecular Medicine. 52 (9), 1428-1442 (2020).
- Cerrizuela, S., et al. High-throughput scNMT protocol for multiomics profiling of single cells from mouse brain and pancreatic organoids. STAR Protocols. 3 (3), 101555 (2022).
- Dimitriu, M. A., Lazar-Contes, I., Roszkowski, M., Mansuy, I. M. Single-cell multiomics techniques: From conception to applications. Frontiers in Cell and Developmental Biology. 10, 854317 (2022).
- Stoeckius, M., et al. Simultaneous epitope and transcriptome measurement in single cells. Nature Methods. 14 (9), 865-868 (2017).
- Cao, J., et al. . Joint profiling of chromatin accessibility and gene expression in thousands of single cells. 361 (6409), 1380-1385 (2018).
- Narayanan, A., et al. Nuclei Isolation from Fresh Frozen Brain Tumors for Single-Nucleus RNA-seq and ATAC-seq.Journal of Visualized Experiments. JoVE. 162, 61542 (2020).
- Kim, M., et al. Single-nucleus transcriptomics reveals functional compartmentalization in syncytial skeletal muscle cells. Nature Communications. 11 (1), 6375 (2020).
- Santos, M. D., et al. Extraction and sequencing of single nuclei from murine skeletal muscles. STAR Protocols. 2 (3), 100694 (2021).
- Safabakhsh, S., et al. Isolating nuclei from frozen human heart tissue for single-nucleus RNA sequencing. Current Protocols. 2 (7), (2022).
- Lau, S. -. F., Cao, H., Fu, A. K. Y., Ip, N. Y. Single-nucleus transcriptome analysis reveals dysregulation of angiogenic endothelial cells and neuroprotective glia in Alzheimer's disease. Proceedings of the National Academy of Sciences of the United States of America. 117 (41), 25800-25809 (2020).
- Armand, E. J., Li, J., Xie, F., Luo, C., Mukamel, E. A. Single-cell sequencing of brain cell transcriptomes and epigenomes. Neuron. 109 (1), 11-26 (2021).
- Morabito, S., et al. Single-nucleus chromatin accessibility and transcriptomic characterization of Alzheimer's disease. Nature Genetics. 53 (8), 1143-1155 (2021).
- Chen, S., et al. Spatially resolved transcriptomics reveals genes associated with the vulnerability of middle temporal gyrus in Alzheimer's disease. Acta Neuropathologica Communications. 10 (1), (2022).
- Paul, F., et al. Transcriptional heterogeneity and lineage commitment in myeloid progenitors. Cell. 163 (7), 1663-1677 (2015).
- Kaufmann, E., et al. BCG educates hematopoietic stem cells to generate protective innate immunity against tuberculosis. Cell. 172 (1-2), 176-190 (2018).
- Christ, A., et al. diet triggers NLRP3-dependent innate immune reprogramming. Cell. 172 (1-2), 162-175 (2018).
- Moorlag, S. J. C. F. M., et al. β-Glucan Induces protective trained immunity against mycobacterium tuberculosis infection: A key role for IL-1. Cell Reports. 31 (7), 107634 (2020).
- de Laval, B., et al. C/EBPβ-dependent epigenetic memory induces trained immunity in hematopoietic stem cells. Cell Stem Cell. 26 (5), 657-674 (2020).
- Renthal, W., et al. Characterization of human mosaic Rett syndrome brain tissue by single-nucleus RNA sequencing. Nature Neuroscience. 21 (12), 1670-1679 (2018).
- Yang, A. C., et al. A human brain vascular atlas reveals diverse mediators of Alzheimer's risk. Nature. 603 (7903), 885-892 (2022).
- Lee, D. R., Zhang, Y., Rhodes, C. T., Petros, T. J. Generation of single-cell and single-nuclei suspensions from embryonic and adult mouse brains. STAR Protocols. 4 (1), 101944 (2022).
- Corces, M. R., et al. Lineage-specific and single-cell chromatin accessibility charts human hematopoiesis and leukemia evolution. Nature Genetics. 48 (10), 1193-1203 (2016).
- Ranzoni, A. M., et al. Integrative single-cell RNA-seq and ATAC-seq analysis of human developmental hematopoiesis. Cell Stem Cell. 28 (3), 472-487 (2021).
- . 10X Genomics Chromium Next GEM Single Cell Multiome ATAC + Gene Expression User Guide. Document Number CG000338 Rev F. At. , (2022).
- J, , et al. Microdissection of mouse brain into functionally and anatomically different regions. Journal of Visualized Experiments: JoVE. 168, 61941 (2021).
- . . 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation for Single Cell Multiome ATAC + GEX sequencing (CG000365 - Rev C). At. , (2022).
- Haag, S., Murthy, A. Murine monocyte and macrophage culture. Bio-Protocol. 11 (6), (2021).
- Haque, A., Engel, J., Teichmann, S. A., Lönnberg, T. A practical guide to single-cell RNA-sequencing for biomedical research and clinical applications. Genome Medicine. 9 (1), (2017).
- Jiang, P. Quality control of single-cell RNA-seq. Methods in Molecular Biology. , 1-9 (1935).
- Regan, C., Preall, J. Practical considerations for single-cell genomics. Current Protocols. 2 (8), (2022).
- . . 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation for Single Cell ATAC Sequencing (CG000169 - Rev E). At. , (2022).
- . 10X Genomics 10X Genomics Demonstrated Protocol - Nuclei Isolation from Complex Tissues for Single Cell Multiome. ATAC + Gene Expression Sequencing. (CG000375 - Rev C). At. , (2022).
- . . 10X Genomics 10X Genomics - Chromium Nuclei Isolation Kit (CG000505 - Rev A). AT. , (2022).
- Shomroni, O., et al. A novel single-cell RNA-sequencing approach and its applicability connecting genotype to phenotype in ageing disease. Scientific Reports. 12 (1), 4091 (2022).
- Ocañas, S. R., Pham, K. D., Blankenship, H. E., Machalinski, A. H., Chucair-Elliott, A. J., Freeman, W. M. Minimizing the ex vivo confounds of cell-isolation techniques on transcriptomic and translatomic profiles of purified microglia. 9 (2), 0348-0321 (2022).
- Gérard, A., et al. High-throughput single-cell activity-based screening and sequencing of antibodies using droplet microfluidics. Nature Biotechnology. 38 (6), 715-721 (2020).
- Vandereyken, K., Sifrim, A., Thienpont, B., Voet, T. Methods and applications for single-cell and spatial multi-omics. Nature Reviews. Genetics. 24, 494-515 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved