Morfogênese Tridimensional em Intestino Canino Utilizando Organoides Intestinais Derivados de Pacientes com Doença Inflamatória Intestinal
In This Article
Summary
A integração de organoides intestinais caninos e um sistema microfluídico Gut-on-a-Chip oferece modelos translacionais relevantes para doenças intestinais humanas. Os protocolos apresentados permitem a morfogênese 3D e a modelagem dinâmica in vitro do intestino, auxiliando no desenvolvimento de tratamentos eficazes para doenças intestinais em cães e humanos com o One Health.
Abstract
Os intestinos caninos possuem semelhanças em anatomia, microbiologia e fisiologia com os dos humanos, e os cães desenvolvem naturalmente distúrbios intestinais espontâneos semelhantes aos humanos. A superação da limitação inerente dos organoides tridimensionais (3D) no acesso à superfície apical do epitélio intestinal levou à geração de culturas bidimensionais (2D) monocamadas, que expõem a superfície luminal acessível usando células derivadas dos organoides. A integração desses organoides e culturas de monocamadas derivadas de organoides em um sistema microfluídico Gut-on-a-Chip evoluiu ainda mais a tecnologia, permitindo o desenvolvimento de modelos intestinais dinâmicos in vitro fisiologicamente mais relevantes.
Neste estudo, apresentamos um protocolo para geração de morfogênese 3D do epitélio intestinal canino utilizando amostras de tecido intestinal primário obtidas de cães acometidos por doença inflamatória intestinal (DII). Também delineamos um protocolo para geração e manutenção de culturas de monocamada 2D e sistemas intestino-em-um-chip usando células derivadas dos organoides intestinais 3D. Os protocolos apresentados neste estudo servem como uma estrutura fundamental para o estabelecimento de um sistema microfluídico Gut-on-a-Chip projetado especificamente para caninos. Ao lançar as bases para essa abordagem inovadora, pretendemos expandir a aplicação dessas técnicas na pesquisa biomédica e translacional, alinhando-se aos princípios da One Health Initiative. Utilizando esta abordagem, podemos desenvolver modelos dinâmicos in vitro fisiologicamente mais relevantes para o estudo da fisiologia intestinal em cães e humanos. Isso tem implicações significativas para aplicações biomédicas e farmacêuticas, pois pode auxiliar no desenvolvimento de tratamentos mais eficazes para doenças intestinais em ambas as espécies.
Introduction
A morfogênese epitelial intestinal tem sido amplamente estudada por meio de modelos animais de laboratório, que são dispendiosos, demorados e não representam com precisão os processos de desenvolvimentohumano1. Além disso, os modelos convencionais estáticos de cultura de células 2D não têm a capacidade de mimetizar a complexa organização espacial de uma arquitetura epitelial 3D2. Como resultado, há a necessidade de um protocolo para induzir morfogênese 3D in vitro usando células epiteliais intestinais de modelos animais relevantes para humanos para avançar nossa compreensão da arquitetura epitelial intestinal.
Cães de companhia desenvolveram anatomia intestinal e composições do microbioma que são notavelmente semelhantes aos humanos devido ao seu ambiente e dieta compartilhados durante a domesticação3. Além dessa semelhança, tanto humanos quanto cães compartilham várias morbidades crônicas que se acredita serem atribuídas à saúde intestinal. Cães, assim como humanos, podem desenvolver espontaneamente condições crônicas como obesidade, disfunção cognitiva, diabetes mellitus, doença inflamatória intestinal (DII) e adenocarcinoma colorretal4,5,6,7,8,9,10. Apesar do desenvolvimento e uso de células epiteliais humanas e murinas em estudos prévios de Gut-on-a-Chip 2,11,12,13,14, o epitélio intestinal canino não tem sido utilizado até o momento. Nossa nova abordagem, utilizando epitélio organoide intestinal canino em um sistema de cultura dinâmico com morfogênese epitelial 3D, tem implicações significativas para a medicina canina e humana.
Avanços recentes na cultura de organoides intestinais levaram ao estabelecimento da cultura de organoides intestinais caninos15. Esse sistema de cultura envolve a cultura de células-tronco intestinais sob condicionamento morfogênico definido, resultando em um modelo 3D com propriedades auto-renovadoras derivadas de células-troncoadultas16. No entanto, a realização de ensaios de transporte ou coculturas hospedeiro-microbioma apresenta dificuldades com esse modelo 3D devido à natureza fechada do lúmen intestinal17. Para resolver isso, pesquisadores geraram uma monocamada 2D derivada de organoides intestinais, permitindo a exposição da superfície luminal18,19. No entanto, tanto organoides 3D quanto monocamadas 2D são mantidos sob condições estáticas, que não refletem com precisão a biomecânica in vivo do microambiente intestinal. A combinação da tecnologia de organoides caninos derivados de pacientes com morfogênese 3D in vitro apresenta uma oportunidade para a pesquisa translacional em doenças crônicas multifatoriais. Essa abordagem permite que os pesquisadores desenvolvam tratamentos mais eficazes beneficiando humanos e cães e avancem ainda mais a pesquisa translacional, alinhando-se com a One Health Initiative, que é uma abordagem colaborativa que reconhece a interconexão da saúde humana, animal e ambiental. Promove a cooperação interdisciplinar para enfrentar desafios complexos de saúde e alcançar resultados de saúde ideais para todos. Ao compreender as interdependências entre humanos, animais e ecossistemas, a iniciativa visa mitigar os riscos de doenças infecciosas emergentes, degradação ambiental e outras preocupações de saúde compartilhadas20,21,22.
Este protocolo descreve métodos abrangentes para a cultura de células epiteliais intestinais caninas obtidas de organoides de pacientes em um microdispositivo Gut-on-a-Chip com uma membrana porosa baseada em polidimetilsiloxano (PDMS). Estabelecer a morfogênese epitelial 3D integrando organoides intestinais caninos e esta tecnologia Gut-on-a-Chip nos permite estudar como o intestino se desenvolve e mantém sua organização celular e nicho de células-tronco. Esta plataforma oferece uma oportunidade valiosa para investigar o impacto das comunidades do microbioma na saúde intestinal e entender como essas comunidades geram metabólitos microbianos que contribuem para a fisiopatologia intestinal14,23. Esses avanços agora podem ser estendidos a amostras intestinais caninas, fornecendo aos pesquisadores oportunidades de explorar a intrincada relação entre o microbioma intestinal e a fisiologia do hospedeiro. Isso abre caminhos para obter informações valiosas sobre os mecanismos subjacentes da fisiopatologia intestinal e compreender o papel potencial dos metabólitos microbianos na saúde canina e humana, bem como em várias condições de doenças. O protocolo utilizado para o Gut-on-a-Chip canino é reprodutível, tornando-o um modelo experimental adequado para medicina comparativa, uma vez que esta abordagem permite a investigação de interações hospedeiro-microbioma, infecções por patógenos e efeitos terapêuticos baseados em probióticos em cães e humanos.
Protocol
O estudo foi aprovado e conduzido de acordo com o Institutional Animal Care and Use Committee da Washington State University (ASAF# 6993). Nesse protocolo, utilizamos um dispositivo microfluídico Gut-on-a-Chip bem estabelecido feito de PDMS, que foi fabricado internamente2 (Figura 1D). Métodos detalhados de fabricação do microdispositivo Gut-on-a-Chip podem ser encontrados em relatos anteriores 2,24. Este protocolo demonstra uma integração única de organoides intestinais e um sistema microfluídico (Figura 2).
1. Ativação superficial de um Gut-on-a-Chip feito de PDMS
- Preparar a solução de polietilenoimina (PEI) a 1% adicionando 1 ml de solução de PEI a 50% em 49 ml de água destilada (DI) num tubo cónico de 50 ml. Inverta o tubo duas a três vezes para misturar bem a solução e, em seguida, filtre a solução utilizando um filtro de seringa de 0,2 μm.
NOTA: Mantenha-o armazenado a 4 °C. - Preparar solução de glutaraldeído (GA) a 0,1% adicionando 100 μL de solução de GA a 50% em 49,9 mL de DI em um tubo cônico de 50 mL. Inverta o tubo duas a três vezes para misturar bem a solução e, em seguida, filtre a solução utilizando um filtro de seringa de 0,2 μm.
NOTA: Conserve-o a 4 °C e certifique-se de que o protege da exposição à luz directa. - Coloque o dispositivo Gut-on-a-Chip num forno seco regulado a 60 °C e incube-o durante um mínimo de 30 minutos para eliminar qualquer humidade restante.
- Exponha o dispositivo Gut-on-a-Chip ao tratamento UV e de ozônio por 60 minutos usando um gerador de UV/ozônio.
NOTA: Para garantir a ativação ideal das superfícies PDMS durante o tratamento, mantenha uma distância de aproximadamente 3 cm ou menos entre a lâmpada UV e o dispositivo. Evite a superlotação de dispositivos no gerador para realizar uma ativação eficiente da superfície. - Fixe a tubulação de entrada, desvio e saída do microcanal superior usando clipes de aglutinante para fixá-los. Fixe também a tubulação de entrada para o microcanal inferior.
- Desconecte a tubulação de saída para o microcanal inferior. Certifique-se de que a tubulação de bypass do microcanal inferior permaneça aberta.
- Usando uma micropipeta P100, introduzir 100 μL de uma solução de PEI a 1% através do orifício de saída do microcanal inferior.
NOTA: Recomenda-se executar este processo enquanto o dispositivo ainda está aquecido devido à exposição aos raios UV/Ozono. Observe a solução de PEI fluindo através do microcanal e a solução de PEI cai para sair da tubulação de bypass para o microcanal inferior. - Reconecte a tubulação de saída para o microcanal inferior.
- Proteja a tubulação de entrada, desvio e saída do microcanal inferior usando clipes de aglutinante para fixá-los. Fixe também a tubulação de entrada para o microcanal superior.
- Desconecte a tubulação de saída do microcanal superior. Certifique-se de que a tubulação de bypass do microcanal superior permaneça aberta.
- Usando uma micropipeta P100, introduzir 100 μL de uma solução de PEI a 1% através do orifício de saída do microcanal superior.
NOTA: Observe a solução de PEI fluindo através do microcanal e a solução de PEI cai para sair da tubulação de bypass para o microcanal superior. - Reconecte a tubulação de saída do microcanal superior.
- Uma vez que os microcanais superior e inferior estejam preenchidos com solução de PEI a 1%, deixe o dispositivo incubar à temperatura ambiente (TR) por 10 min.
- Execute as etapas 1.5-1.12 com solução de AG a 0,1%.
- Uma vez que os microcanais superior e inferior estejam preenchidos com solução de GA a 0,1%, deixe o dispositivo incubar em RT por 20 min.
- Execute as etapas 1.5-1.12 com água DI para remover qualquer solução de ativação de superfície em excesso.
- Coloque o cavaco em forno seco a 60 °C e deixe secar durante a noite.
NOTA: Certifique-se de remover os clipes de aglutinante de toda a tubulação para evitar qualquer impacto da tubulação. Este processo de secagem é fundamental para a ativação superficial uniforme do microcanal dentro do Gut-on-a-Chip12.
2. Revestimento da matriz extracelular (MEC) e preparação do meio de cultura para cultura Gut-on-a-Chip
- Preparar uma mistura de MEC com meio organoide basal de modo a que a concentração final de Colagénio I e Matrigel seja de 60 μg/ml e 2 % (vol/vol), respetivamente.
NOTA: Prepare 50 μL de mistura de ECM por chip intestinal (ou seja, 20 μL de mistura de ECM para cada microcanal superior e inferior e 10 μL extra). Preparar esta solução no dia da utilização e conservar esta solução a 4 °C ou colocá-la no gelo até estar pronta a utilizar. - Retire o Gut-on-a-Chip que foi tratado com UV/Ozônio, PEI e GA do forno seco.
NOTA: Inspecione sob um microscópio de contraste de fase para ver se há umidade residual. - Deixe o Gut-on-a-Chip esfriar em um armário de biossegurança por 10 min.
- Fixe a tubulação de entrada, desvio e saída do microcanal superior usando clipes de aglutinante para fixá-los. Fixe também a tubulação de entrada para o microcanal inferior.
- Desconecte a tubulação de saída para o microcanal inferior.
- Usando uma micropipeta P100, introduzir 20 μL de mistura de MEC através do orifício de saída do microcanal inferior.
NOTA: Observe a mistura de ECM fluindo através do microcanal sem qualquer aprisionamento de bolhas de ar. Se houver alguma bolha de ar presente, introduza mistura adicional de ECM no microcanal inferior até que a bolha desapareça. - Reconecte a tubulação de saída para o microcanal inferior.
- Proteja a tubulação de entrada, desvio e saída do microcanal inferior usando clipes de aglutinante para fixá-los. Fixe também a tubulação de entrada para o microcanal superior.
- Desconecte a tubulação de saída do microcanal superior.
- Usando uma micropipeta P100, introduzir 20 μL de mistura de MEC através do orifício de saída do microcanal superior.
- Reconecte a tubulação de saída para o microcanal superior.
- Colocar o chip em uma incubadora de CO 2 umidificada com 5% de CO2 a 37 °C por 1 h para formar a camada de MEC na membrana PDMS tratada com PEI e GA (Figura 3A).
NOTA: Certifique-se de que toda a tubulação está presa durante a incubação. - Durante a incubação do revestimento da MEC, preparar duas seringas de 1 mL contendo meio de semeadura a frio, que é o meio de cultura organoide sem A8301, mas contendo 10 μM Y-27632 e 2,5 μM CHIR99021, conforme relatado anteriormente em Gut-on-a-Chip derivado de organoides humanos2.
NOTA: A8301 foi removido do meio para melhorar a fixação das células à ECM revestida, conforme relatado anteriormente2. O dia 0 da cultura Gut-on-a-Chip requer apenas fluxo de microcanal superior. Portanto, prepare uma seringa cheia para o canal superior enquanto um mínimo de 0,2 mL para o canal inferior. - Quando o revestimento ECM estiver concluído, retire o Chip da incubadora e solte a braçadeira para a tubulação de bypass conectada ao microcanal inferior.
- Conecte uma seringa de 1 mL cheia com meio de semeadura à agulha romba que está ligada ao microcanal inferior do Gut-on-a-Chip. Introduza cuidadosamente o meio de semeadura (~50 μL) na tubulação de bypass. Uma vez que a tubulação é preenchida com o meio introduzido, prenda a tubulação de bypass conectada ao microcanal inferior com um clipe ligante.
- Solte a braçadeira da tubulação de saída conectada ao microcanal inferior. Introduza cuidadosamente o meio de semeadura no microcanal inferior, permitindo que ele flua suavemente através do sistema. Fixe a tubulação de saída conectada ao microcanal inferior com um clipe aglutinante após a perfusão.
- Em seguida, abra a tubulação de bypass conectada ao microcanal superior.
- Conecte uma seringa de 1 mL preenchida com meio de semeadura à agulha romba que está ligada ao microcanal superior do Gut-on-a-Chip. Introduza cuidadosamente o meio de semeadura (~50 μL) na tubulação de bypass. Uma vez que a tubulação é preenchida com o meio introduzido, prenda a tubulação de bypass conectada ao microcanal superior com um clipe aglutinante.
- Solte a tubulação de saída conectada ao microcanal inferior. Introduza cuidadosamente o meio de semeadura no microcanal superior, permitindo que ele flua suavemente através do sistema. Fixe a tubulação de saída conectada ao microcanal superior com um clipe aglutinante após a perfusão.
3. Preparação de células organoides intestinais caninas para semeadura
NOTA: Para gerar o modelo Gut-on-a-Chip, organoides do cólon canino (referidos como colonoides) derivados de cães pacientes com DII foram utilizados neste protocolo. Esses colonóides foram derivados de três a cinco pequenos fragmentos de tecido colônico biopsiados, seguindo método previamenterelatado15,18. Para obter os melhores resultados, é crucial usar colonóides caninos que tenham sido submetidos a um mínimo de três passagens de cultura para estabelecer organoides estáveis adequados para aplicações in vitro. Recomenda-se cultivar os colonóides caninos por uma duração de pelo menos 3-4 dias para facilitar a diferenciação adequada de células multi-linhagens dentro dos organoides, garantindo sua maturidade funcional e adequação para experimentos subsequentes no modelo Gut-on-a-Chip. O limite máximo da passagem para este trabalho é inferior a 20, como indicado por estudo anterior que demonstrou fenótipo e cariótipo inalterados ao longo de 20 passagens consecutivas25. A sinalização desses doadores é apresentada na Tabela Suplementar S1.
- Cultivar os colonóides caninos em placas de 24 poços embebidas em 30 μL de Matrigel 15,18 com meio de cultura organoide listado na Tabela de Materiais, que é modificado do meio previamente relatado 15,26,27. O meio condicionado foi obtido cultivando-se células Rspo1 e células HEK293 projetadas para secretar Noggin28.
- Descarte o meio de cultura organoide através de sucção a vácuo e introduza 500 μL de Solução de Recuperação Celular em temperatura gelada em cada poço. Incubar durante 30 minutos a 4 °C.
NOTA: Normalmente, três poços de uma placa de 24 poços de organoides intestinais caninos maduros fornecem uma quantidade suficiente de células dissociadas para semear um único dispositivo Gut-on-a-Chip com 40-50 organoides/um campo de visão em ampliação x10. - Interrompa mecanicamente as cúpulas de Matrigel por 5 s usando uma micropipeta P1000. Em seguida, recolher a suspensão organoide em um tubo cônico de 15 mL.
- Centrifugar o tubo cónico a 200 × g e 4 °C durante 5 min, seguido da remoção do sobrenadante.
- Introduzir 1 mL de protease semelhante à tripsina à temperatura ambiente, suplementada com 10 μM Y-27632, e ressuspender o pellet celular por pipetagem usando uma micropipeta P1000.
- Colocar a suspensão celular num banho-maria regulado a 37 °C e incubá-la durante 10 minutos, agitando periodicamente a mistura.
- Introduzir 5 mL de meio basal organoide aquecido e pipetar vigorosamente a suspensão celular com micropipeta P1000 até que fique turva, sem aglomerados celulares visíveis.
- Passe a suspensão celular através de um filtro celular com um corte de 70 μm para eliminar quaisquer detritos de Matrigel e grandes aglomerados celulares.
- Centrifugar o tubo cônico a 200 × g e 4 °C por 5 min, seguido de ressuspensão do pellet em meio de semeadura. Para a semeadura de um dispositivo canino Gut-on-a-Chip, use 20 μL de meio de semeadura para ressuspender o pellet de célula (ou seja, use 20 μL de meio de semeadura ao semear um dispositivo Gut-on-a-Chip).
- Modificar a concentração de células viáveis para 1 × 107 células/mL com meio de semeadura como relatado anteriormente2. Realizar avaliação de viabilidade usando um hemocitômetro combinando 10 μL da suspensão celular com 10 μL de azul de Trypan e, em seguida, observar as células sob um microscópio.
NOTA: É crucial ajustar a concentração celular adequadamente para garantir a fixação celular ideal e a formação de uma monocamada uniforme na membrana do chip. Se o número inicial de células for insuficiente, pode resultar em atraso ou mal-sucedido estabelecimento de uma monocamada confluente. Por outro lado, se o número de células for excessivo, as células não aderentes podem se agregar em aglomerados dentro do canal, levando a efeitos de concentração indesejáveis.
4. Semeadura e formação de uma monocamada de células 2D
- Desconecte a tubulação de saída do microcanal superior. Certifique-se de que a tubulação de bypass do microcanal superior permaneça aberta. Fixe a entrada e a saída do microcanal inferior usando clipes de aglutinante para fixá-los.
- Com uma micropipeta P100 ou P20, introduzir 20 μL da suspensão celular do Protocolo 3 no orifício de saída do microcanal superior (Figura 3B Semeadura).
- Fixe o tubo de desvio e entrada do microcanal superior usando clipes de aglutinante para fixá-lo. Em seguida, reconecte a tubulação de saída ao orifício de saída do microcanal superior, garantindo que a tubulação permaneça aberta durante todo o processo para evitar que qualquer pressão seja aplicada ao microcanal superior. Após esta etapa, prenda lentamente a tubulação de saída do canal superior usando um clipe aglutinante para prendê-la.
- Verifique usando um microscópio se as células estão uniformemente distribuídas por todo o microcanal superior.
NOTA: É importante prender a tubulação para interromper o movimento do meio dentro do canal para permitir condições estáticas estáveis até que a fixação celular desejável seja realizada. - Coloque o cavaco numa incubadora de CO2 humidificada a 37 °C.
NOTA: Leva aproximadamente 3 h para que as células organoides intestinais caninas se fixem ao revestimento da MEC (Figura 3B Anexo). - Conecte a seringa conectada ao microcanal superior do Gut-on-a-Chip a uma bomba de seringa posicionada dentro de uma incubadora de CO2 .
NOTA: Limpe cuidadosamente o meio no microcanal usando o botão da bomba de seringa e remova as células não ligadas. Examine o chip sob um microscópio para garantir que todas as células não conectadas tenham sido efetivamente lavadas. - Iniciar o fluxo do meio de cultura a 30 μL/h com meio de semeadura. Este fluxo contínuo é apenas para o microcanal superior inicialmente até o estabelecimento da monocamada 2D em um Gut-on-a-Chip. Para o microcanal inferior, deixe os microcanais presos e o meio sem lavagem.
- A partir do dia seguinte à semeadura das células, trocar o meio de cultura para o meio de cultura organoide, que contém A8301 e não possui 10 μM Y-27632 e 2,5 μM CHIR99021, do meio de semeadura.
- Uma vez estabelecida a monocamada, inicie o fluxo contínuo do meio para o microcanal inferior também. As células epiteliais organoides intestinais caninas geralmente levam de 2 a 3 dias para estabelecer monocamadas epiteliais (Figura 3C).
5. Estabelecimento da morfogênese 3D em Gut-on-a-Chip canino
NOTA: Depois que as monocamadas confluentes são formadas em Gut-on-a-Chip, o fluxo médio do canal superior e inferior e a deformação celular foram introduzidos para iniciar a morfogênese 3D para a monocamada 2D, conforme apresentado na Figura 2.
- Introduzir o meio de cultura organoide nos microcanais superior e inferior para iniciar o desenvolvimento da morfogênese 3D em um sistema Gut-on-a-Chip. Para atingir uma tensão de cisalhamento de 0,02 dyne/cm2 no projeto Gut-on-a-Chip existente (ou seja, microcanal de 500 μm de altura), aumente a taxa de fluxo para 50 μL/h29.
- Iniciar 10% de deformação celular e 0,15 Hz de frequência, conforme recomendado antes de2, utilizando um biorreator regulado por computador aplicando deformação cíclica em células cultivadas in vitro. Este processo aplicaria sucção a vácuo ao dispositivo Gut-on-a-Chip.
- Manter essas condições de cultura por um período mínimo de 2 a 3 dias. A morfogênese 3D da monocamada intestinal canina geralmente ocorre 2 a 3 dias após o início do fluxo do canal dural e da aspiração a vácuo (Figura 3C).
6. Caracterização do Gut-on-a-Chip canino
- Imagem de células vivas
- Remova quaisquer bolhas de ar no Gut-on-a-Chip fluindo suavemente o meio usando a bomba de seringa.
- Desconecte o dispositivo Gut-on-a-Chip da bomba de seringa.
NOTA: Evite qualquer manobra que possa aplicar pressão dentro do Gut-on-a-Chip. - Posicione o dispositivo em um microscópio para capturar imagens do epitélio 3D estabelecido. Para visualizar a estrutura das camadas epiteliais 3D utilizando contraste de fase, utilizar objetivas de 10x e 20x (Figura 3C).
- Coloração por imunofluorescência
- Preparar a solução de bloqueio dissolvendo 1 g de BSA em 50 mL de solução salina tampão fosfato (PBS) para fazer BSA a 2%. Passar a solução através de um filtro de seringa de 0,2 μm para filtração. Manter esta solução conservada a 4 °C.
- Preparar a solução permeabilizante combinando 150 μL de Triton X-100 com 50 mL de solução bloqueadora, resultando em uma concentração final de 0,3% de Triton X-100. Passar a solução através de um filtro de seringa de 0,2 μm para filtração. Manter esta solução conservada a 4 °C.
- Realizar a fixação das células injetando 100 μL de PFA a 4% nos microcanais superior e inferior, conforme descrito nos passos 2.4-2.11.
- Enxaguar as células injetando 100 μL de PBS nos microcanais superior e inferior, conforme descrito nas etapas 2.4-2.11.
- Realizar a permeabilização das células injetando 100 μL de Triton a 0,3% nos microcanais superior e inferior, conforme descrito nas etapas 2.4-2.11. Coloque o aparelho no TR por 30 min.
- Enxaguar as células injetando 100 μL de PBS nos microcanais superior e inferior, conforme descrito nas etapas 2.4-2.11.
- Realizar o bloqueio das células para evitar a ligação inespecífica injetando 100 μL de BSA a 2% nos microcanais superior e inferior, conforme descrito nas etapas 2.4-2.11. Coloque o aparelho no RT por 1 h.
- Injetar 20 μL da solução de anticorpos primários diluída em BSA a 2% e colocá-la em RT durante 3 h, seguida de incubação noturna a 4 °C.
NOTA: Certifique-se de que toda a tubulação está presa durante a incubação a 4 °C durante a noite. A concentração de um anticorpo primário deve ser 2-5 vezes maior do que a concentração recomendada para coloração de monocamada ou organoide 3D (Figura Suplementar S1). - Enxaguar as células injetando 100 μL de PBS nos microcanais superior e inferior, conforme descrito nas etapas 2.4-2.11.
- Injetar 20 μL da solução de anticorpos secundários diluída em BSA a 2% e colocá-la em RT durante 1 h.
NOTA: Certifique-se de que toda a tubulação está presa durante a incubação. A partir desta etapa, é necessário blindar a configuração do dispositivo com papel alumínio para evitar o fotoclareamento. - Enxaguar as células injetando 100 μL de PBS nos microcanais superior e inferior, conforme descrito nas etapas 2.4-2.11.
- Preparar uma solução combinada para a contracoloração de F-actina e DAPI (diamidino-2-fenilindol). Injectar 20 μL da solução combinada nos microcanais superior e inferior, conforme descrito nos passos 2.4-2.11.
- Enxaguar as células injetando 100 μL de PBS nos microcanais superior e inferior, conforme descrito nas etapas 2.4-2.11.
Realizar imagens de fluorescência da arquitetura das células epiteliais 3D usando um microscópio de fluorescência ou um microscópio confocal.
7. Função da barreira epitelial
- Remova quaisquer bolhas de ar no Gut-on-a-Chip fluindo suavemente o meio usando a bomba de seringa. Certifique-se de que toda a tubulação esteja aberta durante a medição.
- Retire o Gut-on-a-Chip da bomba de seringa e coloque-o no RT durante pelo menos 10 minutos.
- Remova os eletrodos de Ag/AgCl da solução de EtOH a 70%.
- Coloque dois eletrodos de Ag/AgCl na entrada superior e na saída inferior, respectivamente, para medir a resistência da camada epitelial usando um multímetro.
- Coloque dois eletrodos de Ag/AgCl na entrada inferior e na saída superior, respectivamente. Relate a média desses dois valores como um valor de resistência para o Gut-on-a-Chip.
NOTA: O TEER em branco deve ser medido em um Gut-on-a-Chip com apenas revestimento de ECM sem o epitélio. - O cálculo da resistência elétrica transepitelial (TEER) (kΩ ×cm 2) pode ser calculado usando a equação (1).
TEER = (Ωt - Ωem branco) × A (1)
Onde Ωt é um valor de resistência medido no ponto de tempo específico desde o início do experimento, Ωbranco é um valor de resistência medido no momento sem o epitélio, e A é a área da superfície coberta por uma camada celular (aproximadamente 0,11 cm2 para este projeto Gut-on-a-Chip29).- Calcular TEER normalizado usando a equação (2).
TEER =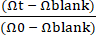 (2)
(2)
Onde Ω0 é um valor de resistência no momento inicial de leitura do experimento, conforme relatado anteriormente30 (Figura 4C).
- Calcular TEER normalizado usando a equação (2).
Representative Results
Este protocolo facilita de forma confiável o desenvolvimento espontâneo da morfogênese intestinal 3D em um sistema Gut-on-a-Chip. Esta abordagem utiliza células epiteliais intestinais caninas obtidas de organoides intestinais derivados de cães acometidos por doença inflamatória intestinal (DII) (Figura 1B). Ocasionalmente agrupamentos da morfogênese 3D de células epiteliais intestinais caninas podem ser observados em todo o microcanal após 6-9 dias de fluxo médio (Figura 3C). Essas alterações morfológicas podem ser monitoradas usando técnicas de contraste de fase. Neste estudo, foram utilizados organoides derivados de dois cães com diagnóstico de DII. Notavelmente, a morfogênese 3D bem-sucedida foi observada em duas réplicas biológicas, cada uma das quais foi realizada com duas réplicas técnicas. Os resultados deste estudo fornecem uma base para futuras investigações envolvendo organoides intestinais derivados de outros doadores caninos. Estes resultados demonstram a potencial aplicabilidade e repetibilidade de nossa abordagem experimental, que já foi relatada em amostras humanas. Esses achados confirmam que a tecnologia Gut-on-a-Chip é aplicável às células epiteliais intestinais caninas, conforme relatado anteriormente com os estudos utilizando células epiteliais intestinais humanas2.
Este protocolo mostrou que a coloração por imunofluorescência pode ser usada para avaliar a estrutura 3D de monocamadas derivadas de organoides que formaram estruturas vilosidades em chips microfluídicos usando microscopia de fluorescência convencional (Figura 4 A,B). Este protocolo pode ser adaptado para validar os fenótipos celulares diferenciados e espacialmente organizados através da coloração por imunofluorescência. A visualização de uma morfogênese 3D dentro de um Gut-on-a-Chip fornece uma excelente oportunidade para investigar a resposta do hospedeiro durante várias interações patológicas 14,23,31. Quando combinada com células epiteliais derivadas de pacientes doadores, como previamente descrito em humanos, essa tecnologia pode ser utilizada na construção de modelos personalizados de doençasintestinais13. Através da integração de imagens de imunofluorescência com técnicas de visualização de RNA direcionadas, como hibridização in situ por fluorescência, pode ser viável analisar visualmente os transcriptomas e proteomas do hospedeiro dentro de um sistema Gut-on-a-Chip.
Preservar a integridade da membrana intestinal é vital para manter a homeostase intestinal, e a plataforma Gut-on-a-Chip fornece uma vantagem valiosa ao permitir o monitoramento preciso e a quantificação dessa função crucial. A medição de TEER usando a tecnologia Gut-on-a-Chip oferece vários benefícios. Por exemplo, estudos anteriores avaliaram com sucesso o TEER ao co-cultivar células intestinais com bactérias não patogênicas e probióticas32, bem como sob condições de intestino permeável23. Isso permite que os pesquisadores estudem o impacto de diferentes condições na função da barreira intestinal e identifiquem potenciais intervenções para promover a saúde intestinal.
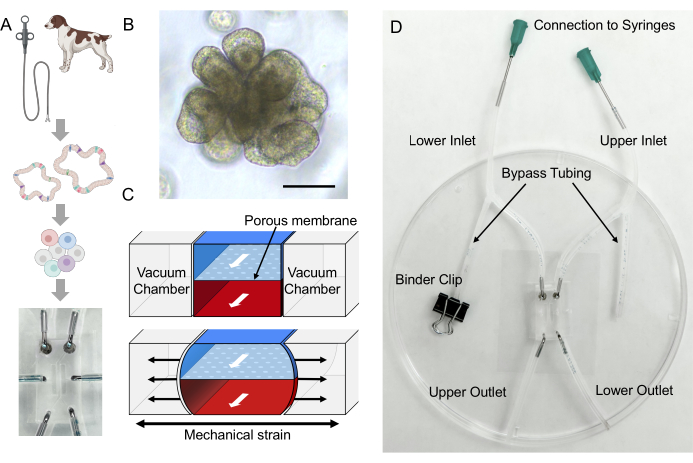
Figura 1: Estabelecimento do IBD canino derivado do paciente Gut-on-a-Chip. (A) Integração dos organoides intestinais derivados do paciente e da plataforma Gut-on-a-Chip. A biópsia endoscópica pode ser realizada para isolar células das criptas intestinais para desenvolver organoides intestinais específicos do doador. As células epiteliais podem ser dissociadas em células únicas dos organoides, depois semeadas em um Gut-on-a-Chip baseado em PDMS e cultivadas em um microambiente dinâmico único. (B) Imagens representativas de colonóides de um cão IBD. Barra de escala = 100 μm. (C) Este esquema ilustra um dispositivo Gut-on-a-Chip que consiste em uma membrana porosa colocada entre os microcanais superior e inferior. O microcanal superior é indicado pela área azul, enquanto o microcanal inferior é indicado pela área vermelha. Câmaras de vácuo estão presentes em cada lado do microcanal, que deformam a membrana porosa para mimetizar o movimento peristáltico24. (D) Uma configuração de Gut-on-a-Chip canino inclui um Gut-on-a-Chip baseado em PDMS montado com tubulação que é colocada em uma tampa 2,24. A tubulação de bypass é fundamental para evitar o acúmulo de pressão dentro do microcanal durante o manuseio (ou seja, conexão com seringas). Clipes de ligante são usados para prender a tubulação. Os materiais sensíveis ao volume podem ser infundidos através dos orifícios abertos da saída superior ou inferior. O meio de cultura organoide pode ser infundido conectando-se as seringas às agulhas rombas e o fluxo através da entrada superior e inferior. Abreviações: DII = doença inflamatória intestinal; PDMS = polidimetilsiloxano. Clique aqui para ver uma versão maior desta figura.
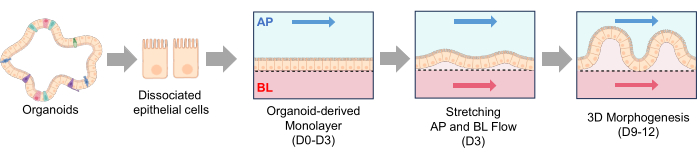
Figura 2: Formação de estruturas vilosidades em IBD canino Gut-on-a-Chip. As células epiteliais dissociadas foram semeadas em um Gut-on-a-Chip revestido com MEC. Uma vez que as células dissociadas estavam aderidas à membrana do PDMS, o fluxo apical foi iniciado por 3 dias (D0-D3). Quando uma monocamada 2D confluente é formada (D3), inicia-se o fluxo basolateral com alongamentos frequentes (Stretching, AP e BL Flow). Após 2-3 dias de fluxo duplo e estiramento da membrana, a monocamada 2D começa a desenvolver morfogênese 3D, e estruturas semelhantes a vilosidades são formadas após 9 dias de cultura (morfogênese 3D, D9-D12). Abreviações: MEC = matriz extracelular; PDMS = polidimetilsiloxano; AP = apical; BL = basolateral. Clique aqui para ver uma versão maior desta figura.
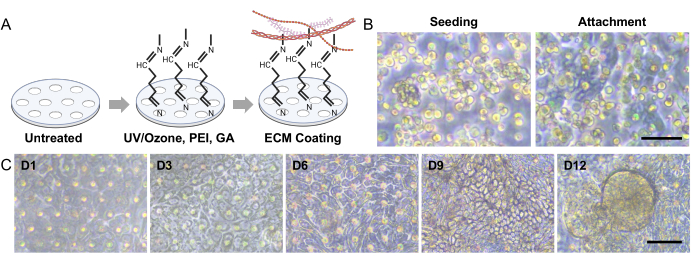
Figura 3: Semeadura organoide intestinal canina e morfogênese 3D em um Gut-on-a-Chip. (A) As etapas experimentais para a ativação superficial de uma membrana porosa em um Gut-on-a-Chip baseado em PDMS. A utilização do tratamento UV/Ozônio, PEI e tratamento com AG em conjunto facilita a reticulação das aminas presentes nas soluções de MEC. Esse processo leva à imobilização estável das proteínas da MEC na membrana porosa. (B) As imagens de contraste de fase demonstram as morfologias das células imediatamente após a semeadura (esquerda) e 3-5 h após a semeadura (direita). A membrana porosa após 3 h de semeadura exibe áreas mais finas e escuras onde células únicas se fixaram, destacando o processo de fixação. (C) As imagens de contraste de fase retratam a morfogênese 3D das monocamadas intestinais dentro de um sistema Gut-on-a-Chip. Essas monocamadas foram derivadas de cães afetados com DII e essas células organoides foram cultivadas por um período de 12 dias sob condições dinâmicas, que envolveram fluxo de fluido e movimentos de alongamento. Barras de escala = 50 μm (B,C). Abreviações: DII = doença inflamatória intestinal; MEC = matriz extracelular; PDMS = polidimetilsiloxano; PEI = polietilenimina; GA = glutaraldeído. Clique aqui para ver uma versão maior desta figura.
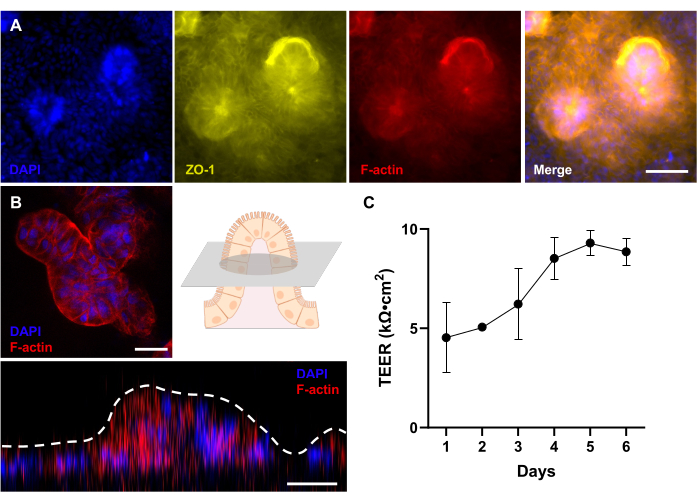
Figura 4: Avaliação do desenvolvimento morfológico 3D em Gut-on-a-Chip canino derivado do paciente. (A) Imagem de imunofluorescência de um IBD canino Gut-on-a-Chip, mostrando uma visão de cima para baixo de um epitélio 3D totalmente desenvolvido após 12 dias de cultura, que é avaliado por um microscópio de fluorescência. A proteína tight junction (ZO-1) é visualizada em amarelo; a membrana da borda em escova (F-actina) aparece em vermelho; e os núcleos são corados com DAPI e aparecem azuis. (B) Imagem de imunofluorescência de um IBD canino Gut-on-a-Chip usando um microscópio confocal com lente de longa distância. Como mostrado no esquema, uma imagem fluorescente de uma seção transversal de uma estrutura semelhante a vilosidades de um epitélio 3D totalmente desenvolvido após 12 dias de cultura é mostrada. Além disso, o empilhamento Z mostra uma visão lateral do epitélio 3D, que revela a formação de estruturas semelhantes a vilosidades. A membrana da borda em escova (F-actina) aparece em vermelho, e os núcleos são corados com DAPI e aparecem em azul. (C) A função da barreira intestinal foi avaliada e medida pelo TEER em Gut-on-a-Chips caninos derivados do paciente. Valores estáveis de TEER foram alcançados no Dia 5 de cultura em Gut-on-a-Chip. As barras de erro expressam o MEV das medições. O valor de TEER foi medido entre duas réplicas biológicas com uma réplica técnica. Barras de escala = 50 μm (A), 25 μm (B). Abreviações: DII = doença inflamatória intestinal; DAPI = 4',6-diamidino-2-fenilindol; TEER = resistência elétrica transepitelial. Clique aqui para ver uma versão maior desta figura.
Figura Suplementar S1: Caracterização do anticorpo policlonal anti-ZO-1 em monocamadas derivadas do colonóide canino e em dispositivos Gut-on-a-Chip. (A) Coloração por imunofluorescência de ZO-1 em amarelo com F-actina em vermelho e sua imagem de sobreposição. Barra de escala = 25 μm. (B) A visualização por imunofluorescência de ZO-1 em amarelo em 'Leaky Gut Chips' foi conduzida sob várias condições, incluindo estimulação com bactérias probióticas (LGG + Citocinas ou VSL#3 + Citocinas) e controles livres de germes sem estimulação probiótica (Citocinas). Barra de escala = 50 μm. Esse dado é reproduzido de Min et al.23. Clique aqui para baixar este arquivo.
Quadro Complementar S1: Resumo das informações sobre os dadores de tecidos. Uma tabela resumo da idade, sexo, raça, avaliação histopatológica e pontuação do índice de atividade da DII canina (CIBDAI) dos doadores. O CIBDAI é um sistema de pontuação numérica utilizado para inferir a gravidade clínica em DII canina33. Clique aqui para baixar este arquivo.
Discussion
Este estudo marca a demonstração pioneira da compatibilidade dos organoides intestinais caninos com o desenvolvimento de um modelo canino IBD Gut-on-a-Chip. A integração de organoides intestinais e culturas de monocamadas derivadas de organoides em um sistema microfluídico (ou seja, sistema Gut-on-a-Chip) evoluiu ainda mais a tecnologia, permitindo a criação de modelos intestinais in vitro que mimetizam a dinâmica fisiológica e são mais representativos das condições biológicas. Em particular, uma vez que há muito poucos relatos de cultura de Gut-on-a-Chip usando organoides derivados de IBD em humanos, o estudo atual usando canino IBD-derivado Gut-on-a-Chip pode fornecer insights líderes sobre o estudo de IBD em humanos.
O desenvolvimento bem-sucedido da morfogênese 3D epitelial intestinal canina em um Gut-on-a-Chip requer atenção cuidadosa a várias etapas críticas. Primeiro, a superfície hidrofóbica dos canais microfluídicos do PDMS pode impedir a adesão da MEC e a subsequente fixação celular, necessitando da ativação superficial do PDMS antes do revestimento da MEC e da semeadura celular (ver secção 1 do protocolo). Para alcançar uma cultura estável de monocamada, a remoção do excesso de células não anexadas é crucial após a ligação celular (etapas do protocolo 4.6-4.7). Além disso, a estimulação dinâmica, como fluxo médio constante e movimento de vácuo peristáltico, é necessária para a morfogênese 3D do epitélio intestinal (etapa 5.2 do protocolo). O manuseio cuidadoso é essencial para evitar bolhas de ar no microcanal durante qualquer etapa da cultura Gut-on-a-Chip.
Se encontrar uma semeadura de células pobre no Gut-on-a-Chip, pode ser devido a um baixo número de células ou má ligação celular. Para solucionar o baixo número de células, é importante inspecionar a saúde dos organoides intestinais preparados, observando seu crescimento em Matrigel. A viabilidade celular pode ser avaliada pela coloração com azul de Trypan após a dissociação celular para garantir que não mais do que 20% das células estejam mortas. Se o número de células viáveis for insuficiente, pode-se tentar otimizar as condições do meio organoide. Outra possibilidade é a dissociação incompleta dos organoides, resultando em um excesso de aglomerados celulares maiores que 70 μm que ficam presos pelo filtro. Para resolver isso, uma opção é estender a duração da pipetagem durante a dissociação celular. Alternativamente, o tubo cônico de 15 mL pode ser agitado suavemente a cada minuto durante o tratamento com uma protease semelhante à tripsina. A má fixação celular ao Gut-on-a-Chip pode ser devido ao revestimento inadequado de ECM. Durante o processo de revestimento, é aconselhável verificar cuidadosamente a presença de bolhas de ar e evitar sua formação, adicionando suavemente mais solução de revestimento conforme necessário. A superlotação das células e a falha em lavar as células não anexadas podem resultar em uma monocamada inicial insuficiente. Nesse caso, uma pulsação leve pode ser aplicada ao empurrar o êmbolo da seringa. Essas etapas de solução de problemas podem ajudar a identificar e resolver problemas durante o processo de cultura Gut-on-a-Chip.
Embora esta plataforma Gut-on-a-Chip permita a criação de camadas epiteliais 3D onduladas, reconhecemos a necessidade de complexidade biológica adicional para replicar o microambiente intestinal completamente. É crucial considerar as interações entre células epiteliais e mesenquimais, a deposição de MEC para regeneração 3D e a presença de características cript-vilosidades que estabeleçam um nicho adequado de células-tronco. As células estromais, como os fibroblastos, desempenham papel vital na produção de proteínas da MEC e na regulação da morfogênese intestinal34,35,36. A inclusão de células mesenquimais neste modelo tem o potencial de aumentar tanto a morfogênese quanto a eficiência da ligação celular. As camadas endoteliais, que englobam a vasculatura capilar e os vasos linfáticos, desempenham papel crucial no controle do transporte molecular e do recrutamento de células imunes37,38. A inclusão de células imunes derivadas do paciente poderia ser essencial na modelagem de doenças intestinais, pois permite a demonstração da interação entre imunidade inata e adaptativa, bem como o estabelecimento de imunidade tecido-específica39. Após a conclusão da morfogênese 3D em Gut-on-a-Chip, o meio de cultura organoide pode ser modificado para um meio de diferenciação organoide. Esta pode ser uma abordagem viável para induzir diferenciação celular adicional, dependendo dos objetivos experimentais.
A obtenção de imagens da microarquitetura 3D in situ é um desafio devido à longa distância de trabalho necessária, que pode ser superada com um objetivo de longa distância. Além disso, os métodos de microfabricação e colagem camada por camada dificultam o acesso às camadas superiores para exame com MEV. Para o projeto atual do Gut-on-a-Chip, é necessária uma bomba de seringa por microdispositivo Gut-on-a-Chip, ocupando o espaço da incubadora de CO2 e evitando experimentos em larga escala. Inovações são necessárias para aumentar a escalabilidade para uma plataforma amigável e triagem de alto rendimento.
Esses protocolos atuais permitem o desenvolvimento espontâneo de camadas epiteliais 3D in vitro, superando as limitações dos organoides 3D tradicionais, monocamadas 2D e sistemas estáticos de cultura de microdispositivos. Este microambiente intestinal dinâmico in vitro pode ser controlado pela introdução de co-cultura de diversos tipos celulares. Estudos prévios exploraram métodos de manipulação do microambiente Gut-on-a-Chip, incluindo a co-cultura do microbioma intestinal14,23 e células mononucleares periféricas30. Esse microambiente reconstituído tem inúmeras aplicações potenciais, incluindo testes de drogas, estudos mecanísticos fundamentais e modelagem de doenças. O microambiente reconstruído possui potencial significativo para uma ampla gama de aplicações, tais como testes de fármacos 23,40,41 e modelagem de doenças 12,13,14,30, bem como investigações mecanicistas fundamentais da morfogênese intestinal 42. Uma variedade de ensaios pode ser realizada por meio da coleta de sobrenadantes para avaliação de metabólitos 43, pela coleta de células para exame genômico 2,32 ou pelo exame visual das células usando corantes de células vivas ou fixação para posterior imagem de imunofluorescência 23,44.
Este estudo apresenta um protocolo reprodutível para o desenvolvimento da morfogênese 3D das camadas epiteliais intestinais caninas em uma plataforma Gut-on-a-Chip. A estrutura epitelial 3D resultante fornece uma representação mais realista do microambiente intestinal, que tem imenso potencial para aplicações em vários estudos biomédicos. Ao utilizar essa arquitetura intestinal, podemos conduzir mais pesquisas translacionais e potencialmente produzir resultados promissores.
Disclosures
Os autores declaram não haver qualquer conflito de interesses.
Acknowledgements
Gostaríamos de agradecer ao serviço de Medicina Interna de Pequenos Animais da WSU (Dr. Jillian Haines, Dra. Sarah Guess, Shelley Ensign LVT) e à Coordenadora de Estudos Clínicos da WSU VTH, Valorie Wiss, por seu apoio no recrutamento de casos e coleta de amostras de cientistas cidadãos (doadores de pacientes). Este trabalho foi apoiado em parte pelo Office of The Director, National Institutes Of Health (K01OD030515 e R21OD031903 à Y.M.A.) e pela Japan Society for the Promotion of Science Overseas Challenge Program for Young Researchers (202280196 to I.N.). A Figura 1A e a Figura 3A foram criadas com BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| Organoid basal medium | |||
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| GlutaMAX | Gibco | 35050-061 | 2 mM, glutamine substitute |
| 1 M HEPES | VWR Life Science | J848-500ML | 10 mM |
| 100x penicillin–streptomycin | Corning | MT30009CI | 1x |
| Organoids and organoid medium | |||
| A-83-01 | PeproTech | 9094360 | 500 nM |
| B27 supplement | Gibco | 17504-044 | 1x |
| CHIR99021 | Reprocell | 04-0004-base | 2.5 µM |
| HEK293 cells engineered to secrete Noggin | Baylor College of Medicine | ||
| Murine EGF | PeproTech | 315-09-1MG | 50 ng/mL |
| Murine Wnt-3a | PeproTech | 315-20-10UG | 100 ng/mL |
| N-Acetyl-L-cysteine | Sigma | A9165-25G | 1 mM |
| N2 MAX Media supplement | Gibco | 17502-048 | 1x |
| Nicotinamide | Sigma | N0636-100G | 10 mM |
| Noggin Conditioned Medium | NA | NA | 10% vol/vol |
| Primocin | InvivoGen | ant-pm-1 | 100 µg/ml |
| R-spondin1 (Rspo1) cells | Trevigen | 3710-001-01 | Rspo1 cells |
| R-Spondin-1 Conditioned Medium | NA | NA | 20% vol/vol |
| SB202190 | Sigma-Aldrich | S7067-25MG | 10 µM |
| Y-27632 | StemCellTechnologies | 72308 | 10 µM |
| [Leu15 ]-Gastrin I human | Sigma-Aldrich | G9145-.5MG | 10 nM |
| Reagents | |||
| 4% Paraformaldehyde solution | Fisher Scientific | AAJ19943K2 | |
| Alexa Fluor 647 Phalloidin | Thermo Fisher Scientific | A22287 | x250 dilution |
| Anti-Rabbit IgG H&L labeled with Alexa Fluor 555 | Abcam | ab150078 | x1,000 dilution |
| Anti-ZO-1 polyclonal antibody | Thermo Fisher Scientific | 61-7300 | x50 dilution |
| Cell Recovery Solution | Corning | 354253 | |
| Collagen I, Rat Tail 3 mg/mL | Gibco | A10483-01 | |
| Diamidino-2-phenylindole (DAPI) | Thermo Fisher Scientific | 62248 | x1,000 dilution |
| EMS Glutaraldehyde Aqueous 50% | Electron Microscopy Sciences | 16320 | |
| Matrigel Matrix | Corning | 356255 | |
| Poly(ethyleneimine) solution | Sigma | 408700-250ML | |
| TrypLE Express | Gibco | 12604-021 | |
| Materials and Equipment | |||
| 24-well culture plates | Corning | 3524 | |
| 87V Industrial Multimeter | Fluke Corporation | ||
| Centrifuge | Eppendorf | 5910R | |
| CO2 incubator | Eppendorf | C170i | |
| DMi8 fluorescence microscope | Leica microsystems | DMi8 | |
| Dry oven | Fisher Scientific | 15-103-0519 | |
| FlexCell FX-5000 Tension system | Flexcell International Corporation | ||
| Inverted phase-contrast microscope | Leica microsystems | DMi1 | |
| SP8-X inverted confocal microscope | Leica microsystems | SP8-X | |
| Syringe pump | Braintree Scientific | model no. BS-8000 120V | |
| Syringe, 3 mL sterile | BD Biosciences | 14-823-435 | |
| Syringes, 1 mL sterile | BD Biosciences | 14-823-434 | |
| UV/ozone generator | Jelight Company | model no. 30 | |
| Software | |||
| LAS X imaging software | Leica microsystems |
References
- Shanks, N., Greek, R., Greek, J. Are animal models predictive for humans. Philosophy, ethics, and humanities in medicine: PEHM. 4, 2 (2009).
- Shin, W., Kim, H. J. 3D in vitro morphogenesis of human intestinal epithelium in a gut-on-a-chip or a hybrid chip with a cell culture insert. Nature protocols. 17 (3), 910-939 (2022).
- Coelho, L. P., et al. Similarity of the dog and human gut microbiomes in gene content and response to diet. BMC Biome. 6 (72), 1-11 (2018).
- German, A. J. The growing problem of obesity in dogs and cats. The Journal of Nutrition. 136, 1940-1946 (1940).
- Patronek, G. J., Waters, D. J., Glickman, L. T. Comparative longevity of pet dogs and humans: Implications for gerontology research. Journals of Gerontology - Series A Biological Sciences and Medical Sciences. 52 (3), B171-B178 (1997).
- Lutz, T. A. Mammalian models of diabetes mellitus, with a focus on type 2 diabetes mellitus. Nature reviews. Endocrinology. 19 (6), 350-360 (2023).
- Allenspach, K., Culverwell, C., Chan, D. Long-term outcome in dogs with chronic enteropathies: 203 cases. Veterinary Record. 178 (15), 368 (2016).
- Patnaik, A. K., Hurvitz, A. I., Johnson, G. F. Canine gastrointestinal neoplasms. Veterinary Pathology. 14 (6), 547-555 (1977).
- Saito, T., et al. Immunohistochemical analysis of beta-catenin, e-cadherin and p53 in canine gastrointestinal epithelial tumors. Journal of Veterinary Medical Science. 82 (9), 1277-1286 (2020).
- Kopper, J. J., et al. Harnessing the biology of canine intestinal organoids to heighten understanding of inflammatory bowel disease pathogenesis and accelerate drug discovery: A One Health approach. Frontiers in Toxicology. 3, 1-13 (2021).
- Jalili-firoozinezhad, S., et al. A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nature Biomedical Engineering. 3 (7), 520-531 (2019).
- Shin, W., et al. Robust formation of an epithelial layer of human intestinal organoids in a polydimethylsiloxane-based Gut-on-a-Chip microdevice. Frontiers in Medical Technology. 2, (2020).
- Shin, Y. C., et al. Three-dimensional regeneration of patient-derived intestinal organoid epithelium in a physiodynamic mucosal Interface-on-a-Chip. Micromachines. 11 (7), 663 (2020).
- Tovaglieri, A., et al. Species-specific enhancement of enterohemorrhagic E. coli pathogenesis mediated by microbiome metabolites. Microbiome. 7 (1), 43 (2019).
- Chandra, L., et al. Derivation of adult canine intestinal organoids for translational research in gastroenterology. BMC Biology. 17 (1), 1-21 (2019).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Wilson, S. S., Tocchi, A., Holly, M. K., Parks, W. C., Smith, J. G. A small intestinal organoid model of non-invasive enteric pathogen-epithelial cell interactions. Mucosal Immunology. 8 (2), 352-361 (2015).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), 1-17 (2020).
- Gabriel, V., et al. Canine intestinal organoids in a dual-chamber permeable support system. Journal of Visualized Experiments. 2 (181), 1-24 (2022).
- Yamada, A., et al. Confronting emerging zoonoses: the one health paradigm. Confronting Emerging Zoonoses: The One Health Paradigm. , 1 (2014).
- Lerner, H., Berg, C. The concept of health in One Health and some practical implications for research and education: what is One Health. Infection Ecology & Epidemiology. 5 (1), 25300 (2015).
- Garcia, S. N., Osburn, B. I., Jay-Russell, M. T. One Health for food safety, food security, and sustainable food production. Frontiers in Sustainable Food Systems. 4, 1-9 (2020).
- Min, S., et al. Live probiotic bacteria administered in a pathomimetic Leaky Gut Chip ameliorate impaired epithelial barrier and mucosal inflammation. Scientific Reports. 12 (1), 22641 (2022).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Qu, M., et al. Establishment of intestinal organoid cultures modeling injury-associated epithelial regeneration. Cell Research. 31 (3), 259-271 (2021).
- Sahoo, D. K., et al. Differential transcriptomic profiles following stimulation with lipopolysaccharide in intestinal organoids from dogs with inflammatory bowel disease and intestinal mast cell tumor. Cancers. 14 (14), 3525 (2022).
- Gabriel, V., et al. Standardization and maintenance of 3D canine hepatic and intestinal organoid cultures for use in biomedical research. Journal of Visualized Experiments. (179), 1-28 (2022).
- Heijmans, J., et al. ER stress causes rapid loss of intestinal epithelial stemness through activation of the unfolded protein response. Cell reports. 3 (4), 1128-1139 (2013).
- Shin, W., et al. A robust longitudinal co-culture of obligate anaerobic gut microbiome with human intestinal epithelium in an anoxic-oxic interface-on-a-chip. Frontiers in Bioengineering and Biotechnology. 7, 1-13 (2019).
- Shin, W., Kim, H. J. Intestinal barrier dysfunction orchestrates the onset of inflammatory host-microbiome cross-talk in a human gut inflammation-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 115 (45), E10539-E10547 (2018).
- Park, G. S., et al. Emulating host-microbiome ecosystem of human gastrointestinal tract in vitro. Stem Cell Reviews and Reports. 13 (3), 321-334 (2017).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Jergens, A. E., et al. A scoring index for disease activity in canine inflammatory bowel disease. Journal of Veterinary Internal Medicine. 17 (3), 291-297 (2003).
- Roulis, M., Flavell, R. A. Fibroblasts and myofibroblasts of the intestinal lamina propria in physiology and disease. Differentiation; research in biological diversity. 92 (3), 116-131 (2016).
- Göke, M., Kanai, M., Podolsky, D. K. Intestinal fibroblasts regulate intestinal epithelial cell proliferation via hepatocyte growth factor. The American Journal of Physiology. 274 (5), G809-G818 (1998).
- Powell, D. W., Pinchuk, I. V., Saada, J. I., Chen, X., Mifflin, R. C. Mesenchymal cells of the intestinal lamina propria. Annual Review of Physiology. 73, 213-237 (2011).
- Pappenheimer, J. R., Michel, C. C. Role of villus microcirculation in intestinal absorption of glucose: coupling of epithelial with endothelial transport. The Journal of Physiology. 553, 561-574 (2003).
- Agace, W. W. T-cell recruitment to the intestinal mucosa. Trends in Immunology. 29 (11), 514-522 (2008).
- Ambrosini, Y. M., Shin, W., Min, S., Kim, H. J. Microphysiological engineering of immune responses in intestinal inflammation. Immune Network. 20 (2), 13 (2020).
- Kasendra, M., et al. Development of a primary human Small Intestine-on-a-Chip using biopsy-derived organoids. Scientific Reports. 8 (1), 1-14 (2018).
- Sontheimer-Phelps, A., et al. Human Colon-on-a-Chip enables continuous in vitro analysis of colon mucus layer accumulation and physiology. Cellular and Molecular Gastroenterology and Hepatology. 9 (3), 507-526 (2020).
- Shin, W., et al. Human intestinal morphogenesis controlled by transepithelial morphogen gradient and flow- dependent physical cues in a microengineered Gut-on-a-Chip. iScience. 15, 391-406 (2019).
- Gijzen, L., et al. An Intestine-on-a-Chip model of plug-and-play modularity to study inflammatory processes. SLAS Technology. 25 (6), 585-597 (2020).
- Kim, H. J., Lee, J., Choi, J. H., Bahinski, A., Ingber, D. E. Co-culture of living microbiome with microengineered human intestinal villi in a gut-on-a-chip microfluidic device. Journal of Visualized Experiments. (114), 3-9 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved