Трехмерный морфогенез в кишечнике собаки с использованием кишечных органоидов, полученных от пациентов с воспалительными заболеваниями кишечника
In This Article
Summary
Интеграция органоидов собачьего кишечника и микрофлюидной системы Gut-on-a-Chip предлагает актуальные трансляционные модели для лечения кишечных заболеваний человека. Представленные протоколы позволяют проводить 3D-морфогенез и динамическое моделирование кишечника in vitro , помогая в разработке эффективных методов лечения кишечных заболеваний у собак и людей с помощью концепции «Единое здоровье».
Abstract
Кишечник собак имеет сходство в анатомии, микробиологии и физиологии с человеческим, и у собак естественным образом развиваются спонтанные кишечные расстройства, похожие на человеческие. Преодоление присущего трехмерным (3D) органоидам ограничения доступа к апикальной поверхности кишечного эпителия привело к созданию двумерных (2D) монослойных культур, которые обнажают доступную просветную поверхность с помощью клеток, полученных из органоидов. Интеграция этих органоидов и однослойных культур, полученных из органоидов, в микрофлюидную систему Gut-on-a-Chip еще больше усовершенствовала технологию, позволив разработать более физиологически значимые динамические модели кишечника in vitro .
В данном исследовании мы представляем протокол генерации 3D-морфогенеза эпителия кишечника собак с использованием образцов первичной кишечной ткани, полученных от собак, страдающих воспалительным заболеванием кишечника (ВЗК). Мы также излагаем протокол для создания и поддержания 2D-монослойных культур и систем кишечник-на-чипе с использованием клеток, полученных из 3D-органоидов кишечника. Протоколы, представленные в этом исследовании, служат основой для создания микрофлюидной системы Gut-on-a-Chip, специально разработанной для собак. Закладывая основу для этого инновационного подхода, мы стремимся расширить применение этих методов в биомедицинских и трансляционных исследованиях в соответствии с принципами инициативы «Единое здоровье». Используя этот подход, мы можем разработать более физиологически значимые динамические модели in vitro для изучения физиологии кишечника как у собак, так и у людей. Это имеет большое значение для биомедицинских и фармацевтических применений, поскольку может помочь в разработке более эффективных методов лечения кишечных заболеваний у обоих видов.
Introduction
Морфогенез кишечного эпителия в значительной степени изучался на моделях лабораторных животных, которые являются дорогостоящими, трудоемкими и неточноотражают процессы развития человека. Кроме того, традиционные статические 2D-модели клеточных культур не способны имитировать сложную пространственную организацию 3D-эпителиальной архитектуры. В результате, существует необходимость в протоколе для индуцирования 3D-морфогенеза in vitro с использованием эпителиальных клеток кишечника из животных моделей, имеющих отношение к человеку, чтобы продвинуть наше понимание архитектуры эпителия кишечника.
У собак-компаньонов развилась анатомия кишечника и состав микробиома, которые удивительно похожи на людей из-за их общей среды обитания и рациона во время одомашнивания3. В дополнение к этому сходству, и люди, и собаки имеют различные хронические заболевания, которые, как считается, связаны со здоровьем кишечника. У собак, как и у людей, могут спонтанно развиваться хронические заболевания, такие как ожирение, когнитивная дисфункция, сахарный диабет, воспалительные заболевания кишечника (ВЗК) и колоректальная аденокарцинома 4,5,6,7,8,9,10. Несмотря на разработку и использование эпителиальных клеток человека и мышей в предыдущих исследованиях Gut-on-a-Chip 2,11,12,13,14, эпителий кишечника собак до сих пор не использовался. Наш новый подход, использующий органоидный эпителий кишечника собак в динамической системе культивирования с 3D-морфогенезом эпителия, имеет большое значение как для собачьей, так и для человеческой медицины.
Недавние достижения в области культивирования органоидов кишечника привели к созданию культуры органоидов кишечника собак15. Эта система культивирования включает культивирование стволовых клеток кишечника при определенном морфогенном кондиционировании, в результате чего получается 3D-модель с самообновляющимися свойствами, полученная из взрослых стволовых клеток16. Однако проведение транспортных анализов или кокультур микробиома хозяина создает трудности с этой 3D-моделью из-за закрытого характера просвета кишечника17. Чтобы решить эту проблему, исследователи создали 2D-монослой, полученный из кишечных органоидов, что позволило обнажить поверхность просвета18,19. Однако как 3D-органоиды, так и 2D-монослои поддерживаются в статических условиях, которые не совсем точно отражают биомеханику микроокружения кишечника in vivo. Сочетание технологии органоидов собак, полученных от пациентов, с 3D-морфогенезом in vitro открывает возможность для трансляционных исследований хронических мультифакториальных заболеваний. Такой подход позволяет исследователям разрабатывать более эффективные методы лечения, приносящие пользу как людям, так и собакам, а также продвигать трансляционные исследования в соответствии с инициативой «Единое здоровье», которая представляет собой совместный подход, признающий взаимосвязь здоровья человека, животных и окружающей среды. Она содействует междисциплинарному сотрудничеству для решения сложных проблем в области здравоохранения и достижения оптимальных результатов в отношении здоровья для всех. Понимая взаимозависимость между людьми, животными и экосистемами, инициатива направлена на смягчение рисков, связанных с возникающими инфекционными заболеваниями, деградацией окружающей среды и другими общими проблемами в области здравоохранения20,21,22.
В этом протоколе описаны комплексные методы культивирования эпителиальных клеток кишечника собак, полученных из органоидов пациентов, на микроустройстве Gut-on-a-Chip с пористой мембраной на основе полидиметилсилоксана (PDMS). Установление морфогенеза 3D-эпителия путем интеграции органоидов кишечника собак и технологии Gut-on-a-Chip позволяет нам изучать, как кишечник развивается и поддерживает свою клеточную организацию и нишу стволовых клеток. Эта платформа предоставляет ценную возможность исследовать влияние сообществ микробиома на здоровье кишечника и понять, как эти сообщества генерируют микробные метаболиты, которые вносят свой вклад в патофизиологию кишечника14,23. Эти достижения теперь могут быть распространены на образцы кишечника собак, предоставляя исследователям возможность изучить сложную взаимосвязь между микробиомом кишечника и физиологией хозяина. Это открывает возможности для получения ценной информации о механизмах, лежащих в основе патофизиологии кишечника, и понимания потенциальной роли микробных метаболитов в здоровье собак и человека, а также в различных заболеваниях. Протокол, используемый для собачьего кишечника на чипе, воспроизводим, что делает его подходящей экспериментальной моделью для сравнительной медицины, поскольку этот подход позволяет исследовать взаимодействие микробиома хозяина, патогенные инфекции и терапевтические эффекты на основе пробиотиков как у собак, так и у людей.
Protocol
Исследование было одобрено и проведено в соответствии с Институциональным комитетом по уходу за животными и их использованию Университета штата Вашингтон (ASAF# 6993). В этом протоколе мы использовали хорошо зарекомендовавшее себя микрофлюидное устройство Gut-on-a-Chip из PDMS, которое было изготовлено на собственном предприятии2 (рис. 1D). Подробные методы изготовления микроустройства Gut-on-a-Chip можно найти в предыдущих отчетах 2,24. Этот протокол демонстрирует уникальную интеграцию кишечных органоидов и микрофлюидной системы (рис. 2).
1. Поверхностная активация Gut-on-a-Chip из PDMS
- Приготовьте 1% раствор полиэтиленимина (PEI), добавив 1 мл 50% раствора PEI в 49 мл дистиллированной (DI) воды в конической пробирке объемом 50 мл. Переверните пробирку два-три раза, чтобы раствор хорошо перемешался, затем отфильтруйте раствор с помощью шприцевого фильтра 0,2 мкм.
ПРИМЕЧАНИЕ: Хранить при температуре 4 °C. - Приготовьте 0,1% раствор глутарового альдегида (ГА), добавив 100 мкл 50% раствора ГА в 49,9 мл ДИ в конической пробирке объемом 50 мл. Переверните пробирку два-три раза, чтобы раствор хорошо перемешался, затем отфильтруйте раствор с помощью шприцевого фильтра 0,2 мкм.
ПРИМЕЧАНИЕ: Храните его при температуре 4 °C и обязательно защищайте от воздействия прямых солнечных лучей. - Поместите устройство Gut-on-a-Chip в сухую духовку при температуре 60 °C и инкубируйте не менее 30 минут, чтобы удалить оставшуюся влагу.
- Подвергните устройство Gut-on-a-Chip воздействию ультрафиолета и озона в течение 60 минут с помощью генератора УФ/озона.
ПРИМЕЧАНИЕ: Чтобы обеспечить оптимальную активацию поверхностей PDMS во время обработки, соблюдайте расстояние примерно 3 см или менее между УФ-лампой и устройством. Избегайте переполнения устройств в генераторе, чтобы обеспечить эффективную поверхностную активацию. - Закрепите входную, перепускную и выпускную трубки верхнего микроканала, зажав их зажимами с помощью зажимов для связующих. Также зажмите впускную трубку для нижнего микроканала.
- Отсоедините выпускную трубку для нижнего микроканала. Убедитесь, что перепускная трубка нижнего микроканала остается открытой.
- С помощью микропипетки Р100 ввести 100 мкл 1% раствора ПЭИ через выходное отверстие нижнего микроканала.
ПРИМЕЧАНИЕ: Рекомендуется выполнять этот процесс, пока устройство еще теплое от воздействия ультрафиолета/озона. Наблюдайте за тем, как раствор PEI протекает через микроканал, а раствор PEI капает и выходит из байпасной трубки в нижний микроканал. - Подсоедините выпускную трубку для нижнего микроканала.
- Закрепите входную, перепускную и выпускную трубки нижнего микроканала, зажав их зажимами с помощью зажимов для связующих. Также зажмите входную трубку для верхнего микроканала.
- Отсоедините выпускную трубку для верхнего микроканала. Убедитесь, что перепускная трубка верхнего микроканала остается открытой.
- С помощью микропипетки Р100 вводят 100 мкл 1% раствора ПЭИ через выходное отверстие верхнего микроканала.
ПРИМЕЧАНИЕ: Наблюдайте за тем, как раствор PEI протекает через микроканал, а раствор PEI капает наружу из байпасной трубки для верхнего микроканала. - Снова присоедините выпускную трубку верхнего микроканала.
- После того, как верхний и нижний микроканалы будут заполнены 1% раствором PEI, дайте устройству инкубироваться при комнатной температуре (RT) в течение 10 минут.
- Выполните шаги 1,5-1,12 с 0,1% раствором ГА.
- После того, как верхний и нижний микроканалы будут заполнены 0,1% раствором ГА, дайте устройству инкубироваться при RT в течение 20 минут.
- Выполните шаги 1.5-1.12 с деионизированной водой, чтобы удалить излишки поверхностного активационного раствора.
- Поместите чипсы в сухую духовку при температуре 60 °C и дайте им высохнуть в течение ночи.
ПРИМЕЧАНИЕ: Обязательно снимите зажимы связующего со всех трубок, чтобы избежать столкновения с трубкой. Этот процесс сушки имеет решающее значение для равномерной активации микроканала внутри Gut-on-a-Chip12.
2. Покрытие внеклеточного матрикса (ВКМ) и подготовка питательной среды для культивирования Gut-on-a-Chip
- Приготовьте смесь ECM с органоидной базальной средой так, чтобы конечная концентрация коллагена I и матригеля составляла 60 мкг/мл и 2 % (об/об) соответственно.
ПРИМЕЧАНИЕ: Приготовьте 50 мкл смеси ECM на кишечный чип (т. е. 20 мкл смеси ECM для каждого верхнего и нижнего микроканала и 10 мкл дополнительно). Приготовьте его в день использования и храните его при температуре 4 °C или положите на лед до тех пор, пока он не будет готов к использованию. - Выньте из сухой духовки Gut-on-a-Chip, обработанный УФ/озоном, PEI и GA.
ПРИМЕЧАНИЕ: Осмотрите под фазово-контрастным микроскопом, чтобы увидеть, есть ли остаточная влага. - Дайте Gut-on-a-Chip остыть в шкафу биобезопасности в течение 10 минут.
- Закрепите входную, перепускную и выпускную трубки верхнего микроканала, зажав их зажимами с помощью зажимов для связующих. Также зажмите впускную трубку для нижнего микроканала.
- Отсоедините выпускную трубку для нижнего микроканала.
- С помощью микропипетки Р100 введите 20 мкл смеси ECM через выходное отверстие нижнего микроканала.
ПРИМЕЧАНИЕ: Наблюдайте за тем, как смесь ECM протекает через микроканал без улавливания пузырьков воздуха. Если есть пузырьки воздуха, введите дополнительную смесь ECM в нижний микроканал до тех пор, пока пузырь не исчезнет. - Снова подсоедините выпускную трубку для нижнего микроканала.
- Закрепите входную, перепускную и выпускную трубки нижнего микроканала, зажав их зажимами с помощью зажимов для связующих. Также зажмите входную трубку для верхнего микроканала.
- Отсоедините выпускную трубку для верхнего микроканала.
- С помощью микропипетки Р100 введите 20 мкл смеси ECM через выходное отверстие верхнего микроканала.
- Снова подсоедините выпускную трубку для верхнего микроканала.
- Поместите чип в увлажненный инкубатор СО2 с 5%СО2 при 37 °C на 1 ч для формирования слоя ECM на мембране PDMS, обработанной PEI и GA (рис. 3A).
ПРИМЕЧАНИЕ: Убедитесь, что все трубки зажаты во время инкубации. - Во время инкубации покрытия ECM подготовьте два шприца объемом 1 мл, содержащие холодную посевную среду, которая представляет собой органоидную питательную среду, не содержащую A8301, но содержащую 10 мкМ Y-27632 и 2,5 мкМ CHIR99021, как сообщалось ранее в Gut-on-a-Chip, полученной из органоидов человека2.
ПРИМЕЧАНИЕ: A8301 был удален из среды для улучшения прикрепления ячеек к покрытому ЭБУ, как сообщалось ранее2. День 0 культивирования Gut-on-a-Chip требует только верхнего микроканального потока. Поэтому подготовьте полный шприц для верхнего канала, в то время как минимум 0,2 мл для нижнего канала. - После завершения нанесения покрытия ECM выньте чип из инкубатора и отпустите зажим на байпасной трубке, подключенной к нижнему микроканалу.
- Подсоедините шприц объемом 1 мл, наполненный посевной средой, к игле с тупым концом, которая соединена с нижним микроканалом Gut-on-a-Chip. Осторожно введите затравочную среду (~50 мкл) в байпасную трубку. После того, как трубка будет заполнена введенной средой, закрепите байпасную трубку, соединенную с нижним микроканалом, связующим зажимом.
- Отпустите зажим выпускной трубки, подключенной к нижнему микроканалу. Осторожно введите высевающую среду в нижний микроканал, чтобы она беспрепятственно протекала через систему. Закрепите выпускную трубку, соединенную с нижним микроканалом, зажимом для связующего после перфузии.
- Далее откройте байпасную трубку, подключенную к верхнему микроканалу.
- Подсоедините шприц объемом 1 мл, наполненный посевной средой, к игле с тупым концом, которая соединена с верхним микроканалом Gut-on-a-Chip. Осторожно введите затравочную среду (~50 мкл) в байпасную трубку. После того, как трубка будет заполнена введенной средой, закрепите байпасную трубку, соединенную с верхним микроканалом, зажимом для связующего вещества.
- Освободите выпускную трубку, подключенную к нижнему микроканалу. Осторожно введите высевающую среду в верхний микроканал, чтобы она беспрепятственно протекала через систему. Закрепите выпускную трубку, соединенную с верхним микроканалом, зажимом для связующего после перфузии.
3. Подготовка органоидных клеток кишечника собак к посеву
ПРИМЕЧАНИЕ: Для создания модели Gut-on-a-Chip в этом протоколе использовались органоиды толстой кишки собак (называемые колоноидами), полученные от собак с ВЗК. Эти колоноиды были получены из трех-пяти небольших фрагментов биопсированной ткани толстой кишки в соответствии с ранее описанным методом15,18. Для достижения оптимальных результатов крайне важно использовать колоноиды собак, которые прошли как минимум три культуральных пассажа для создания стабильных органоидов, пригодных для применения in vitro. Рекомендуется культивировать колоноиды собак в течение не менее 3-4 дней, чтобы способствовать адекватной дифференцировке многолинейных клеток внутри органоидов, обеспечивая их функциональную зрелость и пригодность для последующих экспериментов в модели Gut-on-a-Chip. Максимальный предел пассажа для этой работы составляет менее 20, как указано в предыдущем исследовании, которое продемонстрировало неизмененный фенотип и кариотип на протяжении 20 последовательных пассажей25. Сигналы этих доноров представлены в Дополнительной таблице S1.
- Культивирование колоноидов собак в 24-луночных планшетах, погруженных в 30 мкл Matrigel 15,18 с органоидной питательной средой, указанной в таблице материалов, которая является модифицированной из ранее описанной среды 15,26,27. Кондиционированную среду получали путем культивирования клеток Rspo1 и HEK293, сконструированных для секреции Noggin28.
- Выбросьте питательную среду через вакуумное всасывание и введите 500 мкл раствора для восстановления клеток при ледяной температуре в каждую лунку. Выдерживать 30 минут при температуре 4 °C.
ПРИМЕЧАНИЕ: Как правило, три лунки из 24 лунок зрелых органоидов кишечника собак обеспечивают достаточное количество диссоциированных клеток для засеивания одного устройства Gut-on-a-Chip с 40-50 органоидами/одним полем зрения при увеличении x10. - Механически разрушайте купола Matrigel в течение 5 с помощью микропипетки P1000. Затем соберите органоидную суспензию в коническую пробирку объемом 15 мл.
- Центрифугируют коническую пробирку при 200 × г и 4 °С в течение 5 мин с последующим удалением надосадочной жидкости.
- Введите 1 мл трипсиноподобной протеазы при комнатной температуре с добавлением 10 мкМ Y-27632 и ресуспендируйте клеточную гранулу путем пипетирования с помощью микропипетки P1000.
- Поместите клеточную суспензию на водяную баню, установленную при температуре 37 °C, и инкубируйте ее в течение 10 мин, периодически встряхивая смесь.
- Введите 5 мл теплой органоидной базальной среды и энергично пипетируйте клеточную суспензию с помощью микропипетки P1000 до тех пор, пока она не станет мутной, без каких-либо видимых клеточных сгустков.
- Пропустите клеточную суспензию через сетчатый фильтр с отсечкой 70 мкм, чтобы удалить любой мусор Matrigel и крупные клеточные кластеры.
- Центрифугируют коническую трубку при 200 × г и 4 °C в течение 5 мин с последующим ресуспендированием гранул в посевной среде. Для посева одного собачьего устройства Gut-on-a-Chip используйте 20 мкл посевной среды для ресуспендирования клеточной гранулы (т. е. используйте 20 мкл посевной среды при посеве одного устройства Gut-on-a-Chip).
- Изменяйте концентрацию жизнеспособных клеток до 1 × 107 клеток/мл с помощью затравочной среды, как сообщалось ранее2. Проводят оценку жизнеспособности с помощью гемоцитометра, соединяя 10 мкл клеточной суспензии с 10 мкл трипанового синего, а затем наблюдают за клетками под микроскопом.
ПРИМЕЧАНИЕ: Крайне важно правильно отрегулировать концентрацию клеток, чтобы обеспечить оптимальное прикрепление клеток и образование однородного монослоя на мембране чипа. Если начальное количество клеток недостаточно, это может привести к запоздалому или неудачному образованию сливающегося монослоя. И наоборот, если количество клеток чрезмерно, неадгезивные клетки могут агрегировать в скоплениях в канале, что приводит к нежелательным эффектам концентрации.
4. Засев и формирование 2D клеточного монослоя
- Отсоедините выпускную трубку для верхнего микроканала. Убедитесь, что перепускная трубка верхнего микроканала остается открытой. Закрепите вход и выход нижнего микроканала с помощью зажимных зажимов.
- С помощью микропипетки P100 или P20 введите 20 мкл клеточной суспензии из протокола 3 в выходное отверстие верхнего микроканала (рис. 3B «Посев»).
- Закрепите байпас и впускную трубку верхнего микроканала с помощью зажимов для связующего вещества. Затем снова прикрепите выпускную трубку к выпускному отверстию верхнего микроканала, убедившись, что трубка остается открытой на протяжении всего процесса, чтобы избежать давления на верхний микроканал. После этого шага медленно закрепите выпускную трубку верхнего канала с помощью зажима для связующего.
- Убедитесь с помощью микроскопа, что клетки равномерно распределены по верхнему микроканалу.
ПРИМЕЧАНИЕ: Важно зажать трубку, чтобы остановить движение среды в канале, чтобы обеспечить стабильные статические условия до тех пор, пока не будет достигнуто желаемое присоединение ячейки. - Поместите чип в увлажненный инкубатор CO2 при температуре 37 °C.
ПРИМЕЧАНИЕ: Органоидным клеткам кишечника собаки требуется около 3 часов, чтобы прикрепиться к покрытию ECM (Рисунок 3B , Приложение). - Подсоедините шприц, прикрепленный к верхнему микроканалу Gut-on-a-Chip, к шприцевому насосу, расположенному внутри инкубатораCO2 .
ПРИМЕЧАНИЕ: Осторожно промойте среду в микроканал с помощью ручки шприцевого насоса и удалите несвязанные клетки. Осмотрите чип под микроскопом, чтобы убедиться, что все неприкрепленные клетки были эффективно смыты. - Инициируйте поток питательной среды со скоростью 30 мкл/ч с посевной средой. Этот непрерывный поток первоначально предназначен только для верхнего микроканала до создания 2D-монослоя на Gut-on-a-Chip. Для нижнего микроканала оставьте микроканалы зажатыми, а среду непромывной.
- На следующий день после посева клеток смените питательную среду на органоидную питательную среду, содержащую A8301 и не содержащую 10 мкМ Y-27632 и 2,5 мкМ CHIR99021.
- После того, как монослой установлен, инициируйте непрерывный поток среды в нижний микроканал. Обычно клеткам органоидного эпителия кишечника собак требуется от 2 до 3 дней, чтобы создать эпителиальные монослои (рис. 3C).
5. Установление 3D морфогенеза у собак Gut-on-a-Chip
ПРИМЕЧАНИЕ: После того, как сливающиеся монослои сформированы в Gut-on-a-Chip, был введен средний поток как верхнего, так и нижнего каналов и клеточного штамма, чтобы инициировать 3D-морфогенез в 2D-монослой, как показано на рисунке 2.
- Введение органоидной питательной среды как в верхний, так и в нижний микроканалы, чтобы инициировать развитие 3D-морфогенеза в системе Gut-on-a-Chip. Для достижения напряжения сдвига 0,02 дин/см2 в существующей конструкции Gut-on-a-Chip (т. е. микроканале высотой 500 мкм) увеличьте расход до 50 мкл/ч29.
- Инициируйте 10% клеточной деформации и частоту 0,15 Гц, как рекомендовано в пункте2, с помощью компьютеризированного биореактора, применяющего циклическое напряжение к клеткам, культивируемым in vitro. Этот процесс будет применять вакуумное всасывание к устройству Gut-on-a-Chip.
- Выдерживайте эти условия культивирования не менее 2-3 дней. Трехмерный морфогенез монослоя кишечника собак обычно происходит через 2-3 дня после того, как был начат поток из твердых мозгов и вакуумное отсасывание (рис. 3C).
6. Характеристика собачьей кишки на чипе
- Визуализация живых клеток
- Удалите все пузырьки воздуха в Gut-on-a-Chip, осторожно подавая среду с помощью шприцевого насоса.
- Отсоедините устройство Gut-on-a-Chip от шприцевого насоса.
ПРИМЕЧАНИЕ: Избегайте любых маневров, которые могут оказать давление внутри Gut-on-a-Chip. - Поместите устройство на микроскоп, чтобы получить изображения установленного 3D-эпителия. Для визуализации структуры 3D-слоев эпителия с помощью фазового контраста используют объективы 10x и 20x (рис. 3C).
- Иммунофлуоресцентное окрашивание
- Приготовьте блокирующий раствор, растворив 1 г БСА в 50 мл фосфатного буферного раствора (ФБС) до получения 2% БСА. Пропустите раствор через шприцевой фильтр 0,2 мкм для фильтрации. Храните этот раствор при температуре 4 °C.
- Приготовьте пермеабилизирующий раствор, смешав 150 мкл Triton X-100 с 50 мл блокирующего раствора, в результате чего конечная концентрация Triton X-100 составила 0,3%. Пропустите раствор через шприцевой фильтр 0,2 мкм для фильтрации. Храните этот раствор при температуре 4 °C.
- Выполните фиксацию клеток путем введения 100 мкл 4% PFA как в верхний, так и в нижний микроканалы, как описано в шагах 2.4-2.11.
- Промойте клетки, введя 100 мкл PBS в верхние и нижние микроканалы, как описано в шагах 2.4-2.11.
- Выполните пермеабилизацию клеток, введя 100 мкл 0,3% Triton в верхние и нижние микроканалы, как описано в шагах 2.4-2.11. Поместите устройство в режим RT на 30 минут.
- Промойте клетки, введя 100 мкл PBS в верхние и нижние микроканалы, как описано в шагах 2.4-2.11.
- Выполняйте блокирование клеток для предотвращения неспецифического связывания, вводя 100 мкл 2% БСА как в верхние, так и в нижние микроканалы, как описано в шагах 2.4-2.11. Поместите прибор в режим RT на 1 час.
- Вводят 20 мкл раствора первичных антител, разбавленных 2% БСА, и помещают в РТ на 3 ч с последующей ночной инкубацией при 4 °C.
ПРИМЕЧАНИЕ: Убедитесь, что все трубки зажаты во время инкубации при температуре 4 °C в течение ночи. Концентрация первичного антитела должна быть в 2-5 раз выше рекомендуемой концентрации для монослойного или 3D-органоидного окрашивания (дополнительный рисунок S1). - Промойте клетки, введя 100 мкл PBS в верхние и нижние микроканалы, как описано в шагах 2.4-2.11.
- Вводят 20 мкл раствора вторичных антител, разбавленных 2% БСА, и помещают его на РТ на 1 ч.
ПРИМЕЧАНИЕ: Убедитесь, что все трубки зажаты во время инкубации. Начиная с этого этапа, необходимо экранировать устройство алюминиевой фольгой, чтобы предотвратить фотообесцвечивание. - Промойте клетки, введя 100 мкл PBS в верхние и нижние микроканалы, как описано в шагах 2.4-2.11.
- Готовят комбинированный раствор для противоокрашивания F-актином и DAPI (диамидино-2-фенилиндолом). Введите 20 мкл комбинированного раствора в верхние и нижние микроканалы, как описано в шагах 2.4-2.11.
- Промойте клетки, введя 100 мкл PBS в верхние и нижние микроканалы, как описано в шагах 2.4-2.11.
Выполнить флуоресцентную визуализацию архитектуры 3D-эпителиальных клеток с помощью флуоресцентного микроскопа или конфокального микроскопа.
7. Барьерная функция эпителия
- Удалите все пузырьки воздуха в Gut-on-a-Chip, осторожно подавая среду с помощью шприцевого насоса. Убедитесь, что все трубки открыты во время измерения.
- Извлеките Gut-on-a-Chip из шприцевого насоса и поместите его в RT не менее чем на 10 минут.
- Извлеките электроды Ag/AgCl из 70% раствора EtOH.
- Поместите два электрода Ag/AgCl в верхний вход и нижний выход соответственно, чтобы измерить сопротивление эпителиального слоя с помощью мультиметра.
- Поместите два электрода Ag/AgCl в нижний вход и верхний выход соответственно. Укажите среднее значение этих двух значений в качестве значения сопротивления для Gut-on-a-Chip.
ПРИМЕЧАНИЕ: Пустой TEER следует измерять на Gut-on-a-Chip только с покрытием ECM без эпителия. - Вычислить значение трансэпителиального электрического сопротивления (кОм ×см2) можно с помощью уравнения (1).
TEER = (Ωt - Ωпусто) × A (1)
Где Ωt — это значение сопротивления, измеренное в определенный момент времени с начала эксперимента, Ωblank — это значение сопротивления, измеренное в то время без эпителия, а A — площадь поверхности, покрытой клеточным слоем (приблизительно 0,11см2 для этой конструкции Gut-on-a-Chip29).- Рассчитайте нормализованный TEER с помощью уравнения (2).
ТИР =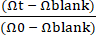 (2)
(2)
Где Ω0 — это значение сопротивления в момент начального считывания эксперимента, как сообщалось ранее,30 (рис. 4C).
- Рассчитайте нормализованный TEER с помощью уравнения (2).
Representative Results
Этот протокол надежно способствует спонтанному развитию 3D-морфогенеза кишечника в системе Gut-on-a-Chip. В этом подходе используются эпителиальные клетки кишечника собак, полученные из кишечных органоидов, полученных от собак, страдающих воспалительным заболеванием кишечника (ВЗК) (рис. 1B). Периодическая кластеризация 3D-морфогенеза эпителиальных клеток кишечника собак может наблюдаться по всему микроканалу после 6-9 дней среднего потока (рис. 3C). Эти морфологические изменения можно отслеживать с помощью фазово-контрастных методов. В этом исследовании мы использовали органоиды, полученные от двух собак с диагнозом ВЗК. Примечательно, что успешный 3D-морфогенез наблюдался в двух биологических репликациях, каждый из которых выполнялся с двумя техническими репликатами. Результаты этого исследования обеспечивают основу для будущих исследований с участием кишечных органоидов, полученных от других доноров собак. Эти результаты демонстрируют потенциальную применимость и воспроизводимость нашего экспериментального подхода, о котором ранее сообщалось на человеческих образцах. Эти результаты являются еще одним подтверждением того, что технология Gut-on-a-Chip применима к эпителиальным клеткам кишечника собак, как сообщалось ранее в исследованиях с использованием эпителиальных клеток кишечника человека2.
Этот протокол показал, что иммунофлуоресцентное окрашивание может быть использовано для оценки 3D-структуры органоидных монослоев, образовавших ворсинчатые структуры в микрофлюидных чипах, с помощью обычной флуоресцентной микроскопии (рис. 4 А,Б). Этот протокол может быть адаптирован для валидации дифференцированных и пространственно организованных клеточных фенотипов с помощью иммунофлуоресцентного окрашивания. Визуализация 3D-морфогенеза в кишечнике-на-чипе дает прекрасную возможность исследовать реакцию хозяина при различных патологических взаимодействиях 14,23,31. В сочетании с эпителиальными клетками, полученными от доноров-пациентов, как это было описано ранее на людях, эта технология может быть использована для построения персонализированных моделей кишечных заболеваний13. Благодаря интеграции иммунофлуоресцентной визуализации с методами таргетной визуализации РНК, такими как флуоресцентная гибридизация in situ, можно визуально анализировать транскриптомы и протеомы хозяина в системе Gut-on-a-Chip.
Сохранение целостности кишечной мембраны жизненно важно для поддержания кишечного гомеостаза, и платформа Gut-on-a-Chip обеспечивает ценное преимущество, позволяя точно контролировать и количественно оценивать эту важнейшую функцию. Измерение TEER с помощью технологии Gut-on-a-Chip имеет ряд преимуществ. Например, в предыдущих исследованиях была проведена успешная оценка TEER при совместном культивировании клеток кишечника с непатогенными и пробиотическими бактериями32, а также в условиях дырявого кишечника23. Это позволяет исследователям изучать влияние различных состояний на барьерную функцию кишечника и определять потенциальные вмешательства для укрепления здоровья кишечника.
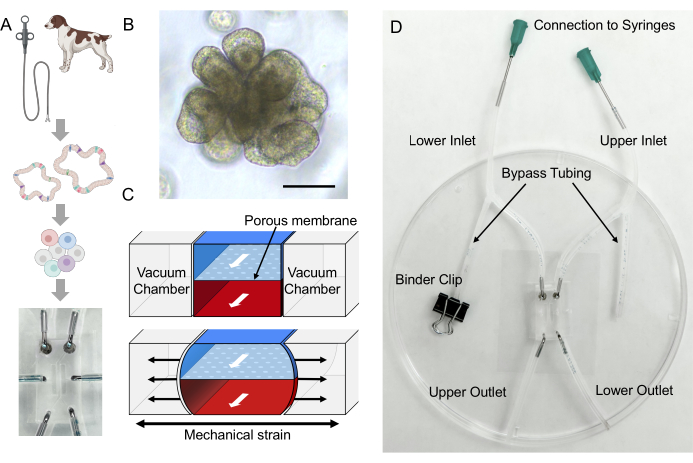
Рисунок 1: Создание системы Gut-on-a-Chip для собак с ВЗК, полученной от пациентов. (A) Интеграция кишечных органоидов пациента и платформы Gut-on-a-Chip. Эндоскопическая биопсия может быть выполнена для выделения клеток кишечных крипт для разработки специфических для доноров кишечных органоидов. Эпителиальные клетки могут быть диссоциированы на отдельные клетки из органоидов, затем высеяны в Gut-on-a-Chip на основе PDMS и культивированы в уникальном динамическом микроокружении. (Б) Репрезентативные изображения колоноидов собаки с ВЗК. Масштабная линейка = 100 мкм. (C) На этой схеме показано устройство Gut-on-a-Chip, состоящее из пористой мембраны, расположенной между верхним и нижним микроканалами. Верхний микроканал обозначен синей областью, а нижний — красной. С каждой стороны микроканала имеются вакуумные камеры, которые деформируют пористую мембрану, имитируя перистальтическое движение24. (D) Установка собачьего Gut-on-a-Chip включает в себя Gut-on-a-Chip на основе PDMS в сборе с трубкой, которая размещена на защитном листе 2,24. Байпасная трубка имеет решающее значение для предотвращения образования давления в микроканале во время работы (т. е. при подключении к шприцам). Зажимы для связующего используются для зажима трубки. Чувствительные к объему материалы могут вводиться через открытые отверстия верхнего или нижнего выпускного отверстия. Органоидную питательную среду можно инфузивировать, подсоединив шприцы к иглам с тупым концом и протекающим через верхний и нижний вход. Сокращения: ВЗК = воспалительное заболевание кишечника; ПДМС = полидиметилсилоксан. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
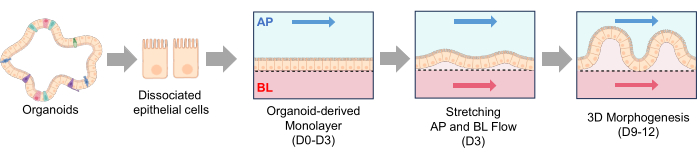
Рисунок 2: Формирование ворсинчатых структур при ВЗК собак Gut-on-a-Chip. Диссоциированные эпителиальные клетки были высеяны в покрытую ECM систему Gut-on-a-Chip. После того, как диссоциированные клетки были прикреплены к мембране PDMS, в течение 3 дней инициировался апикальный поток (D0-D3). При образовании сливающегося 2D монослоя (D3) инициируется базолатеральный поток с частым растяжением (Stretching, AP и BL Flow). Через 2-3 суток двойного потока и растяжения мембраны 2D монослой начинает развивать 3D морфогенез, а ворсинчатые структуры образуются после 9 суток культивирования (3D морфогенез, D9-D12). Сокращения: ECM = внеклеточный матрикс; ПДМС = полидиметилсилоксан; AP = верхушечный; BL = базолатеральный. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Рисунок 3: Посев органоидов в кишечнике собак и 3D-морфогенез в кишечнике-на-чипе . (A) Экспериментальные этапы поверхностной активации пористой мембраны в Gut-on-a-Chip на основе PDMS. Использование УФ/озоновой обработки, обработки PEI и GA в сочетании облегчает сшивание аминов, присутствующих в растворах ECM. Этот процесс приводит к стабильной иммобилизации белков ECM на пористой мембране. (B) Фазово-контрастные изображения демонстрируют морфологию клеток сразу после посева (слева) и через 3-5 ч после посева (справа). Пористая мембрана через 3 часа после посева показывает более тонкие и темные участки, где прикрепились отдельные клетки, подчеркивая процесс прикрепления. (C) Фазово-контрастные изображения отображают 3D-морфогенез монослоев кишечника в системе Gut-on-a-Chip. Эти монослои были получены от собак, пораженных ВЗК, и эти органоидные клетки культивировались в течение 12 дней в динамических условиях, которые включали поток жидкости и растягивающие движения. Масштабные линейки = 50 мкм (B,C). Сокращения: ВЗК = воспалительное заболевание кишечника; ECM = внеклеточный матрикс; ПДМС = полидиметилсилоксан; ПЭИ = полиэтиленимин; GA = глутаровый альдегид. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
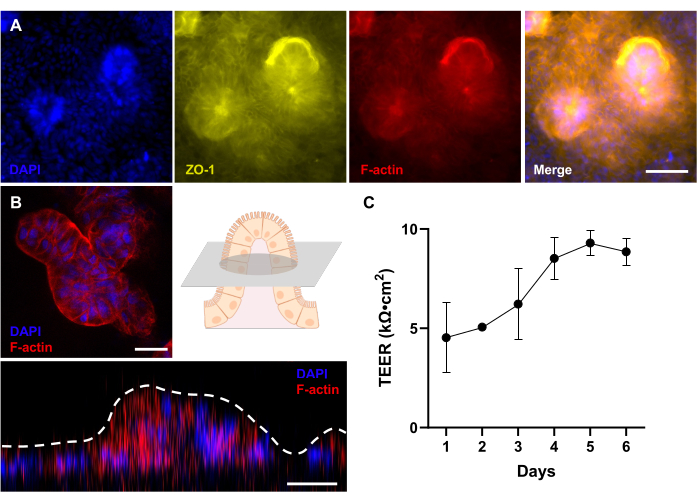
Рисунок 4: Оценка 3D-морфологического развития у собак Gut-on-a-Chip . (A) Иммунофлуоресцентная визуализация кишечника на чипе у собак с ВЗК, демонстрирующая вид сверху вниз полностью развитого 3D-эпителия после 12 дней культивирования, который оценивается с помощью флуоресцентного микроскопа. Белок плотного соединения (ZO-1) визуализирован желтым цветом; кисточно-каймовая мембрана (F-актин) окрашена в красный цвет; а ядра окрашены DAPI и выглядят синими. (B) Иммунофлуоресцентная визуализация кишечника на чипе у собак с ВЗК с использованием конфокального микроскопа с линзой на большом расстоянии. Как показано на схеме, показано флуоресцентное изображение поперечного среза ворсинчатой структуры полностью развитого 3D эпителия через 12 суток культивирования. Кроме того, Z-укладка показывает вид 3D эпителия сбоку, на котором видно образование ворсинчатых структур. Кисточная мембрана (F-актин) окрашена в красный цвет, а ядра окрашены DAPI и выглядят синими. (C) Функция кишечного барьера была оценена и измерена с помощью TEER у собак Gut-on-a-Chips, полученных от пациентов. Стабильные значения TEER были достигнуты на 5-й день культивирования на Gut-on-a-Chip. Столбцы погрешности выражают РЭМ измерений. Значение TEER измерялось между двумя биологическими репликатами с одной технической репликацией. Масштабные линейки = 50 мкм (А), 25 мкм (В). Сокращения: ВЗК = воспалительное заболевание кишечника; DAPI = 4',6-диамидино-2-фенилиндол; TEER = трансэпителиальное электрическое сопротивление. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Дополнительный рисунок S1: Характеристика поликлональных антител против ZO-1 в монослоях колоноидов собак и на устройствах Gut-on-a-Chip. (А) Иммунофлуоресцентное окрашивание ZO-1 в желтый цвет с F-актином в красном цвете и их наложение. Масштабная линейка = 25 мкм. (B) Иммунофлуоресцентная визуализация ZO-1 желтого цвета в «Дырявых кишечных чипсах» проводилась в различных условиях, включая стимуляцию пробиотическими бактериями (LGG + цитокины или VSL#3 + цитокины) и безмикробный контроль без пробиотической стимуляции (цитокины). Масштабная линейка = 50 мкм. Эта цифра воспроизведена из Min et al.23. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительная таблица S1: Сводная информация о донорах тканей. Сводная таблица по возрасту, полу, породе, гистопатологической оценке и индексу активности ВЗК у собак (CIBDAI). CIBDAI — это числовая система оценки, используемая для определения клинической тяжести ВЗК33 у собак. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Discussion
Это исследование знаменует собой новаторскую демонстрацию совместимости органоидов кишечника собак с разработкой модели кишечника на чипе у собак. Интеграция кишечных органоидов и однослойных культур, полученных из органоидов, в микрофлюидную систему (т.е. систему Gut-on-a-Chip) еще больше развила технологию, позволив создавать модели кишечника in vitro , которые точно имитируют физиологическую динамику и являются более репрезентативными для биологических условий. В частности, поскольку существует очень мало сообщений о культуре Gut-on-a-Chip с использованием органоидов, полученных из ВЗК, у людей, текущее исследование с использованием Gut-on-a-Chip, полученного из ВЗК у собак, может дать ведущее представление об изучении ВЗК у людей.
Успешное развитие 3D-морфогенеза эпителия кишечника собак на Gut-on-a-Chip требует тщательного внимания к нескольким критическим этапам. Во-первых, гидрофобная поверхность микрофлюидных каналов PDMS может препятствовать адгезии ECM и последующему прикреплению клеток, что приводит к необходимости поверхностной активации PDMS перед нанесением покрытия ECM и посевом клеток (см. раздел протокола 1). Для достижения стабильной монослойной культуры крайне важно удаление избыточных неприкрепленных клеток после прикрепления клеток (этапы протокола 4.6-4.7). Кроме того, динамическая стимуляция, такая как постоянный поток среды и перистальтическое движение вакуума, необходима для 3D-морфогенеза кишечного эпителия (шаг протокола 5.2). Осторожное обращение необходимо для того, чтобы избежать образования пузырьков воздуха в микроканале на любых этапах культивирования Gut-on-a-Chip.
Если вы столкнулись с плохим посевом клеток в кишечник-на-чипе, это может быть связано с низким количеством клеток или плохим прикреплением клеток. Для устранения неполадок с низким количеством клеток важно проверить здоровье подготовленных кишечных органоидов, наблюдая за их ростом в Матригеле. Жизнеспособность клеток может быть оценена с помощью окрашивания трипановым синим после диссоциации клеток, чтобы убедиться, что не более 20% клеток мертвы. Если количество жизнеспособных клеток недостаточно, можно попытаться оптимизировать условия органоидной среды. Другой возможностью является неполная органоидная диссоциация, приводящая к избытку клеточных скоплений размером более 70 мкм, которые попадают в ловушку фильтра. Чтобы решить эту проблему, одним из вариантов является увеличение продолжительности пипетирования во время диссоциации клеток. В качестве альтернативы коническую пробирку объемом 15 мл можно осторожно встряхивать каждую минуту во время лечения трипсиноподобной протеазой. Плохое прикрепление клеток к Gut-on-a-Chip может быть связано с неправильным покрытием ECM. В процессе нанесения покрытия рекомендуется тщательно проверять наличие пузырьков воздуха и предотвращать их образование, осторожно добавляя больше раствора покрытия по мере необходимости. Переполненность клеток и неспособность смыть неприкрепленные клетки могут привести к недостаточному исходному монослою. В таком случае при нажатии на поршень шприца может быть применена слабая пульсация. Эти действия по устранению неполадок могут помочь выявить и устранить проблемы в процессе культивирования Gut-on-a-Chip.
Несмотря на то, что эта платформа Gut-on-a-Chip позволяет создавать волнообразные 3D-слои эпителия, мы признаем необходимость дополнительной биологической сложности для полной репликации микроокружения кишечника. Крайне важно учитывать взаимодействие между эпителиальными и мезенхимальными клетками, осаждение ECM для 3D-регенерации и наличие характеристик крипт-ворсинок, которые устанавливают подходящую нишу стволовых клеток. Стромальные клетки, такие как фибробласты, играют жизненно важную роль в производстве белков ECM и регуляции кишечного морфогенеза34,35,36. Включение мезенхимальных клеток в эту модель имеет потенциал для усиления как морфогенеза, так и эффективности прикрепления клеток. Эндотелиальные слои, которые охватывают капиллярную сосудистую сеть и лимфатические сосуды, играют решающую роль в управлении молекулярным транспортом и рекрутировании иммунных клеток37,38. Включение иммунных клеток, полученных от пациентов, может иметь важное значение при моделировании кишечных заболеваний, поскольку оно позволяет продемонстрировать взаимодействие между врожденным и адаптивным иммунитетом, а также установить тканеспецифический иммунитет39. После завершения 3D-морфогенеза на Gut-on-a-Chip питательная среда органоидов может быть модифицирована в среду дифференцировки органоидов. Это может быть жизнеспособным подходом для индуцирования дополнительной клеточной дифференцировки, в зависимости от целей эксперимента.
Визуализация 3D-микроархитектуры in situ является сложной задачей из-за большого рабочего расстояния, которое может быть преодолено с помощью объектива на большом расстоянии. Кроме того, послойные методы микроизготовления и склеивания затрудняют доступ к верхним слоям для исследования с помощью СЭМ. Для текущей конструкции Gut-on-a-Chip требуется один шприцевой насос на каждое микроустройство Gut-on-a-Chip, что занимает место в инкубатореCO2 и предотвращает крупномасштабные эксперименты. Инновации необходимы для повышения масштабируемости для удобной платформы и высокопроизводительного скрининга.
Эти современные протоколы позволяют спонтанно разрабатывать 3D-эпителиальные слои in vitro, преодолевая ограничения традиционных 3D-органоидов, 2D-монослоев и статических микроустройств культуральных систем. Эту динамику микроокружения кишечника in vitro можно контролировать, вводя кокультуру различных типов клеток. В предыдущих исследованиях изучались методы манипулирования микроокружением кишечника-на-чипе, включая совместное культивирование кишечного микробиома14,23 и периферических мононуклеарных клеток30. Эта восстановленная микросреда имеет множество потенциальных применений, включая тестирование лекарств, фундаментальные механистические исследования и моделирование заболеваний. Реконструированное микроокружение обладает значительным потенциалом для широкого спектра применений, таких как тестирование на наркотики 23,40,41 и моделирование заболеваний 12,13,14,30, а также фундаментальные механистические исследования морфогенеза кишечника 42. Различные анализы могут быть выполнены либо путем сбора надосадочной жидкости для оценки метаболитов 43, либо путем сбора клеток для геномного исследования 2,32, либо путем визуального обследования клеток с использованием красителей из живых клеток или фиксации для последующей иммунофлуоресцентной визуализации 23,44.
В данном исследовании представлен воспроизводимый протокол разработки 3D-морфогенеза эпителиальных слоев кишечника собак на платформе Gut-on-a-Chip. Полученная 3D-структура эпителия обеспечивает более реалистичное представление микроокружения кишечника, что имеет огромный потенциал для применения в различных биомедицинских исследованиях. Используя эту архитектуру кишечника, мы можем проводить больше трансляционных исследований и потенциально давать многообещающие результаты.
Disclosures
У авторов нет конфликта интересов, о котором можно было бы заявлять.
Acknowledgements
Мы хотели бы поблагодарить Службу внутренней медицины мелких домашних животных WSU (д-р Джиллиан Хейнс, д-р Сара Гесс, Шелли Энсайн LVT) и координатора клинических исследований WSU VTH Валори Висс за их поддержку в наборе случаев и сборе образцов у гражданских ученых (доноров-пациентов). Эта работа была частично поддержана канцелярией директора Национальных институтов здравоохранения (K01OD030515 и R21OD031903 для Y.M.A.) и Японским обществом содействия науке за рубежом (202280196 для молодых исследователей). Рисунки 1A и 3A были созданы с помощью BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| Organoid basal medium | |||
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| GlutaMAX | Gibco | 35050-061 | 2 mM, glutamine substitute |
| 1 M HEPES | VWR Life Science | J848-500ML | 10 mM |
| 100x penicillin–streptomycin | Corning | MT30009CI | 1x |
| Organoids and organoid medium | |||
| A-83-01 | PeproTech | 9094360 | 500 nM |
| B27 supplement | Gibco | 17504-044 | 1x |
| CHIR99021 | Reprocell | 04-0004-base | 2.5 µM |
| HEK293 cells engineered to secrete Noggin | Baylor College of Medicine | ||
| Murine EGF | PeproTech | 315-09-1MG | 50 ng/mL |
| Murine Wnt-3a | PeproTech | 315-20-10UG | 100 ng/mL |
| N-Acetyl-L-cysteine | Sigma | A9165-25G | 1 mM |
| N2 MAX Media supplement | Gibco | 17502-048 | 1x |
| Nicotinamide | Sigma | N0636-100G | 10 mM |
| Noggin Conditioned Medium | NA | NA | 10% vol/vol |
| Primocin | InvivoGen | ant-pm-1 | 100 µg/ml |
| R-spondin1 (Rspo1) cells | Trevigen | 3710-001-01 | Rspo1 cells |
| R-Spondin-1 Conditioned Medium | NA | NA | 20% vol/vol |
| SB202190 | Sigma-Aldrich | S7067-25MG | 10 µM |
| Y-27632 | StemCellTechnologies | 72308 | 10 µM |
| [Leu15 ]-Gastrin I human | Sigma-Aldrich | G9145-.5MG | 10 nM |
| Reagents | |||
| 4% Paraformaldehyde solution | Fisher Scientific | AAJ19943K2 | |
| Alexa Fluor 647 Phalloidin | Thermo Fisher Scientific | A22287 | x250 dilution |
| Anti-Rabbit IgG H&L labeled with Alexa Fluor 555 | Abcam | ab150078 | x1,000 dilution |
| Anti-ZO-1 polyclonal antibody | Thermo Fisher Scientific | 61-7300 | x50 dilution |
| Cell Recovery Solution | Corning | 354253 | |
| Collagen I, Rat Tail 3 mg/mL | Gibco | A10483-01 | |
| Diamidino-2-phenylindole (DAPI) | Thermo Fisher Scientific | 62248 | x1,000 dilution |
| EMS Glutaraldehyde Aqueous 50% | Electron Microscopy Sciences | 16320 | |
| Matrigel Matrix | Corning | 356255 | |
| Poly(ethyleneimine) solution | Sigma | 408700-250ML | |
| TrypLE Express | Gibco | 12604-021 | |
| Materials and Equipment | |||
| 24-well culture plates | Corning | 3524 | |
| 87V Industrial Multimeter | Fluke Corporation | ||
| Centrifuge | Eppendorf | 5910R | |
| CO2 incubator | Eppendorf | C170i | |
| DMi8 fluorescence microscope | Leica microsystems | DMi8 | |
| Dry oven | Fisher Scientific | 15-103-0519 | |
| FlexCell FX-5000 Tension system | Flexcell International Corporation | ||
| Inverted phase-contrast microscope | Leica microsystems | DMi1 | |
| SP8-X inverted confocal microscope | Leica microsystems | SP8-X | |
| Syringe pump | Braintree Scientific | model no. BS-8000 120V | |
| Syringe, 3 mL sterile | BD Biosciences | 14-823-435 | |
| Syringes, 1 mL sterile | BD Biosciences | 14-823-434 | |
| UV/ozone generator | Jelight Company | model no. 30 | |
| Software | |||
| LAS X imaging software | Leica microsystems |
References
- Shanks, N., Greek, R., Greek, J. Are animal models predictive for humans. Philosophy, ethics, and humanities in medicine: PEHM. 4, 2 (2009).
- Shin, W., Kim, H. J. 3D in vitro morphogenesis of human intestinal epithelium in a gut-on-a-chip or a hybrid chip with a cell culture insert. Nature protocols. 17 (3), 910-939 (2022).
- Coelho, L. P., et al. Similarity of the dog and human gut microbiomes in gene content and response to diet. BMC Biome. 6 (72), 1-11 (2018).
- German, A. J. The growing problem of obesity in dogs and cats. The Journal of Nutrition. 136, 1940-1946 (1940).
- Patronek, G. J., Waters, D. J., Glickman, L. T. Comparative longevity of pet dogs and humans: Implications for gerontology research. Journals of Gerontology - Series A Biological Sciences and Medical Sciences. 52 (3), B171-B178 (1997).
- Lutz, T. A. Mammalian models of diabetes mellitus, with a focus on type 2 diabetes mellitus. Nature reviews. Endocrinology. 19 (6), 350-360 (2023).
- Allenspach, K., Culverwell, C., Chan, D. Long-term outcome in dogs with chronic enteropathies: 203 cases. Veterinary Record. 178 (15), 368 (2016).
- Patnaik, A. K., Hurvitz, A. I., Johnson, G. F. Canine gastrointestinal neoplasms. Veterinary Pathology. 14 (6), 547-555 (1977).
- Saito, T., et al. Immunohistochemical analysis of beta-catenin, e-cadherin and p53 in canine gastrointestinal epithelial tumors. Journal of Veterinary Medical Science. 82 (9), 1277-1286 (2020).
- Kopper, J. J., et al. Harnessing the biology of canine intestinal organoids to heighten understanding of inflammatory bowel disease pathogenesis and accelerate drug discovery: A One Health approach. Frontiers in Toxicology. 3, 1-13 (2021).
- Jalili-firoozinezhad, S., et al. A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nature Biomedical Engineering. 3 (7), 520-531 (2019).
- Shin, W., et al. Robust formation of an epithelial layer of human intestinal organoids in a polydimethylsiloxane-based Gut-on-a-Chip microdevice. Frontiers in Medical Technology. 2, (2020).
- Shin, Y. C., et al. Three-dimensional regeneration of patient-derived intestinal organoid epithelium in a physiodynamic mucosal Interface-on-a-Chip. Micromachines. 11 (7), 663 (2020).
- Tovaglieri, A., et al. Species-specific enhancement of enterohemorrhagic E. coli pathogenesis mediated by microbiome metabolites. Microbiome. 7 (1), 43 (2019).
- Chandra, L., et al. Derivation of adult canine intestinal organoids for translational research in gastroenterology. BMC Biology. 17 (1), 1-21 (2019).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Wilson, S. S., Tocchi, A., Holly, M. K., Parks, W. C., Smith, J. G. A small intestinal organoid model of non-invasive enteric pathogen-epithelial cell interactions. Mucosal Immunology. 8 (2), 352-361 (2015).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), 1-17 (2020).
- Gabriel, V., et al. Canine intestinal organoids in a dual-chamber permeable support system. Journal of Visualized Experiments. 2 (181), 1-24 (2022).
- Yamada, A., et al. Confronting emerging zoonoses: the one health paradigm. Confronting Emerging Zoonoses: The One Health Paradigm. , 1 (2014).
- Lerner, H., Berg, C. The concept of health in One Health and some practical implications for research and education: what is One Health. Infection Ecology & Epidemiology. 5 (1), 25300 (2015).
- Garcia, S. N., Osburn, B. I., Jay-Russell, M. T. One Health for food safety, food security, and sustainable food production. Frontiers in Sustainable Food Systems. 4, 1-9 (2020).
- Min, S., et al. Live probiotic bacteria administered in a pathomimetic Leaky Gut Chip ameliorate impaired epithelial barrier and mucosal inflammation. Scientific Reports. 12 (1), 22641 (2022).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Qu, M., et al. Establishment of intestinal organoid cultures modeling injury-associated epithelial regeneration. Cell Research. 31 (3), 259-271 (2021).
- Sahoo, D. K., et al. Differential transcriptomic profiles following stimulation with lipopolysaccharide in intestinal organoids from dogs with inflammatory bowel disease and intestinal mast cell tumor. Cancers. 14 (14), 3525 (2022).
- Gabriel, V., et al. Standardization and maintenance of 3D canine hepatic and intestinal organoid cultures for use in biomedical research. Journal of Visualized Experiments. (179), 1-28 (2022).
- Heijmans, J., et al. ER stress causes rapid loss of intestinal epithelial stemness through activation of the unfolded protein response. Cell reports. 3 (4), 1128-1139 (2013).
- Shin, W., et al. A robust longitudinal co-culture of obligate anaerobic gut microbiome with human intestinal epithelium in an anoxic-oxic interface-on-a-chip. Frontiers in Bioengineering and Biotechnology. 7, 1-13 (2019).
- Shin, W., Kim, H. J. Intestinal barrier dysfunction orchestrates the onset of inflammatory host-microbiome cross-talk in a human gut inflammation-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 115 (45), E10539-E10547 (2018).
- Park, G. S., et al. Emulating host-microbiome ecosystem of human gastrointestinal tract in vitro. Stem Cell Reviews and Reports. 13 (3), 321-334 (2017).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Jergens, A. E., et al. A scoring index for disease activity in canine inflammatory bowel disease. Journal of Veterinary Internal Medicine. 17 (3), 291-297 (2003).
- Roulis, M., Flavell, R. A. Fibroblasts and myofibroblasts of the intestinal lamina propria in physiology and disease. Differentiation; research in biological diversity. 92 (3), 116-131 (2016).
- Göke, M., Kanai, M., Podolsky, D. K. Intestinal fibroblasts regulate intestinal epithelial cell proliferation via hepatocyte growth factor. The American Journal of Physiology. 274 (5), G809-G818 (1998).
- Powell, D. W., Pinchuk, I. V., Saada, J. I., Chen, X., Mifflin, R. C. Mesenchymal cells of the intestinal lamina propria. Annual Review of Physiology. 73, 213-237 (2011).
- Pappenheimer, J. R., Michel, C. C. Role of villus microcirculation in intestinal absorption of glucose: coupling of epithelial with endothelial transport. The Journal of Physiology. 553, 561-574 (2003).
- Agace, W. W. T-cell recruitment to the intestinal mucosa. Trends in Immunology. 29 (11), 514-522 (2008).
- Ambrosini, Y. M., Shin, W., Min, S., Kim, H. J. Microphysiological engineering of immune responses in intestinal inflammation. Immune Network. 20 (2), 13 (2020).
- Kasendra, M., et al. Development of a primary human Small Intestine-on-a-Chip using biopsy-derived organoids. Scientific Reports. 8 (1), 1-14 (2018).
- Sontheimer-Phelps, A., et al. Human Colon-on-a-Chip enables continuous in vitro analysis of colon mucus layer accumulation and physiology. Cellular and Molecular Gastroenterology and Hepatology. 9 (3), 507-526 (2020).
- Shin, W., et al. Human intestinal morphogenesis controlled by transepithelial morphogen gradient and flow- dependent physical cues in a microengineered Gut-on-a-Chip. iScience. 15, 391-406 (2019).
- Gijzen, L., et al. An Intestine-on-a-Chip model of plug-and-play modularity to study inflammatory processes. SLAS Technology. 25 (6), 585-597 (2020).
- Kim, H. J., Lee, J., Choi, J. H., Bahinski, A., Ingber, D. E. Co-culture of living microbiome with microengineered human intestinal villi in a gut-on-a-chip microfluidic device. Journal of Visualized Experiments. (114), 3-9 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved