Attivazione della segnalazione optogenetica negli embrioni di zebrafish
* These authors contributed equally
In This Article
Summary
La manipolazione optogenetica delle vie di segnalazione può essere una potente strategia per studiare come la segnalazione viene decodificata nello sviluppo, nella rigenerazione, nell'omeostasi e nella malattia. Questo protocollo fornisce linee guida pratiche per l'utilizzo di attivatori di segnalazione della proteina morfogenica (BMP) nodale e della proteina morfogenica ossea (BMP) basati sul dominio di rilevamento della luce-ossigeno-voltaggio nell'embrione precoce di zebrafish.
Abstract
Le vie di segnalazione orchestrano processi biologici fondamentali, tra cui lo sviluppo, la rigenerazione, l'omeostasi e la malattia. Sono necessari metodi per manipolare sperimentalmente la segnalazione per capire come la segnalazione viene interpretata in questi contesti di ampio respiro. Gli strumenti di optogenetica molecolare possono fornire manipolazioni reversibili e sintonizzabili dell'attività della via di segnalazione con un alto grado di controllo spazio-temporale e sono stati applicati in vitro, ex vivo e in vivo. Questi strumenti accoppiano domini proteici sensibili alla luce, come il dominio LOV (LOV) che omodimerizza la luce blu, con effettori di segnalazione per conferire un controllo sperimentale dipendente dalla luce sulla segnalazione. Questo protocollo fornisce linee guida pratiche per l'utilizzo della proteina morfogenetica ossea (BMP) basata su LOV e degli attivatori di segnalazione nodale bOpto-BMP e bOpto-Nodal nell'embrione precoce di zebrafish otticamente accessibile. Descrive due esperimenti di controllo: un test fenotipico rapido per determinare le condizioni sperimentali appropriate e un test di immunofluorescenza per valutare direttamente la segnalazione. Insieme, questi esperimenti di controllo possono aiutare a stabilire una pipeline per l'utilizzo di strumenti optogenetici nei primi embrioni di zebrafish. Queste strategie forniscono una potente piattaforma per studiare i ruoli della segnalazione nello sviluppo, nella salute e nella fisiologia.
Introduction
Le vie di segnalazione consentono alle cellule di rispondere al loro ambiente e coordinare le attività su scala tissutale e organismuale. I segnali cruciali per lo sviluppo embrionale includono la proteina morfogenetica ossea (BMP) dei membri della superfamiglia TGF-beta e il nodale 1,2,3. Durante l'embriogenesi, le vie regolate da questi e altri segnali modellano il piano corporeo controllando l'espressione genica e processi aggiuntivi per garantire che diversi tessuti e organi si sviluppino e si interfacciano correttamente. Le patologie, tra cui i difetti congeniti e il cancro, possono verificarsi quando la segnalazione o le risposte alla segnalazione sono perturbate 4,5,6,7. Nonostante le rigorose indagini sulla segnalazione, resta ancora molto da scoprire su come i livelli e le dinamiche vengono decodificati in una varietà di contesti 8,9,10,11, specialmente durante lo sviluppo12,13,14,15,16,17,18,19.
Per capire come viene decodificata la segnalazione, un esperimento ideale sarebbe quello di manipolare i livelli, i tempi e/o le dinamiche di segnalazione - con un alto grado di controllo spaziale e temporale - e valutare i risultati. Ad esempio, vengono proposti precisi gradienti di segnalazione spaziale per modellare i tessuti in via di sviluppo20,21. L'alterazione delle distribuzioni spaziali del gradiente di segnalazione aiuterebbe a verificare questa ipotesi22. Inoltre, l'importanza delle dinamiche di segnalazione nel generare diverse risposte cellulari sta diventando sempre più chiara: la stessa via di segnalazione può istruire le cellule a differenziarsi o proliferare a seconda della frequenza di segnalazione, ad esempio 9,23. I paradigmi sperimentali in cui le dinamiche di segnalazione possono essere facilmente manipolate saranno utili per esplorare la relazione tra dinamica e decisioni sul destino cellulare 8,12,13,14,15.
Storicamente, sono stati utilizzati diversi metodi per manipolare la segnalazione in contesti di sviluppo, portando a scoperte fondamentali 1,2,3. La segnalazione può essere bloccata utilizzando mutanti con perdita di funzione della via, espressione di inibitori ectopici o farmaci antagonisti. I metodi per attivare la segnalazione includono farmaci agonisti, ligandi ricombinanti, espressione ectopica di ligandi o recettori costitutivamente attivi e mutanti con perdita di funzione degli inibitori della via. Questi metodi spaziano lungo un continuum di controllo sperimentale. Ad esempio, i mutanti e l'espressione ectopica possono cadere sul lato del continuum: con questi approcci, cambiamenti drammatici e sistemici nell'attività del percorso possono causare morte prematura e precludere indagini in fasi successive, o nel tempo possono provocare effetti pleiotropici difficili da districare. Inoltre, è spesso difficile manipolare in modo indipendente una funzione di segnalazione alla volta, come il livello o la durata. Verso l'altra estremità del continuum, alcuni metodi offrono un controllo sperimentale più preciso, come i dispositivi microfluidici che espongono i campioni a farmaci o proteine ricombinanti con controllo temporale e talvolta spaziale 18,24,25, o metodi genetici, inclusi promotori inducibili da shock termico e tessuto-specifici che possono offrire benefici simili16,26,27. Tuttavia, questi metodi possono essere difficili da eseguire, potrebbero non essere reversibili, potrebbero avere una cinetica relativamente lenta o una scarsa risoluzione e potrebbero non essere disponibili in alcuni sistemi modello.
Gli approcci optogenetici molecolari sono una potente aggiunta a questo kit di strumenti. Questi approcci utilizzano proteine che rispondono a diverse lunghezze d'onda della luce per manipolare i processi biologici, tra cui la segnalazione 8,12,13,14,15, e sono stati sviluppati nel corso di decenni per l'uso in una varietà di sistemi, dalla coltura cellulare agli animali interi 12,13,28. Rispetto agli approcci storici, l'optogenetica molecolare può spesso offrire un grado più elevato di controllo spazio-temporale sui processi biologici: il controllore nei sistemi optogenetici è la luce e il controllo della lunghezza d'onda, dell'intensità, della durata e della frequenza di esposizione della luce è relativamente semplice. Con sistemi sofisticati come i microscopi confocali e a due fotoni, è possibile il controllo spaziale nella gamma subcellulare 29,30,31. Strumenti per manipolare optogeneticamente la segnalazione sono stati sviluppati e applicati in diversi sistemi, tra cui quelli descritti in Johnson et al.22, Čapek et al.32, Krishnamurthy et al.33 e Huang et al.34. Ad esempio, sfruttando il controllo spaziale offerto dall'optogenetica, questa strategia è stata recentemente utilizzata per modificare un gradiente di segnalazione negli embrioni di Drosophila, dimostrando che l'embriogenesi del moscerino è sorprendentemente robusta ai cambiamenti di questo gradiente22. La reversibilità e la rapida cinetica on/off degli attivatori di segnalazione optogenetica li hanno anche resi strumenti interessanti per studiare la decodifica delle dinamiche di segnalazione 8,12,13,14,15,34,35,36.
L'embrione precoce di zebrafish è un sistema in vivo adatto per gli studi optogenetici perché è fecondato esternamente, trasparente, adatto alla microscopia e geneticamente trattabile. L'esposizione alla luce è più facile da somministrare agli embrioni che si sviluppano al di fuori della madre, la luce può penetrare e accedere ai loro tessuti non opachi, gli embrioni vivi di zebrafish tollerano bene l'imaging (oltre ad essere trasparenti) e i metodi genetici esistenti offrono opportunità dirette per esperimenti di knockdown e sovraespressione, oltre allo sviluppo di utili transgenici37.
Recentemente, sono stati sviluppati strumenti optogenetici per attivare la segnalazione BMP38 e Nodal39 in embrioni di zebrafish con esposizione alla luce blu (Figura 1). Ci riferiamo a questi strumenti come bOpto-BMP e bOpto-Nodal (b per attivato dalla luce blu e Opto per optogenetico). bOpto-BMP/Nodal si basano su meccanismi di attivazione della via simili. Il legame dei ligandi BMP o nodali ai rispettivi recettori serina-treonina chinasi guida le interazioni del dominio recettoriale chinasico che portano alla fosforilazione degli effettori di segnalazione (Smad1/5/9 per BMP e Smad2/3 per Nodal). Gli effettori di segnalazione fosforilati traslocano quindi nel nucleo e regolano l'espressione genica bersaglio3 (Figura 1A,D). Queste interazioni recettoriale-chinasi possono essere rese sensibili alla luce accoppiando le recettori chinasi alle proteine dimerizzanti sensibili alla luce: con l'esposizione alla luce, queste proteine chimeriche dovrebbero dimerizzarsi, facendo sì che i domini recettoriali chinasici interagiscano e attivino la segnalazione (Figura 1B,C,E,F). È importante sottolineare che, a differenza dei recettori endogeni, bOpto-BMP/Nodal non contengono domini extracellulari leganti il ligando, garantendo un'attività indipendente dal ligando (Figura 1C,F). Questa strategia di attivazione optogenetica è stata inizialmente ottenuta con i recettori tirosin-chinasici40,41,42 e poi applicata ai recettori serina-treonina chinasi.
bOpto-BMP/Nodal utilizza il dominio LOV (Homodimerizing Light-Oxygen-Voltage Sensing) reattivo alla luce blu (~450 nm) dell'alga Vaucheria fridiga AUREO1 protein (VfLOV)43,44. Questi costrutti sono costituiti da un motivo di miristoilazione mirato alla membrana seguito da domini chinasici del recettore BMP o nodale, fusi in un dominio LOV (Figura 1B,E). L'esposizione alla luce blu dovrebbe causare l'omodimerizzazione di LOV, con conseguenti interazioni del dominio recettore-chinasico che portano alla rispettiva fosforilazione di Smad e all'attivazione della via (Figura 1C,F). Per bOpto-BMP, è stato riscontrato che una combinazione di costrutti con i domini chinasici del recettore di tipo I di Acvr1l (noto anche come Alk8) e BMPR1aa (noto anche come Alk3) e il dominio della chinasi del recettore di tipo II di BMPR2a attiva in modo ottimale la segnalazione38 (Addgene #207614, #207615 e #207616). Per bOpto-Nodal, viene utilizzata una combinazione di costrutti con il dominio chinasico del recettore di tipo I di Acvr1ba e il dominio della chinasi del recettore di tipo II di Acvr2ba39.
bOpto-BMP/Nodal sono stati introdotti in embrioni di zebrafish precoce iniettando mRNA allo stadio di una cellula e utilizzati per studiare il ruolo della durata della segnalazione nell'interpretazione nodale39, per determinare perché il pesce zebra perde la capacità di rispondere a Nodal45 e per esaminare come i geni bersaglio BMP rispondono a diversi livelli di segnalazione BMP38. È probabile che questi strumenti continueranno ad essere utili in una vasta gamma di indagini future. Tuttavia, il punto di forza degli attivatori di segnalazione optogenetica è anche la loro debolezza: i campioni sensibili alla luce devono essere trattati con cura per evitare l'attività di segnalazione ectopica involontaria. L'esposizione alla luce della stanza o alla luce solare può attivare bOpto-BMP/Nodal.
Questo protocollo fornisce suggerimenti pratici per l'utilizzo di attivatori BMP e nodali basati su LOV codificati con mRNA nei primi embrioni di zebrafish. Si inizia descrivendo in dettaglio una strategia per costruire una scatola luminosa per controllare l'esposizione alla luce e la temperatura uniformi (Figura 2, File supplementare 1, File supplementare 2, File supplementare 3, File supplementare 4, File supplementare 5, File supplementare 6, File supplementare 7, File supplementare 8). Descrive quindi due esperimenti di controllo chiave che determinano se un attivatore di segnalazione optogenetica si comporta come previsto, cioè attivando l'attività della via solo se esposto alla luce (Figura 3). Il primo test di controllo prevede l'esame dei fenotipi a un giorno dopo la fecondazione in embrioni esposti alla luce e non esposti (Figura 3A). Gli embrioni esposti alla luce iniettati con mRNA, ma non gli embrioni non esposti, dovrebbero fenocopiare la BMP o la sovraespressione linfonodale (Figura 4A,B; I fenotipi BMP, in particolare, sono chiaramente distinguibili in questo momento, punto46). Questo test fornisce una rapida lettura dell'attività. Nel secondo test di controllo, per determinare se i fenotipi sono causati specificamente da un eccesso di BMP o da una segnalazione linfonodale e per osservare direttamente il cambiamento nei livelli di segnalazione, la colorazione in immunofluorescenza viene utilizzata per rilevare gli effettori di segnalazione fosforilati (pSmad1/5/9 o pSmad2/3, rispettivamente) dopo un'esposizione alla luce di 20 minuti intorno alla fase tardiva della blastula/gastrulazione precoce, quando l'attività di segnalazione è stata ben descritta12, 16,17,47,48,49,50 (Figura 3B e Figura 4C). (Si noti che, sebbene sia stata dimostrata l'attivazione spazialmente localizzata sia per bOpto-BMP38 che per bOpto-Nodal39, questo protocollo descrive solo l'esposizione uniforme alla luce e le strategie di attivazione della segnalazione.) Si consiglia di eseguire questi esperimenti di controllo prima di applicare bOpto-BMP/Nodal a specifiche domande di ricerca al fine di determinare le condizioni sperimentali locali ideali.
Protocol
I protocolli di ricerca sul pesce zebra sono stati esaminati e approvati dal Comitato per la cura e l'uso degli animali del NICHD presso il National Institutes of Health (ASP 21-008). Tutti gli studi sul pesce zebra sono stati condotti in conformità con la Guida per la cura e l'uso degli animali da laboratorio.
1. Costruire una scatola luminosa
- Per controllare l'esposizione alla luce e la temperatura, costruire una scatola luminosa che utilizzi un illuminatore per micropiastre a diodi emettitori di luce (LED) come sorgente luminosa (Figura 2A, Tabella dei materiali, File supplementare 1, File supplementare 2). Questo illuminatore personalizzabile fornisce un controllo dinamico e programmabile su più lunghezze d'onda.
NOTA: Ci sono molte strategie possibili per costruire una light box, e un approccio alternativo può essere più appropriato (vedi ad esempio, Gerhardt et al.51, Bugaj et al.52, Kumar e Khammash 53, e altro a https://www.optobase.org/materials/). - Includi le seguenti caratteristiche nella scatola luminosa: controllo della temperatura (28 °C è ideale per gli embrioni di zebrafish), esclusione della luce indesiderata (ad es. luce ambientale e luce solare), erogazione uniforme di luce blu che copre l'area target (ad es. piastra a 6 pozzetti) e controllo dell'intensità della luce e delle dinamiche di esposizione.
NOTA: bOpto-BMP/Nodal sono attivati dalla luce blu, ma alcuni strumenti optogenici rispondono ad altre lunghezze d'onda. Utilizzare la lunghezza d'onda appropriata per lo strumento optogenetico. - Praticare un foro attraverso la parte superiore di un'incubatrice (Figura 2B) leggermente più largo della lente di uscita del LED.
- Assicurarsi che non vi siano componenti elettrici nella parte superiore dell'incubatrice che verranno distrutti dalla perforazione (Tabella dei materiali). Questo può essere accertato contattando il produttore dell'incubatrice e chiedendo direttamente.
- Se è presente un foro esistente sul pannello superiore dell'incubatrice, utilizzare un trapano a gradini per aumentare la dimensione del foro a 1.25 pollici. Altrimenti utilizzare una sega a tazza da 1.25 pollici con mandrino.
- Se sono presenti pannelli interni che bloccano la sorgente luminosa, praticare il foro della dimensione appropriata per assicurarsi che il cono di luce non sia ostruito (Figura 2A). I pannelli sono in genere realizzati con lamiere sottili, quindi utilizzare basse velocità e punte da trapano in metallo per evitare danni (si consiglia una punta da trapano al cobalto).
- Costruire un supporto LED per fissare l'illuminatore per micropiastre a LED alla parte superiore dell'incubatrice (Figura 2C, File supplementare 3, File supplementare 4, File supplementare 5, File supplementare 6, File supplementare 7, File supplementare 8).
- Montare quattro distanziatori a cubo M3 sulla staffa verticale utilizzando viti M3.
- Fissare le due staffe laterali a sinistra e a destra dei distanziatori del cubo della staffa verticale. Montare un altro distanziatore a cubo sul foro rimanente sulle staffe laterali.
- Montare la staffa verticale sul gruppo illuminatore per micropiastre a LED (Tabella dei materiali) utilizzando viti M6. Posizionare la guarnizione della lente LED sopra la lente del sistema LED.
- Montare i pezzi assemblati sul supporto del pannello dell'incubatrice, quindi sui distanziatori M3 sulle staffe verticali e laterali. Posizionare la guarnizione dell'incubatrice sopra il foro praticato sulla parte superiore dell'incubatrice.
- Posizionare il supporto del pannello dell'incubatrice sopra la guarnizione dell'incubatrice, assicurandosi che la guarnizione e le aperture del pannello siano concentriche con il foro dell'incubatrice. Montare il pannello sulla parte superiore dell'incubatrice utilizzando n. 8 viti. Assicurarsi che questa guarnizione sia a tenuta di luce.
- Posizionare una piastra a 6 pozzetti sul ripiano superiore dell'incubatrice. Determinare se il fascio di luce copre uniformemente la piastra (Figura 2A). Usa un foglio di carta per visualizzare la copertura della luce.
- Se l'intera piastra non è coperta dal raggio, aumentare la distanza tra il LED e la piastra spostando il ripiano verso il basso. Per il sistema qui descritto, sono sufficienti ~14 pollici tra il LED e lo scaffale.
- Utilizzare un esposimetro per determinare il livello di irraggiamento e l'uniformità spaziale (Tabella dei materiali).
- Per evitare la luce solare involontaria e l'esposizione alla luce della stanza, utilizzare la protezione dalle intemperie per assicurarsi che lo sportello dell'incubatrice sia a tenuta di luce (Figura 2A).
- Gli embrioni di zebrafish si sviluppano robustamente a 28 °C54. Utilizzare un termometro per schede di memoria per assicurarsi che la scatola luminosa contenga 28 °C.
2. Generazione di mRNA per iniezione
NOTA: pCS2+ è la spina dorsale vettoriale per i costrutti bOpto-BMP38 e bOpto-Nodale39. Questo vettore è resistente all'ampicillina. bOpto-BMP è composto da tre costrutti (Figura 1B): BMPR1aa-LOV (Addgene # 207614): dominio chinasico putativo del recettore BMPR1aa di tipo I (noto anche come Alk3) fuso con LOV; Acvr1l-LOV (Addgene # 207615): Dominio chinasico putativo del recettore Acvr1l di tipo I (noto anche come Alk8) fuso a LOV; e BMPR2a-LOV (Addgene # 207616): dominio chinasico putativo del recettore BMPR2a di tipo II e successivo dominio C-terminale fuso a LOV. bOpto-Nodale è composto da due costrutti (Figura 1E): Acvr1ba-LOV: dominio chinasico putativo del recettore Acvr1ba di tipo I (noto anche come Acvr1b) fuso a LOV; Acvr2ba-LOV: dominio chinasico putativo del recettore Acvr2ba di tipo II (noto anche come Acvr2b) fuso con LOV.
- Per linearizzare i plasmidi, digerire tra 2-5 μg di DNA plasmidico utilizzando l'enzima di restrizione NotI a 37 °C per 1-3 ore (Tabella dei materiali).
NOTA: È anche possibile generare DNA linearizzato utilizzando il plasmide come modello PCR. - Purificare il DNA utilizzando un kit di purificazione standard basato su colonna (Tabella dei materiali).
- Utilizzare un kit di trascrizione SP6 in vitro , come un kit mMessage mMachine, per trascrivere l'RNA dal modello linearizzato (Tabella dei materiali). Impostare due reazioni secondo le raccomandazioni del produttore per garantire una maggiore resa.
- Purificare l'RNA utilizzando un kit standard di pulizia dell'RNA basato su colonna (Table of Materials). È anche possibile purificare per precipitazione.
3. Iniezione di mRNA
- Almeno 1 giorno prima delle iniezioni, preparare piastre per iniezione e piastre a 6 pozzetti rivestite di agarosio.
- Preparare 200 ml di agarosio all'1% in un terreno embrionale di zebrafish e cuocere nel microonde fino a quando l'agarosio non si è completamente sciolto. Qualsiasi terreno embrionale standard di zebrafish dovrebbe essere accettabile; Tuttavia, escludere il blu di metilene dal terreno embrionale in quanto può influenzare l'imaging a valle in altre applicazioni.
- Versare con cautela l'agarosio fuso in piastre di Petri di plastica da 100 mm x 15 mm. Riempite i piatti a metà.
- Sciacquare uno stampo per piatti a iniezione con terreno embrionale e posizionarlo delicatamente sull'agarosio fuso, assicurandosi che non rimangano bolle intrappolate tra lo stampo e l'agarosio. Usa del nastro adesivo per creare una linguetta sul retro dello stampo per un facile posizionamento e recupero.
- Lo stampo dovrebbe galleggiare nell'agarosio fuso. Se lo stampo affonda, rimuovere con cautela l'agarosio fuso e ripetere il passaggio 3.1.3.
- Dopo che l'agarosio si è solidificato, utilizzare la linguetta per rimuovere delicatamente la muffa. Questo può essere accelerato posizionando la parabola a 4 °C.
- Realizzare piastre a 6 pozzetti rivestite di agarosio se si lavora con embrioni decoroniati per esperimenti di immunofluorescenza.
- Utilizzare una pipetta di plastica monouso da 10 ml per trasferire una quantità sufficiente di agarosio fuso a coprire il fondo di ciascun pozzetto di una piastra a 6 pozzetti.
- Conservare le piastre per iniezione e le piastre a 6 pozzetti a 4 °C. Possono essere utilizzati immediatamente o conservati fino a quando l'agarosio non si è seccato o contaminato (di solito 2-3 settimane).
- Preparare i puntali delle pipette in vetro fiammato se si lavora con embrioni decoroninati per esperimenti di immunofluorescenza.
- Inserire l'estremità di una pipetta di vetro nella fiamma di un bruciatore Bunsen e ruotare continuamente fino a quando i bordi non sono lisci. Gli embrioni decoroniati devono passare comodamente attraverso l'estremità della pipetta. Non lasciare che l'apertura si restringa al di sotto del diametro di un embrione.
- Acquista o tira gli aghi per microiniezione (Tabella dei materiali). Si consiglia di avere aghi extra disponibili il giorno dell'iniezione nel caso in cui sia necessaria una sostituzione.
- Il giorno prima delle iniezioni, impostare gli allevatori di zebrafish secondo le procedure operative standard (SOP) dell'istituto. Tieni separati maschi e femmine.
- Accendere il regolatore di temperatura della scatola luminosa per mantenere 28 °C. Per garantire che la temperatura della scatola luminosa rimanga a 28 °C, monitorare la temperatura utilizzando un termometro per schede di memoria (Tabella dei materiali).
- Preparare una o più miscele di mRNA per iniezione. Iniettare quantità equimolari di ciascun costrutto. È necessario determinare empiricamente quale quantità iniettare.
- Le dimensioni della trascrizione bOpto-BMP sono le seguenti:
Acvr1l-LOV = 2007 nucleotidi (nt)
BMPR1aa-LOV = 1983 nt
BMPR2a-LOV = 3409 nt - Per iniettare quantità equimolari, iniettare 1,01 volte di più del costrutto Acvr1l rispetto a BMPR1aa; iniettare 1,72 volte di più del costrutto BMPR2a rispetto a BMPR1aa.
- Le dimensioni del trascritto bOpto-Nodale sono le seguenti:
Acvr1ba-LOV e Acvr2ba-LOV sono entrambi 1962 nt. - Per iniettare quantità equimolari, iniettare la stessa quantità di ogni costrutto.
- Preparare miscele di iniezione equimolari, combinando tutti gli mRNA mirati a una via in un'unica miscela di iniezione. Se lo si desidera, includere un tracciante per iniezione di rosso fenolo. Per i dati mostrati nella Figura 4, sono stati utilizzati 15 pg di ciascun costrutto bOpto-Nodale (Acvr1ba-LOV e Acvr2ba-LOV) e per bOpto-BMP 7,8 pg Acvr1l-LOV e BMPR1aa-LOV e 13,4 pg BMPR2a-LOV.
- Conservare le miscele iniettabili a -20 °C. Una volta determinata la concentrazione ottimale della miscela iniettabile, effettuare aliquote da 5-10 μL e conservare a -20 °C o -80 °C.
- Giorno dell'iniezione
- Se si esegue un test di fenotipizzazione (Figura 3A), iniettare attraverso il corion direttamente al centro della cellula allo stadio di una cellula secondo la SOP del laboratorio. Il corion protegge gli embrioni dai fattori di stress ambientale e mantiene gli embrioni lisati contenuti. Ciò è utile durante la valutazione per una quantificazione accurata degli embrioni lisati (Figura 4A,B).
- Se si esegue un test di immunofluorescenza (Figura 3B), gli embrioni dovranno essere decoroniati per l'imaging (Figura 4C). Pertanto, iniettare direttamente al centro della cellula di embrioni decoroninati allo stadio di una cellula (vedi Rogers et al.55 per il protocollo di decoronione). In alternativa, gli embrioni possono essere decoroniati manualmente dopo la fissazione, ma questo è più ingombrante rispetto alla decoronione con la pronasi.
- Utilizzare pipette di vetro fiammato per manipolare gli embrioni decoroniati (fase 3.1.10). Fare attenzione a non esporre gli embrioni decoroninati all'aria o alla plastica, che causerebbero la lisi degli embrioni. Maneggiare delicatamente gli embrioni decoroniati.
- Preparare un piatto extra di embrioni non iniettati come proxy per valutare la progressione dello stadio (vedere il punto 4.3.5). Assicurarsi che gli embrioni proxy provengano dallo stesso set di embrioni sperimentali, in modo che tutti gli embrioni siano stati fecondati contemporaneamente dagli stessi genitori. Ciò è utile per il test di immunofluorescenza in cui lo stadio è rilevante ma non è necessario per il test di fenotipizzazione.
- Utilizzare le seguenti condizioni sia per i saggi di fenotipizzazione che per quelli di immunofluorescenza: 1) non iniettato, non esposto, 2) non iniettato, esposto alla luce, 3) iniettato, non esposto, 4) iniettato, esposto alla luce. Selezionare almeno 30 embrioni per condizione. Per una salute ottimale dell'embrione, non incubare più di 30 embrioni per pozzetto in una piastra da 6 pozzetti.
- Dopo l'iniezione, trasferire gli embrioni in piastre di Petri marcate o piastre a 6 pozzetti rivestite di agarosio (per gli embrioni decoroniati) e incubare a 28 °C. Gli embrioni non sono ancora sensibili alla luce. Trattare gli embrioni iniettati come se fossero sensibili alla luce dopo 1,5 ore dalla fecondazione (hpf).
4. Esperimento di esposizione alla luce
NOTA: L'esposizione alla luce di ~450 nm con un irraggiamento di 45 W/m2 attiva in modo robusto bOpto-BMP/Nodale senza evidente fototossicità (per informazioni sull'esposimetro, vedere la tabella dei materiali). Il livello di segnalazione optogeneticamente attivato può essere regolato modificando i valori di irraggiamento38. Tuttavia, la fototossicità dovrà essere valutata a irradianze più elevate.
- Passaggio sensibile al tempo. Allo stadio da 4 a 16 cellule, circa 1,5 hpf, rimuovono gli embrioni non fecondati e non sani. Ridistribuire se necessario per garantire lo stesso numero di embrioni in ogni pozzetto (non più di 30).
NOTA: È importante eseguire questo passaggio intorno allo stadio da 4 a 16 cellule perché gli embrioni diventeranno sensibili alla luce quando l'mRNA iniettato viene tradotto in proteina. Non abbiamo osservato prove che gli embrioni siano significativamente sensibili alla luce prima di 1,5 hpf. Per ridurre al minimo la fotoattivazione involontaria quando si valutano embrioni dopo 1,5 hpf, utilizzare luci rosse o coprire le sorgenti luminose, compresi gli stadi del microscopio, con carta da filtro gel rossa che blocca le lunghezze d'onda blu di dimerizzazione del LOV (Tabella dei materiali).- Valutare gli embrioni in modo coerente per garantire una distribuzione imparziale tra le condizioni e gli esperimenti.
- Per il test di fenotipizzazione, utilizzare il seguente protocollo di esposizione alla luce di 1 giorno a partire da 1,5 hpf (Figura 3A).
- Avvolgere la piastra di controllo non esposta in un foglio di alluminio. Questa piastra deve includere sia gli embrioni non iniettati che quelli iniettati. Assicurarsi che la piastra sia completamente coperta e fare attenzione a non introdurre strappi nella pellicola. Posizionare questa piastra sul ripiano inferiore della scatola luminosa a 28 °C (Figura 2A).
- Posizionare la piastra esposta sul ripiano superiore della scatola luminosa a 28 °C (Figura 2A). Assicurarsi che il coperchio sia sul piatto per evitare l'evaporazione del terreno embrionale. Accendere la luce blu (un irraggiamento di 45 W/m2 attiva in modo robusto la segnalazione).
- Chiudere lo sportello della scatola luminosa per evitare l'esposizione involontaria alla luce della stanza. Se lo si desidera, includere un termometro per schede di memoria all'interno della scatola luminosa prima di chiudere lo sportello. Non aprire la porta fino a quando il punteggio del fenotipo non è stato assegnato a 1 giorno dopo la fecondazione (dpf; vedere il punto 5.1).
- Per il test di immunofluorescenza, esporre gli embrioni alla luce blu per 20 minuti a partire da circa il 40% di epibolia56 (~6 hpf) e fissare immediatamente dopo l'esposizione alla luce, insieme ai controlli non esposti (Figura 3B). Un'esposizione di 20 minuti alla luce blu al 40% dell'epibolia attiva in modo riproducibile la segnalazione.
- Circa 1,5 hpf, avvolgere separatamente sia i piatti esposti che quelli non esposti in un foglio di alluminio. Assicurati che i piatti siano completamente coperti e fai attenzione a non introdurre strappi nella pellicola. Lascia il piatto proxy scartato. Posizionare le stoviglie avvolte e la piastra proxy non scartata nella scatola luminosa a 28 °C (Figura 2A). Non accendere ancora il LED.
- Se si esegue il test di più di una quantità di mRNA, per la condizione non esposta, ordinare gli embrioni iniettati con quantità diverse in singole piastre a 6 pozzetti rivestite di agarosio, che aiuteranno a ridurre al minimo l'esposizione involontaria alla luce durante la successiva fissazione.
- Chiudere lo sportello della scatola luminosa per evitare l'esposizione involontaria alla luce della stanza.
- Diluire lo stock di formaldeide al 4% in 1 soluzione salina tamponata con fosfato (PBS) e aliquotare 1 mL in provette per microcentrifuga a fondo tondo da 2 mL pre-etichettate, una provetta per condizione. Conservare a 4 °C.
- Intorno ai 5 hpf, rimuovere la capsula contenente gli embrioni non iniettati e valutare lo stadio di sviluppo utilizzando un endoscopio da dissezione. Lo stadio degli embrioni proxy dovrebbe riflettere lo stadio degli embrioni sensibili alla luce nei piatti avvolti.
- Rimuovi anche i piatti avvolti, in modo che tutti i piatti abbiano la stessa temperatura. Ripetere fino a quando gli embrioni proxy non hanno raggiunto il 40% di epibolia (~6 hpf). La progressione dell'embriogenesi è sensibile alla temperatura54; Pertanto, più a lungo le piastre rimangono fuori dall'incubatrice, più tempo ci vorrà perché gli embrioni raggiungano il 40% di epibola.
- Una volta che gli embrioni proxy hanno raggiunto il 40% di epibolia, scartare il piatto esposto e posizionarlo sul ripiano superiore della scatola luminosa (Figura 2A). Lasciare i piatti non esposti avvolti e posizionarli sul ripiano inferiore. Accendere immediatamente la luce blu, chiudere la porta e impostare un timer per 20 minuti (un irraggiamento di 45 W/m2 attiva in modo robusto la segnalazione).
- Per prepararsi al fissaggio, eliminare quanta più luce possibile nella stanza (chiudere le persiane, spegnere le luci a soffitto, spegnere gli schermi, ecc.). Assicurarsi che i tubi contenenti formaldeide siano etichettati in modo appropriato. Immediatamente prima del fissaggio, rimuovere i tubi contenenti formaldeide da 4 °C e posizionarli accanto alla scatola luminosa.
- Passo sensibile al tempo e alla luce. Preparati a muoverti rapidamente alla fine dei 20 minuti di esposizione alla luce. Dopo 20 minuti, aprire lo sportello della scatola luminosa e rimuovere il piatto non esposto.
- Utilizzare un puntale di pipetta in vetro fiammato per trasferire gli embrioni sensibili alla luce in modo rapido ma delicato nella provetta corrispondente preparata di formaldeide al 4%.
- Ridurre al minimo il tempo di trasferimento (<45 s) degli embrioni sensibili alla luce per evitare l'esposizione involontaria alla luce. Assicurarsi che non vi siano bolle d'aria nella pipetta. L'esposizione all'aria distruggerà gli embrioni decoroniati.
- Per espellere gli embrioni nella formaldeide, immergere la punta della pipetta di vetro nella formaldeide e lasciare che gli embrioni affondino nel liquido. Ridurre al minimo la quantità di terreno embrionale che viene trasferito alla formaldeide mantenendo gli embrioni all'estremità della punta.
- Dopo che gli embrioni sono stati trasferiti, rimettere la pipetta nello stesso pozzetto e pipettare su e giù per rimuovere eventuali embrioni bloccati. In questo modo si evita che gli embrioni di più condizioni finiscano accidentalmente in una provetta.
- Ripetere immediatamente i passaggi da 4.3.11 a 4.3.13 per gli embrioni non esposti e non iniettati, seguiti dagli embrioni esposti (iniettati e non iniettati).
- Conservare gli embrioni fissati a 4 °C per una notte.
5. Valutazione dell'esperimento
- Punteggio fenotipico e imaging
- A 1 dpf, idealmente tra 24-32 hpf, rimuovere gli embrioni dalla scatola luminosa per valutare i fenotipi utilizzando un endoscopio di dissezione e creare una rubrica di punteggio. Questo è l'endpoint sperimentale; La fotoattivazione involontaria non è più un problema.
- Segna gli embrioni mentre sei ancora nel corion per facilitare. Utilizzare una pipetta o una sonda per spostare gli embrioni in modo da visualizzare da più angolazioni.
- Gli embrioni che sperimentano un eccesso di segnalazione BMP saranno ventralizzati con vari gradi di gravità, come descritto in dettaglio in Kishimoto et al. 199746 (Figura 4A, pannello di sinistra). Gli embrioni che presentano un eccesso di segnalazione linfonodale presenteranno una serie di difetti di sviluppo correlati all'eccesso di mesendoderma (Figura 4A, pannello di destra)1,3,47,57,58,59,60. Spesso hanno lisati di 1 dpf.
- Assegnare un punteggio a ciascun embrione in tutte le condizioni (Figura 4B). Acquisire un'immagine panoramica di tutti gli embrioni in ogni pozzetto. Se lo si desidera, decorionare e visualizzare i singoli embrioni rappresentativi in metilcellulosa (Figura 4A).
- Colorazione e imaging in immunofluorescenza
- Dopo aver incubato gli embrioni in formaldeide al 4% a 4 °C per una notte, rimuovere la formaldeide e lavare 3-5 volte con 1 soluzione salina tamponata con fosfato con Tween20 (PBST). Rimuovere il PBST e aggiungere il 100% di metanolo.
- Chiudere le provette e capovolgerle delicatamente per mescolare PBST residuo e metanolo. Lavare 2 volte con metanolo e conservare a -20 °C per almeno 2 ore fino a anni.
- Per il protocollo di immunofluorescenza pSmad1/5/9 (BMP) vedere Rogers et al.38. Per il protocollo di immunofluorescenza pSmad2/3 (Nodale) vedere van Boxtel et al.17 e Rogers et al.47.
- Immagine di embrioni immunocolorati, utilizzando un microscopio in grado di sezionare otticamente (ad esempio, un microscopio confocale o a foglio luminoso). Evitare la saturazione e mantenere condizioni di imaging identiche tra tutti i campioni colorati con lo stesso anticorpo.
- Immagine entro 5 giorni dal completamento della colorazione in immunofluorescenza perché la fluorescenza può sbiadire nel tempo.
Representative Results
L'obiettivo dei due esperimenti di controllo qui descritti è quello di determinare se bOpto-BMP/Nodal attivano i rispettivi percorsi in risposta all'esposizione alla luce blu senza influenzare la segnalazione in assenza di luce, come previsto. Utilizzare questi controlli per stabilire il flusso di lavoro sperimentale appropriato nel laboratorio prima di applicare bOpto-BMP/Nodal alle domande di ricerca di interesse.
Il test di fenotipizzazione può essere completato in soli 2 giorni e fornisce un'utile indicazione dell'attività di segnalazione e della fototossicità (Figura 3A). Gli embrioni iniettati esposti alla luce blu dovrebbero fenocopiare l'eccesso di segnalazione BMP (ventralizzazione46; Figura 4A, pannello di sinistra) o segnalazione linfonodale (difetti di sviluppo correlati all'extra mesendoderma 1,3,47,57,58,59,60 (Figura 4A, pannello di destra)). Se iniettati, gli embrioni esposti alla luce sono afenotipici, testare la qualità dell'mRNA e prendere in considerazione l'idea di iniettarne di più, e ricontrollare la strategia di esposizione alla luce per garantire un'esposizione costante alla luce intensa (~450 nm di luce con un irraggiamento di 45 W/m2 dovrebbe attivare fortemente la segnalazione). Al contrario, gli embrioni iniettati e non esposti dovrebbero avere un aspetto identico ai fratelli non iniettati. Se iniettati, gli embrioni non esposti presentano fenotipi, ridurre la quantità di mRNA iniettato e rivalutare l'impostazione sperimentale per garantire che gli embrioni non esposti siano protetti dall'esposizione alla luce. I dati mostrati nella Figura 4B mostrano i risultati di tipici esperimenti di fenotipizzazione con quantità di mRNA e condizioni di esposizione appropriate: una forte attività di segnalazione è evidente negli embrioni iniettati ed esposti alla luce, con solo una piccola frazione di embrioni iniettati e non esposti che presentano fenotipi.
Il test di fenotipizzazione offre anche l'opportunità di valutare la fototossicità. Se la fototossicità è trascurabile, gli embrioni non iniettati ed esposti alla luce dovrebbero apparire wild type, simili agli embrioni non iniettati e non esposti. Se gli embrioni non iniettati ed esposti alla luce presentano difetti, ma non gli embrioni non iniettati e non esposti, prendere in considerazione la possibilità di ridurre l'irradiazione luminosa. Un'irradianza di 45 W/m2 attiva in modo robusto la segnalazione senza evidente fototossicità. I dati mostrati nella Figura 4B non mostrano differenze preoccupanti tra gli embrioni non iniettati, esposti alla luce e non iniettati, non esposti, indicando una fototossicità trascurabile.
Sebbene i saggi di immunofluorescenza richiedano più tempo e impegno (~1 settimana) rispetto al test di fenotipizzazione (2 giorni), la colorazione in immunofluorescenza fornisce una lettura diretta dell'attività della via di segnalazione e può rivelare sottili cambiamenti di segnalazione che potrebbero non essere riflessi dalla morfologia grossolana. L'immunofluorescenza è particolarmente importante per valutare le risposte a bOpto-Nodale, perché l'eccesso di segnalazione linfonodale spesso provoca la lisi embrionale di 1 dpf - che può avere molte cause - in contrasto con i fenotipi specifici di ventralizzazione caratteristici dell'eccesso di segnalazione BMP46 (Figura 4A). Gli embrioni iniettati esposti alla luce blu dovrebbero mostrare un aumento uniforme della fosforilazione di Smad1/5/9 o Smad2/3 rispetto agli embrioni non iniettati ed esposti alla luce. Se i livelli non aumentano, o aumentano solo debolmente, testare la qualità dell'mRNA e prendere in considerazione l'iniezione di più, e ricontrollare la strategia di esposizione alla luce. Un'esposizione di 20 minuti alla luce blu con un'irradianza di 45 W/m2 intorno al 40% di epibolia dovrebbe attivare fortemente la segnalazione. Se la colorazione di pSmad non è uniforme, prova a iniettare l'mRNA al centro della cellula (piuttosto che nel tuorlo), il che può comportare una distribuzione più uniforme dell'mRNA.
Gli embrioni iniettati e non esposti dovrebbero avere livelli di pSmad paragonabili a quelli degli embrioni non iniettati. Aneddoticamente, abbiamo osservato una fosforilazione di Smad più permeabile con bOpto-Nodal rispetto a bOpto-BMP. Se i livelli di pSmad sono aumentati negli embrioni iniettati e non esposti, ridurre la quantità di mRNA iniettato. Inoltre, rivalutare l'impostazione sperimentale per garantire che 1) gli embrioni non esposti non siano inavvertitamente esposti alla luce e 2) che l'esposizione alla luce durante la fissazione sia minima. Durante la fase di fissazione, è fondamentale far trascorrere non più di 45 secondi tra la rimozione dalla scatola luminosa e l'immersione in formaldeide. Inoltre, durante questa fase, ridurre al minimo l'esposizione alla luce della stanza e alla luce solare chiudendo le persiane delle finestre, spegnendo le fonti di luce bianca, utilizzando luci rosse o coprendo le fonti di luce bianca con carta da filtro gel che blocca la luce blu (Tabella dei materiali).
I dati nella Figura 4C mostrano i risultati di tipici esperimenti di colorazione in immunofluorescenza con quantità di mRNA appropriate e condizioni di esposizione alla luce: i livelli di pSmad sono simili negli embrioni non iniettati e non esposti, mentre gli embrioni iniettati ed esposti alla luce mostrano livelli più elevati di fosforilazione di Smad.
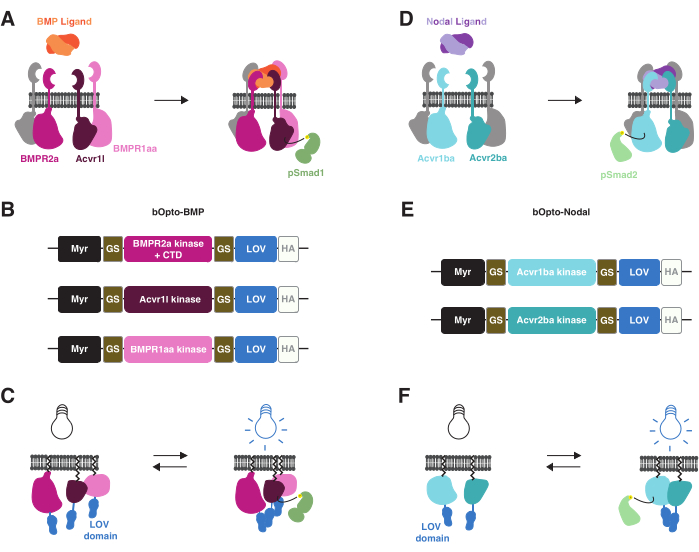
Figura 1: Strategia di attivazione del segnale bOpto-BMP e -Nodale . (A) La via di segnalazione endogena del BMP è attivata dal legame del ligando BMP, che porta alla formazione di un complesso recettoriale di tipo I/II, alla fosforilazione di Smad1/5/9 e all'espressione dei geni bersaglio del BMP. I recettori di tipo I BMPR1aa e Acvr1l sono noti anche come Alk3 e Alk8, rispettivamente. BMPR2a è un recettore di tipo II. (B) costrutti bOpto-BMP38. I domini chinasici putativi di BMPR1aa e Acvr1l sono fusi con LOV; la fusione BMPR2a-LOV contiene il dominio chinasico putativo e il dominio C-terminale del recettore (CTD). Tutte le fusioni sono mirate alla membrana con un motivo di miristoilazione (Myr). I domini sono separati da linker glicina-serina (GS). I costrutti sono contrassegnati nel CTD con un tag epitopo HA. Si è scoperto che questa combinazione di tre costrutti attiva in modo ottimale la segnalazione BMP. (C) Attivazione del segnale BMP mediata da bOpto-BMP. Se esposti alla luce blu, i domini LOV si dimerizzano, il che si pensa inneschi la formazione di complessi e l'attivazione della segnalazione. (D) La via di segnalazione endogena nodale è attivata dal legame del ligando nodale, che porta alla formazione di un complesso recettoriale di tipo I/II, alla fosforilazione di Smad2/3 e all'espressione di geni bersaglio nodali. Il recettore di tipo I Acvr1ba e il recettore di tipo II Acvr2ba sono noti anche come Acvr1b e Acvr2b, rispettivamente. (E) costrutti bOpto-Nodali39. I domini chinasici putativi di Acvr1ba e Acvr2ba sono fusi con LOV. Tutte le fusioni sono mirate alla membrana con un motivo di miristoilazione (Myr). I domini sono separati da linker GS. I costrutti sono contrassegnati nel CTD con un tag epitopo HA. (F) Attivazione del segnale nodale mediata da bOpto-Nodale. Se esposti alla luce blu, i domini LOV si dimerizzano, il che si pensa inneschi la formazione di complessi e l'attivazione della segnalazione. Fare clic qui per visualizzare una versione più grande di questa figura.
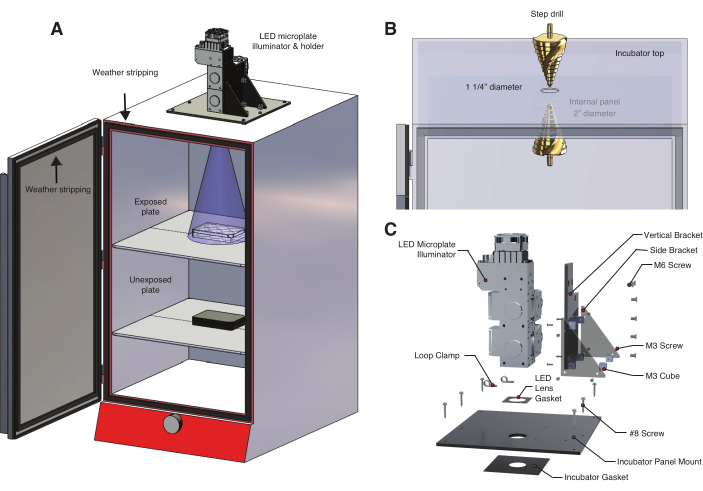
Figura 2: Scatola luminosa a temperatura controllata per esperimenti di optogenetica . (A) Un illuminatore per micropiastre a LED è montato sulla parte superiore di un'incubatrice utilizzando un supporto LED personalizzato. Gli embrioni di pesce zebra in una piastra a 6 pozzetti sul primo ripiano sono esposti alla luce attraverso un foro praticato nella parte superiore dell'incubatrice. Il ripiano inferiore contiene una seconda serie di embrioni di controllo non esposti in una piastra a 6 pozzetti avvolta in un foglio di alluminio. La porta dell'incubatrice è rivestita con guarnizioni per evitare l'esposizione involontaria alla luce della stanza o alla luce solare. (B) Dettaglio della procedura per creare un foro nell'incubatrice utilizzando un trapano a gradino. Il modello di incubatrice qui utilizzato ha un pannello interno che ha richiesto la pratica di un secondo foro più grande (Tabella dei materiali). (C) Dettaglio del supporto LED personalizzato progettato per un sistema di illuminazione a tre lunghezze d'onda. Fare clic qui per visualizzare una versione più grande di questa figura.
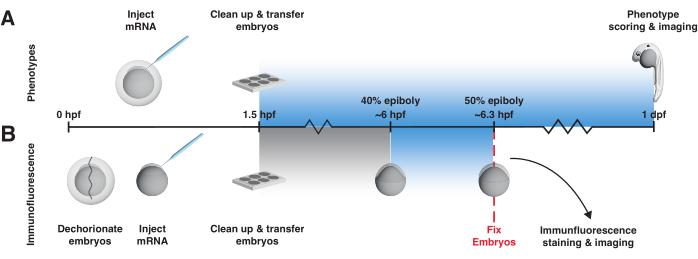
Figura 3: Flusso di lavoro dell'esperimento bOpto-BMP/Nodale. Saggio del fenotipo e colorazione in immunofluorescenza pSmad per testare l'attività di bOpto-BMP/Nodal. Gli embrioni vengono iniettati con mRNA allo stadio monocellulare e trasferiti in una scatola luminosa entro e non oltre 1,5 ore dalla fecondazione (hpf). (A) Saggio del fenotipo. Gli embrioni iniettati e i fratelli non iniettati vengono allevati al buio o esposti a una luce blu uniforme a partire da 1,5 hpf fino a 1 giorno dopo la fecondazione (dpf). L'attività di segnalazione optogenetica può essere valutata assegnando un punteggio agli embrioni per fenotipi coerenti con l'eccesso di attività della via. (B) colorazione in immunofluorescenza pSmad. Gli embrioni iniettati e i fratelli non iniettati vengono allevati al buio fino al 40% di epibolia (~6 hpf). Metà degli embrioni iniettati e metà di quelli non iniettati vengono quindi esposti a una luce blu uniforme per 20 minuti. Dopo l'esposizione, tutti gli embrioni vengono fissati e sottoposti a colorazione in immunofluorescenza per pSmad. Livelli elevati di pSmad1/5/9 o pSmad2/3 riflettono rispettivamente l'attivazione optogenetica della segnalazione BMP o nodale. Fare clic qui per visualizzare una versione più grande di questa figura.
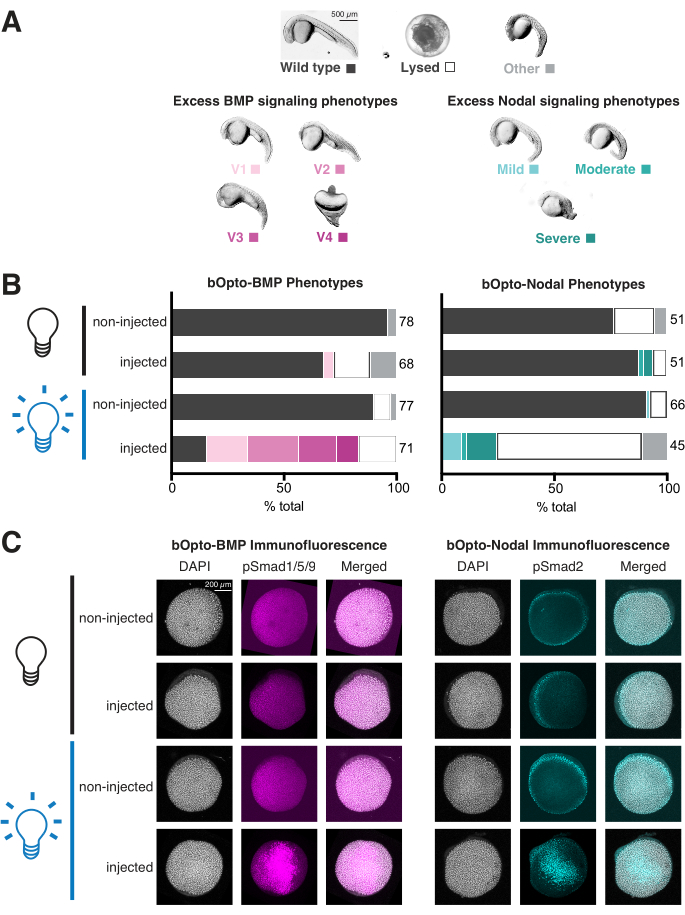
Figura 4: Valutazione delle risposte di segnalazione attivate dalla luce in embrioni di zebrafish. Gli embrioni di zebrafish sono stati iniettati allo stadio di una cellula con mRNA codificante per bOpto-BMP/Nodal. (A) Gli embrioni sono stati allevati al buio o esposti a luce blu uniforme a partire da 1,5 ore dopo la fecondazione (hpf). I fenotipi sono stati valutati a 1 giorno dopo la fecondazione (dpf). Vengono mostrati fenotipi rappresentativi. L'eccesso di segnalazione BMP porta alla ventralizzazione (pannello sinistro), mentre l'eccesso di segnalazione linfonodale causa difetti di sviluppo associati a un ulteriore mesendoderma (pannello destro). Barra della scala = 500 μm. (B) Quantificazione del fenotipo. Gli embrioni iniettati e i fratelli non iniettati sono stati allevati al buio a partire da 1,5 hpf (bulbo nero). Metà degli embrioni iniettati e metà di quelli non iniettati sono stati esposti a una luce blu uniforme (lampadina blu). (C) Gli embrioni iniettati e i fratelli non iniettati sono stati allevati al buio a partire da 1,5 hpf (bulbo nero). Al 40% di epibolia (~6 hpf), metà degli embrioni iniettati e metà di quelli non iniettati sono stati esposti a luce blu uniforme (lampadina blu). Dopo 20 minuti, tutti gli embrioni sono stati fissati e sottoposti a colorazione in immunofluorescenza per Smad1/5/9 o Smad2/3 fosforilati. Intensità di pSmad più elevate indicano rispettivamente un aumento della segnalazione BMP/Nodale. Barra della scala = 200 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
File supplementare 1: Assemblaggio completo della scatola luminosa. File PDF 3D che mostra una vista 3D dell'assieme completo della scatola luminosa. Fare clic qui per scaricare il file.
File supplementare 2: Vista esplosa della scatola luminosa. File PDF 3D che mostra una vista 3D dell'assieme light box esploso. Fare clic qui per scaricare il file.
File supplementare 3: Guarnizione luce grande. File di disegno CAD (. DWG) per fabbricare la grande guarnizione della luce per il supporto del LED utilizzando una taglierina laser. Fare clic qui per scaricare il file.
File supplementare 4: Guarnizione leggera piccola. File di disegno CAD (. DWG) per fabbricare la piccola guarnizione luminosa per il supporto del LED utilizzando una taglierina laser. Fare clic qui per scaricare il file.
File supplementare 5: Base della piattaforma in acrilico. File di disegno CAD (. DWG) per fabbricare la base della piattaforma acrilica del supporto del LED utilizzando una taglierina laser. Fare clic qui per scaricare il file.
File supplementare 6: Piattaforma acrilica verticale. File di disegno CAD (. DWG) per fabbricare la piattaforma acrilica del supporto LED verticale utilizzando una taglierina laser. Fare clic qui per scaricare il file.
File supplementare 7: Supporto acrilico a sinistra. File di disegno CAD (. DWG) per fabbricare il supporto sinistro in acrilico del supporto LED utilizzando una taglierina laser. Fare clic qui per scaricare il file.
File supplementare 8: Supporto acrilico a destra. File di disegno CAD (. DWG) per fabbricare il supporto destro in acrilico del supporto LED utilizzando una taglierina laser. Fare clic qui per scaricare il file.
Discussion
L'iniezione di mRNA è l'attuale strategia per fornire bOpto-BMP/Nodal agli embrioni di zebrafish. Questo metodo presenta diversi inconvenienti. Innanzitutto, la quantità appropriata di mRNA varia da laboratorio a laboratorio. La quantità utilizzata dovrebbe essere sufficiente per attivare la segnalazione in modo robusto con l'esposizione alla luce, ma senza l'attivazione involontaria del buio. È una buona idea testare diverse quantità per trovare i livelli ottimali di mRNA e, una volta stabiliti, creare aliquote di una miscela master per introdurre in modo riproducibile la stessa quantità di mRNA. In secondo luogo, una distribuzione non uniforme dell'mRNA iniettato può portare a un'attivazione non uniforme della segnalazione. Si ritiene che l'iniezione nel centro della cellula (non nel tuorlo) promuova una distribuzione uniforme dell'mRNA. Infine, poiché l'mRNA iniettato si degrada nel tempo, questo approccio potrebbe non essere adatto per esperimenti su embrioni più anziani. In futuro, questi problemi potrebbero essere risolti da linee transgeniche di zebrafish che esprimono ubiquitariamente bOpto-BMP/Nodal con un promotore materno o inducibile da farmaci. Sebbene lavorare con pesci zebra adulti potenzialmente sensibili alla luce possa essere una sfida in questo contesto, sono stati sviluppati con successo i transgenicizebrafish 61,62 e Drosophila 22,34,35,63 che ospitano strumenti optogenetici.
Evitare la fotoattivazione involontaria è una sfida generale con gli strumenti optogenici. Per semplicità, trattare gli embrioni iniettati di età superiore a 1,5 hpf come sensibili alla luce. L'esposizione involontaria alla luce può spesso essere evitata semplicemente avvolgendo piatti o stoviglie con un foglio di alluminio. Tuttavia, per gli esperimenti che richiedono l'osservazione visiva di embrioni vivi di età superiore a 1,5 hpf, è possibile utilizzare sorgenti di luce rossa o coprire le sorgenti di luce bianca con carta da filtro gel economica che blocca le lunghezze d'onda di dimerizzazione di LOV (Tabella dei materiali).
La scatola luminosa qui descritta è progettata per applicazioni specifiche che richiedono un controllo preciso dei livelli di irradianza luminosa, della dinamica e delle lunghezze d'onda (Figura 2). Altri vantaggi di questa scatola luminosa includono un'esposizione uniforme alla luce, un riscaldamento involontario trascurabile del campione, un ampio spazio per più piastre a 6 pozzetti e sorgenti luminose di lunga durata e spettralmente ben caratterizzate. Tuttavia, possono essere preferibili diverse strategie di esposizione alla luce a seconda dell'applicazione di ricerca. Molti laboratori hanno sviluppato sistemi di esposizione alla luce uniforme più semplici ed economici con ingombri ridotti, tra cui il rivestimento degli incubatori con strisce LED, la sospensione di pannelli LED sui campioni o l'incorporazione di LED nei coperchi delle piastre di coltura 32,38,39,40,64,65,66. È importante sottolineare che la scatola luminosa utilizzata in questo protocollo non consente agli utenti di regolare in modo indipendente i singoli pozzetti (a differenza di Bugaj et al.52) o di fornire un controllo spaziale sull'esposizione alla luce. L'attivazione optogenetica spazialmente localizzata è stata dimostrata con bOpto-BMP38 e bOpto-Nodal39 utilizzando laser in SPIM o sistemi confocali, rispettivamente, ed è stata anche realizzata con molte altre strategie optogenetiche in una varietà di sistemi modello (discussi in Rogers e Müller12). Alcuni approcci hanno anche raggiunto la risoluzione spaziale subcellulare 29,30,31. Sebbene l'implementazione di sistemi di esposizione alla luce localizzati spazialmente sia al di fuori dell'ambito di questo protocollo, gli esperimenti di attivazione spaziale con bOpto-BMP/Nodal sono teoricamente possibili con apparecchiature specializzate come dispositivi digitali a microspecchi o approcci di mascheramento. I lettori sono incoraggiati a esplorare l'ampia letteratura sulle scatole luminose fai-da-te per esperimenti optogenici prima di impegnarsi in una strategia di esposizione alla luce (vedi ad esempio, Gerhardt et al.51, Bugaj et al.52, Kumar e Khammash 53 e altri a https://www.optobase.org/materials/).
Le strategie optogenetiche molecolari offrono spesso un grado più elevato di controllo spazio-temporale sui processi biologici rispetto agli approcci storici come i mutanti, l'espressione genica ectopica, le proteine ricombinanti e i farmaci. I lettori interessati ai benefici degli approcci optogenici possono esplorare altri strumenti pubblicati disponibili nel pesce zebra e in altri organismi. Questi includono strumenti per manipolare ulteriori vie di segnalazione 32,65,67,68, regolare l'espressione genica 61,64,66,69,70,71, alterare la localizzazione delle proteine 31,72 e attivare l'apoptosi 62. Questi strumenti e molti altri sono comodamente catalogati su OptoBase, una risorsa web curata per gli approcci di optogenetica molecolare28. Per coloro che sono ispirati a creare nuovi strumenti optogenici, la risorsa presenta anche utili descrizioni di proteine sensibili alla luce che sono state impiegate in un'ampia gamma di strategie, comprese le proteine sensibili alla luce che rispondono alle lunghezze d'onda del verde, del rosso e del vicino infrarosso. Siamo entusiasti che la comunità scientifica si renda conto del pieno potenziale degli approcci optogenetici molecolari.
Disclosures
Gli autori non hanno nulla da rivelare.
Acknowledgements
Il finanziamento per questo protocollo è stato fornito dal NICHD Intramural Program a KWR (ZIA HD009002-01). Ringraziamo Jeff Farrell e il suo laboratorio per il loro illuminante feedback, Will Anderson per l'eccellente supporto tecnico, Leanne Iannucci per aver sottoposto a stress test il protocollo e la misurazione dell'irraggiamento e la struttura NIH Shared Zebrafish per il loro duro lavoro nel mantenere il pesce zebra in salute.
Materials
| Name | Company | Catalog Number | Comments |
| Building a light box & Light exposure protocol | |||
| #8 x 1" Hex Self-drilling Screw | McMaster-Carr | 99663A222 | 1.4.5 |
| Digital Optical Power and Energy Meter | ThorLabs | PM100D | 1.7 4 |
| Incubator (142 liters) | Boekel Scientific | 139400 | 1.3.1 |
| Incubator Panel Mount (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Incubator_panel | 1.4.4 |
| Large HSS Spiral Groove Step Drill Bit | CO-Z | SDB0001TA | 1.3.2 |
| LED lens gasket, Incubator gasket; 1/32" thick black silicone | McMaster-Carr | 5812T12 | 1.4.3 1.4.4 |
| LED microplate illuminator | Prizmatix | NA | 1.1 1.4.3 |
| M3 10mm Cube Standoff | Newark Eletronics | 005.60.533 | 1.4.1 |
| M3 x 10mm 316SS Flat Head Screw | McMaster-Carr | 91801A156 | 1.4.1 |
| M6 x 10mm 316SS Flat Head Screw | McMaster-Carr | 91801A305 | 1.4.3 |
| Memory card thermometer | Fisherbrand | 15-081-111 | 1.9 3.2.1 |
| Microscope Slide Power Meter Sensor Head (150 mW) | ThorLabs | S170C | 1.7 4 |
| Red gel filter paper #E106 | Rosco / B&H Foto & Electronics | 110084014805-E106 | 4.2.1 |
| Side Brackets (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Side_bracket | 1.4.2 |
| Vertical Bracket (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Vertical_bracket | 1.4.1 |
| Weather stripping: Light duty EPDM foam, 1/2" wd 1/4" tk | McMaster-Carr | 8694K12 | 1.8 |
| Generating mRNA | |||
| EZNA MicroElute Cycle Pure Kit | Omega | D6293-02 | 2.4 |
| GeneJET Miniprep Kit (250 rxns) | Thermo Scientific | K0503 | 2.2 |
| Microsample incubator (Hybex) | SciGene | 1057-30-0 | 2 |
| Microsample incubator 1.5 ml tube block (Hybex) | SciGene | 1057-34-0 | 2 |
| Nanodrop One Spectrophotometer | Thermo Scientific | ND-ONE-W | 2.4 |
| NotI-HF restriction enzyme | New England Biolabs (NEB) | R3189L | 2.1 |
| pCS2-Opto-Alk3 | Addgene | 207614 | 2 |
| pCS2-Opto-Alk8 | Addgene | 207615 | 2 |
| pCS2-Opto-BMPR2a | Addgene | 207616 | 2 |
| RNeasy Mini Kit (250 rxns) | Qiagen | 74106 | 2.3 |
| Injecting mRNA | |||
| Agarose (UltraPure) | Invitrogen / Thermo Fisher | 16500500 | 3.1.1 |
| 250 ml glass beakers | Fisherbrand | FB100250 | 3.3.2 |
| 6-well dishes (case of 50) | Falcon | 08 772 1B | 3.1.6 |
| B-8A ball joint | Narishige | B-8A | 3.3 |
| Back pressure unit (microinjection rig component) | Applied Scientific Instrumentation (ASI) | BPU | 3.3 |
| Foot switch (microinjection rig component) | Applied Scientific Instrumentation (ASI) | FWS | 3.3 |
| GJ-1 magnetic stand | Narishige | GJ-1 | 3.3 |
| Glass capillaries (4 in, OD 1 mm, filament) | World Precision Instruments | 1B100F-4 | 3.1.11 |
| Glass petri dish bottoms (for dechorionating) | Pyrex | 08-748A | 3.3.2 |
| Glass pipettes (5 3/4" with wide tip) | Kimble-Chase | 63A53WT | 3.1.9 |
| Injection dish molds | Adaptive Science Tools | tu1 | 3.1.3 |
| IP iron plate | Narishige | IP | 3.3 |
| M-152 micromanipulator | Narishige | M-152 | 3.3 |
| Micro pipette holder kit (microinjection rig component) | Applied Scientific Instrumentation (ASI) | MIMPH-MPIP-Kit | 3.3 |
| Micrometers | Meiji Techno America | MA285 | 3.3 |
| MPPI-2 pressure injector (microinjection rig component) | Applied Scientific Instrumentation (ASI) | MPPI-3 | 3.3 |
| Needle puller | World Precision Instruments | PUL-1000 | 3.1.11 |
| Petri dishes (100 mm x 15 mm, case of 500) | Falcon | 08-757-100D | 3.1.2 |
| Pipettor (10 ml, green) | Bel-Art | F37898-0000 | 3.3 |
| Pronase | Roche | 11459643001 | 3.3.2 |
| Squeeze bottles (500 ml) | Nalgene / Thermo Scientific | 2402-0500 | 3.3 |
References
- Jones, W. D., Mullins, M. C. Cell signaling pathways controlling an axis organizing center in the zebrafish. Current Topics in Developmental Biology. 150, 149-209 (2022).
- Hill, C. S. Establishment and interpretation of NODAL and BMP signaling gradients in early vertebrate development. Current Topics in Developmental Biology. 149, 311-340 (2022).
- Zinski, J., Tajer, B., Mullins, M. C. TGF-β Family Signaling in Early Vertebrate Development. Cold Spring Harbor Perspectives in Biology. 10 (6), a033274 (2018).
- Shore, E. M., Kaplan, F. S. Inherited human diseases of heterotopic bone formation. Nature Reviews. Rheumatology. 6 (9), 518-527 (2010).
- Hebron, K. E., Hernandez, E. R., Yohe, M. E. The RASopathies: from pathogenetics to therapeutics. Disease Models & Mechanisms. 15 (2), dmm049107 (2022).
- Grant, M. G., Patterson, V. L., Grimes, D. T., Burdine, R. D. Modeling Syndromic Congenital Heart Defects in Zebrafish. Current Topics in Developmental Biology. 124, 1-40 (2017).
- Nusse, R., Clevers, H. Wnt/beta-Catenin Signaling, Disease, and Emerging Therapeutic Modalities. Cell. 169 (6), 985-999 (2017).
- Farahani, P. E., Reed, E. H., Underhill, E. J., Aoki, K., Toettcher, J. E. Signaling, Deconstructed: Using Optogenetics to Dissect and Direct Information Flow in Biological Systems. Annual Review of Biomedical Engineering. 23, 61-87 (2021).
- Purvis, J. E., Lahav, G. Encoding and decoding cellular information through signaling dynamics. Cell. 152 (5), 945-956 (2013).
- Wibisana, J. N., Okada, M. Encoding and decoding NF-kappaB nuclear dynamics. Current Opinion in Cell Biology. 77, 102103 (2022).
- Friedel, L., Loewer, A. The guardian's choice: how p53 enables context-specific decision-making in individual cells. TheFEBS Journal. 289 (1), 40-52 (2022).
- Rogers, K. W., Müller, P. Optogenetic approaches to investigate spatiotemporal signaling during development. Current Topics in Developmental Biology. 137, 37-77 (2020).
- Johnson, H. E., Toettcher, J. E. Illuminating developmental biology with cellular optogenetics. Current Opinion in Biotechnology. 52, 42-48 (2018).
- Bosman, S. L., Sonnen, K. F. Signaling oscillations in embryonic development. Current Topics in Developmental Biology. 149, 341-372 (2022).
- Li, P., Elowitz, M. B. Communication codes in developmental signaling pathways. Development. 146 (12), dev170977 (2019).
- Tucker, J. A., Mintzer, K. A., Mullins, M. C. The BMP signaling gradient patterns dorsoventral tissues in a temporally progressive manner along the anteroposterior axis. Developmental Cell. 14 (1), 108-119 (2008).
- van Boxtel, A. L., et al. A temporal window for signal activation dictates the dimensions of a Nodal signaling domain. Developmental Cell. 35 (2), 175-185 (2015).
- Sorre, B., Warmflash, A., Brivanlou, A. H., Siggia, E. D. Encoding of temporal signals by the TGF-β pathway and implications for embryonic patterning. Developmental Cell. 30 (3), 334-342 (2014).
- Economou, A. D., Hill, C. S. Temporal dynamics in the formation and interpretation of Nodal and BMP morphogen gradients. Current Topics in Developmental Biology. 137, 363-389 (2020).
- Rogers, K. W., Schier, A. F. Morphogen gradients: from generation to interpretation. Annual Review of Cell and Developmental Biology. 27, 377-407 (2011).
- Barkai, N., Shilo, B. Z. Robust generation and decoding of morphogen gradients. Cold Spring Harbor Perspectives in Biology. 1 (5), a001990 (2009).
- Johnson, H. E., Djabrayan, N. J. V., Shvartsman, S. Y., Toettcher, J. E. Optogenetic Rescue of a Patterning Mutant. Current Biology. 30 (17), 3414-3424 (2020).
- Imayoshi, I., et al. Oscillatory control of factors determining multipotency and fate in mouse neural progenitors. Science. 342 (6163), 1203-1208 (2013).
- Lin, B., et al. Synthetic spatially graded Rac activation drives cell polarization and movement. Proceedings of the National Academy of Sciences of the United States of America. 109 (52), E3668-E3677 (2012).
- Cui, K. W., et al. Spatially controlled stem cell differentiation via morphogen gradients: A comparison of static and dynamic microfluidic platforms. Journal of Vacuum Science & Technology. A, Vaccum, Surfaces, and Films. 38 (3), 033205 (2020).
- Faden, F., Mielke, S., Lange, D., Dissmeyer, N. Generic tools for conditionally altering protein abundance and phenotypes on demand. Biological Chemistry. 395 (7-8), 737-762 (2014).
- Shoji, W., Sato-Maeda, M. Application of heat shock promoter in transgenic zebrafish. Development, Growth & Differentiation. 50 (6), 401-406 (2008).
- Kolar, K., Knobloch, C., Stork, H., Znidaric, M., Weber, W. OptoBase: A web platform for molecular optogenetics. ACS Synthetic Biology. 7 (7), 1825-1828 (2018).
- Benedetti, L., et al. Light-activated protein interaction with high spatial subcellular confinement. Proceedings of the National Academy of Sciences of the United States of America. 115 (10), E2238-E2245 (2018).
- Krueger, D., De Renzis, S. Optogenetic Methods to Control Tissue Mechanics in Drosophila. Methods in Molecular Biology. 2540, 269-283 (2022).
- Buckley, C. E. Optogenetic Control of Subcellular Protein Location and Signaling in Vertebrate Embryos. Methods in Molecular Biology. 1920, 143-162 (2019).
- Čapek, D., et al. Light-activated Frizzled7 reveals a permissive role of non-canonical wnt signaling in mesendoderm cell migration. Elife. 8, e42093 (2019).
- Krishnamurthy, V. V., et al. Reversible optogenetic control of kinase activity during differentiation and embryonic development. Development. 143 (21), 4085-4094 (2016).
- Huang, A., Amourda, C., Zhang, S., Tolwinski, N. S., Saunders, T. E. Decoding temporal interpretation of the morphogen Bicoid in the early Drosophila embryo. Elife. 6, e26258 (2017).
- Johnson, H. E., Toettcher, J. E. Signaling dynamics control cell fate in the early Drosophila embryo. Developmental Cell. 48 (3), 361.e3-370.e3 (2019).
- Aoki, K., et al. Stochastic ERK activation induced by noise and cell-to-cell propagation regulates cell density-dependent proliferation. Molecular Cell. 52 (4), 529-540 (2013).
- Chow, R. W., Vermot, J. The rise of photoresponsive protein technologies applications in vivo: a spotlight on zebrafish developmental and cell biology. F1000Research. , (2017).
- Rogers, K. W., ElGamacy, M., Jordan, B. M., Müller, P. Optogenetic investigation of BMP target gene expression diversity. Elife. 9, e58641 (2020).
- Sako, K., et al. Optogenetic control of Nodal signaling reveals a temporal pattern of Nodal signaling regulating cell fate specification during gastrulation. Cell Reports. 16 (3), 866-877 (2016).
- Grusch, M., et al. Spatio-temporally precise activation of engineered receptor tyrosine kinases by light. The EMBO Journal. 33 (15), 1713-1726 (2014).
- Crossman, S. H., Janovjak, H. Light-activated receptor tyrosine kinases: Designs and applications. Current Opinion in Pharmacology. 63, 102197 (2022).
- Kainrath, S., Janovjak, H. Design and Application of Light-Regulated Receptor Tyrosine Kinases. Methods in Molecular Biology. 2173, 233-246 (2020).
- Takahashi, F., et al. AUREOCHROME, a photoreceptor required for photomorphogenesis in stramenopiles. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19625-19630 (2007).
- Toyooka, T., Hisatomi, O., Takahashi, F., Kataoka, H., Terazima, M. Photoreactions of aureochrome-1. Biophysical Journal. 100 (11), 2801-2809 (2011).
- Vopalensky, P., Pralow, S., Vastenhouw, N. L. Reduced expression of the Nodal co-receptor Oep causes loss of mesendodermal competence in zebrafish. Development. 145 (5), dev.158832 (2018).
- Kishimoto, Y., Lee, K. H., Zon, L., Hammerschmidt, M., Schulte-Merker, S. The molecular nature of zebrafish swirl: BMP2 function is essential during early dorsoventral patterning. Development. 124 (22), 4457-4466 (1997).
- Rogers, K. W., et al. Nodal patterning without Lefty inhibitory feedback is functional but fragile. Elife. 6, e28785 (2017).
- Dubrulle, J., et al. Response to Nodal morphogen gradient is determined by the kinetics of target gene induction. Elife. 4, e05042 (2015).
- Harvey, S. A., Smith, J. C. Visualisation and quantification of morphogen gradient formation in the zebrafish. PLoS Biology. 7 (5), e1000101 (2009).
- Zinski, J., Tuazon, F., Huang, Y., Mullins, M., Umulis, D. Imaging and Quantification of P-Smad1/5 in Zebrafish Blastula and Gastrula Embryos. Methods in Molecular Biology. 1891, 135-154 (2019).
- Gerhardt, K. P., Castillo-Hair, S. M., Tabor, J. J. DIY optogenetics: Building, programming, and using the Light Plate Apparatus. Methods in Enzymology. 624, 197-226 (2019).
- Bugaj, L. J., Lim, W. A. High-throughput multicolor optogenetics in microwell plates. Nature Protocols. 14 (7), 2205-2228 (2019).
- Kumar, S., Khammash, M. Platforms for Optogenetic Stimulation and Feedback Control. Frontiers in Bioengineering and Biotechnology. 10, 918917 (2022).
- Urushibata, H., et al. Control of Developmental Speed in Zebrafish Embryos Using Different Incubation Temperatures. Zebrafish. 18 (5), 316-325 (2021).
- Rogers, K. W., Bläßle, A., Schier, A. F., Müller, P. Measuring protein stability in living zebrafish embryos using fluorescence decay after photoconversion (FDAP). Journal of Visualized Experiments. (95), e52266 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Feldman, B., et al. Zebrafish organizer development and germ-layer formation require nodal-related signals. Nature. 395 (6698), 181-185 (1998).
- Shimizu, T., et al. Cooperative roles of Bozozok/Dharma and Nodal-related proteins in the formation of the dorsal organizer in zebrafish. Mechanisms of Development. 91 (1-2), 293-303 (2000).
- Rebagliati, M. R., Toyama, R., Fricke, C., Haffter, P., Dawid, I. B. Zebrafish nodal-related genes are implicated in axial patterning and establishing left-right asymmetry. Developmental Biology. 199 (2), 261-272 (1998).
- Gritsman, K., Talbot, W. S., Schier, A. F. Nodal signaling patterns the organizer. Development. 127 (5), 921-932 (2000).
- LaBelle, J., et al. TAEL 2.0: An Improved Optogenetic Expression System for Zebrafish. Zebrafish. 18 (1), 20-28 (2021).
- Mruk, K., Ciepla, P., Piza, P. A., Alnaqib, M. A., Chen, J. K. Targeted cell ablation in zebrafish using optogenetic transcriptional control. Development. 147 (12), dev183640 (2020).
- Johnson, H. E., et al. The spatiotemporal limits of developmental Erk signaling. Developmental Cell. 40 (2), 185-192 (2017).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Patel, A. L., et al. Optimizing photoswitchable MEK. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25756-25763 (2019).
- LaBelle, J., Woo, S. Light-Induced GFP Expression in Zebrafish Embryos using the Optogenetic TAEL/C120 System. Journal of Visualized Experiments. (174), e62818 (2021).
- Kainrath, S., Stadler, M., Reichhart, E., Distel, M., Janovjak, H. Green-light-induced inactivation of receptor signaling using cobalamin-binding domains. Angewandte Chemie. 56 (16), 4608-4611 (2017).
- Benman, W., et al. Temperature-responsive optogenetic probes of cell signaling. Nat Chem Biol. 18 (2), 152-160 (2022).
- Reade, A., et al. TAEL: a zebrafish-optimized optogenetic gene expression system with fine spatial and temporal control. Development. 144 (2), 345-355 (2017).
- Putri, R. R., Chen, L. Spatiotemporal control of zebrafish (Danio rerio) gene expression using a light-activated CRISPR activation system. Gene. 677, 273-279 (2018).
- Liu, H., Gomez, G., Lin, S., Lin, S., Lin, C. Optogenetic control of transcription in zebrafish. PLoS One. 7 (11), e50738 (2012).
- Buckley, C. E., et al. Reversible optogenetic control of subcellular protein localization in a live vertebrate embryo. Developmental Cell. 36 (1), 117-126 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved