Ativação da Sinalização Optogenética em Embriões de Zebrafish
* These authors contributed equally
In This Article
Summary
A manipulação optogenética de vias de sinalização pode ser uma estratégia poderosa para investigar como a sinalização é decodificada no desenvolvimento, regeneração, homeostase e doença. Este protocolo fornece diretrizes práticas para o uso de ativadores de sinalização nodal e proteína morfogênica óssea (BMP) baseados em luz-oxigênio-voltagem no embrião inicial do peixe-zebra.
Abstract
As vias de sinalização orquestram processos biológicos fundamentais, incluindo desenvolvimento, regeneração, homeostase e doença. Métodos para manipular experimentalmente a sinalização são necessários para entender como a sinalização é interpretada nesses contextos abrangentes. Ferramentas optogenéticas moleculares podem fornecer manipulações reversíveis e ajustáveis da atividade da via de sinalização com alto grau de controle espaço-temporal e têm sido aplicadas in vitro, ex vivo e in vivo. Essas ferramentas combinam domínios de proteínas responsivos à luz, como o domínio de detecção de luz-oxigênio-voltagem (LOV) homodimerizante da luz azul, com efetores de sinalização para conferir controle experimental dependente da luz sobre a sinalização. Este protocolo fornece diretrizes práticas para o uso da proteína morfogenética óssea (BMP) baseada em LOV e ativadores de sinalização nodal bOpto-BMP e bOpto-Nodal no embrião de zebrafish precoce opticamente acessível. Descreve dois experimentos de controle: um ensaio rápido de fenótipo para determinar condições experimentais apropriadas e um ensaio de imunofluorescência para avaliar diretamente a sinalização. Juntos, esses experimentos de controle podem ajudar a estabelecer um pipeline para o uso de ferramentas optogenéticas em embriões de peixe-zebra. Essas estratégias fornecem uma plataforma poderosa para investigar os papéis da sinalização no desenvolvimento, saúde e fisiologia.
Introduction
As vias de sinalização permitem que as células respondam ao seu ambiente e coordenem atividades em escalas de tecidos e organismos. Sinais cruciais para o desenvolvimento embrionário incluem a proteína morfogenética óssea (BMP) dos membros da superfamília TGF-beta e o Nodal 1,2,3. Durante a embriogênese, as vias reguladas por esses sinais e outros modelam o plano do corpo, controlando a expressão gênica e processos adicionais para garantir que diversos tecidos e órgãos se desenvolvam e interajam adequadamente. Patologias, incluindo defeitos congênitos e câncer, podem ocorrer quando a sinalização ou as respostas à sinalização são perturbadas 4,5,6,7. Apesar da rigorosa investigação sobre sinalização, muito mais ainda precisa ser descoberto sobre como níveis e dinâmicas são decodificados em uma variedade de contextos 8,9,10,11, especialmente durante o desenvolvimento 12,13,14,15,16,17,18,19.
Para entender como a sinalização é decodificada, um experimento ideal seria manipular os níveis, o tempo e/ou a dinâmica da sinalização - com alto grau de controle espacial e temporal - e avaliar os resultados. Por exemplo, gradientes precisos de sinalização espacial são propostos para padronizar tecidos em desenvolvimento20,21. Alterar as distribuições espaciais dos gradientes de sinalização ajudaria a testar essa hipótese22. Além disso, a importância da dinâmica de sinalização na geração de diversas respostas celulares está ficando cada vez mais clara: uma mesma via de sinalização pode instruir as células a se diferenciarem ou proliferarem dependendo da frequência de sinalização,por exemplo9,23. Paradigmas experimentais nos quais a dinâmica de sinalização pode ser facilmente manipulada serão valiosos para explorar a relação entre dinâmica e decisões sobre o destino celular 8,12,13,14,15.
Historicamente, múltiplos métodos têm sido utilizados para manipular a sinalização em contextos de desenvolvimento, levando a descobertas fundamentais 1,2,3. A sinalização pode ser bloqueada usando mutantes de perda de função da via, expressão de inibidores ectópicos ou drogas antagonistas. Métodos para ativar a sinalização incluem drogas agonistas, ligantes recombinantes, expressão ectópica de ligantes ou receptores constitutivamente ativos e mutantes inibidores de perda de função de vias aéreas. Esses métodos variam ao longo de um continuum de controle experimental. Por exemplo, mutantes e expressão ectópica podem cair no lado da marreta do contínuo: Com essas abordagens, mudanças dramáticas e sistêmicas na atividade da via podem causar morte precoce e impedir investigações em estágios posteriores, ou ao longo do tempo podem resultar em efeitos pleiotrópicos difíceis de desembaraçar. Além disso, muitas vezes é desafiador manipular independentemente um recurso de sinalização por vez, como nível ou duração. No outro extremo do contínuo, alguns métodos oferecem controle experimental mais preciso, como dispositivos microfluídicos que expõem amostras a drogas ou proteínas recombinantes com controle temporal e, às vezes, espacial 18,24,25, ou métodos genéticos, incluindo promotores induzíveis por choque térmico e tecido-específicos que podem oferecer benefícios semelhantes16,26,27. No entanto, esses métodos podem ser difíceis de executar, podem não ser reversíveis, podem ter cinética relativamente lenta ou baixa resolução, e podem não estar disponíveis em alguns sistemas modelo.
Abordagens optogenéticas moleculares são uma poderosa adição a este kit de ferramentas. Essas abordagens utilizam proteínas que respondem a diferentes comprimentos de onda de luz para manipular processos biológicos, incluindo a sinalização8,12,13,14,15, e foram desenvolvidas ao longo de décadas para uso em uma variedade de sistemas, desde cultura celular até animais inteiros12,13,28. Em comparação com abordagens históricas, a optogenética molecular pode muitas vezes oferecer um maior grau de controle espaço-temporal sobre processos biológicos: O controlador em sistemas optogenéticos é a luz, e o controle do comprimento de onda, intensidade, duração e frequência de exposição da luz é relativamente simples. Com sistemas sofisticados, como microscópios confocais e de dois fótons, o controle espacial na faixa subcelular é possível 29,30,31. Ferramentas para manipular optogeneticamente a sinalização têm sido desenvolvidas e aplicadas em vários sistemas, incluindo os descritos em Johnson et al.22, Čapek et al.32, Krishnamurthy et al.33 e Huang et al.34. Por exemplo, explorando o controle espacial proporcionado pela optogenética, essa estratégia foi recentemente utilizada para modificar um gradiente de sinalização em embriões de Drosophila, demonstrando que a embriogênese de moscas é surpreendentemente robusta a mudanças nessegradiente22. A reversibilidade e a rápida cinética liga/desliga dos ativadores de sinalização optogenética também os tornaram ferramentas atrativas para investigar a decodificação da dinâmica da sinalização8,12,13,14,15,34,35,36.
O embrião de peixe-zebra precoce é um sistema in vivo adequado para estudos optogenéticos porque é fertilizado externamente, transparente, amigável à microscopia e geneticamente tratável. A exposição à luz é mais fácil de entregar a embriões que se desenvolvem fora da mãe, a luz pode penetrar e acessar seus tecidos não opacos, embriões vivos de peixe-zebra toleram bem a imagem (além de transparentes) e os métodos genéticos existentes fornecem oportunidades diretas para experimentos de knockdown e superexpressão, além do desenvolvimento de transgênicos úteis37.
Recentemente, ferramentas optogenéticas foram desenvolvidas para ativar a sinalização BMP38 e Nodal39 em embriões de zebrafish com exposição à luz azul (Figura 1). Referimo-nos a essas ferramentas como bOpto-BMP e bOpto-Nodal (b para ativado por luz azul e Opto para optogenética). bOpto-BMP/Nodal são baseados em mecanismos de ativação de vias semelhantes. A ligação de BMP ou ligantes nodais às suas respectivas receptoras serina-treonina quinases conduz interações de domínio receptor quinase que levam à fosforilação de efetores de sinalização (Smad1/5/9 para BMP e Smad2/3 para Nodal). Os efetores de sinalização fosforilados então se translocam para o núcleo e regulam a expressão do gene alvo3 (Figura 1A,D). Essas interações do receptor quinase podem ser tornadas responsivas à luz acoplando as quinases do receptor às proteínas dimerizantes responsivas à luz: Com a exposição à luz, essas proteínas quiméricas devem dimerizar-se, fazendo com que os domínios da quinase do receptor interajam e ativem a sinalização (Figura 1B,C,E,F). É importante ressaltar que, ao contrário dos receptores endógenos, o bOpto-BMP/Nodal não contém domínios de ligação ao ligante extracelular, garantindo atividade independente do ligante (Figura 1C,F). Essa estratégia de ativação optogenética foi primeiramente realizada com o receptor tirosina quinases40,41,42 e depois aplicada com o receptor serina-treonina quinases.
bOpto-BMP/Nodal utilizam o domínio homodimerizante luz-oxigênio-voltage sensing (LOV) responsivo à luz azul (~450 nm) da alga Vaucheria fridiga AUREO1 protein (VfLOV)43,44. Esses construtos consistem em um motivo de miristoilação direcionado à membrana, seguido por domínios BMP ou nodal receptor quinase, fundidos a um domínio LOV (Figura 1B,E). A exposição à luz azul deve causar homodimerização da LOV, resultando em interações no domínio da quinase do receptor que levam à respectiva fosforilação do Smad e ativação da via (Figura 1C,F). Para bOpto-BMP, uma combinação de construções com os domínios da quinase do receptor tipo I de Acvr1l (também conhecido como Alk8) e BMPR1aa (também conhecido como Alk3) e o domínio quinase do receptor tipo II de BMPR2a foi encontrada para ativar otimamente a sinalização38 (Addgene #207614, #207615 e #207616). Para o bOpto-Nodal, uma combinação de construtos com o domínio da quinase do receptor tipo I do Acvr1ba e o domínio quinase do receptor tipo II do Acvr2ba é usada39.
bOpto-BMP/Nodal foram introduzidos em embriões de peixe-zebra inicial injetando RNAm no estágio de uma célula e usados para investigar o papel da duração da sinalização na interpretação nodal39, para determinar por que o peixe-zebra perde a capacidade de responder ao Nodal45 e para examinar como os genes-alvo do BMP respondem a diferentes níveis de sinalização de BMP38. É provável que essas ferramentas continuem a ser úteis em uma gama diversificada de investigações futuras. No entanto, a força dos ativadores de sinalização optogenética também é sua fraqueza: amostras sensíveis à luz devem ser tratadas com cuidado para evitar atividade de sinalização ectópica inadvertida. A exposição à luz ambiente ou à luz solar pode ativar o bOpto-BMP/Nodal.
Este protocolo fornece sugestões práticas para o uso de BMP e ativadores nodais baseados em LOV-mRNA codificados por mRNA em embriões precoces de zebrafish. Começa detalhando uma estratégia para construir uma caixa de luz para controlar a exposição à luz uniforme e a temperatura (Figura 2, Arquivo Suplementar 1, Arquivo Suplementar 2, Arquivo Suplementar 3, Arquivo Suplementar 4, Arquivo Suplementar 5, Arquivo Suplementar 6, Arquivo Suplementar 7, Arquivo Suplementar 8). Em seguida, descreve dois experimentos de controle chave que determinam se um ativador de sinalização optogenética está se comportando como esperado, ou seja, ativando a atividade da via apenas quando exposto à luz (Figura 3). O primeiro ensaio de controle envolve o exame de fenótipos um dia após a fertilização em embriões expostos e não expostos à luz (Figura 3A). Embriões expostos à luz injetados com RNAm, mas não embriões não expostos, devem fenocopiar BMP ou superexpressão nodal (Figura 4A,B; Os fenótipos de BMP, em particular, são claramente distinguíveis neste momento ponto46). Este ensaio fornece uma leitura rápida da atividade. No segundo ensaio de controle, para determinar se os fenótipos são causados especificamente pelo excesso de BMP ou sinalização nodal e para observar diretamente a mudança nos níveis de sinalização, a coloração de imunofluorescência é usada para detectar efetores de sinalização fosforilados (pSmad1/5/9 ou pSmad2/3, respectivamente) após uma exposição à luz de 20 min em torno do estágio final de blástula/gastrulação inicial, quando a atividade de sinalização foi bem descrita12, 16,17,47,48,49,50 (Figura 3B e Figura 4C). (Observe que, embora a ativação espacialmente localizada tenha sido demonstrada tanto para o bOpto-BMP38 quanto para o bOpto-Nodal39, esse protocolo descreve apenas estratégias uniformes de exposição à luz e ativação de sinalização.) É aconselhável executar esses experimentos de controle antes de aplicar o bOpto-BMP/Nodal em questões específicas de pesquisa, a fim de determinar condições experimentais locais ideais.
Protocol
Os protocolos de pesquisa do peixe-zebra foram revisados e aprovados pelo Comitê de Cuidados e Uso de Animais do NICHD no National Institutes of Health (ASP 21-008). Todos os estudos de zebrafish foram realizados de acordo com o Guia para o Cuidado e Uso de Animais de Laboratório.
1. Construindo uma caixa de luz
- Para controlar a exposição à luz e a temperatura, construa uma caixa de luz que use um iluminador de microplaca de diodo emissor de luz (LED) como fonte de luz (Figura 2A, Tabela de Materiais, Arquivo Suplementar 1, Arquivo Suplementar 2). Este iluminador personalizável fornece controle dinâmico e programável sobre vários comprimentos de onda.
NOTA: Existem muitas estratégias possíveis para construir uma caixa de luz, e uma abordagem alternativa pode ser mais apropriada (ver, por exemplo, Gerhardt et al.51, Bugaj et al.52, Kumar e Khammash 53, e mais em https://www.optobase.org/materials/). - Inclua os seguintes recursos na caixa de luz: Controle de temperatura (28 °C é ideal para embriões de peixe-zebra), exclusão de luz indesejada (por exemplo, luz ambiente e luz solar), entrega uniforme de luz azul que cobre a área alvo (por exemplo, placa de 6 poços) e controle sobre a intensidade da luz e a dinâmica de exposição.
NOTA: bOpto-BMP/Nodal são ativados por luz azul, mas algumas ferramentas optogenéticas respondem a outros comprimentos de onda. Use o comprimento de onda apropriado para a ferramenta optogenética. - Faça um furo na parte superior de uma incubadora (Figura 2B) ligeiramente mais larga do que a lente de saída LED.
- Certifique-se de que não há componentes elétricos na parte superior da incubadora que serão destruídos pela perfuração (Tabela de Materiais). Isso pode ser verificado entrando em contato com o fabricante da incubadora e perguntando diretamente.
- Se houver um furo existente no painel superior da incubadora, use uma broca de degrau para aumentar o tamanho do furo para 1,25 polegadas. Caso contrário, use uma serra furada de 1,25 polegadas com caramanchão.
- Se houver painéis internos que bloqueiem a fonte de luz, faça o furo apropriado para garantir que o cone de luz não seja bloqueado (Figura 2A). Os painéis são normalmente feitos de chapa fina, então use velocidades baixas e brocas de metal para evitar danos (broca de cobalto recomendada).
- Construa um suporte de LED para fixar o iluminador de microplaca LED na parte superior da incubadora (Figura 2C, Arquivo Suplementar 3, Arquivo Suplementar 4, Arquivo Suplementar 5, Arquivo Suplementar 6, Arquivo Suplementar 7, Arquivo Suplementar 8).
- Monte quatro suportes de cubo M3 na peça do suporte vertical usando parafusos M3.
- Fixe os dois colchetes laterais à esquerda e à direita dos suportes de cubo do colchete vertical. Monte outro cubo no orifício restante nos suportes laterais.
- Monte a peça do suporte vertical no conjunto do iluminador de microplaca LED (Tabela de Materiais) usando parafusos M6. Coloque a junta da lente LED sobre a lente do sistema LED.
- Monte as peças montadas no suporte do painel da incubadora e, em seguida, nos suportes M3 nos suportes verticais e laterais. Coloque a junta da incubadora sobre o orifício perfurado em cima da incubadora.
- Coloque o suporte do painel da incubadora na parte superior da junta da incubadora, garantindo que a junta e as aberturas do painel estejam concêntricas com o orifício da incubadora. Monte o painel na parte superior da incubadora usando parafusos nº 8. Certifique-se de que esta vedação é estanque.
- Coloque um prato de 6 poços na prateleira superior da incubadora. Determinar se o feixe de luz cobre uniformemente a placa (Figura 2A). Use uma folha de papel para visualizar a cobertura de luz.
- Se a placa inteira não estiver coberta pelo feixe, aumente a distância entre o LED e a placa movendo a prateleira para baixo. Para o sistema descrito aqui, ~14 polegadas entre o LED e a prateleira é suficiente.
- Utilizar um medidor de luz para determinar o nível de irradiância e uniformidade espacial (Tabela de Materiais).
- Para evitar a exposição inadvertida à luz solar e à luz ambiente, use a proteção contra intempéries para garantir que a porta da incubadora seja estanque à luz (Figura 2A).
- Os embriões de peixe-zebra desenvolvem-se robustamente a 28 °C54. Use um termômetro de cartão de memória para garantir que a caixa de luz contenha 28 °C.
2. Geração de mRNA para injeção
NOTA: pCS2+ é a espinha dorsal vetorial para construções bOpto-BMP38 e construções bOpto-Nodal39. Este vetor é resistente à ampicilina. bOpto-BMP é composto por três construtos (Figura 1B): BMPR1aa-LOV (Addgene # 207614): Domínio putativo quinase do receptor tipo I BMPR1aa (também conhecido como Alk3) fundido à LOV; Acvr1l-LOV (Addgene # 207615): Suposto domínio quinase do receptor Acvr1l tipo I (também conhecido como Alk8) fundido à LOV; e BMPR2a-LOV (Addgene # 207616): Domínio putativo quinase do receptor tipo II BMPR2a e domínio C-terminal seguinte fundido à LOV. bOpto-Nodal é composto por dois construtos (Figura 1E): Acvr1ba-LOV: Domínio putativo quinase do receptor Acvr1ba tipo I (também conhecido como Acvr1b) fundido à LOV; Acvr2ba-LOV: Domínio putativo da quinase do receptor Acvr2ba tipo II (também conhecido como Acvr2b) fundido à LOV.
- Para linearizar plasmídeos, digerir entre 2-5 μg de DNA plasmidial usando a enzima de restrição NotI a 37 °C por 1-3 h (Tabela de Materiais).
NOTA: Também é possível gerar DNA linearizado usando o plasmídeo como modelo de PCR. - Purifice o DNA usando um kit de purificação padrão baseado em coluna (Tabela de Materiais).
- Use um kit de transcrição in vitro SP6, como um kit mMessage mMachine para transcrever o RNA do modelo linearizado (Tabela de Materiais). Configure duas reações de acordo com as recomendações do fabricante para garantir maior rendimento.
- Purifice o RNA usando um kit de limpeza de RNA padrão baseado em coluna (Tabela de Materiais). Também é possível purificar por precipitação.
3. Injetando mRNA
- Pelo menos 1 dia antes das injeções, faça pratos de injeção e placas de 6 poços revestidas com agarose.
- Preparar 200 mL de agarose a 1% em meio embrião de peixe-zebra e micro-ondas até que a agarose se dissolva completamente. Qualquer meio padrão de embrião de peixe-zebra deve ser aceitável; no entanto, exclua o azul de metileno do meio embrionário, pois pode afetar a imagem a jusante em outras aplicações.
- Despeje cuidadosamente agarose derretida em placas de Petri de plástico de 100 mm x 15 mm. Encha os pratos no meio do caminho.
- Lave um molde de prato de injeção com meio embrionário e coloque suavemente sobre agarose derretida, garantindo que nenhuma bolha fique presa entre o molde e a agarose. Use fita adesiva para fazer uma aba na parte de trás do molde para facilitar a colocação e a recuperação.
- O molde deve flutuar na agarose fundida. Se o molde afundar, retire cuidadosamente da agarose derretida e repita o passo 3.1.3.
- Depois que a agarose tiver solidificado, use a aba para remover suavemente o molde. Isso pode ser acelerado colocando o prato a 4 °C.
- Faça placas de 6 poços revestidas com agarose se estiver trabalhando com embriões descorionados para experimentos de imunofluorescência.
- Use uma pipeta plástica descartável de 10 mL para transferir agarose derretida suficiente para cobrir o fundo de cada poço de uma placa de 6 poços.
- Loja pratos de injeção e placas de 6 poços a 4 °C. Eles podem ser usados imediatamente ou armazenados até que a agarose seja seca ou contaminada (geralmente 2-3 semanas).
- Prepare pontas de pipeta de vidro flamejado se estiver trabalhando com embriões descorionados para experimentos de imunofluorescência.
- Insira a extremidade de uma pipeta de vidro em uma chama de queimador de Bunsen e gire continuamente até que as bordas fiquem lisas. Os embriões descorionados devem caber confortavelmente através da extremidade da pipeta. Não permita que a abertura encolhe abaixo do diâmetro de um embrião.
- Comprar ou puxar agulhas de microinjeção (Tabela de Materiais). É aconselhável ter agulhas extras disponíveis no dia das injeções, caso seja necessária uma substituição.
- Na véspera das injeções, montou criadores de peixe-zebra de acordo com os procedimentos operacionais padrão (POPs) do instituto. Mantenha machos e fêmeas separados.
- Ligue o regulador de temperatura da caixa de luz para manter 28 °C. Para garantir que a temperatura da caixa de luz permaneça em 28 °C, monitore a temperatura usando um termômetro de cartão de memória (Tabela de Materiais).
- Preparar mistura(s) de injeção de mRNA. Injetar quantidades equimolares de cada construto. É necessário determinar empiricamente a quantidade a ser injetada.
- Os tamanhos de transcrição do bOpto-BMP são os seguintes:
Acvr1l-LOV = 2007 nucleotídeos (nt)
BMPR1aa-LOV = 1983 nt
BMPR2a-LOV = 3409 nt - Para injetar quantidades equimolares, injete 1,01x mais do construto Acvr1l do que BMPR1aa; injetar 1,72x mais do construto BMPR2a do que BMPR1aa.
- Os tamanhos de transcrição do bOpto-Nodal são os seguintes:
Acvr1ba-LOV e Acvr2ba-LOV são ambos 1962 nt. - Para injetar quantidades equimolares, injete a mesma quantidade de cada construto.
- Prepare misturas de injeção equimolares, combinando todos os mRNAs visando uma via em uma mistura de injeção. Inclua o traçador de injeção de vermelho fenol, se desejado. Para os dados apresentados na Figura 4, foram utilizados 15 pg de cada construto bOpto-Nodal (Acvr1ba-LOV e Acvr2ba-LOV) e, para bOpto-BMP, 7,8 pg Acvr1l-LOV e BMPR1aa-LOV, e 13,4 pg BMPR2a-LOV.
- Conservar misturas injetáveis a -20 °C. Uma vez determinada a concentração ideal da mistura de injeção, fazer alíquotas de 5-10 μL e armazenar a -20 °C ou -80 °C.
- Dia da injeção
- Se estiver realizando um ensaio de fenotipagem (Figura 3A), injete através do córion diretamente no centro da célula no estágio de uma célula de acordo com o POP do seu laboratório. O córion protege os embriões de estressores ambientais e mantém os embriões lisados contidos. Isso é útil durante a pontuação para quantificação precisa de embriões lisados (Figura 4A,B).
- Se for realizado um ensaio de imunofluorescência (Figura 3B), os embriões eventualmente precisarão ser descorionados para exames de imagem (Figura 4C). Portanto, injetar diretamente no centro da célula de embriões descorionados no estágio de uma célula (ver Rogers et al.55 para protocolo de descorionação). Alternativamente, os embriões podem ser descorionados manualmente após a fixação, mas isso é mais complicado do que descorionar com pronase.
- Utilizar pipetas de vidro flamejado para manusear embriões descorionados (passo 3.1.10). Tome cuidado para não expor embriões descorionados ao ar ou plástico, o que fará com que os embriões lisem. Manuseie embriões descorionados suavemente.
- Preparar um prato extra de embriões não injectados como proxy para avaliar a progressão de fase (ver passo 4.3.5). Certifique-se de que os embriões substitutos sejam do mesmo conjunto de embriões experimentais, de modo que todos os embriões foram fertilizados ao mesmo tempo dos mesmos pais. Isso é útil para o ensaio de imunofluorescência, onde o estágio é relevante, mas é desnecessário para o ensaio de fenotipagem.
- Utilizar as seguintes condições para os ensaios de fenotipagem e imunofluorescência: 1) não injetado, não exposto, 2) não injetado, exposto à luz, 3) injetado, não exposto, 4) injetado, exposto à luz. Selecione pelo menos 30 embriões por condição. Para uma saúde ideal do embrião, não incube mais de 30 embriões por poço em uma placa de 6 poços.
- Após a injeção, transfira embriões para placas de Petri marcadas ou placas de 6 poços revestidas com agarose (para embriões descorionados) e incube a 28 °C. Os embriões ainda não são sensíveis à luz. Trate os embriões injetados como se fossem sensíveis à luz após 1,5 horas pós-fertilização (hpf).
4. Experimento de exposição à luz
NOTA: A exposição à luz de ~450 nm com uma irradiância de 45 W/m2 ativa robustamente o bOpto-BMP/Nodal sem fototoxicidade óbvia (para informações sobre o contador de luz, consulte a Tabela de Materiais). O nível de sinalização optogeneticamente ativado pode ser sintonizado pela alteração dos valores de irradiância38. No entanto, a fototoxicidade precisará ser avaliada em irradiâncias mais altas.
- Etapa sensível ao tempo. No estágio de 4 a 16 células, cerca de 1,5 hpf, remover embriões não fertilizados e insalubres. Redistribuir, se necessário, para garantir o mesmo número de embriões em cada poço (não mais de 30).
NOTA: É importante realizar esta etapa em torno do estágio de 4 a 16 células, porque os embriões se tornarão sensíveis à luz à medida que o mRNA injetado for traduzido em proteína. Não observamos evidências de que os embriões sejam significativamente sensíveis à luz antes de 1,5 hpf. Para minimizar a fotoativação inadvertida se avaliar embriões após 1,5 hpf, use luzes vermelhas ou cubra fontes de luz - incluindo estágios de microscópio - com papel de filtro de gel vermelho que bloqueia comprimentos de onda azuis dimerizantes de LOV (Tabela de Materiais).- Avaliar embriões de forma consistente para garantir distribuições imparciais entre condições e experimentos.
- Para o ensaio de fenotipagem, use o seguinte protocolo de exposição à luz de 1 dia a partir de 1,5 hpf (Figura 3A).
- Embrulhe a placa de controle não exposta em papel alumínio. Esta placa deve incluir embriões não injetados e injetados. Certifique-se de que o prato está totalmente coberto e tome cuidado para não introduzir lágrimas no papel alumínio. Coloque esta placa na prateleira inferior da caixa luminosa de 28 °C (figura 2A).
- Coloque a placa exposta na prateleira superior da caixa luminosa a 28 °C (figura 2A). Certifique-se de que a cobertura esteja sobre o prato para evitar a evaporação do meio embrionário. Ligue a luz azul (uma irradiância de 45 W/m2 ativa robustamente a sinalização).
- Feche a porta da caixa de luz para evitar a exposição inadvertida à luz ambiente. Se desejar, inclua um termômetro de cartão de memória dentro da caixa de luz antes de fechar a porta. Não abra a porta até que o fenótipo seja pontuado 1 dia após a fertilização (dpf; ver passo 5.1).
- Para o ensaio de imunofluorescência, expor os embriões à luz azul por 20 min iniciando em torno de 40% epibólico56 (~6 hpf) e fixar imediatamente após a exposição à luz, juntamente com os controles não expostos (Figura 3B). Uma exposição de 20 min à luz azul a 40% de epibólio ativa a sinalização de forma reprodutível.
- Cerca de 1,5 hpf, envolva separadamente os pratos expostos e não expostos em papel alumínio. Certifique-se de que os pratos estão totalmente cobertos e tome cuidado para não introduzir lágrimas no papel alumínio. Deixe o prato de procuração desembrulhado. Coloque os pratos embrulhados e o prato de substituição desembrulhado na caixa de luz a 28 °C (Figura 2A). Não ligue o LED ainda.
- Se testar mais de uma quantidade de mRNA, para a condição não exposta, classifique os embriões injetados com quantidades diferentes em placas individuais de 6 poços revestidas de agarose, o que ajudará a minimizar a exposição inadvertida à luz durante a fixação subsequente.
- Feche a porta da caixa de luz para evitar a exposição inadvertida à luz ambiente.
- Diluir o estoque de formaldeído a 4% em solução salina tamponada com fosfato (PBS) e alicitar 1 mL em tubos de microcentrífuga de fundo redondo pré-marcados de 2 mL, um tubo por condição. Conservar a 4 °C.
- Em torno de 5 hpf, remova a placa substituta contendo embriões não injetados e avalie o estágio de desenvolvimento usando um escopo dissecante. O estágio dos embriões substitutos deve refletir o estágio dos embriões sensíveis à luz nos pratos embrulhados.
- Retire também os pratos embrulhados, para que todos os pratos experimentem a mesma temperatura. Repita até que os embriões substitutos tenham atingido 40% de epibólio (~6 hpf). A progressão da embriogênese é sensível à temperatura54; Portanto, quanto mais tempo as placas estiverem fora da incubadora, mais tempo levará para que os embriões atinjam 40% de epibolia.
- Uma vez que os embriões substitutos tenham atingido 40% de epibolia, desembrulhe a placa exposta e coloque-a na prateleira superior da caixa de luz (Figura 2A). Deixe o(s) prato(s) não exposto(s) embrulhado(s) e coloque na prateleira inferior. Acenda imediatamente a luz azul, feche a porta e ajuste um temporizador para 20 min (uma irradiância de 45 W/m2 ativa robustamente a sinalização).
- Para se preparar para a fixação, elimine o máximo de luz ambiente possível (feche as persianas, apague as luzes aéreas, desligue as telas, etc.). Certifique-se de que os tubos contendo formaldeído estão devidamente rotulados. Imediatamente antes da fixação, retire os tubos contendo formaldeído a 4 °C e coloque ao lado da caixa de luz.
- Passo sensível ao tempo e à luz. Esteja preparado para se mover rapidamente no final dos 20 minutos de exposição à luz. Após 20 min, abra a porta da caixa de luz e retire o prato não exposto.
- Use uma ponta de pipeta de vidro flamejada para transferir embriões sensíveis à luz de forma rápida, mas suave, para o tubo correspondente preparado de formaldeído a 4%.
- Minimizar o tempo de transferência (<45 s) de embriões sensíveis à luz para evitar a exposição inadvertida à luz. Certifique-se de que não há bolhas de ar na pipeta. A exposição ao ar destruirá embriões descorionados.
- Para ejetar embriões em formaldeído, submerja a ponta da pipeta de vidro no formaldeído e deixe os embriões afundarem no líquido. Minimizar a quantidade de meio embrionário que é transferido para o formaldeído, mantendo os embriões no final da ponta.
- Depois que os embriões forem transferidos, devolva a pipeta para o mesmo poço e pipete para cima e para baixo para desalojar os embriões presos. Isso evita que embriões de várias condições acabem acidentalmente em uma trompa.
- Repetir imediatamente os passos 4.3.11-4.3.13 para os embriões não expostos e não injectados, seguidos dos embriões expostos (injectados e não injectados).
- Armazenar embriões fixos a 4 °C durante a noite.
5. Avaliação do experimento
- Pontuação fenotípica e exames de imagem
- A 1 dpf, idealmente entre 24-32 hpf, remova embriões da caixa de luz para avaliar fenótipos usando um escopo dissecante e crie uma rubrica de pontuação. Este é o desfecho experimental; a fotoativação inadvertida não é mais uma preocupação.
- Escore embriões ainda no córion para facilidade. Use uma pipeta ou sonda para mover embriões, a fim de ver de vários ângulos.
- Embriões com excesso de sinalização BMP serão ventralizados com diferentes graus de severidade, como descrito em detalhes em Kishimoto et al. 199746 (Figura 4A, painel esquerdo). Embriões com excesso de sinalização nodal apresentarão uma série de defeitos de desenvolvimento relacionados ao excesso de mesendoderma (Figura 4A, painel direito)1,3,47,57,58,59,60. Eles muitas vezes terão lisado por 1 dpf.
- Pontuar cada embrião em todas as condições (Figura 4B). Adquira uma imagem geral de todos os embriões em cada poço. Se desejado, descorionar e imagear embriões representativos individuais em metilcelulose (Figura 4A).
- Coloração por imunofluorescência e exames de imagem
- Depois de incubar os embriões em formaldeído a 4% a 4 °C durante a noite, remova o formaldeído e lave 3-5x com solução salina tamponada com fosfato 1x com Tween20 (PBST). Retire o PBST e adicione 100% de metanol.
- Feche os tubos e inverta-os suavemente para misturar PBST residual e metanol. Lavar 2x com metanol e conservar a -20 °C durante, pelo menos, 2 h até anos.
- Para o protocolo de imunofluorescência pSmad1/5/9 (BMP), ver Rogers et al.38. Para o protocolo de imunofluorescência pSmad2/3 (nodal), ver van Boxtel et al.17 e Rogers et al.47.
- Imagem de embriões imunomarcados, usando um microscópio capaz de seccionamento óptico (por exemplo, um microscópio confocal ou de folha de luz). Evitar a saturação e manter condições de imagem idênticas entre todas as amostras coradas com o mesmo anticorpo.
- Imagem dentro de 5 dias após completar a coloração de imunofluorescência, porque a fluorescência pode desaparecer com o tempo.
Representative Results
O objetivo dos dois experimentos de controle aqui descritos é determinar se o bOpto-BMP/Nodal ativa suas respectivas vias em resposta à exposição à luz azul sem afetar a sinalização na ausência de luz, como esperado. Use esses controles para estabelecer o fluxo de trabalho experimental apropriado em seu laboratório antes de aplicar o bOpto-BMP/Nodal às suas perguntas de pesquisa de interesse.
O ensaio de fenotipagem pode ser concluído em apenas 2 dias e fornece uma indicação útil de atividade de sinalização e fototoxicidade (Figura 3A). Embriões injetados expostos à luz azul devem fenocopiar o excesso de sinalização de BMP (ventralização46; Figura 4A, painel esquerdo) ou sinalização nodal (defeitos de desenvolvimento relacionados ao mesendoderma extra-1,3,47,57,58,59,60 (Figura 4A, painel direito)). Se injetados, os embriões expostos à luz são afentípicos, testam a qualidade do RNAm e consideram injetar mais, e verificam novamente a estratégia de exposição à luz para garantir a exposição constante à luz brilhante (~450 nm de luz com uma irradiância de 45 W/m2 deve ativar fortemente a sinalização). Em contraste, embriões injetados e não expostos devem parecer idênticos aos irmãos não injetados. Se injetados, os embriões não expostos exibem fenótipos, reduzem a quantidade de RNAm injetado e reavaliam a configuração experimental para garantir que os embriões não expostos sejam protegidos da exposição à luz. Os dados mostrados na Figura 4B mostram os resultados de experimentos típicos de fenotipagem com quantidades e condições de exposição apropriadas de RNAm: forte atividade de sinalização é evidente em embriões injetados expostos à luz, com apenas uma pequena fração de embriões injetados e não expostos exibindo fenótipos.
O ensaio de fenotipagem também oferece uma oportunidade para avaliar a fototoxicidade. Se a fototoxicidade for negligenciável, os embriões não injectados e expostos à luz devem parecer do tipo selvagem, semelhantes aos embriões não injectados e não expostos. Se embriões não injetados expostos à luz tiverem defeitos, mas não embriões não injetados e não expostos, considere diminuir a irradiância da luz. Uma irradiância de 45 W/m2 ativa robustamente a sinalização sem fototoxicidade óbvia. Os dados apresentados na Figura 4B não mostram diferenças preocupantes entre embriões não injetados, expostos à luz e não injetados, não expostos, indicando fototoxicidade desprezível.
Embora os ensaios de imunofluorescência exijam mais tempo e esforço (~1 semana) em comparação com o ensaio de fenotipagem (2 dias), a coloração de imunofluorescência fornece uma leitura direta da atividade da via de sinalização e pode revelar alterações sutis de sinalização que podem não ser refletidas pela morfologia macroscópica. A imunofluorescência é especialmente importante para avaliar as respostas ao bOpto-Nodal, pois o excesso de sinalização nodal frequentemente resulta em lise de embriões por 1 dpf - o que pode ter várias causas - em contraste com os fenótipos específicos de ventralização característicos do excesso de sinalização BMP46 (Figura 4A). Embriões injetados expostos à luz azul devem exibir um aumento uniforme na fosforilação de Smad1/5/9 ou Smad2/3 em comparação com embriões não injetados expostos à luz. Se os níveis não forem aumentados, ou apenas fracamente aumentados, teste a qualidade do mRNA e considere injetar mais, e verifique novamente a estratégia de exposição à luz. Uma exposição de 20 min à luz azul com uma irradiância de 45 W/m2 em torno de 40% de epibólio deve ativar fortemente a sinalização. Se a coloração pSmad não for uniforme, tente injetar mRNA no centro da célula (em vez da gema), o que pode resultar em uma distribuição de mRNA mais uniforme.
Embriões injetados e não expostos devem ter níveis de pSmad comparáveis aos embriões não injetados. Curiosamente, observamos fosforilação de Smad mais vazada com bOpto-Nodal do que com bOpto-BMP. Se os níveis de pSmad forem aumentados em embriões injetados e não expostos, reduza a quantidade de mRNA injetada. Além disso, reavalie a configuração experimental para garantir que 1) embriões não expostos não sejam inadvertidamente expostos à luz e 2) a exposição à luz durante a fixação seja mínima. Durante a etapa de fixação, é fundamental permitir que não transcorram mais do que 45 s entre a remoção da caixa de luz e a imersão em formaldeído. Além disso, durante essa etapa, minimize a exposição à luz ambiente e à luz solar, fechando persianas, desligando fontes de luz branca, usando luzes vermelhas ou cobrindo fontes de luz branca com papel de filtro de gel bloqueador de luz azul (Tabela de Materiais).
Os dados da Figura 4C mostram os resultados de experimentos típicos de coloração por imunofluorescência com quantidades adequadas de RNAm e condições de exposição à luz: os níveis de pSmad são semelhantes em embriões não injetados e não expostos, enquanto embriões injetados expostos à luz exibem níveis mais altos de fosforilação de Smad.
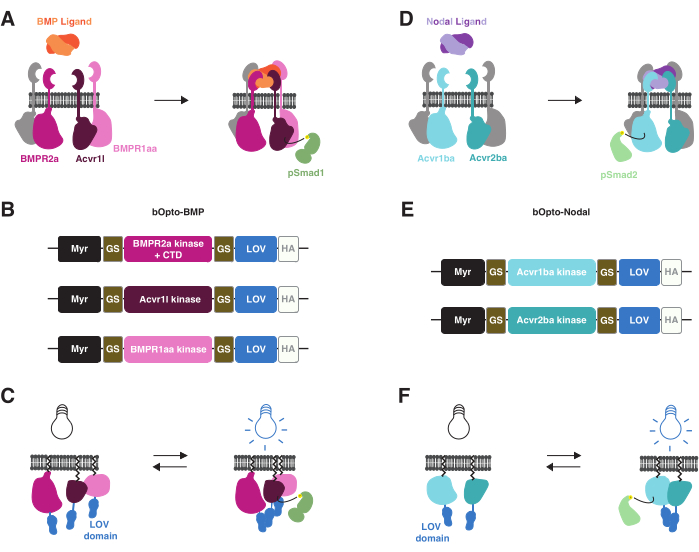
Figura 1: Estratégia de ativação da sinalização bOpto-BMP e -Nodal . (A) A via de sinalização endógena das BMPs é ativada pela ligação dos ligantes BMP, levando à formação de um complexo receptor tipo I/II, fosforilação de Smad1/5/9 e expressão de genes-alvo de BMP. Os receptores tipo I BMPR1aa e Acvr1l também são conhecidos como Alk3 e Alk8, respectivamente. BMPR2a é um receptor tipo II. (B) construtos bOpto-BMP38. Domínios putativos de quinase de BMPR1aa e Acvr1l são fundidos com LOV; a fusão BMPR2a-LOV contém o suposto domínio da quinase e o domínio do receptor C-terminal (CTD). Todas as fusões são direcionadas à membrana com um motivo de miristoilação (Myr). Os domínios são separados por ligantes glicina-serina (GS). As construções são marcadas no CTD com uma etiqueta de epítopo HA. Essa combinação de três construtos foi encontrada para ativar de forma otimizada a sinalização BMP. (C) ativação da sinalização BMP mediada por bOpto-BMP. Quando expostos à luz azul, os domínios LOV dimerizam-se, o que é pensado para desencadear a formação de complexos e ativação de sinalização. (D) A via de sinalização nodal endógena é ativada pela ligação do ligante nodal, levando à formação de um complexo receptor tipo I/II, fosforilação de Smad2/3 e expressão de genes-alvo nodais. O receptor tipo I Acvr1ba e o receptor tipo II Acvr2ba também são conhecidos como Acvr1b e Acvr2b, respectivamente. (E) construções bOpto-Nodal39. Domínios putativos quinases de Acvr1ba e Acvr2ba são fundidos com LOV. Todas as fusões são direcionadas à membrana com um motivo de miristoilação (Myr). Os domínios são separados por vinculadores GS. As construções são marcadas no CTD com uma etiqueta de epítopo HA. (F) ativação da sinalização nodal mediada por bOpto-Nodal. Quando expostos à luz azul, os domínios LOV dimerizam-se, o que é pensado para desencadear a formação de complexos e ativação de sinalização. Clique aqui para ver uma versão maior desta figura.
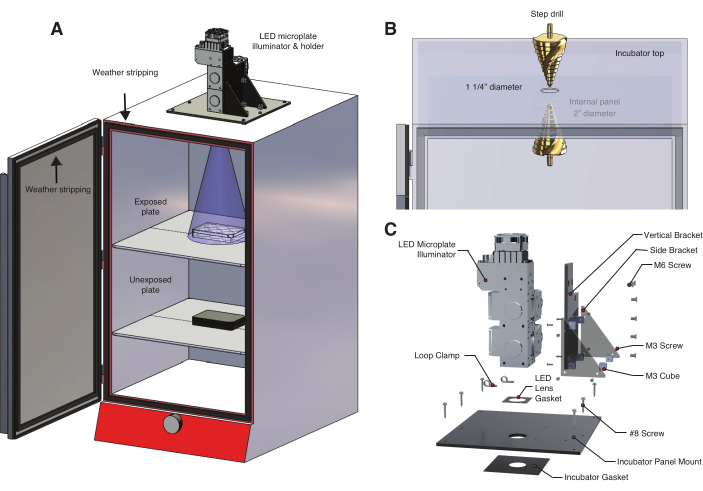
Figura 2: Caixa de luz com temperatura controlada para experimentos optogenéticos . (A) Um iluminador de microplaca LED é montado na parte superior de uma incubadora usando um suporte LED personalizado. Embriões de peixe-zebra em uma placa de 6 poços na primeira prateleira são expostos à luz através de um orifício perfurado no topo da incubadora. A prateleira inferior contém um segundo conjunto de embriões de controle não expostos em uma placa de 6 poços envolta em folha de alumínio. A porta da incubadora é forrada com proteção contra intempéries para evitar a exposição inadvertida à luz ambiente ou à luz solar. (B) Detalhe do procedimento para criar um furo na incubadora usando uma broca step. O modelo de incubadora utilizado aqui possui um painel interno que exigia a perfuração de um segundo furo maior (Tabela de Materiais). (C) Detalhe do suporte LED personalizado projetado para um sistema de iluminação de três comprimentos de onda. Clique aqui para ver uma versão maior desta figura.
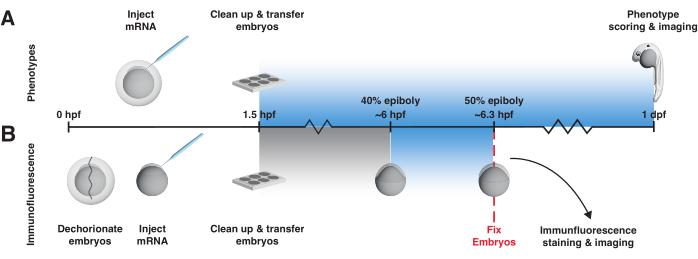
Figura 3: Fluxo de trabalho do experimento bOpto-BMP/Nodal. Ensaio fenotípico e coloração de imunofluorescência pSmad para testar a atividade do bOpto-BMP/Nodal. Os embriões são injetados com mRNA no estágio de uma célula e transferidos para uma caixa de luz no máximo 1,5 h após a fertilização (hpf). (A) Ensaio fenotípico. Embriões injetados e irmãos não injetados são criados no escuro ou expostos à luz azul uniforme a partir de 1,5 hpf até 1 dia pós-fertilização (dpf). A atividade de sinalização optogenética pode ser avaliada pontuando embriões para fenótipos consistentes com excesso de atividade da via. (B) coloração por imunofluorescência pSmad. Embriões injetados e irmãos não injetados são criados no escuro até 40% epibolia (~6 hpf). Metade dos embriões injetados e metade dos embriões não injetados são então expostos à luz azul uniforme por 20 min. Após a exposição, todos os embriões são fixados e submetidos à coloração de imunofluorescência para pSmad. Níveis elevados de pSmad1/5/9 ou pSmad2/3 refletem ativação optogenética da sinalização BMP ou Nodal, respectivamente. Clique aqui para ver uma versão maior desta figura.
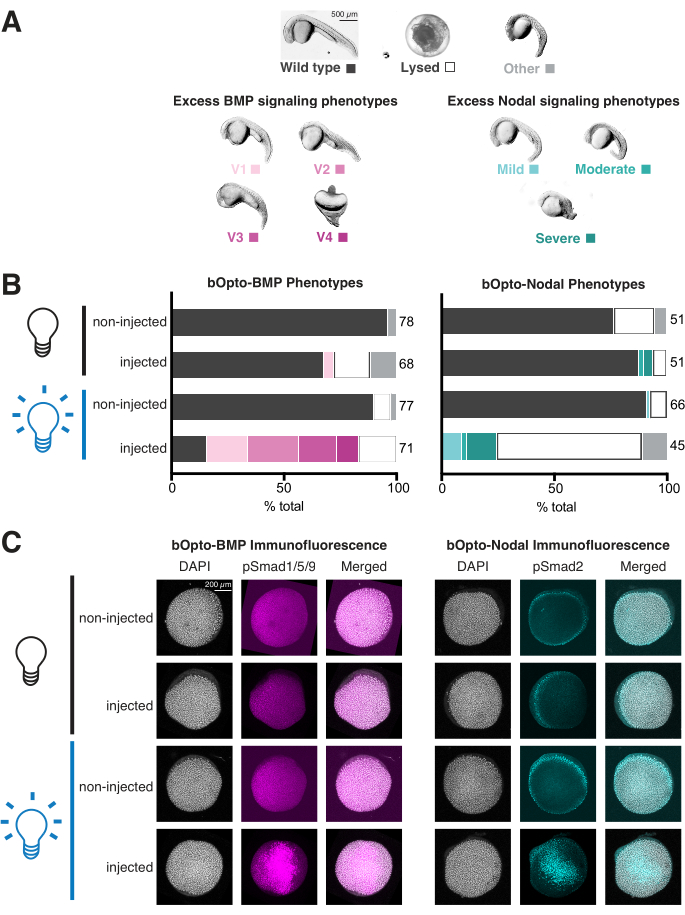
Figura 4: Avaliação das respostas de sinalização ativada pela luz em embriões de peixe-zebra. Embriões de zebrafish foram injetados no estágio unicelular com RNAm codificando bOpto-BMP/Nodal. (A) Os embriões foram criados no escuro ou expostos à luz azul uniforme a partir de 1,5 h após a fecundação (hpf). Os fenótipos foram pontuados no 1º dia pós-fertilização (dpf). Fenótipos representativos são mostrados. O excesso de sinalização BMP leva à ventralização (painel esquerdo), enquanto o excesso de sinalização nodal causa defeitos de desenvolvimento associados ao mesendoderma extra (painel direito). Barra de escala = 500 μm. (B) Quantificação do fenótipo. Embriões injetados e irmãos não injetados foram criados no escuro a partir de 1,5 hpf (bulbo preto). Metade dos embriões injetados e metade dos não injetados foram expostos à luz azul uniforme (bulbo azul). (C) Embriões injetados e irmãos não injetados foram criados no escuro a partir de 1,5 hpf (bulbo preto). A 40% de epibolia (~6 hpf), metade dos embriões injetados e metade dos não injetados foram expostos à luz azul uniforme (lâmpada azul). Após 20 min, todos os embriões foram fixados e submetidos à coloração de imunofluorescência para Smad1/5/9 fosforilado ou Smad2/3. Intensidades de pSmad mais altas indicam aumento da sinalização BMP/Nodal, respectivamente. Barra de escala = 200 μm. Clique aqui para ver uma versão maior desta figura.
Arquivo Suplementar 1: Montagem completa da caixa de luz. Arquivo PDF 3D mostrando uma visualização 3D do conjunto completo da caixa de luz. Clique aqui para baixar este arquivo.
Arquivo suplementar 2: Caixa de luz explodiu vista. Arquivo PDF 3D mostrando uma visão 3D do conjunto da caixa de luz explodida. Clique aqui para baixar este arquivo.
Arquivo Suplementar 3: Grande junta leve. Arquivo de desenho CAD (. DWG) para fabricar a grande junta de luz para o suporte de LED usando um cortador a laser. Clique aqui para baixar este arquivo.
Arquivo Suplementar 4: Junta leve pequena. Arquivo de desenho CAD (. DWG) para fabricar a pequena junta de luz para o suporte LED usando um cortador a laser. Clique aqui para baixar este arquivo.
Arquivo Suplementar 5: Base de plataforma acrílica. Arquivo de desenho CAD (. DWG) para fabricar a base da plataforma acrílica do suporte LED usando um cortador a laser. Clique aqui para baixar este arquivo.
Arquivo Suplementar 6: Plataforma de acrílico vertical. Arquivo de desenho CAD (. DWG) para fabricar a plataforma de acrílico do suporte de LED vertical usando um cortador a laser. Clique aqui para baixar este arquivo.
Arquivo Suplementar 7: Suporte de acrílico esquerdo. Arquivo de desenho CAD (. DWG) para fabricar o suporte esquerdo de acrílico do suporte LED usando um cortador a laser. Clique aqui para baixar este arquivo.
Arquivo Suplementar 8: Direito de suporte acrílico. Arquivo de desenho CAD (. DWG) para fabricar o suporte direito de acrílico do suporte LED usando um cortador a laser. Clique aqui para baixar este arquivo.
Discussion
A injeção de mRNA é a estratégia atual para entregar bOpto-BMP/Nodal a embriões de zebrafish. Este método tem várias desvantagens. Primeiro, a quantidade apropriada de mRNA varia entre os laboratórios. A quantidade utilizada deve ser suficiente para ativar a sinalização de forma robusta com exposição à luz, mas sem ativação inadvertida do escuro. É uma boa ideia testar várias quantidades para encontrar níveis ideais de mRNA e, uma vez estabelecidos, criar alíquotas de uma mistura mestre para introduzir reproduticamente a mesma quantidade de mRNA. Em segundo lugar, a distribuição desigual do RNAm injetado pode levar à ativação desigual da sinalização. Acredita-se que injetar no centro da célula (não na gema) promova até mesmo a distribuição de mRNA. Finalmente, como o mRNA injetado se degrada com o tempo, essa abordagem pode não ser adequada para experimentos em embriões mais velhos. No futuro, esses problemas poderão ser resolvidos por linhagens de zebrafish transgênicos expressando de forma ubíqua bOpto-BMP/Nodal com um promotor materno ou induzível por drogas. Embora trabalhar com zebrafish adultos potencialmente sensíveis à luz possa ser um desafio neste contexto, os peixes-zebra 61,62 e Drosophila 22,34,35,63 transgênicos que abrigam ferramentas optogenéticas foram desenvolvidos com sucesso.
Evitar a fotoativação inadvertida é um desafio geral com ferramentas optogenéticas. Para simplificar, trate embriões injetados com mais de 1,5 hpf como sensíveis à luz. A exposição inadvertida à luz muitas vezes pode ser evitada simplesmente embrulhando pratos ou pratos com papel alumínio. No entanto, para experimentos que requerem observação visual de embriões vivos com mais de 1,5 hpf, é possível usar fontes de luz vermelha ou cobrir fontes de luz branca com papel de filtro de gel barato que bloqueia comprimentos de onda dimerizantes de LOV (Tabela de Materiais).
A caixa de luz descrita aqui é projetada para aplicações específicas que exigem controle preciso sobre os níveis de irradiância, dinâmica e comprimentos de onda da luz (Figura 2). Outros benefícios desta caixa de luz incluem exposição uniforme à luz, aquecimento inadvertido inadvertido da amostra, amplo espaço para múltiplas placas de 6 poços e fontes de luz de longa duração e espectralmente bem caracterizadas. No entanto, diferentes estratégias de exposição à luz podem ser preferíveis dependendo da aplicação da pesquisa. Muitos laboratórios desenvolveram sistemas de exposição à luz uniformes mais simples e econômicos com pegadas menores, incluindo incubadoras de revestimento com fitas de LED, suspensão de painéis de LED sobre amostras ou incorporação de LEDs em tampas de placas de cultura 32,38,39,40,64,65,66. É importante ressaltar que a caixa de luz usada neste protocolo não permite que os usuários regulem poços individuais de forma independente (em contraste com Bugaj et al.52) ou forneçam controle espacial sobre a exposição à luz. A ativação optogenética espacialmente localizada foi demonstrada com bOpto-BMP38 e bOpto-Nodal39 usando lasers em SPIM ou sistemas confocais, respectivamente, e também foi realizada com muitas outras estratégias optogenéticas em uma variedade de sistemas modelo (discutido em Rogers e Müller12). Algumas abordagens até alcançaram resolução espacial subcelular 29,30,31. Embora a implementação de sistemas de exposição à luz espacialmente localizados esteja fora do escopo deste protocolo, experimentos de ativação espacial com bOpto-BMP/Nodal são teoricamente possíveis com equipamentos especializados, como dispositivos de microespelho digital ou abordagens de mascaramento. Os leitores são encorajados a explorar a extensa literatura sobre caixas de luz DIY para experimentos optogenéticos antes de se comprometerem com uma estratégia de exposição à luz (ver, por exemplo, Gerhardt et al.51, Bugaj et al.52, Kumar e Khammash 53 e mais em https://www.optobase.org/materials/).
Estratégias optogenéticas moleculares frequentemente oferecem um maior grau de controle espaço-temporal sobre processos biológicos em comparação com abordagens históricas, como mutantes, expressão gênica ectópica, proteínas recombinantes e drogas. Os leitores interessados nos benefícios das abordagens optogenéticas podem explorar outras ferramentas publicadas disponíveis em peixes-zebra e outros organismos. Estes incluem ferramentas para manipular vias de sinalização adicionais 32,65,67,68, regular a expressão gênica 61,64,66,69,70,71, alterar a localização de proteínas 31,72 e ativar a apoptose 62. Essas ferramentas e muitas outras estão convenientemente catalogadas no OptoBase, um recurso web com curadoria para abordagens de optogenética molecular28. Para aqueles inspirados a criar novas ferramentas optogenéticas, o recurso também apresenta descrições úteis de proteínas responsivas à luz que foram empregadas em uma ampla gama de estratégias, incluindo proteínas responsivas à luz que respondem a comprimentos de onda verde, vermelho e infravermelho próximo. Estamos entusiasmados para que a comunidade científica perceba todo o potencial das abordagens optogenéticas moleculares.
Disclosures
Os autores não têm nada a revelar.
Acknowledgements
O financiamento para este protocolo foi fornecido pelo Programa Intramural do NICHD para KWR (ZIA HD009002-01). Agradecemos a Jeff Farrell e seu laboratório por seu feedback esclarecedor, a Will Anderson por excelente suporte técnico, a Leanne Iannucci por testar o protocolo e medir a irradiância, e às instalações do NIH Shared Zebrafish por seu trabalho árduo mantendo o peixe-zebra saudável.
Materials
| Name | Company | Catalog Number | Comments |
| Building a light box & Light exposure protocol | |||
| #8 x 1" Hex Self-drilling Screw | McMaster-Carr | 99663A222 | 1.4.5 |
| Digital Optical Power and Energy Meter | ThorLabs | PM100D | 1.7 4 |
| Incubator (142 liters) | Boekel Scientific | 139400 | 1.3.1 |
| Incubator Panel Mount (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Incubator_panel | 1.4.4 |
| Large HSS Spiral Groove Step Drill Bit | CO-Z | SDB0001TA | 1.3.2 |
| LED lens gasket, Incubator gasket; 1/32" thick black silicone | McMaster-Carr | 5812T12 | 1.4.3 1.4.4 |
| LED microplate illuminator | Prizmatix | NA | 1.1 1.4.3 |
| M3 10mm Cube Standoff | Newark Eletronics | 005.60.533 | 1.4.1 |
| M3 x 10mm 316SS Flat Head Screw | McMaster-Carr | 91801A156 | 1.4.1 |
| M6 x 10mm 316SS Flat Head Screw | McMaster-Carr | 91801A305 | 1.4.3 |
| Memory card thermometer | Fisherbrand | 15-081-111 | 1.9 3.2.1 |
| Microscope Slide Power Meter Sensor Head (150 mW) | ThorLabs | S170C | 1.7 4 |
| Red gel filter paper #E106 | Rosco / B&H Foto & Electronics | 110084014805-E106 | 4.2.1 |
| Side Brackets (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Side_bracket | 1.4.2 |
| Vertical Bracket (1/4" thick cast black acrylic) | Custom part / Piedmont Plastics | Vertical_bracket | 1.4.1 |
| Weather stripping: Light duty EPDM foam, 1/2" wd 1/4" tk | McMaster-Carr | 8694K12 | 1.8 |
| Generating mRNA | |||
| EZNA MicroElute Cycle Pure Kit | Omega | D6293-02 | 2.4 |
| GeneJET Miniprep Kit (250 rxns) | Thermo Scientific | K0503 | 2.2 |
| Microsample incubator (Hybex) | SciGene | 1057-30-0 | 2 |
| Microsample incubator 1.5 ml tube block (Hybex) | SciGene | 1057-34-0 | 2 |
| Nanodrop One Spectrophotometer | Thermo Scientific | ND-ONE-W | 2.4 |
| NotI-HF restriction enzyme | New England Biolabs (NEB) | R3189L | 2.1 |
| pCS2-Opto-Alk3 | Addgene | 207614 | 2 |
| pCS2-Opto-Alk8 | Addgene | 207615 | 2 |
| pCS2-Opto-BMPR2a | Addgene | 207616 | 2 |
| RNeasy Mini Kit (250 rxns) | Qiagen | 74106 | 2.3 |
| Injecting mRNA | |||
| Agarose (UltraPure) | Invitrogen / Thermo Fisher | 16500500 | 3.1.1 |
| 250 ml glass beakers | Fisherbrand | FB100250 | 3.3.2 |
| 6-well dishes (case of 50) | Falcon | 08 772 1B | 3.1.6 |
| B-8A ball joint | Narishige | B-8A | 3.3 |
| Back pressure unit (microinjection rig component) | Applied Scientific Instrumentation (ASI) | BPU | 3.3 |
| Foot switch (microinjection rig component) | Applied Scientific Instrumentation (ASI) | FWS | 3.3 |
| GJ-1 magnetic stand | Narishige | GJ-1 | 3.3 |
| Glass capillaries (4 in, OD 1 mm, filament) | World Precision Instruments | 1B100F-4 | 3.1.11 |
| Glass petri dish bottoms (for dechorionating) | Pyrex | 08-748A | 3.3.2 |
| Glass pipettes (5 3/4" with wide tip) | Kimble-Chase | 63A53WT | 3.1.9 |
| Injection dish molds | Adaptive Science Tools | tu1 | 3.1.3 |
| IP iron plate | Narishige | IP | 3.3 |
| M-152 micromanipulator | Narishige | M-152 | 3.3 |
| Micro pipette holder kit (microinjection rig component) | Applied Scientific Instrumentation (ASI) | MIMPH-MPIP-Kit | 3.3 |
| Micrometers | Meiji Techno America | MA285 | 3.3 |
| MPPI-2 pressure injector (microinjection rig component) | Applied Scientific Instrumentation (ASI) | MPPI-3 | 3.3 |
| Needle puller | World Precision Instruments | PUL-1000 | 3.1.11 |
| Petri dishes (100 mm x 15 mm, case of 500) | Falcon | 08-757-100D | 3.1.2 |
| Pipettor (10 ml, green) | Bel-Art | F37898-0000 | 3.3 |
| Pronase | Roche | 11459643001 | 3.3.2 |
| Squeeze bottles (500 ml) | Nalgene / Thermo Scientific | 2402-0500 | 3.3 |
References
- Jones, W. D., Mullins, M. C. Cell signaling pathways controlling an axis organizing center in the zebrafish. Current Topics in Developmental Biology. 150, 149-209 (2022).
- Hill, C. S. Establishment and interpretation of NODAL and BMP signaling gradients in early vertebrate development. Current Topics in Developmental Biology. 149, 311-340 (2022).
- Zinski, J., Tajer, B., Mullins, M. C. TGF-β Family Signaling in Early Vertebrate Development. Cold Spring Harbor Perspectives in Biology. 10 (6), a033274 (2018).
- Shore, E. M., Kaplan, F. S. Inherited human diseases of heterotopic bone formation. Nature Reviews. Rheumatology. 6 (9), 518-527 (2010).
- Hebron, K. E., Hernandez, E. R., Yohe, M. E. The RASopathies: from pathogenetics to therapeutics. Disease Models & Mechanisms. 15 (2), dmm049107 (2022).
- Grant, M. G., Patterson, V. L., Grimes, D. T., Burdine, R. D. Modeling Syndromic Congenital Heart Defects in Zebrafish. Current Topics in Developmental Biology. 124, 1-40 (2017).
- Nusse, R., Clevers, H. Wnt/beta-Catenin Signaling, Disease, and Emerging Therapeutic Modalities. Cell. 169 (6), 985-999 (2017).
- Farahani, P. E., Reed, E. H., Underhill, E. J., Aoki, K., Toettcher, J. E. Signaling, Deconstructed: Using Optogenetics to Dissect and Direct Information Flow in Biological Systems. Annual Review of Biomedical Engineering. 23, 61-87 (2021).
- Purvis, J. E., Lahav, G. Encoding and decoding cellular information through signaling dynamics. Cell. 152 (5), 945-956 (2013).
- Wibisana, J. N., Okada, M. Encoding and decoding NF-kappaB nuclear dynamics. Current Opinion in Cell Biology. 77, 102103 (2022).
- Friedel, L., Loewer, A. The guardian's choice: how p53 enables context-specific decision-making in individual cells. TheFEBS Journal. 289 (1), 40-52 (2022).
- Rogers, K. W., Müller, P. Optogenetic approaches to investigate spatiotemporal signaling during development. Current Topics in Developmental Biology. 137, 37-77 (2020).
- Johnson, H. E., Toettcher, J. E. Illuminating developmental biology with cellular optogenetics. Current Opinion in Biotechnology. 52, 42-48 (2018).
- Bosman, S. L., Sonnen, K. F. Signaling oscillations in embryonic development. Current Topics in Developmental Biology. 149, 341-372 (2022).
- Li, P., Elowitz, M. B. Communication codes in developmental signaling pathways. Development. 146 (12), dev170977 (2019).
- Tucker, J. A., Mintzer, K. A., Mullins, M. C. The BMP signaling gradient patterns dorsoventral tissues in a temporally progressive manner along the anteroposterior axis. Developmental Cell. 14 (1), 108-119 (2008).
- van Boxtel, A. L., et al. A temporal window for signal activation dictates the dimensions of a Nodal signaling domain. Developmental Cell. 35 (2), 175-185 (2015).
- Sorre, B., Warmflash, A., Brivanlou, A. H., Siggia, E. D. Encoding of temporal signals by the TGF-β pathway and implications for embryonic patterning. Developmental Cell. 30 (3), 334-342 (2014).
- Economou, A. D., Hill, C. S. Temporal dynamics in the formation and interpretation of Nodal and BMP morphogen gradients. Current Topics in Developmental Biology. 137, 363-389 (2020).
- Rogers, K. W., Schier, A. F. Morphogen gradients: from generation to interpretation. Annual Review of Cell and Developmental Biology. 27, 377-407 (2011).
- Barkai, N., Shilo, B. Z. Robust generation and decoding of morphogen gradients. Cold Spring Harbor Perspectives in Biology. 1 (5), a001990 (2009).
- Johnson, H. E., Djabrayan, N. J. V., Shvartsman, S. Y., Toettcher, J. E. Optogenetic Rescue of a Patterning Mutant. Current Biology. 30 (17), 3414-3424 (2020).
- Imayoshi, I., et al. Oscillatory control of factors determining multipotency and fate in mouse neural progenitors. Science. 342 (6163), 1203-1208 (2013).
- Lin, B., et al. Synthetic spatially graded Rac activation drives cell polarization and movement. Proceedings of the National Academy of Sciences of the United States of America. 109 (52), E3668-E3677 (2012).
- Cui, K. W., et al. Spatially controlled stem cell differentiation via morphogen gradients: A comparison of static and dynamic microfluidic platforms. Journal of Vacuum Science & Technology. A, Vaccum, Surfaces, and Films. 38 (3), 033205 (2020).
- Faden, F., Mielke, S., Lange, D., Dissmeyer, N. Generic tools for conditionally altering protein abundance and phenotypes on demand. Biological Chemistry. 395 (7-8), 737-762 (2014).
- Shoji, W., Sato-Maeda, M. Application of heat shock promoter in transgenic zebrafish. Development, Growth & Differentiation. 50 (6), 401-406 (2008).
- Kolar, K., Knobloch, C., Stork, H., Znidaric, M., Weber, W. OptoBase: A web platform for molecular optogenetics. ACS Synthetic Biology. 7 (7), 1825-1828 (2018).
- Benedetti, L., et al. Light-activated protein interaction with high spatial subcellular confinement. Proceedings of the National Academy of Sciences of the United States of America. 115 (10), E2238-E2245 (2018).
- Krueger, D., De Renzis, S. Optogenetic Methods to Control Tissue Mechanics in Drosophila. Methods in Molecular Biology. 2540, 269-283 (2022).
- Buckley, C. E. Optogenetic Control of Subcellular Protein Location and Signaling in Vertebrate Embryos. Methods in Molecular Biology. 1920, 143-162 (2019).
- Čapek, D., et al. Light-activated Frizzled7 reveals a permissive role of non-canonical wnt signaling in mesendoderm cell migration. Elife. 8, e42093 (2019).
- Krishnamurthy, V. V., et al. Reversible optogenetic control of kinase activity during differentiation and embryonic development. Development. 143 (21), 4085-4094 (2016).
- Huang, A., Amourda, C., Zhang, S., Tolwinski, N. S., Saunders, T. E. Decoding temporal interpretation of the morphogen Bicoid in the early Drosophila embryo. Elife. 6, e26258 (2017).
- Johnson, H. E., Toettcher, J. E. Signaling dynamics control cell fate in the early Drosophila embryo. Developmental Cell. 48 (3), 361.e3-370.e3 (2019).
- Aoki, K., et al. Stochastic ERK activation induced by noise and cell-to-cell propagation regulates cell density-dependent proliferation. Molecular Cell. 52 (4), 529-540 (2013).
- Chow, R. W., Vermot, J. The rise of photoresponsive protein technologies applications in vivo: a spotlight on zebrafish developmental and cell biology. F1000Research. , (2017).
- Rogers, K. W., ElGamacy, M., Jordan, B. M., Müller, P. Optogenetic investigation of BMP target gene expression diversity. Elife. 9, e58641 (2020).
- Sako, K., et al. Optogenetic control of Nodal signaling reveals a temporal pattern of Nodal signaling regulating cell fate specification during gastrulation. Cell Reports. 16 (3), 866-877 (2016).
- Grusch, M., et al. Spatio-temporally precise activation of engineered receptor tyrosine kinases by light. The EMBO Journal. 33 (15), 1713-1726 (2014).
- Crossman, S. H., Janovjak, H. Light-activated receptor tyrosine kinases: Designs and applications. Current Opinion in Pharmacology. 63, 102197 (2022).
- Kainrath, S., Janovjak, H. Design and Application of Light-Regulated Receptor Tyrosine Kinases. Methods in Molecular Biology. 2173, 233-246 (2020).
- Takahashi, F., et al. AUREOCHROME, a photoreceptor required for photomorphogenesis in stramenopiles. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19625-19630 (2007).
- Toyooka, T., Hisatomi, O., Takahashi, F., Kataoka, H., Terazima, M. Photoreactions of aureochrome-1. Biophysical Journal. 100 (11), 2801-2809 (2011).
- Vopalensky, P., Pralow, S., Vastenhouw, N. L. Reduced expression of the Nodal co-receptor Oep causes loss of mesendodermal competence in zebrafish. Development. 145 (5), dev.158832 (2018).
- Kishimoto, Y., Lee, K. H., Zon, L., Hammerschmidt, M., Schulte-Merker, S. The molecular nature of zebrafish swirl: BMP2 function is essential during early dorsoventral patterning. Development. 124 (22), 4457-4466 (1997).
- Rogers, K. W., et al. Nodal patterning without Lefty inhibitory feedback is functional but fragile. Elife. 6, e28785 (2017).
- Dubrulle, J., et al. Response to Nodal morphogen gradient is determined by the kinetics of target gene induction. Elife. 4, e05042 (2015).
- Harvey, S. A., Smith, J. C. Visualisation and quantification of morphogen gradient formation in the zebrafish. PLoS Biology. 7 (5), e1000101 (2009).
- Zinski, J., Tuazon, F., Huang, Y., Mullins, M., Umulis, D. Imaging and Quantification of P-Smad1/5 in Zebrafish Blastula and Gastrula Embryos. Methods in Molecular Biology. 1891, 135-154 (2019).
- Gerhardt, K. P., Castillo-Hair, S. M., Tabor, J. J. DIY optogenetics: Building, programming, and using the Light Plate Apparatus. Methods in Enzymology. 624, 197-226 (2019).
- Bugaj, L. J., Lim, W. A. High-throughput multicolor optogenetics in microwell plates. Nature Protocols. 14 (7), 2205-2228 (2019).
- Kumar, S., Khammash, M. Platforms for Optogenetic Stimulation and Feedback Control. Frontiers in Bioengineering and Biotechnology. 10, 918917 (2022).
- Urushibata, H., et al. Control of Developmental Speed in Zebrafish Embryos Using Different Incubation Temperatures. Zebrafish. 18 (5), 316-325 (2021).
- Rogers, K. W., Bläßle, A., Schier, A. F., Müller, P. Measuring protein stability in living zebrafish embryos using fluorescence decay after photoconversion (FDAP). Journal of Visualized Experiments. (95), e52266 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Feldman, B., et al. Zebrafish organizer development and germ-layer formation require nodal-related signals. Nature. 395 (6698), 181-185 (1998).
- Shimizu, T., et al. Cooperative roles of Bozozok/Dharma and Nodal-related proteins in the formation of the dorsal organizer in zebrafish. Mechanisms of Development. 91 (1-2), 293-303 (2000).
- Rebagliati, M. R., Toyama, R., Fricke, C., Haffter, P., Dawid, I. B. Zebrafish nodal-related genes are implicated in axial patterning and establishing left-right asymmetry. Developmental Biology. 199 (2), 261-272 (1998).
- Gritsman, K., Talbot, W. S., Schier, A. F. Nodal signaling patterns the organizer. Development. 127 (5), 921-932 (2000).
- LaBelle, J., et al. TAEL 2.0: An Improved Optogenetic Expression System for Zebrafish. Zebrafish. 18 (1), 20-28 (2021).
- Mruk, K., Ciepla, P., Piza, P. A., Alnaqib, M. A., Chen, J. K. Targeted cell ablation in zebrafish using optogenetic transcriptional control. Development. 147 (12), dev183640 (2020).
- Johnson, H. E., et al. The spatiotemporal limits of developmental Erk signaling. Developmental Cell. 40 (2), 185-192 (2017).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Patel, A. L., et al. Optimizing photoswitchable MEK. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25756-25763 (2019).
- LaBelle, J., Woo, S. Light-Induced GFP Expression in Zebrafish Embryos using the Optogenetic TAEL/C120 System. Journal of Visualized Experiments. (174), e62818 (2021).
- Kainrath, S., Stadler, M., Reichhart, E., Distel, M., Janovjak, H. Green-light-induced inactivation of receptor signaling using cobalamin-binding domains. Angewandte Chemie. 56 (16), 4608-4611 (2017).
- Benman, W., et al. Temperature-responsive optogenetic probes of cell signaling. Nat Chem Biol. 18 (2), 152-160 (2022).
- Reade, A., et al. TAEL: a zebrafish-optimized optogenetic gene expression system with fine spatial and temporal control. Development. 144 (2), 345-355 (2017).
- Putri, R. R., Chen, L. Spatiotemporal control of zebrafish (Danio rerio) gene expression using a light-activated CRISPR activation system. Gene. 677, 273-279 (2018).
- Liu, H., Gomez, G., Lin, S., Lin, S., Lin, C. Optogenetic control of transcription in zebrafish. PLoS One. 7 (11), e50738 (2012).
- Buckley, C. E., et al. Reversible optogenetic control of subcellular protein localization in a live vertebrate embryo. Developmental Cell. 36 (1), 117-126 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved