בידוד סימולטני של סוגי תאים עיקריים תושבי מערכת העצבים המרכזית מעכברים אוטואימוניים בוגרים
* These authors contributed equally
In This Article
Summary
נכון להיום, פרוטוקולים לבידוד סימולטני של כל סוגי התאים העיקריים השוכנים במערכת העצבים המרכזית מאותו עכבר הם דרישה שלא נענתה. הפרוטוקול מראה הליך ישים בעכברים אוטואימוניים נאיביים וניסיוניים של אנצפלומיאליטיס לחקור רשתות סלולריות מורכבות במהלך דלקת עצבית ובו זמנית להפחית את מספר העכברים הנדרש.
Abstract
אנצפלומיאליטיס אוטואימונית ניסיונית (EAE) היא המודל הנפוץ ביותר לטרשת נפוצה (MS) ומשמשת לעתים קרובות כדי להבהיר עוד יותר את האטיולוגיה שעדיין לא ידועה של טרשת נפוצה על מנת לפתח אסטרטגיות טיפול חדשות. מודל המיאלין אוליגודנדרוציטים גליקופרוטאין פפטיד 35-55 (MOG35-55) EAE משחזר מהלך מחלה מונופאזית המגביל את עצמו עם שיתוק עולה תוך 10 ימים לאחר החיסון. העכברים נבדקים מדי יום באמצעות שיטת ניקוד קליני. טרשת נפוצה מונעת על ידי פתומנגנונים שונים עם דפוס זמני ספציפי, ולכן חקירת תפקידם של סוגי תאים שוכנים במערכת העצבים המרכזית (CNS) במהלך התקדמות המחלה היא בעלת עניין רב. התכונה הייחודית של פרוטוקול זה היא בידוד סימולטני של כל סוגי התאים העיקריים תושבי CNS (מיקרוגליה, אוליגודנדרוציטים, אסטרוציטים ונוירונים) החלים ב- EAE בוגר ובעכברים בריאים. הדיסוציאציה של המוח וחוט השדרה מעכברים בוגרים מלווה במיון תאים המופעלים מגנטית (MACS) כדי לבודד מיקרוגליה, אוליגודנדרוציטים, אסטרוציטים ונוירונים. ציטומטריית זרימה שימשה לביצוע ניתוחי איכות של תרחיפים חד-תאיים מטוהרים המאשרים את הכדאיות לאחר בידוד התא ומצביעים על טוהר כל סוג תא של כ-90%. לסיכום, פרוטוקול זה מציע דרך מדויקת ומקיפה לנתח רשתות סלולריות מורכבות בעכברים בריאים ובעכברי EAE. יתר על כן, מספר העכברים הנדרש יכול להיות מופחת באופן משמעותי מכיוון שכל ארבעת סוגי התאים מבודדים מאותם עכברים.
Introduction
טרשת נפוצה (MS) היא מחלה אוטואימונית דלקתית כרונית של מערכת העצבים המרכזית (CNS) המאופיינת בדמיאלינציה, נזק אקסונלי, גליוזה וניוון עצבי. למרות גישות מחקר רבות בתחום זה, הפתופיזיולוגיה של טרשת נפוצה עדיין אינה מובנת במלואה 1,2,3,4. המודל החייתי הנפוץ ביותר לחקר טרשת נפוצה הוא פפטיד גליקופרוטאין אוליגודנדרוציטים מיאלין 35-55 (MOG35-55)-induced experimental autoimmune encephalomyelitis (EAE) אשר חולק רבים מהמאפיינים הקליניים והפתופיזיולוגיים שלו 5,6,7,8,9 . הוא מבוסס על התגובה של מערכת החיסון נגד אנטיגנים ספציפיים למערכת העצבים המרכזית, מה שמוביל לדלקת, דמיאלינציה וניוון עצבי-אקסונלי. אנצפלומיאליטיס אוטואימונית ניסיונית (EAE) היא מודל מתאים לחקר מסלולים נוירו-דלקתיים ומפל איתות הנמצאים בטרשת נפוצה.
אפשרויות הטיפול הנוכחיות בטרשת נפוצה יעילות רק באופן חלקי ומתמקדות בעיקר בשלב הדלקתי הראשוני של המחלה. עם זאת, נראה כי המרכיב הנוירודגנרטיבי של טרשת נפוצה הוא האתגר העיקרי עבור גישות טיפוליות ארוכות טווח. לכן, פרוטוקולי בידוד תאים ניתנים לשחזור ומדויקים נדרשים כדי לחקור מנגנונים מולקולריים ותאיים במחלות אוטואימוניות באופן מקיף. גם אם קיימים פרוטוקולים מסוימים לבידוד של סוג תא בודד אחד 10,11,12,13,14,15, קיים צורך בלתי מסופק בבידוד סימולטני של מספר אוכלוסיות תאים תושבות CNS בבת אחת. פרוטוקולים קודמים לבידוד תאים תושבי CNS חסרים בשמירה על פונקציונליות התא וטוהר, וכתוצאה מכך גידול משותף עם תאים שכנים 16,17,18 או חוסר התאמה לניתוחים מורכבים של רשתות תוך תאיות ex vivo 19,20,21,22.
מטרת פרוטוקול זה הייתה לבסס שיטה ניתנת לשחזור ומקיפה לבידוד סימולטני של תרחיפים חד-תאיים טהורים בני קיימא של כל סוגי התאים העיקריים תושבי CNS החלים בעכברים בוגרים בריאים ועכברי EAE. סוגי התאים השונים בודדו באמצעות מיון תאים המופעל מגנטית (MACS)23. הפרדת התאים יכולה להתבצע על ידי ברירה חיובית, כלומר תיוג מגנטי של סמני שטח ספציפיים לסוג התא, או על ידי ברירה שלילית באמצעות ביוטינילציה ודלדול של כל התאים הבלתי רצויים. ציטומטריית זרימה יושמה כדי להבטיח טוהר של מעל 90% וקיום של לפחות 80% מהמתלים החד-תאיים המבודדים.
לסיכום, המטרה העיקרית הייתה לקבוע פרוטוקול לבידוד סימולטני של כל סוגי התאים העיקריים השוכנים במערכת העצבים המרכזית ככלי רב-תכליתי לחקר מסלולים נוירו-דלקתיים המציע ניתוח מקיף ומדויק של רשתות סלולריות מורכבות ומפל איתות ביוכימי בעכברים בריאים ו-EAE.
Protocol
כל ניסויי EAE הושרו בנקבות עכברי C57BL/6J בגיל 10-12 שבועות ואושרו על ידי הרשויות המקומיות (Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen). הציות לחוק ההגנה על בעלי חיים בגרמניה ובאיחוד האירופי הובטח גם הוא בכל עת של הניסויים. כל העכברים הוחזקו בכלובים מאווררים בנפרד בתנאי מגורי בעלי חיים.
הערה: נפחי המגיבים הבאים מתייחסים למוח ולחוט השדרה של מורין בוגר אחד, הנקראים תרחיף תאי CNS להלן ושוקלים בערך 20 מ"ג עד 500 מ"ג. אם מתוכנן דיסוציאציה של יותר מתרחיף אחד של תאי CNS, יש להגדיל את כל נפחי המגיבים והחומרים בהתאם. מומלץ לאחסן את המלח החוצץ פוספט של דולבקו (D-PBS; 1x) עם סידן ומגנזיום, בתוספת 1 גרם/ליטר גלוקוז ו-36 מ"ג/ליטר נתרן פירובט) ברציפות על קרח במהלך כל הניסוי. אם גידול תאים מתוכנן לאחר מכן, בצע את כל השלבים בתנאים סטריליים על ידי שימוש בברדסים . אחרת, אף אחד מסעיפי הפרוטוקול הבאים לא צריך להתבצע מתחת למכסה מנוע. אחסנו את המאגרים על קרח. השתמשו רק בתמיסות מקוררות מראש והימנעו מערבולות לאורך כל הניסוי. ראה איור 1 לקבלת זרימת עבודה כוללת.
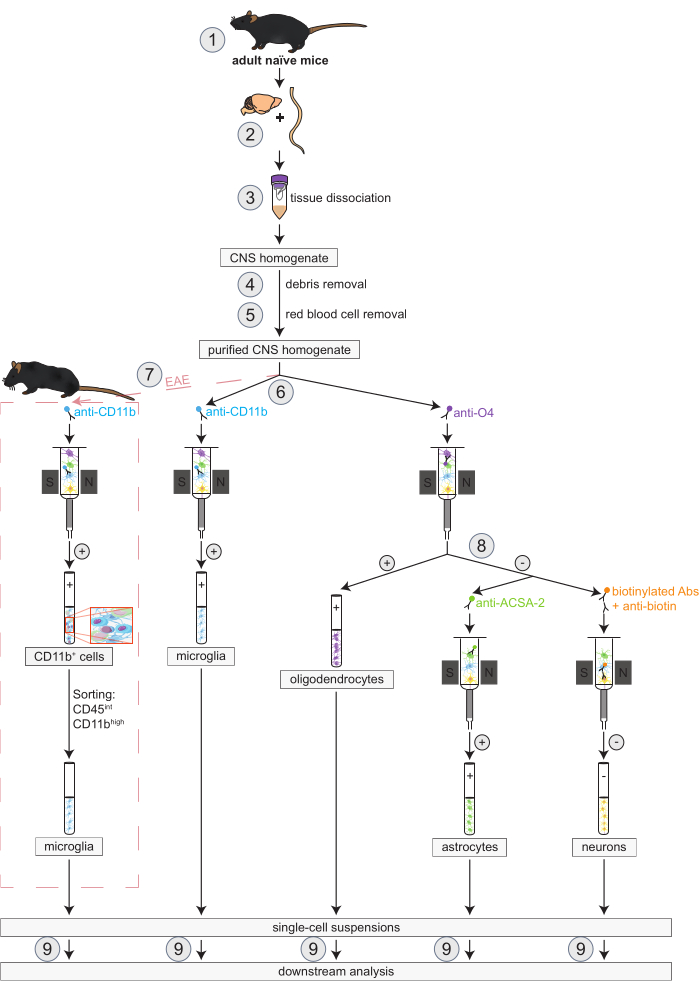
איור 1: תהליך עבודה לבידוד סימולטני של אוליגודנדרוציטים, מיקרוגליה, אסטרוציטים ותאי עצב בעכברים נאיביים ובעכברי EAE. השלבים הראשונים של זרימת העבודה זהים הן עבור עכברים נאיביים והן עבור עכברי EAE. אם רוצים לעבוד עם משכפל EAE, יש לבצע אינדוקציה של EAE לפני כן (1). בקצרה, הפרוטוקול מתחיל בדיסקציה (2) ודיסוציאציה (3) של המוח וחוט השדרה ולאחר מכן הסרת פסולת (4) ותאי דם אדומים (5). לאחר מכן, השעיית תאי CNS מטוהרים כתוצאה מכך מפוצלת לשני שברים לבידוד בו זמנית של אוליגודנדרוציטים ומיקרוגליה באמצעות MACS (6). מיקרוגליה מזוהים באמצעות מיקרו-חרוזים נגד CD11b בעוד אוליגודנדרוציטים מבודדים באמצעות מיקרו-חרוזים אנטי-O4 (בחירות חיוביות). מהזרימה השלילית של האוליגודנדרוציטים (8), אסטרוציטים מבודדים באמצעות מיקרו-חרוזים אנטי-ACSA-2 (ברירה חיובית) ונוירונים על ידי תיוג ביוטין ודלדול של כל התאים שאינם עצביים (ברירה שלילית). בעכברי EAE, הבידוד של תאי CD11b+ מלווה במיון תאים המופעלים על ידי פלואורסצנטיות של תאיםגבוהים CD45intCD11b כדי לחסל תאים חיסוניים אחרים מסוג CD11b+ כמו מקרופאגים, תאים דנדריטיים, מונוציטים, גרנולוציטים ותאי הרג טבעיים הידועים כמשתתפים בתהליכים נוירו-דלקתיים במהלך קורס EAE (7)27,28,48. לאחר בידוד סוגי התאים השונים של תושבי CNS, ניתן לבצע ניתוחי טוהר (9). קיצורים: ABS = נוגדנים; ACSA-2 = אנטיגן פני השטח של תא אסטרוציטים-2; CD11b = קינאז תלוי ציקלין 11B; CD45 = קולטן מסוג טירוזין-חלבון phosphatase C; CNS = מערכת העצבים המרכזית; EAE = אנצפלומיאליטיס אוטואימונית ניסיונית; MACS = מיון תאים המופעל באמצעות מגנטית; O4 = סמן אוליגודנדרוציטים O4. נתון זה שונהמ-49. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
1. אינדוקציה של EAE פעיל
- הכנת ריאגנטים
- להפרדת תאים: הכינו את מאגר ה-PB ואחסנו אותו בטמפרטורה של 2-8°C למשך שבוע אחד לכל היותר. כדי להכין תמיסת מלאי, להוסיף 475 מ"ל של 1x PBS ללא תוספי (pH 7.2) + 25 מ"ל של 0.5% אלבומין בסרום בקר (BSA). השתמש בדילול 1:20 שהוכן ב- BSA.
- עבור ציטומטריית זרימה ומיון תאים המופעלים על ידי פלואורסצנטיות (FACS): הכינו את מאגר FACS, PBS עם 2% סרום עגל עובר (FCS) ו- 2 mM EDTA ואחסנו אותו ב- 2-8 °C. כדי להכין, להוסיף 500 מ"ל של 1x PBS ללא תוספות ו 10 מ"ל של FCS + 2 מ"ל EDTA (מ 0.5 M מלאי EDTA)
- לבצע חיסון על פי הפרוטוקול של Bittner et al. 5. בקצרה, יש להשרות EAE על ידי הזרקה תת עורית של תחליב המכיל 200 מיקרוגרם MOG35-55 פפטיד ו-200 מיקרוליטר של אדג'ובנט שלם של פרויד כולל 200 מיקרוגרם Mycobacterium tuberculosis.
- מרדימים את העכבר עם 2% isoflurane באמצעות תא הרדמה עם וופורייזר isoflurane. יש להשתמש במשחה וטרינרית על עיני בעל החיים כדי למנוע יובש בזמן הרדמה.
- לאחר שעתיים, הזריקו זריקה תוך צפקית של 100 ng רעלן שעלת (PTx) מומס ב 100 μL של 1x PBS על פי הפרוטוקול של Huntemann et al.24. חזור על זריקת PTx ביום השני לאחר החיסון.
זהירות: התבוננו בכל בעל חיים עד שהוא חזר להכרה מספקת כדי לשמור על עצם החזה. עכברים שעברו את הליכי ההזרקה אינם מוחזרים לחברתם של העכברים האחרים עד להחלמה מלאה. עבור Mycobacterium tuberculosis ו- PTx: יש להימנע משאיפה, בליעה ומגע עם העור והעיניים. Mycobacterium tuberculosis הוא מפעיל של מערכת החיסון המולדת. ל-PTx השפעות ביולוגיות רבות. - עקוב אחר התקדמות EAE מדי יום, המבוצע על ידי שני חוקרים עיוורים המנטרים משקל ובודקים את העכברים קלינית.
- למטרה זו, השתמש בשיטת הניקוד הבאה הייתה דרגה 0-ללא סימנים קליניים של EAE, דרגה 1- פרזיס זנב חלקי, פרזיס זנב שלם דרגה 2, חולשת גפיים אחוריות בינונית דרגה 3, חולשת גפיים אחוריות שלמות דרגה 4 והליכה אטקסית, פרפרזיס דרגה 5 קלה, דרגה 6-פרפרזיס, דרגה 7-פרפלגיה, דרגה 8-טטרפרזיס, דרגה 9-קוואדריפלגיה, ומוות בדרגה 10.
- השתמש בקריטריוני ההחרגה הבאים להשתתפות נוספת בניסוי, ציון קליני > 7 או ירידה במשקל העולה על 20% ממשקל הגוף הראשוני.
- לדיסקציה של המוח וחוט השדרה, יש להרדים עכברי EAE ביום ה-16 לאחר השראת EAE המייצגת את המחלה המקסימלית.
2. הכנת רקמות CNS (משך: כ -10 דקות לעכברים)
- לאחר הקרבת עכברים עם פחמן דו חמצני, להתחיל עם זילוח transcardial של כל עכבר עם 20 מ"ל של 1x PBS. חזור על הזילוח שוב עם 20 מ"ל של 1x PBS.
- מניחים את העכבר במצב שכיבה ומקבעים את הגפיים עם צינוריות. החל 75% אתנול על הגוף הקדמי של החיה. אמצעי סטריליות נוספים אינם נחוצים בשלב זה.
- פתח את הבטן ואת בית החזה על ידי ביצוע חתך אורכי דרך העור ואת fascia בעזרת מספריים.
- חתכו את הצלעות לרוחב וקפלו את בית החזה כדי לקבל גישה חופשית ללב. תקן את בית החזה מקופל כלפי מעלה עם צינוריות.
- פתח את האטריום הימני באמצעות מספריים. החל 20 מ"ל של 1x PBS לתוך החדר השמאלי עם צינורית כדי לשטוף את הדם דרך אטריום ימין חתוך.
- חשוף את הגולגולת על ידי חיתוך העור על גבי ראש המורין דרך חתך אורכי והזז את העור סביב הראש באמצעות מלקחיים. חותכים את הגולגולת בעזרת מספריים לאורך תפר הסגיטל.
- הכנס קצה של מלקחיים לאורך קו החתך כדי לפתוח את הקלוטה. הסר את החלקים הנותרים של הקלוטה עם מלקחיים, כך שהמוח חשוף במלואו.
- הסר את המוח בזהירות ומקם אותו לתוך מטריצה במוח murine. חתכו את המוח לפרוסות קשת בעובי 1 מ"מ באמצעות סכין גילוח.
- חותכים את עמוד השדרה בעזרת מספריים ממש מעל הפסגה האיליאק כך שניתן יהיה להכניס את המזרק לתעלת עמוד השדרה.
הערה: הדרך הקלה ביותר להסיר את חוט השדרה היא לשטוף אותו מתעלת עמוד השדרה באמצעות PBS. אחרת, יש לפתוח את קשתות החוליות בנפרד עם מספריים ואז ניתן להסיר את חוט השדרה. - שטפו את חוט השדרה מתעלת עמוד השדרה מהקאודלי לגולגולתי באמצעות מזרק 20 מ"ל עם מחט 20G המכילה PBS 1x. חתכו את חוט השדרה למקטעים באורך 0.5 ס"מ באמצעות אזמל.
- אחסנו כל תרחיף תאי CNS המורכב מהמוח ומחוט השדרה המתאים בצלוחית פטרי נפרדת אחת לכל עכבר מלאה בכ-3 מ"ל של D-PBS קר. אחסנו את הכלים על קרח עד לעיבוד נוסף.
3. דיסוציאציה של רקמת CNS (משך: כ 1-1.5 שעות בהתאם למספר השעיות תאי CNS)
הערה: רקמה עצבית מעכברים בוגרים מנותקת על ידי שילוב של דיסוציאציה מכנית עם פירוק אנזימטי של המטריצה החוץ תאית. בכך, השלמות המבנית נשארת, ומתלה התא יכול לשמש להליכי בידוד תאים נוספים.
- הכינו את הנפח המתאים של תערובת אנזימים 1 המורכבת מ-50 מיקרוליטר אנזים P ו-1,900 מיקרוליטר של חיץ Z לכל השעיית תאי CNS. שני הריאגנטים שייכים לערכת הדיסוציאציה המוחית הבוגרת.
- הכן את הנפח המתאים של תערובת אנזימים 2 המורכבת מ -10 μL של אנזים A ו- 20 μL של חיץ Y לכל השעיית תאי CNS. שני הריאגנטים שייכים לערכת הדיסוציאציה המוחית הבוגרת.
- מעבירים 1,950 מיקרוליטר של אנזים מערבבים 1 לתוך צינור C ומוסיפים את חתיכות הרקמה של תרחיף אחד של תא CNS לאחר מכן. השתמש בשפופרת C אחת לכל עכבר.
- הוסף 30 μL של תערובת אנזימים 2 לכל צינור C. סגור את צינורות C בחוזקה וחבר אותם הפוך על השרוול של dissociator התא עם תנורי חימום.
- הפעל את התוכנית המתאימה בשם 37C_ABDK_01 (נמשכת 30 דקות). שימו לב לפחות ל-5 הדקות הראשונות של התוכנית כדי לוודא שכל הצינורות מסתובבים באותה מהירות. התרחשות של שגיאות במהלך הריצה אפשרית. לאחר מכן, עבור לשלב 6.
- בשתי הדקות האחרונות של התוכנית, הניחו מסננת אחת של 70 מיקרומטר על צינור של 50 מ"ל עבור כל תרחיף תאי CNS מנותק. יש להרטיב מראש את המסננות הללו עם 2 מ"ל של D-PBS.
- לאחר סיום התוכנית, חבר את צינורות C מהדיסוציאטור והכנס אותם לצנטריפוגה. צנטריפוגייט הדגימות ב 300 x g ו 4 ° C במשך 1 דקות כדי לאסוף את הדגימה בתחתית הצינור.
- השהה מחדש את הדגימה והחל אותה על המסננת הלחה מראש. הוסף 10 מ"ל של D-PBS קר לצינור C הריק וסגור אותו. נערו אותו בעדינות והניחו את המתלה על המסננת המתאימה.
- השליכו את המסננות וסגרו את צינורות 50 מ"ל. צנטריפוגט את מתלה התא שוב ב 300 x גרם ו 4 ° C במשך 10 דקות. לאחר מכן, שאפו את כל הסופרנאטנט בזהירות רבה.
4. הסרת פסולת (משך: כ 1.5-2 שעות בהתאם למספר השעיות תאי CNS)
הערה: דיסוציאציה של רקמות מובילה לעתים קרובות למיאלין ולפסולת תאים שיכולים לפגוע בניתוח במורד הזרם. על ידי הוספת פתרון להסרת פסולת, ניתן להסיר פסולת זו ביעילות מהשעיית תאי CNS.
- השהה מחדש את גלולת התא בזהירות עם 3,100 מיקרוליטר של D-PBS עבור כל השעיית תא CNS. אין לערבל.
- אם עובדים עם יותר מתלה אחד של תאי CNS, אגרו לכל היותר שני מתלים של תאי CNS הנגזרים ממצב אחד או מקבוצת ניסוי אחת בצינור אחד של 15 מ"ל.
- הוסף 900 μL של תמיסת הסרת פסולת מערכת הדיסוציאציה המוחית הבוגרת לתרחיף אחד של תאי CNS או 1,800 μL של תמיסת הסרת פסולת לשני תרחיפים משולבים של תאי CNS.
- הופכים את הצינור ומערבבים את המתלים. לאחר מכן, לכסות אותו בעדינות רבה עם 4 מ"ל של D-PBS קר. שיפוע ברור צריך להיות גלוי (איור 2A).
- צנטריפוגה את הצינורות במשך 10 דקות ב 3000 x גרם ו 4 ° C עם האצה מלאה וללא בלימה.
- אם ההפרדה מתרחשת כמתוכנן, נוצרים שלושה שלבים (איור 2C). שאפו את שני השלבים העליונים לחלוטין (איור 2C-1,2) והשליכו אותם. חשוב שלא יישארו שאריות מיאלין (איור 2E).
הערה: אם השיפוע לא פעל והתאים נחוצים בדחיפות, אל תשאב את שני השלבים העליונים. במקום זאת, מלא את צינור 15 מ"ל עם D-PBS קר עד 15 מ"ל והפוך מספר פעמים. צנטריפוגייט שוב ב 1000 x גרם במשך 10 דקות ב 4 ° C עם האצה מלאה וללא בלימה. למצוץ את supernatant ולחזור על השלבים 4.1 - 4.4. - מלא את הצינור עם D-PBS קר עד 14 מ"ל ולסגור אותו. הפוך את הצינור בעוצמה על ספסל העבודה עד שגלולת התא תתנתק מתחתית הצינור. אין לערבל.
- צנטריפוגט את הדגימה שוב ב 1000 x גרם ו 4 ° C במשך 10 דקות. הגדר האצה מלאה ובלם מלא. שאפו את הסופרנאטנט בזהירות ובשלמות.

איור 2: עשה ואל תעשה במהלך פינוי פסולת. (A) דוגמה חיובית לשיפוע לאחר כיסוי עם 4 מ"ל של PBS. השלב העליון המורכב מ -4 מ"ל של PBS ניתן להבחין בבירור מהשלב התחתון המורכב מהשעיית תאי CNS עם פתרון הסרת הפסולת. (B) דוגמה שלילית לשיפוע לאחר כיסוי עם 4 מ"ל של PBS. השיפוע חסר הפרדה ברורה בין PBS לבין מתלה התא שמתחתיו. מעט מה-PBS מתפזר לתוך מתלה התא. (C) דוגמה חיובית לשיפוע לאחר צנטריפוגה. ניתן להבחין בקלות בין שלושה שלבים נפרדים. לא ניתן לראות שאריות מיאלין בשלב העליון (1) או התחתון (3) של השיפוע. השלב האמצעי מכיל את כל המיאלין (2). גלולת התא נראית בתחתית צינור 15 מ"ל. (D) דוגמה שלילית לשיפוע לאחר צנטריפוגה. אין הפרדה מדויקת בין שלושת השלבים האפשרית. חלק משאריות המיאלין נראות בשלב העליון (1) והתחתון (3) של השיפוע. (E) דוגמה חיובית לשיפוע לאחר שאיפת שני השלבים העליונים. הדגימה המתקבלת מכילה רק את גלולת התא וסופרנאטנט ברור מעל. לא נותרו שאריות מיאלין. (F) דוגמה שלילית לשיפוע לאחר שאיפת שני השלבים העליונים. הדגימה עדיין מכילה כמה שאריות מיאלין (חץ שחור). קיצורים: CNS = מערכת העצבים המרכזית; PBS = מלוחים חוצצי פוספט לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. הסרת תאי דם אדומים (משך: כשעה בהתאם למספר השעיות תאי CNS)
הערה: שלב זה מונע זיהום מאוחר יותר על ידי תאי דם אדומים ומבטיח ליזה אופטימלית של אריתרוציטים עם השפעה מינימלית על סוגי תאים אחרים שבודדו מרקמת CNS. הכרכים הבאים מסומנים עבור תרחיפים של תאים הנגזרים מ-100 מ"ג עד 1 גרם רקמה עצבית המתאימה לשני מוחות עכברים בוגרים וחוטי שדרה. אם עובדים עם יותר משני מתלים של תאי CNS, הגדילו את כל הריאגנטים ואת הנפחים הכוללים בהתאם.
- התחל עם הכנת פתרון להסרת תאי דם אדומים (RBCRS): לכל שני תרחיפים של תאי CNS מאוגמים. לדלל 100 μL של תמיסת מלאי להסרת תאי דם אדומים (10x) מערכת דיסוציאציה מוחית בוגרת ב 900 μL של ddH2O כדי להגיע לדילול סופי של 1:10.
- יש לאחסן את ה-RBCRS בטמפרטורה של 2-8°C עד לשימוש. יש להשליך שאריות שאינן בשימוש בסוף היום.
- להשעות מחדש את גלולת התא של עד שני תרחיפים של תאי CNS ב 1 מ"ל של RBCRS. הימנעו מערבולות. לדגור על התמיסה במשך 10 דקות ב 4 ° C.
- הוסף 10 מ"ל של חיץ PB קר לשני מתלי תאים מאוגמים. צנטריפוגו את הדגימה בטמפרטורה של 300 x גרם ו-4 מעלות צלזיוס למשך 10 דקות ושאפו את הסופרנאטנט לחלוטין לאחר מכן.
- השהה מחדש כל כדור תא מתרחיף תא CNS אחד ב 80 מיקרוליטר של חיץ PB על ידי צנרת איטית למעלה ולמטה. בהתאם לכך, השתמש ב- 160 μL כדי להשהות מחדש כדורי תאים שמקורם בשני תרחיפים של תאי CNS.
- כאשר עובדים עם מספר תרחיפים של תאי CNS מאותו מצב ניסיוני, אגרו את כל מתלי התאים הללו.
- קבע את ספירת התאים, לדוגמה, באמצעות תא ספירה משופר. מתלי התאים היו בדרך כלל מדוללים 1:50 בחיץ PB, ואחריו דילול נוסף של 1:10 בתמיסה כחולה טריפאן 0.4%.
6. פרוטוקול חרוזים מגנטיים בעכברים נאיביים ועכברי EAE (משך: כשעה)
- תייגו באופן מגנטי את סוגי התאים השונים במערכת העצבים המרכזית עם MicroBeads ספציפיים לאנטיגן פני השטח שלהם. לאחר מכן, מקם את תרחיף התא בעמודה והפרד מגנטית בין תאים מסומנים שנשמרים בתוך העמודה לבין תאים ללא תווית שעוברים דרכה.
- לאחר הסרת העמודה מהשדה המגנטי, שטפו החוצה תאים המסומנים מגנטית מהעמודה לתוך צינור כשבר התא שנבחר באופן חיובי.
הערה: אמצעי האחסון עבור תהליך הסימון המגנטי מחושבים עבור עד 1 x 107 תאים בסך הכל. אם מתקבלים תאים נוספים, הגדל את כל המגיבים ואת כל הנפחים הכוללים בהתאם. מומלץ לעבוד מהר ולהשתמש רק בתמיסות מקוררות מראש כדי למנוע סגירת נוגדנים על פני התא ותיוג תאים לא ספציפיים, כמו גם כדי להבטיח כדאיות גבוהה של אוכלוסיות התאים המבודדות. כמו כן, חשוב לבצע את שלבי השטיפה ברגע שמאגר העמודים מתרוקן על ידי הוספת מאגר PB כדי שהעמודים לא יתייבשו. - חלק את השעיית תאי CNS מטוהרים ולא מדוללים לשני שברים עבור הבידודים הבאים של מיקרוגליה ואוליגודנדרוציטים. היחס בין שני השברים תלוי בספירת התאים הרצויה של כל סוג תא.
הערה: פרטים נוספים (משך הדגירה, שלבי פרוטוקול מפורטים, אמצעי אחסון, ריאגנטים ושיטת ספירת תאים) מצוינים בטבלה 1.
טבלה 1: זרימת עבודה לתיוג מגנטי סימולטני ולבידוד של אוליגודנדרוציטים ותאי מיקרוגליה מעכברים נאיביים ועכברי EAE. שני סוגי התאים מבודדים באמצעות ברירה חיובית. שלבים המפורטים באותה שורה מצוינים לביצוע בבת אחת. קיצורים: CD11b = קינאז תלוי ציקלין 11B; EAE = אנצפלומיאליטיס אוטואימונית ניסיונית; FcR = חלבון דמוי קולטן Fc; O4 = סמן אוליגודנדרוציטים O4. אנא לחץ כאן כדי להוריד טבלה זו.
7. תיקון פרוטוקול: מיון נוסף לבידוד תאי מיקרוגליה בעכברי EAE (משך: כשעה וחצי עד שעתיים)
הערה: בעת עבודה עם עכברי EAE, יש צורך להשלים את פרוטוקול בידוד התאים מבוסס MACS על ידי FACS כדי להסיר אוכלוסיות תאים CD11b+ שאינן מיקרוגליה (למשל, מונוציטים, מקרופאגים, תאי הרג טבעיים, גרנולוציטים או תאים דנדריטיים) מחלק התא CD11b+ . אחרת, ניתן להתעלם משלב זה.
- הכינו את תערובת האב לצביעה המכילה 1x PBS בתוספת CD11b FITC (שיבוט M1/70, 1:50) ו-CD45 APC/Cy7 (שיבוט 30-F11, 1:200). יש להשתמש ב-100 μL של תערובת האב לצביעה לכל 5 x 106 תאים. מערבלים את כל הנוגדנים לפני השימוש.
- צנטריפוגו את תרחיף תאי המיקרוגליה בטמפרטורה של 300 x גרם ו-4 מעלות צלזיוס למשך 10 דקות ושאפו את הסופרנאטנט בזהירות.
- להשעות מחדש את גלולת התא עם 100 μL של תערובת מאסטר צביעה מוכן לכל 5 x 106 תאים. יש לדגור במשך 15 דקות בחושך בטמפרטורת החדר (RT).
- עצור את התגובה על ידי הוספת 500 μL של PBS וצנטריפואט הדגימה שוב ב 300 x גרם ו 4 ° C במשך 10 דקות.
- שאפו את הסופרנאטנט בזהירות והשהו מחדש את גלולת התא עם 1x PBS בתוספת 10 מיקרוגרם / מ"ל DNAse כדי להגיע לריכוז סופי של 1 x 107 תאים למ"ל. אחסן את התאים ב- 4 °C עד לתחילת המיון.
- החל את מתלה התא על מסננת של 100 מיקרומטר המונחת על צינור FACS חדש מיד לפני תחילת המיון.
- הגדר את קצב הזרימה ל- 1000 אירועים לשנייה והשתמש בפייה של 100 מיקרומטר. מיין את אוכלוסיית התאים הרצויה של תאיםגבוהים CD45intCD11b לתוך צינור חדש 15 מ"ל מוכן עם 1x PBS ב RT.
8. הכנת זרימה שלילית של אוליגודנדרוציטים לבידוד נוירונים ואסטרוציטים (משך: כשעה אחת)
הערה: הזרימה השלילית של אוליגודנדרוציטים משלב 6 נאספת לבידוד נוסף של נוירונים ואסטרוציטים. לשם כך, מתלה התא מחולק לשני חלקים. בשל הבידוד הקודם של אוליגודנדרוציטים מהשעיית תאי CNS, זיהום על ידי תאי O4+ ממוזער כי אחרת היה נצפה.
- צנטריפואט את הזרימה השלילית של האוליגודנדרוציטים ב 300 x גרם ו 4 ° C במשך 10 דקות ושאפו את supernatant בזהירות.
- השהה מחדש את גלולת התא ב 80 μL של חיץ PB לכל תרחיף תאי CNS משולב ששימש בעבר לבידוד של החלק החיובי אוליגודנדרוציטים.
- ספור את התאים. בצע את ספירת התאים בהנחה שהם O4 - באמצעות תא ספירה משופר לאחר דילול תרחיף התא 1:50 במאגר PB ואחריו דילול נוסף של 1:10 בכחול טריפאן 0.4%.
- פצל את תרחיף התא המטוהר והלא מדולל לשני שברים עבור הבידוד הבא בו זמנית של נוירונים ואסטרוציטים. היחס בין שני השברים תלוי בכמות המועדפת של כל סוג תא.
הערה: פרטים נוספים (משך הדגירה, שלבי פרוטוקול מפורטים, אמצעי אחסון, ריאגנטים ושיטת ספירת תאים) מצוינים בטבלה 2.
טבלה 2: זרימת עבודה לתיוג מגנטי סימולטני ולבידוד של נוירונים ואסטרוציטים מעכברים נאיביים ועכברי EAE. שני סוגי התאים מבודדים מהזרימה השלילית של אוליגודנדרוציטים. אסטרוציטים מופרדים כברירה חיובית באמצעות מיקרו-חרוזים אנטי-ACSA-2 ואילו תאי עצב מטוהרים באמצעות ביוטינילציה ודלדול של כל התאים שאינם עצביים כברירה שלילית. שלבים המפורטים באותה שורה מצוינים לביצוע בבת אחת. קיצורים: Anti-ACSA-2 = אנטיגן פני השטח של תאי אסטרוציטים-2; EAE = אנצפלומיאליטיס אוטואימונית ניסיונית; FcR = חלבון דמוי קולטן Fc; MACS = מיון תאים המופעל באמצעות מגנטית. אנא לחץ כאן כדי להוריד טבלה זו.
9. ניתוחי טוהר של סוגי התאים המבודדים תושבי CNS (משך: כשעתיים)
הערה: מומלץ לבצע ציטומטריית זרימה של כל ארבע אוכלוסיות התאים המבודדות השוכנות במערכת העצבים המרכזית כדי למדוד ולהשוות את הטוהר והכדאיות שלהן. לכן, יש צורך להכתים את כל סוגי התאים עם נוגדן שכותרתו פלואורופור. צביעת תאים חיים/מתים מיושמת באמצעות צבע בר קיימא הניתן לתיקון (1:10,000).
- פאנל טוהר - פרוטוקול צביעה חוץ-תאי
- השתמש 1 x 105 תאים מומסים 50 μL של PBS לכל צביעה.
- הכינו את תערובת האב המומסת ב-PBS עם 2% FCS/2 mM EDTA המורכבת מהנוגדנים החד-שבטיים המצומדים פלואורוכרום הבאים המכוונים לסמני משטח ספציפיים לסוג התא: CD11b FITC (שיבוט 1/70, 1:100)25,26,27,28, ביוטין-PE (שיבוט Bio3-18E7, 1:200)29,30,31,32, ACSA-2 PE-Vio615 (שיבוט REA-969, 1:200)33,34,35, O4 APC (שיבוט REA-576, 1:400), ו-CD45 BV510 (שיבוט 30-F11, 1:150)36,37. הוסף 1 מיקרוגרם של anti-CD16/32 לכל 1 x 106 תאים כדי לחסום את קולטן Fc3 8,39. מערבלים את כל הנוגדנים לפני השימוש.
- צנטריפוגו את מתלה התא למשך 5 דקות בטמפרטורה של 540 x גרם ו-4°C ושאפו את הסופרנאטנט בזהירות.
- השהה מחדש את גלולת התא ב -100 מיקרוליטר של תערובת האב המתאימה ודגר על הדגימה במשך 15 דקות ב- RT בחושך.
- שטפו את התאים עם 500 μL של 1x PBS עם 2% FCS/2 mM EDTA וצנטריפוגייט את הדגימה למשך 5 דקות ב-540 x גרם ו-4°C.
- שאפו את הסופרנאטנט והשהו מחדש את גלולת התא עם 70 μL של 1x PBS עם 2% FCS/2 mM EDTA.
- מערבול את הדגימה כדי לנתק את גלולת התא לחלוטין. לאחר מכן, המדגם מוכן לניתוח ציטומטריה זרימה.
- פאנל טוהר - פרוטוקול צביעה תוך תאי עם NeuN
- השתמש 1 x 105 תאים של כל אוכלוסיית תאים עבור צביעה תוך תאית של NeuN שהוא סמן גרעיני ספציפי נוירון 40,41. זוהי דרך נוספת להכתים נוירונים בני קיימא.
- העבר 1 x 105 תאים מכל אוכלוסיית תאים לתוך צינור FACS. הוסף 1 מ"ל PBS עם 2% FCS/2 mM EDTA לכל צינור. צנטריפוגט את הצינורות ב 540 x גרם ו 4 ° C במשך 5 דקות.
- בינתיים, הכינו את תערובת האב המומסת ב-PBS עם 2% FCS/2 mM EDTA המורכב מהנוגדנים החד-שבטיים המצומדים פלואורוכרום הבאים המכוונים לסמני שטח ספציפיים לסוג התא: CD11b FITC (שיבוט M1/70, 1:100)25,26,27,28, ביוטין-PE (שיבוט Bio3-18E7, 1:200)29,30,31,32, ACSA-2 PE-Vio615 (שיבוט REA-969, 1:200)33,34,35 ו- CD45 BV510 (שיבוט 30-F11, 1:150)36,37.
- שאפו את תאי הסופרנאטנט והשהו מחדש ב-100 מיקרוליטר של תערובת האב שהוכנה ודגרו על הדגימה במשך 10 דקות ב-RT בחושך.
- שטפו את התאים עם 100 μL של PBS עם 2% FCS / 2 mM EDTA וצנטריפוגייט אותם שוב ב 540 x g ו 4 °C במשך 5 דקות.
- בינתיים, הכינו 200 μL של תמיסת הקיבוע/חלחול: הוסיפו 50 μL מהמלאי המרוכז של תרכיז הקיבוע/חדירות ל-150 μL של מדלל קיבוע/חלחול כדי להגיע לדילול סופי של 1:4.
- שאפו את הסופרנאטנט והשהו מחדש את התאים ב-100 מיקרוליטר של תמיסת קיבוע/חדירה 1x. לדגור את הדגימה במשך 30 דקות ב 4 ° C.
- בינתיים, הכינו 1 מ"ל של 1x חיץ חדירות/שטיפה על ידי הוספת 100 μL של מלאי חיץ החדירות ל-900 μL של ddH2O כדי להגיע לדילול סופי של 1:10.
- שטפו את התאים 1x עם 100 μL של 1x חיץ חדירה/שטיפה וצנטריפוגייט את הדגימה ב 540 x גרם ו 4 ° C במשך 5 דקות.
- בינתיים, הכינו תערובת מאסטר נוספת במאגר חדירות/שטיפה 1x המורכב רק מ-NeuN (NeuN AF647, EPR12763 שיבוט, 1:200) ו-1 מיקרוגרם של אנטי-CD16/32 לכל 106 תאים כדי לחסום את קולטן ה-Fc.
- שאפו את הסופר-נאנט. להשהות מחדש את התאים הקבועים וחדירתיים ב 50 μL של תערובת המאסטר השני לדגור במשך 30 דקות ב 4 ° C.
- יש לשטוף את הדגימה עם 100 μL של 1x חיץ חדירה/שטיפה וצנטריפוגייט בטמפרטורה של 540 x גרם ו-4°C למשך 5 דקות.
- השליכו את הסופרנאטנט והשהו מחדש את גלולת התא ב-70 מיקרוליטר של PBS עם 2% FCS/2 mM EDTA. לאחר מכן, המדגם מוכן לניתוח ציטומטרי זרימה.
- לאחר הגדרת הפאנל על ציטומטר הזרימה, רכשו תאים לניתוח טוהר באמצעות תוכנה לניתוח ציטומטריית זרימה.
10. ניתוח סטטיסטי
- ביצוע ניתוחים סטטיסטיים ועיצוב גרפים עם תוכנת ניתוח גרפי. הנתונים מוצגים כממוצע ± SEM.
Representative Results
הפרוטוקול הנוכחי מציע את האפשרות לבודד בו זמנית את כל התאים העיקריים השוכנים במערכת העצבים המרכזית, כלומר מיקרוגליה, אוליגודנדרוציטים, אסטרוציטים ונוירונים ממערכת CNS אחת משוכפלת. זה חשוב להפחתת מספר העכברים הדרושים לניסויים מסוג זה ולהבטיח את יכולת ההשוואה של ניתוחים מולקולריים וביוכימיים ברמה התאית. אם סוגי התאים הבודדים מבודדים משכפלים שונים של מערכת העצבים המרכזית, לא ניתן למפות אינטראקציות תאיות באופן אמיתי וסטיות טכניות פוטנציאליות במהלך תהליכי הבידוד עלולות להטות ניתוחים נוספים במורד הזרם. בנוסף, ממצאים מולקולריים וביוכימיים מכל סוג תא לא יהיו דומים זה לזה מכיוון שהם אינם נגזרים מאותו הקשר EAE. פרוטוקול MACS קיים באמצעות מערכת/ערכה מסחרית הותאם כדי לאפשר בידוד סימולטני של סוגי התאים הנ"ל.
בידוד תאי מיקרוגליה בוצע באמצעות מיקרו-חרוזים נגד CD11b, אוליגודנדרוציטים בודדו באמצעות מיקרו-חרוזים אנטי-O4 (טבלה 1), ומיקרו-חרוזים אנטי-ACSA-2 שימשו לבידוד אסטרוציטים (טבלה 2). לעומת זאת, בידוד תאי עצב מייצג ברירה שלילית והושג על-ידי ביוטינילציה ותיוג מגנטי של כל התאים הלא-עצביים (טבלה 2). כל התאים הלא-עצביים (למשל, אוליגודנדרוציטים, מיקרוגליה, אסטרוציטים, תאי אנדותל ופיברובלסטים), למעט תאי דם, יכולים להיות מסומנים באופן מגנטי על-ידי שימוש בנוגדן מצומד לביוטין, המכוון במיוחד נגד אנטיגן פני השטח המתבטא בתאים לא-עצביים אלה (טבלה 2). על ידי דלדול של תאים לא-עצביים אלה המסומנים מגנטית, אוכלוסיות תאים עצביים טהורות מאוד ובנות קיימא יכולות להיווצר 30,42,43.
שני לוחות ציטומטריית זרימה חדשים לניתוח טוהר המתלים החד-תאיים שנוצרו תוכננו. כאן נעשה שימוש בסמנים ספציפיים לסוג התא ובסמנים גרעיניים בשילוב עם אפליה בין תאים חיים למתים.
תפוקת התאים שהתקבלה עבור עכבר וסוג תא (איור 3A) נותחה והובילה לממוצע של 8. 4 x 105 ± 3 x 104 מיקרוגליה, 3.23 x 106 ± 1 x 105 אוליגודנדרוציטים, 8.6 x 105 ± 2 x 104 אסטרוציטים, ו 4.5 x 105 ± 1 x 104 נוירונים לכל עכבר נאיבי.
בהקשר של המטרה לחקור מודלים של מחלות של דלקת עצבית, הפרוטוקול יושם גם על מודל עכבר של EAE. העכברים הומתו ביום ה-16 לאחר השראת EAE המייצגת את המחלה המקסימלית. במצב EAE זה, כ 2.9 x 106 ± 6.7 x 105 oligodendrocytes, 5.2 x 105 ± 9 x 104 אסטרוציטים ו 4.4 x 105 ± 4 x 104 נוירונים בודדו. תפוקת תאי המיקרוגליה ירדה לכ-1.7 x 10,5 ± 4 x 10,4 מיקרוגליה לכל עכבר EAE בגלל מיון התאים הנוסף לאחר שלבי MACS (איור 3A).
לאחר בידוד, אפיונים פנוטיפיים של אוכלוסיות תאים שונות באמצעות ציטומטריית זרימה הוכיחו שניתן להשיג תרחיפים חד-תאיים בני קיימא עם טוהר של כ-90% עבור כל סוגי התאים העיקריים השוכנים במערכת העצבים המרכזית (איור 3B). תאי מיקרוגליה היו מגודריםכגבוהים CD45intCD11b כפי שהוגדרו בספרות 44,45,46,47.
ב- EAE, היה צורך למיין מיקרוגליה מכל תאי CD11b+ כדי להבדיל אותם מתאי חיסון אחרים של CD11b + כמו מונוציטים, נויטרופילים, תאי הרג טבעיים, גרנולוציטים ומקרופאגים שמהגרים למערכת העצבים המרכזית במהלך דלקת עצבית 27,28,48. לכן, תאי מיקרוגליה מוינו כתאיםגבוהים CD45intCD11 מתרחיף התאים CD11b+. כל אסטרטגיית מיון תאי המיקרוגליה מתוארת באיור 4. בעכברים תמימים, אוכלוסיית תאי המיקרוגליה הייתה 91.16% מכלל התאים הבודדים החיים (96% מכלל אוכלוסיית CD11b+) (איור 4A). בעכברי EAE, אוכלוסיית תאי המיקרוגליה הייתה 46.85% מכלל התאים הבודדים החיים (55% מכלל אוכלוסיית CD11b+) (איור 4B). אף על פי שגם נהלי MACS וגם הליכי FACS מפעילים לחץ מכני על התאים הבודדים, 75.41% ±-8.63% מהמיקרוגליה המטוהרת הממוינת היו בני קיימא (איור 3B).
אסטרוציטים ונוירונים שבודדו ישירות מהשעיית תאי CNS הראשונית הראו זיהום רלוונטי עם אוליגודנדרוציטים, מה שהוביל להנחה כי בידוד בו זמנית של נוירונים ואסטרוציטים מהזרימה השלילית של אוליגודנדרוציטים יכול למנוע זיהום זה. ניתוחי ציטומטריית זרימה אישרו כי אסטרוציטים שבודדו מהזרימה השלילית של אוליגודנדרוציטים היו בעלי טוהר של 89.23% ± 2.78% והראו כדאיות של 80.56% ± 1.41%. בדומה לתוצאות אלה, טוהר תאי העצב שבודדו ממקטע תאי O4 היה 81.25% ±-3.31% והכדאיות הייתה 83.90% ±-2.61% (איור 3B). ממצאים אלה גם מאשרים כי בידוד בו זמנית של שני סוגי תאים אלה רק לאחר מכן לבידוד של אוליגודנדרוציטים אין השפעה על כמות התאים הפונקציונליים קיימא.
התוצאות לגבי הכדאיות והטוהר של המתלים החד-תאיים המבודדים היו דומות מאוד בעכברי EAE בהשוואה לאלה שהתקבלו בעכברים נאיביים, מה שאישר שהפרוטוקול הזה מתאים לעכברים בריאים, כמו גם בהקשר של EAE (איור 3B).
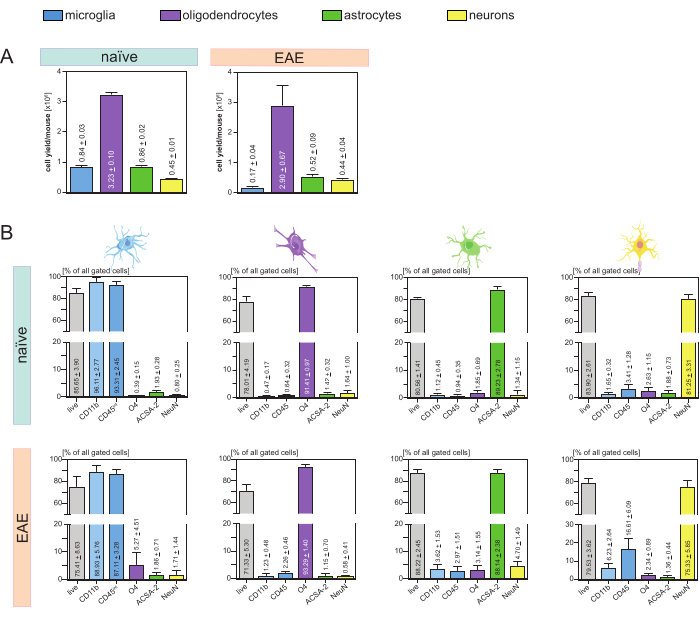
איור 3: תפוקת תאים ותיקוף מבוסס ציטומטריה של זרימה של תאים מבודדים שוכנים במערכת העצבים המרכזית. (A) תפוקת תאים לכל עכבר וסוג תא לאחר בידוד של תאים שוכנים במערכת העצבים המרכזית בעכברים תמימים ועכברי EAE. תרשימי עמודות ממחישים את כמות תפוקות התאים לכל עכבר וסוג תא לאחר יישום הפרוטוקול המוצג. חמישה שכפולים ביולוגיים עובדו עבור התוצאות בעכברים תמימים, וארבעה שכפולים ביולוגיים נותחו בעכברי EAE. בהתאמה מתוארים אמצעים ± SEMs. (B) ניתוחי טוהר וכדאיות תואמים של שברי התאים המטוהרים. תרשימי עמודות מציינים את הכדאיות והטוהר של המתלים החד-תאיים המתקבלים בהתבסס על הביטוי שלהם של סמנים ספציפיים לסוג התא. NeuN שימש כסמן גרעיני ספציפי לתאי עצב. חמישה שכפולים ביולוגיים נרכשו והושוו עבור כל סוג תא הן עבור עכברים בריאים והן עבור עכברי EAE. אמצעים מתאימים ± SEMs מסומנים. קיצורים: Anti-ACSA-2 = אנטיגן פני השטח של תאי אסטרוציטים-2; CD11b = קינאז תלוי ציקלין 11B; CD45 = קולטן מסוג טירוזין-חלבון phosphatase C; CNS = מערכת העצבים המרכזית; EAE = אנצפלומיאליטיס אוטואימונית ניסיונית; MACS = מיון תאים המופעל באמצעות מגנטית; NeuN = חלבון קושר RNA fox-1 הומולוג 3; O4 = סמן אוליגודנדרוציטים O4; SEM = שגיאת תקן של הממוצע. נתון זה שונהמ-49. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
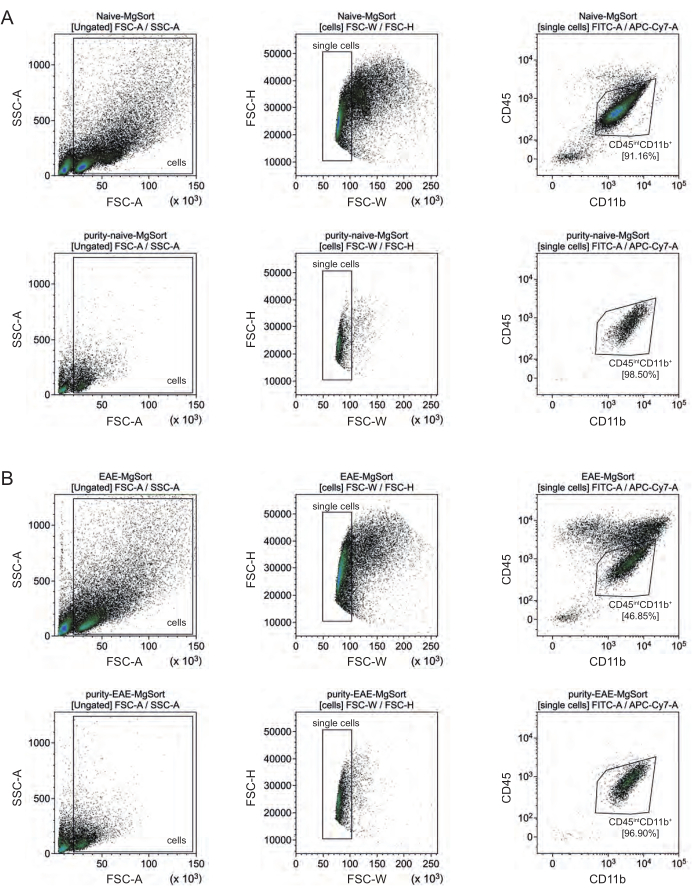
איור 4: אסטרטגיית Gating למיון תאים של תאי מיקרוגליה לאחר בידוד של תאי CD11b+. (A) אסטרטגיית Gating בעכברים נאיביים ו-(B) EAE. השורה העליונה של כל חלונית מציגה תרשימי נקודות לפני המיון והשורה התחתונה לאחר המיון. לאחר בחירה של תאים חיים (SSC-A / FSC-A) ותאים בודדים (FCS-H / FSC-W), אוכלוסיית תאי CD45intCD11b+ מוינו כאוכלוסיית מיקרוגליה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
עד כה, שיטות למיפוי תאים תושבי CNS ex vivo על ידי שילוב ספקטרומטריית מסות וריצוף RNA מציעות פרופיל תאי מדויק מאוד בבריאות ובחולי, אך דורשות ידע טכני שאפתני ומומחיות בתחום זה50,51. יתר על כן, הם אינם מאפשרים ניתוחים פונקציונליים והם יקרים מאוד. מלבד זאת, מערכות מוח על שבב מיקרופלואידיות מספקות סינון מהיר ובמחיר סביר למנגנוני מחלה ובדיקה של גישות טיפוליות חדשות עם הגבלת גדילת תאים ונדידתתאים 52,53,54,55. אורגנואידים CNS יכולים גם להוות חלופה מקבילה בעתיד לחקר מודלים תאיים, קשרים בין-תאיים ואינטראקציות במהלך קורסי מחלה 56,57,58,59. עם זאת, מיון תאים פלואורסצנטיים ומגנטיים הם כיום השיטות היעילות ביותר ליצירת תרחיפים חד-תאיים טהורים וברי קיימא ex vivo 35,60,61. גם אם פרוטוקולי ייצור מבוססים אחרים לבידוד סוגי תאים תושבי CNS דומים לגבי השלבים הבודדים של הבידוד המגנטי ודיסוציאציה קודמת של התא, הם מיועדים להתבצע עבור כל סוג תא בנפרד. לעומת זאת, הפרוטוקול הנוכחי משלב שיטות בידוד שונות עבור כל סוג תא תושב CNS בהקשר לוגי, כך שניתן לבצע אותן בו זמנית וממתלה תא CNS יחיד (טבלה 1, טבלה 2). לפיכך, הוא מאפשר ניתוחים מולטי-אומיים מתרחיף אחד של תאי CNS בודדים, ובסופו של דבר, חקירה של רשתות נוירונים מורכבות. גם אם אין חובה לאגד מספר רקמות מבעלי חיים מרובים כדי לבצע פרוטוקול זה, איגום זה מבטיח מספר מספיק של תאים מבודדים לניתוח נוסף במורד הזרם. השימוש בעכברים שונים לבידוד סוגי התאים הבודדים ישלול את האפשרות לנתח אינטראקציות תאיות פוטנציאליות. מלבד זאת, שילוב שיטות בידוד אינדיבידואליות עבור סוגי תאי CNS שונים, אשר כולם עוקבים אחר דיסוציאציה קודמת של מערכת העצבים המרכזית, חוסך עלויות חומר על ידי שימוש בתרחיף תאי CNS מנותק אחד עבור כל שלבי הבידוד המגנטי הבאים. בנוסף, הטיה טכנית פוטנציאלית הנגרמת על ידי שימוש בעכברים שונים ממוזערת.
מגבלה אחת של הפרוטוקול יכולה להיות השימוש הכמעט בלעדי בנקבות עכברי C57BL/6J. פרוטוקול החיסון EAE תוכנן והוקם עבור נקבות עכברים, ולכן פרוטוקול בידוד תאים זה יושם גם בעכברות C57BL/6J נקבות. עם זאת, עכברים זכרים תמימים שימשו גם במהלך הפיתוח של פרוטוקול זה, מבלי לזהות כל השפעה על מספר התאים או טוהר כתוצאה מכך. הגבלה נוספת משפיעה על בידוד התאים המגנטיים של תאי עצב מכיוון שלא קיימים מיקרו-חרוזים ספציפיים לבידוד נוירונים במונחים של ברירה חיובית. ההנחה הייתה שניתן להשיג תרחיף חד-תאי טהור באמצעות תיוג ביוטין ודלדול של כל התאים הלא-עצביים (טבלה 2). הנחה זו אומתה על ידי השימוש ב-NeuN כסמן גרעיני ספציפי לנוירונים, המשולב בלוח טוהר ציטומטריית הזרימה שהוזכר. מגבלה נוספת נוגעת לבידוד תאי מיקרוגליה בעכברי EAE. כאן, תפוקות התאים המתקבלות יורדות בהשוואה לסוגי התאים האחרים בגלל שלב המיון הנוסף לאחר פרוטוקול MACS. יתר על כן, ניתן לטעון כי מיון מגביר את הלחץ המכני של מיקרוגליה בהשוואה לאוכלוסיות תאים אחרות. אסטרטגיות מיון אינדיבידואליות עשויות להוביל לכמויות שונות של תפוקת תאים. אם מספר התא המבודד קטן מהצפוי או הרצוי, מומלץ להתאים את הגדרת ה-gating ו/או לשפר את האפליה החיה/מתה.
שלב קריטי בפרוטוקול מייצג את פינוי הפסולת. השיפוע חייב להיות מרובד לאט מאוד ובעדינות כדי ליצור את שלושת השלבים הנפרדים הרצויים (איור 2A). רק אם המיאלין ושאריות פסולת אחרות בשני השלבים העליונים מוסרים לחלוטין (איור 2E), מתלים טהורים של תא אחד יכולים להיווצר, וזיהום נוסף יכול להיות מופחת. אם מתלי התאים המתקבלים חסרים טוהר, זה כנראה החלק בפרוטוקול שיש לשפר תחילה לצד הבטחת השימוש הנכון בכל מיקרו-חרוזים.
קבלת רמות גבוהות של טוהר וכדאיות יכולה להיות מאתגרת בסוג זה של ניסוי. להלן כמה המלצות לפתרון בעיות:
-עבודה בתנאים סטריליים היא חובה כדי למנוע זיהום של מיקרו-חרוזים שונים ולאפשר שימוש חוזר, במיוחד לגידול לאחר מכן.
-מומלץ מאוד לסמן כל צינורית כדי למנוע ערבובים.
-הימנעו משימוש בריאגנטים/מאגרים לא מקוררים. אחסנו את כל מתלי התאים על קרח במהלך כל הניסוי כדי להבטיח כדאיות גבוהה.
-הקפידו על זמן קצר ככל האפשר בין שלבי העבודה השונים. אין חלק ספציפי בפרוטוקול שבו מומלץ להשהות את הניסוי.
-רלוונטי מאוד לדבוק בתקופות הדגירה שצוינו.
לסיכום, פרוטוקול נוכחי זה לבידוד סימולטני של כל סוגי התאים העיקריים השוכנים במערכת העצבים המרכזית ממערכת CNS אחת מציע את האפשרות לנתח רשתות עצביות מורכבות ומסלולים נוירו-דלקתיים ex vivo מהשעיית תא CNS אחד. לפיכך, תאים שוכנים במערכת העצבים המרכזית יכולים להיחקר במהלך שלבים שונים של מסלולי מחלה, למשל, במהלך דלקת עצבית, ניוון עצבי ו / או הפוגה ב- EAE. יתר על כן, אינטראקציות תא-תאים ומסלולים ביוכימיים יכולים להיחקר ברמה האישית והשונות בתוך קבוצות ניסוי יכולה להיות מופחתת. יש גם הזדמנות לטפח שברים של תאי CNS מבודדים במונוקולטורה עבור בדיקות פונקציונליות נוספות ותיקוף. בסך הכל, פרוטוקול זה מציע התקדמות משמעותית שעשויה להשפיע על גישות מחקר פרה-קליני וקליני.
Disclosures
כל המחברים מצהירים שאין להם ניגודי עניינים.
Acknowledgements
האיורים נוצרו באמצעות Adobe Illustrator (גרסה 2023) ו-Servier Medical Art (https://smart.servier.com). אנטוניה הנס נתמכה על ידי קרן יורגן מנצ'ו.
Materials
| Name | Company | Catalog Number | Comments |
| 70 μm cell strainers | Corning, MA, USA | 352350 | CNS tissue dissociation |
| ACSA-2 Antibody, anti-mouse, PE-Vio 615 (clone REA-969) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-116-244 | Flow cytometry, store at 4 °C |
| Adult Brain Dissociation Kit, mouse, and rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-107-677 | Tissue dissociation,contains debris and red blood cell removal solutions; prepare aliquots of enzyme A and P upon arrival and store them at -20 °C; store the remaining kit at 4 °C |
| Anti-ACSA-2 MicroBead Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-097-678 | MACS of astrocytes, store at 4 °C |
| Anti-mouse CD16/32 antibody | BioLegend, London, UK | 101301 | Flow cytometry, store at 4 °C |
| Anti-O4 MicroBeads, human, mouse, rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-094-543 | MACS of oligodendrocytes, store at 4 °C |
| AstroMACS Separation buffer | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-221 | MACS of astrocytes, store at 4 °C |
| Biotin Antibody, PE (clone Bio3-18E7) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-113-853 | Flow cytometry, store at 4 °C |
| BRAND Neubauer counting chamber | Thermo Fisher Scientific,Waltham, MA, USA | 10195580 | Cell counting |
| Brilliant Violet 510 anti-mouse CD45 Antibody (clone 30-F11) | BioLegend, London, UK | 103137 | Flow cytometry, store at 4 °C |
| CD11b MicroBeads, human, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-049-601 | MACS of microglia, store at 4 °C |
| DNAse I, recombinant, Rnase-free | Merck KGaA, Darmstadt, Germany | 4716728001 | Flow cytometry, store at -20° C |
| D-PBS with Calcium, Magnesium, Glucose, Pyruvat | Thermo Fisher Scientific,Waltham, MA, USA | 14287080 | Buffer, store at 4 °C |
| D-PBS, without calcium, without magnesium | Thermo Fisher Scientific,Waltham, MA, USA | 14190250 | Buffer, store at 4 °C |
| eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher Scientific,Waltham, MA, USA | 65-0865-14 | Flow cytometry, store at 4 °C |
| eBioscience Foxp3/Transcription factor staining buffer set | Thermo Fisher Scientific,Waltham, MA, USA | 00-5523-00 | Flow cytometry, store at 4°C |
| Falcon (15 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 11507411 | Cell tube |
| Falcon (50 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 10788561 | Cell tube |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Thermo Fisher Scientific,Waltham, MA, USA | 08-771-23 | Flow cytometry |
| FcR Blocking Reagent, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-092-575 | MACS of oligodendrocytes, store at 4 °C |
| Female C57BL/6J mice | Charles River Laboratories, Sulzfeld, Germany | Active EAE induction | |
| Fetal calf serum (FCS) | Merck KGaA, Darmstadt, Germany | F2442-50ML | Flow cytometry, store at -5 to -20 °C |
| FITC Rat Anti-CD 11b (clone M1/70) | BD Biosciences, San Jose, CA, USA | 553310 | Flow cytometry, store at 4 °C |
| Freund’s Complete adjuvant | Merck KGaA, Darmstadt, Germany | AR001 | Active EAE induction, store at 4 °C |
| GentleMACS C Tubes | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-093-237 | CNS tissue dissociation |
| GentleMACS Octo Dissociator with Heaters | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-096-427 | CNS tissue dissociation |
| Graphpad Prism 8.4.3 | Graphpad by Dotmatics | Graphical Analysis | |
| Isoflurane | AbbVie, North Chicago, IL, USA | Active EAE induction, store at 4 °C | |
| Kaluza Analysis Software V2.1.1 | Beckman Coulter, Indianapolis, IN, USA | Flow cytometry analysis | |
| LS Columns | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-401 | MACS |
| MACS BSA Stock Solution | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-376 | PB-buffer |
| MACS MultiStand | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-303 | MACS |
| MOG35–55 peptide | Charité, Berlin, Germany; alternatives: Genosphere Biotechnologies (Paris, France) or sb-Peptide (Saint Egrève, France) | Active EAE induction, store at -20 °C | |
| Mycobacterium tuberculosis strain H37 Ra | Becton, Dickinson and Company (BD),Franklin Lakes, NJ, USA | Active EAE induction, store at 4 °C | |
| Neuron Isolation Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-115-390 | MACS of neurons, store at 4 °C |
| O4 Antibody, anti-human/mouse/rat, APC, (clone REA-576) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-119-897 | Flow cytometry, store at 4 °C |
| Pertussis toxin in glycerol | Hooke Laboratories Inc., Lawrence, MA, USA | BT-0105 | Active EAE induction; store at -20 °C |
| pluriStrainer Mini 100 μm | pluriSelect Life Science UG, Leipzig, Sachsen, Germany | 43-10100-40 | Flow cytometry |
| QuadroMACS Separator | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-090-976 | MACS |
| Recombinant Alexa Fluor 647 Anti-NeuN antibody (clone EPR12763) | Abcam, Cambridge, UK | EPR12763 | Flow cytometry, store at -20 °C |
| Stainless Steel Brain Matrices, 1 mm | Ted Pella, Redding, CA, USA | 15067 | CNS tissue dissection |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific,Waltham, MA, USA | 15250061 | Cell counting |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific,Waltham, MA, USA | 15575020 | Flow cytometry, store at room temperature |
References
- Trapp, B. D., Nave, K. A. Multiple Sclerosis: An Immune or Neurodegenerative Disorder. Annu Rev Neurosci. 31 (1), 247-269 (2008).
- Stys, P. K., Zamponi, G. W., van Minnen, J., Geurts, J. J. Will the real multiple sclerosis please stand up. Nat Rev Neurosci. 13 (7), 507-514 (2012).
- Korn, T. Pathophysiology of multiple sclerosis. J Neurol. 255 (Suppl 6), 2-6 (2008).
- Ward, M., Goldman, M. D. Epidemiology and Pathophysiology of Multiple Sclerosis. CONTINUUM. 28 (4), 988-1005 (2022).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin Oligodendrocyte Glycoprotein (MOG35-55) Induced Experimental Autoimmune Encephalomyelitis (EAE) in C57BL/6 Mice. J Vis Exp. (86), 51275 (2014).
- Bittner, S., et al. The TASK1 channel inhibitor A293 shows efficacy in a mouse model of multiple sclerosis. Exp Neurol. 238 (2), 149-155 (2012).
- Göbel, K., et al. Plasma kallikrein modulates immune cell trafficking during neuroinflammation via PAR2 and bradykinin release. Proc Natl Acad Sci U S A. 116 (1), 271-276 (2019).
- Ballerini, C. Experimental Autoimmune Encephalomyelitis. Methods Mol Biol. 2285, 375-384 (2021).
- Birmpili, D., Charmarke Askar, I., Bigaut, K., Bagnard, D. The Translatability of Multiple Sclerosis Animal Models for Biomarkers Discovery and Their Clinical Use. Int J Mol Sci. 23 (19), 11532 (2022).
- Tsatas, O., Ghasemlou, N. Isolation and RNA purification of macrophages/microglia from the adult mouse spinal cord. J Immunol Methods. 477, 112678 (2020).
- Calvo, B., Rubio, F., Fernández, M., Tranque, P. Dissociation of neonatal and adult mice brain for simultaneous analysis of microglia, astrocytes and infiltrating lymphocytes by flow cytometry. IBRO Rep. 8, 36-47 (2020).
- Diaz-Amarilla, P., et al. Isolation and characterization of neurotoxic astrocytes derived from adult triple transgenic Alzheimer's disease mice. Neurochem Int. 159, 105403 (2022).
- Galatro, T. F., Vainchtein, I. D., Brouwer, N., Boddeke, E. W. G. M., Eggen, B. J. L. Isolation of Microglia and Immune Infiltrates from Mouse and Primate Central Nervous System. Methods Mol Biol. 1559, 333-342 (2017).
- Altendorfer, B., et al. Transcriptomic Profiling Identifies CD8+ T Cells in the Brain of Aged and Alzheimer's Disease Transgenic Mice as Tissue-Resident Memory T Cells. J Immunol. 209 (7), 1272-1285 (2022).
- Lanfranco, M. F., Sepulveda, J., Kopetsky, G., Rebeck, G. W. Expression and secretion of apoE isoforms in astrocytes and microglia during inflammation. Glia. 69 (6), 1478-1493 (2021).
- Swire, M., Ffrench-Constant, C. Oligodendrocyte-Neuron Myelinating Coculture. Methods Mol Biol. 1936, 111-128 (2019).
- Park, J., Koito, H., Li, J., Han, A. Microfluidic compartmentalized co-culture platform for CNS axon myelination research. Biomed Microdevices. 11 (6), 1145-1153 (2009).
- Facci, L., Barbierato, M., Skaper, S. D. Astrocyte/Microglia Cocultures as a Model to Study Neuroinflammation. Methods Mol Biol. 1727, 127-137 (2018).
- Speicher, A. M., Wiendl, H., Meuth, S. G., Pawlowski, M. Generating microglia from human pluripotent stem cells: novel in vitro models for the study of neurodegeneration. Mol Neurodegener. 14 (1), 46 (2019).
- Homayouni Moghadam, F., et al. Isolation and Culture of Embryonic Mouse Neural Stem Cells. J Vis Exp. (141), 58874 (2018).
- Santos, R., et al. Differentiation of Inflammation-Responsive Astrocytes from Glial Progenitors Generated from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 8 (6), 1757-1769 (2017).
- Tcw, J., et al. An Efficient Platform for Astrocyte Differentiation from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 9 (2), 600-614 (2017).
- Miltenyi, S., Müller, W., Weichel, W., Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Huntemann, N., et al. An optimized and validated protocol for inducing chronic experimental autoimmune encephalomyelitis in C57BL/6J mice. J Neurosci Methods. 367, 109443 (2022).
- Martin, E., El-Behi, M., Fontaine, B., Delarasse, C. Analysis of Microglia and Monocyte-derived Macrophages from the Central Nervous System by Flow Cytometry. J Vis Exp. (124), 55781 (2017).
- Sarkar, S., et al. Rapid and Refined CD11b Magnetic Isolation of Primary Microglia with Enhanced Purity and Versatility. J Vis Exp. (122), 55364 (2017).
- Rodríguez Murúa, S., Farez, M. F., Quintana, F. J. The Immune Response in Multiple Sclerosis. Annu Rev Pathol. 17, 121-139 (2021).
- Engelhardt, B., Ransohoff, R. M. Capture, crawl, cross: the T cell code to breach the blood-brain barriers. Trends Immunol. 33 (12), 579-589 (2012).
- Elia, G. Biotinylation reagents for the study of cell surface proteins. Proteomics. 8 (19), 4012-4024 (2008).
- Berl, S., et al. Enrichment and isolation of neurons from adult mouse brain for ex vivo analysis. J Neurosci Methods. 283, 15-22 (2017).
- Turvy, D. N., Blum, J. S. Biotin Labeling and Quantitation of Cell-Surface Proteins. Curr Protoc Immunol. 18 (7), (2001).
- Mao, S. Y. Biotinylation of Antibodies. Methods Mol Biol. 115, 39-41 (1999).
- Kantzer, C. G., et al. Anti-ACSA-2 defines a novel monoclonal antibody for prospective isolation of living neonatal and adult astrocytes. Glia. 65 (6), 990-1004 (2017).
- Batiuk, M. Y., et al. An immunoaffinity-based method for isolating ultrapure adult astrocytes based on ATP1B2 targeting by the ACSA-2 antibody. J Biol Chem. 292 (21), 8874-8891 (2017).
- Pan, J., Wan, J. Methodological comparison of FACS and MACS isolation of enriched microglia and astrocytes from mouse brain. J Immunol Methods. 486, 112834 (2020).
- Donovan, J. A., Koretzky, G. A. CD45 and the immune response. J Am Soc Nephrol. 4 (4), 976-985 (1993).
- Hathcock, K. S., Hirano, H., Hodes, R. J. CD45 expression by murine B cells and T cells: Alteration of CD45 isoforms in subpopulations of activated B cells. Immunol Res. 12 (1), 21-36 (1993).
- Balogh, P., Tew, J. G., Szakal, A. K. Simultaneous blockade of Fc? receptors and indirect labeling of mouse lymphocytes by the selective detection of allotype-restricted epitopes on the kappa chain of rat monoclonal antibodies. Cytometry. 47 (2), 107-110 (2002).
- Becerril-García, M. A., et al. Langerhans Cells From Mice at Birth Express Endocytic- and Pattern Recognition-Receptors, Migrate to Draining Lymph Nodes Ferrying Antigen and Activate Neonatal T Cells in vivo. Front Immunol. 11, 744 (2020).
- Dent, M. A., Segura-Anaya, E., Alva-Medina, J., Aranda-Anzaldo, A. NeuN/Fox-3 is an intrinsic component of the neuronal nuclear matrix. FEBS Lett. 584 (13), 2767-2771 (2010).
- Duan, W., et al. Novel Insights into NeuN: from Neuronal Marker to Splicing Regulator. Mol Neurobiol. 53 (3), 1637-1647 (2016).
- Monteiro, R., Sivasubramanian, M. K., Balasubramanian, P., Subramanian, M. Obesity-Induced Sympathoexcitation is Associated with Glial Senescence in the Brainstem. FASEB J. 34 (S1), 1-1 (2020).
- Li, S., Chang, L., Teissie, J. . Electroporation protocols: mircroorganism, mammalian system, and nanodevice. , (2020).
- Kettenmann, H., Hanisch, U. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiol Rev. 91 (2), 461-553 (2011).
- Haage, V., et al. Comprehensive gene expression meta-analysis identifies signature genes that distinguish microglia from peripheral monocytes/macrophages in health and glioma. Acta Neuropathol Commun. 7 (1), 20 (2019).
- Kosior, N., Petkau, T. L., Connolly, C., Lu, G., Leavitt, B. R. Isolating cells from adult murine brain for validation of cell-type specific cre-mediated deletion. J Neurosci Methods. 328, 108422 (2019).
- Jurga, A. M., Paleczna, M., Kuter, K. Z. Overview of General and Discriminating Markers of Differential Microglia Phenotypes. Front Cell Neurosci. 14, 198 (2020).
- Man, S., Ubogu, E. E., Ransohoff, R. M. Inflammatory Cell Migration into the Central Nervous System: A Few New Twists on an Old Tale. Brain Pathol. 17 (2), 243-250 (2007).
- Schroeter, C. B., et al. One Brain-All Cells: A Comprehensive Protocol to Isolate All Principal CNS-Resident Cell Types from Brain and Spinal Cord of Adult Healthy and EAE Mice. Cells. 10 (3), 651 (2021).
- Sankowski, R., et al. Mapping microglia states in the human brain through the integration of high-dimensional techniques. Nate Neurosci. 22 (12), 2098-2110 (2019).
- Brennan, F. H., et al. Microglia coordinate cellular interactions during spinal cord repair in mice. Nat Commun. 13 (1), 4096 (2022).
- Enright, H. A., et al. Functional and transcriptional characterization of complex neuronal co-cultures. Sci Rep. 10 (1), 11007 (2020).
- Mofazzal Jahromi, M. A., et al. Microfluidic Brain-on-a-Chip: Perspectives for Mimicking Neural System Disorders. Mol Neurobiol. 56 (12), 8489-8512 (2019).
- Chin, E., Goh, E. Blood-brain barrier on a chip. Methods Cell Biol. 146, 159-182 (2018).
- Miccoli, B., Braeken, D., Li, Y. E. Brain-on-a-chip Devices for Drug Screening and Disease Modeling Applications. Curr Pharm Des. 24 (45), 5419-5436 (2019).
- Giandomenico, S. L., et al. Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output. Nat Neurosci. 22 (4), 669-679 (2019).
- Pellegrini, L., et al. Human CNS barrier-forming organoids with cerebrospinal fluid production. Science. 369 (6500), eaaz5626 (2020).
- Chhibber, T., et al. CNS organoids: an innovative tool for neurological disease modeling and drug neurotoxicity screening. Drug Discov Today. 25 (2), 456-465 (2020).
- Tang, X. Y., et al. Human organoids in basic research and clinical applications. Signal Transduct TargetTher. 7 (1), 168 (2022).
- Sutermaster, B. A., Darling, E. M. Considerations for high-yield, high-throughput cell enrichment: fluorescence versus magnetic sorting. Sci Rep. 9 (1), 227 (2019).
- Doughty, D., et al. Development of a novel purification protocol to isolate and identify brain microglia. Exp Biol Med. 247 (16), 1433-1446 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved