Isolamento Simultâneo dos Principais Tipos Celulares Residentes no Sistema Nervoso Central de Camundongos Adultos com Encefalomielite Autoimune
* These authors contributed equally
In This Article
Summary
Até o momento, os protocolos para o isolamento simultâneo de todos os principais tipos celulares residentes no sistema nervoso central do mesmo camundongo são uma demanda não atendida. O protocolo mostra um procedimento aplicável em camundongos ingênuos e experimentais com encefalomielite autoimune para investigar redes celulares complexas durante a neuroinflamação e, simultaneamente, reduzir o número necessário de camundongos.
Abstract
A encefalomielite autoimune experimental (EAE) é o modelo murino mais comum para esclerose múltipla (EM) e é frequentemente usada para elucidar melhor a etiologia ainda desconhecida da SM, a fim de desenvolver novas estratégias de tratamento. O modelo EAE do peptídeo glicoproteico oligodendrítico de mielina 35-55 (MOG35-55) reproduz um curso de doença monofásica autolimitada com paralisia ascendente dentro de 10 dias após a imunização. Os camundongos são examinados diariamente usando um sistema de pontuação clínica. A SM é conduzida por diferentes patomecanismos com um padrão temporal específico, de modo que a investigação do papel dos tipos celulares residentes no sistema nervoso central (SNC) durante a progressão da doença é de grande interesse. A característica única deste protocolo é o isolamento simultâneo de todos os principais tipos celulares residentes no SNC (microglia, oligodendrócitos, astrócitos e neurônios) aplicáveis em EAE adultos e camundongos saudáveis. A dissociação do cérebro e da medula espinhal de camundongos adultos é seguida pela classificação de células ativadas por magnetismo (MACS) para isolar microglia, oligodendrócitos, astrócitos e neurônios. A citometria de fluxo foi utilizada para realizar análises de qualidade das suspensões unicelulares purificadas, confirmando a viabilidade após o isolamento celular e indicando a pureza de cada tipo celular de aproximadamente 90%. Em conclusão, este protocolo oferece uma maneira precisa e abrangente de analisar redes celulares complexas em camundongos saudáveis e EAE. Além disso, o número necessário de camundongos pode ser substancialmente reduzido, pois todos os quatro tipos de células são isolados dos mesmos camundongos.
Introduction
A esclerose múltipla (EM) é uma doença inflamatória crônica autoimune do sistema nervoso central (SNC) caracterizada por desmielinização, dano axonal, gliose e neurodegeneração. Apesar das inúmeras abordagens de pesquisa nesse campo, a fisiopatologia da SM ainda não é totalmente compreendida 1,2,3,4. O modelo animal mais comum para investigação da SM é a encefalomielite autoimune experimental (EAE) induzida pelo peptídeo glicoproteico 35-55 (MOG35-55) induzida por encefalomielite autoimune (EAE) por oligodendrócitos, que compartilha muitas de suas características clínicas e fisiopatológicas5,6,7,8,9. Baseia-se na resposta do sistema imunológico contra antígenos específicos do SNC que levam à inflamação, desmielinização e degeneração neuroaxonal. A encefalomielite autoimune experimental (EAE) é um modelo adequado para a investigação de vias neuroinflamatórias e cascatas de sinalização encontradas na EM.
As opções terapêuticas atuais para a EM são apenas parcialmente eficazes e concentram-se principalmente na fase inflamatória inicial da doença. No entanto, o componente neurodegenerativo da SM parece ser o maior desafio para abordagens terapêuticas de longo prazo. Portanto, protocolos de isolamento celular reprodutíveis e precisos são necessários para investigar mecanismos moleculares e celulares em doenças autoimunes de forma abrangente. Mesmo que existam alguns protocolos para o isolamento de um único tipo celular 10,11,12,13,14,15, há uma necessidade não atendida do isolamento simultâneo de várias populações celulares residentes no SNC ao mesmo tempo. Protocolos prévios para o isolamento de células residentes no SNC carecem de preservar a funcionalidade e pureza celular, resultando em co-cultivo com células vizinhas 16,17,18 ou na inadequação para análises complexas de redes intracelulares ex vivo 19,20,21,22.
O objetivo deste protocolo foi estabelecer um método reprodutível e abrangente para o isolamento simultâneo de suspensões unicelulares viáveis puras de todos os principais tipos celulares residentes no SNC aplicáveis em camundongos adultos saudáveis e EAE. Os diferentes tipos celulares foram isolados utilizando-se a classificação de células ativadas por magnetismo (MACS)23. A separação celular pode ser realizada por seleção positiva, ou seja, marcação magnética de marcadores de superfície específicos do tipo celular, ou por seleção negativa via biotinilação e depleção de todas as células indesejadas. A citometria de fluxo foi aplicada para garantir uma pureza acima de 90% e uma viabilidade de pelo menos 80% das suspensões unicelulares isoladas.
Em conclusão, o objetivo principal foi estabelecer um protocolo para o isolamento simultâneo de todos os principais tipos celulares residentes no SNC como uma ferramenta versátil para a investigação de vias neuroinflamatórias, oferecendo uma análise abrangente e precisa de redes celulares complexas e cascatas de sinalização bioquímica em camundongos saudáveis e EAE.
Protocol
Todos os experimentos de EAE foram induzidos em camundongos fêmeas C57BL/6J com idade entre 10 e 12 semanas e aprovados pelas autoridades locais (Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen). O cumprimento da legislação alemã e de proteção animal da UE também foi assegurado em qualquer momento dos experimentos. Todos os camundongos foram mantidos em gaiolas ventiladas individualmente.
NOTA: Os seguintes volumes de reagentes referem-se a um cérebro murino adulto e medula espinhal, que são nomeados suspensão de células do SNC no seguinte e pesam aproximadamente cerca de 20 mg a 500 mg. Se a dissociação de mais de uma suspensão de células do SNC for planejada, todos os volumes e materiais de reagentes devem ser ampliados de acordo. Recomenda-se armazenar continuamente no gelo o soro fisiológico tamponada com fosfato de Dulbecco (D-PBS; 1x) com cálcio e magnésio, suplementado com 1 g/L de glicose e 36 mg/L de piruvato de sódio) continuamente no gelo durante todo o experimento. Se o cultivo celular for planejado posteriormente, execute todas as etapas em condições estéreis pelo uso de capuzes. Caso contrário, nenhuma das seções de protocolo a seguir precisa ser executada sob um capô. Guarde os tampões no gelo. Use apenas soluções pré-resfriadas e evite vórtices durante todo o experimento. Consulte a Figura 1 para ver o fluxo de trabalho geral.
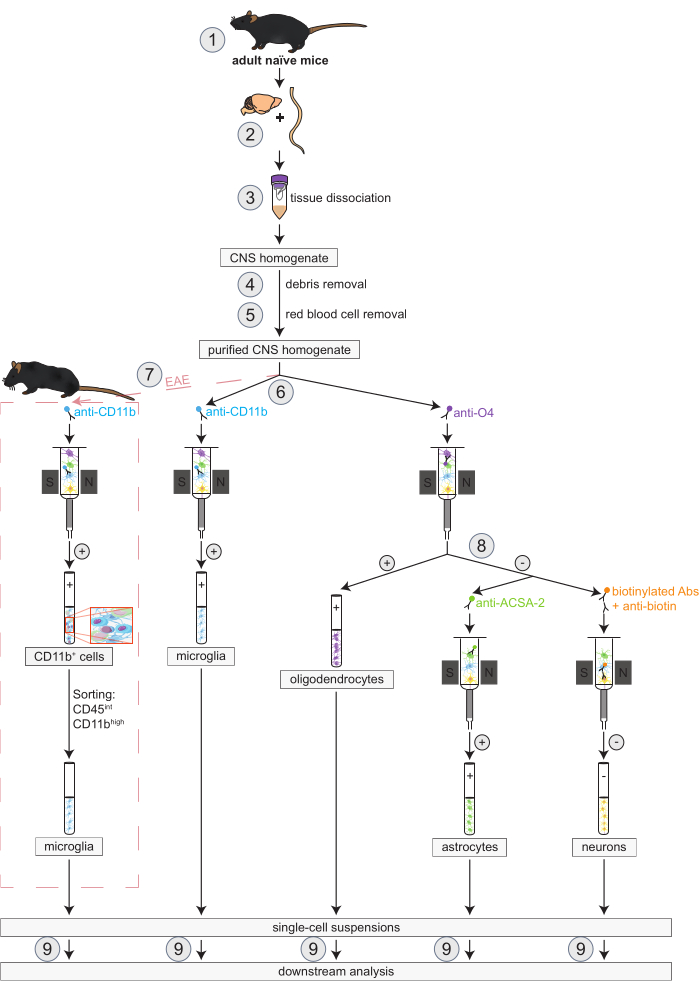
Figura 1: Fluxo de trabalho para o isolamento simultâneo de oligodendrócitos, microglia, astrócitos e neurônios em camundongos ingênuos e EAE. Os primeiros passos do fluxo de trabalho são os mesmos para ratos ingênuos e EAE. Se se deseja trabalhar com uma réplica de EAE, a indução de EAE deve ser realizada previamente (1). Em resumo, o protocolo inicia-se com a dissecção (2) e dissociação (3) do cérebro murino e medula espinhal, seguida da remoção de debris (4) e hemácias (5). Posteriormente, a suspensão de células purificadas do SNC resultante é dividida em duas frações para o isolamento simultâneo de oligodendrócitos e microglia via MACS (6). Microglias são detectadas via microesferas anti-CD11b, enquanto oligodendrócitos são isolados usando microesferas anti-O4 (seleções positivas). A partir do fluxo negativo dos oligodendrócitos (8), os astrócitos são isolados via microesferas anti-ACSA-2 (seleção positiva) e os neurônios por marcação de biotina e depleção de todas as células não-neuronais (seleção negativa). Em camundongos EAE, o isolamento de células CD11b+ é seguido pela classificação celular ativada por fluorescênciade células altas CD45intCD11b para eliminar outras células imunes CD11b+ como macrófagos, células dendríticas, monócitos, granulócitos e células natural killer que são conhecidas por participar de processos de neuroinflamação durante o curso de EAE (7)27,28,48. Após o isolamento dos diferentes tipos celulares residentes no SNC, análises de pureza podem ser realizadas (9). Abreviações: Abs = anticorpos; ACSA-2 = antígeno 2 de superfície celular dos astrócitos; CD11b = quinase dependente de ciclina 11B; CD45 = tirosina-proteína fosfatase C tipo receptor; SNC = sistema nervoso central; EAE = encefalomielite autoimune experimental; MACS = classificação de células ativadas por magnetismo; O4 = marcador oligodendrócito O4. Este número foi modificado de49. Clique aqui para ver uma versão maior desta figura.
1. Indução de EAE ativo
- Preparação de reagentes
- Para separação celular: Prepare o tampão PB e armazene-o a 2-8 °C por no máximo 1 semana. Para preparar a solução-mãe, adicionar 475 mL de 1x PBS sem suplementos (pH 7,2) + 25 mL de albumina de soro bovino (BSA) a 0,5%. Utilizar uma diluição de 1:20 preparada em BSA.
- Para citometria de fluxo e classificação celular ativada por fluorescência (FACS): Preparar o tampão FACS, PBS com soro fetal de bezerro a 2% (FCS) e EDTA 2 mM e armazená-lo a 2-8 °C. Para preparar, adicione 500 mL de 1x PBS sem suplementos e 10 mL de FCS + 2 mL de EDTA (a partir de estoque de EDTA 0,5 M)
- Realizar a imunização de acordo com o protocolo de Bittner e col. 5. Em resumo, induzir EAE por injeção subcutânea de uma emulsão contendo 200 μg de peptídeo MOG35-55 e 200 μL de adjuvante Freud completo, incluindo 200 μg de Mycobacterium tuberculosis.
- Anestesiar o camundongo com isoflurano a 2% utilizando uma câmara de anestesia com vaporizador de isoflurano. Use pomada veterinária nos olhos do animal para evitar o ressecamento durante a anestesia.
- Após 2 h, injetar uma injeção intraperitoneal de 100 ng de toxina pertussis (PTx) dissolvida em 100 μL de 1x PBS de acordo com o protocolo de Huntemann et al.24. Repetir a injeção de PTx no dia 2 após a imunização.
CUIDADO: Observe cada animal até que ele tenha recuperado a consciência suficiente para manter a decúbito esternal. Os ratos que foram submetidos aos procedimentos de injeção não são devolvidos à companhia dos outros ratos até que tenham se recuperado totalmente. Para Mycobacterium tuberculosis e PTx: Evitar inalação, ingestão e contato com a pele e olhos. O Mycobacterium tuberculosis é um ativador do sistema imune inato. PTx tem muitos efeitos biológicos. - Monitorar a progressão do EAE diariamente, realizado por dois pesquisadores cegos que monitoram o peso e examinam os camundongos clinicamente.
- Para isso, utilizou-se o seguinte sistema de pontuação: grau 0 - ausência de sinais clínicos de EAE, grau 1 - paresia parcial da cauda, grau 2 - paresia completa da cauda, grau 3 - fraqueza moderada dos membros posteriores, grau 4 - fraqueza completa dos membros posteriores e marcha atáxica, paraparesia leve grau 5, paraparesia grau 6, paraplegia grau 7, tetraparesia grau 8, tetraplegia grau 9, tetraplegia grau 9, e grau 10-óbito.
- Use os seguintes critérios de exclusão para participação adicional no escore clínico do experimento > 7 ou uma perda de peso superior a 20% do peso corporal inicial.
- Para a dissecção do cérebro e da medula espinhal, eutanasiar camundongos EAE no dia 16 após a indução de EAE, representando o máximo da doença.
2. Preparação do tecido do SNC (Duração: aproximadamente 10 min por camundongo)
- Após sacrificar camundongos com dióxido de carbono, iniciar com a perfusão transcárdica de cada camundongo com 20 mL de PBS 1x. Repetir novamente a perfusão com 20 mL de PBS 1x.
- Coloque o mouse em decúbito dorsal e fixe os membros com cânulas. Aplicar etanol 75% no corpo frontal do animal. Não são necessárias medidas adicionais de esterilidade nesse momento.
- Abra o abdome e o tórax fazendo uma secção longitudinal através da pele e da fáscia com a ajuda de uma tesoura.
- Corte as costelas lateralmente e dobre o tórax para ter livre acesso ao coração. Fixe o tórax dobrado para cima com cânulas.
- Abra o átrio direito com uma tesoura. Aplicar 20 ml de 1x PBS no ventrículo esquerdo com uma cânula para eliminar o sangue através do átrio direito incisado.
- Exponha o crânio cortando a pele no topo da cabeça murina através de uma seção longitudinal e desloque a pele ao redor da cabeça usando uma pinça. Incise o crânio com a ajuda de uma tesoura ao longo da sutura sagital.
- Insira a ponta de uma pinça ao longo da linha de incisão para abrir a calota. Remova as partes restantes da calota com pinça para que o cérebro fique totalmente exposto.
- Remova o cérebro cuidadosamente e coloque-o em uma matriz cerebral murina. Corte o cérebro em fatias sagitais de 1 mm de espessura usando uma lâmina de barbear.
- Corte a coluna vertebral com a ajuda de uma tesoura logo acima da crista ilíaca para que a seringa possa ser inserida no canal vertebral.
NOTA: A maneira mais fácil de remover a medula espinhal é liberá-la para fora do canal espinhal com PBS. Caso contrário, os arcos vertebrais devem ser abertos individualmente com tesoura e, em seguida, a medula espinhal pode ser removida. - Lavar a medula espinhal para fora do canal espinhal de caudal para cranial usando uma seringa de 20 mL com uma agulha de 20G contendo 1x PBS. Corte a medula espinhal em segmentos de 0,5 cm de comprimento usando um bisturi.
- Armazenar cada suspensão de células do SNC constituída pelo cérebro e pela medula espinhal correspondente numa placa de Petri separada por rato, preenchida com aproximadamente 3 ml de D-PBS frio. Guarde os pratos no gelo até processamento posterior.
3. Dissociação tecidual do SNC (Duração: aproximadamente 1-1,5 h dependendo do número de suspensões de células do SNC)
NOTA: O tecido neural de camundongos adultos é dissociado pela combinação de dissociação mecânica com degradação enzimática da matriz extracelular. Assim, a integridade estrutural permanece, e a suspensão celular pode ser usada para procedimentos adicionais de isolamento celular.
- Preparar o volume adequado da mistura enzimática 1 constituída por 50 μL de enzima P e 1.900 μL de tampão Z por suspensão de células do SNC. Ambos os reagentes pertencem ao kit de dissociação cerebral adulto.
- Preparar o volume adequado da mistura enzimática 2 constituída por 10 μL de enzima A e 20 μL de tampão Y por suspensão de células do SNC. Ambos os reagentes pertencem ao kit de dissociação cerebral adulto.
- Transfira 1.950 μL da mistura enzimática 1 para o tubo C e adicione os pedaços de tecido de uma suspensão de célula do SNC em seguida. Use um tubo C por mouse.
- Adicionar 30 μL de mistura enzimática 2 a cada tubo C. Feche bem os tubos C e prenda-os de cabeça para baixo na manga do dissociador de células com aquecedores.
- Execute o programa apropriado chamado 37C_ABDK_01 (leva 30 min). Observe pelo menos os primeiros 5 min do programa para garantir que todos os tubos girem na mesma velocidade. A ocorrência de erros durante a execução é possível. Em seguida, vá para a etapa 6.
- Nos últimos 2 min do programa, colocar um filtro de 70 μm em um tubo de 50 mL para cada suspensão de célula dissociada do SNC. Pré-umedecer esses filtros com 2 mL de D-PBS.
- Após o término do programa, conecte os tubos C do dissociador e coloque-os em uma centrífuga. Centrifugar as amostras a 300 x g e 4 °C durante 1 min para recolher a amostra no fundo do tubo.
- Ressuspenda a amostra e aplique-a no coador pré-umedecido. Adicionar 10 mL de D-PBS frio ao tubo C vazio e fechá-lo. Agite-o suavemente e aplique a suspensão no coador correspondente.
- Descarte os filtros e feche os tubos de 50 mL. Centrifugar novamente a suspensão celular a 300 x g e 4 °C durante 10 minutos. Depois, aspirar todo o sobrenadante com muito cuidado.
4. Remoção de detritos (Duração: Aproximadamente 1,5-2 h dependendo do número de suspensões de células do SNC)
NOTA: A dissociação tecidual geralmente leva a mielina e restos celulares que podem prejudicar a análise a jusante. Ao adicionar uma solução de remoção de detritos, esses detritos podem ser removidos eficientemente da suspensão de células do SNC.
- Ressuspender cuidadosamente o pellet de células com 3.100 μL de D-PBS para cada suspensão de células do SNC. Não vórtice.
- Se trabalhar com mais de uma suspensão de células do SNC, agrupe no máximo duas suspensões de células do SNC derivadas de uma condição ou grupo experimental em um tubo de 15 mL.
- Adicionar 900 μL da solução de remoção de detritos do kit de dissociação cerebral adulto a uma suspensão de células do SNC ou 1.800 μL de solução de remoção de detritos a duas suspensões de células do SNC agrupadas.
- Inverta o tubo e misture a suspensão. Em seguida, sobreponha suavemente com 4 mL de D-PBS frio. Um gradiente claro deve ser visível (Figura 2A).
- Centrifugar os tubos por 10 min a 3000 x g e 4 °C com aceleração total e sem freio.
- Se a separação ocorrer como pretendido, formam-se três fases (Figura 2C). Aspirar completamente as duas fases superiores (Figura 2C-1,2) e descartá-las. É importante que nenhum resíduo de mielina seja deixado para trás (Figura 2E).
NOTA: Se o gradiente não funcionou e as células são necessárias urgentemente, não sugue as duas fases superiores. Em vez disso, encha o tubo de 15 mL com D-PBS frio até 15 mL e inverta várias vezes. Centrifugar novamente a 1000 x g durante 10 minutos a 4 °C com aceleração total e sem travão. Sugue o sobrenadante e repita os passos 4.1- 4.4. - Encher o tubo com D-PBS frio até 14 mL e fechá-lo. Inverta o tubo poderosamente na bancada de trabalho até que o pellet de célula se desprenda do fundo do tubo. Não vórtice.
- Centrifugar novamente a amostra a 1000 x g e 4 °C durante 10 min. Ajuste a aceleração total e freio total. Aspirar o sobrenadante cuidadosa e completamente.

Figura 2: Do's e Dont's durante a remoção de detritos. (A) Exemplo positivo para o gradiente após sobreposição com 4 mL de PBS. A fase superior consistindo de 4 mL de PBS é claramente distinguível da fase inferior que consiste na suspensão de células do SNC com a solução de remoção de detritos. (B) Exemplo negativo para o gradiente após sobreposição com 4 mL de PBS. O gradiente não tem uma separação clara entre o PBS e a suspensão celular abaixo. Um pouco do PBS é difundido na suspensão celular. (C) Exemplo positivo para o gradiente após centrifugação. Três fases separadas podem ser facilmente distinguidas. Nenhum resíduo de mielina é visível na fase superior (1) ou inferior (3) do gradiente. A fase média contém toda a mielina (2). O pellet de células é visível no fundo do tubo de 15 mL. (D) Exemplo negativo para o gradiente após centrifugação. Não há separação precisa entre as três fases possíveis. Alguns resíduos de mielina são visíveis nas fases superior (1) e inferior (3) do gradiente. (E) Exemplo positivo para o gradiente após a aspiração das duas fases superiores. A amostra resultante contém apenas o pellet de células e um sobrenadante claro acima. Nenhum resíduo de mielina é deixado para trás. (F) Exemplo negativo para o gradiente após a aspiração das duas fases superiores. A amostra ainda contém alguns resíduos de mielina (seta preta). Abreviações: SNC = sistema nervoso central; PBS = solução salina tamponada com fosfato Clique aqui para ver uma versão maior desta figura.
5. Remoção de glóbulos vermelhos (Duração: Aproximadamente 1 h dependendo do número de suspensões de células do SNC)
NOTA: Esta etapa evita a contaminação posterior por glóbulos vermelhos e garante uma lise ideal de eritrócitos com efeito mínimo sobre os outros tipos de células isoladas do tecido do SNC. Os seguintes volumes são indicados para suspensões celulares derivadas de 100 mg a 1 g de tecido neuronal correspondente a dois cérebros de camundongos adultos e medula espinhal. Se estiver trabalhando com mais de duas suspensões de células do SNC, aumente a escala de todos os reagentes e volumes totais de acordo.
- Comece com a preparação de solução de remoção de glóbulos vermelhos (RBCRS): por duas suspensões de células do SNC agrupadas. Diluir 100 μL de solução estoque de remoção de hemácias (10x) do kit de dissociação cerebral adulto em 900 μL de ddH2O para atingir uma diluição final de 1:10.
- Conservar o RBCRS a 2-8 °C até à utilização. O descarte de restos não utilizados no final do dia.
- Ressuspender o pellet de células de até duas suspensões de células do SNC em 1 mL de RBCRS. Evite vórtices. Incubar a solução durante 10 min a 4 °C.
- Adicionar 10 mL de tampão PB frio a duas suspensões de células agrupadas. Centrifugar a amostra a 300 x g e 4 °C durante 10 min e aspirar completamente o sobrenadante a seguir.
- Ressuspender cada pastilha de célula de uma suspensão de célula do SNC em 80 μL de tampão PB pipetando lentamente para cima e para baixo. Assim, use 160 μL para ressuspender pellets celulares derivados de duas suspensões de células do SNC.
- Ao trabalhar com várias suspensões de células do SNC da mesma condição experimental, agrupe todas essas suspensões de células.
- Determine a contagem de células, por exemplo, usando uma câmara de contagem aprimorada. As suspensões celulares foram geralmente diluídas 1:50 em tampão PB, seguidas por uma diluição adicional de 1:10 em solução de azul de tripano a 0,4%.
6. Protocolo de esferas magnéticas em camundongos ingênuos e EAE (Duração: Aproximadamente 1 h)
- Rotular magneticamente os diferentes tipos de células do SNC com MicroBeads específicos para seu antígeno de superfície. Em seguida, coloque a suspensão celular na coluna e separe magneticamente as células marcadas retidas dentro da coluna e as células não marcadas que atravessam.
- Depois de remover a coluna do campo magnético, libere as células marcadas magneticamente da coluna em um tubo como a fração de célula positivamente selecionada.
NOTA: Os volumes para o processo de marcação magnética são calculados para até 1 x 107 células totais. Se mais células forem obtidas, aumente todos os volumes reagentes e totais de acordo. Recomenda-se trabalhar rápido e usar apenas soluções pré-resfriadas para evitar o fechamento de anticorpos na superfície celular e marcação celular inespecífica, bem como para garantir uma alta viabilidade das populações celulares isoladas. Também é importante realizar as etapas de lavagem assim que o reservatório da coluna estiver vazio, adicionando o tampão PB para que as colunas não sequem. - Dividir a suspensão de células purificadas não diluídas do SNC em duas fracções para os seguintes isolamentos de micróglia e oligodendrócitos. A razão de ambas as frações depende da contagem de células desejada de cada tipo celular.
NOTA: Mais detalhes (duração da incubação, etapas detalhadas do protocolo, volumes, reagentes e método de contagem de células) são indicados na Tabela 1.
Tabela 1: Fluxo de trabalho para a marcação magnética simultânea e isolamento de oligodendrócitos e microglia de camundongos virgens e EAE. Ambos os tipos celulares são isolados através de uma seleção positiva. As etapas listadas na mesma linha são indicadas para serem executadas de uma só vez. Abreviações: CD11b = quinase dependente de ciclina 11B; EAE = encefalomielite autoimune experimental; FcR = proteína semelhante ao receptor Fc; O4 =marcador oligodendrócito O4. Clique aqui para baixar esta tabela.
7. Alteração do protocolo: triagem adicional para o isolamento de micróglia em camundongos EAE (Duração: Aproximadamente 1,5-2 h)
NOTA: Ao trabalhar com camundongos EAE, é necessário complementar o protocolo de isolamento celular baseado em MACS pelo FACS para remover populações de células CD11b+ que não sejam micróglias (por exemplo, monócitos, macrófagos, células natural killer, granulócitos ou células dendríticas) da fração de células CD11b+ . Caso contrário, esta etapa pode ser ignorada.
- Preparar a mistura mestre de coloração contendo 1x PBS suplementado com CD11b FITC (clone M1/70, 1:50) e CD45 APC/Cy7 (clone 30-F11, 1:200). Use 100 μL da mistura mestre de coloração por 5 x 106 células. Vórtice todos os anticorpos antes de usar.
- Centrifugar a suspensão de células da micróglia a 300 x g e 4 °C durante 10 minutos e aspirar cuidadosamente o sobrenadante.
- Ressuspender o pellet de células com 100 μL da mistura mestre de coloração preparada por 5 x 106 células. Incubar durante 15 minutos no escuro à temperatura ambiente (TR).
- Parar a reacção adicionando 500 μL de PBS e centrifugar novamente a amostra a 300 x g e 4 °C durante 10 min.
- Aspirar cuidadosamente o sobrenadante e ressuspender o pellet celular com 1x PBS suplementado com 10 μg/mL de DNAse para atingir uma concentração final de 1 x 107 células por mL. Conservar as células a 4 °C até ao início da triagem.
- Aplique a suspensão celular em um filtro de 100 μm colocado em um novo tubo FACS imediatamente antes de iniciar a triagem.
- Defina a taxa de fluxo para 1000 eventos por segundo e use o bocal de 100 μm. Classificar a população celular desejadade células altas CD45intCD11b em um novo tubo de 15 mL preparado com 1x PBS no TR.
8. Preparação de flow-through negativo de oligodendrócitos para o isolamento de neurônios e astrócitos (Duração: Aproximadamente 1 h)
NOTA: O fluxo negativo de oligodendrócitos da etapa 6 é coletado para isolamento adicional de neurônios e astrócitos. Para isso, a suspensão celular é dividida em duas partes. Devido ao isolamento prévio dos oligodendrócitos da suspensão celular do SNC, minimiza-se a contaminação por células O4+ que seria observada de outra forma.
- Centrifugar o fluxo negativo dos oligodendrócitos a 300 x g e 4 °C durante 10 min e aspirar cuidadosamente o sobrenadante.
- Ressuspender o pellet de células em 80 μL de tampão PB por suspensão de células do SNC previamente utilizadas para o isolamento da fração positiva de oligodendrócitos.
- Conte as células. Realizar a contagem das células assumidas como O4- usando uma câmara de contagem melhorada após diluir a suspensão celular 1:50 em tampão PB seguida de uma diluição adicional de 1:10 em azul de tripano a 0,4%.
- Dividir a suspensão celular purificada não diluída em duas frações para o seguinte isolamento simultâneo de neurônios e astrócitos. A proporção de ambas as frações depende da quantidade preferida de cada tipo celular.
NOTA: Mais detalhes (duração da incubação, etapas detalhadas do protocolo, volumes, reagentes e método de contagem celular) são indicados na Tabela 2.
Tabela 2: Fluxo de trabalho para a marcação magnética simultânea e isolamento de neurônios e astrócitos de camundongos ingênuos e EAE. Ambos os tipos celulares são isolados do fluxo negativo de oligodendrócitos. Os astrócitos são separados como uma seleção positiva via microesferas anti-ACSA-2, enquanto os neurônios são purificados via biotinilação e depleção de todas as células não-neuronais como uma seleção negativa. As etapas listadas na mesma linha são indicadas para serem executadas de uma só vez. Abreviações: Anti-ACSA-2 = astrocyte cell surface antigen-2; EAE = encefalomielite autoimune experimental; FcR = proteína semelhante ao receptor Fc; MACS = classificação de células ativadas por magnetismo. Clique aqui para baixar esta tabela.
9. Análise da pureza dos tipos celulares isolados residentes no SNC (Duração: Aproximadamente 2 h)
NOTA: A realização de citometria de fluxo de todas as quatro populações de células residentes no SNC isoladas é recomendada para medir e comparar suas purezas e viabilidade. Portanto, é necessário corar todos os tipos celulares com um anticorpo marcado com fluoróforo. A coloração de células vivas/mortas é implementada usando um corante de viabilidade fixável (1:10.000).
- Painel de pureza - protocolo de coloração extracelular
- Use 1 x 105 células dissolvidas em 50 μL de PBS por coloração.
- Preparar a mistura mestre de coloração dissolvida em PBS com 2% FCS/2 mM EDTA consistindo dos seguintes anticorpos monoclonais conjugados com fluorocromo visando marcadores de superfície específicos do tipo celular: CD11b FITC (clone 1/70, 1:100)25,26,27,28, Biotina-PE (clone Bio3-18E7, 1:200)29,30,31,32, ACSA-2 PE-Vio615 (clone REA-969, 1:200)33,34,35, O4 APC (clone REA-576, 1:400) e CD45 BV510 (clone 30-F11, 1:150)36,37. Adicionar 1 μg de anti-CD16/32 por 1 x 106 células para bloquear o receptor Fc3 8,39. Vórtice todos os anticorpos antes do uso.
- Centrifugar a suspensão celular durante 5 min a 540 x g e 4 °C e aspirar cuidadosamente o sobrenadante.
- Ressuspender o pellet celular em 100 μL da respectiva mistura mestra e incubar a amostra por 15 min em RT no escuro.
- Lavar as células com 500 μL de 1x PBS com 2% FCS/2 mM EDTA e centrifugar a amostra durante 5 min a 540 x g e 4 °C.
- Aspirar o sobrenadante e ressuspender o pellet celular com 70 μL de 1x PBS com 2% FCS/2 mM EDTA.
- Vórtice a amostra para dissociar completamente a pelota celular. Posteriormente, a amostra está pronta para análise por citometria de fluxo.
- Painel de pureza - protocolo de coloração intracelular com NeuN
- Utilizar 1 x 105 células de cada população celular para coloração intracelular de NeuN, que é um marcador nuclear neuro-específico 40,41. Esta é uma maneira adicional de manchar neurônios viáveis.
- Transfira 1 x 105 células de cada população celular para um tubo FACS. Adicionar 1 mL de PBS com 2% FCS/2 mM EDTA por tubo. Centrifugar os tubos a 540 x g e 4 °C durante 5 min.
- Enquanto isso, preparar a mistura mestre dissolvida em PBS com 2% de FCS/2 mM EDTA consistindo dos seguintes anticorpos monoclonais conjugados ao fluorocromo visando marcadores de superfície específicos do tipo celular: CD11b FITC (clone M1/70, 1:100)25,26,27,28, Biotina-PE (clone Bio3-18E7, 1:200)29,30,31,32, ACSA-2 PE-Vio615 (clone REA-969, 1:200)33,34,35 e CD45 BV510 (clone 30-F11, 1:150)36,37.
- Aspirar o sobrenadante e ressuspender as células em 100 μL da mistura mestre preparada e incubar a amostra por 10 min em RT no escuro.
- Lavar as células com 100 μL de PBS com 2% FCS/2 mM EDTA e centrifuga-las novamente a 540 x g e 4 °C durante 5 min.
- Enquanto isso, prepare 200 μL da solução de fixação/permeabilização: Adicionar 50 μL do estoque concentrado de concentrado de fixação/permeabilização a 150 μL de diluente de fixação/permeabilização para atingir uma diluição final de 1:4.
- Aspirar o sobrenadante e ressuspender as células em 100 μL de solução de fixação/permeabilização 1x. Incubar a amostra durante 30 min a 4 °C.
- Enquanto isso, prepare 1 mL de tampão de permeabilização/lavagem 1x adicionando 100 μL do estoque tampão de permeabilização a 900 μL de ddH2O para atingir uma diluição final de 1:10.
- Lavar as células 1x com 100 μL de 1x tampão de permeabilização/lavagem e centrifugar a amostra a 540 x g e 4 °C durante 5 min.
- Enquanto isso, prepare outra mistura mestra em 1x tampão de permeabilização/lavagem consistindo apenas de NeuN (NeuN AF647, clone EPR12763, 1:200) e 1 μg de anti-CD16/32 por 106 células para bloquear o receptor Fc.
- Aspirar o sobrenadante. Ressuspender as células fixas e permeabilizadas em 50 μL da segunda mistura master e incubar por 30 min a 4 °C.
- Lavar a amostra com 100 μL de 1x permeabilização/tampão de lavagem e centrifugar a 540 x g e 4 °C durante 5 min.
- Eliminar o sobrenadante e ressuspender o pellet celular em 70 μL de PBS com 2% FCS/2 mM EDTA. Posteriormente, a amostra está pronta para a análise por citometria de fluxo.
- Após a configuração do painel no citômetro de fluxo, adquira células para análise de pureza usando um software de análise de citometria de fluxo.
10. Análise estatística
- Realizar análises estatísticas e projetar gráficos com um programa de análise gráfica. Os dados são apresentados como média ± MEV.
Representative Results
O protocolo atual oferece a possibilidade de isolar simultaneamente todas as principais células residentes no SNC, ou seja, micróglia, oligodendrócitos, astrócitos e neurônios de uma única réplica do SNC. Isto é importante para a redução do número de ratinhos necessários para este tipo de experiências e para garantir a comparabilidade das análises moleculares e bioquímicas a nível celular. Se os tipos celulares individuais são isolados de diferentes réplicas do SNC, as interações celulares não podem ser mapeadas com veracidade e possíveis desvios técnicos durante os processos de isolamento podem enviesar análises a jusante. Além disso, os achados moleculares e bioquímicos de cada tipo celular não seriam comparáveis entre si, pois não são derivados do mesmo contexto EAE. Um protocolo MACS pré-existente utilizando um sistema/kit comercial foi adaptado para permitir o isolamento simultâneo dos tipos celulares acima mencionados.
O isolamento da micróglia foi realizado com microesferas anti-CD11b, oligodendrócitos foram isolados via microesferas anti-O4 (Tabela 1) e microesferas anti-ACSA-2 foram utilizadas para isolar os astrócitos (Tabela 2). Em contraste, o isolamento dos neurônios representa uma seleção negativa e foi realizado por biotinilação e marcação magnética de todas as células não neuronais (Tabela 2). Todas as células não neuronais (por exemplo, oligodendrócitos, micróglia, astrócitos, células endoteliais e fibroblastos), exceto as células sanguíneas, podem ser marcadas magneticamente usando um anticorpo conjugado à biotina, especificamente direcionado contra um antígeno de superfície expresso nessas células não neuronais (Tabela 2). Pela depleção dessas células não-neuronais marcadas magneticamente, populações de células neuronais altamente puras e viáveis podem ser geradas 30,42,43.
Dois novos painéis de citometria de fluxo para as análises de pureza das suspensões unicelulares geradas foram projetados. Aqui, marcadores de superfície e nucleares específicos do tipo celular combinados com discriminação de células vivas/mortas foram usados.
Os rendimentos celulares resultantes por camundongo e tipo de célula (Figura 3A) foram analisados e resultaram em uma média de 8. 4 x 105 ± 3 x 104 microglia, 3,23 x 106 ± 1 x 105 oligodendrócitos, 8,6 x 105 ± 2 x 104 astrócitos e 4,5 x 105 ± 1 x 104 neurônios por camundongo ingênuo.
No contexto do objetivo de investigar modelos patológicos de neuroinflamação, o protocolo também foi aplicado a um modelo murino de EAE. Os camundongos foram eutanasiados no 16º dia após a indução com EAE, representando o máximo da doença. Neste cenário EAE, aproximadamente 2,9 x 106 ± 6,7 x 105 oligodendrócitos, 5,2 x 105 ± 9 x 104 astrócitos e 4,4 x 105 ± 4 x 104 neurônios foram isolados. O rendimento de células da microglia foi reduzido para aproximadamente 1,7 x 105 ± 4 x 104 microglia por camundongo EAE devido à classificação celular adicional após as etapas MACS (Figura 3A).
Após o isolamento, as caracterizações fenotípicas das diferentes populações celulares por citometria de fluxo provaram que suspensões unicelulares viáveis com pureza de aproximadamente 90% para todos os principais tipos celulares residentes no SNC (Figura 3B) poderiam ser obtidas. As micróglias foram classificadas como CD45intCD11belevadas, conforme definido na literatura 44,45,46,47.
No EAE, a microglia teve que ser separada de todas as células CD11b+ para diferenciá-las de outras células imunes CD11b+, como monócitos, neutrófilos, células natural killer, granulócitos e macrófagos que imigram para o SNC durante a neuroinflamação 27,28,48. Portanto, as microglias foram classificadas como células CD45intCD11altas da suspensão de células CD11b+. Toda a estratégia de classificação da micróglia está representada na Figura 4. Em camundongos virgens, a população de micróglia foi de 91,16% de todas as células únicas vivas (96% da população CD11b+ total) (Figura 4A). Em camundongos EAE, a população de micróglia foi de 46,85% de todas as células únicas vivas (55% da população CD11b+ total) (Figura 4B). Embora ambos os procedimentos MACS e FACS apliquem estresse mecânico às células isoladas, 75,41% ± 8,63% das micróglias purificadas selecionadas foram viáveis (Figura 3B).
Astrócitos e neurônios que foram diretamente isolados da suspensão inicial de células do SNC mostraram contaminação relevante com oligodendrócitos, o que levou à suposição de que o isolamento simultâneo de neurônios e astrócitos do fluxo negativo de oligodendrócitos poderia prevenir essa contaminação. A análise por citometria de fluxo confirmou que os astrócitos isolados do flow-through negativo dos oligodendrócitos apresentaram pureza de 89,23% ± 2,78% e demonstraram viabilidade de 80,56% ± 1,41%. Semelhante a esses resultados, a pureza dos neurônios isolados da fração célula O4- foi de 81,25% ± 3,31% e a viabilidade foi de 83,90% ± 2,61% (Figura 3B). Esses achados também confirmam que o isolamento simultâneo desses dois tipos celulares somente posteriormente ao isolamento de oligodendrócitos não tem impacto na quantidade de células funcionais viáveis.
Os resultados quanto à viabilidade e pureza das suspensões unicelulares isoladas foram muito semelhantes em camundongos EAE em comparação com aqueles recebidos em camundongos virgens, confirmando que este protocolo é adequado para camundongos saudáveis, bem como no contexto de EAE (Figura 3B).
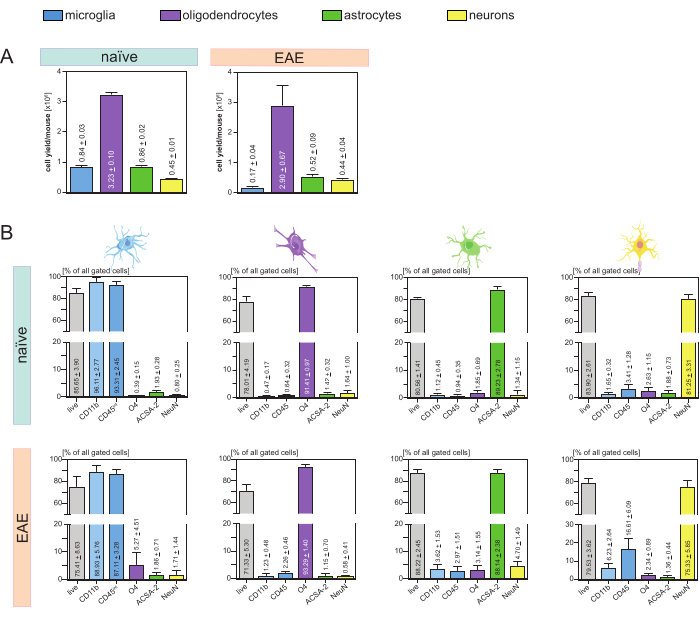
Figura 3: Rendimento celular e validação baseada em citometria de fluxo de células residentes isoladas no SNC. (A) Rendimentos celulares por camundongo e tipo celular após isolamento de células residentes no SNC em camundongos virgens e EAE. Os gráficos de barras visualizam a quantidade de rendimentos celulares por camundongo e tipo de célula após a implementação do protocolo apresentado. Cinco réplicas biológicas foram processadas para os resultados em camundongos virgens e quatro réplicas biológicas foram analisadas em camundongos EAE. Respectivos meios ± SEMs são representados. (B) Análises correspondentes de pureza e viabilidade das frações celulares purificadas. Os gráficos de barras indicam a viabilidade e a pureza das suspensões unicelulares resultantes com base na sua expressão de marcadores específicos do tipo de célula. NeuN foi usado como um marcador nuclear específico do tipo celular para neurônios. Cinco réplicas biológicas foram adquiridas e comparadas para cada tipo celular para camundongos saudáveis e EAE. Indicam-se os respectivos meios ± MEV. Abreviações: Anti-ACSA-2 = astrocyte cell surface antigen-2; CD11b = quinase dependente de ciclina 11B; CD45 = tirosina-proteína fosfatase C tipo receptor; SNC = sistema nervoso central; EAE = encefalomielite autoimune experimental; MACS = classificação de células ativadas por magnetismo; NeuN =proteína ligadora de RNA fox-1 homóloga 3; O4 = marcador oligodendrócito O4; EPM = erro padrão da média. Este número foi modificado de49. Clique aqui para ver uma versão maior desta figura.
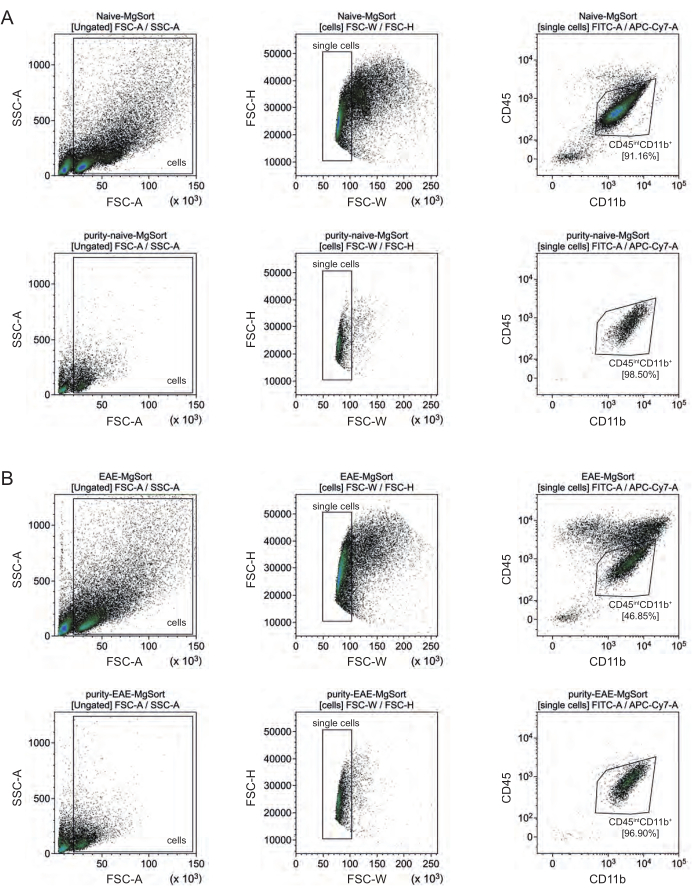
Figura 4: Estratégia de gating para triagem celular da micróglia após isolamento de células CD11b+. (A) Estratégia de gating em camundongos ingênuos e (B) EAE. A linha superior de cada painel mostra gráficos de pontos antes da classificação e a linha inferior após a classificação. Após a seleção de células vivas (SSC-A / FSC-A) e únicas (FCS-H / FSC-W), a população de células CD45intCD11b+ foi classificada como população de micróglia. Clique aqui para ver uma versão maior desta figura.
Discussion
Até o momento, métodos para mapear células residentes no SNC ex vivo, combinando espectrometria de massa e sequenciamento de RNA, oferecem um perfil celular muito preciso em saúde e doença, mas requerem conhecimento técnico ambicioso e experiência neste campo50,51. Além disso, não permitem análises funcionais e são muito caros. Além disso, sistemas microfluídicos cérebro-em-um-chip fornecem uma triagem rápida e acessível para mecanismos de doença e teste de novas abordagens terapêuticas com restrição de crescimento e migração celular 52,53,54,55. Os organoides do SNC também podem representar uma alternativa equivalente no futuro para a investigação de modelagem celular, conexões intercelulares e interações durante o curso da doença 56,57,58,59. Entretanto, a classificação de células ativadas por fluorescência e magnetismo são atualmente os métodos mais eficazes para gerar suspensões unicelulares puras e viáveis ex vivo 35,60,61. Mesmo que outros protocolos de fabricação estabelecidos para o isolamento de tipos celulares residentes no SNC sejam semelhantes em relação às etapas individuais do isolamento magnético e à dissociação celular prévia, eles devem ser realizados para cada tipo celular separadamente. Por outro lado, o protocolo atual integra diferentes métodos de isolamento para cada tipo de célula residente no SNC em um contexto lógico para que possam ser realizados simultaneamente de uma só vez e a partir de uma única suspensão de células do SNC (Tabela 1, Tabela 2). Assim, possibilita análises multi-ômicas a partir de uma única suspensão celular do SNC e, eventualmente, a exploração de redes neuronais complexas. Mesmo que não seja obrigatório agrupar vários tecidos de vários animais para realizar este protocolo, este agrupamento garante um número adequado de células isoladas para uma análise posterior a jusante. O uso de diferentes camundongos para o isolamento dos tipos de células isoladas excluiria a possibilidade de analisar potenciais interações celulares. Além disso, a combinação de métodos individuais de isolamento para os diferentes tipos de células do SNC, que seguem uma dissociação prévia do SNC, economiza custos de material usando uma suspensão dissociada de células do SNC para todos os passos de isolamento magnético que seguem. Além disso, um potencial viés técnico causado pelo uso de diferentes camundongos é minimizado.
Uma limitação do protocolo pode ser o uso quase exclusivo de camundongos fêmeas C57BL/6J. O protocolo de imunização EAE foi projetado e estabelecido para camundongos fêmeas, de modo que este protocolo de isolamento celular também foi implementado em camundongos fêmeas C57BL/6J. No entanto, camundongos machos virgens também foram usados durante o desenvolvimento deste protocolo, sem reconhecer qualquer efeito sobre o número de células ou purezas resultantes. Outra restrição afeta o isolamento de células magnéticas de neurônios, pois não existem microesferas específicas para o isolamento de neurônios em termos de uma seleção positiva. Assumiu-se que uma suspensão unicelular pura poderia ser obtida via marcação com biotina e depleção de todas as células não neuronais (Tabela 2). Essa suposição foi verificada pelo uso do NeuN como marcador nuclear específico para neurônios, integrado ao referido painel de pureza da citometria de fluxo. Outra limitação diz respeito ao isolamento da micróglia em camundongos EAE. Aqui, os rendimentos celulares resultantes são diminuídos em comparação com os outros tipos de células devido à etapa de classificação adicional após o protocolo MACS. Além disso, pode-se argumentar que a classificação aumenta o estresse mecânico da micróglia em comparação com as outras populações celulares. Estratégias de classificação individuais podem levar a diferentes quantidades de rendimento celular. Se o número de células isoladas for menor do que o esperado ou desejado, recomenda-se ajustar a configuração do confinamento e/ou melhorar a discriminação vivo/morto.
Uma etapa crítica no protocolo representa a remoção de detritos. O gradiente deve ser colocado em camadas muito lenta e suavemente para criar as três fases separadas desejadas (Figura 2A). Somente se a mielina e outros resíduos de detritos nas duas fases superiores forem totalmente removidos (Figura 2E), suspensões unicelulares puras podem ser geradas, e a contaminação adicional pode ser reduzida. Se as suspensões celulares resultantes não tiverem pureza, esta é provavelmente a seção do protocolo que deve ser melhorada primeiro ao lado da garantia do uso correto de todas as micro-contas.
Receber altos níveis de pureza e viabilidade pode ser um desafio nesse tipo de experimento. Algumas recomendações para solução de problemas são:
-O trabalho em condições estéreis é obrigatório para evitar a contaminação das diferentes microesferas e permitir o uso repetido, especialmente para cultivo posterior.
-A rotulagem de cada tubo para evitar misturas é altamente recomendada.
-Evite o uso de reagentes/buffers não resfriados. Armazenar todas as suspensões de células no gelo durante todo o experimento para garantir alta viabilidade.
-Mantenha o tempo entre as diferentes etapas de trabalho o mais curto possível. Não há nenhuma parte específica no protocolo em que a pausa do experimento seja recomendada.
-É altamente relevante aderir aos períodos de incubação especificados.
Em conclusão, este protocolo atual para o isolamento simultâneo de todos os principais tipos celulares residentes no SNC a partir de uma réplica do SNC oferece a possibilidade de analisar redes neuronais complexas e vias neuroinflamatórias ex vivo a partir de uma suspensão de células do SNC. Assim, as células residentes no SNC podem ser investigadas durante diferentes estágios do curso da doença, por exemplo, durante a neuroinflamação, neurodegeneração e/ou remissão no EAE. Além disso, as interações célula-célula e as vias bioquímicas podem ser estudadas em nível individual e a variabilidade dentro dos grupos experimentais pode ser reduzida. Há também a oportunidade de cultivar frações das células isoladas do SNC em monoculturas para posterior ensaios funcionais e validação. Tudo em um, este protocolo oferece avanços significativos que potencialmente afetam as abordagens de pesquisa pré-clínica e clínica.
Disclosures
Todos os autores declaram não haver conflitos de interesse.
Acknowledgements
As figuras foram criadas usando Adobe Illustrator (versão 2023) e Servier Medical Art (https://smart.servier.com). Antonia Henes foi apoiada por Jürgen Manchot Stiftung.
Materials
| Name | Company | Catalog Number | Comments |
| 70 μm cell strainers | Corning, MA, USA | 352350 | CNS tissue dissociation |
| ACSA-2 Antibody, anti-mouse, PE-Vio 615 (clone REA-969) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-116-244 | Flow cytometry, store at 4 °C |
| Adult Brain Dissociation Kit, mouse, and rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-107-677 | Tissue dissociation,contains debris and red blood cell removal solutions; prepare aliquots of enzyme A and P upon arrival and store them at -20 °C; store the remaining kit at 4 °C |
| Anti-ACSA-2 MicroBead Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-097-678 | MACS of astrocytes, store at 4 °C |
| Anti-mouse CD16/32 antibody | BioLegend, London, UK | 101301 | Flow cytometry, store at 4 °C |
| Anti-O4 MicroBeads, human, mouse, rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-094-543 | MACS of oligodendrocytes, store at 4 °C |
| AstroMACS Separation buffer | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-221 | MACS of astrocytes, store at 4 °C |
| Biotin Antibody, PE (clone Bio3-18E7) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-113-853 | Flow cytometry, store at 4 °C |
| BRAND Neubauer counting chamber | Thermo Fisher Scientific,Waltham, MA, USA | 10195580 | Cell counting |
| Brilliant Violet 510 anti-mouse CD45 Antibody (clone 30-F11) | BioLegend, London, UK | 103137 | Flow cytometry, store at 4 °C |
| CD11b MicroBeads, human, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-049-601 | MACS of microglia, store at 4 °C |
| DNAse I, recombinant, Rnase-free | Merck KGaA, Darmstadt, Germany | 4716728001 | Flow cytometry, store at -20° C |
| D-PBS with Calcium, Magnesium, Glucose, Pyruvat | Thermo Fisher Scientific,Waltham, MA, USA | 14287080 | Buffer, store at 4 °C |
| D-PBS, without calcium, without magnesium | Thermo Fisher Scientific,Waltham, MA, USA | 14190250 | Buffer, store at 4 °C |
| eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher Scientific,Waltham, MA, USA | 65-0865-14 | Flow cytometry, store at 4 °C |
| eBioscience Foxp3/Transcription factor staining buffer set | Thermo Fisher Scientific,Waltham, MA, USA | 00-5523-00 | Flow cytometry, store at 4°C |
| Falcon (15 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 11507411 | Cell tube |
| Falcon (50 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 10788561 | Cell tube |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Thermo Fisher Scientific,Waltham, MA, USA | 08-771-23 | Flow cytometry |
| FcR Blocking Reagent, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-092-575 | MACS of oligodendrocytes, store at 4 °C |
| Female C57BL/6J mice | Charles River Laboratories, Sulzfeld, Germany | Active EAE induction | |
| Fetal calf serum (FCS) | Merck KGaA, Darmstadt, Germany | F2442-50ML | Flow cytometry, store at -5 to -20 °C |
| FITC Rat Anti-CD 11b (clone M1/70) | BD Biosciences, San Jose, CA, USA | 553310 | Flow cytometry, store at 4 °C |
| Freund’s Complete adjuvant | Merck KGaA, Darmstadt, Germany | AR001 | Active EAE induction, store at 4 °C |
| GentleMACS C Tubes | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-093-237 | CNS tissue dissociation |
| GentleMACS Octo Dissociator with Heaters | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-096-427 | CNS tissue dissociation |
| Graphpad Prism 8.4.3 | Graphpad by Dotmatics | Graphical Analysis | |
| Isoflurane | AbbVie, North Chicago, IL, USA | Active EAE induction, store at 4 °C | |
| Kaluza Analysis Software V2.1.1 | Beckman Coulter, Indianapolis, IN, USA | Flow cytometry analysis | |
| LS Columns | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-401 | MACS |
| MACS BSA Stock Solution | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-376 | PB-buffer |
| MACS MultiStand | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-303 | MACS |
| MOG35–55 peptide | Charité, Berlin, Germany; alternatives: Genosphere Biotechnologies (Paris, France) or sb-Peptide (Saint Egrève, France) | Active EAE induction, store at -20 °C | |
| Mycobacterium tuberculosis strain H37 Ra | Becton, Dickinson and Company (BD),Franklin Lakes, NJ, USA | Active EAE induction, store at 4 °C | |
| Neuron Isolation Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-115-390 | MACS of neurons, store at 4 °C |
| O4 Antibody, anti-human/mouse/rat, APC, (clone REA-576) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-119-897 | Flow cytometry, store at 4 °C |
| Pertussis toxin in glycerol | Hooke Laboratories Inc., Lawrence, MA, USA | BT-0105 | Active EAE induction; store at -20 °C |
| pluriStrainer Mini 100 μm | pluriSelect Life Science UG, Leipzig, Sachsen, Germany | 43-10100-40 | Flow cytometry |
| QuadroMACS Separator | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-090-976 | MACS |
| Recombinant Alexa Fluor 647 Anti-NeuN antibody (clone EPR12763) | Abcam, Cambridge, UK | EPR12763 | Flow cytometry, store at -20 °C |
| Stainless Steel Brain Matrices, 1 mm | Ted Pella, Redding, CA, USA | 15067 | CNS tissue dissection |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific,Waltham, MA, USA | 15250061 | Cell counting |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific,Waltham, MA, USA | 15575020 | Flow cytometry, store at room temperature |
References
- Trapp, B. D., Nave, K. A. Multiple Sclerosis: An Immune or Neurodegenerative Disorder. Annu Rev Neurosci. 31 (1), 247-269 (2008).
- Stys, P. K., Zamponi, G. W., van Minnen, J., Geurts, J. J. Will the real multiple sclerosis please stand up. Nat Rev Neurosci. 13 (7), 507-514 (2012).
- Korn, T. Pathophysiology of multiple sclerosis. J Neurol. 255 (Suppl 6), 2-6 (2008).
- Ward, M., Goldman, M. D. Epidemiology and Pathophysiology of Multiple Sclerosis. CONTINUUM. 28 (4), 988-1005 (2022).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin Oligodendrocyte Glycoprotein (MOG35-55) Induced Experimental Autoimmune Encephalomyelitis (EAE) in C57BL/6 Mice. J Vis Exp. (86), 51275 (2014).
- Bittner, S., et al. The TASK1 channel inhibitor A293 shows efficacy in a mouse model of multiple sclerosis. Exp Neurol. 238 (2), 149-155 (2012).
- Göbel, K., et al. Plasma kallikrein modulates immune cell trafficking during neuroinflammation via PAR2 and bradykinin release. Proc Natl Acad Sci U S A. 116 (1), 271-276 (2019).
- Ballerini, C. Experimental Autoimmune Encephalomyelitis. Methods Mol Biol. 2285, 375-384 (2021).
- Birmpili, D., Charmarke Askar, I., Bigaut, K., Bagnard, D. The Translatability of Multiple Sclerosis Animal Models for Biomarkers Discovery and Their Clinical Use. Int J Mol Sci. 23 (19), 11532 (2022).
- Tsatas, O., Ghasemlou, N. Isolation and RNA purification of macrophages/microglia from the adult mouse spinal cord. J Immunol Methods. 477, 112678 (2020).
- Calvo, B., Rubio, F., Fernández, M., Tranque, P. Dissociation of neonatal and adult mice brain for simultaneous analysis of microglia, astrocytes and infiltrating lymphocytes by flow cytometry. IBRO Rep. 8, 36-47 (2020).
- Diaz-Amarilla, P., et al. Isolation and characterization of neurotoxic astrocytes derived from adult triple transgenic Alzheimer's disease mice. Neurochem Int. 159, 105403 (2022).
- Galatro, T. F., Vainchtein, I. D., Brouwer, N., Boddeke, E. W. G. M., Eggen, B. J. L. Isolation of Microglia and Immune Infiltrates from Mouse and Primate Central Nervous System. Methods Mol Biol. 1559, 333-342 (2017).
- Altendorfer, B., et al. Transcriptomic Profiling Identifies CD8+ T Cells in the Brain of Aged and Alzheimer's Disease Transgenic Mice as Tissue-Resident Memory T Cells. J Immunol. 209 (7), 1272-1285 (2022).
- Lanfranco, M. F., Sepulveda, J., Kopetsky, G., Rebeck, G. W. Expression and secretion of apoE isoforms in astrocytes and microglia during inflammation. Glia. 69 (6), 1478-1493 (2021).
- Swire, M., Ffrench-Constant, C. Oligodendrocyte-Neuron Myelinating Coculture. Methods Mol Biol. 1936, 111-128 (2019).
- Park, J., Koito, H., Li, J., Han, A. Microfluidic compartmentalized co-culture platform for CNS axon myelination research. Biomed Microdevices. 11 (6), 1145-1153 (2009).
- Facci, L., Barbierato, M., Skaper, S. D. Astrocyte/Microglia Cocultures as a Model to Study Neuroinflammation. Methods Mol Biol. 1727, 127-137 (2018).
- Speicher, A. M., Wiendl, H., Meuth, S. G., Pawlowski, M. Generating microglia from human pluripotent stem cells: novel in vitro models for the study of neurodegeneration. Mol Neurodegener. 14 (1), 46 (2019).
- Homayouni Moghadam, F., et al. Isolation and Culture of Embryonic Mouse Neural Stem Cells. J Vis Exp. (141), 58874 (2018).
- Santos, R., et al. Differentiation of Inflammation-Responsive Astrocytes from Glial Progenitors Generated from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 8 (6), 1757-1769 (2017).
- Tcw, J., et al. An Efficient Platform for Astrocyte Differentiation from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 9 (2), 600-614 (2017).
- Miltenyi, S., Müller, W., Weichel, W., Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Huntemann, N., et al. An optimized and validated protocol for inducing chronic experimental autoimmune encephalomyelitis in C57BL/6J mice. J Neurosci Methods. 367, 109443 (2022).
- Martin, E., El-Behi, M., Fontaine, B., Delarasse, C. Analysis of Microglia and Monocyte-derived Macrophages from the Central Nervous System by Flow Cytometry. J Vis Exp. (124), 55781 (2017).
- Sarkar, S., et al. Rapid and Refined CD11b Magnetic Isolation of Primary Microglia with Enhanced Purity and Versatility. J Vis Exp. (122), 55364 (2017).
- Rodríguez Murúa, S., Farez, M. F., Quintana, F. J. The Immune Response in Multiple Sclerosis. Annu Rev Pathol. 17, 121-139 (2021).
- Engelhardt, B., Ransohoff, R. M. Capture, crawl, cross: the T cell code to breach the blood-brain barriers. Trends Immunol. 33 (12), 579-589 (2012).
- Elia, G. Biotinylation reagents for the study of cell surface proteins. Proteomics. 8 (19), 4012-4024 (2008).
- Berl, S., et al. Enrichment and isolation of neurons from adult mouse brain for ex vivo analysis. J Neurosci Methods. 283, 15-22 (2017).
- Turvy, D. N., Blum, J. S. Biotin Labeling and Quantitation of Cell-Surface Proteins. Curr Protoc Immunol. 18 (7), (2001).
- Mao, S. Y. Biotinylation of Antibodies. Methods Mol Biol. 115, 39-41 (1999).
- Kantzer, C. G., et al. Anti-ACSA-2 defines a novel monoclonal antibody for prospective isolation of living neonatal and adult astrocytes. Glia. 65 (6), 990-1004 (2017).
- Batiuk, M. Y., et al. An immunoaffinity-based method for isolating ultrapure adult astrocytes based on ATP1B2 targeting by the ACSA-2 antibody. J Biol Chem. 292 (21), 8874-8891 (2017).
- Pan, J., Wan, J. Methodological comparison of FACS and MACS isolation of enriched microglia and astrocytes from mouse brain. J Immunol Methods. 486, 112834 (2020).
- Donovan, J. A., Koretzky, G. A. CD45 and the immune response. J Am Soc Nephrol. 4 (4), 976-985 (1993).
- Hathcock, K. S., Hirano, H., Hodes, R. J. CD45 expression by murine B cells and T cells: Alteration of CD45 isoforms in subpopulations of activated B cells. Immunol Res. 12 (1), 21-36 (1993).
- Balogh, P., Tew, J. G., Szakal, A. K. Simultaneous blockade of Fc? receptors and indirect labeling of mouse lymphocytes by the selective detection of allotype-restricted epitopes on the kappa chain of rat monoclonal antibodies. Cytometry. 47 (2), 107-110 (2002).
- Becerril-García, M. A., et al. Langerhans Cells From Mice at Birth Express Endocytic- and Pattern Recognition-Receptors, Migrate to Draining Lymph Nodes Ferrying Antigen and Activate Neonatal T Cells in vivo. Front Immunol. 11, 744 (2020).
- Dent, M. A., Segura-Anaya, E., Alva-Medina, J., Aranda-Anzaldo, A. NeuN/Fox-3 is an intrinsic component of the neuronal nuclear matrix. FEBS Lett. 584 (13), 2767-2771 (2010).
- Duan, W., et al. Novel Insights into NeuN: from Neuronal Marker to Splicing Regulator. Mol Neurobiol. 53 (3), 1637-1647 (2016).
- Monteiro, R., Sivasubramanian, M. K., Balasubramanian, P., Subramanian, M. Obesity-Induced Sympathoexcitation is Associated with Glial Senescence in the Brainstem. FASEB J. 34 (S1), 1-1 (2020).
- Li, S., Chang, L., Teissie, J. . Electroporation protocols: mircroorganism, mammalian system, and nanodevice. , (2020).
- Kettenmann, H., Hanisch, U. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiol Rev. 91 (2), 461-553 (2011).
- Haage, V., et al. Comprehensive gene expression meta-analysis identifies signature genes that distinguish microglia from peripheral monocytes/macrophages in health and glioma. Acta Neuropathol Commun. 7 (1), 20 (2019).
- Kosior, N., Petkau, T. L., Connolly, C., Lu, G., Leavitt, B. R. Isolating cells from adult murine brain for validation of cell-type specific cre-mediated deletion. J Neurosci Methods. 328, 108422 (2019).
- Jurga, A. M., Paleczna, M., Kuter, K. Z. Overview of General and Discriminating Markers of Differential Microglia Phenotypes. Front Cell Neurosci. 14, 198 (2020).
- Man, S., Ubogu, E. E., Ransohoff, R. M. Inflammatory Cell Migration into the Central Nervous System: A Few New Twists on an Old Tale. Brain Pathol. 17 (2), 243-250 (2007).
- Schroeter, C. B., et al. One Brain-All Cells: A Comprehensive Protocol to Isolate All Principal CNS-Resident Cell Types from Brain and Spinal Cord of Adult Healthy and EAE Mice. Cells. 10 (3), 651 (2021).
- Sankowski, R., et al. Mapping microglia states in the human brain through the integration of high-dimensional techniques. Nate Neurosci. 22 (12), 2098-2110 (2019).
- Brennan, F. H., et al. Microglia coordinate cellular interactions during spinal cord repair in mice. Nat Commun. 13 (1), 4096 (2022).
- Enright, H. A., et al. Functional and transcriptional characterization of complex neuronal co-cultures. Sci Rep. 10 (1), 11007 (2020).
- Mofazzal Jahromi, M. A., et al. Microfluidic Brain-on-a-Chip: Perspectives for Mimicking Neural System Disorders. Mol Neurobiol. 56 (12), 8489-8512 (2019).
- Chin, E., Goh, E. Blood-brain barrier on a chip. Methods Cell Biol. 146, 159-182 (2018).
- Miccoli, B., Braeken, D., Li, Y. E. Brain-on-a-chip Devices for Drug Screening and Disease Modeling Applications. Curr Pharm Des. 24 (45), 5419-5436 (2019).
- Giandomenico, S. L., et al. Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output. Nat Neurosci. 22 (4), 669-679 (2019).
- Pellegrini, L., et al. Human CNS barrier-forming organoids with cerebrospinal fluid production. Science. 369 (6500), eaaz5626 (2020).
- Chhibber, T., et al. CNS organoids: an innovative tool for neurological disease modeling and drug neurotoxicity screening. Drug Discov Today. 25 (2), 456-465 (2020).
- Tang, X. Y., et al. Human organoids in basic research and clinical applications. Signal Transduct TargetTher. 7 (1), 168 (2022).
- Sutermaster, B. A., Darling, E. M. Considerations for high-yield, high-throughput cell enrichment: fluorescence versus magnetic sorting. Sci Rep. 9 (1), 227 (2019).
- Doughty, D., et al. Development of a novel purification protocol to isolate and identify brain microglia. Exp Biol Med. 247 (16), 1433-1446 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved