Одновременное выделение основных типов клеток резидентных клеток центральной нервной системы у взрослых мышей с аутоиммунным энцефаломиелитом
* These authors contributed equally
In This Article
Summary
На сегодняшний день протоколы одновременной изоляции всех основных типов резидентных клеток центральной нервной системы от одной и той же мыши являются неудовлетворенным спросом. В протоколе показана процедура, применимая у наивных и экспериментальных мышей с аутоиммунным энцефаломиелитом, для исследования сложных клеточных сетей во время нейровоспаления и одновременного снижения требуемой численности мышей.
Abstract
Экспериментальный аутоиммунный энцефаломиелит (ЭАЭ) является наиболее распространенной мышиной моделью рассеянного склероза (РС) и часто используется для дальнейшего выяснения все еще неизвестной этиологии рассеянного склероза с целью разработки новых стратегий лечения. Модель ЭАЭ гликопротеина миелина олигодендроцита 35-55 (MOG35-55) воспроизводит самоизлечивающееся монофазное течение заболевания с восходящим параличом в течение 10 суток после иммунизации. Мышей ежедневно осматривают с помощью клинической системы оценки. Рассеянный склероз обусловлен различными патомеханизмами со специфическим временным паттерном, поэтому изучение роли резидентных типов клеток центральной нервной системы (ЦНС) в прогрессировании заболевания представляет большой интерес. Уникальной особенностью этого протокола является одновременная изоляция всех основных типов клеток ЦНС (микроглия, олигодендроциты, астроциты и нейроны), применимых у взрослых и здоровых мышей. За диссоциацией головного и спинного мозга у взрослых мышей следует магнитно-активируемая сортировка клеток (MACS) для выделения микроглии, олигодендроцитов, астроцитов и нейронов. Методом проточной цитометрии проводили качественные анализы очищенных одноклеточных суспензий, подтверждающие жизнеспособность после выделения клеток и указывающие на чистоту каждого типа клеток около 90%. В заключение, этот протокол предлагает точный и всесторонний способ анализа сложных клеточных сетей у здоровых мышей и мышей с ЭАЭ. Кроме того, необходимое количество мышей может быть существенно уменьшено, так как все четыре типа клеток выделены из одних и тех же мышей.
Introduction
Рассеянный склероз (РС) — это хроническое воспалительное аутоиммунное заболевание центральной нервной системы (ЦНС), характеризующееся демиелинизацией, повреждением аксонов, глиозом и нейродегенерацией. Несмотря на многочисленные исследовательские подходы в этой области, патофизиология рассеянного склероза до сих пор до конца не изучена 1,2,3,4. Наиболее распространенной животной моделью для исследования рассеянного склероза является экспериментальный аутоиммунный энцефаломиелит (ЭАЭ), индуцированный олигодендроцитами гликопротеина 35-55 (MOG35-55), который имеет многие клинические и патофизиологические особенности 5,6,7,8,9 . Он основан на ответе иммунной системы на ЦНС-специфические антигены, приводящие к воспалению, демиелинизации и нейроаксональной дегенерации. Экспериментальный аутоиммунный энцефаломиелит (ЭАЭ) является подходящей моделью для исследования нейровоспалительных путей и сигнальных каскадов, обнаруженных при рассеянном склерозе.
Современные варианты терапии рассеянного склероза эффективны лишь частично и сосредоточены в первую очередь на начальной воспалительной фазе заболевания. Тем не менее, нейродегенеративный компонент рассеянного склероза, по-видимому, является основной проблемой для долгосрочных терапевтических подходов. Таким образом, для всестороннего изучения молекулярных и клеточных механизмов при аутоиммунных заболеваниях необходимы воспроизводимые и точные протоколы выделения клеток. Даже если существуют некоторые протоколы выделения одного единственного типа клеток 10,11,12,13,14,15, существует неудовлетворенная потребность в одновременной изоляции сразу нескольких популяций клеток ЦНС. Предыдущие протоколы выделения резидентных клеток ЦНС не сохраняли клеточную функциональность и чистоту, что приводило к совместному культивированию с соседними клетками 16,17,18 или непригодностью для комплексного анализа внутриклеточных сетей ex vivo 19,20,21,22.
Целью данного протокола было создание воспроизводимого и комплексного метода одновременного выделения чистых жизнеспособных одноклеточных суспензий всех основных типов резидентных клеток ЦНС, применимых у взрослых здоровых мышей и мышей с ЭАЭ. Различные типы клеток были выделены с помощью магнитно-активированной сортировки клеток (MACS)23. Разделение клеток может быть осуществлено либо путем положительного отбора, т.е. магнитного мечения поверхностных маркеров, специфичных для типа клеток, либо путем отрицательного отбора путем биотинилирования и истощения всех нежелательных клеток. Для обеспечения чистоты выше 90% и жизнеспособности не менее 80% выделенных одноклеточных суспензий применяли проточную цитометрию.
В заключение, основной целью было создание протокола одновременного выделения всех основных типов резидентных клеток ЦНС в качестве универсального инструмента для исследования нейровоспалительных путей, предлагающего всесторонний и точный анализ сложных клеточных сетей и биохимических сигнальных каскадов у здоровых мышей и мышей с ЭАЭ.
Protocol
Все эксперименты по ЭАЭ были индуцированы на самках мышей C57BL/6J в возрасте 10-12 недель и одобрены местными властями (Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen). Соблюдение законодательства Германии и ЕС о защите животных также обеспечивалось на всех этапах проведения экспериментов. Все мыши содержались в индивидуально вентилируемых клетках, условиях содержания животных.
ПРИМЕЧАНИЕ: Следующие объемы реагентов относятся к одному взрослому мышиному головному и спинному мозгу, которые далее называются суспензией клеток ЦНС и весят примерно от 20 мг до 500 мг. Если планируется диссоциация более чем одной суспензии клеток ЦНС, необходимо соответствующим образом увеличить все объемы реагентов и материалы. Рекомендуется непрерывно хранить фосфатно-солевой буфер Dulbecco (D-PBS; 1x) с кальцием и магнием, дополненный 1 г/л глюкозы и 36 мг/л пирувата натрия) на льду в течение всего эксперимента. Если после этого планируется культивирование клеток, выполните все этапы в стерильных условиях с использованием вытяжек. В противном случае ни один из следующих разделов протокола не нужно выполнять под капотом. Храните буферы на льду. Используйте только предварительно охлажденные растворы и избегайте завихрения на протяжении всего эксперимента. На рисунке 1 показан общий рабочий процесс.
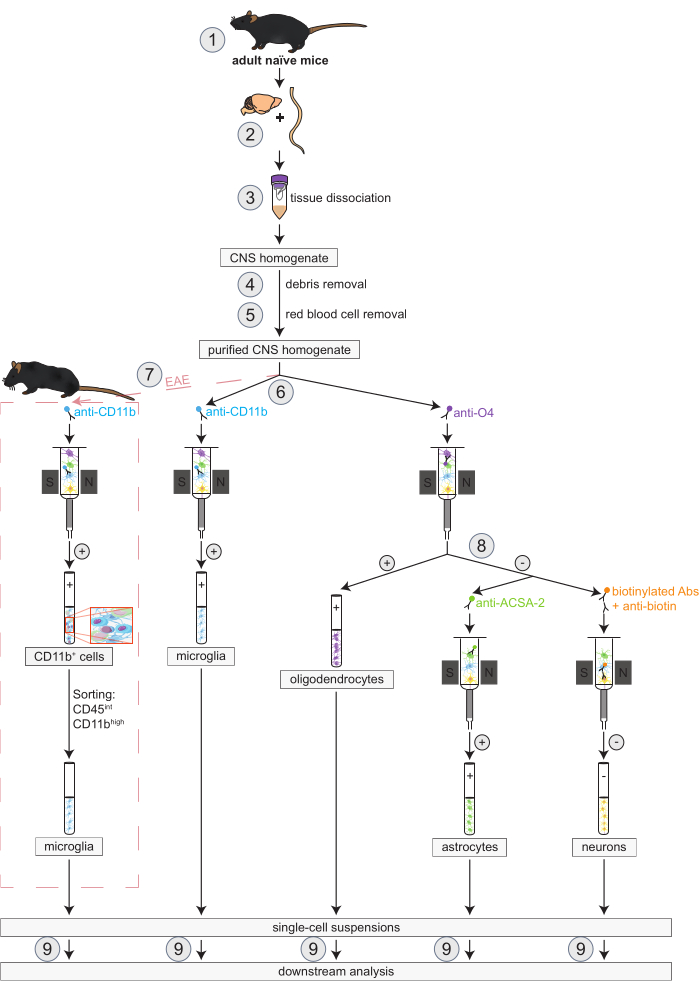
Рисунок 1: Рабочий процесс одновременного выделения олигодендроцитов, микроглии, астроцитов и нейронов у наивных мышей и мышей с ЭАЭ. Первые шаги рабочего процесса одинаковы как для наивных, так и для мышей EAE. Если требуется работа с репликацией EAE, индукция EAE должна быть выполнена заранее (1). Вкратце, протокол начинается с вскрытия (2) и диссоциации (3) головного и спинного мозга мышей с последующим удалением обломков (4) и эритроцитов (5). Затем полученную очищенную клеточную суспензию ЦНС расщепляют на две фракции для одновременного выделения олигодендроцитов и микроглии с помощью MACS (6). Микроглия обнаруживается с помощью микрогранул анти-CD11b, в то время как олигодендроциты выделяются с помощью микрогранул анти-O4 (положительный отбор). Из отрицательного потока олигодендроцитов (8) астроциты выделяют с помощью микрогранул анти-ACSA-2 (положительный отбор), а нейроны — путем мечения биотином и истощения всех ненейрональных клеток (отрицательный отбор). У мышей с ЭАЭ выделение CD11b+ клеток сопровождается флуоресцентно-активированной сортировкой клеток CD45intCD11bhigh с целью элиминации других CD11b+ иммунных клеток, таких как макрофаги, дендритные клетки, моноциты, гранулоциты и естественные клетки-киллеры, которые, как известно, участвуют в процессах нейровоспаления во время течения ЭАЭ (7)27,28,48. После выделения различных типов клеток, резидентных в ЦНС, может быть проведен анализ чистоты (9). Аббревиатуры: Abs = антитела; ACSA-2 = поверхностный антиген клетки астроцита-2; CD11b = циклин-зависимая киназа 11B; CD45 = тирозин-протеинфосфатаза рецепторного типа С; ЦНС = центральная нервная система; ЭАЭ = экспериментальный аутоиммунный энцефаломиелит; MACS = магнитно-активируемая сортировка клеток; O4 = маркер олигодендроцитов O4. Эта цифра была изменена с49. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
1. Индукция активных ЭАЭ
- Приготовление реагентов
- Для разделения клеток: Приготовьте буфер PB и храните его при температуре 2-8 °C не более 1 недели. Для приготовления исходного раствора добавьте 475 мл 1x PBS без добавок (pH 7,2) + 25 мл 0,5% бычьего сывороточного альбумина (BSA). Используйте разведение 1:20, приготовленное в BSA.
- Для проточной цитометрии и флуоресцентно-активируемой сортировки клеток (FACS): Приготовьте буфер FACS, PBS с 2% сывороткой крови телят плода (FCS) и 2 мМ ЭДТА и храните его при температуре 2-8 °C. Для приготовления добавьте 500 мл 1x PBS без добавок и 10 мл FCS + 2 мл ЭДТА (из 0,5 мл запаса ЭДТА)
- Проводите иммунизацию в соответствии с протоколом Bittner et al. 5. Короче говоря, индуцировать ЭАЭ путем подкожного введения эмульсии, содержащей 200 мкг пептида MOG35-55 и 200 мкл полного адъюванта Фрейда, включая 200 мкг микобактерий туберкулеза.
- Обезболивайте мышь 2% изофлураном, используя наркозную камеру с испарителем изофлурана. Наносите ветеринарную мазь на глаза животного, чтобы предотвратить сухость во время наркоза.
- Через 2 ч вводят внутрибрюшинную инъекцию 100 нг коклюшного токсина (PTx), растворенного в 100 мкл 1x PBS, в соответствии с протоколом Huntemann et al.24. Повторите инъекцию PTx на 2-й день после иммунизации.
ВНИМАНИЕ: Наблюдайте за каждым животным до тех пор, пока оно не придет в сознание настолько, чтобы поддерживать положение грудины. Мышей, прошедших инъекционные процедуры, не возвращают в компанию других мышей до тех пор, пока они полностью не выздоровеют. Для микобактерий туберкулеза и PTx: избегать вдыхания, проглатывания и контакта с кожей и глазами. Микобактерия туберкулеза является активатором врожденной иммунной системы. PTx обладает многими биологическими эффектами. - Ежедневный мониторинг прогрессирования ЭАЭ выполняется двумя слепыми исследователями, которые следят за весом и клинически обследуют мышей.
- С этой целью используют следующую систему подсчета баллов: 0 степень – отсутствие клинических признаков ЭАЭ, 1 степень – частичный парез хвоста, 2 степень – полный парез хвоста, 3 степень – умеренная слабость задних конечностей, 4 степень – полная слабость задних конечностей и атаксическая походка, 5 степень – легкий парапарез, 6 степень – парапарез, 7 степень – параплегия, 8 степень – тетрапарез, 9 степень – квадриплегия, и 10 степень – смерть.
- Используйте следующие критерии исключения для дальнейшего участия в эксперименте: клиническая оценка > 7 или потеря веса, превышающая 20% от исходной массы тела.
- Для вскрытия головного и спинного мозга мышей с ЭАЭ эвтаназируют на 16-й день после индукции ЭАЭ, представляющей собой максимум заболевания.
2. Подготовка тканей ЦНС (продолжительность: примерно 10 минут на мышей)
- После принесения мышам в жертву углекислого газа начните с транскардиальной перфузии каждой мыши с 20 мл 1x PBS. Повторите перфузию еще раз с 20 мл 1x PBS.
- Поместите мышь в положение лежа на спине и зафиксируйте конечности канюлями. Нанесите 75% этанол на переднюю часть тела животного. В этом случае нет необходимости в дальнейших мерах по обеспечению стерильности.
- Вскрыть брюшную полость и грудную клетку, сделав продольный разрез через кожу и фасцию с помощью ножниц.
- Разрежьте ребра сбоку и сложите грудную клетку, чтобы получить свободный доступ к сердцу. Зафиксируйте грудную клетку, сложенную кверху, с помощью канюль.
- Откройте правое предсердие с помощью ножниц. Нанесите 20 мл 1x PBS в левый желудочек с помощью канюли, чтобы вымыть кровь через разрезанное правое предсердие.
- Обнажите череп, разрезав кожу на голове мыши через продольный разрез и сдвиньте кожу вокруг головы с помощью щипцов. Надрезают череп ножницами по сагиттальному шву.
- Введите кончик щипца вдоль линии разреза, чтобы расколоть калотту. Удалите щипцами оставшиеся части калотты так, чтобы мозг был полностью обнажен.
- Осторожно извлеките мозг и поместите его в матрицу мозга мыши. Разрежьте мозг на сагиттальные ломтики толщиной 1 мм с помощью лезвия бритвы.
- Разрежьте позвоночный столб ножницами чуть выше гребня подвздошной кости, чтобы шприц можно было ввести в спинномозговой канал.
ПРИМЕЧАНИЕ: Самый простой способ удалить спинной мозг – это промыть его из спинномозгового канала с помощью PBS. В противном случае дуги позвонков должны быть раскрыты по отдельности ножницами, а затем спинной мозг может быть удален. - Промыть спинной мозг из спинномозгового канала от каудального до краниального с помощью шприца объемом 20 мл с иглой 20G, содержащей 1x PBS. Разрежьте спинной мозг на сегменты длиной 0,5 см с помощью скальпеля.
- Храните каждую клеточную суспензию ЦНС, состоящую из головного и соответствующего спинного мозга, в одной отдельной чашке Петри для каждой мыши, наполненной примерно 3 мл холодного D-PBS. Храните посуду на льду до дальнейшей обработки.
3. Диссоциация тканей ЦНС (продолжительность: примерно 1-1,5 ч в зависимости от количества суспензий клеток ЦНС)
Примечание: Нервная ткань взрослых мышей диссоциирована путем сочетания механической диссоциации с ферментативной деградацией внеклеточного матрикса. Таким образом, структурная целостность сохраняется, и клеточная суспензия может быть использована для дальнейших процедур выделения клеток.
- Приготовьте соответствующий объем ферментной смеси 1, состоящей из 50 мкл фермента Р и 1 900 мкл буфера Z на суспензию клеток ЦНС. Оба реагента относятся к набору для диссоциации мозга взрослого человека.
- Приготовьте соответствующий объем ферментной смеси 2, состоящей из 10 мкл фермента А и 20 мкл буфера Y на суспензию клеток ЦНС. Оба реагента относятся к набору для диссоциации мозга взрослого человека.
- Переложите 1 950 мкл смеси ферментов 1 в С-трубку, а затем добавьте кусочки ткани одной клеточной суспензии ЦНС. Используйте одну С-трубку на мышь.
- Добавьте 30 мкл смеси ферментов 2 в каждую С-трубку. Плотно закройте трубки С и прикрепите их вверх дном на рукав клеточного диссоциатора с нагревателями.
- Запустите соответствующую программу с именем 37C_ABDK_01 (займет 30 минут). Соблюдайте по крайней мере первые 5 минут программы, чтобы убедиться, что все трубы вращаются с одинаковой скоростью. Возможно возникновение ошибок во время прогона. Затем перейдите к шагу 6.
- В последние 2 минуты программы поместите одно ситечко 70 мкм на пробирку объемом 50 мл для каждой диссоциированной клеточной суспензии ЦНС. Предварительно смочите эти ситечки 2 мл D-PBS.
- После завершения программы присоедините С-трубки от диссоциатора и поместите их в центрифугу. Центрифуцируют образцы при 300 x g и 4 °C в течение 1 мин, чтобы собрать образец на дне пробирки.
- Повторно суспендируйте образец и приложите его к предварительно увлажненному ситечку. Добавьте 10 мл холодного D-PBS в пустую пробирку C и закройте ее. Аккуратно встряхните его и нанесите суспензию на соответствующее ситечко.
- Выбросьте сетчатые фильтры и закройте пробирки объемом 50 мл. Снова центрифуют клеточную суспензию при 300 x g и 4 °C в течение 10 мин. После этого очень осторожно аспирируйте всю надосадочную жидкость.
4. Удаление мусора (продолжительность: примерно 1,5-2 часа в зависимости от количества суспензий клеток ЦНС)
ПРИМЕЧАНИЕ: Диссоциация тканей часто приводит к образованию миелина и клеточного мусора, которые могут ухудшить последующий анализ. Добавив раствор для удаления мусора, этот мусор может быть эффективно удален из суспензии клеток ЦНС.
- Осторожно ресуспендируйте клеточную гранулу с 3 100 мкл D-PBS для каждой суспензии клеток ЦНС. Не вихритесь.
- При работе с более чем одной суспензией клеток ЦНС в одной пробирке объемом 15 мл следует объединять не более двух суспензий клеток ЦНС, полученных из одного состояния или экспериментальной группы.
- Добавьте 900 мкл раствора для удаления мусора из набора для диссоциации мозга взрослого человека к одной суспензии клеток ЦНС или 1800 мкл раствора для удаления мусора к двум объединенным суспензиям клеток ЦНС.
- Переверните трубку и перемешайте суспензию. После этого очень аккуратно налейте на него 4 мл холодного D-PBS. Должен быть виден четкий градиент (рис. 2A).
- Центрифугируйте пробирки в течение 10 мин при 3000 x g и 4 °C с полным ускорением и без торможения.
- Если разделение происходит так, как задумано, образуются три фазы (рис. 2C). Полностью аспирируйте две верхние фазы (Рисунок 2C-1,2) и выбросьте их. Важно, чтобы не осталось остатков миелина (рис. 2E).
ПРИМЕЧАНИЕ: Если градиент не сработал, а ячейки нужны срочно, не отсасывайте две верхние фазы. Вместо этого наполните пробирку объемом 15 мл холодным D-PBS до 15 мл и переверните несколько раз. Снова центрифуйте при 1000 x g в течение 10 мин при 4 °C с полным ускорением и без торможения. Отсосите надосадочную жидкость и повторите шаги 4.1-4.4. - Наполните тюбик холодным D-PBS до 14 мл и закройте его. Сильно переворачивайте трубку на рабочем столе, пока гранула ячейки не отделится от дна трубки. Не вихритесь.
- Снова центрифуют образец при 1000 x g и 4 °C в течение 10 мин. Установите полный разгон и полный тормоз. Аспирируйте надосадочную жидкость осторожно и полностью.

Рисунок 2: Что можно и чего нельзя делать при удалении мусора. (A) Положительный пример градиента после наложения 4 мл PBS. Верхняя фаза, состоящая из 4 мл PBS, четко отличается от нижней фазы, состоящей из суспензии клеток ЦНС с раствором для удаления мусора. (B) Отрицательный пример градиента после наложения 4 мл PBS. В градиенте отсутствует четкое разделение между PBS и клеточной суспензией, расположенной ниже. Небольшое количество PBS диффундирует в клеточную суспензию. (C) Положительный пример градиента после центрифугирования. Можно легко выделить три отдельные фазы. Остатки миелина не видны ни в верхней (1), ни в нижней фазе (3) градиента. Средняя фаза содержит весь миелин (2). Клеточная гранула видна на дне пробирки объемом 15 мл. (D) Отрицательный пример градиента после центрифугирования. Точного разделения между тремя фазами не существует. Некоторые остатки миелина видны в верхней (1) и нижней фазе (3) градиента. (E) Положительный пример градиента после аспирации двух верхних фаз. Полученный образец содержит только клеточную гранулу и прозрачный надосадочный раствор сверху. Никаких остатков миелина не остается. (F) Отрицательный пример градиента после аспирации двух верхних фаз. Образец все еще содержит некоторое количество остатков миелина (черная стрелка). Сокращения: ЦНС = центральная нервная система; PBS = фосфатно-солевой буфер Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Удаление эритроцитов (продолжительность: примерно 1 ч в зависимости от количества суспензий клеток ЦНС)
ПРИМЕЧАНИЕ: Этот этап предотвращает последующее загрязнение эритроцитами и обеспечивает оптимальный лизис эритроцитов с минимальным влиянием на другие типы клеток, выделенных из ткани ЦНС. Следующие объемы указаны для клеточных суспензий, полученных от 100 мг до 1 г нейрональной ткани, соответствующей двум головному и спинному мозгу взрослых мышей. Если вы работаете с более чем двумя суспензиями клеток ЦНС, соответственно увеличьте масштаб всех реагентов и общий объем.
- Начните с приготовления раствора для удаления эритроцитов (RBCRS): на две объединенные суспензии клеток ЦНС. Разведите 100 мкл исходного раствора для удаления эритроцитов (10x) из набора для диссоциации мозга взрослого человека в 900 мкл ddH2O до окончательного разведения 1:10.
- Храните RBCRS при температуре 2-8 °C до использования. Неиспользованные остатки выбрасывайте в конце дня.
- Ресуспендировать клеточную гранулу до двух клеточных суспензий ЦНС в 1 мл RBCRS. Избегайте вихрей. Выдерживают раствор 10 мин при температуре 4 °С.
- Добавьте 10 мл холодного PB-буфера к двум суспензиям объединенных клеток. Центрифуируют образец при 300 x g и 4 °C в течение 10 мин, а затем полностью отсасывают надосадочную жидкость.
- Ресуспендируйте каждую клеточную гранулу из одной клеточной суспензии ЦНС в 80 мкл PB-буфера путем медленного пипетирования вверх и вниз. Соответственно, используйте 160 мкл для ресуспендирования клеточных гранул, полученных из двух клеточных суспензий ЦНС.
- При работе с несколькими клеточными суспензиями ЦНС из одного и того же экспериментального состояния объединяют все эти клеточные суспензии.
- Определите количество клеток, например, с помощью усовершенствованной счетной камеры. Клеточные суспензии обычно разводили в соотношении 1:50 в буфере PB с последующим дальнейшим разведением 1:10 в 0,4% растворе трипанового синего.
6. Протокол магнитных шариков у наивных мышей и мышей EAE (продолжительность: примерно 1 час)
- Магнитная маркировка различных типов клеток ЦНС микрогранулами, специфичными для их поверхностного антигена. Затем поместите клеточную суспензию в столбец и магнитно отделите меченые ячейки, оставшиеся в колонке, и немеченые ячейки, которые проходят через нее.
- После удаления колонки из магнитного поля вымойте магнитно-меченые ячейки из колонки в трубку в виде положительно отобранной фракции клеток.
ПРИМЕЧАНИЕ: Объемы для процесса магнитной маркировки рассчитываются для 1 x 107 ячеек. Если получено больше клеток, соответственно увеличьте масштаб всех реагентов и общих объемов. Рекомендуется работать быстро и использовать только предварительно охлажденные растворы, чтобы предотвратить налипание антител на поверхности клеток и неспецифическое мечение клеток, а также обеспечить высокую жизнеспособность выделенных клеточных популяций. Также важно выполнить этапы промывки, как только резервуар колонны опустеет, добавив буфер PB, чтобы колонны не пересыхали. - Очищенную неразбавленную клеточную суспензию ЦНС разделить на две фракции для последующего выделения микроглии и олигодендроцитов. Соотношение обеих фракций зависит от желаемого количества клеток каждого типа.
ПРИМЕЧАНИЕ: Более подробная информация (продолжительность инкубации, подробные этапы протокола, объемы, реагенты и метод подсчета клеток) указана в таблице 1.
Таблица 1: Рабочий процесс одновременного магнитного мечения и выделения олигодендроцитов и микроглии у наивных мышей и мышей с ЭАЭ. Оба типа клеток выделяются путем положительного отбора. Шаги, перечисленные в одной строке, указываются для выполнения сразу. Сокращения: CD11b = циклин-зависимая киназа 11B; ЭАЭ = экспериментальный аутоиммунный энцефаломиелит; FcR = Fc-рецептороподобный белок; O4 = маркер олигодендроцитов O4. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
7. Поправка к протоколу: дополнительная сортировка для выделения микроглии у мышей с ЭАЭ (продолжительность: примерно 1,5-2 часа)
ПРИМЕЧАНИЕ: При работе с мышами EAE необходимо дополнить протокол выделения клеток на основе MACS FACS для удаления популяций CD11b+ , отличных от микроглии (например, моноцитов, макрофагов, естественных клеток-киллеров, гранулоцитов или дендритных клеток) из фракции клеток CD11b+ . В противном случае этот шаг можно проигнорировать.
- Приготовьте окрашивающую мастер-смесь, содержащую 1x PBS, дополненную CD11b FITC (клон M1/70, 1:50) и CD45 APC/Cy7 (клон 30-F11, 1:200). Используйте 100 мкл смеси для окрашивания наячейки 5 x 10 6. Встряхните все антитела перед применением.
- Центрифуют суспензию клеток микроглии при 300 x g и 4 °C в течение 10 мин и осторожно аспирируют надосадочную жидкость.
- Ресуспендируйте гранулу ячейки со 100 мкл приготовленной смеси для окрашивания на 5 x 106 ячеек. Инкубировать 15 мин в темноте при комнатной температуре (RT).
- Остановите реакцию, добавив 500 мкл PBS, и снова центрифугируйте образец при 300 x g и 4 °C в течение 10 мин.
- Осторожно аспирируйте надосадочную жидкость и ресуспендируйте клеточную гранулу с 1x PBS, добавленной 10 мкг/мл ДНКазы до достижения конечной концентрации 1 x 10,7 клеток на мл. Храните ячейки при температуре 4 °C до начала сортировки.
- Нанесите клеточную суспензию на ситечко 100 мкм, помещенное на новую пробирку FACS, непосредственно перед началом сортировки.
- Установите скорость потока 1000 событий в секунду и используйте сопло 100 мкм. Отсортируйте желаемую клеточную популяцию CD45intCD11bhigh в новую пробирку объемом 15 мл, приготовленную с 1x PBS на РТ.
8. Подготовка отрицательного потока олигодендроцитов для выделения нейронов и астроцитов (продолжительность: примерно 1 ч)
ПРИМЕЧАНИЕ: Отрицательный поток олигодендроцитов из шага 6 собирается для дальнейшего выделения нейронов и астроцитов. Для этого клеточную суспензию расщепляют на две части. Благодаря предыдущему выделению олигодендроцитов из клеточной суспензии ЦНС, контаминация клетками O4+ сводится к минимуму, что наблюдалось бы в противном случае.
- Центрифуют отрицательный поток олигодендроцитов при 300 x g и 4 °C в течение 10 мин и осторожно аспирируют надосадочную жидкость.
- Ресуспендировать клеточную гранулу в 80 мкл PB-буфера на объединенную клеточную суспензию ЦНС, ранее использовавшуюся для выделения положительной фракции олигодендроцитов.
- Подсчитайте ячейки. Выполняют подсчет клеток, предположительно O4- , используя улучшенную счетную камеру после разбавления клеточной суспензии 1:50 в буфере PB с последующим дальнейшим разведением 1:10 в 0,4% трипановом синем.
- Очищенную неразбавленную клеточную суспензию расщепляют на две фракции для последующего одновременного выделения нейронов и астроцитов. Соотношение обеих фракций зависит от предпочтительного количества каждого типа клеток.
ПРИМЕЧАНИЕ: Более подробная информация (продолжительность инкубации, подробные этапы протокола, объемы, реагенты и метод подсчета клеток) указана в таблице 2.
Таблица 2: Схема одновременного магнитного мечения и выделения нейронов и астроцитов от наивных мышей и мышей с ЭАЭ. Оба типа клеток выделяются из отрицательного потока олигодендроцитов. Астроциты отделяются в результате положительного отбора с помощью микрогранул анти-ACSA-2, в то время как нейроны очищаются путем биотинилирования и истощения всех ненейрональных клеток в качестве отрицательного отбора. Шаги, перечисленные в одной строке, указываются для выполнения сразу. Сокращения: Anti-ACSA-2 = поверхностный антиген астроцитов-2; ЭАЭ = экспериментальный аутоиммунный энцефаломиелит; FcR = Fc-рецептороподобный белок; MACS = магнитно-активируемая сортировка клеток. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
9. Анализ чистоты изолированных резидентных типов клеток ЦНС (продолжительность: около 2 часов)
ПРИМЕЧАНИЕ: Рекомендуется проведение проточной цитометрии всех четырех изолированных популяций резидентных клеток ЦНС для измерения и сравнения их чистоты и жизнеспособности. Поэтому необходимо окрашивать все типы клеток антителом, помеченным флуорофором. Окрашивание живых/мертвых клеток осуществляется с помощью фиксируемого красителя жизнеспособности (1:10 000).
- Панель чистоты - протокол внеклеточного окрашивания
- Используйте 1 x 105 клеток, растворенных в 50 мкл PBS на окрашивание.
- Приготовьте окрашивающую мастер-смесь, растворенную в PBS с 2% FCS/2 мМ ЭДТА, состоящую из следующих флуорохром-конъюгированных моноклональных антител, нацеленных на клеточно-специфичные поверхностные маркеры: CD11b FITC (клон 1/70, 1:100)25,26,27,28, Биотин-ПЭ (клон Био3-18Е7, 1:200)29,30,31,32, ACSA-2 PE-Vio615 (клон REA-969, 1:200)33,34,35, O4 APC (клон REA-576, 1:400) и CD45 BV510 (клон 30-F11, 1:150)36,37. Добавьте 1 мкг анти-CD16/32 на 1 x 106 клеток, чтобы блокировать Fc-рецептор3 8,39. Перемешайте все антитела перед использованием.
- Центрифугируйте клеточную суспензию в течение 5 мин при 540 x g и 4 °C и осторожно отсасывайте надосадочную жидкость.
- Ресуспендант клеточной гранулы в 100 мкл соответствующей мастер-смеси и инкубируют образец в течение 15 мин при RT в темноте.
- Промывают клетки 500 мкл 1x PBS с 2% FCS/2 мМ ЭДТА и центрифуируют образец в течение 5 мин при 540 x g и 4 °C.
- Отсасывайте надосадочную жидкость и ресуспендируйте клеточную гранулу с 70 мкл 1x PBS с 2% FCS/2 мМ ЭДТА.
- Встряхните образец, чтобы полностью диссоциировать клеточную гранулу. После этого образец готов к анализу методом проточной цитометрии.
- Панель чистоты - протокол внутриклеточного окрашивания с NeuN
- Используют 1 x 10,5 клеток каждой клеточной популяции для внутриклеточного окрашивания NeuN, который является нейрон-специфическим ядерным маркером 40,41. Это дополнительный способ окрашивания жизнеспособных нейронов.
- Перенесите 1 x 105 клеток каждой клеточной популяции в пробирку FACS. Добавьте 1 мл PBS с 2% FCS/2 мМ ЭДТА на пробирку. Центрифугируйте пробирки при 540 x g и 4 °C в течение 5 мин.
- Тем временем готовят мастер-смесь, растворенную в PBS с 2% FCS/2 мМ ЭДТА, состоящую из следующих флуорохром-конъюгированных моноклональных антител, нацеленных на клеточные поверхностные маркеры: CD11b FITC (клон M1/70, 1:100)25,26,27,28, биотин-ПЭ (клон Bio3-18E7, 1:200)29,30,31,32, ACSA-2 PE-Vio615 (клон REA-969, 1:200)33,34,35 и CD45 BV510 (клон 30-F11, 1:150)36,37.
- Аспирируют надосадочную жидкость и ресуспендируют клетки в 100 мкл приготовленной мастер-смеси и инкубируют образец в течение 10 мин при РТ в темноте.
- Промойте клетки 100 мкл PBS с 2% FCS/2 мМ ЭДТА и снова центрифуйте их при 540 x g и 4 °C в течение 5 минут.
- Тем временем приготовьте 200 мкл раствора для фиксации/пермеабилизации: добавьте 50 мкл концентрированного запаса концентрата фиксации/пермеабилизации к 150 мкл разбавителя для фиксации/пермеабилизации до окончательного разбавления 1:4.
- Отсасывайте надосадочную жидкость и ресуспендируйте клетки в 100 мкл раствора 1-кратной фиксации/пермеабилизации. Инкубируют образец в течение 30 мин при 4 °C.
- Тем временем приготовьте 1 мл буфера для пермеабилизации/промывки, добавив 100 мкл буферного запаса для пермеабилизации к 900 мкл ddH2O для достижения окончательного разбавления 1:10.
- Промывают клетки 1 раз 100 мкл 1x буфера для пермеабилизации/промывки и центрифуируют образец при 540 x g и 4 °C в течение 5 мин.
- Тем временем приготовьте еще одну мастер-смесь в буфере пермеабилизации/промывки, состоящем только из NeuN (NeuN AF647, клон EPR12763, 1:200) и 1 мкг анти-CD16/32 на 106 клеток для блокирования Fc-рецептора.
- Аспирировать надосадочную жидкость. Ресуспендант фиксированных и пермеабилизированных клеток в 50 мкл второй мастер-смеси и инкубируют в течение 30 мин при 4 °C.
- Промывают образец 100 мкл 1-кратного буфера для пермеабилизации/промывки и центрифуируют при 540 x g и 4 °C в течение 5 мин.
- Выбросьте надосадочную жидкость и повторно суспендируйте клеточную гранулу в 70 мкл PBS с 2% FCS/2 мМ ЭДТА. После этого образец готов к проточному цитометрическому анализу.
- После настройки панели на проточном цитометре соберите клетки для анализа чистоты с помощью программного обеспечения для анализа проточной цитометрии.
10. Статистический анализ
- Выполняйте статистический анализ и создавайте графики с помощью программы графического анализа. Данные представлены в виде среднего ± SEM.
Representative Results
Существующий протокол позволяет одновременно изолировать все основные резидентные клетки ЦНС, т.е. микроглию, олигодендроциты, астроциты и нейроны, из одной реплики ЦНС. Это важно для сокращения численности мышей, необходимых для такого рода экспериментов, и для обеспечения сопоставимости молекулярных и биохимических анализов на клеточном уровне. Если отдельные типы клеток изолированы из разных репликаций ЦНС, клеточные взаимодействия не могут быть точно отображены, а потенциальные технические отклонения во время процессов выделения могут повлиять на дальнейший последующий анализ. Кроме того, молекулярные и биохимические результаты каждого типа клеток не могут быть сопоставимы друг с другом, поскольку они не получены из одного и того же контекста EAE. Ранее существовавший протокол MACS с использованием коммерческой системы/комплекта был адаптирован для обеспечения одновременной изоляции вышеупомянутых типов клеток.
Выделение микроглии проводили с помощью микрогранул анти-CD11b, олигодендроцитов выделяли с помощью микрогранул анти-O4 (табл. 1), а микрогранулы анти-ACSA-2 использовали для выделения астроцитов (табл. 2). Напротив, выделение нейронов представляет собой отрицательный отбор и было достигнуто путем биотинилирования и магнитного мечения всех ненейрональных клеток (табл. 2). Все ненейрональные клетки (например, олигодендроциты, микроглия, астроциты, эндотелиальные клетки и фибробласты), за исключением клеток крови, могут быть магнитно помечены с помощью биотино-конъюгированного антитела, специфически направленного против поверхностного антигена, экспрессируемого на этих ненейрональных клетках (табл. 2). Путем истощения этих магнитно-меченых ненейрональных клеток могут быть получены высокочистые и жизнеспособные популяции нейрональных клеток 30,42,43.
Были разработаны две новые панели проточной цитометрии для анализа чистоты полученных одноклеточных суспензий. Здесь использовались специфичные для типа клеток поверхностные и ядерные маркеры в сочетании с дискриминацией живых/мертвых клеток.
Результирующая выходность клеток на мышь и тип клеток (рис. 3A) была проанализирована и привела к среднему значению 8. 4 x 105 ± 3 x 104 микроглии, 3,23 x 106 ± 1 x 105 олигодендроцитов, 8,6 x 105 ± 2 x 104 астроцитов и 4,5 x 105 ± 1 x 104 нейронов на наивную мышь.
В контексте исследования патологических моделей нейровоспаления протокол также был применен к мышиной модели ЭАЭ. Мышей усыпляли на 16-й день после индукции ЭАЭ, представляющей собой максимум заболевания. В этих условиях ЭАЭ были выделены примерно 2,9 x 106 ± 6,7 x 105 олигодендроцитов, 5,2 x 105 ± 9 x 104 астроцитов и 4,4 x 105 ± 4 x 104 нейронов. Выход клеток микроглии был снижен примерно до 1,7 x 105 ± 4 x 104 микроглии на мышь EAE из-за дополнительной сортировки клеток после этапов MACS (рис. 3A).
После выделения фенотипические характеристики различных клеточных популяций с помощью проточной цитометрии доказали, что можно получить жизнеспособные одноклеточные суспензии с чистотой около 90% для всех основных типов клеток ЦНС (рис. 3B). Микроглия была ограничена как CD45intCD11b, как определено в литературе 44,45,46,47.
При ЭАЭ микроглия должна была быть отсортирована от всех CD11b+ клеток, чтобы дифференцировать их от других CD11b+ иммунных клеток, таких как моноциты, нейтрофилы, естественные клетки-киллеры, гранулоциты и макрофаги, которые иммигрируют в ЦНС во время нейровоспаления 27,28,48. Таким образом, микроглия была отсортирована как CD45intCD11high клетки из суспензии клеток CD11b+. Вся стратегия сортировки микроглии показана на рисунке 4. У наивных мышей популяция микроглии составляла 91,16% всех живых одиночных клеток (96% от общей популяции CD11b+) (рис. 4A). У мышей с ЭАЭ популяция микроглии составила 46,85% от всех живых одиночных клеток (55% от общей популяции CD11b+) (рис. 4B). Несмотря на то, что процедуры MACS и FACS подвергают отдельные клетки механическому воздействию, 75,41% ± 8,63% отсортированных очищенных микроглий оказались жизнеспособными (рис. 3B).
Астроциты и нейроны, которые были непосредственно выделены из исходной клеточной суспензии ЦНС, показали соответствующую контаминацию олигодендроцитами, что привело к предположению, что одновременная изоляция нейронов и астроцитов от отрицательного потока олигодендроцитов может предотвратить это загрязнение. Анализ методом проточной цитометрии подтвердил, что астроциты, выделенные из отрицательного потока олигодендроцитов, имели чистоту 89,23% ± 2,78% и демонстрировали жизнеспособность 80,56% ± 1,41%. Как и в случае с этими результатами, чистота нейронов, выделенных из фракции O4-клеток , составила 81,25% ± 3,31%, а жизнеспособность — 83,90% ± 2,61% (рис. 3B). Эти данные также подтверждают, что одновременное выделение этих двух типов клеток только впоследствии с выделением олигодендроцитов не оказывает влияния на количество жизнеспособных функциональных клеток.
Результаты, касающиеся жизнеспособности и чистоты выделенных одноклеточных суспензий, были очень похожи у мышей с ЭАЭ по сравнению с теми, которые были получены у наивных мышей, что подтверждает, что этот протокол подходит для здоровых мышей, а также в контексте ЭАЭ (рис. 3Б).
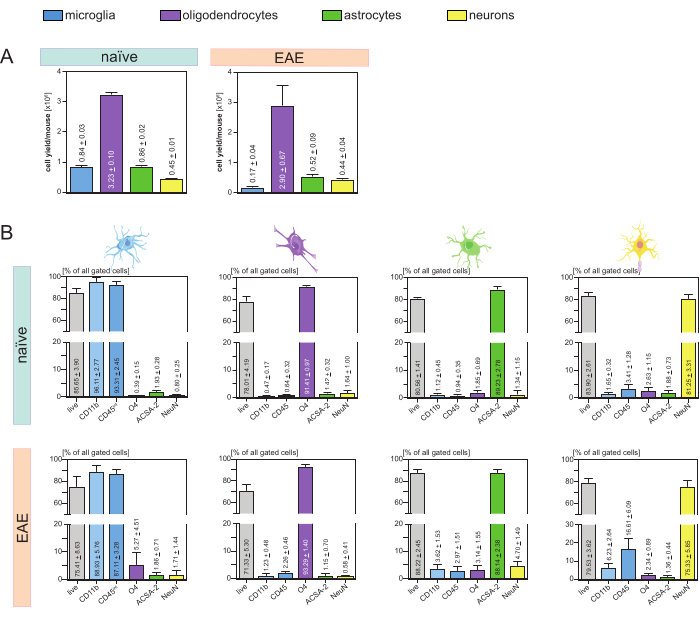
Рисунок 3: Выход клеток и валидация изолированных резидентных клеток ЦНС на основе проточной цитометрии. (A) Выход клеток на мышей и тип клеток после выделения резидентных клеток ЦНС у наивных мышей и мышей с ЭАЭ. Гистограммы визуализируют количество выходов ячеек на одну мышь и тип ячейки после реализации представленного протокола. Пять биологических репликатов были обработаны для получения результатов на наивных мышах, а четыре биологических репликата были проанализированы на мышах EAE. Изображены соответствующие средства ± SEM. (B) Соответствующие анализы чистоты и жизнеспособности очищенных клеточных фракций. Гистограммы показывают жизнеспособность и чистоту полученных одноклеточных суспензий на основе их экспрессии маркеров, специфичных для типа клеток. NeuN использовали в качестве клеточного специфического ядерного маркера для нейронов. Было получено и сравнено пять биологических репликатов для каждого типа клеток как у здоровых, так и у мышей с ЭАЭ. Указываются соответствующие средства ± SEM. Сокращения: Anti-ACSA-2 = поверхностный антиген астроцитов-2; CD11b = циклин-зависимая киназа 11B; CD45 = тирозин-протеинфосфатаза рецепторного типа С; ЦНС = центральная нервная система; ЭАЭ = экспериментальный аутоиммунный энцефаломиелит; MACS = магнитно-активируемая сортировка клеток; NeuN = РНК-связывающий белок fox-1 гомолог 3; O4 = маркер олигодендроцитов O4; SEM = стандартная ошибка среднего значения. Эта цифра была изменена с49. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
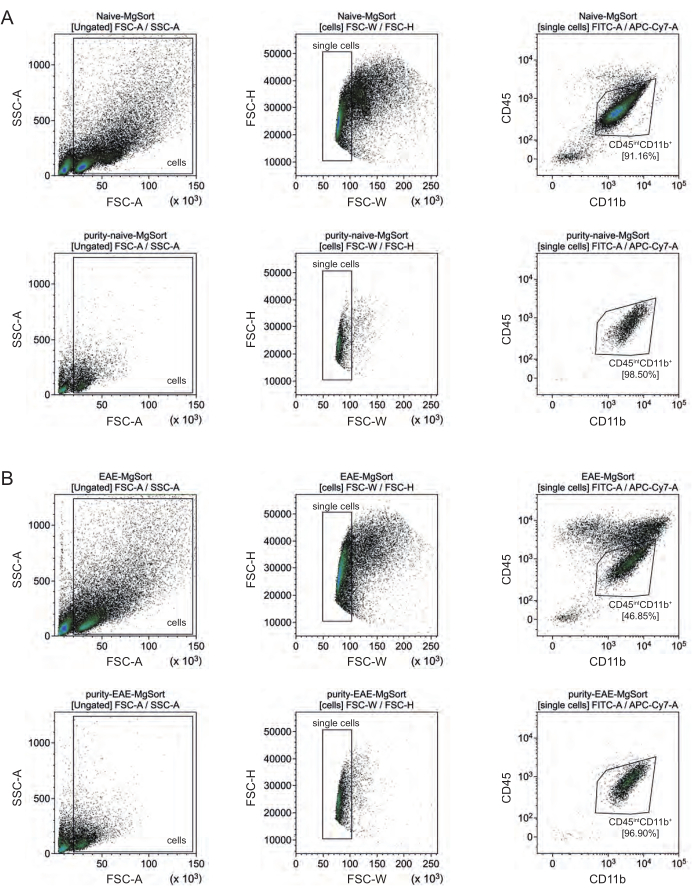
Рисунок 4: Стратегия стробирования для клеточной сортировки микроглии после выделения CD11b+ клеток. (А) Стратегия стробирования у наивных и (Б) ЭАЭ мышей. В верхней строке каждой панели отображаются точечные диаграммы до сортировки и в нижней строке после сортировки. После отбора живых (SSC-A/FSC-A) и одиночных клеток (FCS-H/FSC-W) популяцию CD45intCD11b+ клеток сортировали как популяцию микроглии. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Discussion
До сих пор методы картирования резидентных клеток ЦНС ex vivo путем сочетания масс-спектрометрии и секвенирования РНК обеспечивают очень точное клеточное профилирование в норме и при заболеваниях, но требуют амбициозных технических знаний и опыта вэтой области. Кроме того, они не позволяют проводить функциональные анализы и стоят очень дорого. Кроме того, микрофлюидные системы «мозг-на-чипе» обеспечивают быстрый и доступный скрининг механизмов заболевания и тестирование новых терапевтических подходов с ограничением роста и миграции клеток 52,53,54,55. Органоиды ЦНС также могут представлять собой эквивалентную альтернативу в будущем для исследования клеточного моделирования, межклеточных связей и взаимодействий во время течения заболевания 56,57,58,59. Тем не менее, флуоресцентная и магнитно-активируемая сортировка клеток в настоящее время является наиболее эффективным методом получения чистых и жизнеспособных одноклеточных суспензий ex vivo 35,60,61. Несмотря на то, что другие установленные технологические протоколы выделения резидентных типов клеток ЦНС сходны в отношении отдельных этапов магнитной изоляции и предшествующей диссоциации клеток, они предназначены для выполнения для каждого типа клеток отдельно. В отличие от этого, текущий протокол интегрирует различные методы изоляции для каждого типа клеток ЦНС в логический контекст, так что они могут выполняться одновременно одновременно и из одной суспензии клеток ЦНС (Таблица 1, Таблица 2). Таким образом, он позволяет проводить мультиомиксный анализ суспензии одной клетки ЦНС и, в конечном итоге, исследовать сложные нейронные сети. Даже если для выполнения этого протокола не обязательно объединять несколько тканей нескольких животных, такое объединение обеспечивает достаточное количество изолированных клеток для дальнейшего анализа. Использование разных мышей для выделения отдельных типов клеток исключило бы возможность анализа потенциальных клеточных взаимодействий. Кроме того, комбинирование индивидуальных методов выделения для различных типов клеток ЦНС, которые следуют за предшествующей диссоциацией ЦНС, экономит материальные затраты за счет использования одной диссоциированной клеточной суспензии ЦНС для всех последующих этапов магнитной изоляции. Кроме того, сводится к минимуму потенциальная техническая предвзятость, вызванная использованием различных мышей.
Одним из ограничений протокола может быть почти исключительное использование самок мышей C57BL/6J. Протокол иммунизации EAE был разработан и внедрен для самок мышей, поэтому этот протокол выделения клеток был реализован и у самок мышей C57BL/6J. Тем не менее, наивные самцы мышей также использовались во время разработки этого протокола, не признавая никакого влияния на результирующее количество клеток или чистоту. Еще одно ограничение влияет на магнитную клеточную изоляцию нейронов, так как не существует специфических микрогранул для выделения нейронов с точки зрения положительного отбора. Предполагалось, что чистая одноклеточная суспензия может быть получена путем мечения биотином и истощения всех ненейрональных клеток (табл. 2). Это предположение было подтверждено использованием NeuN в качестве специфического ядерного маркера для нейронов, интегрированного в упомянутую панель чистоты проточной цитометрии. Еще одно ограничение касается выделения микроглии у мышей с ЭАЭ. В этом случае выход клеток снижается по сравнению с другими типами клеток из-за дополнительного этапа сортировки после протокола MACS. Более того, можно утверждать, что сортировка увеличивает механическое напряжение микроглии по сравнению с другими клеточными популяциями. Индивидуальные стратегии сортировки могут привести к различному количеству выходов клеток. Если количество изолированных ячеек меньше, чем ожидалось или желательно, рекомендуется отрегулировать настройку стробирования и/или улучшить различение «живой/мертвый».
Критическим этапом протокола является удаление мусора. Градиент должен быть наложен очень медленно и аккуратно, чтобы создать три желаемые отдельные фазы (рис. 2A). Только в том случае, если миелин и другие остатки мусора в двух верхних фазах полностью удалены (рис. 2E), можно получить чистые одноклеточные суспензии и уменьшить дальнейшее загрязнение. Если полученной клеточной суспензии не хватает чистоты, вероятно, это тот раздел протокола, который следует улучшить в первую очередь после обеспечения правильного использования всех микрогранул.
Получение высоких уровней чистоты и жизнеспособности может быть сложной задачей в этом типе эксперимента. Ниже приведены некоторые рекомендации по устранению неполадок.
-Работа в стерильных условиях обязательна для предотвращения загрязнения различных микрогранул и возможности многократного использования, особенно для последующего культивирования.
-Настоятельно рекомендуется маркировка каждой тюбика, чтобы предотвратить путаницу.
-Избегайте использования неохлажденных реагентов / буферов. Храните все клеточные суспензии на льду в течение всего эксперимента, чтобы обеспечить высокую жизнеспособность.
-Время между различными рабочими этапами должно быть как можно короче. В протоколе нет конкретного раздела, где рекомендуется приостановить эксперимент.
-Крайне актуально придерживаться указанных инкубационных периодов.
В заключение, этот современный протокол одновременного выделения всех основных типов резидентных клеток ЦНС из одной репликации ЦНС дает возможность анализировать сложные нейронные сети и нейровоспалительные пути ex vivo из одной клеточной суспензии ЦНС. Таким образом, резидентные клетки ЦНС могут быть исследованы на разных стадиях течения заболевания, например, при нейровоспалении, нейродегенерации и/или ремиссии при ЭАЭ. Кроме того, межклеточные взаимодействия и биохимические пути могут быть изучены на индивидуальном уровне, а вариабельность в экспериментальных группах может быть снижена. Существует также возможность культивирования фракций изолированных клеток ЦНС в монокультурах для дальнейшего функционального анализа и валидации. В целом, этот протокол предлагает значительные достижения, потенциально влияющие на подходы к доклиническим и клиническим исследованиям.
Disclosures
Все авторы заявляют об отсутствии конфликта интересов.
Acknowledgements
Фигуры были созданы с помощью Adobe Illustrator (версия 2023) и Servier Medical Art (https://smart.servier.com). Антонию Хенес поддержал Фонд Юргена Манчота.
Materials
| Name | Company | Catalog Number | Comments |
| 70 μm cell strainers | Corning, MA, USA | 352350 | CNS tissue dissociation |
| ACSA-2 Antibody, anti-mouse, PE-Vio 615 (clone REA-969) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-116-244 | Flow cytometry, store at 4 °C |
| Adult Brain Dissociation Kit, mouse, and rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-107-677 | Tissue dissociation,contains debris and red blood cell removal solutions; prepare aliquots of enzyme A and P upon arrival and store them at -20 °C; store the remaining kit at 4 °C |
| Anti-ACSA-2 MicroBead Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-097-678 | MACS of astrocytes, store at 4 °C |
| Anti-mouse CD16/32 antibody | BioLegend, London, UK | 101301 | Flow cytometry, store at 4 °C |
| Anti-O4 MicroBeads, human, mouse, rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-094-543 | MACS of oligodendrocytes, store at 4 °C |
| AstroMACS Separation buffer | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-221 | MACS of astrocytes, store at 4 °C |
| Biotin Antibody, PE (clone Bio3-18E7) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-113-853 | Flow cytometry, store at 4 °C |
| BRAND Neubauer counting chamber | Thermo Fisher Scientific,Waltham, MA, USA | 10195580 | Cell counting |
| Brilliant Violet 510 anti-mouse CD45 Antibody (clone 30-F11) | BioLegend, London, UK | 103137 | Flow cytometry, store at 4 °C |
| CD11b MicroBeads, human, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-049-601 | MACS of microglia, store at 4 °C |
| DNAse I, recombinant, Rnase-free | Merck KGaA, Darmstadt, Germany | 4716728001 | Flow cytometry, store at -20° C |
| D-PBS with Calcium, Magnesium, Glucose, Pyruvat | Thermo Fisher Scientific,Waltham, MA, USA | 14287080 | Buffer, store at 4 °C |
| D-PBS, without calcium, without magnesium | Thermo Fisher Scientific,Waltham, MA, USA | 14190250 | Buffer, store at 4 °C |
| eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher Scientific,Waltham, MA, USA | 65-0865-14 | Flow cytometry, store at 4 °C |
| eBioscience Foxp3/Transcription factor staining buffer set | Thermo Fisher Scientific,Waltham, MA, USA | 00-5523-00 | Flow cytometry, store at 4°C |
| Falcon (15 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 11507411 | Cell tube |
| Falcon (50 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 10788561 | Cell tube |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Thermo Fisher Scientific,Waltham, MA, USA | 08-771-23 | Flow cytometry |
| FcR Blocking Reagent, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-092-575 | MACS of oligodendrocytes, store at 4 °C |
| Female C57BL/6J mice | Charles River Laboratories, Sulzfeld, Germany | Active EAE induction | |
| Fetal calf serum (FCS) | Merck KGaA, Darmstadt, Germany | F2442-50ML | Flow cytometry, store at -5 to -20 °C |
| FITC Rat Anti-CD 11b (clone M1/70) | BD Biosciences, San Jose, CA, USA | 553310 | Flow cytometry, store at 4 °C |
| Freund’s Complete adjuvant | Merck KGaA, Darmstadt, Germany | AR001 | Active EAE induction, store at 4 °C |
| GentleMACS C Tubes | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-093-237 | CNS tissue dissociation |
| GentleMACS Octo Dissociator with Heaters | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-096-427 | CNS tissue dissociation |
| Graphpad Prism 8.4.3 | Graphpad by Dotmatics | Graphical Analysis | |
| Isoflurane | AbbVie, North Chicago, IL, USA | Active EAE induction, store at 4 °C | |
| Kaluza Analysis Software V2.1.1 | Beckman Coulter, Indianapolis, IN, USA | Flow cytometry analysis | |
| LS Columns | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-401 | MACS |
| MACS BSA Stock Solution | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-376 | PB-buffer |
| MACS MultiStand | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-303 | MACS |
| MOG35–55 peptide | Charité, Berlin, Germany; alternatives: Genosphere Biotechnologies (Paris, France) or sb-Peptide (Saint Egrève, France) | Active EAE induction, store at -20 °C | |
| Mycobacterium tuberculosis strain H37 Ra | Becton, Dickinson and Company (BD),Franklin Lakes, NJ, USA | Active EAE induction, store at 4 °C | |
| Neuron Isolation Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-115-390 | MACS of neurons, store at 4 °C |
| O4 Antibody, anti-human/mouse/rat, APC, (clone REA-576) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-119-897 | Flow cytometry, store at 4 °C |
| Pertussis toxin in glycerol | Hooke Laboratories Inc., Lawrence, MA, USA | BT-0105 | Active EAE induction; store at -20 °C |
| pluriStrainer Mini 100 μm | pluriSelect Life Science UG, Leipzig, Sachsen, Germany | 43-10100-40 | Flow cytometry |
| QuadroMACS Separator | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-090-976 | MACS |
| Recombinant Alexa Fluor 647 Anti-NeuN antibody (clone EPR12763) | Abcam, Cambridge, UK | EPR12763 | Flow cytometry, store at -20 °C |
| Stainless Steel Brain Matrices, 1 mm | Ted Pella, Redding, CA, USA | 15067 | CNS tissue dissection |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific,Waltham, MA, USA | 15250061 | Cell counting |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific,Waltham, MA, USA | 15575020 | Flow cytometry, store at room temperature |
References
- Trapp, B. D., Nave, K. A. Multiple Sclerosis: An Immune or Neurodegenerative Disorder. Annu Rev Neurosci. 31 (1), 247-269 (2008).
- Stys, P. K., Zamponi, G. W., van Minnen, J., Geurts, J. J. Will the real multiple sclerosis please stand up. Nat Rev Neurosci. 13 (7), 507-514 (2012).
- Korn, T. Pathophysiology of multiple sclerosis. J Neurol. 255 (Suppl 6), 2-6 (2008).
- Ward, M., Goldman, M. D. Epidemiology and Pathophysiology of Multiple Sclerosis. CONTINUUM. 28 (4), 988-1005 (2022).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin Oligodendrocyte Glycoprotein (MOG35-55) Induced Experimental Autoimmune Encephalomyelitis (EAE) in C57BL/6 Mice. J Vis Exp. (86), 51275 (2014).
- Bittner, S., et al. The TASK1 channel inhibitor A293 shows efficacy in a mouse model of multiple sclerosis. Exp Neurol. 238 (2), 149-155 (2012).
- Göbel, K., et al. Plasma kallikrein modulates immune cell trafficking during neuroinflammation via PAR2 and bradykinin release. Proc Natl Acad Sci U S A. 116 (1), 271-276 (2019).
- Ballerini, C. Experimental Autoimmune Encephalomyelitis. Methods Mol Biol. 2285, 375-384 (2021).
- Birmpili, D., Charmarke Askar, I., Bigaut, K., Bagnard, D. The Translatability of Multiple Sclerosis Animal Models for Biomarkers Discovery and Their Clinical Use. Int J Mol Sci. 23 (19), 11532 (2022).
- Tsatas, O., Ghasemlou, N. Isolation and RNA purification of macrophages/microglia from the adult mouse spinal cord. J Immunol Methods. 477, 112678 (2020).
- Calvo, B., Rubio, F., Fernández, M., Tranque, P. Dissociation of neonatal and adult mice brain for simultaneous analysis of microglia, astrocytes and infiltrating lymphocytes by flow cytometry. IBRO Rep. 8, 36-47 (2020).
- Diaz-Amarilla, P., et al. Isolation and characterization of neurotoxic astrocytes derived from adult triple transgenic Alzheimer's disease mice. Neurochem Int. 159, 105403 (2022).
- Galatro, T. F., Vainchtein, I. D., Brouwer, N., Boddeke, E. W. G. M., Eggen, B. J. L. Isolation of Microglia and Immune Infiltrates from Mouse and Primate Central Nervous System. Methods Mol Biol. 1559, 333-342 (2017).
- Altendorfer, B., et al. Transcriptomic Profiling Identifies CD8+ T Cells in the Brain of Aged and Alzheimer's Disease Transgenic Mice as Tissue-Resident Memory T Cells. J Immunol. 209 (7), 1272-1285 (2022).
- Lanfranco, M. F., Sepulveda, J., Kopetsky, G., Rebeck, G. W. Expression and secretion of apoE isoforms in astrocytes and microglia during inflammation. Glia. 69 (6), 1478-1493 (2021).
- Swire, M., Ffrench-Constant, C. Oligodendrocyte-Neuron Myelinating Coculture. Methods Mol Biol. 1936, 111-128 (2019).
- Park, J., Koito, H., Li, J., Han, A. Microfluidic compartmentalized co-culture platform for CNS axon myelination research. Biomed Microdevices. 11 (6), 1145-1153 (2009).
- Facci, L., Barbierato, M., Skaper, S. D. Astrocyte/Microglia Cocultures as a Model to Study Neuroinflammation. Methods Mol Biol. 1727, 127-137 (2018).
- Speicher, A. M., Wiendl, H., Meuth, S. G., Pawlowski, M. Generating microglia from human pluripotent stem cells: novel in vitro models for the study of neurodegeneration. Mol Neurodegener. 14 (1), 46 (2019).
- Homayouni Moghadam, F., et al. Isolation and Culture of Embryonic Mouse Neural Stem Cells. J Vis Exp. (141), 58874 (2018).
- Santos, R., et al. Differentiation of Inflammation-Responsive Astrocytes from Glial Progenitors Generated from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 8 (6), 1757-1769 (2017).
- Tcw, J., et al. An Efficient Platform for Astrocyte Differentiation from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 9 (2), 600-614 (2017).
- Miltenyi, S., Müller, W., Weichel, W., Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Huntemann, N., et al. An optimized and validated protocol for inducing chronic experimental autoimmune encephalomyelitis in C57BL/6J mice. J Neurosci Methods. 367, 109443 (2022).
- Martin, E., El-Behi, M., Fontaine, B., Delarasse, C. Analysis of Microglia and Monocyte-derived Macrophages from the Central Nervous System by Flow Cytometry. J Vis Exp. (124), 55781 (2017).
- Sarkar, S., et al. Rapid and Refined CD11b Magnetic Isolation of Primary Microglia with Enhanced Purity and Versatility. J Vis Exp. (122), 55364 (2017).
- Rodríguez Murúa, S., Farez, M. F., Quintana, F. J. The Immune Response in Multiple Sclerosis. Annu Rev Pathol. 17, 121-139 (2021).
- Engelhardt, B., Ransohoff, R. M. Capture, crawl, cross: the T cell code to breach the blood-brain barriers. Trends Immunol. 33 (12), 579-589 (2012).
- Elia, G. Biotinylation reagents for the study of cell surface proteins. Proteomics. 8 (19), 4012-4024 (2008).
- Berl, S., et al. Enrichment and isolation of neurons from adult mouse brain for ex vivo analysis. J Neurosci Methods. 283, 15-22 (2017).
- Turvy, D. N., Blum, J. S. Biotin Labeling and Quantitation of Cell-Surface Proteins. Curr Protoc Immunol. 18 (7), (2001).
- Mao, S. Y. Biotinylation of Antibodies. Methods Mol Biol. 115, 39-41 (1999).
- Kantzer, C. G., et al. Anti-ACSA-2 defines a novel monoclonal antibody for prospective isolation of living neonatal and adult astrocytes. Glia. 65 (6), 990-1004 (2017).
- Batiuk, M. Y., et al. An immunoaffinity-based method for isolating ultrapure adult astrocytes based on ATP1B2 targeting by the ACSA-2 antibody. J Biol Chem. 292 (21), 8874-8891 (2017).
- Pan, J., Wan, J. Methodological comparison of FACS and MACS isolation of enriched microglia and astrocytes from mouse brain. J Immunol Methods. 486, 112834 (2020).
- Donovan, J. A., Koretzky, G. A. CD45 and the immune response. J Am Soc Nephrol. 4 (4), 976-985 (1993).
- Hathcock, K. S., Hirano, H., Hodes, R. J. CD45 expression by murine B cells and T cells: Alteration of CD45 isoforms in subpopulations of activated B cells. Immunol Res. 12 (1), 21-36 (1993).
- Balogh, P., Tew, J. G., Szakal, A. K. Simultaneous blockade of Fc? receptors and indirect labeling of mouse lymphocytes by the selective detection of allotype-restricted epitopes on the kappa chain of rat monoclonal antibodies. Cytometry. 47 (2), 107-110 (2002).
- Becerril-García, M. A., et al. Langerhans Cells From Mice at Birth Express Endocytic- and Pattern Recognition-Receptors, Migrate to Draining Lymph Nodes Ferrying Antigen and Activate Neonatal T Cells in vivo. Front Immunol. 11, 744 (2020).
- Dent, M. A., Segura-Anaya, E., Alva-Medina, J., Aranda-Anzaldo, A. NeuN/Fox-3 is an intrinsic component of the neuronal nuclear matrix. FEBS Lett. 584 (13), 2767-2771 (2010).
- Duan, W., et al. Novel Insights into NeuN: from Neuronal Marker to Splicing Regulator. Mol Neurobiol. 53 (3), 1637-1647 (2016).
- Monteiro, R., Sivasubramanian, M. K., Balasubramanian, P., Subramanian, M. Obesity-Induced Sympathoexcitation is Associated with Glial Senescence in the Brainstem. FASEB J. 34 (S1), 1-1 (2020).
- Li, S., Chang, L., Teissie, J. . Electroporation protocols: mircroorganism, mammalian system, and nanodevice. , (2020).
- Kettenmann, H., Hanisch, U. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiol Rev. 91 (2), 461-553 (2011).
- Haage, V., et al. Comprehensive gene expression meta-analysis identifies signature genes that distinguish microglia from peripheral monocytes/macrophages in health and glioma. Acta Neuropathol Commun. 7 (1), 20 (2019).
- Kosior, N., Petkau, T. L., Connolly, C., Lu, G., Leavitt, B. R. Isolating cells from adult murine brain for validation of cell-type specific cre-mediated deletion. J Neurosci Methods. 328, 108422 (2019).
- Jurga, A. M., Paleczna, M., Kuter, K. Z. Overview of General and Discriminating Markers of Differential Microglia Phenotypes. Front Cell Neurosci. 14, 198 (2020).
- Man, S., Ubogu, E. E., Ransohoff, R. M. Inflammatory Cell Migration into the Central Nervous System: A Few New Twists on an Old Tale. Brain Pathol. 17 (2), 243-250 (2007).
- Schroeter, C. B., et al. One Brain-All Cells: A Comprehensive Protocol to Isolate All Principal CNS-Resident Cell Types from Brain and Spinal Cord of Adult Healthy and EAE Mice. Cells. 10 (3), 651 (2021).
- Sankowski, R., et al. Mapping microglia states in the human brain through the integration of high-dimensional techniques. Nate Neurosci. 22 (12), 2098-2110 (2019).
- Brennan, F. H., et al. Microglia coordinate cellular interactions during spinal cord repair in mice. Nat Commun. 13 (1), 4096 (2022).
- Enright, H. A., et al. Functional and transcriptional characterization of complex neuronal co-cultures. Sci Rep. 10 (1), 11007 (2020).
- Mofazzal Jahromi, M. A., et al. Microfluidic Brain-on-a-Chip: Perspectives for Mimicking Neural System Disorders. Mol Neurobiol. 56 (12), 8489-8512 (2019).
- Chin, E., Goh, E. Blood-brain barrier on a chip. Methods Cell Biol. 146, 159-182 (2018).
- Miccoli, B., Braeken, D., Li, Y. E. Brain-on-a-chip Devices for Drug Screening and Disease Modeling Applications. Curr Pharm Des. 24 (45), 5419-5436 (2019).
- Giandomenico, S. L., et al. Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output. Nat Neurosci. 22 (4), 669-679 (2019).
- Pellegrini, L., et al. Human CNS barrier-forming organoids with cerebrospinal fluid production. Science. 369 (6500), eaaz5626 (2020).
- Chhibber, T., et al. CNS organoids: an innovative tool for neurological disease modeling and drug neurotoxicity screening. Drug Discov Today. 25 (2), 456-465 (2020).
- Tang, X. Y., et al. Human organoids in basic research and clinical applications. Signal Transduct TargetTher. 7 (1), 168 (2022).
- Sutermaster, B. A., Darling, E. M. Considerations for high-yield, high-throughput cell enrichment: fluorescence versus magnetic sorting. Sci Rep. 9 (1), 227 (2019).
- Doughty, D., et al. Development of a novel purification protocol to isolate and identify brain microglia. Exp Biol Med. 247 (16), 1433-1446 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved