A subscription to JoVE is required to view this content. Sign in or start your free trial.
Guaine di mais staccate per l'imaging su cellule vive dell'infezione da patogeni fungini del mais fogliare
In This Article
Summary
Questo manoscritto descrive in dettaglio un protocollo di inoculazione ottimizzato che utilizza guaine fogliari di mais staccate per studi citologici, fisiologici e molecolari riproducibili delle interazioni del mais con i patogeni fungini delle piante. Le guaine fogliari facilitano l'osservazione in tempo reale delle interazioni cellulari tra la pianta vivente e il fungo nei tessuti non fissati.
Abstract
Abbiamo ottimizzato un protocollo per inoculare guaine fogliari di mais con funghi patogeni fogliari emibiotrofi e necrotrofi. Il metodo è modificato da quello originariamente applicato alle guaine delle foglie di riso e consente l'osservazione microscopica diretta della crescita e dello sviluppo dei funghi nelle cellule vegetali viventi. Le guaine fogliari raccolte da piantine di mais con due colletti fogliari completamente emersi vengono inoculate con gocce da 20 μL di 5 x 105 spore/mL di sospensioni di spore fungine e incubate in camere di umidità a 23 °C sotto luce fluorescente continua. Dopo 24-72 ore, il tessuto in eccesso viene rimosso con una lama di rasoio per lasciare un singolo strato di cellule epidermiche, un campione otticamente trasparente che può essere visualizzato direttamente senza la necessità di fissazione chimica o pulizia. Le cellule vegetali e fungine rimangono in vita per tutta la durata dell'esperimento e le interazioni possono essere visualizzate in tempo reale. Le guaine possono essere colorate o sottoposte a plasmolisi per studiare la citologia dello sviluppo e la vitalità delle cellule ospiti e patogene durante l'infezione e la colonizzazione. I ceppi fungini trasformati per esprimere proteine fluorescenti possono essere inoculati o co-inoculati sulle guaine per una maggiore risoluzione e per facilitare la valutazione di interazioni competitive o sinergiche. I ceppi fungini che esprimono proteine di fusione fluorescenti possono essere utilizzati per tracciare e quantificare la produzione e il targeting di queste singole proteine nelle piante. I tessuti della guaina inoculati possono essere estratti per caratterizzare acidi nucleici, proteine o metaboliti. L'uso di questi saggi di guaina ha notevolmente fatto progredire gli studi dettagliati dei meccanismi di patogenicità fungina nel mais e anche degli effettori proteici fungini e dei metaboliti secondari che contribuiscono alla patogenicità.
Introduction
Le analisi spaziali e temporali a livello cellulare sono fondamentali per comprendere la fisiologia e la citologia delle interazioni fungo-pianta. I tessuti fogliari che sono stati fissati chimicamente 1,2,3 o eliminati e colorati4, così come le membrane artificiali 5, sono stati utilizzati in passato per studiare la citologia dello sviluppo dei patogeni fogliari e le interazioni pianta-fungo. Tuttavia, lo studio degli eventi di infezione nei tessuti viventi dell'ospite in tempo reale senza fissazione o chiarificazione è impegna....
Protocol
NOTA: il flusso di lavoro per il metodo è illustrato nella Figura 1.
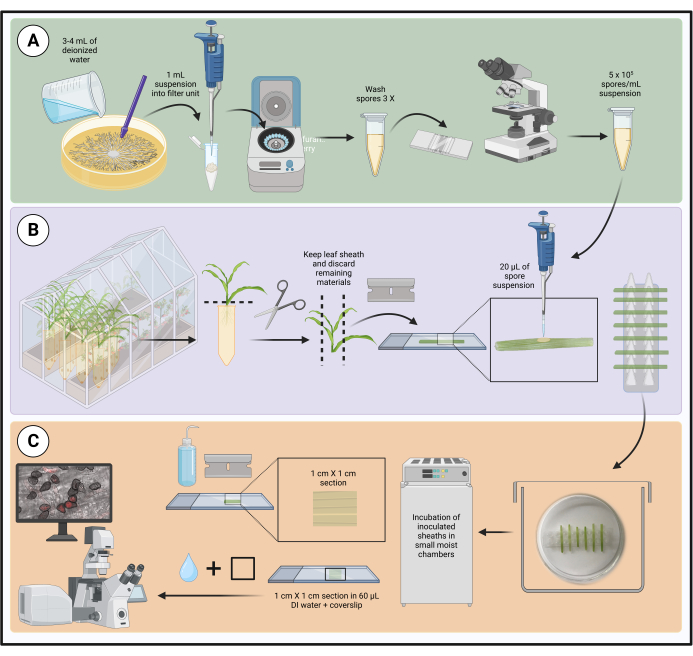
Figura 1: Fasi del protocollo di inoculo ottimizzato utilizzando guaine fogliari di mais staccate. La preparazione della sospensione di spore, l'inoculazione della guaina fogliare e la preparazione del campione per la micro.......
Representative Results
Gli esempi seguenti descrivono i risultati rappresentativi in seguito all'uso del metodo di inoculazione della guaina fogliare di mais. Questi esempi dimostrano la facilità, la velocità e la precisione con cui l'osservazione e il confronto delle interazioni mais-funghi possono essere realizzati in tempo reale con questo saggio ottimizzato. L'imaging di cellule vive consente anche l'estrazione di informazioni quantitative, fornendo uno strumento utile per studi molecolari, citologici e fisiologici comparativi. Ulteriori.......
Discussion
Il metodo di inoculazione della guaina fogliare ottimizzato qui descritto è modificato da un protocollo originale che è stato sviluppato ed è stato applicato alle guaine fogliari di riso 6,8,36. Consente osservazioni dirette e dettagliate della crescita e dello sviluppo fungino nelle cellule vegetali viventi con microscopia a campo largo o confocale. Il protocollo è adatto per la caratterizzazione, il confronto e la quantifi.......
Disclosures
Gli autori dichiarano di non avere interessi finanziari concorrenti e nulla da rivelare.
Acknowledgements
Gli autori ringraziano l'USDA-NIFA per il loro sostegno finanziario (numeri di sovvenzione 2018-67013-28489 e 2020-70410-32901). Tutte le opinioni, i risultati, le conclusioni o le raccomandazioni espresse in questo manoscritto sono esclusivamente quelle degli autori e non riflettono necessariamente le opinioni del Dipartimento dell'Agricoltura degli Stati Uniti. Ringraziamo la studentessa brasiliana di Science Without Borders, Mayara de Silva, per le immagini che appaiono nella Figura 6A e nella Figura 7D. Ringraziamo anche il Dipartimento di Patologia Vegetale dell'Università del Kentucky per aver fornito l'accesso ai microscopi con....
Materials
| Name | Company | Catalog Number | Comments |
| Axiocam monochrome microscope camera | ZEISS | 426560-9010-000 | Compatible with the Axioplan 2 microscope; provides low read noise and high speed for live cell imaging |
| Axioplan 2 epifluorescence microscope | ZEISS | N/A | Allows live viewing and image/video capture of biological samples |
| Benchtop centrifuge 24 X 1.5/2 mL | Thermo Fisher Scientific | 75002431 | Sorvall Legend Micro 17; max speed: 13,300 rpm (17,000 x g) |
| Falcon bacteriological Petri dish with lid | Fisher Scientific | 08-757-105 | Polystyrene material; hydrophobic surface |
| Filter paper | Fisher Scientific | 09-920-115 | Whatman grade 1 for Petri plate moist chambers |
| FV 3000 laser scanning confocal microscope | Olympus | N/A | For visualization of fungal transformants' |
| Germination paper | Anchor Paper Co. | SD7615L | 76# heavy weight for plastic box moist chambers |
| Glass Petri dishes | VWR International | 75845-542 | Type 1 class A, 33 expansion borosilicate glass; complete set (cover + bottom), for Petri plate moist chambers |
| Glass wool | Ohio Valley Specialty Chemical | 3350 | For glass-wool filter units |
| Hemocytometer/Neubauer counting chamber and cover glass | VWR International | 15170-172 | 0.1 mm chamber depth; comes with two 0.4 mm cover glasses |
| Microscope coverslips | Fisher Scientific | 12-553-457 | Borosilicate glass; 100/Pk.; 22 mm length, 22 mm width |
| Maize cultivar Golden Jubilee seeds | West Coast Seeds Ltd., Delta, BC, Canada | CN361 | Matures in 95-105 days; seed type: F1 |
| Microcentrifuge tubes | USA Scientific | 1415-2500 | 1.5 mL capacity |
| Microscope slides | Fisher Scientific | 12-550-123 | Superfrost white tab slide; 76 mm length, 25 mm width |
| Oatmeal Agar (OA) | VWR International | 255210 | Difco Oatmeal Agar, BD; 500 g |
| Nail polish | Revlon | 43671 | Clear nail polish for sealing microscope slides; color 771 Clear |
| Non-skirted 96-well PCR plate | USA Sientific | 1402-9500 | 100 uL plate volume |
| Pestle for microcentrifuge tubes | USA Scientific | 1415-5390 | Conical tip; polypropylene material |
| PlanApo 60X/1,00 WLSM water objective | Olympus | 1-UB933 | Compatible with the Olympus FV 3000 confocal microscope |
| Potato Dextrose Agar (PDA) | VWR International | 90000-758 | Difco Potato Dextrose Media, BD; 500 g |
| Pro-Mix BX | Premium Horticulture Supply Co. | N/A | Premium general-purpose growing medium formulated to provide a balance of water retention and proper drainage |
| SC10 cone-tainers | Greenhouse Megastore | CN-SS-SC-10B | 1.5 inch diameter, 8.25 inch depth, and a volume of 164 mL |
| SC10 cone-tainers tray | Greenhouse Megastore | CN-SS-SCTR98 | 24 inch length x 12 inch width x 6.75 inch height; holds up to 98 of SC10 cone-tainers |
| Single edge razor blade | Thermo Fisher Scientific | 17-989-145 | AccuTec blade; steel material; 38 mm length blade |
| Storage containers/boxes with latch closure | Target | 002-02-0405 | Clear view storage boxes for rmoist chamber; outside dimensions: 23 5/8 inch x 16 3/8 inch x 6 1/2 inch; 32 qt. capacity |
References
- Cheng, Y., Yao, J., Zhang, H., Huang, L., Kang, Z. Cytological and molecular analysis of nonhost resistance in rice to wheat powdery mildew and leaf rust pathogens. Protoplasma. 252 (4), 1167-1179 (2015).
- Hickey, E. L., Coffey, M. D.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved