Split Retina como uma Preparação Flatmount Melhorada para o Estudo de Neurônios da Camada Nuclear Interna na Retina de Vertebrados
In This Article
Summary
Este trabalho apresenta uma preparação alternativa de retina flatmount na qual a remoção de corpos celulares fotorreceptores permite uma difusão mais rápida de anticorpos e um melhor acesso da pipeta de remendo aos neurônios internos da retina para experimentos de imunohistoquímica, hibridização in situ e eletrofisiologia.
Abstract
As células bipolares e as células horizontais da retina dos vertebrados são os primeiros neurônios a processar a informação visual depois que os fótons são detectados pelos fotorreceptores. Eles realizam operações fundamentais, como adaptação à luz, sensibilidade ao contraste e oponência espacial e de cores. Uma compreensão completa dos circuitos precisos e dos mecanismos bioquímicos que governam seu comportamento fará avançar a pesquisa em neurociência visual e a medicina oftalmológica. No entanto, as preparações atuais para examinar células bipolares e horizontais (montagens inteiras da retina e cortes verticais) são limitadas em sua capacidade de capturar a anatomia e fisiologia dessas células. Neste trabalho, apresentamos um método para remoção de corpos celulares fotorreceptores de retinas vivas de camundongos planos, proporcionando melhor acesso a células bipolares e horizontais para um eficiente clampeamento de remendo e rápida marcação imunológica. As retinas divididas são preparadas sanduíche de uma retina isolada de camundongo entre dois pedaços de nitrocelulose e, em seguida, descascando-os suavemente. A separação divide a retina logo acima da camada plexiforme externa para produzir dois pedaços de nitrocelulose, um contendo os corpos celulares fotorreceptores e outro contendo a retina interna restante. Ao contrário dos cortes verticais de retina, a preparação de retina dividida não corta os processos dendríticos dos neurônios internos da retina, permitindo gravações de células bipolares e horizontais que integram as contribuições de redes acopladas de junções comunicantes e células amácrinas de campo amplo. Este trabalho demonstra a versatilidade desta preparação para o estudo de células horizontais e bipolares em eletrofisiologia, imunohistoquímica e experimentos de hibridização in situ .
Introduction
A retina é um tecido neural fino localizado no olho posterior, onde a luz é interceptada e processada em um sinal eletroquímico que pode ser interpretado pelo cérebro. Na parte posterior da retina, os fotorreceptores bastonetes e cônicos são estimulados pela luz, o que reduz a taxa de liberação tônica do neurotransmissor, o glutamato1. Os primeiros neurônios a experimentar e responder a essa mudança induzida pela luz na concentração de glutamato são as células bipolares (BCs) e as células horizontais (HCs), cujos somas residem na região mais externa da camada nuclear interna (INL). Esses neurônios de segunda ordem realizam o primeiro estágio de processamento do sinal na retina e moldam características críticas da visão, como adaptação à luz, sensibilidade ao contraste e oponência espacial/colorida2. Embora essas funções tenham sido atribuídas a CBs e HCs, os mecanismos circuitais e bioquímicos subjacentes a esses processos não são totalmente compreendidos3. Portanto, o avanço de ferramentas e métodos para explorar a fisiologia do CM e do CH é de suma importância.
Os cortes verticais (transversais) da retina têm se mostrado o modelo mais prático para o estudo de CBs e HCs; no entanto, certos aspectos da fisiologia da CB e da CH são inacessíveis ao experimentador sob esse modelo. Registros diretos de HCs ou medidas indiretas de seus efeitos sobre CBs não refletem a conectividade endógena da retina, uma vez que os processos laterais dessas células são cortados durante o fatiamento. Preparações de retina montadas inteiras contornam esse problema preservando esses processos laterais, mas as camadas retinianas circundantes representam um desafio para o acesso a essas células4. Embora existam exemplos abundantes de registros de imunomarcação 5,6,7,8 e patch clamp9 de neurônios INL em retinas de montagem inteira, há uma oportunidade de agilizar e simplificar a coleta desses dados. As limitações inerentes das seções transversais e os desafios de todo o modelo de montagem inspiraram o desenvolvimento desta preparação alternativa de retina de montagem plana.
O trabalho a seguir descreve um protocolo para remover facilmente a camada fotorreceptora de retinas vivas e planas para melhorar o acesso a BCs e HCs para um clampeamento simplificado e imunomarcação mais rápida e eficiente. O descamamento de dois pedaços de membrana de nitrocelulose ligados a cada lado de uma retina isolada rasga o tecido através dos axônios fotorreceptores, deixando uma retina dividida que retém a camada plexiforme externa (OPL) e todas as camadas internas da retina. Enquanto outros descreveram protocolos para separar mecanicamente camadas da retina, esses métodos são pouco adequados para aplicações de patch clamping e microscopia ou requerem manipulação tediosa do tecido. Vários desses métodos requerem tecido congelado ou liofilizado para separação das camadas, tornando-os incompatíveis com os experimentos de eletrofisiologia10,11,12. Outros são projetados para tecidos vivos, mas necessitam de 5-15 peelings sequenciais com papel filtro 4,11 ou tratamento com tripsina13 para remover os fotorreceptores. A técnica aqui descrita melhora suas antecessoras simplificando o procedimento de remoção de fotorreceptores e ampliando o repertório de aplicações a jusante.
Protocol
Os camundongos receberam água e ração ad libitum e foram mantidos em um ciclo claro/escuro de 12 horas. Os camundongos foram eutanasiados por exposição ao isoflurano seguida de deslocamento cervical. Todos os procedimentos com animais estavam de acordo com as diretrizes do National Institutes of Health e aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Oregon Health and Science University.
NOTA: A enucleação ocular, a dissecção da retina e a divisão da retina devem ser realizadas o mais rápido possível para preservar a saúde do tecido vivo. Procure completar a dissecção em < 4 min por olho. Essas três etapas devem ser executadas sequencialmente. Camundongos selvagens: Camundongos adultos (>3 meses) machos e fêmeas C57BL/6J foram usados para experimentos. Para a morfologia das sinapses, camundongos expressando proteína fluorescente verde (GFP) sob o promotor Pcp2 (Pcp2-cre/GFP)14 foram usados. Camundongos transgênicos: Para visualização de células horizontais com GFP durante experimentos de imunohistoquímica ou eletrofisiologia, um camundongo triplo-transgênico foi usado: vGATFLPo; vGlut2Cre; Ai80d. As linhagens vGATFlpo e vGluT2Cre são camundongos knock-in que expressam Flpo ou Cre recombinase a jusante de seus respectivos promotores. O camundongo Ai80d é um camundongo repórter interseccional (CatCh/EYFP) e expressará apenas rodopsina de canal permeável a Ca2+ (ChR2) em células que expressam recombinases de Cre e Flpo. Assim, o camundongo triplo transgênico só expressa ChR2 em células com história de expressão de VGAT e vGluT2.
1. Preparo de materiais para dissecção e divisão da retina
- Preparar pedaços de membrana de nitrocelulose
NOTA: Desanexar a retina dividida da membrana de nitrocelulose reduz a fluorescência de fundo na microscopia e simplifica a gravação de grampos de patch. A remoção da membrana pode ser realizada antes ou após a fixação do tecido. Para retinas divididas fixas, não é necessário tratar os pedaços de membrana de nitrocelulose. Para retinas divididas vivas, tratar a membrana de acordo com os passos 1.1.3 - 1.1.5 para facilitar o descolamento suave do tecido.- Cortar 16 pedaços (ou mais) de membrana de nitrocelulose em quadrados de 5 mm x 5 mm. Extra pode ser preparado a granel e armazenado para uso futuro.
- Separe metade dos pedaços de membrana para uso posterior. Estas peças não serão tratadas com uma solução de bloqueio.
- Incubar as peças restantes em uma solução bloqueadora de IHQ sem detergente (como soro de cavalo a 3% + NaN3 a 0,025% diluído em PBS) por 10 min à temperatura ambiente, agitando suavemente.
CUIDADO: Use EPI apropriado ao manusear NaN3, pois é uma toxina potente. - Lave bem as peças de membrana por incubação em meio Ames tamponada com bicarbonato por 10 min à temperatura ambiente, agitando suavemente.
- Seque completamente ao ar os pedaços bloqueados da membrana (~20 min). Rotular e armazenar as peças de membrana à temperatura ambiente, mantendo-as separadas das peças de membrana não tratadas.
- Preparar mídia Ames
- Preparar meios Ames tamponada com bicarbonato e manter a solução à temperatura ambiente sob carbogenação constante (95% O 2 e 5% CO2).
2. Enucleação do olho do rato
- Eutanásia do camundongo por qualquer método disponível de acordo com as diretrizes institucionais da IACUC.
- Vire o mouse para um lado e use dois dedos para pressionar suavemente a cavidade ocular. Isso fará com que o olho fique protuberante para fora do crânio.
- Usando tesouras de dissecção curvas, corte sob o olho abaulado para cortar o nervo óptico e separar o olho do crânio.
- Pegue o olho com uma tesoura e coloque-o em uma placa de Petri cheia de mídia Ames gelada.
NOTA: Para aplicações a jusante em que o tecido será fixado após a divisão, PBS gelado pode ser usado em vez de mídia Ames. - Repita os passos 2.1 - 2.4 para o olho restante.
3. Dissecção de retina
- Use a pipeta de transferência de vidro personalizada para transferir um olho para uma nova placa de Petri contendo mídia Ames fresca e gelada.
NOTA: A ampla abertura da pipeta de transferência personalizada evita o esmagamento acidental do tecido, e o uso de vidro minimiza a adesão do tecido às paredes da pipeta. No entanto, uma pipeta de transferência de plástico de boca larga também é aceitável se o experimentador já for proficiente no uso dessa ferramenta. - Use pinças para estabilizar o olho, fixando seu tecido conjuntivo extra no fundo da placa de Petri. Em seguida, puncione o olho ao longo da linha da ora serrata usando uma agulha 25G para criar um ponto de entrada para a tesoura Vannas.
- Use uma tesoura de Vannas para cortar ao longo da linha da ora serrata até que a córnea fique livre do resto do olho (Figura 1A Suplementar). Retire a lente da ocular com pinça (Figura 1B Suplementar).
- Use a pipeta de vidro personalizada para transferir a ocular para um grande volume (≥100 mL) de Ames carbogenado, e repita as etapas 3.1 - 3.3 com o olho restante.
NOTA: Os óculos são colocados em Ames carbogenados, para manter a saúde dos tecidos, enquanto a dissecção é realizada no outro olho. - Transfira uma xícara para uma placa de Petri recheada com Ames recém-carbogenado.
- Usando uma tesoura de Vannas, faça um pequeno corte para dentro da borda da esclera e, em seguida, use dois pares de pinças para descascar a esclera para longe da retina (Figura 1C Suplementar). Evite agarrar a retina com a pinça. Em vez disso, afaste as abas da esclera criadas pelo recorte de tesoura.
- Use a tesoura Vannas para cortar o nervo óptico conectando a esclera e a retina (Figura 1D Suplementar) e, em seguida, retire suavemente a retina da esclera usando a tesoura ou pinça para isolar a retina. (Figura 1A).
NOTA: Embora o EPR normalmente permaneça conectado ao óculo, nenhuma etapa extra é necessária para remover o EPR no caso de ele estar conectado à retina. Nesse ponto, as bordas da retina podem ser opcionalmente aparadas com bisturi para evitar ondulação durante a etapa de achatamento (Figura 1B). - Use um bisturi para cortar a retina em metades ou quartos (Figura 1C) e, em seguida, use a pipeta de transferência personalizada para retornar as peças a um grande volume (≥ 100 mL) de meio Ames continuamente carbogenado.
NOTA: A escolha de metades ou quartos é subjetiva. Escolha a melhor opção para a aplicação desejada. - Repita os passos 3.5 - 3.8 para o olho restante antes de proceder à divisão da retina.
4. Divisão da retina
- Descarte o meio Ames das placas de Petri e substitua-o por Ames recém-carbogenados.
NOTA: Para manter a carbogenação durante todo o restante do procedimento de divisão da retina, substitua o meio na placa de Petri por Ames recém-carbogenados, aproximadamente a cada 5 min. - Usando a pipeta de transferência personalizada, coloque um pedaço de retina em uma lâmina de vidro (7,5 cm x 5 cm), de lado da célula ganglionar para cima, em seguida, achate-o removendo o líquido circundante com uma limpeza de tarefa delicada (Figura 1D). Se necessário, puxe suavemente as bordas da retina com um pincel de ponta fina sob um microscópio de dissecção.
- Use pinça para abaixar um pedaço seco de membrana de nitrocelulose de 5 mm x 5 mm sobre a retina, fazendo com que ela adera ao lado da célula ganglionar (Figura 1E).
NOTA: Se for necessária a remoção de membrana de tecido vivo (ou seja, para eletrofisiologia), use um pedaço seco de membrana tratada com soro para esta etapa (ver etapas 1.1.3 - 1.1.5 para obter detalhes). Isso reduz a força de adesão à camada de células ganglionares, facilitando a remoção da retina da nitrocelulose pós-split. - Vire a retina para que a nitrocelulose fique apoiada na lâmina de vidro e coloque um pedaço seco de membrana de 5 mm x 5 mm no lado fotorreceptor da retina (Figura 1F).
- Toque a ponta molhada do pincel no espaço entre as duas membranas e permita que a ação capilar suge o Ames para dentro do sanduíche (Figura 1G). Isso reduz a aderência das membranas à retina e só é necessário se a retina tiver sido excessivamente seca com a delicada tarefa de limpar.
NOTA: Se a retina perdeu sua aparência brilhante, ela foi excessivamente seca, e o passo 4.5 é necessário. - Para garantir uma aderência uniforme, aplique uma leve pressão descendente na membrana superior com um pincel úmido (Figura 1H).
- Ao fixar a membrana inferior ao vidro com um par de pinças, use um movimento lento e constante para descascar suavemente a membrana superior com um segundo par de pinças. Isso fará com que a retina se divida logo acima da OPL (Figura 1I).
- Descarte a membrana superior que contém os fotorreceptores (Figura 1J, esquerda). A membrana inferior contém a retina interna, doravante denominada retina dividida (Figura 1J, direita).
- Devolver imediatamente a retina dividida ao meio de Ames carbogenado.
NOTA: Para experimentos em tecidos vivos, as retinas podem se beneficiar de um período de recuperação de 15-30 min em Ames carbogenados, após a divisão.

Figura 1: Procedimento de divisão da retina. (A) Após a enucleação e preparação da ocular em PBS ou Ames frios, isole a retina do camundongo da ocular e substitua a PBS por meio Ames carbogenado, à temperatura ambiente. (B) Com o uso de bisturi, aparar as bordas da retina até que não haja regiões com rosca interna (opcional). (C) Corte a retina em quartos ou metades usando bisturi. (D) Coloque um pedaço de retina em uma lâmina de vidro (lado da célula ganglionar para cima) usando a pipeta de transferência personalizada e remova todo o excesso de Ames usando uma limpeza de tarefa delicada. Certifique-se de que a retina semi-seca está deitada no vidro antes de prosseguir para a próxima etapa. Use uma ponta de pincel molhada por Ames para desdobrar suavemente regiões da retina que não são planas. (E) Com o uso de pinças, colocar um pedaço pré-cortado de membrana de nitrocelulose seca (5 mm x 5 mm) sobre a retina achatada. (F) Vire o pedaço de nitrocelulose para que o lado fotorreceptor da retina esteja agora voltado para cima. Em seguida, coloque outro pedaço seco de membrana na retina. (G) Toque a ponta molhada da escova no espaço entre as duas membranas e permita que a ação capilar suge o Ames para dentro do sanduíche. Isso reduz a aderência das membranas à retina e só é necessário se a retina foi excessivamente seca com a delicada tarefa de limpeza. (H) Use uma ponta de pincel molhada para pressionar suavemente para baixo no centro da retina sanduíche. (I) Use um par de pinças para fixar o pedaço inferior da membrana na lâmina de vidro, enquanto usa outro par de pinças para descascar suavemente o pedaço superior da membrana para longe do inferior. (J) A retina interna (esquerda) permanece na membrana inferior enquanto os fotorreceptores (direita) são afastados com a membrana superior. Os painéis (A), (B), (C), (D) e (J) foram adquiridos em microscópio de dissecção; a barra de escala representa aproximadamente 1 mm; os painéis (E-I) foram adquiridos com uma câmera de smartphone sem ampliação. Clique aqui para ver uma versão maior desta figura.
5. Preparação de retinas divididas para experimentos de imunofluorescência
NOTA: A retina dividida ainda estará aderida à membrana de nitrocelulose até o passo 5.5. Conclua as etapas 5.1, 5.2, 5.3 ou 5.4, e não as quatro, pois são para experimentos diferentes.
CUIDADO: Use EPIs apropriados e proceda com cuidado ao manusear paraformaldeído (fixador).
- Preparação para imunofluorescência plana
- Incubar a retina dividida em paraformaldeído a 4% sobre gelo por 30 minutos usando solução suficiente para cobrir completamente a retina.
- Lavar as retinas divididas 3x em 5-10 mL de PBS à temperatura ambiente. Pausa opcional: retinas divididas podem ser deixadas em PBS a 4 °C por até 24 h.
- Preparo para imunofluorescência com cortes verticais de retina dividida
- Incubar a retina dividida em paraformaldeído a 4% sobre gelo por 30 minutos usando solução suficiente para cobrir completamente a retina.
- Lavar as retinas divididas 3x em 5-10 mL de PBS à temperatura ambiente. Pausa opcional: retinas divididas podem ser deixadas em PBS a 4 °C por até 24 h.
- Com a membrana ainda ligada, imergir sequencialmente a retina dividida em 10%, 20% e 30% de sacarose a 4 °C por 1 h cada para crioproteger o tecido.
- Incorpore as retinas divididas crioprotegidas em composto de temperatura de corte ideal (O.C.T.) e armazene-as a -80 °C (até 6 meses) até a criossecção.
- Remova as retinas divididas embutidas de -80 °C e use um criostato para cortar seções de 20 μm de espessura. Monte as seções em lâminas de microscópio de vidro carregadas eletrostaticamente, deixe-as secar ao ar e armazene-as a -20 °C por até 6 meses.
- Preparação para hibridização in situ de fluorescência dupla e imunohistoquímica
- Incubar a retina dividida em paraformaldeído a 4% sobre gelo durante 2 h utilizando solução suficiente para cobrir completamente a retina.
- Lavar as retinas divididas 3x em 5-10 mL de PBS à temperatura ambiente. Pausa opcional: retinas divididas podem ser deixadas em PBS a 4 °C por até 24 h.
- Preparação para eletrofisiologia
- Prepare pipetas de remendo puxando pipetas de vidro borossilicato de paredes grossas com filamento usando um puxador de micropipetas. Use apenas pipetas com uma resistência medida entre 6-10 MΩ.
- Encha as pipetas puxadas com solução interna contendo (em mM): 125 K-gluconato, 8 KCl, 5 HEPES, 1 MgCl 2, 1 CaCl 2,0,2 EGTA, 3 ATP-Mg e 0,5 GTP-Na.
- Remoção da retina dividida da membrana de nitrocelulose
- Usando uma caneta de barreira hidrofóbica, prepare poços circulares em uma lâmina de microscópio (~1 cm de diâmetro) e deixe-os secar ao ar por 5-10 min.
- Coloque as retinas divididas dentro dos poços de barreira hidrofóbicos preparados e adicione PBS suficiente para cobri-los completamente.
- Sob um microscópio de dissecção, empurre as cerdas de um pincel fino sob as bordas do tecido e levante suavemente para cima. Dessa forma, trabalhe em torno da retina em um círculo para elevá-la para longe da membrana.
- Use pinças para remover a membrana de baixo do pedaço flutuante da retina.
- Aspirar cuidadosamente o PBS restante para que o pedaço de retina venha a repousar na lâmina do microscópio, de lado para baixo das células ganglionares.
Observação : as etapas a seguir não devem ser executadas sequencialmente. Escolha o protocolo apropriado para a aplicação desejada (ou seja, imunomarcação ou hibridização in situ de fluorescência dupla [FISH] e imunohistoquímica [IHQ] ou eletrofisiologia).
6. Imunomarcação
- Se ainda não estiver preparado, use uma caneta de barreira hidrofóbica para criar poços circulares em uma lâmina de microscópio (~1 cm de diâmetro) e deixe-os secar ao ar por 5-10 min. Todas as etapas de incubação e lavagem serão realizadas dentro desses poços de caneta.
- Incubar as retinas divididas ou secções verticais da retina dividida em solução de incubação de anticorpos (AIS: 3% de soro de cavalo, 0,5% Triton X-100, 0,025% NaN3 em PBS) durante 30 minutos à temperatura ambiente.
- Incubar as retinas divididas ou secções verticais da retina dividida com anticorpos primários diluídos em AIS durante 1 h à temperatura ambiente.
NOTA: O tempo de incubação de anticorpos primários exigirá otimização para diferentes alvos proteicos e anticorpos. - Lave o tecido 3x em PBS à temperatura ambiente.
- Incubar o tecido com anticorpos secundários diluídos em AIS por 1 h à temperatura ambiente. Lave o tecido 3x em PBS à temperatura ambiente.
- Se a coloração nuclear for desejada, incubar o tecido com DAPI diluído em PBS por 30 s à temperatura ambiente. Lave o tecido 1x em PBS à temperatura ambiente.
- Aplique uma gota de mídia de montagem de lâmina em cada pedaço de tecido e monte uma lamínula de vidro.
- Aplique esmalte ao redor das bordas da tampa para selar a amostra. Conservar a lâmina a 4 °C.
7. Dual FISH e IHC
- Asse as retinas divididas a 40 °C por 30 min em forno de hibridização para aumentar a aderência à lâmina.
- Preencha o protocolo RNAscope FISH de acordo com o protocolo do fabricante com as seguintes exceções e alterações:
- Nenhuma etapa de recuperação de antígeno é necessária. Use protease III com um tempo de incubação de 18 min à temperatura ambiente.
- Execute todas as etapas de lavagem na lâmina dentro dos poços feita por uma caneta de barreira hidrofóbica.
- Incubar as amostras em anticorpos primários diluídos (ver Tabela de Materiais) em PBS durante 30 min a 40 °C no forno de hibridização. Lave as amostras 3x em PBS à temperatura ambiente.
- Incubar as amostras em anticorpos secundários diluídos (ver Tabela de Materiais) em PBS durante 30 min a 40 °C no forno de hibridização. Lave as amostras 3x em PBS à temperatura ambiente.
- Incubar as amostras em 1x DAPI por 30 s à temperatura ambiente. Lave as amostras 1x em PBS à temperatura ambiente.
- Aplique uma gota de mídia de montagem anti-desbotamento em cada pedaço de tecido e monte uma lamínula de vidro.
- Aplique esmalte ao redor das bordas da tampa para selar a amostra. Conservar a lâmina a 4 °C.
8. Eletrofisiologia
- Depois de remover a membrana de nitrocelulose, transfira uma retina dividida para a câmara de gravação de patch clamp e fixe-a suavemente no lugar com uma harpa de platina.
- Durante todo o experimento, perfundir continuamente a retina dividida com solução de Ames carbogenada, com 95% deO2 e 5% de CO2. Manter a solução entre 32-34 °C.
NOTA: Durante o experimento, o tecido pode ser visualizado usando microscopia de contraste com gradiente de Dodt. - Sob a iluminação da sala, execute o clampeamento de voltagem de célula inteira para gravar a partir dos neurônios do INL.
- Durante a gravação, simule as respostas da luz usando uma unidade de injeção microcelular para aplicar compostos farmacêuticos, ou um LED de 470 nm para estimular a canalrodopsina (ChR2).
NOTA: A intensidade da luz pode ser medida usando um medidor de potência óptico digital.
- Durante a gravação, simule as respostas da luz usando uma unidade de injeção microcelular para aplicar compostos farmacêuticos, ou um LED de 470 nm para estimular a canalrodopsina (ChR2).
9. Microscopia confocal
- Para imunofluorescência confocal, obter imagens com um microscópio confocal usando uma objetiva de imersão em óleo 40x/1.3 ou 63x/1.40. Use FIJI para ajustar o brilho e o contraste e para gerar projeções Z a partir de pilhas de imagens.
Representative Results
A divisão da retina preserva os terminais fotorreceptores
Para confirmar que a divisão da retina não danifica os dendritos dos neurônios de segunda ordem na OPL, seções verticais das retinas divididas foram coradas com anticorpos contra a proteína sináptica da vesícula sináptica sinaptofisina (verde) e proteína quinase C alfa (PKCα; vermelho). A intensa banda de marcação da sinaptofisina no topo da retina dividida indica que os terminais sinápticos dos fotorreceptores estão retidos (Figura 2). Além disso, a coloração PKCα revela morfologia normal das células bipolares do bastonete (hemácias). Nenhum núcleo fotorreceptor é visível, indicando que a retina está dividida entre a OPL e a fileira mais interna de corpos celulares fotorreceptores (Figura 2).
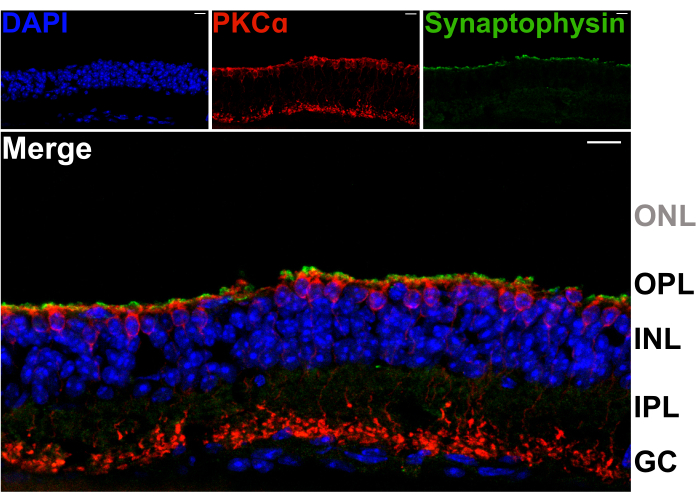
Figura 2: Retinas divididas retêm terminais fotorreceptores. Micrografias confocais fluorescentes mostrando um corte vertical de uma retina do espeto que foi criossecada (20 μm de espessura) após o procedimento de splitting. Cada imagem é uma projeção máxima de uma pilha z confocal. O corte foi imunomarcado com anticorpos contra PKCα (centro superior) e sinaptofisina (canto superior direito) para visualização de hemácias e vesículas sinápticas, respectivamente. A imagem mesclada (abaixo) mostra vesículas sinápticas (verde), que residem nos terminais fotorreceptores, logo acima dos processos apicais das hemácias (vermelho) na LPO. Os núcleos celulares são marcados com DAPI (azul). Nenhum núcleo fotorreceptor é visível dentro da ONL. Abreviaturas: ONL = camada nuclear externa; OPL = camada plexiforme externa; INL = camada nuclear interna; LIP = camada plexiforme interna; GC = células ganglionares. Barras de escala = 10 μm. Clique aqui para ver uma versão maior desta figura.
A morfologia da sinapse na OPL é preservada após a divisão da retina
Usando um camundongo que expressa GFP em hemácias sob o promotor pcp2, 14 proteínas pré e pós-sinápticas na OPL foram imunomarcadas para avaliar a integridade dessa camada sináptica após uma divisão14. Apesar das forças de cisalhamento ocorrerem através dos axônios dos fotorreceptores, a divisão não perturba a morfologia das sinapses do fotorreceptor-BC na OPL, como se observa o posicionamento normal dos dendritos eritrocitários, marcados para RGS11, e das fitas sinápticas dos fotorreceptores, marcados para CtBP215 (Figura 3). Para cada contato sináptico entre bastões e hemácias, RGS11 pode ser visto como puncta vermelho que se encontram dentro da forma de ferradura das fitas sinápticas (verde). Em um experimento subsequente, um anticorpo anti-GPR17916 foi usado para marcar as pontas dendríticas ON-BC pós-sinápticas16, e um anticorpo anti-PSD-95 foi usado para marcar terminais fotorreceptores de bastonetes pré-sinápticos (Figura 2 suplementar). Esses resultados confirmam novamente a estabilidade da OPL na preparação da retina dividida, uma vez que os dendritos eritrocitários estão intimamente associados ao seu parceiro pré-sináptico, os terminais da haste.
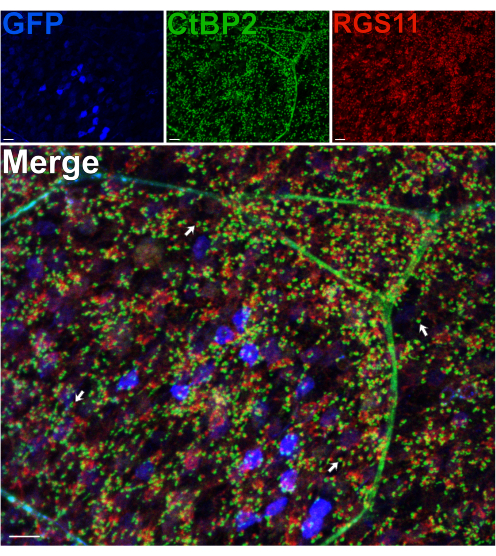
Figura 3: A morfologia da sinapse na OPL está preservada após a divisão da retina. Imagens de imunofluorescência confocal de uma retina dividida de um camundongo transgênico expressando GFP em hemácias sob o promotor Pcp2. Os níveis de expressão de GFP (azul) variam entre as hemácias na retina. Após a divisão, a retina foi fixada e, em seguida, incubada com anticorpos contra CtBP2 (verde) e RGS11 (vermelho) para marcar fitas sinápticas de fotorreceptores e pontas dendríticas ON-BC, respectivamente. Cada par vermelho-verde representa um contato sináptico entre uma haste e um ON-BC. Barras de escala = 10 μm. Clique aqui para ver uma versão maior desta figura.
A divisão da retina mantém a viabilidade das hemácias
Para avaliar a viabilidade dos neurônios internos da retina após uma cisão, foi utilizado um corante nuclear de infravermelho próximo (MI-NIR) impermeável à membrana, que permite a identificação de células mortas. Após a incubação com MI-NIR, retinas divididas foram fixadas e, em seguida, marcadas com anti-PKCα para identificar hemácias. Micrografias confocais da retina dividida revelam variabilidade regional na viabilidade celular em todo o tecido, com algumas regiões experimentando taxas mais altas de morte celular do que outras. Essa variabilidade pode resultar de danos infligidos a determinadas regiões da retina durante os procedimentos de dissecção, divisão ou manuseio (Figura 4). Dado que os corpos celulares das hemácias residem na região mais externa do INL, próximo ao local da cisão, uma avaliação cuidadosa de sua viabilidade foi justificada. A escassa colocalização de PKCα e MI-NIR confirmou que a maioria das hemácias permanece viável após a divisão da retina (Figura 4).
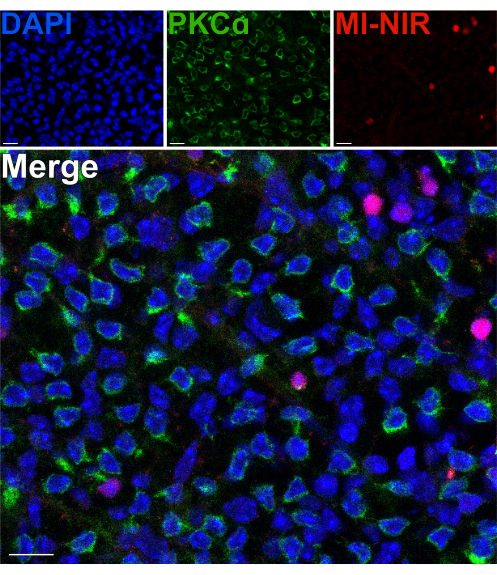
Figura 4: As células bipolares dos bastonetes são viáveis após a divisão da retina. Micrografias confocais fluorescentes mostrando uma região de uma retina dividida em uma perspectiva plana. Após a separação, a retina viva foi incubada com corante MI-NIR (vermelho) por 30 min a 37 °C. A retina foi então fixada e imunomarcada com anticorpos contra PKCα para visualização das hemácias. Nessa região da retina, a colocalização de PKCα e MI-NIR é infrequente. MI-NIR colocaliza-se com núcleos (azuis) que não pertencem a hemácias. Abreviações: MI-NIR = mancha NIR viva/morta impermeável por membrana. Barras de escala = 10 μm. Clique aqui para ver uma versão maior desta figura.
Retinas divididas são passíveis de dupla FISH e IHC
Ao estender o tempo de fixação da CCI padrão, retinas divididas podem ser processadas sequencialmente por FISH e IHQ para marcar simultaneamente RNAs e proteínas17,18. Experimentos confirmaram que uma fixação de 2 h em paraformaldeído a 4% produz marcação robusta de RNAm, preservando epítopos proteicos para ligação de anticorpos. A FISH foi realizada em retinas divididas seguidas de IHQ para visualizar a expressão da subunidade δ do receptorGABA A (GABRD; sondas de RNAm anti-senso) em relação à posição das hemácias (anticorpo anti-PKCα) na INL externa (Figura 5A). A expressão do mRNA GABRD parece rara em hemácias (Figura 5A); no entanto, o transcrito é abundantemente expresso por células amácrinas e células ganglionares, como evidenciado pelo padrão de marcação em cortes transversais de uma retina intacta (Figura 5B). No INL externo (Figura 5A), o RNAm do GABRD distribui-se mais uniformemente em relação ao INL interno (Figura 5C), onde se concentra em células distintas. Sondas antisense direcionadas a outras subunidades do receptor GABA produzem padrões de marcação distintos, demonstrando a especificidade das sondas (dados não mostrados).
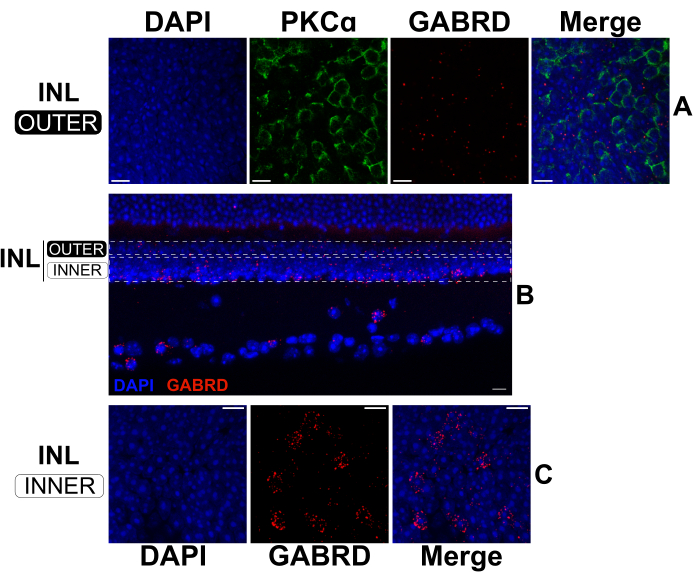
Figura 5: Dupla FISH e IHQ em uma retina dividida e uma retina intacta. (A, C) Micrografias confocais de uma retina dividida de montagem plana e (B) uma seção vertical de uma retina intacta. As imagens em (A) e (C) são projeções máximas de cortes ópticos nas regiões superior e inferior do INL, respectivamente. Os retângulos pontilhados em (B) representam os limites aproximados usados para criar as projeções mostradas em (A) e (C). A retina dividida (A, C) foi fixada por 2 h, depois marcada com sondas de mRNA antisenso contra GABRD (vermelho). Em seguida, a retina dividida foi corada com anticorpos contra PKCα para marcar hemácias (verde). O canal PKCα foi omitido das projeções do INL mais baixo para clareza. A retina íntegra em (B) foi fixada por 24 h antes da secção. Em seguida, a retina fixa foi marcada com sondas de mRNA antisenso contra GABRD (vermelho). Todas as amostras foram coradas com DAPI (azul) por 20 s antes da montagem com lamínulas. Abreviações: INL = camada nuclear interna. Barras de escala= 10 μm. Clique aqui para ver uma versão maior desta figura.
As retinas divididas são adequadas para o registro eletrofisiológico de grampeamento de BCs e HCs
Para remendar uma soma BC ou HC em uma retina de montagem inteira tradicional, a pipeta deve se aproximar do lado da célula ganglionar ou do lado do fotorreceptor. Ambas as abordagens requerem a travessia de várias camadas da retina para alcançar o INL, durante o qual a ponta da pipeta muitas vezes fica obstruída por debris. Em uma preparação de corte de vibratomo, os somas BC e HC são facilmente acessíveis, mas seus processos dendríticos podem ser seccionados, interrompendo suas conexões laterais. Nas retinas divididas, no entanto, os corpos celulares das hemácias e HCs ficam na superfície do tecido, proporcionando um acesso muito melhor às pipetas de remendo enquanto preservam os circuitos laterais da OPL.
A Figura 6 mostra as respostas à luz quimicamente simuladas registradas a partir de CBs em uma retina dividida. O meio Ames perfundido foi suplementado com L-AP4 (4 μM), um agonista mGluR do grupo III, para simular a liberação de glutamato dos fotorreceptores no escuro. O antagonista mGluR6, CPPG (600 μM, em Ames), foi insuflado sobre os dendritos da célula patched (mantida a -60 mV) para simular um flash de luz via inibição de mGluR6. As células responderam aos sopros de CPPG com dois tipos de correntes internas. Um tipo mostra uma corrente transitória seguida de um platô (Figura 6A), semelhante às correntes canônicas evocadas pela luz registradas a partir de hemácias em cortes de retina19. O outro tipo permanece sustentado durante toda a duração do sopro (Figura 6B), assemelhando-se às correntes registradas a partir de células bipolares do cone ON (ON-GC)19.
Um experimento separado foi realizado para atingir HCs, um tipo celular com um amplo campo dendrítico que muitas vezes é difícil de preservar em preparações de cortes. Uma linhagem de camundongo expressando canal de rodopsina (ChR2) e GFP em HCs foi usada para facilitar a identificação em um microscópio de fluorescência. Primeiro, as correntes dos HCs foram registradas em resposta a uma série de etapas de despolarização (-100 mV a 50 mV, tamanho do passo = 15 mV) às quais responderam com correntes internas seguidas de correntes externas (Figura 6C). Essas células foram então estimuladas com um breve pulso de luz azul (200 ms, 470 nm) produzindo grandes correntes internas de ChR2 em duas células (Figura 6D).
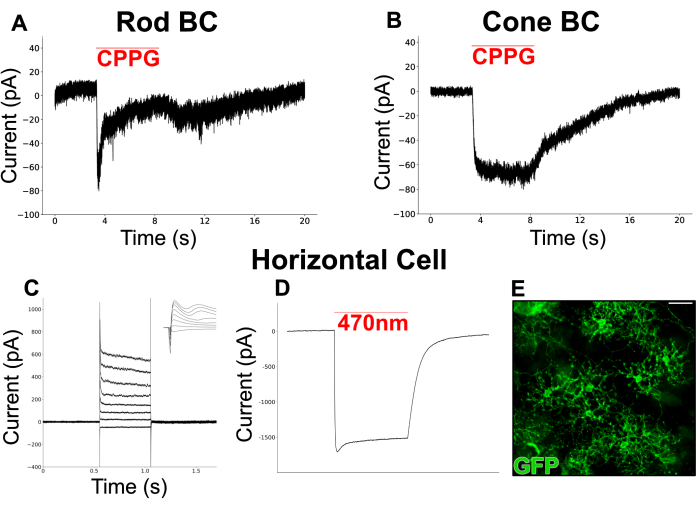
Figura 6: Registros de patch clamp dos neurônios INL em retinas divididas. (A) Um hemácias putativas e (B) hemograma foram clampeados por voltagem a -60 mV em meio Ames perfundido contendo L-AP4 (4 μM). O sopro de CPPG (600 μM) sobre os dendritos das células pinçadas invocou uma corrente interna que era transitória na hemácia, mas sustentada no hemograma. O registro de CH em (A) é um traço único, enquanto o registro de hemograma em (B) representa a média de 3 traços. (C) Um registro de patch clamp de um HC em um vGATFLPo; vGlut2Cre; Rato Ai80d. A linha vermelha mostra a duração de um pulso de luz de 200 ms, 470 nm, usado para invocar a grande corrente interna através de ChR2. (D) Respostas de corrente injetada de um HC que foi fixado por tensão a -60 mV, em seguida, escalonado entre -70 mV e +35 mV em intervalos de 15 mV e retornado a -60 mV. O inset mostra os mesmos traços em uma janela de 6 ms ao redor do início da etapa de tensão. (E) Micrografia por imunofluorescência de uma retina dividida de montagem plana mostrando células horizontais expressando GFP em um vGATFLPo; vGlut2Cre; Rato Ai80d. Barra de escala = 20 μm. Os dados eletrofisiológicos foram coletados a uma taxa de amostragem de 20 kHz e filtrados com um filtro passa-baixa de Bessel a 5 kHz. Os dados foram então exportados e a visualização e análise off-line foram realizadas usando Python 3. Clique aqui para ver uma versão maior desta figura.
A divisão da retina permite interrogar rapidamente a anatomia do INL e OPL
A membrana limitante externa (ELM) e a ONL da retina compreendem uma barreira de ~90 μm de espessura, que impede a difusão de anticorpos para a retina interna e cria condições de imunomarcação subótimas20,21,22. Portanto, a imunomarcação de alvos no OPL ou INL usando uma retina planmount convencional requer protocolos de coloração demorados que muitas vezes requerem incubações de anticorpos de 48-96 h 5,6,7,8,20,22.
A remoção dos fotorreceptores permite a rápida penetração de anticorpos nos neurônios internos da retina. Como resultado, a marcação de alvos proteicos da retina interna pode ser alcançada em apenas 1 h com o uso de anticorpos primários conjugados com corante. Anticorpos contra PKCα e Calbindin-D foram usados para marcar hemácias e HCs do INL, respectivamente (Figura 7). Ao contrário dos cortes verticais tradicionais da retina, que truncam os processos laterais dos neurônios de campo amplo, a preparação da retina dividida permite a visualização da árvore dendrítica completa de células de campo largo, como os HCs (Figura 6E, Figura 7).
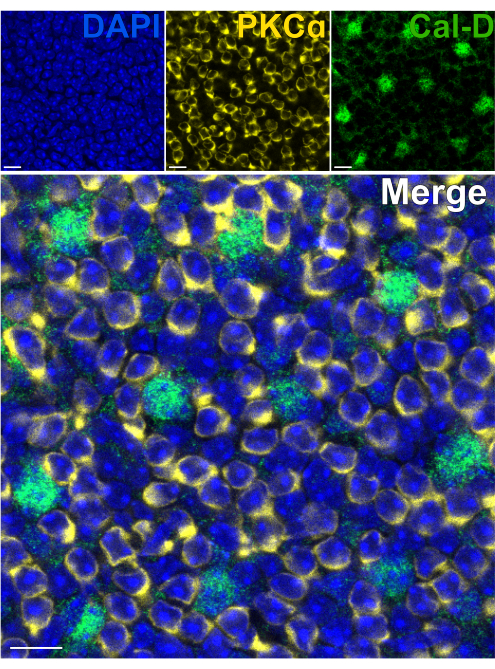
Figura 7: Marcação imunológica rápida de proteínas internas da retina em uma retina dividida. Imagens de imunofluorescência confocal de uma retina dividida de uma perspectiva plana. A retina dividida foi incubada com anticorpos contra PKCα (amarelo) e Calbindina-D (verde) por 1 h à temperatura ambiente para marcar ON-BCs e HCs, respectivamente. (A) Cada imagem de canal único é uma projeção Z média composta por quatro seções ópticas: DAPI, Average z10-13; Calbindin-D, Média z11-14; PKCα, Média z11-14. (B) Na imagem mesclada, as mesmas projeções são sobrepostas. Barras de escala = 10 μm. Clique aqui para ver uma versão maior desta figura.
Figura suplementar 1: Principais etapas da dissecção de retina. Todas as imagens foram obtidas com uma câmera de smartphone montada nas lentes oculares de um microscópio de dissecção. (A) Uma imagem de cima para baixo de um olho de rato após a remoção da córnea. (B) Uma imagem de cima para baixo do óculos do rato após a remoção da lente. (C) Uma pequena incisão é feita na esclera no óculos do rato. As setas indicam os dois retalhos da esclera que são tracionados em direções opostas por pinças para começar a separar a retina da esclera. (D) Após a esclera ter sido parcialmente afastada da retina, uma tesoura de Vannas é inserida entre a esclera e a retina, e o nervo óptico é seccionado, liberando a retina. O círculo pontilhado vermelho mostra a cabeça do nervo óptico, e a tesoura demonstra a trajetória correta de corte (inserir tesoura entre a esclera e a retina). A retina isolada após a esclera é afastada. Clique aqui para baixar este arquivo.
Figura 2 Suplementar: Caracterização dos componentes pré e pós-sinápticos da LPO na retina dividida. Imagens de imunofluorescência confocal da OPL em uma retina dividida. A retina dividida foi incubada com anticorpos contra GPR179 e PSD95 por 1 h à temperatura ambiente para marcar as pontas dendríticas dos ON-BCs e os terminais dos fotorreceptores dos bastonetes, respectivamente. As imagens à esquerda e ao centro são projeções máximas de várias seções ópticas; as mesmas projeções são sobrepostas na imagem mais à direita. Puncta GPR179 nas pontas dendríticas ON-BC são vistos associando-se intimamente com os terminais fotorreceptores do bastonete, demonstrando contatos sinápticos intactos dentro da OPL. Barras de escala = 10 μm. Clique aqui para baixar este arquivo.
Figura suplementar 3: Solução de problemas: avaliação da qualidade de uma retina dividida. Micrografias fluorescentes de uma retina dividida coradas com DAPI para visualização dos núcleos celulares. As células podem ser identificadas com base no diâmetro e profundidade do tecido do núcleo. (A) Os núcleos fotorreceptores são menores, mais brilhantes e mais superficiais, enquanto (B) os núcleos BC são maiores, mais fracos e mais profundos. (C) Imagem de baixa magnificação de uma região onde os fotorreceptores foram removidos incompletamente. Os núcleos que aparecem em foco são de BCs, que são mais profundos do que os núcleos fotorreceptores nas bordas da imagem que aparecem fora de foco. Barras de escala para (A) e (B) = 20 μm. Barra de escala para (C) = 50 μm. Clique aqui para baixar este arquivo.
Discussion
Após os fotorreceptores transduzirem a absorção de fótons para a liberação de neurotransmissores, os CBs e HCs são os primeiros neurônios da retina a processar o sinal visual23. Embora a importância desses neurônios seja bem apreciada, muitas de suas funções são incompletamente compreendidas ou inexploradas completamente. Muitos estudos de fisiologia de BC e HC provavelmente se beneficiariam de uma preparação de retina plana que melhora o acesso aos neurônios INL enquanto preserva a conectividade lateral. O desenvolvimento do método split retina representa um esforço para fornecer um protocolo fácil para a aquisição de registros eletrofisiológicos de alta qualidade e dados de microscopia de CBs e HCs em uma orientação flatmount. A preparação de retina dividida descrita aqui pode ser realizada em cerca de 20 min por camundongo (10 min por retina) após o isolamento da retina, sem o uso de equipamentos especializados. O método inspira-se nos procedimentos de remoção de fotorreceptores existentes, mas oferece melhorias significativas na simplicidade, rapidez e versatilidade 4,10,11,12,13. Ao contrário dos métodos anteriores para separar as camadas da retina, a divisão da retina não requer congelamento, liofilização ou aplicação repetida de adesivos na retina. Com a prática, quase todos os fotorreceptores podem ser removidos em uma única lágrima com a membrana de nitrocelulose. A rapidez e facilidade dessa abordagem permite minimizar o tempo que a retina passa fora de Ames carbogenado, possibilitando alta viabilidade celular por longos períodos; retinas divididas podem ser mantidas em meio de Ames carbogenado, por várias horas após a divisão. Como prova da saúde dos neurônios INL nesta preparação, uma coloração de células vivas/mortas (Figura 4) e eletrofisiologia patch-clamp (Figura 6) confirmam a viabilidade de hemácias e HCs após uma cisão.
A remoção da camada fotorreceptora em retinas divididas transmite uma vantagem significativa durante a imunomarcação, reduzindo drasticamente o tempo de difusão dos anticorpos para o INL. A marcação de anticorpos primários e secundários pode ser concluída em 2 h, uma melhora substancial em relação à coloração convencional de montagem plana, que pode levar 72 h ou mais, dependendo do alvo 5,6,7,8,20,22. Como resultado, os dados da microscopia podem ser adquiridos no mesmo dia da preparação do tecido, acelerando drasticamente o ritmo dos experimentos de imunofluorescência. Para facilitar o recozimento da sonda de RNAm, os experimentos com FISH normalmente recomendam tempos de fixação muito mais longos (~24 h) do que a imunomarcação18. No entanto, os experimentos aqui apresentados demonstram que uma fixação de 2 h ainda produz excepcional marcação de FISH (Figura 5). Apesar de estender o tempo de fixação de 30 min para 2 h, não foi necessário realizar etapas de recuperação antigênica para obtenção de excelente imunomarcação, mas isso pode variar de acordo com o anticorpo ou antígeno. O tratamento com protease no protocolo de FISH pode interferir na marcação de anticorpos, provavelmente devido à destruição de epítopos-alvo. Essa questão foi contornada com o uso de anticorpos policlonais que têm como alvo múltiplos epítopos, diminuindo a probabilidade de que a destruição de epítopos dificultasse a imunomarcação. Além disso, um tratamento de protease moderada (ACD protease III) foi usado para evitar a alteração excessiva do epítopo, ao mesmo tempo em que fornecia penetração tecidual suficiente.
Ocasionalmente, a retina se dividirá através da camada nuclear externa (ONL), deixando para trás camadas de somas fotorreceptores sem células INL visíveis. Para evitar isso, deve-se garantir que a retina fique completamente plana no vidro e que qualquer líquido residual ao redor da retina tenha sido removido. Pressionar mais firmemente a nitrocelulose com o pincel também pode ajudar a evitar a divisão através do ONL. Se a membrana ficar muito molhada ou a retina for dobrada sobre si mesma, as chances de uma divisão bem-sucedida serão muito reduzidas. O uso de DAPI para corar núcleos celulares é útil para avaliar a qualidade da divisão e determinar a cobertura de fotorreceptores remanescentes. Os núcleos fotorreceptores são menores, mais brilhantes e mais superficiais (Figura 3A Suplementar), enquanto os núcleos BC são maiores, mais fracos e mais profundos (Figura 3B Suplementar). Em alguns casos, o plano da lágrima irá variar ligeiramente através do pedaço da retina, resultando em manchas onde os corpos celulares fotorreceptores não foram completamente removidos (Figura 3C Suplementar). Para aplicações em microscopia e eletrofisiologia, isso não impede a capacidade de coletar dados de qualidade de regiões onde os fotorreceptores foram adequadamente removidos; Grandes campos de retina interna exposta podem ser facilmente encontrados ao criar imagens ou gravar com uma pipeta de remeção. Se a remoção mais completa do fotorreceptor for desejada, uma segunda ruptura pode ser realizada com um pedaço adicional de membrana de nitrocelulose, embora a remoção de 100% do fotorreceptor não seja garantida. Portanto, recomenda-se cautela ao usar retinas divididas em estudos de expressão gênica ou proteômica em que material fotorreceptor residual possa influenciar os resultados. Para aplicações unicelulares, essa preocupação é injustificada, pois os dados dos fotorreceptores podem ser excluídos da análise.
As vantagens da preparação da retina dividida são talvez mais salientes em registros eletrofisiológicos de interneurônios de campo amplo. Enquanto os cortes verticais tradicionais cortam os processos extensivos de células de campo largo, a preparação de retina dividida deixa o OPL e o IPL intactos, permitindo capturar a entrada de células de campo largo como HCs 24, A17s25, TH ACs 26 e NOS-1 ACs27 que, de outra forma, seriam negligenciadas em cortes verticais. Portanto, a interpretação dos resultados e a comparação com dados prévios coletados de cortes de retina requerem reflexão cuidadosa. No entanto, em experimentos utilizando miméticos farmacológicos de estimulação luminosa, esses resultados assemelham-se aos dados registrados a partir de cortes de retina19. Ao expressar ChR2 sob promotores célula-específicos, pode-se estimular uma população celular desejada durante o registro de BCs no INL para investigar o impacto da célula desejada na via vertical de informação. O registro diretamente de neurônios INL mais profundos, como células amácrinas, também é viável na retina dividida. Enquanto neste caso o eletrodo de remendo deve primeiro viajar através dos neurônios INL mais superficiais, há consideravelmente menos tecido obstruindo seu caminho quando comparado a uma preparação de montagem inteira tradicional.
Além de medir a influência de células de campo largo em outros neurônios, esse método permite o clampeamento direto de uma única célula a partir de HCs, cujos dendritos formam uma extensa rede acoplada de junções comunicantes no OPL28. As células horizontais enviam feedback crítico aos fotorreceptores que moldam a transmissão de informações verticais através da retina. No entanto, como os campos dendríticos dos HCs são truncados em cortes verticais, faltam dados de registro de célula única. Este trabalho apresenta HCs anatômica e fisiologicamente intactos a partir dos quais correntes evocadas por ChR2 são registradas em uma linha tripla transgênica de camundongos (Figura 6 C-E). Fora da estimulação com ChR2, a retina dividida pode ser usada para estudar correntes endógenas de HC e acoplamento de junções comunicantes28. Enquanto a retina dividida fornece um modelo conveniente para estudar a conectividade sináptica e a atividade neuronal induzida por aplicação química ou estimulação de ChR2, a falta de fotorreceptores impede qualquer exploração direta de respostas à luz natural ou mecanismos de adaptação à luz.
A imagem in situ na retina tem feito progressos admiráveis nos últimos anos. No entanto, a maioria dos exames de imagem limita-se à camada de células ganglionares em preparações de retina de montagem total29. Os autores imaginam que a ausência de fotorreceptores na retina dividida o tornará um modelo ideal para imagens de cálcio vivo na OPL e INL. Além da imagem com cálcio, esse modelo tem grande potencial para uso com biossensores codificados geneticamente, como iGluSnFR 30,31, iGABASnFR32 e pHluorin33. Combinadas com a preparação da retina dividida, essas poderosas ferramentas podem oferecer uma abordagem eficiente para explorar as interações sinápticas e as propriedades biofísicas de CBs e HCs que contribuem para o processamento de luz na retina.
Disclosures
Os autores declaram não haver interesses financeiros concorrentes.
Acknowledgements
Este trabalho foi apoiado pelas seguintes concessões do NIH: NIH grant R01EY031596 (para C.M.); Concessão do NIH R01EY029985 (para C.M.); P30EY010572 de concessão do NIH (para C.M.); Concessão do NIH R01EY032564 (para B.S.). Agradecemos a Tammie Haley por seu apoio técnico na preparação de seções de retina, e ao Dr. Charles Allen por generosamente contribuir com as sondas de mRNA FISH usadas neste trabalho.
Materials
| Name | Company | Catalog Number | Comments |
| #1.5 glass coverslips | Fisherbrand | 12544E | |
| 2 pairs of Dumont #5 forceps | Ted Pella | 38125 | |
| 25 gauge needle | Becton Dickenson | 305122 | |
| 470 nm LED | THORLABS | M470L2 | |
| 5-306 curved scissors | Miltex | 5-306 | |
| 9" disposable pasteur pipetes | Fisherbrand | 13-678-20D | for constructing custom transfer pipette |
| Ai80d mouse | Jackson Laboratories | 25109 | RRID: IMSR_JAX:025109 |
| Ames Medium w/L-Glutamate | US Biological | A1372-25 | |
| amplifier control software | Molecular Devices | Clampex 10.3 software | |
| anti-calbindin D28K antibody | Invitrogen | PA-5 85669 | RRID: AB_2792808, host species = rabbit; 1:100 dilution |
| anti-CtBP2 antibody | BD Biosciences | 612044 | RRID: AB_399431, host species = mouse; 1:5000 dilution |
| anti-GPR179 antibody | NA | NA | gift from Kirill Martemyanov; Scripps Research Institute, Jupiter, FL; host species = sheep; 1:1000 dilution |
| anti-PKC alpha antibody | Sigma-Aldrich | P4334 | RRID: AB_477345, host species = rabbit; 1:5000 dilution |
| anti-PKC alpha antibody | Santa Cruz Biotechnology | sc8393 AF594 | RRID: AB_628142, host species = mouse; 1:1000 dilution |
| anti-PSD95 antibody | BD Transduction Laboratories | 610495 | RRID: AB_397862, host species = mouse; 1:1000 dilution |
| anti-RGS11 antibody | NA | NA | gift from Ted Wensel; Baylor College of Medicine, Houston, TX; host species = rabbit; between 1:1000 and 1:5000 dilution |
| anti-Synaptophysin P38 antibody | Sigma | S-S5768 | RRID: AB_477523, host species = mouse; 1:1000 dilution |
| Aquamount mounting media | Epredia | 13800 | slide mounting media |
| C57BL/6J mouse | Jackson Laboratories | 000664 | RRID: IMSR_JAX:000664 |
| carbogen tank | Matheson | NA | 95% O2 and 5% CO2 |
| custom transfer pipette | custom build | NA | Instructions: use scissors to cut off the tip of a plasitc transfer pipette at the point it begins to taper. Use pliers to safely break off the last 2-3 inches of a glass pasteur pipette. Fit the narrow end of the glass pasteur pipette into the wide tip of the plastic transfer pipete. Wrap parafilm around the joint of the two pieces to enhance the seal. |
| Digitical optical power meter | THORLABS | PM100D | |
| dissection microscope | Zeiss | Stemi 2000 | |
| electrophysiology amplifier | Molecular Devices | Axopatch 200B | |
| electrophysiology microscope | Olympus | OLYMPUS, BX50WI | Dodt gradient contrast microscopy |
| Fluoromount-G | SouthernBiotech | 0100-01 | |
| HC PL APO CS2 40x/1.3 | Leica | 506358 | |
| HC PL APO CS2 63x/1.40 | Leica | 15506350 | |
| Hybridization oven | Robbins Scientific | Model 1000 | for RNAscope protocol only |
| Immedge hydrophobic barrier pen | Vector Laboratories | H-4000 | |
| isoflurane | Piramal Critical Care | 66794-017-25 | |
| Kimwipe (delicate task wipe) | Kimtech Science | 34155 | |
| Leica HC PL APO CS2 40x/1.3 oil immersion objective | Leica | 506358 | |
| Leica HC PL APO CS2 63x/1.40 oil immersion objective | Leica | 15506350 | |
| Leica TCS SP8 X confocal microscope | Leica | discontinued | |
| medium 15 mm petri dish | Corning | 25060-60 | eyes are kept here during retina dissection |
| Merit 97-275 steel scissors | Merit | 97-275 | |
| Micropipette Puller | Sutter Instrument | p-97 | |
| Mm-Gabrd-C2 mRNA probe | ACD | 459481-C2 | |
| mouse euthanasia chamber | NA | NA | custom build; glass petri dish covering a small glass jar. |
| nitrocellulose membrane filters | GE Healthcare Life Sciences; Whatman | 7184-005 | 0.45 µm pore size |
| Picospritzer | General Valve Corporation | Picospritzer II | referred to in the text as microcellular injection unit |
| plastic transfer pipets | Fisherbrand | 13-711-7M | for constructing custom transfer pipette |
| Plastic tubing | Tygon | R-603 | for connection to carbogen tank |
| platinum harp | custom build | NA | for anchoring split retinas within the electrophysiology recording chamber. |
| size 0 paint brush | generic | NA | for flattening retina during splitting. |
| SlowFade Gold antifade reagent | Molecular Probes | S36937 | referred to in the text as anti-fade mounting media |
| small 10 mm petri dish | Falcon | 353001 | eyes are placed here following enucleation |
| small glass pane (7.5 cm x 5 cm) | generic | NA | isolatd retina pieces are placed onto this for the splitting procedure |
| Superfrost plus microscope slides | Fisherbrand | 12-550-15 | electrostatically-charged glass microscope slides |
| Thick-walled borosilicate glass pipettes with filament | Sutter Instrument | BF150-86-10HP | |
| Vannas Scissors; straight | Titan Medical | TMS121 | not brand specific; any comparable scissors will work |
| vGATFLPo mouse | Jackson Laboratories | 29591 | RRID: IMSR_JAX:029591 |
| vGlut2Cre mouse | Jackson Laboratories | 28863, 016963 | RRID: IMSR_JAX:028863, RRID: IMSR_JAX:016963 |
| Zombie NIR Fixable Viability Kit | BioLegend | 423105 | referred to in the text as MI-NIR |
References
- Morgans, C. W. Neurotransmitter release at ribbon synapses in the retina. Immunology & Cell Biology. 78 (4), 442-446 (2000).
- Euler, T., Haverkamp, S., Schubert, T., Baden, T. Retinal bipolar cells: elementary building blocks of vision. Nature Reviews Neuroscience. 15 (8), 507-519 (2014).
- Barnes, S., Grove, J. C. R., McHugh, C. F., Hirano, A. A., Brecha, N. C. Horizontal Cell Feedback to Cone Photoreceptors in Mammalian Retina: Novel Insights From the GABA-pH Hybrid Model. Frontiers in Cellular Neuroscience. 14, (2020).
- Walston, S. T., Chang, Y. C., Weiland, J. D., Chow, R. H. Method to remove photoreceptors from whole mount retina in vitro. Journal of Neurophysiology. 118 (5), 2763-2769 (2017).
- Stefanov, A., Novelli, E., Strettoi, E. Inner retinal preservation in the photoinducible I307N rhodopsin mutant mouse, a model of autosomal dominant retinitis pigmentosa. Journal of Comparative Neurology. 528 (9), 1502-1522 (2020).
- Matsuoka, R. L., Nguyen-Ba-Charvet, K. T., Parray, A., Badea, T. C., Chédotal, A., Kolodkin, A. L. Transmembrane semaphorin signaling controls laminar stratification in the mammalian retina. Nature. 470 (7333), 259-263 (2011).
- Matsuoka, R. L., et al. Guidance-Cue Control of Horizontal Cell Morphology, Lamination, and Synapse Formation in the Mammalian Outer Retina. Journal of Neuroscience. 32 (20), 6859-6868 (2012).
- Wässle, H., Puller, C., Müller, F., Haverkamp, S. Cone Contacts, Mosaics, and Territories of Bipolar Cells in the Mouse Retina. Journal of Neuroscience. 29 (1), 106-117 (2009).
- Thoreson, W. B., Dacey, D. M. Diverse Cell Types, Circuits, and Mechanisms for Color Vision in the Vertebrate Retina. Physiological Reviews. 99 (3), 1527-1573 (2019).
- Guido, M. E., et al. A simple method to obtain retinal cell preparations highly enriched in specific cell types. Suitability for lipid metabolism studies. Brain Research Protocols. 4 (2), 147-155 (1999).
- Rose, K., Walston, S. T., Chen, J. Separation of photoreceptor cell compartments in mouse retina for protein analysis. Molecular Neurodegeneration. 12 (1), 28 (2017).
- Todorova, V., et al. Retinal Layer Separation (ReLayS) method enables the molecular analysis of photoreceptor segments and cell bodies, as well as the inner retina. Scientific Reports. 12 (1), 20195 (2022).
- Shiosaka, S., Kiyama, H., Tohyama, M. A simple method for the separation of retinal sublayers from the entire retina with special reference to application for cell culture. Journal of Neuroscience Methods. 10 (3), 229-235 (1984).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre-recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Sarria, I., Orlandi, C., McCall, M. A., Gregg, R. G., Martemyanov, K. A. Intermolecular Interaction between Anchoring Subunits Specify Subcellular Targeting and Function of RGS Proteins in Retina ON-Bipolar Neurons. The Journal of Neuroscience. 36 (10), 2915-2925 (2016).
- Orlandi, C., Cao, Y., Martemyanov, K. A. Orphan Receptor GPR179 Forms Macromolecular Complexes With Components of Metabotropic Signaling Cascade in Retina ON-Bipolar Neurons. Investigative Ophthalmology & Visual Science. 54 (10), 7153-7161 (2013).
- Dikshit, A., Zong, H., Anderson, C., Zhang, B., Ma, X. -. J. Simultaneous Visualization of RNA and Protein Expression in Tissue Using a Combined RNAscopeTM In Situ Hybridization and Immunofluorescence Protocol. Methods in Molecular Biology. 2148, 301-312 (2020).
- Wang, F., et al. RNAscope. The Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Morgans, C. W., et al. TRPM1 is required for the depolarizing light response in retinal ON-bipolar cells. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 19174-19178 (2009).
- Alessio, E., Zhang, D. Q. Immunostaining of whole-mount retinas with the CLARITY tissue clearing method. Investigative Ophthalmology & Visual Science. 61 (7), 5054 (2020).
- Ferguson, L. R., Dominguez, J. M., Balaiya, S., Grover, S., Chalam, K. V. Retinal Thickness Normative Data in Wild-Type Mice Using Customized Miniature SD-OCT. PLoS ONE. 8 (6), e67265 (2013).
- Ivanova, E., Toychiev, A. H., Yee, C. W., Sagdullaev, B. T. Optimized Protocol for Retinal Wholemount Preparation for Imaging and Immunohistochemistry. Journal of Visualized Experiments JoVE. (82), e51018 (2013).
- Kolb, H. Neurotransmitters in the Retina. Webvision: The Organization of the Retina and Visual System. , (1995).
- Chaya, T., et al. Versatile functional roles of horizontal cells in the retinal circuit. Scientific Reports. 7 (1), 5540 (2017).
- Egger, V., Diamond, J. S. A17 Amacrine Cells and Olfactory Granule Cells: Parallel Processors of Early Sensory Information. Frontiers in Cellular Neuroscience. 14, 600537 (2020).
- Dacey, D. M. The dopaminergic amacrine cell. The Journal of Comparative Neurology. 301 (3), 461-489 (1990).
- Park, S. J., et al. Connectomic analysis reveals an interneuron with an integral role in the retinal circuit for night vision. eLife. 9, 56077 (2020).
- Janssen-Bienhold, U., et al. Connexin57 is expressed in dendro-dendritic and axo-axonal gap junctions of mouse horizontal cells and its distribution is modulated by light. The Journal of Comparative Neurology. 513 (4), 363-374 (2009).
- Jain, V., et al. The functional organization of excitation and inhibition in the dendrites of mouse direction-selective ganglion cells. eLife. 9, 52949 (2020).
- Marvin, J. S., et al. Stability, affinity, and chromatic variants of the glutamate sensor iGluSnFR. Nature Methods. 15 (11), 936-939 (2018).
- Strauss, S., et al. Center-surround interactions underlie bipolar cell motion sensitivity in the mouse retina. Nature Communications. 13 (1), 5574 (2022).
- Marvin, J. S., et al. A genetically encoded fluorescent sensor for in vivo imaging of GABA. Nature Methods. 16 (8), 763-770 (2019).
- Beckwith-Cohen, B., Holzhausen, L. C., Wang, T. M., Rajappa, R., Kramer, R. H. Localizing Proton-Mediated Inhibitory Feedback at the Retinal Horizontal Cell-Cone Synapse with Genetically-Encoded pH Probes. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 39 (4), 651-662 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved