גישה תרמופלסמונית לחקר תיקון קרום פלזמה בתאים חיים וקרומי מודל
In This Article
Summary
שיטת הניקור התרמופלסמוני משלבת מיקרוסקופ קונפוקלי, פינצטה אופטית וננו-חלקיקי זהב כדי לחקור תגובות חלבונים במהלך תיקון קרום פלזמה בתאים ובועיות חד-למלריות ענקיות. הטכניקה מאפשרת ניקוב מהיר ומקומי של הממברנה, ומאפשרת זיהוי חלבוני מפתח ותפקידם הפונקציונלי במנגנון המורכב לתיקון קרום הפלזמה.
Abstract
קרום התא חיוני להישרדות התא, והבטחת שלמותו חיונית מכיוון שהתא חווה פציעות לאורך כל מחזור חייו. כדי למנוע נזק לממברנה, התאים פיתחו מנגנוני תיקון יעילים של קרום הפלזמה. ניתן לחקור מנגנוני תיקון אלה על ידי שילוב של מיקרוסקופ קונפוקלי ותרמופלסמוניקה ננומטרית כדי לזהות ולחקור את תפקידם של חלבוני מפתח, כגון נספחים, המעורבים בתיקון פני השטח בתאים חיים ובמערכות מודל ממברנה.
שיטת הניקוב משתמשת בלייזר כדי לגרום לחימום מקומי מאוד על קרינת ננו-חלקיקים. השימוש באור אינפרא אדום קרוב ממזער את הפוטוטוקסיות בדגימה הביולוגית, בעוד שרוב הבליעה מתרחשת בננו-חלקיק פלסמוני תהודה קרוב לאינפרא אדום. שיטה תרמופלסמונית זו נוצלה למחקר פוטותרמי וביופיזי פוטנציאלי כדי לשפר את ההבנה של מנגנונים תוך-תאיים ותגובות תאיות באמצעות מחקרי שלפוחית ואיחוי תאים. הגישה הוכחה כמשלימה לשיטות קיימות לשיבוש הממברנה, כגון פציעות המושרות באופן מכני, כימי או אופטי, ומספקת רמה גבוהה של שליטה על ידי גרימת פציעות מקומיות ביותר. היקף הפגיעה מוגבל לקרבת הננו-חלקיק הכדורי, ולא מתרחש נזק מזיק לאורך נתיב הקרן בניגוד ללייזרים פועמים באורכי גל שונים. למרות מגבלות מסוימות, כגון היווצרות ננו-בועות, השיטה התרמופלסמונית מציעה כלי ייחודי לחקר תגובות תאיות בתיקון קרום פלזמה בסביבה כמעט טבעית מבלי לפגוע בכדאיות התא.
בשילוב עם מיקרוסקופיה קונפוקלית, שיטת הניקור יכולה לספק הבנה מכניסטית של דינמיקת הממברנות במערכות ממברנות מודל, כמו גם מידע כמותי על תגובות חלבונים לנזק לממברנה, כולל גיוס חלבונים ותפקודם הביופיזי. בסך הכל, היישום של שיטה זו במערכות מודל מופחתות יכול לשפר את הבנתנו את המנגנון המורכב לתיקון קרום פלזמה בתאים חיים.
Introduction
קרום התא, המשמש הן כמחסום פיזי והן כפלטפורמת איתות, חיוני להישרדות התא1. לאורך כל מחזור התא שלה, קרום הפלזמה (PM) נתון לנזקים, כגון פציעות מכניות 2,3,4,5 וכימיות6 הנגרמות על ידי מתח. כדי לשמור על שלמות הממברנה ולהבטיח את הישרדות התא, התא פיתח מנגנוני תיקון קרום פלזמה (PMR) חזקים. מנגנונים אלה תלויים באסטרטגיות שונות, כגון ארגון מחדש של שלד ציטו-שלד, איחוי ממברנות ואסטרטגיות החלפת ממברנות 7,8,9,10,11, שכולן מסתמכות על גיוס חלבונים ספציפיים. יש לציין כי בני משפחת חלבוני האנקסין זוהו כחלבוני מפתח הקשורים לתהליכים של PMR 1,9,12,13,14,15,16. בעקבות פגיעה בחומר חלקיקי, התא חווה זרם של יוני סידן (Ca2+), המהווים איום מיידי על הישרדות התא17. בתגובה לשטף Ca2+, חלבוני אנקסין, הממוקמים בעיקר בציטוזול, נקשרים לעלון הפנימי של קרום הפלזמה הפגוע כחלק מאסטרטגיות PMR18. Annexin A2 (ANXA2) היה אחד החברים הראשונים במשפחת האנקטין שנקשר ל-PMR במחלת ניוון שרירים חסר דיספרלין, והוצע כי הוא מתווך תיקון על ידי איחוי שלפוחיות תוך-תאיות ל-PM ליד אתר הפציעה 5,19,20,21. לאחר מכן, מספר תפקידים יוחסו לנספחים22, ותפקידם ב-PMR זכה לתשומת לב מוגברת ב-20 השנים האחרונות. עם זאת, תפקידם המדויק של הנספחים ב-PMR עדיין אינו מובן במלואו 15,18,21,22.
מאמר זה מציע שיטה לחקר אינטראקציה חלבון-ממברנה ודינמיקה של ממברנות באופן מבוקר ומקומי מאוד, תוך שימוש בשילוב של מיקרוסקופיה קונפוקלית, פינצטה אופטית וננו-חלקיקי זהב (AuNPs). שיטה זו מאפשרת מחקר כמותי של אינטראקציות חלבון, שומנים ומולקולות קטנות בתגובה לנזק לממברנה וזרם Ca2+ . למרות המורכבות והריבוי של המרכיבים המעורבים בתהליך תיקון הממברנה, מערכות ממברנות פשוטות המחקות את קרום הפלזמה שימשו להשגת הבנה מכניסטית עמוקה יותר של דינמיקת הממברנה והתגובה של חלבוני אנקסין לשיבוש הממברנה16. שלפוחיות שומנים חד-למלריות ענקיות (GUVs) נבחרו כמערכת קרום המודל עם הרכב שומנים מוגדר. ה-GUVs נוצרו בשיטת הידרציה בעזרת ג'ל, במיוחד הידרציה של ג'ל אלכוהול פוליוויניל, כפי שתואר על ידי Weinberger et al.23, שאפשרה אנקפסולציה יעילה של נספחים לתוך GUVs.
השימוש בקרינת לייזר אינפרא-אדום קרוב (NIR) על ננו-חלקיקים מתכתיים (NPs) גורם לחימום משמעותי של NP, מה שהופך אותו לשיטה יעילה להקמת מקור חום מקומי המנוצל ביישומים ביו-רפואיים24. השיטה שימשה בתחילה למדידה ישירה של הטמפרטורה סביב AuNP יחיד הן בבדיקות ביומימטיות דו-ממדיות והן תלת-ממדיות. בבדיקות אלה25,26, הננו-חלקיקים הפלזמוניים הוקרנו על דו-שכבה ליפידית נתמכת או נלכדו אופטית ליד GUV שעברו מעבר פאזה תרמית מקומית בחימום מקומי, מה שאיפשר כימות ובקרה של פרופיל הטמפרטורה המדויק סביב החלקיק. פרופיל טמפרטורת ייחוס זה שימש בעת חקירה או מניפולציה של דגימות ביולוגיות. התקדמות נוספת בשיטה הקלה על השראת נקבוביות ננוסקופיות בממברנות27, ואפשרה איחוי שלפוחית ואיחוי תאים28,29. מחקרים אחרים חקרו את ההתנהגות של חלבוני קרום היקפי בחלבוני GUVs29 וחלבונים טרנסממברנליים30 על ידי יצירת בועיות היברידיות חדשניות, בעוד שהעברת תרופות ספציפיות לתאים נחקרה גם כדי לשלוט ולחקור תגובות תאיות או ביטוי גנים 28,29,31,32,33. לאחרונה נעשה שימוש בשיטה כדי לחקור תגובות חלבונים לנזק לממברנות 32,34,35.
קיימות מספר שיטות לשיבוש קרום הפלזמה כדי לחקור תגובות תאיות ותיקון ממברנה. אלה כוללים ניקובי מיקרו-מחטים, טלטול מיקרו-חרוזים וגירוד תאים, שכולם יכולים לשבש את קרום התא באופן מכני 14,36,37. נזק כימי יכול להיות מושג על ידי הוספת דטרגנטים 5,38 או רעלנים חיידקיים39,40 המערערים את יציבות השומנים הדו-שכבתיים ויוצרים נקבוביות קרום על פני קרום הפלזמה. יתר על כן, פציעות המושרות אופטית על ידי גלים רציפים ולייזרים פועמים שימשו לחקר רכיבי PMR, כגון חלבוני אנקסין 5,14,21,41, בשילוב עם ננו-חלקיקים פלסמוניים 42,43,44,45 . למרות יעילותם של לייזרים פועמים בהספק גבוה, הם עלולים לגרום לפציעות משמעותיות ולנזק לפנים התא לאורך נתיב הקרן. יתר על כן, השינויים המפורטים המתרחשים בחומר הביולוגי בעת הקרנת לייזר פועמת והאם היא יוצרת נקבובית מוגדרת היטב עדיין צריכים להיחקר. במאמר זה מוצגת שיטה חלופית, המשתמשת בתרמופלזמוניקה כדי לגרום לחורים ננוסקופיים בחומר חלקיקי באופן מבוקר34,35 מבלי לגרום נזק משמעותי למבנים הפנימיים. זה מושג על ידי חשיפת NPs פלסמוניים ללייזר NIR ממוקד מאוד, וכתוצאה מכך עליית טמפרטורה מקומית מאוד שיכולה להגיע בקלות לטמפרטורות העולות על 200 מעלות צלזיוס, מה שיכול להוביל לפיצוצים ננוסקופיים קטנים 25,46,47. ניתן לשלוט בתהליך זה על ידי התאמת עוצמת הלייזר, כמו גם הגודל, הצורה וההרכב של NPs48. על ידי שימוש בטכניקה זו, חוקרים יכולים לחקור את תפקידם של חלבונים בתיקון חלקיקים חלקיקיים בתאים חיים, מה שיכול לעזור לענות על כמה מהשאלות הבלתי פתורות לגבי מעורבותם של חלבוני אנקסין בתיקון ממברנות מבלי לפגוע בכדאיות התא.
הלכידה האופטית של ננו-חלקיקים פלסמוניים הוכחה היטב על ידי מחקרים קודמים 25,49,50,51,52; עם זאת, תובנות נוספות לגבי התכונות התרמופלסמוניות של ננו-חלקיקים 53,54,55 ניתן לקבל בחומרים המשלימים (קובץ משלים 1). השיטה התרמופלסמונית יכולה לשמש ליצירת חורים ננוסקופיים בחומר חלקיקי לצורך חקר התגובה התאית ומנגנוני התיקון. ליתר דיוק, הנקב יכול להיות מושג באמצעות חימום אופטי של AuNPs בקרבת הממברנה, כפי שמוצג באיורים 1A ו-B. ניקוב מקומי זה מאפשר זרם Ca2+, שאומת על ידי חיישן סידן, ובכך מפעיל את מנגנון PMR. עבור ניסויים בתאים חיים, AuNPs בקוטר של 200 ננומטר שותקו על פני השטח מתחת לתא כדי לפקח על התפקיד של ANXA2 ב- PMR באמצעות מיקרוסקופ קונפוקלי. לייזר NIR (איור 1A,B), באורך גל של 1064 ננומטר, מקרין את ה-AuNP ומנצל את התכונות הפלזמוניות שלו (איור 1C), וכתוצאה מכך חימום מקומי משמעותי (איור 1D) בחלון השקיפות הביולוגית49 תוך גרימת נזק מינימלי לתא עצמו. אזור הטמפרטורה הגבוהה המקיף את ה-AuNP יורד במהירות ב-30-40% במרחק המתאים לרדיוס ה-NP, כפי שמתואר באיור 1E, מה שמאפשר פגיעה מוגבלת מאוד בכל שלושת המימדים.
קובץ משלים 1. אנא לחץ כאן כדי להוריד קובץ זה.
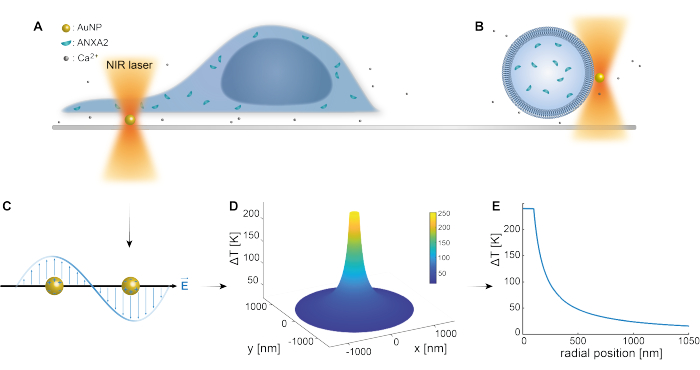
איור 1: קווי מתאר סכמטיים של שיטת הניסוי. (A) תאים נגועים ב-ANXA ממוקמים על גבי ננו-חלקיקי זהב משותקים (AuNPs) על פני השטח, או (B) שלפוחיות חד-למלריות ענקיות (GUVs) עם ANXA עטוף תלויות בתווך המכיל AuNPs. (C) AuNP יחיד מוקרן על-ידי מלכודת אופטית NIR, שבה האינטראקציה בין השדה האלקטרומגנטי הנכנס לבין אלקטרונים מוליכים מובילה לתנודה קולקטיבית של אלקטרונים בתוך NP. (D) תהליך זה גורם לעלייה מוגבלת מאוד אך משמעותית בטמפרטורה. כדי להעריך את הטמפרטורה על פני השטח NP, משתמשים בתורת Mie, ומחושב פרופיל טמפרטורה (E) עבור AuNP בקוטר של 200 ננומטר ועוצמת לייזר I = 6.36 x 108 W/cm2. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כדי למזער את ההשפעה התרמית על קרום התא, AuNPs מוקרנים רק למשך ~ שנייה אחת. זה גורם לפרץ חום חולף ומקומי, אשר מפחית את הנזק לחלבונים שבדרך כלל דורשים זמן רב יותר כדי להתפתח. עם ניקוב הממברנה, חלבוני אנקסין מגויסים תוך שבריר שנייה, ותוך מספר שניות נוצר פיגום דמוי טבעת אנקסין סביב אתר הפציעה (איור 2). גישה זו יושמה גם כדי לחקור את המעורבות של ANXA5 הן בתאים חיים והן בקרומי מודל16 במאמץ לשפוך אור על התוכנית המלאה של תהליכי התיקון. בעוד שההתמקדות העיקרית הייתה בגיוס מתאם של חלבוני אנקסין שונים, ההיבטים הביופיזיקליים של מנגנון התיקון טרם הובהרו.
כדי ליישם באופן מלא את השיטה המוצעת, נדרשים שלושה מרכיבים מרכזיים: מיקרוסקופ קונפוקלי, פינצטה אופטית וננו-חלקיקי מתכת. פינצטה אופטית משמשת ללכידת AuNPs, ואת הבנייה שלהם ניתן להשיג על ידי ביצוע ההליך שתואר על ידי Neuman et al.49. עם זאת, אם בניית פינצטה אופטית מתגלה כמאתגרת מדי, ניתן להשתמש בלייזר NIR ממוקד היטב כדי להקרין AuNPs משותקים מתחת לתאים. בעוד AuNPs כדוריים נבחרו עבור פרוטוקול זה, מגוון של חלקיקים פלסמוניים עם ספקטרום בליעה teven יכול לשמש גם כדי להשיג שיפוע טמפרטורה מקומי מאוד בתוך אזור NIR48.
הדמיה פלואורסצנטית נחוצה לצפייה בתפקידם של החלבונים המסומנים באופן פלואורסצנטי, ולכן מיקרוסקופ השתקפות פנימי כולל (TIRF)56 יכול להיחשב כחלופה לדימות קונפוקלי. עם זאת, טכניקה זו מאפשרת רק הדמיה של פני השטח ולא תהיה תואמת לניסויי שלפוחית הממברנה של המודל. כתוצאה מכך, הן הפינצטה האופטית והן המיקרוסקופ הקונפוקלי חיוניים למיקום מדויק של הננו-חלקיק ולחקירה מפורטת של האזור המקומי הסובב את הפגיעה בתא. כדי להקרין ביעילות את הננו-חלקיק עם מיקוד לייזר מוגבל עקיפה, יש צורך לדמיין את הננו-חלקיק. ניתן להשיג זאת בצורה אופטימלית על ידי מיקרוסקופ השתקפות, שהוא תכונת הדמיה סטנדרטית של מיקרוסקופים קונפוקליים של לייקה. עם זאת, אם הדמיית השתקפות או פיזור אינה זמינה, ניתן לשקול שיטות חלופיות, כגון תיוג AuNP פלואורסצנטי פחות יעיל.
לסיכום, לשיטה התרמופלסמונית הנשלטת והמקומית המוצגת במחקר זה יש פוטנציאל לשמש פלטפורמה מצוינת לחקר המרכיבים המולקולריים המעורבים בתגובות תאיות ובמנגנוני תיקון חלקיקים בתאים חיים. בנוסף לחקר תגובת החלבון על נזקי PM ניתן להשתמש בגישה זו גם לניקוב מקומי של שלפוחיות, ובכך לאפשר חקירה של תגובת החלבון הן בדינמיקה של חלבון-חלבון והן בדינמיקה של חלבון-ממברנה. יתר על כן, שיטה זו מאפשרת ניתוח כמותי של יחסי הגומלין בין חלבונים, שומנים ומולקולות קטנות כאשר ממברנות משובשות. באופן קולקטיבי, להתקדמות זו יש פוטנציאל לשפוך אור על כמה מהשאלות הבלתי פתורות בנוגע למכונות המורכבות והמורכבות לתיקון קרום פלזמה.
Protocol
1. הכנת ניקוב קרום התא
- זריעת תאים (יום 1)
- תרבית תאי כליות עובריים אנושיים (HEK293T) בתרבית בינונית בטמפרטורה של 37°C באינקובטור של 5% CO2 עד שהם מגיעים למפגש של 70%.
- נתקו את התאים מפני השטח באמצעות 500 מיקרוליטר טריפסין, ספרו 200,000 תאי HEK293T וזרעו אותם בצלחת תרבית בעלת נפח כולל של 3 מ"ל מדיום תרבית. יש לדגור על התאים בטמפרטורה של 37°C באינקובטור של 5% CO2 למשך 24 שעות.
הערה: כדי למנוע קיבוץ תאים במרכז הצלחת, פזרו את התאים באופן שווה והימנעו מערבול המנה, מכיוון שהדבר עלול לפגוע ביעילות ההעברה.
- טרנספקציה של תאים (יום 2)
הערה: ניתן להשתמש בתאים הנגועים עד 48 שעות לאחר הטרנספקציה.- Pipet את פלסמיד של עניין ואת מגיב transfection במשך 5 s לפני השימוש.
- בצינור סטרילי של 2 מ"ל, מערבבים את הדברים הבאים בסדר הספציפי: 500 μL של מדיום סרום מופחת, 5 μL של מגיב טרנספקציה (פי 4 יותר מאשר פלסמיד), ו 1.25 μL של פלסמיד (1 מיקרוגרם / μL).
הערה: כדי לחקור זרימת סידן עם קרע בממברנה, בצע את אותו הליך אך השתמש בחיישן הסידן הקשור לקרום GCaMP6-CAAX (1 מיקרוגרם/μL). - מזלפים בעדינות אך ביסודיות את תערובת הטרנספקציה ודגרים עליה בטמפרטורת החדר (RT) במשך 30 דקות לפני הוספתה טיפתית לתאים.
- לפני הוספת תערובת transfection, להסיר את המדיום מן צלחת התרבית, בעדינות לשטוף את התאים עם 2 מ"ל של מלוחים פוספט חוצץ, ולהוסיף 2000 μL של מדיום סרום מופחת לצלחת.
- לדגור את התאים יחד עם תערובת transfection ב 37 ° C באינקובטור 5% CO2 מכשיר אדים במשך 2 שעות ו 45 דקות לפני שינוי המדיום ל 3 מ"ל של מדיום התרבית.
- הכנת תמיסת ננו-חלקיקי זהב (AuNP) (יום 2)
- מערבולת את פתרון מלאי AuNP של 200 ננומטר עבור 10 שניות ברמה 10 (ראה טבלת חומרים למפרט נוסף של מנגנון), סוניקט למשך 5 דקות (משרעת מקסימלית), ומערבולת שוב עבור 10 שניות.
- מערבבים 150 μL של AuNPs עם 850 μL של מים מזוקקים לנפח כולל של 1 מ"ל.
הערה: ניתן לאחסן את תמיסת AuNP המדוללת במקרר ולעשות בה שימוש חוזר עד חודש אחד.
- הכנת המנה הניסיונית (יום 2)
- מצפים את צלחת המיקרווול ב-150 μL של תמיסת חיבור תאים של 0.01%-0.1% ודגרים במשך 15 דקות ב-RT.
- שטפו את משטח הזכוכית פעמיים עם 500 מיקרוליטר מים מזוקקים ואפשרו לו להתייבש באוויר למשך ~10 דקות.
- הוסף 80 μL של תמיסת AuNP טיפה למשטח היבש.
הערה: מערבולת (10 שניות), סוניקט (5 דקות) ומערבולת (10 שניות) את תמיסת AuNP המדוללת לפני הוספתה למשטח הזכוכית המצופה כדי למזער אגרגטים של AuNP. - המתן ~ 10 דקות לפני הצגת 1.5 מ"ל של מדיום תרבות. תן את המנה לדגור ב 37 מעלות צלזיוס במשך הלילה.
- הכנת תא הניסוי (יום 3)
הערה: ניתן להכין את תא הניסוי ביום 3 או 4; עם זאת, ודא כי ההכנות הבאות נעשות באותו יום של הניסוי.- הסר את המדיום מן התאים בצלחת התרבית ולשטוף את התאים עם 2 מ"ל של מלוחים חוצץ פוספט.
הערה: שלב זה חיוני כדי להסיר כל תווך שיורי ולכלוך שעלולים להפריע לשלבים הבאים. - מוסיפים 500 מיקרוליטר של תמיסת פירוק תאים מבוססת אנזים לבאר ודגרים למשך 1-3 דקות עד שהתאים מתנתקים מצלחת התרבית.
- הוסף 1.5 מ"ל של מדיום תרבית טרי פיפטה תמיסת התא כדי לקבל פתרון תאים הומוגני כדי למזער את הסבירות של אשכולות תאים.
- בזהירות להסיר את המדיום מן AuNPs במיקרו-באר הניסוי.
- הוסף את תמיסת התא (2 מ"ל) למיקרווול ואפשר לו לדגור לפחות 5 שעות לפני ביצוע הניסוי.
הערה: לתנאי ניסוי אופטימליים, הימנע מערבול החדר, מכיוון שהדבר עלול לגרום לתאים להתקבץ במרכז החדר.
- הסר את המדיום מן התאים בצלחת התרבית ולשטוף את התאים עם 2 מ"ל של מלוחים חוצץ פוספט.
2. ניסוי ניקוב קרום התא
- הגדרות אופטיות של הניסוי
- בצע את הניסויים באמצעות מיקרוסקופ סריקה קונפוקלי בשילוב לייזרמלכוד 1064 ננומטר 57.
- בצע את הלכידה האופטית במישור המוקד תוך שימוש ביעד טבילה במים של 63x עם צמצם מספרי (NA) של 1.2.
- נניח שהמוקד הוא בגודל של דיסק אוורירי ושרוחב קרן המוקד של לייזר הקרינה הוא ~ 540 ננומטר רדיוס.
- המר את עוצמת הלייזר (P) לעוצמת הלייזר המתאימה (I) על-ידי חישוב עוצמת הלייזר לכל אזור (W/cm2).
- השתמש במפצל קרן אופטי אקוסטי (AOBS) כדי לדמיין אותות פלואורסצנטיים מרובים שזוהו באמצעות צינורות מכפיל אור וזיהוי סימולטני של NPs מתכתיים באמצעות אות הפיזור שלהם.
הערה: לא כל המערכות הקונפוקליות מצוידות ב- AOBS, המאפשר הדמיית השתקפות של NPs מתכתיים. כאן יש ליישם צורות אחרות של גילוי, או לנסות סריקה רציפה של לייזר NIR באזור שמתחת לתא. - במהלך מפגשי הניסוי, הרכיבו על המיקרוסקופ תא פתוח בעל תחתית זכוכית המכיל תאים, גשושיות פלואורסצנטיות מולקולריות וננו-חלקיקי זהב.
- הזז את ההשמנה יחסית לתאים על ידי תרגום הדגימה המורכבת על שלב פיאזואלקטרי, המאפשר תנועות רוחב מדויקות ננומטר16.
הערה: המלכודת האופטית נשמרת במצב נייח.
- הגדרות ניסיוניות לניקוב קרום התא
- הניחו HEK293T תאים, שעברו על פלסמידים של אנקסין יחד עם חלבון פלואורסצנטי, על גבי AuNPs מבודדים שמשותקים על משטח הזכוכית (איור 1A).
- השתמש בלייזר Argon 488 ננומטר כדי להמחיש את אות הפלואורסצנטיות של GFP ובלייזר HeNe 633 ננומטר לצפייה בהשתקפות AuNP במיקרוסקופ קונפוקלי סורק.
- השתמש בטוויטר האופטי, הפועל עם לייזר NIR 1064 ננומטר, כדי להקרין AuNP יחיד במשך ~1 שניות, מה שגורם לעלייה מקומית משמעותית בטמפרטורה המשבשת את קרום הפלזמה.
- החל קרינה בין 200-295 mW על החלקיק הממוקד, וכתוצאה מכך עלייה משמעותית בטמפרטורה.
הערה: יש אובדן כוח משמעותי בתוך האופטיקה, כאשר עוצמת הלייזר בנקודת המוקד מגיעה לכ -20% מהמילי וואט המוצהר, בהתאם להגדרה הספציפית. העוצמה הסגולית (הנמדדת ברוחב / ס"מ2) תלויה ביישור המדויק של המערכת, במיוחד בגודל המוקד. בנוסף, הולכת החום של זכוכית גבוהה מזו של התא והמים וכתוצאה מכך הפחתת כמות החום המשתחררת לקרום הפלזמה מופחתת מעט48,58. - השג פציעת PM יעילה ומקומית ותגובה לתיקון חלבונים לאחר מכן על ידי כיול נכון של הלוקליזציה של נקודת מיקוד הלייזר NIR. זה מושג על ידי לכידת AuNP יחיד תלוי באותו מדיום הדמיה ולוודא כי AuNP שנבחר הוא בפוקוס לפני הקרנה.
הערה: הננו-חלקיק נחשב לממוקד כאשר אות הפיזור שלו נראה החד ביותר, כלומר מציג קצוות ברורים והיעדר הילה סביב החלקיק, כאשר צופים בו במיקרוסקופ קונפוקלי (איור 2C (ii)).
- תנאי צפיפות תאים ו- AuNP
- בחר תאים בודדים במקום אשכולות תאים כדי למנוע חפיפה של קרום הפלזמה.
הערה: התאים צריכים להיות דבוקים לפני השטח, תוך הצגת מורפולוגיה שטוחה (איור משלים 1), המאפשרת ניקוב של פריפריית התא תוך מניעת נזק לקרום הגרעין (איור משלים 2). - לדגור על התאים על פי הפרוטוקול או עד שהם התיישבו והשתטחו כדי למנוע ספיגה תאית של AuNP. הימנע מזמן דגירה מוגזם והפחת את הסבירות לאנדוציטוזה של AuNP באמצעות PEGylated AuNPs.
- ודא כי AuNPs משותקים נמצאים כחלקיקים בודדים, מרווחים מספיק זה מזה כדי למנוע אגרגטים. אגרגטים יכולים להוביל לעלייה משמעותית בשיפוע התרמי, וכתוצאה מכך טמפרטורות גבוהות שעלולות לשבש חלק ניכר מהתא.
- החלף את הדגימה כל 1-2 שעות כדי לשמור על בריאות התא.
הערה: חשיפה ממושכת עלולה להוביל להידרדרות בבריאות התא, ולפגוע ביכולתם להגיב במדויק לפציעה במונחים של תיקון ממברנה. ירידה זו בבריאות התא נצפית בדרך כלל על ידי שינוי בצורת התא, כאשר התאים נראים כדוריים יותר ונוקשים יותר, ובסופו של דבר מגיעים לשיאם במוות תאי.
- בחר תאים בודדים במקום אשכולות תאים כדי למנוע חפיפה של קרום הפלזמה.
מידע משלים. אנא לחץ כאן כדי להוריד קובץ זה.
3. הכנת שלפוחית חד-למלרית ענקית (GUV)
- הכנת תערובת השומנים
- הפוך את הרכב השומנים של GUV על-ידי שילוב של 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) ו-1,2-dioleoyl-sn-glycero-3-phospho-L-serine (DOPS) ביחס מולארי של 4:1 (ראה טבלה 1). Aliquot את מלאי השומנים לתוך בקבוקוני זכוכית 1.5 מ"ל על פי הצרכים הניסיוניים ולאחסן אותם ב -20 ° C.
הערה: לשימור שומנים ממושך ולמניעת חמצון של שומנים בלתי רוויים, החליפו את האוויר בארגון בבקבוקונים האליציטוטיים. - לפני ערבוב השומנים, נקו היטב מזרק זכוכית או מתכת של 50 μL ו-500 μL עם כלורופורם חמש פעמים כדי לוודא שהם נקיים ממזהמים עבור השומנים המומסים בכלורופורם.
אזהרה: יש לטפל בכלורופורם במכסה אדים בשל רעילותו.- מעבירים את הנפח המחושב של כלורופורם לבקבוקון נקי מזכוכית ענבר, ולאחר מכן את הכמות שצוינה של כל ליפיד (ראו טבלה 1).
הערה: כדי למנוע זיהום צולב בין מלאי השומנים, ודא שהמזרקים מנוקים עם כלורופורם. - לבסוף, מוסיפים את צבע הממברנה ומערבבים היטב את השומנים על ידי pipetting. לאחסן את תערובת השומנים מוכן ב -20 °C לשימוש נוסף; התערובת נשארת בת קיימא במשך 2-3 שבועות ללא נזק משמעותי לשומנים.
הערה: הערבוב צריך להיעשות עם מזרק מתכתי או זכוכית. תמיד לשמור את השומנים על קרח כאשר הם מחוץ למקפיא.
- מעבירים את הנפח המחושב של כלורופורם לבקבוקון נקי מזכוכית ענבר, ולאחר מכן את הכמות שצוינה של כל ליפיד (ראו טבלה 1).
- הפוך את הרכב השומנים של GUV על-ידי שילוב של 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) ו-1,2-dioleoyl-sn-glycero-3-phospho-L-serine (DOPS) ביחס מולארי של 4:1 (ראה טבלה 1). Aliquot את מלאי השומנים לתוך בקבוקוני זכוכית 1.5 מ"ל על פי הצרכים הניסיוניים ולאחסן אותם ב -20 ° C.
- הכנת ג'ל אלכוהול פוליוויניל (PVA)
- הכן את GUVs באמצעות שיטת הידרציה בעזרת ג'ל המתוארת על ידי Weinberger et al.23עם שינויים קלים.
- הכינו את ג'ל ה-PVA על ידי המסת 5 גרם PVA ב-100 מ"ל של חיץ המכיל 50 מ"מ סוכרוז, 25 מ"מ NaCl ו-25 מ"מ טריס (pH 7.4).
- מחממים את תמיסת ה-PVA ל-85°C ומערבבים עד שהיא הופכת לשקופה. תנו לו להתקרר ל-RT ואחסנו אותו במקרר לשימוש נוסף.
הערה: PVA אינו מומס כראוי בחיץ, ולכן יש צורך בחימום של עד 85°C.
- הכן את GUVs באמצעות שיטת הידרציה בעזרת ג'ל המתוארת על ידי Weinberger et al.23עם שינויים קלים.
- הכנת שקופיות זכוכית
- נקו את מגלשות הזכוכית עם אתנול והניחו להן להתייבש באוויר. לאחר מכן, טפל בשקופיות עם שואב פלזמה אוויר כדי להסיר כל זיהום שיורי משטח הזכוכית.
- הכנת שקופיות זכוכית מצופות PVA
- חממו את ג'ל ה-PVA (5%) עד 60°C למשך 30 דקות כדי להגביר את הנזילות שלו. יש למרוח 90 מיקרוליטר של PVA חם על מגלשת הזכוכית, לפזר באופן אחיד ולתת לו להתייבש בארון חימום בטמפרטורה של 50°C למשך 50 דקות.
- לאחר שמגלשת זכוכית PVA מוכנה, הוסף 30 μL של תערובת השומנים המוכנה באמצעות מזרק זכוכית או מתכת ופרוס אותו לתוך סרט דק באמצעות קצה המחט.
- יבש את תערובת השומנים על ידי אידוי תכולת הכלורופורם שלה תחת לחץ חנקן עדין. יתר על כן, יבש את שקופיות הזכוכית תחת ואקום במשך 1.5-2 שעות.
- גידול GUV בתא
- הרכיבו את החדר הפנימי, הדומה בעיצובו לדו"ח59 שפורסם בעבר, באמצעות מגלשת הזכוכית המוכנה.
- בצינור נפרד של 2 מ"ל, מדללים את החלבון הרקומביננטי המעניין (במקרה זה, ANXA5 או ANXA4) לריכוז סופי של 500 ננומטר עם חיץ גדל (GB) המורכב מסוכרוז 80 mM, 70 mM NaCl ו- 25 mM Tris-HCl (pH 7.4).
- הוסף 400 μL של תמיסת חלבון רקומביננטי מדולל לתא. דגרו על התא ב-RT במשך שעה אחת כדי לאפשר ל-GUV לצמוח משכבת השומנים שהושקעה. השתמש באותו חיץ, למעט החלבון, כבקרה שלילית.
הערה: עטפו את התא בסרט פוליאולפין כדי למנוע אידוי חיץ. - לאסוף את GUVs על ידי העברת 400 μL של תוכן התא צינור 2 מ"ל.
- הסר חלבונים שאינם עטופים מחוץ ל- GUV על ידי הוספת 1 מ"ל של מאגר תצפית (OB) המכיל 55 mM גלוקוז, 70 mM NaCl ו- 50 mM Tris-HCl (pH 7.4) לתמיסה שנאספת. לאחר מכן, צנטריפוגה את התמיסה ב 600 x גרם במשך 10 דקות ב 13 ° C.
- לאחר הצנטריפוגה, להחליף 1 מ"ל של supernatant עם נפח שווה של חיץ תצפית. פזרו את ה-GUV באמצעות צנרת עדינה ואחסנו אותם במקרר עד שישמשו אותם בניסויי GUV.
4. ניסוי ניקוב GUV
- הכנת הקאמרי
- השתמשו בצלחת בעלת תחתית זכוכית בקוטר 35 מ"מ לצורך הניסוי. כדי למנוע מ-GUV להידבק למשטח ולהתפוצץ, צפו את המשטח ב-β-קזאין (5 מ"ג/מ"ל) למשך 15-30 דקות.
- עבור תמיסת β-קזאין, יש להמיס 0.1 גרם של החלבון במאגר של 20 מ"ל של 20 mM Tris (PH 7.5) ו-100 mM NaCl. מסננים את תמיסת החלבון, מכניסים אותה לבקבוקונים קטנים ומקפיאים אותה לשימוש נוסף.
- שטפו את התא פעמיים עם חיץ תצפית כדי להסיר עודפי β קזאין חופשיים מפני השטח והניחו להם להתייבש ב-RT.
- בצינור נפרד של 2 מ"ל, מערבבים את ה- GUV שנאספו עם OB. הוסף CaCl2 לתערובת לקבלת הריכוז הסופי הרצוי (במקרה זה, 200 מיקרומטר).
- הציגו ננו-קונכיות זהב 150 ננומטר (AuNS) לתערובת ביחס של 1:100. התערובת הסופית כוללת 250 μL של GUVs, 225 μL של OB, 20 μL של CaCl2 (5 mM), ו 5 μL של AuNSs שצוינו.
- השתמשו בצלחת בעלת תחתית זכוכית בקוטר 35 מ"מ לצורך הניסוי. כדי למנוע מ-GUV להידבק למשטח ולהתפוצץ, צפו את המשטח ב-β-קזאין (5 מ"ג/מ"ל) למשך 15-30 דקות.
- מערך ניסיוני
- מעבירים את התערובת לתא ומרכיבים אותה על במת המיקרוסקופ. בהתאם לגודל החדר, מוסיפים את התערובת כולה או חלק מהתערובת.
הערה: העיתוי הוא קריטי מכיוון שיוני סידן יכולים לעבור דרך הממברנה ולתווך את קשירת הנספחים לעלון הפנימי של הממברנה. - השתמש באותו מערך אופטי המשמש לניסויי ניקוב התא.
- השתמש בפינצטה האופטית כדי ללכוד AuNS בודד בסמיכות או על פני השטח של GUV על ידי הפעלת עוצמת לייזר של ~ 125 mW.
- לאחר מכן, להגדיל את כוח הלייזר ל ~ 300 mW. זה מייצר עליית טמפרטורה מקומית מאוד, אשר משבשת ומנקבת את הממברנה באתר היעד.
הערה: AuNSs מועדפים לניסויי GUV בשל יכולתם ליצור עליית טמפרטורה חולפת גבוהה יותר תוך שמירה על גודל קטן יותר בהשוואה ל- AuNPs מוצקים.
- מעבירים את התערובת לתא ומרכיבים אותה על במת המיקרוסקופ. בהתאם לגודל החדר, מוסיפים את התערובת כולה או חלק מהתערובת.
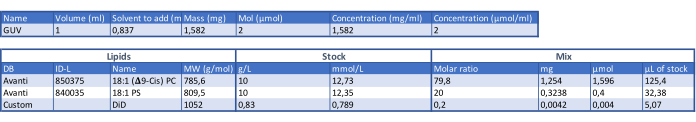
טבלה 1: טבלה לקביעת הרכב GUV. אנא לחץ כאן כדי להוריד טבלה זו.
5. מדידות וניתוח נתונים של תגובת ANXA בניסויי ניקוב תאים
- השתמשו ב-MATLAB כדי לנתח את התמונות ולחשב ולשרטט את פרופיל הטמפרטורה של AuNP (איור 1D, E) בהתבסס על משוואות60,61 של מיי.
- בנוסף, עבד את כל התמונות הקונפוקליות באמצעות התפלגות FIJI ImageJ 62,63.
- חישוב רדיוס טבעת ANXA
- חתוך את האזור המעניין המכיל את האזור המנוקב מהנתונים הגולמיים לפני ניתוח פגיעה בממברנה.
- השתמשו בתהליך העבודה הפנימי של MATLAB לעיבוד כל תמונה על ידי סימון ידני של מרכז טבעת ANXA וההיקף החיצוני שלה.
- השתמש בסימונים אלה כדי להגדיר את מגבלות העיבוד עבור האזור המעניין.
הערה: האזור מעובד לאחר מכן רדיאלית בתוך הגבולות שנקבעו, ועוצמת הפלואורסצנטיות במרחק מסוים למרכז היא הממוצע על פני המעגל המלא עם אותו מרחק מרכז. מספר זה מאוחסן עבור כל שלב רדיוס. - השתמש בתהליך העבודה כדי להתאים את העוצמות הממוצעות לאורך כל טווח הסריקה לעקומת גאוס חד-ממדית כדי לזהות את המקסימום (Rp) והרוחב המלא בחצי מקסימום (FWHM) המתאימים ל-Rext ו-Rint, בהתאמה, כפי שמתואר באיור 3A.
- השתמש בסימונים אלה כדי להגדיר את מגבלות העיבוד עבור האזור המעניין.
- לבסוף, קבעו את רדיוס טבעת ANXA לפי המרחק ממרכז הטבעתל-R ext שניתן על ידי התרשים שנוצר על ידי תהליך העבודה של MATLAB.
- חישוב רדיוס טבעת ANXA תלת מימדי
- עקבו אחר השינוי ברדיוס טבעת ANXA בכיוון z באמצעות אותו תהליך עבודה של ניתוח MATLAB כמו בשלב 5.1. החילו את תהליך העבודה על מספר מקטעי z קונפוקליים לאורך פצע הממברנה, כפי שמודגם באיור 3C, E.
- חשב את השיפוע עבור כל פצע בהתבסס על השינוי ברדיוסים מעל חתכי z, כפי שמתואר באיור 3F.
- התפתחות הזמן של רדיוס טבעת ANXA
- באופן דומה, עקוב אחר התפתחות טבעת ANXA של טבעת ANXA לאחר ניקוב קרום תרמופלסמוני באמצעות זרימת העבודה של ניתוח MATLAB משלב 5.1. נתח נקודות זמן עוקבות כדי לעקוב אחר שינויים לאורך זמן, כפי שמודגם באיור 3D, G, H.
Representative Results
במחקר הנוכחי, השיטה התרמופלסמונית משמשת לחקר תגובת חלבון האנקסין להפרעה בקרום הפלזמה; עם זאת, כל חלבון שניתן לגייס עם פגיעה בממברנה יכול להיחקר באמצעות בדיקה זו, בהתחשב בכך שהחלבון המתאים מסומן באופן פלואורסצנטי. גיוס חלבונים ותפקודם מנוטרים על ידי הדמיה קונפוקלית הן בתאי כליות עובריות אנושיות (HEK293T) והן בשלפוחיות חד-למלריות ענקיות (GUV). כדי לפרט, איור 2 מדגים את תנאי הניסוי שבהם קרן לייזר NIR ממוקדת ב-1064 ננומטר משמשת להקרנת AuNP יחיד (איור 2A), מה שגורם לפגיעה בקרום ולזרימה של Ca2+ לתוך התא, מה שמפעיל את מנגנון PMR. לאחר מכן, נספחים מגויסים במהירות לאתר הפגיעה, שם הם נקשרים לפוספוליפידים הטעונים שלילית בהיקף הפצע, ויוצרים מבנה דמוי טבעת תוך שניות (איור 2B, i-iv). ניסויי קרום המודל, באמצעות GUVs, הראו כי נקבי הממברנה נאטמו מחדש במהירות בהיעדר ANXA, כפי שמתואר באיור 2C. אולם בנוכחות ANXA נצפתה הצטברות מהירה של ANXA באתר הפציעה לאחר ניקוב הממברנה (איור 2D). יש לציין כי ANXA המשיכה לגלגל את הקצוות החשופים, מה שהוביל בסופו של דבר להתפוצצות ה- GUV. מנגנון גלגול זה נובע ככל הנראה מהיכולת של ANXA לגרום לעקמומיות ולכופף את קרומי השומנים20.
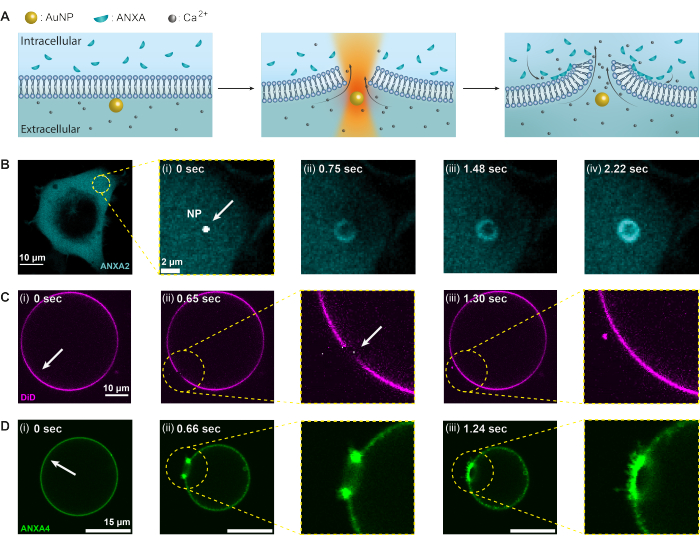
איור 2: תגובת Annexins (ANXAs) להפרעה בקרום המושרה על-ידי תרמופלסמוניק. בתחילה, (A) קרום הפלזמה פועל כמחסום בין הסביבה החוץ תאית המכילה רמות גבוהות של יוני Ca2+ לבין הסביבה התוך-תאית עם ANXA עטופים. עם הקרנה בלייזר אינפרא אדום קרוב (NIR), ה- AuNP מייצר חום משמעותי, גורם לקרום להיקרע וכתוצאה מכך זרם של יוני Ca2+. כתוצאה מכך, מכונות תיקון קרום פלזמה (PMR) מופעל, אשר כרוך גיוס של ANXAs לאתר הפציעה, שם הם נקשרים פוספוליפידים טעונים שלילית. (ב-ד) תמונות מיקרוסקופ קונפוקלי של תא המכיל ANXA2 ו- GUV המכיל ANXA4 מדגימות תהליך זה. (i) לפני הקרינה, התמונות מראות תא שלם, או GUV, כאשר אתרי ההקרנה מסומנים בחצים הלבנים. (ii) עם הקרנת ננו-חלקיקים, (B) ANXA מגויסים במהירות לאתר הפגיעה, ויוצרים מבנה דמוי טבעת סביב פצע הממברנה (B [ii-iv]). לוח (C) מראה GUV מוכתם בקרום ללא ANXA, אשר, עם ניקוב, אוטם מחדש במהירות ללא עיצוב מחדש של הממברנה שניתן לראות. מצד שני, לוח (D) מראה GUV המכיל ANXA4 רקומביננטי, שכבר קשור לממברנה לפני (i) הקרנה עקב דליפת Ca2+ על פני הממברנה. (ii) עם הניקוב, ANXA4 נקשר לקצוות החופשיים, מה שגורם ל-GUV לקרוס כאשר הממברנה מתגלגלת הרחק מהקצה. מוטות קנה המידה הם 10 מיקרומטר עבור איור (B), 2 מיקרומטר עבור B (i), 10 מיקרומטר עבור (C) ו-15 מיקרומטר עבור (D). נתון זה משוכפל מ Moreno-Pescador et. al16 באישור החברה המלכותית לכימיה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
ניתוח של מבנים שלמים דמויי טבעת ANXA (איור 2B ואיור משלים 1) מספק תובנות שימושיות לגבי גודל הפצע והמורפולוגיה. רדיוס מבנה טבעת ANXA יכול להיקבע על פני זמן ומרחב, כמתואר בסעיף 5. מורנו ועמיתיו ניתחו יותר מ-135 פגיעות בקרום הפלזמה בתאים חיים, כאשר הניתוח של מבנים טבעתיים מסוג ANXA5 מתואר באיור 3. הרדיוס נקבע על-ידי מדידת המרחק ממרכז הטבעת לרדיוס החיצוני של העקומה בהתבסס על חצי הרוחב המלא של פרופיל העוצמה שהתמוטט (איור 3A). הממצאים הדגימו התפלגות הטרוגנית של גדלי טבעות ANXA5 (איור 3B), שנשארה קבועה לאורך זמן (איור 3D,G,H) ומרחב (איור 3C,E,F). תוצאות אלה מצביעות על הצטברות של ANXA5 סביב אתרי הפגיעה, דבר המצביע על אסטרטגיית PMR חלופית בתיווך ANXA5 בתאים חיים לניצנים הפנימיים דמויי המשפך המשוערים של הממברנההפגועה 5.
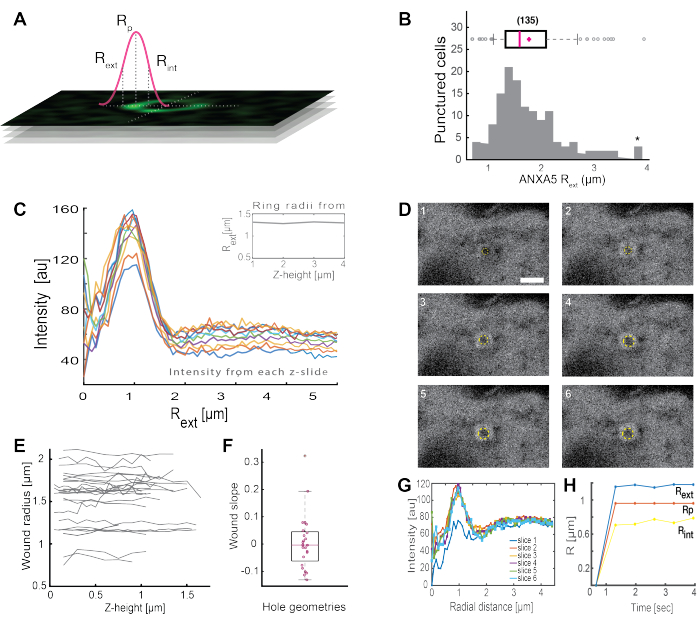
איור 3: ניתוח מבנים טבעתיים של ANXA5 המקיפים אתר פגיעה בתאים חיים. (A) הייצוג הסכמטי ממחיש את הגישה האנליטית, המבוססת על חצי רוחב מקסימלי של פרופיל קו עוצמת ANXA. (B) ההיסטוגרמה מדגימה 135 רדיוסי טבעת ANXA5 שנמדדו. (C) פרופילי קו עוצמת פלואורסצנטיות על פני טבעת ANXA5-GFP עבור כל חתך z של ערימת z. (D) התמונות הקונפוקליות ממחישות את התפתחות הזמן של פצע, כאשר ANXA5-GFP מצטבר בהיקף הפצע מיד לאחר הפציעה, ואחריו ייצוב הפצע. מסגרות הזמן שסומנו 1-6 צולמו במרווחים של 0.66 שניות לכל מסגרת. סרגל קנה המידה הוא 2 מיקרומטר. (E) רדיוסי הפצעים נקבעו כפונקציה של עומק הפצע בהתבסס על השיטה שהוצגה בלוח A. (F) שיפוע הפצע נותח כרדיוסי טבעת ANXA5 כפונקציה של גובה z בהתבסס על הנתונים שחולצו מלוח E. (G) פרופילי קו עוצמת הפלואורסצנטיות נמדדו על פני טבעת ANXA5-GFP מלוח D, כאשר בכל מרווח זמן 1-6 מסומן כפרוסה 1-6. לבסוף, (H) התפתחות הזמן של רדיוסי טבעת ANXA5-GFP מוצגת כפונקציה של הזמן המחושב מהנתונים בלוח G. נתון זה משוכפל מ Moreno-Pescador et. al16 באישור החברה המלכותית לכימיה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
בהשוואה למבנים דמויי טבעת שנוצרים על-ידי הפרעה לחומר חלקיקי בלבד (איור משלים 1), פציעות בקרבת הגרעין (איור משלים 2A) עשויות להשפיע על האבולוציה והגיאומטריה של הפצע. מדי פעם, רק חלק קטן של טבעות ANXA היו ברורים (איור משלים 2B,C), אשר ניתן לנתח גם באמצעות זרימת העבודה הפנימית של ניתוח MATLAB (ראה סעיף 5), אם כי נתונים נוספים עשויים ללכת לאיבוד. בדרך כלל, תצורות טבעות ANXA שנצפו בתאים לא נצמדים (איור משלים 2C) ממוקמות קרוב הן לגרעין והן לפריפריה של התא. כתוצאה מכך, מבנה טבעת מוארך יותר ניתן לצפות, אשר אינו אופטימלי עבור ניתוח הנתונים המוצגים. בנוסף, תאים שאינם דבקים נראו רגישים יותר למוות תאי בעקבות פציעה של חומר חלקיקי. יתר על כן, כאשר בוחנים פציעות הנובעות מהקרנה של אגרגטים AuNP, חשוב לציין כי פציעות אלה עשויות להיות חמורות יותר ופחות ניתנות לשליטה. זאת בשל הגידול המשמעותי בחימום פלסמוני, אשר יכול לפגוע בחלק גדול של התא. כתוצאה מכך, פציעות כאלה לא שולבו בניתוח טבעת ANXA5.
יתר על כן, הממצאים הראשוניים מצביעים על כך שההפרעה בקרום הפלזמה באמצעות תרמופלזמוניקה גורמת לרמות גבוהות של Ca2+ תוך תאי. זה נצפה אפילו בקרינה בעוצמה נמוכה של AuNPs בודדים, מה שמרמז על חדירות PM35, כפי שמתואר באיור 4. זרם Ca2+ נצפה בתאים המבטאים בדיקת סידן קשורה לקרום, GCaMP6s-CAAX, אשר עוברת שינוי קונפורמציה עם זרם Ca2+ , ולכן ניתן לראות עלייה בעוצמתו64. עוצמת הסידן כומתה עבור כל טביעת הרגל של התא לאורך זמן. כדי למנוע רעשי רקע, רמת Ca2+ ברקע הופחתה לפני הפרעה בממברנה ותיקון לאחר הממברנה. העוצמה המרבית נקבעה על-ידי נרמול העוצמה הממוצעת של Ca2+ בתוך התא, וכתוצאה מכך עקומת העוצמה הציגה עלייה ראשונית מהירה בעוצמה של Ca2+ ואחריה ירידה איטית יותר, כפי שמתואר באיור 4B.
התא הגיע לעוצמת סידן מקסימלית של ~ 6.6 שניות, מה שעולה בקנה אחד עם ממצאיהם של Klenow et al.64, שהציעו כי זמן שיא עוצמת הסידן (t = tc) מתאים לזמן הדרוש לסגירת פצע. עם זאת, בעוד שנדרשות חקירות נוספות כדי לבסס את המנגנון הבסיסי של תיקון קרום וריפוי פצעים, הממצאים הראשוניים הראו כי תהליך Ca2+ זה נצפה אך ורק בתא הפגוע ולא בתא שלא נפגע המשמש כבקרה חיובית. זה מאשר כי התא חווה זרם Ca2+ על הפרעה בקרום thermoplasmonic, שבו עודף סידן תוך תאי נשאב באופן פעיל החוצה לאחר PMR מוצלח כמו רמת הסידן התאית כבר לא בתחרות עם זרם Ca2+ , בסופו של דבר להשיג הומאוסטטזיסהתא 64.
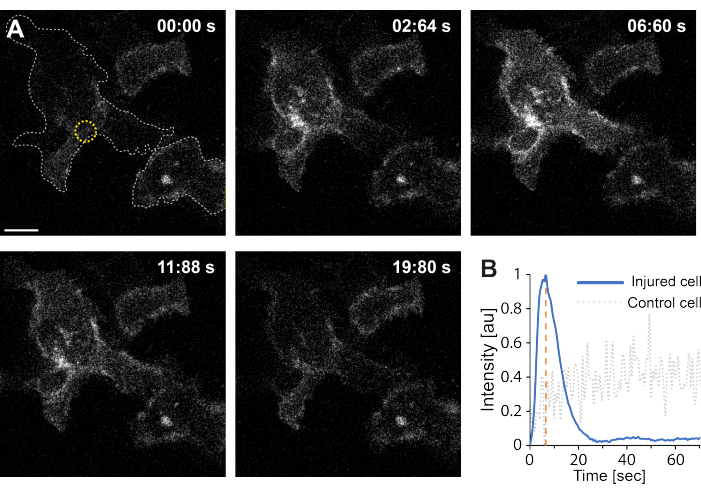
איור 4: זרימת סידן מתרחשת כאשר קרום הפלזמה של תא HEK293T נקרע על-ידי תרמופלזמוניקה. סדרה של תמונות קונפוקליות מראות שני תאים (התא המעניין ותא שלא נפגע המשמש כבקרה חיובית) המבטאים את בדיקת הסידן הקשורה לקרום, GCaMP6s-CAAX. סרגל קנה המידה מודד 10 מיקרומטר. (A) לפני הקרינה, בשעה 00:00 שניות, טביעת הרגל של שני התאים מודגשת על-ידי הקו האפור המקווקו, ואתר ההקרנה מסומן בעיגול הצהוב. עם הקרנת לייזר, זרם מהיר של Ca2+ הוא ציין, להגיע לעוצמה מקסימלית ב ~ 6.6 שניות, מסומן על ידי קו מקווקו כתום, נקודת זמן כי הוא הניח להתאים את הזמן של סגירת הפצע64. (B) פרופיל עוצמת הסידן שהתקבל מבדיקת GCaMP6s-CAAX בתא הפגוע (קו כחול) הושווה לעוצמת Ca2+ בתא שכן שלא נפגע (קו מקווקו אפור), והראה זרימה ברורה של Ca2+ אך ורק עם הפרעה ל-PM. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
המחקר מדגיש את הגישה התרמופלסמונית כטכניקה מבטיחה לחקר תגובות חלבונים בתאים חיים ומודל ממברנות לאחר הפרעה בממברנה. שיטה זו לא רק מספקת מידע נרחב על גיוס חלבונים, אלא גם על התפקוד הביופיזיקלי של חלבונים המעורבים בדינמיקה של חלבון-ממברנה. כתוצאה מכך, הוא מאפשר זיהוי של רכיבים מולקולריים האחראים לתיקון פני השטח ומקדם את ההבנה של המנגנון המורכב אך חיוני של תיקון קרום פלזמה. למרות שקיימות שיטות שונות לגרימת שיבוש בממברנה, כגון טכניקות מכניות, כימיות ואופטיות, שיטות אלה סובלות ממגבלות, כגון היותן לא ספציפיות לתאים, יוצרות פגיעות מרובות בקרום התא, או גורמות נזק משמעותי לממברנה ובוערות חומר תאי פנימי לאורך נתיב הלייזר בעת שימוש בלייזרים פועמים בעוצמה גבוהה. בעוד שהשילוב של מיקרוסקופ קונפוקלי ופינצטה אופטית מציע את המידע המקיף ביותר, ניתן להשתמש גם בשיטות הדמיה חלופיות. לדוגמה, מכיוון שההדמיה של ננו-חלקיק פלסמוני מושגת באמצעות מיקרוסקופ השתקפות, מצב הדמיה מובנה במיקרוסקופ קונפוקלי של לייקה, ניתן להשתמש בטכניקות הדמיה נוספות, כגון מיקרוסקופ שדה כהה65,66, שיטות פיזור אחרות כמו iSCAT67,68, או תיוג פלואורסצנטי של הננו-חלקיק, להדמיית AuNP, אם כי הדבר עשוי להגביל את תחולת השיטה.
השיטה המוצגת מסוגלת גם לגרום לחורים ננוסקופיים בקרומי המודל, ומאפשרת לחקור את השפעות הסינרגיה בין נספחים שונים. זה מושג על ידי עטיפת נספחים רקומביננטיים בעלי תווית שונה, למשל, RFP ו- GFP, בהתאמה, ולאחר מכן ניקוב תרמופלסמוני. מערכת מודל זו מספקת תובנה לגבי האופן שבו נספחים מתקשרים עם ממברנות בקרבת קצוות חופשיים, כפי שמודגם באיור 2D. עם זאת, שלא כמו בתאים, החורים הנגרמים על GUV ממשיכים להתרחב, ואחריו ערעור היציבות של השלפוחית. הדמיה של התפתחות החור באמצעות מיקרוסקופ קונפוקלי יכולה להיות מאתגרת בשל ההתרחבות המהירה של קוטר החור, אך ניתן להשיג אותה על ידי לכידת מספר ערימות z לאורך זמן. שיטה חלופית תהיה להשתמש בדיסק מסתובב קונפוקלי להדמיה מהירה יותר. יתר על כן, הגישה התרמופלסמונית מניבה בדרך כלל מספר מוגבל של תוצאות אופטימליות בשעה כאשר היא מיושמת על תאים בודדים או ניסויי GUV, בדרך כלל שניים עד שלושה, בטמפרטורות מדגם בין 20 ° C ל 30 ° C. כדי לקבל את התצפית המדויקת ביותר על דינמיקה של חלבון-ממברנה, מומלץ לשמור את התאים במאגר המכיל HEPES ולהחליף את הדגימה מדי שעה. לחלופין, ניתן להרחיב את חלון הניסוי על ידי ביצוע הניסויים בתא דגירה של התא, כלומר בטמפרטורה קבועה של 37 מעלות צלזיוס עם 5% CO2. יתר על כן, שילוב גישה זו עם טכניקות הדמיה אחרות, כגון מיקרוסקופ שחזור אופטי סטוכסטי (STORM), יכול לספק הבנה עמוקה יותר של הפונקציה הביופיזית והאינטראקציה של חלבוני מפתח המעורבים בתיקון ממברנות ברמת מולקולה יחידה. זה יכול לספק מידע מפורט על אתר הפציעה, כולל גיאומטריית הפצע והמיקום של חלבוני אנקסין, כמו גם לזהות שחקני מפתח אחרים המעורבים בתיקון פני השטח של הממברנה.
על מנת להשיג יעילות ודיוק מרביים בגרימת פגיעה בממברנה, חובה לוודא את מיקום מוקד הלייזר לפני כל ניסוי ולוודא כי המיקום הצירי של מוקד הלייזר עולה בקנה אחד עם המיקוד הקונפוקלי. יישור זה מייעל את העוצמה במהלך הדמיית AuNP, מה שמוביל לעליית טמפרטורה מקומית מקסימלית וכתוצאה מכך לפגיעה בקרום בעוצמת לייזר נמוכה יותר. תהליך זה מבוצע באופן ידני ולכן רגיש לשונות ביעילות הקרע של הממברנה, שכן המיקוד מתורגם ידנית למיקום החופף למיקום החלקיק. במיקרוסקופים חסרי מצב השתקפות, כמו במערכות מסחריות מסוימות, לוקליזציה משותפת של מיקוד הלייזר והחלקיק יכולה להיות מאתגרת. במקרים כאלה, ניתן להשתמש במצבי הדמיה חלופיים (למשל, שדה בהיר), וניתן לבצע סריקת רסטר איטית סביב מיקום החלקיקים הצפוי. יש לציין כי עוצמת לייזר נמוכה עשויה לגרום לחדירת הממברנה בלבד, בעוד שעוצמת לייזר גבוהה יכולה ליצור טמפרטורות סביב NP העולות על נקודת הרתיחה של המים, גם אם משטח הזכוכית הוא בעל אפקט קירור. ההערכה היא כי היווצרות ננו-בועות סביב NPs מתרחשת בין 200 ° C ל 300 ° C25,48, כאשר החום הנפיץ עלול לגרום לתזוזה של חלקיקים ממוקד הלייזר או לפיצול חלקיקים. בנוסף, היווצרות ננו או מיקרו-בועות במהלך חימום מציבה אתגר לשיטה זו. מכיוון שממשקי אוויר מרטיבים את הממברנות ועלולים לגרום לערעור יציבות החלבון, דבר שאינו רצוי, חובה להגביל את החימום כאשר חוקרים תיקון ממברנה. יש לציין כי ננו-קליפות זהב אינן סובלות מטמפרטורות גבוהות והן יתפרקו בתנאים אלה, כפי שמודגם במיקרוסקופ ברזולוציה גבוהה58.
מאמר זה מספק פרוטוקול מפורט לשימוש בתרמופלזמוניקה לביצוע נקבים מקומיים מאוד בממברנות, אשר ישים הן לתאים והן לקרומי מודל. כדי להפחית עוד יותר את היקף החימום, ניתן להשתמש בננו-חלקיקים קטנים יותר בעלי תהודה לאור NIR, המאפשרים נקבים תוך-תאיים באנדוזומים, ברשתית האנדופלסמית ובמעטפת הגרעין. ננו-חלקיקים כאלה, כולל מוטות וננו-מטריושקות48, יכולים לשמש לחקר תיקון מעטפת גרעינית על ידי התמקדות בננו-חלקיקי זהב אנדוציטוזים הנקלטים בקלות על פני התא ונסחרים לעבר גרעין69. באופן כללי, טכניקה זו מאפשרת זיהוי ובחינה של מרכיבים מולקולריים מרכזיים המעורבים ב-PMR, תוך הבהרת תפקודם ותפקידם הביופיזיקלי תוך שמירה על יכולת הקיום של התאים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ברצוננו להודות ל-Jesper Nylandsted על שסיפק לנו חלבוני אנקסין רקומביננטיים ופלסמידים המקודדים עבור נספחים. עבודה זו נתמכה כספית על ידי המועצה הדנית למחקר עצמאי, מדעי הטבע (DFF-4181-00196), על ידי תוכנית הסינרגיה הבין-תחומית של קרן נובו נורדיסק 2018 (NNF18OC0034936), הוועדה המדעית של האגודה הדנית לסרטן (R90-A5847-14-S2), קרן לונדבק (R218-2016-534), ועל ידי מרכז המצוינות של קרן לונדבק (Biomembranes in Nanomedicine).
Materials
| Name | Company | Catalog Number | Comments |
| 1064 nm trapping laser | Spectra Physics | N/A | Spectra Physics J201-BL-106C, Nd: YVO4 NIR laser |
| 160 nm Gold Nanoshells | NanoComposix | NCXGSIR150 | |
| 200 nm Gold Nanoparticles | BBI Solutions | EM.GC200/7 | |
| 35 mm glass surface MatTex microwell | MATTEK | P35G-1.5-14-C | |
| Amber-glass vials | Supelco Sigma Aldrich | 243438 | |
| Annexin A2 plasmids | N/A | N/A | Received from our collaborator at the Danish Cancer Research Center |
| Annexin A4 recombinant-protein | N/A | N/A | N-terminal GFP tagged ANXA4 received from our collaborator at the Danish Cancer Research Center |
| Annexin A5 recombinant-protein | N/A | N/A | N-terminal GFP tagged ANXA5 received from our collaborator at the Danish Cancer Research Center |
| beta-casein | Sigma Life Science | C6905-1G | |
| CaCl2 | Suprlco (sigma Aldrich) | 10035-04-8 | |
| Centrifuge 5702 | Eppendorf | 5702 | |
| Chloroform | VWR Chemicals | 67-66-3 | |
| Culture dish (Nunclon Delta Surface) | Thermo scientific | 150460 | |
| DID cell-labelling Solution | Invitrogen | 7757 | |
| Distilled water | Gibco | 15230-089 | |
| DOPC | Avanti Polar Lipids | 850375C | Dissolved in chloroform |
| DOPS | Avanti Polar Lipids | 840035C | Dissolved in chloroform |
| Dulbecco's Modified Eage's Medium | Thermo Fisher Scientific | 11995065 | |
| FIJI ImageJ distribution | ImageJ2 | N/A | |
| GCaMP6s-CAAX | N/A | Received from our collaborator at the Danish Cancer Research Center | |
| Gibco Fetal Bovine Serum | Fisher Scientific | 11573397 | 10% of the culture medium |
| Glucose | PROLABO | 24 374.297 | |
| Hamilton syringes | Hamilton Company | N/A | 50 and 500 microliters |
| Harrick Plasma Cleaner PDG-002 | Harrick Plasma | N/A | |
| HEK293T cells | N/A | Received from our collaborator at the Danish Cancer Research Center | |
| Leica Acousto-Optical Beam Splitter (AOBS) | Leica | N/A | |
| Leica PL APO 63x water immersion objective, NA = 1.2 | Leica | N/A | |
| Leica SP5 confocal scanning microscope | Leica | N/A | |
| Lipofectamine | Fisher Scientific | 15338030 | |
| MatLab | The Mathworks, Inc., Natick, Massachusetts, United States | N/A | |
| NaCl | VWR Chemicals | 7647-14-5 | |
| Opti-MEM Reduced-Serum Medium | Thermo Fisher Scientific | 11058021 | |
| Parafilm | Bemis | PM-992 | |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 1% of the culture medium |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | 10010023 | |
| Piezoelectric stage (PI 731.20) | Physik Instrumente (Germany) | N/A | |
| Poly-L-Lysine | Sigma-Aldrich | P8920-100ML | 0.01-0.1% for coating |
| Polyvinyl alcohol | Sigma-Aldrich | 363065-25G | |
| round glass slide 25 mm Ø | VWR | 631-1584 | |
| Sonicator Brandson 2800 | Brandson | N/A | |
| sucrose | Sigma Life Science | 57-50-1 | |
| T25 tissue culture flask | Falcon | 353108 | Blue Vented cap |
| Tris-HCl | Invitrogen | 15567-027 | |
| TrypLE | Thermo Fisher Scientific | A1285901 | |
| Trypsin-EDTA | Fisher Scientific | 11590626 | |
| VWR Mixer mini vortex 230V EU | VWR | 12620-84 | ECN: 444-2790, SN: 150713022 |
References
- Bendix, P. M., et al. Interdisciplinary synergy to reveal mechanisms of annexin-mediated plasma membrane shaping and repair. Cells. 9 (4), 1029 (2020).
- Gajic, O., Lee, J., Doerr, C. H., Berrios, J. C., Myers, J. L., Hubmayr, R. D. Ventilator-induced Cell Wounding and Repair in the Intact Lung. American Journal of Respiratory and Critical Care Medicine. 167, 1057-1063 (2003).
- McNeil, P. L., Khakee, R. Disruptions of muscle fiber plasma membranes. Role in exercise-induced damage. The American Journal of Pathology. 140 (5), 1097-1109 (1992).
- Yu, Q. C., McNeil, P. L. Transient disruptions of aortic endothelial cell plasma membranes. The American Journal of Pathology. 141 (6), 1349-1360 (1992).
- Boye, T. L., et al. Annexin A4 and A6 induce membrane curvature and constriction during cell membrane repair. Nature Communications. 8, 1623 (2017).
- Bischofberger, M., Gonzalez, M. R., van der Goot, F. G. Membrane injury by pore-forming proteins. Current Opinion in Cell Biology. 21, 589-595 (2009).
- Tang, S. K. Y., Marshall, W. F. Self-repairing cells. Science (New York, N.Y.). 356, 1022-1025 (2017).
- Abreu-Blanco, M. T., Verboon, J. M., Parkhurst, S. M. Single cell wound repair: Dealing with life's little traumas. Bioarchitecture. 1, 114-121 (2011).
- Sønder, S. L., et al. Annexin A7 is required for ESCRT III-mediated plasma membrane repair. Scientific Reports. 9, 6726 (2019).
- Andrews, N. W., Almeida, P. E., Corrotte, M. Damage control: cellular mechanisms of plasma membrane repair. Trends in Cell Biology. 24 (12), 734-742 (2014).
- Idone, V., Tam, C., Goss, J. W., Toomre, D., Pypaert, M., Andrews, N. W. Repair of injured plasma membrane by rapid Ca2+-dependent endocytosis. The Journal of Cell Biology. 180 (5), 905-914 (2008).
- Lauritzen, S. P., Boye, T. L., Nylandsted, J. Annexins are instrumental for efficient plasma membrane repair in cancer cells. Seminars in Cell & Developmental Biology. 45, 32-38 (2015).
- Häger, S. C., Nylandsted, J. Annexins: players of single cell wound healing and regeneration. Communicative & Integrative Biology. 12 (1), 162-165 (2019).
- Jaiswal, J. K., et al. S100A11 is required for efficient plasma membrane repair and survival of invasive cancer cells. Nature Communications. 5, 3795 (2014).
- Draeger, A., Monastyrskaya, K., Babiychuk, E. B. Plasma membrane repair and cellular damage control: The annexin survival kit. Biochemical Pharmacology. 81 (6), 703-712 (2011).
- Moreno-Pescador, G. S., et al. Thermoplasmonic nano-rupture of cells reveals annexin V function in plasma membrane repair. Nanoscale. 14 (21), 7778-7787 (2022).
- Zhivotovsky, B., Orrenius, S. Calcium and cell death mechanisms: A perspective from the cell death community. Cell Calcium. 50 (3), 211-221 (2011).
- Gerke, V., Moss, S. E. Annexins: From structure to function. Physiological Reviews. 82 (2), 331-371 (2002).
- Idone, V., Tam, C., Andrews, N. W. Two-way traffic on the road to plasma membrane repair. Trends in Cell Biology. 18 (11), 552-559 (2008).
- Boye, T. L., et al. Annexins induce curvature on free-edge membranes displaying distinct morphologies. Scientific Reports. 8, 10309 (2018).
- Bouter, A., et al. Annexin-A5 assembled into two-dimensional arrays promotes cell membrane repair. Nature Communications. 2, 270 (2011).
- Boye, T. L., Nylandsted, J. Annexins in plasma membrane repair. Biological Chemistry. 397 (10), 961-969 (2016).
- Weinberger, A., et al. Gel-assisted formation of giant unilamellar vesicles. Biophysical Journal. 105 (1), 154-164 (2013).
- Numata, T., Tatsuta, H., Morita, Y., Otani, Y., Umeda, N. Localized thermal processing with a laser-trapped and heated metal nanoparticle. IEEJ Transactions on Electrical and Electronic Engineering. 2, 398-401 (2007).
- Bendix, P. M., Reihani, S. N. S., Oddershede, L. B. Direct measurements of heating by electromagnetically trapped gold nanoparticles on supported lipid bilayers. ACS Nano. 4 (4), 2256-2262 (2010).
- Kyrsting, A., Bendix, P. M., Stamou, D. G., Oddershede, L. B. Heat profiling of three-dimensionally optically trapped gold nanoparticles using vesicle cargo release. Nano Letters. 11 (2), 888-892 (2011).
- Andersen, T., Kyrsting, A., Bendix, P. M. Local and transient permeation events are associated with local melting of giant liposomes. Soft Matter. 10 (24), 4268-4274 (2014).
- Bahadori, A., Oddershede, L. B., Bendix, P. M. Hot-nanoparticle-mediated fusion of selected cells. Nano Research. 10, 2034-2045 (2017).
- Rørvig-Lund, A., Bahadori, A., Semsey, S., Bendix, P. M., Oddershede, L. B. Vesicle fusion triggered by optically heated gold nanoparticles. Nano Letters. 15 (6), 4183-4188 (2015).
- Moreno-Pescador, G., Arastoo, M. R., Ruhoff, V. T., Chiantia, S., Daniels, R., Bendix, P. M. Thermoplasmonic vesicle fusion reveals membrane phase segregation of influenza spike proteins. Nano Letters. 23 (8), 3377-3384 (2023).
- Bahadori, A., Lund, A. R., Semsey, S., Oddershede, L. B., Bendix, P. M. Controlled cellular fusion using optically trapped plasmonic nano-heaters. SPIE Proceedings. SPIE 9922, Optical Trapping and Optical Micromanipulation XIII. 992211, (2016).
- Bahadori, A., Moreno-Pescador, G., Oddershede, L. B., Bendix, P. M. Remotely controlled fusion of selected vesicles and living cells: a key issue review. Reports on Progress in Physics. 81 (3), 32602 (2018).
- Moreno-Pescador, G., Arastoo, M. R., Chiantia, S., Daniels, R., Bendix, P. M. Thermoplasmonic induced vesicle fusion for investigating membrane protein phase affinity. bioRxiv. , (2022).
- Pescador, G. S. M., et al. Investigating plasma-membrane repair employing thermoplasmonics. Biophysical Journal. 120 (3), 45A (2021).
- Moreno-Pescador, G. S., Qoqaj, I., Thusgaard Ruhoff, V., Iversen, J., Nylandsted, J., Bendix, P. M. Effect of local thermoplasmonic heating on biological membranes. SPIE 11083, Optical Trapping and Optical Micromanipulation XVI. 110830M, (2019).
- Bement, W. M., Mandato, C. A., Kirsch, M. N. Wound-induced assembly and closure of an actomyosin purse string in Xenopus oocytes. Current Biology. 9 (11), 579-587 (1999).
- Weisleder, N., et al. Recombinant MG53 protein modulates therapeutic cell membrane repair in treatment of muscular dystrophy. Science Translational Medicine. 4 (139), 139ra85 (2012).
- Sudji, I. R., Subburaj, Y., Frenkel, N., García-Sáez, A. J., Wink, M. Membrane disintegration caused by the steroid saponin digitonin is related to the presence of cholesterol. Molecules. 20 (11), 20146-20160 (2015).
- Babiychuk, E. B., Monastyrskaya, K., Potez, S., Draeger, A. Intracellular Ca2+ operates a switch between repair and lysis of streptolysin O-perforated cells. Cell Death & Differentiation. 16, 1126-1134 (2009).
- Nygård Skalman, L., Holst, M. R., Larsson, E., Lundmark, R. Plasma membrane damage caused by listeriolysin O is not repaired through endocytosis of the membrane pore. Biology Open. 7 (10), bio035287 (2018).
- Swaggart, K. A., et al. Annexin A6 modifies muscular dystrophy by mediating sarcolemmal repair. Proceedings of the National Academy of Sciences of the United States of America. 111, 6004-6009 (2014).
- Yeheskely-Hayon, D., Minai, L., Golan, L., Dann, E. J., Yelin, D. Optically induced cell fusion using bispecific nanoparticles. Small. 9 (22), 3771-3777 (2013).
- Minai, L., Yeheskely-Hayon, D., Golan, L., Bisker, G., Dann, E. J., Yelin, D. Optical nanomanipulations of malignant cells: Controlled cell damage and fusion. Small. 8 (11), 1732-1739 (2012).
- Lukianova-Hleb, E., et al. Plasmonic nanobubbles as transient vapor nanobubbles generated around plasmonic nanoparticles. ACS Nano. 4 (4), 2109-2123 (2010).
- Vogel, A., Noack, J., Hüttman, G., Paltauf, G. Mechanisms of femtosecond laser nanosurgery of cells and tissues. Applied Physics B. 81, 1015-1047 (2005).
- Baffou, G., Polleux, J., Rigneault, H., Monneret, S. Super-heating and micro-bubble generation around plasmonic nanoparticles under cw illumination. Journal of Physical Chemistry C. 118 (9), 4890-4898 (2014).
- Sasikumar, K., Liang, Z., Cahill, D. G., Keblinski, P. Curvature induced phase stability of an intensely heated liquid. Journal of Chemical Physics. 140 (23), 234506 (2014).
- Jauffred, L., Samadi, A., Klingberg, H., Bendix, P. M., Oddershede, L. B. Plasmonic heating of nanostructures. Chemical Reviews. 119 (13), 8087-8130 (2019).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nature Methods. 5 (6), 491-505 (2008).
- Bendix, P. M., Jauffred, L., Norregaard, K., Oddershede, L. B. Optical trapping of nanoparticles and quantum dots. IEEE Journal of Selected Topics in Quantum Electronics. 20, 15-26 (2014).
- Samadi, A., Bendix, P. M., Oddershede, L. B. Optical manipulation of individual strongly absorbing platinum nanoparticles. Nanoscale. 46, 18449-18455 (2017).
- Jørgensen, J. T., Norregaard, K., Tian, P., Bendix, P. M., Kjaer, A., Oddershede, L. B. Single particle and PET-based platform for identifying optimal plasmonic nano-heaters for photothermal cancer therapy. Scientific Reports. 6, 30076 (2016).
- Goldenberg, H., Tranter, C. J. Heat flow in an infinite medium heated by a sphere. British Journal of Applied Physics. 3 (9), 296-298 (1952).
- Eustis, S., El-Sayed, M. A. Why gold nanoparticles are more precious than pretty gold: Noble metal surface plasmon resonance and its enhancement of the radiative and nonradiative properties of nanocrystals of different shapes. Chemical Society Reviews. 35, 209-217 (2006).
- Landau, L. D., Lifshitz, E. M. . Fluid Mechanics: Landau and Lifshitz: Course of Theoretical Physics. 6, (2013).
- Niederauer, C., Seynen, M., Zomerdijk, J., Kamp, M., Ganzinger, K. A. The K2: Open-source simultaneous triple-color TIRF microscope for live-cell and single-molecule imaging. HardwareX. 13, e00404 (2023).
- Richardson, A. C., Reihani, N., Oddershede, L. B. Combining confocal microscopy with precise force-scope optical tweezers. SPIE Proceedings:SPIE 6326, Optical Trapping and Optical Micromanipulation III. 632628, (2006).
- Samadi, A., Klingberg, H., Jauffred, L., Kjær, A., Bendix, P. M., Oddershede, L. B. Platinum nanoparticles: a non-toxic, effective and thermally stable alternative plasmonic material for cancer therapy and bioengineering. Nanoscale. 10 (19), 9097-9107 (2018).
- . Available from: https://www.thermofisher.com/order/catalog/product/A7816 (2023)
- Kreibig, U., Vollmer, M. Theoretical considerations. In: Optical Properties of Metal Clusters. 25, (1995).
- Mie, G. Beiträge zur Optik trüber Medien, speziell kolloidaler Metallösungen. Annalen der Physik. 330 (3), 377-445 (1908).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Klenow, M. B., Heitmann, A. S. B., Nylandsted, J., Simonsen, A. C. Timescale of hole closure during plasma membrane repair estimated by calcium imaging and numerical modeling. Scientific Reports. 11, 4226 (2021).
- Li, T., Wu, X., Liu, F., Li, N. Analytical methods based on the light-scattering of plasmonic nanoparticles at the single particle level with dark-field microscopy imaging. Analyst. 142 (2), 248-256 (2017).
- Gibbs-Flournoy, E. A., Bromberg, P. A., Hofer, T. P. J., Samet, J. M., Zucker, R. M. Darkfield-Confocal Microscopy detection of nanoscale particle internalization by human lung cells. Particle and Fibre Toxicology. 8 (1), 2 (2011).
- Taylor, R. W., Sandoghdar, V. Interferometric scattering microscopy: Seeing single nanoparticles and molecules via Rayleigh scattering. Nano Letters. 19 (8), 4827-4835 (2019).
- Wu, Y., Ali, M. R. K., Chen, K., Fang, N., El-Sayed, M. A. Gold nanoparticles in biological optical imaging. Nano Today. 24, 120-140 (2019).
- Klingberg, H., Oddershede, L. B., Loeschner, K., Larsen, E. H., Loft, S., Møller, P. Uptake of gold nanoparticles in primary human endothelial cells. Toxicology Research. 4 (3), 566-666 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved