התגבשות ABCG5/G8 בסביבת ביצלה ליפידית לקריסטלוגרפיה של קרני רנטגן
In This Article
Summary
פרוטוקול זה מתאר מערך להתגבשות של טרנספורטר הסטרול ABCG5/G8. ABCG5/G8 משוחזר לאופניים לצורך התגבשות טיפה תלויה. הפרוטוקול אינו דורש חומרים או מצעים מיוחדים, מה שהופך אותו לנגיש וקל להתאמה בכל מעבדה לקביעת מבנה החלבון באמצעות קריסטלוגרפיה בקרני רנטגן.
Abstract
מובילי קסטות קושרות ATP (ABC) מהווים חלבוני קרום משובצי שומנים. מיצוי חלבוני הממברנה הללו מדו-שכבת השומנים לסביבה מימית מושג בדרך כלל על ידי שימוש בדטרגנטים. דטרגנטים אלה מפרקים את דו-שכבת השומנים ומסיסים את החלבונים. בית הגידול הפנימי של חלבוני הממברנה בתוך דו-שכבת השומנים מציב אתגר בשמירה על יציבותם ואחידותם בתמיסה לאפיון מבני. Bicelles, המהווים תערובת של פוספוליפידים ודטרגנטים בעלי שרשרת ארוכה וקצרה, משכפלים את מבנה השומנים הטבעי. השימוש בליפידים, דו-גלגליים ודטרגנטים משמש כמערכת מודל מתאימה לקבלת גבישי עקיפה באיכות גבוהה, במיוחד כדי לקבוע את המבנה ברזולוציה גבוהה של חלבוני ממברנה. באמצעות מיקרו-סביבות סינתטיות אלה, חלבוני הממברנה משמרים את הקונפורמציה והפונקציונליות הטבעית שלהם, ומאפשרים היווצרות של גבישים תלת-ממדיים. בגישה זו, ABCG5/G8 ההטרודימרי המסיס בדטרגנטים שולב מחדש ב-DMPC/CHAPSO bicelles, בתוספת כולסטרול. מערך זה שימש בהליך הניסויי של דיפוזיית אדים להתגבשות חלבונים.
Introduction
מובילי קלטות קושרות ATP (ABC) מהווים משפחת חלבוני ממברנה האחראית על תהליכי הובלה מגוונים תלויי ATP על פני ממברנות ביולוגיות 1,2,3,4,5. חלבונים טרנספורטרים אלה מעורבים במחלות לב וכלי דם וממלאים תפקיד משמעותי בהקלה על זרימת כולסטרול למרה לצורך הפרשה נוספת בכבד. כתוצאה מכך, חילוף החומרים והאיזון של הכולסטרול זכו להתעניינות רבה לאורך השנים6. מנגנון ספציפי המעורב בסילוק כולסטרול וסטרולים אחרים מהגוף כולל חברים בתת-משפחת ABCG האנושית, במיוחד ABCG5/G8 ההטרודימרי 7,8,9,10. מוטציות בכל אחד מהגנים הללו משבשות את ההטרודימר, מובילות לאובדן תפקוד וגורמות לסיטוסטרולמיה, הפרעה המשפיעה על סחר בסטרולים11,12,13. בהתחשב ברלוונטיות של המחלה ובתפקידם בקידום אפלוקס כולסטרול, מובילי סטרולים משכו תשומת לב משמעותית. אף על פי כן, הפרטים המורכבים של המנגנון המולקולרי שלהם וסלקטיביות המצע שלהם נותרו במידה רבה בלתי נחשפים. לפיכך, הבהרת המבנה הגבישי של ABCG5/G8 היא צעד מכריע לקראת הבנת המנגנונים והתפקודים במורד הזרם בהובלת כולסטרול.
חלבוני ממברנה דורשים עיגון בתוך הממברנות כדי להתקפל ולתפקד כראוי. כתוצאה מכך, מיצוי חלבוני ממברנה מסביבתם הטבעית גורם לעתים קרובות לחוסר יציבות של חלבונים, קיפול שגוי ואובדן תפקוד14,15. אתגרים אלה מדגישים את המשוכות העיקריות העומדות בפני התגבשות חלבון הממברנה. עם זאת, הרכבה מחדש של חלבונים לדו-שכבות של חומרי ניקוי סינתטיים, כמו bicelles, התגלתה כפתרון למצוקה זו, ואפשרה שמירה על חלבוני ממברנה בתוך סביבה דו-שכבתית ילידית16. ביצלות הן מכלולים של פוספוליפידים ודטרגנטים סינתטיים המרחפים ומסיסים במים. יש לציין שהם מאמצים מבנה דו-שכבתי המחקה קרומים ביולוגיים16,17,18. ביצלות יכולות לעבור בין פאזות נוזל וג'ל בהתבסס על טמפרטורה וצמיגות. התגבשות ביצלה מנצלת את הדיסקיות הדו-שכבתיות הקטנות ואת הצמיגות הנמוכה בטמפרטורות מופחתות, מה שמקל על ערבוב יסודי של חלבונים ותמיסות ביצלה. גודל הביצלות תלוי ביחס דטרגנט-ליפידים במהלך ההכנה19,20. הדטרגנטים הנפוצים להיווצרות ביצלה כוללים 3-[(3-cholamidopropyl)dimethylammonio]-2-hydroxy-1-propanesulfonate (CHAPSO), יחד עם 3-[(3-cholamidopropyl)dimethylammonio]-1-propanesulfonate (CHAPS) ו-1,2-ditridecanoyl-sn-glycerol-3-phosphocholine (DHPC)21. דטרגנטים אלה משמשים בשילוב עם שומנים כגון di-myristoyl-phosphatidylcholine (DMPC) ו 1-palmitoyl-2-oleoyl-phosphatidylcholine (POPC). יתר על כן, מחקרים אחרונים הדגימו את הפונקציונליות המלאה של חלבוני הממברנה בתוך bicelles בתנאים פיזיולוגיים. לדוגמה, לי ועמיתיו התגבשו בהצלחה ודיווחו על המבנה הגבישי של ABCG5/ABCG8 בהתבסס על דו-שכבה דו-שכבתית ליפידית22,23. בתהליך ההתגבשות, ניתן לאכלס תערובות חלבון-ביצלה באמצעות ציוד סטנדרטי, כולל רובוטי התגבשות בעלי תפוקה גבוהה24. עם זאת, ההיתכנות של ניצול הביצלות תלויה ביציבות התרמו-יציבה של החלבונים בשל תנאי ההתגבשות בטמפרטורות גבוהות יותר. עם זאת, בהשוואה לטכניקות אחרות, תנאי ההתגבשות הנדרשים לחלבוני ממברנה נותרים בדרך כלל מתונים, וכוללים ריכוזים נמוכים של משקע, מלח וחיץ. זה הופך הן תערובות חלבון-ביצלה והן דיפוזיה של אדים לכלים יעילים וקלים ליישום למחקרים מבניים של חלבוני ממברנה.
פרוטוקול זה מתאר שלבים חיוניים בהכנת חלבונים ובהתגבשות ביצלה לקביעת המבנה הגבישי של קרני רנטגן של ABCG5/G8 ברזולוציה גבוהה (איור 1).
Protocol
1. שיבוט וביטוי חלבונים
- שבט את הגן האנושי ABCG5/G8 לשמרי Pichia pastoris בהתאם לפרוטוקולים קודמים25,26. בקצרה, לגזור pSGP18 ו pLIC ביטוי וקטורים מ pPICZB. הוסף תג המקודד אתר פרוטאז 3C של rhinovirus ואחריו פפטיד קושר קלמודולין (CBP) למסוף C של ABCG8 cDNA (pSGP18-G8-3C-CBP).
- הוסף תג שישה היסטידין המופרד על ידי גליצין (6GlyHis6) למסוף C של ABCG5 cDNA (pLIC-G5-H12). הפוך את הפלסמידים לזן פיצ'יה KM71H באמצעות אלקטרופורציה.
הערה: עיין בטבלת החומרים לקבלת פרטים על הפלסמידים, המדיה והמאגרים שבהם נעשה שימוש. - לגדל תאי שמרים מותמרים על צלחות אגר MD ב 28 ° C.
- הוסף תג שישה היסטידין המופרד על ידי גליצין (6GlyHis6) למסוף C של ABCG5 cDNA (pLIC-G5-H12). הפוך את הפלסמידים לזן פיצ'יה KM71H באמצעות אלקטרופורציה.
- לאחר 1-2 ימים, בחר 10-12 מושבות וחסן אותן לתוך 10 מ"ל של מדיה מינימלית בסיס חנקן שמרים גליצרול (MGY) באמצעות צינורות צנטריפוגות 50 מ"ל לתרבית בקנה מידה קטן.
- צרו שלושה חורים קטנים במכסה צינור הצנטריפוגה לאוורור טוב יותר. אפשר לתאים לגדול ב-28°C עם טלטול מתמיד ב-250 סל"ד עד שהצפיפות האופטית ב-600 ננומטר (OD600) מגיעה ל-10, בדרך כלל לוקח 1-2 לילות.
הערה: צמיחת תאים נמשכת בדרך כלל בין 12-24 שעות.
- צרו שלושה חורים קטנים במכסה צינור הצנטריפוגה לאוורור טוב יותר. אפשר לתאים לגדול ב-28°C עם טלטול מתמיד ב-250 סל"ד עד שהצפיפות האופטית ב-600 ננומטר (OD600) מגיעה ל-10, בדרך כלל לוקח 1-2 לילות.
- למחרת, קח 1 ליטר של מדיה סטרילית MGY וחסן אותו עם התרבית הראשונית בבקבוק 2.4 ליטר. לדגור את הבקבוק ב 28 ° C ב אינקובטור שייקר ב 250 סל"ד במשך 24 שעות.
- כדי לשמור על pH בין 5-6, להוסיף 10% אמוניום הידרוקסיד (NH4OH) עד שה- pH מתייצב.
- התאימו את רמת החומציות וגרמו לביטוי חלבונים על ידי הוספת 1 מ"ל מתנול טהור לכל תרבית של 1 ליטר (0.1% מתנול).
הערה: לאחר מכן יש להזין תאים בתרבית מתנול טהור של 5 מ"ל לליטר (0.5% מתנול (v/v) כל 12 שעות למשך זמן כולל של 36-48 שעות. - קצור תאים על ידי צנטריפוגה ב 15,000 x גרם במשך 30 דקות ב 4 ° C.
- יש לאסוף כדורי תאים ולהשהות אותם מחדש במאגר ליזיס (0.33 מ' סוכרוז, 0.3 מ' טריס-קל pH 7.5, 0.1 מ' חומצה אמינוהקסנואית, 1 מ"מ EDTA ו-1 מ"מ EGTA) לריכוז של 0.5 גרם/מ"ל. אחסנו את המתלים בטמפרטורה של -80°C. בדרך כלל, ניתן לשחזר 30 ± 5 גרם של מסת התא מ 1 L של תאים בתרבית.
הערה: יש לאחסן כדורי תאים ישירות במקפיא או לבצע השעיה מיידית במאגר ליזיס לתכשירי ממברנה.
2. הכנת קרום מיקרוזומלי
- הפשירו את התאים והוסיפו מעכבי פרוטאז (2 מיקרוגרם/מ"ל לאופפטין, 2 מיקרוגרם/מ"ל פפסטטין A, 2 מ"מ PMSF, ראו טבלת חומרים).
- כדי לקדם את תאי הליזה, השתמש במתחלב או מיקרופלואיזר מקורר קרח (ראה טבלת חומרים) בטמפרטורה של 25,000-30,000 psi. חזור על תהליך זה 3-4 פעמים.
- צנטריפוגה לסילוק פסולת תאים: סחרור במהירות 3,500-4,000 x גרם במשך 15 דקות, ולאחר מכן סיבוב שני במהירות 15,000 x גרם למשך 30 דקות. שמור על שני הסיבובים ב 4 ° C.
- כדי לבודד שלפוחיות קרום מיקרוזומליות, העבר את הסופרנאטנט לצינורות אולטרה-צנטריפוגות וחשף אותו לאולטרה-צנטריפוגה ב -2,00,000 x גרם למשך 1.5 שעות ב -4 מעלות צלזיוס.
- יש להשהות מחדש את כדורית הממברנה ב-50 מ"ל של Buffer A (50 mM Tris-Cl pH 8.0, 100 mM NaCl ו-10% גליצרול) באמצעות הומוגנייזר מקפץ. אחסנו את המתלים בטמפרטורה של -80°C.
3. חלבון הכנה-טיהור של heterodimers
- הפשירו את הקרומים המיקרוזומליים הקפואים, והתאימו את הריכוז ל-4-6 מ"ג/מ"ל באמצעות מאגר מסיסות. המאגר צריך להכיל 50 mM Tris-HCl, pH 8.0, 100 mM NaCl, 10% גליצרול, 1% (w/v) β-דודציל מלטוזיד (β-DDM), 0.5% (w/v) cholate, 0.1% (w/v) cholesteryl hemisuccinate (CHS), 5 mM imidazole, 5 mM β-mercaptoethanol (β-ME), 2 μg/mL leupeptin, 2 μg/mL pepstatin A ו-2 mM PMSF (ראה טבלת חומרים).
הערה: ניתן לערבב נפחים שווים של הכנת הממברנה ומאגר המסיסות, או להשתמש במאגר מסיסות פי 2 ללא מעכבי פרוטאז וחומרים מחזרים. רתיחה קצרה של החיץ מסייעת להמיס CHS ביעילות. לטיהור, יש להשתמש רק במאגר המקורר בטמפרטורה של 4°C.- ערבבו את התערובת במהירות בינונית במשך שעה אחת ב-4°C. לאחר מכן יש להוסיף ערבוב נוסף בטמפרטורת החדר (RT) למשך 20-30 דקות.
- צנטריפוגה את התערובת ב 1,00,000 x גרם במשך 30 דקות ב 4 ° C כדי להסיר ממברנות בלתי מסיסות. אספו את הסופרנאטנט המסיס והוסיפו 20 mM imidazole ו-0.1 mM TCEP.
- ביצוע כרומטוגרפיה של עמודת זיקה26: קשרו את הסופרנאטנט המסיס לחרוזי Ni-NTA משווי משקל מראש (10-15 מ"ל) (ראה טבלת חומרים) בחיץ A (שלב 2.2.1) למשך הלילה.
הערה: הימנע משימוש בגליצרול במאגרי ריצה מנקודה זו ואילך.- שטפו את העמודה פעמיים עם 10 נפחי עמודות של Buffer B (50 mM HEPES, pH 7.5, 100 mM NaCl, 0.1% (w/v) β-DDM, 0.05% (w/v) cholate, 0.01% (w/v) CHS, 0.1 mM TCEP) המכילים 25 mM imidazole.
- שטף את העמודה עם 10 כרכי עמודות של Buffer B המכילים 50 mM imidazole.
- יש להקפיד על החלבון באמצעות Buffer C (Buffer B עם 200 mM imidazole).
- הוסף 1 mM TCEP (ראה טבלה של חומרים) ו 10 mM MgCl2 לחלבונים מדוללים.
- אמת את השברים המדוללים בג'ל SDS-PAGE כדי לאשר את גודל החלבון הנכון26.
הערה: תפוקת חלבון אופיינית (1st Ni-NTA): 10-20 מ"ג חלבון לכל תרבית של 6 ליטר. יש להשתמש ב-DDM בריכוז המיצלה הקריטי (CMC) פי 10 או 5x, כ-0.01%. פרוטוקול זה משתמש ב-0.1% DDM. - לדלל את שברי השיא מאלוציית Ni-NTA עם נפח שווה של Buffer D1 (Buffer B עם 1 mM CaCl 2, 1 mM MgCl2), לערבב ולהעמיס את שברי החלבונים על עמודת CBP (3-5 מ"ל) (ראה טבלת חומרים) ששוותה מראש עם CBP wash Buffer D1.
- בצע שטיפות רציפות על עמודת CBP כדי להחליף חומרי ניקוי באמצעות Buffer D1 ו-D2 (Buffer B עם 1 mM CaCl 2, 1 mM MgCl2, 0.1% (w/v) דציל-מלטוז נאופנטיל גליקול (DMNG), ללא β-DDM): ראשית, שטוף עם 3 נפחי עמודות של D1; שנית, יש לכבס עם 3 כרכי עמודות של D1:D2 (3:1, v/v); שלישית, לכבס עם 3 כרכי עמודות של D1:D2 (1:1, v/v); שלב רביעי, שטף עם 3 כרכי עמודות של D1:D2 (1:3, v/v), ואחריו אמצעי אחסון של 6-10 עמודות של D2.
- יש להקפיד על החלבון באמצעות CBP לשטוף Buffer D2 עם 300 mM NaCl בשברים של 1 מ"ל מעמודת CBP (סה"כ 10 מ"ל). רכז את השברים המדוללים ל 1-2 מ"ל.
הערה: תפוקת החלבון האופיינית (1st CBP) היא 5-15 מ"ג חלבון לכל תרבית של 6 ליטר. דטרגנטים מלטוז נאופנטיל גליקול (MNG) משפרים את אחסון החלבון המטוהר ב-4°C. נעשה שימוש הן ב-DMNG והן ב-Lauryl MNG (LMNG), כאשר DMNG הניב גבישי עקיפה טובים יותר של קרני רנטגן. השתמש DMNG ב 10-20x של ריכוז מיצלה קריטי שלה (CMC), כ 0.003%. פרוטוקול זה השתמש ב- 0.1% DMNG. חלק קטן מפליטת CBP יכול להיות מטוהר עוד יותר על ידי כרומטוגרפיית סינון ג'ל (שלב 4.4.) כדי לנתח את פעילות ATPase של חלבונים או להעריך פיזור מונו באמצעות מיקרוסקופ אלקטרונים שידור (TEM).
4. הכנת חלבונים-טיפול טרום התגבשות
- נתקעו את תגי הגליקנים וה-CBP המקושרים ל-N באמצעות אנדוגליקוזידאז H (אנדו H, ~0.2 מ"ג ל-10-15 מ"ג חלבון מטוהר) ופרוטאז HRV-3C (~2 מ"ג ל-10-15 מ"ג חלבון מטוהר), בהתאמה (ראו טבלת חומרים). לדגור לילה ב 4 °C (75 °F).
- במהלך הדגירה של אנדו H ופרוטאז 3C, בצעו אלקילציה רדוקטיבית על החלבונים המאוגרים. יש להתחיל בדגירה עם יודואצטמיד במינון 20 mM (ראו טבלת חומרים) למשך הלילה בטמפרטורה של 4°C. לאחר מכן יש לדגור שעה אחת עם יודואצטמיד נוסף של 2 mM על קרח.
הערה: שלב זה מייצב עוד יותר את אחסון החלבון למשך עד חודש ב-4°C. - השתמש בעמודת CBP שנייה (1-2 מ"ל) כדי להפריד את תג ה- CBP השסוע. השתמש במאגר D2 עבור תהליך זה.
הערה: תפוקת החלבון האופיינית (2nd CBP) היא 5-10 מ"ג חלבון לכל תרבית של 6 ליטר. - לטהר את החלבון ללא תגי CBP באמצעות כרומטוגרפיית סינון ג'ל. המאגר צריך להכיל 10 mM HEPES, pH 7.5, 100 mM NaCl, 0.1% (w/v) DMNG, 0.05% (w/v) cholate ו-0.01% (w/v) CHS.
הערה: תפוקת החלבון האופיינית (סינון ג'ל) היא 2-8 מ"ג חלבון לכל תרבית של 6 ליטר. במהלך שלב זה, היעדר שיא DDM (~ 65 kD) במהלך סינון ג'ל מצביע על החלפת חומרי ניקוי מוצלחת ל- DMNG. - שנה את מקטעי החלבון המצטברים באמצעות מתילציה רדוקטיבית: הוסף 20 mM dimethylamine borane (DMAB, ראה טבלה של חומרים) ו 40 mM פורמלדהיד לחלבון. יש לדגור במשך שעתיים ב-4°C על שייקר מתנודד. הוסף 10 mM DMAB.
- חזור על שלב 4.5, כולל תוספת של 10 mM DMAB, ודגור לילה (12-18 שעות) ב 4 ° C.
- עצור את התגובה על ידי הוספת 100 mM Tris-Cl, pH 7.5.
- טען את החלבון שעבר מתילציה על עמודת Ni-NTA של 2 מ"ל שוות ערך מראש עם 100 mM Tris-Cl, pH 8.0 ו-100 mM NaCl.
- שטוף את העמודה באמצעות 10 נפחי עמודות של מאגר כביסה (10 mM HEPES, pH 7.5, 100 mM NaCl, עם 0.5 מ"ג/מ"ל DOPC: סמים (3:1, w/w), 0.1% (w/v) DMNG, 0.05% (w/v) cholate, 0.01% (w/v) CHS).
- יש להקפיד על החלבון השומני באמצעות חיץ אלוציה (10 mM HEPES, pH 7.5, 100 mM NaCl, 200 mM imidazole, 0.5 מ"ג/מ"ל DOPC: סמים (1:1, w/w), 0.1% (w/v) DMNG, 0.05% (w/v) cholate, 0.01% (w/v) CHS).
הערה: תפוקת החלבון האופיינית (2nd Ni-NTA) היא 1-5 מ"ג חלבון לכל תרבית של 6 ליטר. - מעבירים את החלבון דרך עמודת התפלה PD-10 המאוזנת מראש עם החיץ המשמש בשלב 4.4.
- לדגור על חלבון מותפל ושומנים למשך הלילה עם כולסטרול (מוכן איזופרופנול או אתנול) לריכוז סופי של ~ 20 מיקרומטר.
- למחרת בבוקר, להסיר את המשקע על ידי ultracentrifugation ב 1,50,000 x גרם במשך 10 דקות ב 4 °C (75 °F). לאסוף את supernatant.
- רכז את החלבון לריכוז סופי של 30-50 מ"ג/מ"ל באמצעות רכז צנטריפוגלי בחיתוך של 100 kDa .
- הסר את המשקע באמצעות צנטריפוגה מקוררת במהירות הגבוהה ביותר למשך 30 דקות ב- 4 ° C.
- שמור את supernatant על קרח ב 4 ° C וליצור תנאי התגבשות bicelles.
הערה: יש להשתמש בחלבונים המרוכזים לגדילת גבישים תוך שבוע. אין להקפיא את החלבונים.
5. התגבשות חלבונים בביצלות
- הכינו תמיסת ציר 10% ביצלה עם ליפידים DMPC וחומר ניקוי CHAPSO ביחס של 3:1 (w/w) (ראו טבלת חומרים).
הערה: יש להשתמש ב-CHAPSO בריכוז מיצלה קריטי (CMC) פי 5, כ-0.5%. זה שומר על ריכוז חומרי ניקוי סביב CMC שלה בתערובת חלבון-bicelle (שלב 5.2).- הוסף חומר ניקוי מומס H2O שעבר דה-יוניזציה (CHAPSO) לשומנים מיובשים מראש (תערובת של 5 מול% כולסטרול ו-95 מול-DMPC).
הערה: הכינו הרכבי שומנים שונים בכלורופורם, וייבשו אותם במבחנה מזכוכית באמצעות זרם גז חנקן ב-RT. סלקו שאריות ממיסים על ידי הכנסתם לתא ואקום למשך הלילה, ויצרו שכבת שומנים דקה. - יש להשהות מחדש שומנים וחומרי ניקוי באמצעות סוניק אמבט מים.
- ערבבו את תערובת הביצלה במים צוננים כקרח בעוצמה רציפה עד שהתמיסה הופכת לשקופה.
הערה: יש להשתמש בהגנה על השמיעה ולהבטיח אספקת קרח מספקת כדי לשמור על התערובת בפאזה נוזלית. - הסר רכיבים לא מומסים באמצעות מסנן צנטריפוגלי של 0.2 מיקרומטר (ראה טבלת חומרים).
הערה: אחסן את תמיסת bicelle aliquoted ב -80 ° C.
- הוסף חומר ניקוי מומס H2O שעבר דה-יוניזציה (CHAPSO) לשומנים מיובשים מראש (תערובת של 5 מול% כולסטרול ו-95 מול-DMPC).
- צרו תערובת חלבון/ביצלה על קרח על ידי שילוב עדין של 10% ביצלות (שלב 5.1.4) וחלבונים (שלב 4.7.4) ביחס של 1:4 (v/v), והשיגו ריכוז חלבון סופי בין 5-10 מ"ג/מ"ל.
- דוגרים על תערובת החלבונים והביצלה על קרח במשך 30 דקות.
- הגדר תנאי התגבשות בפורמט דיפוזיה של אדי טיפה תלויה באמצעות לוחות 48 בארות.
- ערבבו נפחים שווים (0.5 או 1 מיקרוליטר) של תערובת חלבון/ביצלה ותמיסת מאגר התגבשות המכילה 1.6 M-2.0 M אמוניום סולפט, 100 mM MES (pH 6.5), 0%-4% PEG 400 ו-1 mM TCEP (ראו טבלת חומרים).
הערה: צור מטריצה של תמיסת המאגר לפני כל ניסוי, תוך התאמת אמוניום סולפט (1.6-2.0 מטר) ו-PEG 400 (0%-4%). - דגירה להתגבשות ב 20 מעלות צלזיוס.
- בדקו את מגשי ההתגבשות למחרת כדי לוודא איטום זכוכית כיסוי מתאים.
- עקוב אחר גדילת הגביש לפחות פעם ביום. גבישים באיכות גבוהה מופיעים בדרך כלל תוך 1-2 שבועות, בגודל 50-150 מיקרומטר x 20-50 מיקרומטר x 2-5 מיקרומטר.
הערה: ייתכן שיחלוף זמן רב יותר להיווצרות גבישים בריכוזי חלבון נמוכים יותר. גבישים בוגרים יש לקצור בתוך חודש. - השרו גבישי חלבון ב-0.2 M נתרן מלונט והקפיאו אותם בחנקן נוזלי באמצעות 50 או 100 מיקרומטר cryo-loops.
הערה: אם קיים דיפרקטומטר רנטגן, בדוק כמה גבישים עם חשיפה לקרן רנטגן של 15-30 דקות כדי לחשוף עקיפה של עד 5 Å. עקיפה ברזולוציה גבוהה יותר דורשת מקור אור סינכרוטרון. באמצעות 0.2 M נתרן malonate כמו הגנה cryo, גביש בגודל 100 מיקרומטר x 50 מיקרומטר x 2 מיקרומטר יכול לספק סביב 90 מסגרות תמונה עקיפה עם רנטגן סינכרוטרון.
- ערבבו נפחים שווים (0.5 או 1 מיקרוליטר) של תערובת חלבון/ביצלה ותמיסת מאגר התגבשות המכילה 1.6 M-2.0 M אמוניום סולפט, 100 mM MES (pH 6.5), 0%-4% PEG 400 ו-1 mM TCEP (ראו טבלת חומרים).
Representative Results
חצי-טרנספורטרים רקומביננטיים של ABCG5 ו-ABCG8 אנושיים באים לידי ביטוי משותף בשמרי פסטוריס של פיצ'יה . לאחר מכן מחלקים את קרום השמרים באמצעות צנטריפוגה. כפי שמתואר בפרוטוקול זה, החלבונים ההטרודימריים מופקים באמצעות כרומטוגרפיה של עמודת טנדם. לאחר מכן, חלבונים שטופלו מראש כימית מתגבשים על ידי דגירה שלהם עם פוספוליפידים / כולסטרול bicelles. סקירות סכמטיות של תהליכי הטיהור וההתגבשות מוצגות באיור 1.
כדי להעריך את הפיזור של החלבונים המטוהרים, דגימות המכילות 0.01-0.05 מ"ג / מ"ל של חלבונים מוכתמות עם 1%-2% אורניל אצטט. הדגימות האלה נבדקות לאחר מכן באמצעות TEM עם כתם שלילי (איור 2A). על מנת להעריך את יציבות החלבון מבלי לעבור מחזורי הקפאה-הפשרה, נעשה שימוש בכרומטוגרפיית סינון ג'ל אנליטית. ניתוח זה כולל ניטור של אחסון בזמן של חלבונים מטוהרים באמצעות שימוש באליציטוטים קטנים בעלי נפח שווה של החלבונים (איור 2B). ייתכן אובדן קל של חלבונים בשברי השיא לאחר שבוע של דגירה ב -4 מעלות צלזיוס, אולי בגלל צברי חלבונים מסיסים שיורית. עם זאת, תנובת החלבון הכוללת עדיין מספיקה לגידול גבישים. השימוש בכתם שלילי TEM ובכרומטוגרפיית סינון ג'ל אנליטית הוא נוהג סטנדרטי להערכת התאמתם של חלבונים להתגבשות, במיוחד ממבנים מהונדסים שונים.
לצורך הערכת איכות החלבונים בכל שלב בתהליך הכרומטוגרפיה של העמודה, כמו גם לאחר הטיפול הכימי שלפני ההתגבשות, אליציטוטים של שברים המתאימים לשתי עמודות Ni-NTA, שתי עמודות CBP, סינון ג'ל אחד ואלקילציה רדוקטיבית נטענים על ג'ל SDS-PAGE 10% (איור 3). בנוסף, ניתן ליישם את אותה סביבת תגובה המשמשת לאלקילציה עבור תיוג כספית עם אתיל כספית (EMTS), אם כי זה מעבר להיקף המחקר הנוכחי.
גדילת הגבישים מנוטרת מדי יום באמצעות מיקרוסקופ סטריאופוני שולחני המצויד במקטב. גבישים בוגרים ומתאימים לאיסוף נתונים מגיעים בדרך כלל לממדים של 50 מיקרומטר x 100 מיקרומטר x 2 מיקרומטר (איור 4). במהלך תהליך קצירת הגבישים נמנעים במכוון מגבישים או אשכולות קטנים יותר.
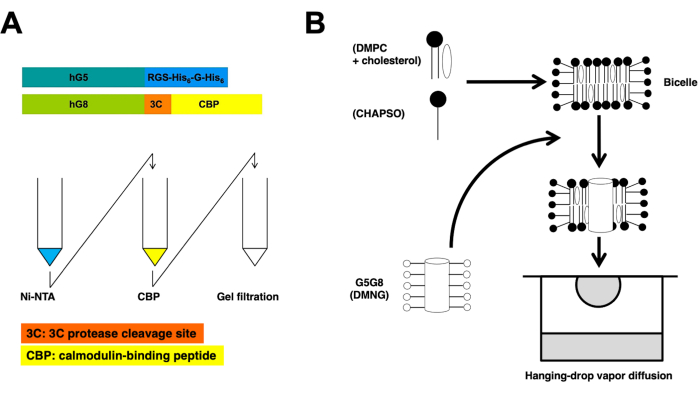
איור 1: סקירות סכמטיות לטיהור (A) והתגבשות ביצלה (B) של ABCG5/G8 הטרודימרי. מבנים של ABCG5 אנושי רקומביננטי (hG5) ו- ABCG8 (hG8) נושאים תגי RGS-H 6-G-H6 ו- 3C-CBP, בהתאמה (A, למעלה). כרומטוגרפיית עמודת זיקה טנדם, ואחריה כרומטוגרפיית סינון ג'ל להשגת טיהור הטרודימרי (A, למטה). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
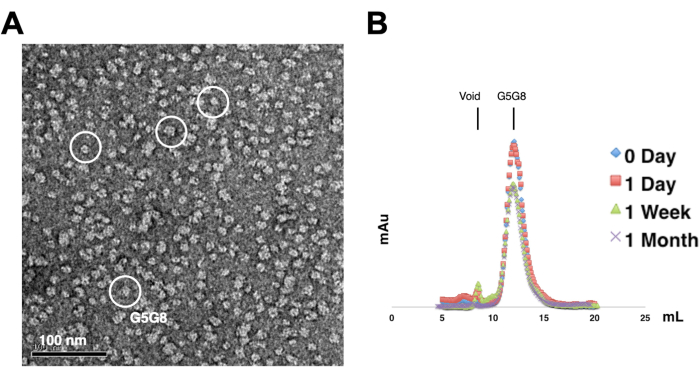
איור 2: הערכה של פיזור חד-פיזור (A) ויציבות (B) של חלבונים מטוהרים. (A) מיקרוגרף אלקטרונים של הטרודימרים מוכתמים שלילית ABCG5/G8 (G5G8) באמצעות TEM. חלקיקים מייצגים מודגשים בעיגולים לבנים מוצקים. סרגל קנה מידה = 100 ננומטר. (B) חלבונים אלקילטים המאוחסנים בטמפרטורה של 4°C שנותחו על ידי כרומטוגרפיית סינון ג'ל אנליטית במשך חודש עם אובדן קל של חלבונים לאחר שבוע. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
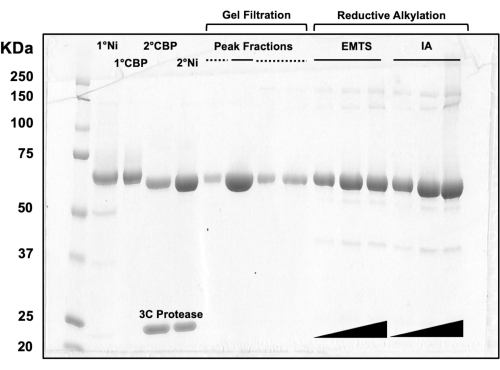
איור 3: ניתוח SDS-PAGE של חלבונים המדמים כרומטוגרפיית עמודות ואלקילציה רדוקטיבית. נפחים שונים (1-10 מיקרוליטר) של שברי חלבון הועמסו על ג'ל טריס/גליצין 10% ופעלו במשך 45 דקות במתח קבוע של 200 וולט. הג'ל הוכתם בכחול קומאסי, נעצר, יובש באוויר ונסרק על ידי סורק שולחני. 1° & 2° Ni: טור Ni-NTA הראשון והשני; 1° & 2° CBP: עמודות CBP ראשונה ושנייה; שיא שברים קו מוצק: שברים מאוגמים להתגבשות; שיא שברים מקווקוים: שברי כתף; EMTS: אתיל כספית thiosalicynate; IA: iodoacedamide. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
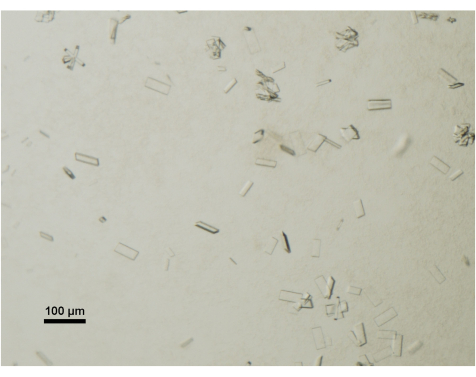
איור 4: הערכת הבשלת גבישי חלבון באמצעות מיקרוסקופ אור. גבישים בוגרים של ABCG5/G8 מטיפת התגבשות הודגמו תחת שולחן ומיקרוסקופ סטריאו מצויד במקטב. סרגל קנה מידה = 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
האתגרים הקשורים להתגבשות חלבוני ממברנה הניעו את הפיתוח של שיטות התגבשות מונחות שומנים דו-שכבתיים, כגון גישות bicelle27 או lipid cubic phase (LCP)14 . עם זאת, השגת התגבשות מוצלחת של חלבוני ממברנה עדיין תלויה בשלב הקריטי ולעיתים צוואר הבקבוק של הכנת החלבון. יש לציין כי מובילי ABC מציבים מכשול עצום בגידול גבישים המתאימים לקריסטלוגרפיה של קרני רנטגן. פרוטוקול זה מספק הדרכה מעשית מקיפה לייעול ההכנה של טרנספורטר סטרול ABCG5/G8 אנושי וטיפוח צמיחת גבישים באמצעות גישת התגבשות ביצל.
שיקול מרכזי בתכנון פרוטוקול זה היה הצורך בתפוקת חלבון משמעותית בשלבים הראשונים של טיהור החלבון, המאפשרת מידה מסוימת של אובדן חלבון במהלך הטיפול שלפני ההתגבשות (איור 3). אסטרטגיות נפוצות להתמודדות עם אתגר זה כוללות הנדסת חלבונים נרחבת, ניצול של מארחי ביטוי מגוונים, וחקר אורתולוגים או הומולוגים, בין גישות אחרות. עם זאת, עם הליך מורכב לכאורה זה, זוהו מספר צעדים מרכזיים העומדים בבסיס הצלחת הפרוטוקול וגם מספקים תובנות לגבי מגבלות פוטנציאליות שעשויות להתעורר בעת חקר מובילי ABC אחרים או חלבוני ממברנה בכלל.
ראשית, פרוטוקול זה משתמש בצנטריפוגה יסודית בכל שלב כדי למזער את צבירת החלבונים. בנוסף, ניטור רציף של היציבות התרמו-יציבה של החלבונים המטוהרים הוא חיוני. מיקרוסקופ אלקטרונים משמש לאימות חד-פיזור חלבון, בעוד סינון ג'ל אנליטי עוקב אחר יציבות החלבון לאורך זמן (איור 2). ניתן לשלב גם טכניקות חלופיות כמו דיכרואיזם מעגלי (CD) או קלורימטריה סריקה דיפרנציאלית (DSC). יתר על כן, שילוב של שומנים בשלבים ספציפיים הוא חיוני כדי למקסם הן את הפעילות ואת הקריסטלונזה של ABCG5 / G8 מטוהר. לדוגמה, cholate ו- CHS נחוצים כדי להציג הידרוליזה ATP מדידה; פוספוליפידים הם הכרחיים לשמירה על יציבותם של חלבונים מתילציה; וכולסטרול הוא מרכיב הכרחי בתמיסת ביצלה, המעודד צמיחת גבישים המתאימים לעקיפה של קרני רנטגן ברזולוציה גבוהה (איור 4).
בעיקרו של דבר, ניתן לבצע את ההליך כולו תוך מאמץ של שבוע. בניגוד ל-LCP, שליפת גבישים ממגשי התגבשות תלויים היא פשוטה. במבט קדימה, עם תפוקת חלבון משמעותית (כ-10 מ"ג), פרוטוקול זה ניתן להתאמה בקלות לפיתוח חקירות קריסטלוגרפיות המערבות מוטנטים ABCG5/G8 או חלבוני טרנספורטר אחרים. זה רלוונטי במיוחד למקרים שכיום מתחמקים מהדמיה באמצעות מיקרוסקופ אלקטרונים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכת על ידי מענק גילוי של מועצת המחקר למדעי הטבע וההנדסה (RGPIN 2018-04070) ומענק פרויקט מחקר של המכונים הקנדיים לבריאות (PJT-180640) ל- JYL. פרוטוקול זה מבוסס על הדיווחים המקוריים במבנים גבישיים ABCG5/G8 שדווחו קודם לכן על ידי Farhat et al.22 ו- Lee et al.23.
Materials
| Name | Company | Catalog Number | Comments |
| (NH4)2SO4 | MilliporeSigma | A4915 | |
| ABCG5 | National Institute of Health collection | NCBI accession number NM_022436 | |
| ABCG8 | National Institute of Health collection | NCBI accession number NM_022437 | |
| ÄKTA FPLC system | Cytiva (formerly GE Healthcare Life Sciences) | ||
| CaCl2 | Wisent | 600-024-CG | Anhydrous |
| CBP | Agilent | 214303 | Calmodulin binding peptide affinity resin |
| Centrifugal concentrators (Vivaspin) | Sartorius | ||
| CHAPSO | Anatrace | C317 | Anagrade |
| Cholesterol | Anatrace | CH200 | |
| CHS | Steraloids | C6823-000 | |
| DMAB | MilliporeSigma | 180238 | 97% |
| DMNG | Anatrace | NG322 | |
| DMPC | Anatrace | D514 | |
| DOPC | Avanti | 850375 | |
| DOPC | Anatrace | D518 | |
| DOPE | Avanti | 850725 | |
| DTT | Fisher | BP172 | |
| Dual Thickness MicroLoops | MiTeGen | ||
| EDTA | BioShop | EDT003 | Disodium salt, dihydrate |
| EGTA | MilliporeSigma | 324626 | |
| Emulsifier (EmulsiFex-C3) | Avestin | ||
| Endo H | New England Biolabs | P0702 | |
| Ethanol | Greenfield | P016EAAN | Ethyl Alcohol Anhydrous |
| Formaldehyde | MilliporeSigma | 252549 | ACS Reagent |
| Glycerol | BioShop | GLY004 | |
| HEPES | BioShop | HEP001 | |
| HRV-3C protease | Homemade | ||
| Imidazole | BioShop | IMD510 | Reagent grade |
| Iodoacetamide | MilliporeSigma | I1149 | BioUltra |
| Isopropanol | Fisher | BP2618212 | |
| Leupeptin | BioShop | LEU001 | |
| MES | MilliporeSigma | 69892 | BioUltra |
| Methanol | Fisher | A412P | |
| MgCl2 | Wisent | 800-070-CG | Hydrated |
| microfluidizer (LM 20) | Microfluidics | ||
| NaCl | BioShop | SOD002 | |
| NH4OH | Fisher | A669-212 | ACS Reagent |
| Ni-NTA superflow | Qiagen | 30430 | Nickel-charged resins |
| PEG 400 | MilliporeSigma | 202398 | |
| Pepstatin | BioShop | PEP605 | |
| PMSF | MilliporeSigma | P7626 | |
| pSGP18 and pLIC | Homemade (derived from pPICZ, Invitrogen) | ||
| SDS | BioShop | SDS003 | |
| Sodium cholate | Fisher | 229101 | |
| Sodium malonate | MilliporeSigma | 63409 | |
| Sucrose | Wisent | 800-081-WG | Ultra pure |
| Superdex 200 30/100 GL | Cytiva (formerly GE Healthcare Life Sciences) | 28990944 | Prepacked gel-filtration column |
| TCEP | |||
| TEM | FEI, Technai | ||
| Tris Base | Fisher | BP152 | |
| β-DDM | Anatrace | D310S | Sol Grade |
| β-mercaptoethanol | MilliporeSigma | ||
| ε-aminocaproic acid | Fisher | AAA1471936 |
References
- Hamada, H., Tsuruo, T. Purification of the 170- to 180-kilodalton membrane glycoprotein associated with multidrug resistance. 170- to 180-kilodalton membrane glycoprotein is an ATPase. Journal of Biological Chemistry. 263 (3), 1454-1458 (1988).
- Higgins, F., Hiles, D., Whalley, K., Jamieson, J. Nucleotide binding by membrane components of bacterial periplasmic binding protein-dependent transport systems. The EMBO Journal. 4 (4), 1033-1039 (1985).
- Higgins, F., et al. A family of related ATP-binding subunits coupled to many distinct biological processes in bacteria. Nature. 323 (6087), 448-450 (1986).
- Horio, M., Gottesman, M., Pastan, I. ATP-dependent transport of vinblastine in vesicles from human multidrug-resistant cells. Proceedings of the National Academy of Sciences of the United States of America. 85 (10), 3580-3584 (1988).
- Mimmack, L., et al. Energy coupling to periplasmic binding protein-dependent transport systems: stoichiometry of ATP hydrolysis during transport in vivo. Proceedings of the National Academy of Sciences of the United States of America. 86 (21), 8257-8261 (1989).
- Grundy, M. Absorption and Metabolism of Dietary Cholesterol. Annual Review of Nutrition. 3 (1), 71-96 (1983).
- Berge, E., et al. Accumulation of dietary cholesterol in sitosterolemia caused by mutations in adjacent ABC transporters. Science. 290 (5497), 1771-1775 (2000).
- Repa, J., et al. Regulation of ATP-binding cassette sterol transporters ABCG5 and ABCG8 by the Liver X receptors α and β. Journal of Biological Chemistry. 277 (21), 18793-18800 (2002).
- Yu, L., et al. Stimulation of cholesterol excretion by the Liver X receptor agonist requires ATP-binding cassette transporters G5 and G8. Journal of Biological Chemistry. 278 (18), 15565-15570 (2003).
- Yu, L., et al. Expression of ABCG5 and ABCG8 is required for regulation of biliary cholesterol secretion. Journal of Biological Chemistry. 280 (10), 8742-8747 (2005).
- Lütjohann, D., Björkhem, I., Beil, F., von Bergmann, K. Sterol absorption and sterol balance in phytosterolemia evaluated by deuterium-labeled sterols: effect of sitostanol treatment. Journal of Lipid Research. 36 (8), 1763-1773 (1995).
- Miettinen, A. Phytosterolaemia, xanthomatosis and premature atherosclerotic arterial disease: a case with high plant sterol absorption, impaired sterol elimination and low cholesterol synthesis. European Journal of Clinical Investigation. 10 (1), 27-35 (1980).
- Salen, G., et al. Sitosterolemia. Journal of Lipid Research. 33 (7), 945-955 (1992).
- Caffrey, M. Membrane protein crystallization. Journal of Structural Biology. 142 (1), 108-132 (2003).
- Michel, H. Crystallization of membrane proteins. Trends in Biochemical Sciences. 8 (2), 56-59 (1983).
- Dürr, N., Gildenberg, M., Ramamoorthy, A. The magic of bicelleslights up membrane protein structure. Chemical Reviews. 112 (11), 6054 (2012).
- Dürr, N., Soong, R., Ramamoorthy, A. When detergent meets bilayer: Birth and coming of age of lipid bicelles. Progress in nuclear magnetic resonance spectroscopy. 69 (1), 1-22 (2013).
- Dufourc, J. Bicelles and nanodiscs for biophysical chemistry. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1863 (1), 183478 (2021).
- Beaugrand, M., et al. Lipid concentration and molar ratio boundaries for the use of isotropic bicelles. Langmuir. 30 (21), 6162-6170 (2014).
- Sanders, R., Schwonek, P. Characterization of magnetically orientable bilayers in mixtures of dihexanoylphosphatidylcholine and dimyristoylphosphatidylcholine by solid-state NMR. Biochemistry. 31 (37), 8898-8905 (1992).
- Seddon, M., Curnow, P., Booth, J. Membrane proteins, lipids and detergents: not just a soap opera. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1666 (1-2), 105-117 (2004).
- Farhat, D., et al. Structural analysis of cholesterol binding and sterol selectivity by ABCG5/G8. Journal of Molecular Biology. 434 (20), 167795 (2022).
- Lee, J. Y., et al. Crystal structure of the human sterol transporter ABCG5/ABCG8. Nature. 533 (7604), 561-564 (2016).
- Ujwal, R., Bowie, U. Crystallizing membrane proteins using lipidic bicelles. Methods. 55 (4), 337-341 (2011).
- Johnson, H., Lee, J. Y., Pickert, A., Urbatsch, L. Bile acids stimulate ATP hydrolysis in the purified cholesterol transporter ABCG5/G8. Biochemistry. 49 (16), 3403-3411 (2010).
- Wang, Z., et al. Purification and ATP hydrolysis of the putative cholesterol transporters ABCG5 and ABCG8. Biochemistry. 45 (32), 9929-9939 (2006).
- Faham, S. Crystallization of bacteriorhodopsin from bicelle formulations at room temperature. Protein Science. 14 (3), 836-840 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved