ABCG5/G8 Кристаллизация в липидной бицеллярной среде для рентгеновской кристаллографии
In This Article
Summary
Этот протокол описывает установку для кристаллизации переносчика стерола ABCG5/G8. ABCG5/G8 восстанавливается в бицеллы для кристаллизации в виде висячей капли. Протокол не требует специализированных материалов или подложек, что делает его доступным и легким для адаптации в любой лаборатории для определения структуры белка с помощью рентгеновской кристаллографии.
Abstract
Транспортеры АТФ-связывающей кассеты (АВС) представляют собой мембранные белки, внедренные в липиды. Извлечение этих мембранных белков из липидного бислоя в водную среду обычно достигается с помощью детергентов. Эти детергенты разрушают липидный бислой и растворяют белки. Внутренняя среда обитания мембранных белков в липидном бислое создает проблему в поддержании их стабильности и однородности в решении для структурной характеристики. Бицеллы, которые включают в себя смесь длинноцепочечных и короткоцепочечных фосфолипидов и детергентов, воспроизводят естественную липидную структуру. Использование липидных бицелл и детергентов служит подходящей модельной системой для получения высококачественных дифракционных кристаллов, в частности, для определения структуры мембранных белков с высоким разрешением. Благодаря этим синтетическим микросредам мембранные белки сохраняют свою естественную конформацию и функциональность, способствуя образованию трехмерных кристаллов. При таком подходе растворимый в детергенте гетеродимерный ABCG5/G8 реинтегрировали в бицеллы DMPC/CHAPSO, дополненные холестерином. Эта установка была использована в экспериментальной процедуре диффузии пара для кристаллизации белка.
Introduction
АТФ-связывающие кассетные транспортеры (АВС) представляют собой суперсемейство мембранных белков, ответственных за различные АТФ-зависимые транспортные процессы через биологические мембраны 1,2,3,4,5. Эти белки-переносчики участвуют в сердечно-сосудистых заболеваниях и играют важную роль в облегчении оттока холестерина в желчь для последующего выведения в печень. Следовательно, метаболизм и баланс холестерина привлекли значительный интерес на протяжениимногих лет. Специфический механизм, участвующий в выведении холестерина и других стеринов из организма, включает членов подсемейства ABCG человека, в частности, гетеродимерных ABCG5/G8 7,8,9,10. Мутации в любом из этих генов нарушают гетеродимер, приводя к потере функции и вызывая ситостеролемию, расстройство, влияющее на транспорт стеринов11,12,13. Учитывая актуальность заболевания и их роль в стимулировании оттока холестерина, переносчики стеринов привлекли значительное внимание. Тем не менее, сложные детали их молекулярного механизма и субстратной селективности остаются в значительной степени нераскрытыми. Таким образом, выяснение кристаллической структуры ABCG5/G8 является важным шагом на пути к пониманию механизмов и нисходящих функций в транспорте холестерина.
Мембранные белки требуют закрепления внутри мембран, чтобы сворачиваться и функционировать правильно. Следовательно, извлечение мембранных белков из их естественной среды часто приводит к нестабильности белка, неправильному сворачиванию и потере функции14,15. Эти проблемы подчеркивают основные препятствия, с которыми приходится сталкиваться при кристаллизации мембранных белков. Тем не менее, восстановление белков в синтетические бислои детергента, такие как бицеллы, появилось в качестве решения этой проблемы, позволяя поддерживать мембранные белки в среде, подобной нативной бислойнойсреде. Бицеллы представляют собой скопления синтетических фосфолипидов и моющих средств, взвешенных и растворенных в воде. Примечательно, что они принимают двухслойную структуру, которая имитирует биологические мембраны16,17,18. Бицеллы могут переходить из жидкой и гелевой фаз в зависимости от температуры и вязкости. Кристаллизация бицелл основана на небольших двухслойных дисках и низкой вязкости при пониженных температурах, что способствует тщательному смешиванию белков и растворов бицелл. Размер бицелл зависит от соотношения детергента и липидов при приготовлении 19,20. Преобладающими детергентами для образования бицелл являются 3-[(3-холамидопропил)диметиламмонио]-2-гидрокси-1-пропансульфонат (CHAPSO), а также 3-[(3-холамидопропил)диметиламмонио]-1-пропансульфонат (CHAPS) и 1,2-дитридеканоил-sn-глицерин-3-фосфохолин (DHPC)21. Эти моющие средства используются в сочетании с липидами, такими как димиристоилфосфатидилхолин (ДМПК) и 1-пальмитоил-2-олеоил-фосфатидилхолин (ПОПК). Кроме того, недавние исследования продемонстрировали полную функциональность мембранных белков внутри бицелл в физиологических условиях. Например, Ли и его коллеги успешно кристаллизовали и сообщили о кристаллической структуре ABCG5/ABCG8 на основе липидного бислоя22,23. В процессе кристаллизации белково-бицеллярные смеси могут размещаться с использованием стандартного оборудования, в том числе высокопроизводительных кристаллизационных роботов24. Возможность использования бицелл, однако, зависит от термостабильности белков из-за условий кристаллизации при более высоких температурах. Тем не менее, по сравнению с другими методами, необходимые условия кристаллизации мембранных белков обычно остаются мягкими, с низкими концентрациями осадка, соли и буфера. Это делает как белково-бицеллярные смеси, так и диффузию пара эффективными и легко реализуемыми инструментами для структурных исследований мембранных белков.
В этом протоколе описаны основные этапы подготовки белка и кристаллизации бицелл для определения рентгеновской кристаллической структуры ABCG5/G8 с высоким разрешением (рис. 1).
Protocol
1. Клонирование и экспрессия белка
- Клонируйте человеческий ген ABCG5/G8 в дрожжи Pichia pastoris в соответствии с предыдущими протоколами25,26. Вкратце, наследуйте векторы экспрессии pSGP18 и pLIC из pPICZB. Добавьте метку, кодирующую сайт протеазы 3С риновируса, за которым следует кальмодулин-связывающий пептид (CBP) на С-конец кДНК ABCG8 (pSGP18-G8-3C-CBP).
- Добавьте шестигистидиновую метку, разделенную глицином (His6 GlyHis6), к С-концу кДНК ABCG5 (pLIC-G5-H12). Сотрансформируют плазмиды в штамм Pichia KM71H с помощью электропорации.
ПРИМЕЧАНИЕ: Пожалуйста, ознакомьтесь с таблицей материалов для получения подробной информации об используемых плазмидах, средах и буферах. - Выращивайте трансформированные дрожжевые клетки на пластинах из агара MD при температуре 28 °C.
- Добавьте шестигистидиновую метку, разделенную глицином (His6 GlyHis6), к С-концу кДНК ABCG5 (pLIC-G5-H12). Сотрансформируют плазмиды в штамм Pichia KM71H с помощью электропорации.
- Через 1-2 дня отбирают 10-12 колоний и инокулируют их в 10 мл минимальной глицериновой азотистой среды на основе дрожжей (MGY), используя центрифужные пробирки по 50 мл для мелкомасштабного культивирования.
- Сделайте три небольших отверстия в крышке пробирки центрифуги для лучшей аэрации. Дайте клеткам расти при 28 °C с постоянным встряхиванием при 250 об/мин до тех пор, пока оптическая плотность на длине волны 600 нм (OD600) не достигнет 10, обычно занимая 1-2 ночи.
ПРИМЕЧАНИЕ: Рост клеток обычно занимает от 12 до 24 часов.
- Сделайте три небольших отверстия в крышке пробирки центрифуги для лучшей аэрации. Дайте клеткам расти при 28 °C с постоянным встряхиванием при 250 об/мин до тех пор, пока оптическая плотность на длине волны 600 нм (OD600) не достигнет 10, обычно занимая 1-2 ночи.
- На следующий день берут 1 л стерильной среды MGY и инокулируют ее первичной культурой в колбу объемом 2,4 л. Инкубируют колбу при 28 °C в шейкере-инкубаторе при 250 об/мин в течение 24 ч.
- Чтобы поддерживать pH в пределах 5-6, добавьте 10% гидроксид аммония (NH4OH) до тех пор, пока pH не стабилизируется.
- Отрегулируйте рН и индуцируйте экспрессию белка, добавив 1 мл чистого метанола на 1 л культуры (0,1 % (v/v) метанола).
ПРИМЕЧАНИЕ: Затем подавайте в клетки 5 мл чистого метанола на литр культуры (0,5 % (v/v) метанола) каждые 12 ч в течение общей продолжительности 36-48 ч. - Собирают клетки центрифугированием при 15 000 x g в течение 30 мин при 4 °C.
- Соберите клеточные гранулы и ресуспендируйте их в лизисном буфере (0,33 М сахарозы, 0,3 М Tris-Cl pH 7,5, 0,1 М аминогексановой кислоты, 1 мМ ЭДТА и 1 мМ ЭГТА) до концентрации 0,5 г/мл. Хранить суспензию при температуре -80 °C. Как правило, из 1 л культивируемых клеток можно извлечь 30 ± 5 г клеточной массы.
ПРИМЕЧАНИЕ: Храните клеточные гранулы непосредственно в морозильной камере или выполняйте немедленную ресуспендию в лизисном буфере для мембранных препаратов.
2. Препарирование микросомальной мембраны
- Разморозьте клетки и добавьте ингибиторы протеазы (2 мкг/мл лейпептина, 2 мкг/мл пестатина А, 2 мМ PMSF, см. таблицу материалов).
- Для дальнейшего лизиса клеток используйте охлажденный льдом эмульгатор или микрофлюидизатор (см. Таблицу материалов) при давлении 25 000-30 000 фунтов на квадратный дюйм. Повторите этот процесс 3-4 раза.
- Центрифуга для удаления клеточного мусора: отжим при 3 500-4 000 x g в течение 15 мин, затем второй отжим при 15 000 x g в течение 30 мин. Поддерживайте оба отжима при температуре 4 °C.
- Чтобы изолировать везикулы микросомальной мембраны, переносят надосадочную жидкость в ультрацентрифужные пробирки и подвергают ультрацентрифугированию при 2 00 000 x g в течение 1,5 ч при 4 °C.
- Ресуспендируйте мембранную гранулу в 50 мл буфера A (50 мМ Tris-Cl pH 8,0, 100 мМ NaCl и 10% глицерина) с помощью гомогенизатора. Хранить суспензию при температуре -80 °C.
3. Белковый препарат-очистка гетеродимеров
- Разморозьте замороженные микросомальные мембраны и отрегулируйте концентрацию до 4-6 мг/мл с помощью буфера для солюбилизации. Буфер должен содержать 50 мМ Tris-HCl, рН 8,0, 100 мМ NaCl, 10% глицерина, 1% (w/v) β-додецилмальтозида (β-DDM), 0,5% (w/v) холата, 0,1% (w/v) холестерилгемиссукцината (CHS), 5 мМ имидазола, 5 мМ β-меркаптоэтанола (β-ME), 2 мкг/мл лейпептина, 2 мкг/мл пепстатина А и 2 мМ PMSF (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Можно смешать равные объемы мембранного препарата и буфера для солюбилизации или использовать 2-кратный буфер для солюбилизации без ингибиторов протеазы и восстановителей. Короткое кипячение буфера помогает эффективно растворять CHS. Для очистки используйте только буфер, охлаждаемый 4 °C.- Перемешивайте смесь на средней скорости в течение 1 ч при 4 °C. После этого дополнительно помешивают при комнатной температуре (RT) в течение 20-30 мин.
- Центрифугируют смесь при 1 00 000 x g в течение 30 мин при 4 °C для удаления нерастворимых мембран. Соберут солюбилизированный надосадочную жидкость и добавляют 20 мМ имидазола и 0,1 мМ ТЦЭП.
- Выполняют аффинную колоночную хроматографию26: связывают растворимую надосадочную жидкость с предварительно уравновешенными гранулами Ni-NTA (10-15 мл) (см. таблицу материалов) в буфере А (шаг 2.2.1) в течение ночи.
ПРИМЕЧАНИЕ: Избегайте использования глицерина в буферах, начиная с этого момента.- Дважды промыть колонку 10 объемами буфера B (50 мМ HEPES, pH 7,5, 100 мМ NaCl, 0,1 % (масс/об) β-DDM, 0,05 % (массовый/обовительный) холат, 0,01 % (w/v) CHS, 0,1 мМ TCEP), содержащий 25 мМ имидазола.
- Промойте колонку 10 объемами буфера Б, содержащего 50 мМ имидазола.
- Элюируют белок с помощью буфера C (буфер B с 200 мМ имидазола).
- Добавьте к элюированным белкам 1 мМ TCEP (см. таблицу материалов) и 10 мМMgCl2 .
- Проверьте элюированные фракции на геле SDS-PAGE, чтобы подтвердить правильный размер белка26.
ПРИМЕЧАНИЕ: Типичный выход белка (1-й Ni-NTA):10-20 мг белка на 6-литровую культуру. Используйте ДДМ в 10 или 5 раз больше его критической концентрации мицелл (КМЦ), примерно 0,01%. В этом протоколе используется 0,1% DDM. - Разбавьте пиковые фракции элюирования Ni-NTA равным объемом буфера D1 (буфер B с 1 мМ CaCl 2, 1 мМ MgCl2), перемешайте и загрузите белковые фракции в колонку CBP (3-5 мл) (см. Таблицу материалов), которая была предварительно уравновешена буфером D1 для промывки CBP.
- Выполните последовательную промывку колонны CBP для замены моющих средств с использованием буфера D1 и D2 (буфер B с 1 мМ CaCl 2, 1 мМ MgCl2, 0,1% (w/v) децилмальтозного неопентилгликоля (DMNG), без β-DDM): сначала промыть 3 колонками объемов D1; во-вторых, промывка 3-мя колонками объемов D1:D2 (3:1, v/v); в-третьих, промыть 3-мя колонками объемов D1:D2 (1:1, v/v); четвертый этап, промывка объемами 3 колонн D1:D2 (1:3, v/v), затем 6-10 объемами колонн D2.
- Элюируют белок с помощью CBP wash Buffer D2 с 300 мМ NaCl во фракциях по 1 мл из колонки CBP (всего 10 мл). Концентрировать элюированные фракции до 1-2 мл.
ПРИМЕЧАНИЕ: Типичный выход белка (1-й CBP) составляет5-15 мг белка на 6-литровую культуру. Моющие средства на основе мальтозы, неопентилгликоля (MNG) улучшают хранение очищенного белка при 4 °C. Использовались как DMNG, так и Lauryl MNG (LMNG), при этом DMNG давал лучшие рентгеновские дифракционные кристаллы. Используйте DMNG в 10-20 раз больше его критической концентрации мицелл (CMC), примерно 0,003%. В этом протоколе использовалось 0,1% DMNG. Фракция элюата CBP может быть дополнительно очищена с помощью гель-фильтрационной хроматографии (шаг 4.4.) для анализа активности белков АТФазы или оценки монодисперсности с помощью просвечивающей электронной микроскопии (ПЭМ).
4. Подготовка белка - предкристаллизационная обработка
- Расщепляют N-связанные гликаны и метки CBP с помощью эндогликозидазы H (Endo H, ~0,2 мг на 10-15 мг очищенного белка) и протеазы HRV-3C (~2 мг на 10-15 мг очищенного белка) соответственно (см. таблицу материалов). Инкубировать в течение ночи при температуре 4 °C.
- Во время инкубации протеаз Endo H и 3C проводят восстановительное алкилирование объединенных белков. Начните с инкубации с 20 мМ йодоацетамида (см. таблицу материалов) в течение ночи при 4 °C. После этого следует инкубация в течение 1 ч с добавлением 2 мМ йодоацетамида на льду.
ПРИМЕЧАНИЕ: Этот этап дополнительно стабилизирует хранение белка на срок до одного месяца при температуре 4 °C. - Используйте вторую колонку CBP (1-2 мл), чтобы отделить расщепленную метку CBP. Используйте буфер D2 для этого процесса.
ПРИМЕЧАНИЕ: Типичный выход белка (2-й CBP) составляет5-10 мг белка на 6-литровую культуру. - Очистите белок, свободный от меток CBP, с помощью гель-фильтрационной хроматографии. Буфер должен содержать 10 мМ HEPES, рН 7,5, 100 мМ NaCl, 0,1% (массовый/об.) DMNG, 0,05 % (массовый/об) холат и 0,01% (массовый/об.) CHS.
ПРИМЕЧАНИЕ: Типичный выход белка (гелевая фильтрация) составляет 2-8 мг белка на 6 л культуры. На этом этапе отсутствие пика ДДМ (~65 кД) во время фильтрации геля свидетельствует об успешном обмене моющего средства на DMNG. - Модифицируйте объединенные белковые фракции путем восстановительного метилирования: добавьте к белку 20 мМ диметиламинборана (DMAB, см. таблицу материалов) и 40 мМ формальдегида. Инкубируют в течение 2 ч при 4 °C на осциллирующем встряхивателе. Добавьте 10 мМ DMAB.
- Повторите шаг 4,5, включая добавление 10 мМ DMAB, и инкубируйте в течение ночи (12-18 ч) при 4 °C.
- Остановите реакцию, добавив 100 мМ Tris-Cl, pH 7,5.
- Загрузите метилированный белок на колонку Ni-NTA объемом 2 мл, предварительно уравновешенную 100 мМ Tris-Cl, pH 8,0 и 100 мМ NaCl.
- Промыть колонку, используя 10 объемов промывочного буфера (10 мМ HEPES, pH 7,5, 100 мМ NaCl, с 0,5 мг/мл DOPC: DOPC: DOPE (3:1, w/w), 0,1% (w/v) DMNG, 0,05% (w/v) холат, 0,01% (w/v) CHS).
- Элюируют релипированный белок с помощью элюирующего буфера (10 мМ HEPES, рН 7,5, 100 мМ NaCl, 200 мМ имидазола, 0,5 мг/мл DOPC: DOPE (1:1, w/w), 0,1% (w/v) DMNG, 0,05% (w/v) холат, 0,01% (w/v) CHS).
ПРИМЕЧАНИЕ: Типичный выход белка (2-й Ni-NTA) составляет1-5 мг белка на 6 л культуры. - Пропустите белки через колонну обессоливания PD-10, предварительно уравновешенную буфером, используемым на этапе 4.4.
- Инкубируйте обессоленный и релипированный белок в течение ночи с холестерином (приготовленным в изопропаноле или этаноле) до конечной концентрации ~20 мкМ.
- На следующее утро осадок удаляют ультрацентрифугированием при 1 50 000 х г в течение 10 мин при 4 °C. Соберите надосадочную жидкость.
- Концентрируйте белок до конечной концентрации 30-50 мг/мл с помощью центробежного концентратора с предельным давлением 100 кДа.
- Удалите осадок с помощью настольной охлаждаемой центрифуги на максимальной скорости в течение 30 минут при 4 °C.
- Надосадочную жидкость выдерживают на льду при температуре 4 °С и устанавливают условия кристаллизации в бицеллах.
ПРИМЕЧАНИЕ: Концентрированные белки должны быть использованы для роста кристаллов в течение недели. Не замораживайте белки.
5. Кристаллизация белка в бицеллах
- Приготовьте 10% исходный раствор бицелл с липидами DMPC и моющим средством CHAPSO в соотношении 3:1 (по массе/весу) (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Используйте CHAPSO при концентрации мицелл (CMC) в 5 раз большей, чем критическая, примерно 0,5%. Это поддерживает концентрацию моющего средства вокруг его КМЦ в белково-бицеллярной смеси (шаг 5.2).- Добавьте деионизированное растворенное моющее средство H2O (CHAPSO) к предварительно высушенным липидам (смесь 5 моль холестерина и 95 моль DMPC).
ПРИМЕЧАНИЕ: Приготовьте различные липидные композиции в хлороформе и высушите их в стеклянной пробирке, используя поток газообразного азота при RT. Удалите остаточные растворители, поместив их в вакуумную камеру на ночь, образуя тонкий липидный слой. - Ресуспендируйте липиды и моющее средство с помощью ультразвукового аппарата на водяной бане.
- Обработайте смесь бицелл ультразвуком в охлажденной льду воде с помощью непрерывной мощности до тех пор, пока раствор не станет прозрачным.
ПРИМЕЧАНИЕ: Используйте средства защиты органов слуха и обеспечьте достаточную подачу льда, чтобы смесь оставалась в жидкой фазе. - Удалите нерастворенные компоненты с помощью центробежного фильтра 0,2 мкм (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Храните аликвотированный раствор бицелл при температуре -80 °C.
- Добавьте деионизированное растворенное моющее средство H2O (CHAPSO) к предварительно высушенным липидам (смесь 5 моль холестерина и 95 моль DMPC).
- Приготовьте смесь белка и бицелл на льду, аккуратно смешав 10% бицелл (шаг 5.1.4) и белков (шаг 4.7.4) в соотношении 1:4 (v/v), достигнув конечной концентрации белка в пределах 5-10 мг/мл.
- Выдерживайте смесь белка и бицелл на льду в течение 30 минут.
- Настройка условий кристаллизации в формате висячей капельной диффузии паров с использованием 48-луночных планшетов.
- Смешайте равные объемы (0,5 или 1 мкл) смеси белка/бицелл и кристаллизационного резервуарного раствора, содержащего 1,6–2,0 М сульфата аммония, 100 мМ МЭС (рН 6,5), 0%–4% ПЭГ 400 и 1 мМ ТКЭП (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Перед каждым экспериментом создавайте матрицу пластового раствора, корректируя сульфат аммония (1,6-2,0 М) и ПЭГ 400 (0%-4%). - Инкубировать для кристаллизации при 20 °С.
- Проверьте лотки для кристаллизации на следующий день, чтобы убедиться в надлежащей герметизации защитного стекла.
- Следите за ростом кристаллов не реже одного раза в день. Высококачественные кристаллы обычно появляются в течение 1-2 недель, размером 50-150 мкм х 20-50 мкм х 2-5 мкм.
ПРИМЕЧАНИЕ: Кристаллы могут формироваться дольше при более низких концентрациях белка. Зрелые кристаллы должны быть собраны в течение одного месяца. - Кристаллы белка замачивают в 0,2 М малонате натрия и мгновенно замораживают их в жидком азоте с помощью криопетлей 50 или 100 мкм.
ПРИМЕЧАНИЕ: Если имеется рентгеновский дифрактометр, протестируйте несколько кристаллов с помощью 15-30-минутного рентгеновского пучка, чтобы выявить дифракцию до 5 Å. Для дифракции с более высоким разрешением требуется источник синхротронного излучения. Используя 0,2 М малоната натрия в качестве криопротектора, кристалл размером 100 мкм x 50 мкм x 2 мкм может обеспечить около 90 рамок дифракционных изображений с помощью синхротронного рентгеновского излучения.
- Смешайте равные объемы (0,5 или 1 мкл) смеси белка/бицелл и кристаллизационного резервуарного раствора, содержащего 1,6–2,0 М сульфата аммония, 100 мМ МЭС (рН 6,5), 0%–4% ПЭГ 400 и 1 мМ ТКЭП (см. Таблицу материалов).
Representative Results
Рекомбинантные полупереносчики ABC, человеческие ABCG5 и ABCG8, экспрессируются совместно с дрожжами Pichia pastoris . Затем дрожжевая мембранная фракция фракционируется с помощью центрифугирования. Как указано в этом протоколе, гетеродимерные белки экстрагируются с помощью хроматографии с тандемной колонкой. Затем предварительно химически обработанные белки кристаллизуют путем их инкубации с фосфолипидными/холестериновыми бицеллами. Схематические обзоры процессов очистки и кристаллизации представлены на рисунке 1.
Для оценки монодисперсности очищенных белков образцы, содержащие 0,01-0,05 мг/мл белков, окрашивают 1%-2% уранилацетатом. Затем эти образцы исследуют с помощью ПЭМ с отрицательным окрашиванием (рис. 2А). Для оценки стабильности белка без прохождения циклов замораживания-оттаивания используется аналитическая гель-фильтрационная хроматография. Этот анализ включает в себя мониторинг временного хранения очищенных белков с использованием небольших аликвот белков равного объема (рис. 2B). После недели инкубации при 4 °C может наблюдаться небольшая потеря белков на пиковых фракциях, возможно, из-за остаточных растворимых белковых агрегатов. Тем не менее, общий выход белка остается достаточным для роста кристаллов. Использование ПЭМ с отрицательным окрашиванием и аналитической гель-фильтрационной хроматографии является стандартной практикой для оценки пригодности белков для кристаллизации, особенно из различных инженерных конструкций.
Для оценки качества белка на каждом этапе процесса колоночной хроматографии, а также после предкристаллизационной химической обработки на 10%-ный гель SDS-PAGE загружают аликвоты фракций, соответствующих двум колонкам Ni-NTA, двум колонкам CBP, одной гелевой фильтрации и восстановительному алкилированию (рис. 3). Кроме того, та же реакционная среда, используемая для алкилирования, может быть применена для мечения ртути этилртутью (EMTS), хотя это выходит за рамки настоящего исследования.
За ростом кристаллов ежедневно следят с помощью настольного стереомикроскопа, оснащенного поляризатором. Зрелые кристаллы, пригодные для сбора данных, обычно достигают размеров 50 мкм x 100 мкм x 2 мкм (рис. 4). В процессе сбора кристаллов намеренно избегаются более мелкие кристаллы или кластеры.
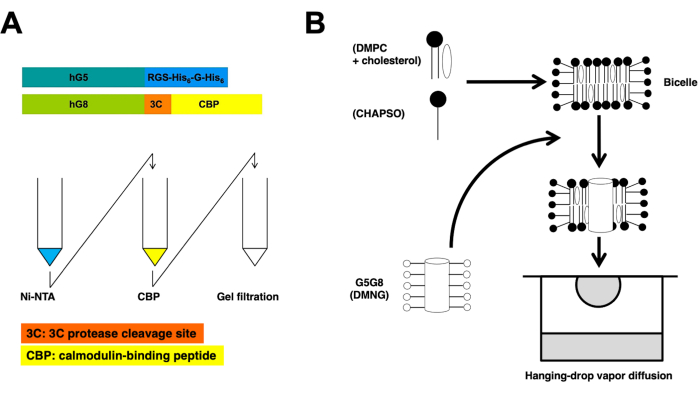
Рисунок 1: Схематические обзоры очистки (A) и бицеллярной кристаллизации (B) гетеродимерных ABCG5/G8. Конструкции рекомбинантных человеческих ABCG5 (hG5) и ABCG8 (hG8) несут метки RGS-H 6-G-H6 и 3C-CBP соответственно (А, вверху). Тандемная сродственная колоночная хроматография с последующей гель-фильтрационной хроматографией для достижения гетеродимерной очистки (А, внизу). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
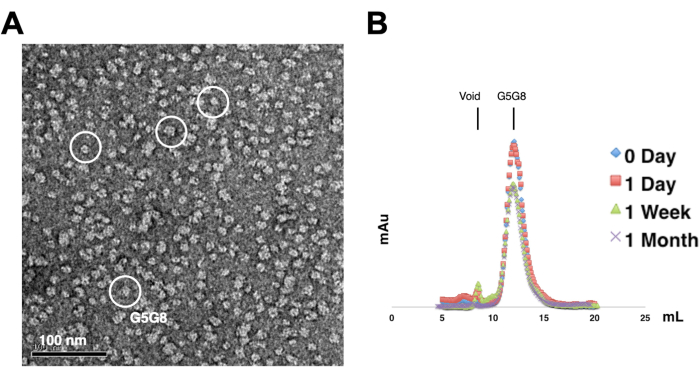
Рисунок 2: Оценка монодисперсности (А) и стабильности (В) очищенных белков . (A) Электронная микрофотография отрицательно окрашенных гетеродимеров ABCG5/G8 (G5G8) с использованием ПЭМ. Репрезентативные частицы выделены сплошными белыми кружками. Масштабная линейка = 100 нм. (B) Алкилированные белки, хранящиеся при 4 °C, анализируются методом аналитической гель-фильтрационной хроматографии в течение месяца с незначительной потерей белков через неделю. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
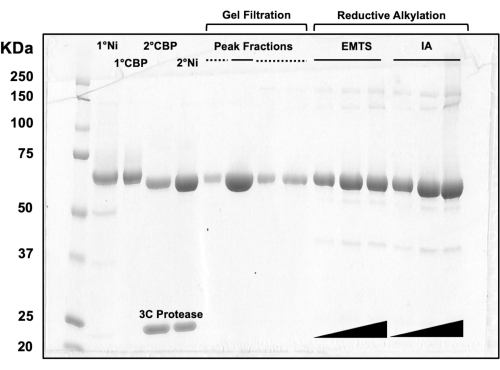
Рисунок 3: SDS-PAGE анализ белковых элюатов колоночной хроматографии и восстановительного алкилирования. Различные объемы (1-10 мкл) белковых фракций загружали на 10% гель трис/глицина и запускали в течение 45 мин при постоянном напряжении 200 В. Гель был окрашен синим цветом Кумасси, обесцвечен, высушен на воздухе и отсканирован настольным сканером. 1° и 2° Ni: первая и вторая Ni-NTA колонны; 1° и 2° CBP: первая и вторая колонны CBP; Сплошная линия Peak Fractions: объединенные фракции для кристаллизации; Пиковые дроби пунктирной линией: доли плеча; ЭМТС: тиосалицинат этилртути; ИА: йодоацедамид. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
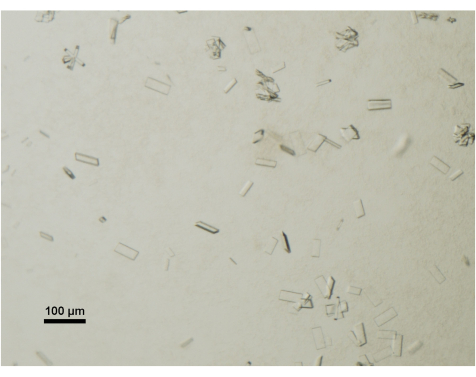
Рисунок 4: Оценка созревания кристаллов белка методом световой микроскопии. Зрелые кристаллы ABCG5/G8 из кристаллизационной капли визуализировали под настольным стереомикроскопом, оснащенным поляризатором. Масштабная линейка = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Discussion
Проблемы, связанные с кристаллизацией мембранных белков, послужили толчком к разработке методов кристаллизации, основанных на бипидном бислое, таких как бицелла27 или липидная кубическая фаза (LCP)14 . Тем не менее, достижение успешной кристаллизации мембранных белков по-прежнему зависит от критического и иногда узкого этапа подготовки белка. Примечательно, что переносчики ABC представляют собой серьезное препятствие для выращивания кристаллов, пригодных для рентгеновской кристаллографии. Этот протокол содержит всестороннее практическое руководство по рационализации подготовки человеческого транспортера стеринов ABCG5/G8 и стимулированию роста кристаллов с помощью подхода к кристаллизации бицелл.
Ключевым фактором при разработке этого протокола было требование значительного выхода белка на начальных этапах очистки белка, что позволило бы обеспечить определенную степень потери белка во время предварительной кристаллизационной обработки (рис. 3). Общие стратегии решения этой проблемы включают в себя, среди прочего, обширную белковую инженерию, использование различных экспрессионных хозяев и исследование ортологов или гомологов. Тем не менее, с помощью этой, казалось бы, сложной процедуры был определен ряд ключевых шагов, которые лежат в основе успеха протокола, а также дают представление о потенциальных ограничениях, которые могут возникнуть при изучении других транспортеров ABC или мембранных белков в целом.
Во-первых, этот протокол использует тщательное центрифугирование на каждом этапе, чтобы свести к минимуму агрегацию белков. Кроме того, постоянный контроль термостабильности очищенных белков имеет решающее значение. Электронная микроскопия используется для проверки монодисперсности белка, в то время как аналитическая фильтрация геля отслеживает стабильность белка с течением времени (рис. 2). Также могут быть использованы альтернативные методы, такие как циркулярный дихроизм (КД) или дифференциальная сканирующая калориметрия (ДСК). Кроме того, включение липидов на определенных стадиях имеет важное значение для максимизации как активности, так и кристаллогенеза очищенного ABCG5/G8. Например, холат и CHS необходимы для осуществления измеримого гидролиза АТФ; фосфолипиды незаменимы для поддержания стабильности метилированных белков; а холестерин является необходимым компонентом раствора бицеллы, способствуя росту кристаллов, пригодных для рентгеновской дифракции высокого разрешения (рис. 4).
По сути, вся процедура может быть выполнена в течение недели усилий. В отличие от LCP, извлечение кристаллов из кристаллизационных лотков с висячей каплей является простым. Забегая вперед, можно сказать, что при значительном выходе белка (около 10 мг) этот протокол легко адаптируется для разработки кристаллографических исследований с участием мутантов ABCG5/G8 или других белков-переносчиков. Это особенно актуально для случаев, которые в настоящее время не поддаются визуализации с помощью электронной микроскопии.
Disclosures
Авторам нечего раскрывать.
Acknowledgements
Эта работа поддержана грантом Совета по естественным наукам и инженерным исследованиям (RGPIN 2018-04070) и грантом Канадского института исследований в области здравоохранения (PJT-180640) для JYL. Этот протокол основан на оригинальных отчетах по кристаллическим структурам ABCG5/G8, о которых сообщалось ранее Farhat et al.22 и Lee et al.23.
Materials
| Name | Company | Catalog Number | Comments |
| (NH4)2SO4 | MilliporeSigma | A4915 | |
| ABCG5 | National Institute of Health collection | NCBI accession number NM_022436 | |
| ABCG8 | National Institute of Health collection | NCBI accession number NM_022437 | |
| ÄKTA FPLC system | Cytiva (formerly GE Healthcare Life Sciences) | ||
| CaCl2 | Wisent | 600-024-CG | Anhydrous |
| CBP | Agilent | 214303 | Calmodulin binding peptide affinity resin |
| Centrifugal concentrators (Vivaspin) | Sartorius | ||
| CHAPSO | Anatrace | C317 | Anagrade |
| Cholesterol | Anatrace | CH200 | |
| CHS | Steraloids | C6823-000 | |
| DMAB | MilliporeSigma | 180238 | 97% |
| DMNG | Anatrace | NG322 | |
| DMPC | Anatrace | D514 | |
| DOPC | Avanti | 850375 | |
| DOPC | Anatrace | D518 | |
| DOPE | Avanti | 850725 | |
| DTT | Fisher | BP172 | |
| Dual Thickness MicroLoops | MiTeGen | ||
| EDTA | BioShop | EDT003 | Disodium salt, dihydrate |
| EGTA | MilliporeSigma | 324626 | |
| Emulsifier (EmulsiFex-C3) | Avestin | ||
| Endo H | New England Biolabs | P0702 | |
| Ethanol | Greenfield | P016EAAN | Ethyl Alcohol Anhydrous |
| Formaldehyde | MilliporeSigma | 252549 | ACS Reagent |
| Glycerol | BioShop | GLY004 | |
| HEPES | BioShop | HEP001 | |
| HRV-3C protease | Homemade | ||
| Imidazole | BioShop | IMD510 | Reagent grade |
| Iodoacetamide | MilliporeSigma | I1149 | BioUltra |
| Isopropanol | Fisher | BP2618212 | |
| Leupeptin | BioShop | LEU001 | |
| MES | MilliporeSigma | 69892 | BioUltra |
| Methanol | Fisher | A412P | |
| MgCl2 | Wisent | 800-070-CG | Hydrated |
| microfluidizer (LM 20) | Microfluidics | ||
| NaCl | BioShop | SOD002 | |
| NH4OH | Fisher | A669-212 | ACS Reagent |
| Ni-NTA superflow | Qiagen | 30430 | Nickel-charged resins |
| PEG 400 | MilliporeSigma | 202398 | |
| Pepstatin | BioShop | PEP605 | |
| PMSF | MilliporeSigma | P7626 | |
| pSGP18 and pLIC | Homemade (derived from pPICZ, Invitrogen) | ||
| SDS | BioShop | SDS003 | |
| Sodium cholate | Fisher | 229101 | |
| Sodium malonate | MilliporeSigma | 63409 | |
| Sucrose | Wisent | 800-081-WG | Ultra pure |
| Superdex 200 30/100 GL | Cytiva (formerly GE Healthcare Life Sciences) | 28990944 | Prepacked gel-filtration column |
| TCEP | |||
| TEM | FEI, Technai | ||
| Tris Base | Fisher | BP152 | |
| β-DDM | Anatrace | D310S | Sol Grade |
| β-mercaptoethanol | MilliporeSigma | ||
| ε-aminocaproic acid | Fisher | AAA1471936 |
References
- Hamada, H., Tsuruo, T. Purification of the 170- to 180-kilodalton membrane glycoprotein associated with multidrug resistance. 170- to 180-kilodalton membrane glycoprotein is an ATPase. Journal of Biological Chemistry. 263 (3), 1454-1458 (1988).
- Higgins, F., Hiles, D., Whalley, K., Jamieson, J. Nucleotide binding by membrane components of bacterial periplasmic binding protein-dependent transport systems. The EMBO Journal. 4 (4), 1033-1039 (1985).
- Higgins, F., et al. A family of related ATP-binding subunits coupled to many distinct biological processes in bacteria. Nature. 323 (6087), 448-450 (1986).
- Horio, M., Gottesman, M., Pastan, I. ATP-dependent transport of vinblastine in vesicles from human multidrug-resistant cells. Proceedings of the National Academy of Sciences of the United States of America. 85 (10), 3580-3584 (1988).
- Mimmack, L., et al. Energy coupling to periplasmic binding protein-dependent transport systems: stoichiometry of ATP hydrolysis during transport in vivo. Proceedings of the National Academy of Sciences of the United States of America. 86 (21), 8257-8261 (1989).
- Grundy, M. Absorption and Metabolism of Dietary Cholesterol. Annual Review of Nutrition. 3 (1), 71-96 (1983).
- Berge, E., et al. Accumulation of dietary cholesterol in sitosterolemia caused by mutations in adjacent ABC transporters. Science. 290 (5497), 1771-1775 (2000).
- Repa, J., et al. Regulation of ATP-binding cassette sterol transporters ABCG5 and ABCG8 by the Liver X receptors α and β. Journal of Biological Chemistry. 277 (21), 18793-18800 (2002).
- Yu, L., et al. Stimulation of cholesterol excretion by the Liver X receptor agonist requires ATP-binding cassette transporters G5 and G8. Journal of Biological Chemistry. 278 (18), 15565-15570 (2003).
- Yu, L., et al. Expression of ABCG5 and ABCG8 is required for regulation of biliary cholesterol secretion. Journal of Biological Chemistry. 280 (10), 8742-8747 (2005).
- Lütjohann, D., Björkhem, I., Beil, F., von Bergmann, K. Sterol absorption and sterol balance in phytosterolemia evaluated by deuterium-labeled sterols: effect of sitostanol treatment. Journal of Lipid Research. 36 (8), 1763-1773 (1995).
- Miettinen, A. Phytosterolaemia, xanthomatosis and premature atherosclerotic arterial disease: a case with high plant sterol absorption, impaired sterol elimination and low cholesterol synthesis. European Journal of Clinical Investigation. 10 (1), 27-35 (1980).
- Salen, G., et al. Sitosterolemia. Journal of Lipid Research. 33 (7), 945-955 (1992).
- Caffrey, M. Membrane protein crystallization. Journal of Structural Biology. 142 (1), 108-132 (2003).
- Michel, H. Crystallization of membrane proteins. Trends in Biochemical Sciences. 8 (2), 56-59 (1983).
- Dürr, N., Gildenberg, M., Ramamoorthy, A. The magic of bicelleslights up membrane protein structure. Chemical Reviews. 112 (11), 6054 (2012).
- Dürr, N., Soong, R., Ramamoorthy, A. When detergent meets bilayer: Birth and coming of age of lipid bicelles. Progress in nuclear magnetic resonance spectroscopy. 69 (1), 1-22 (2013).
- Dufourc, J. Bicelles and nanodiscs for biophysical chemistry. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1863 (1), 183478 (2021).
- Beaugrand, M., et al. Lipid concentration and molar ratio boundaries for the use of isotropic bicelles. Langmuir. 30 (21), 6162-6170 (2014).
- Sanders, R., Schwonek, P. Characterization of magnetically orientable bilayers in mixtures of dihexanoylphosphatidylcholine and dimyristoylphosphatidylcholine by solid-state NMR. Biochemistry. 31 (37), 8898-8905 (1992).
- Seddon, M., Curnow, P., Booth, J. Membrane proteins, lipids and detergents: not just a soap opera. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1666 (1-2), 105-117 (2004).
- Farhat, D., et al. Structural analysis of cholesterol binding and sterol selectivity by ABCG5/G8. Journal of Molecular Biology. 434 (20), 167795 (2022).
- Lee, J. Y., et al. Crystal structure of the human sterol transporter ABCG5/ABCG8. Nature. 533 (7604), 561-564 (2016).
- Ujwal, R., Bowie, U. Crystallizing membrane proteins using lipidic bicelles. Methods. 55 (4), 337-341 (2011).
- Johnson, H., Lee, J. Y., Pickert, A., Urbatsch, L. Bile acids stimulate ATP hydrolysis in the purified cholesterol transporter ABCG5/G8. Biochemistry. 49 (16), 3403-3411 (2010).
- Wang, Z., et al. Purification and ATP hydrolysis of the putative cholesterol transporters ABCG5 and ABCG8. Biochemistry. 45 (32), 9929-9939 (2006).
- Faham, S. Crystallization of bacteriorhodopsin from bicelle formulations at room temperature. Protein Science. 14 (3), 836-840 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved