בדיקת מיקרוגרעין על דם מלא בהקפאה
In This Article
Summary
כאן אנו מציגים פרוטוקול אופטימלי לבדיקת מיקרוגרעין בלוק ציטוקינזיס על דגימות דם שלמות שמורות בהקפאה. שיטה אופטימלית זו של שימור בהקפאה של דם שלם לניתוח מיקרוגרעין היא טכניקה אמינה עבור דגימה בקנה מידה גדול ומחקרים רב-מרכזיים, וניתן להשתמש בה גם עבור בדיקות אחרות הקשורות לדם.
Abstract
בדיקת מיקרוגרעין בלוק ציטוקינזיס במבחנה (CBMN) היא טכניקה נפוצה במחקר רדיוביולוגי, דוזימטריה ביולוגית, מחקרי גנוטוקסיות ובדיקות רגישות לקרינה במבחנה . שיטה ציטוגנטית זו מבוססת על איתור מיקרו-גרעינים בתאים דו-ספרתיים הנובעים מפיגור במקטעים כרומוזומליים במהלך חלוקת התא. דגימות דם שלמות טריות הן סוג הדגימה המועדף ביותר לבדיקת CBMN. עם זאת, החסרונות של עבודה עם דגימות דם טריות כוללים עיבוד מיידי לאחר איסוף הדם ואת המספר המוגבל של ניתוחים חוזרים שניתן לבצע ללא דגימת דם נוספת.
מכיוון שהצורך בדגימות דם טריות יכול להיות מאתגר מבחינה לוגיסטית, בדיקת CBMN על דגימות דם שלמות בהקפאה תהיה בעלת יתרון גדול, במיוחד במחקרי חולים בקנה מידה גדול. מאמר זה מתאר פרוטוקול להקפאת דגימות דם שלמות ולביצוע בדיקת CBMN על דגימות דם קפואות אלה. דגימות דם ממתנדבים בריאים הוקפאו והופשרו בנקודות זמן שונות ולאחר מכן, עברו פרוטוקול בדיקת מיקרו-גרעין שונה. התוצאות מראות כי הליך אופטימלי זה מאפשר ביצוע של בדיקת CBMN על דגימות דם קפואות. פרוטוקול ההקפאה המתואר עשוי להיות שימושי מאוד גם עבור בדיקות ציטוגנטיות אחרות ומגוון בדיקות פונקציונליות הדורשות לימפוציטים מתרבים.
Introduction
מאז גילויו, השימוש בקרינה מייננת (IR) היה נושא לוויכוח בקרב חוקרים בגלל ההשפעות השליליות שלה על יצורים חיים. ההשפעה המזיקה מתבטאת בדרך כלל בנזק לדנ"א כגון שברים דו-גדיליים (DSBs), והכישלון לתקן DSB אלה מוביל לסטיות כרומוזומליות ומוטציות, שהן סימני היכר חשובים של סרטן 1,2. סטיות כרומוזומליות כאלה יכולות להיבחן על ידי בדיקות ציטוגניות כגון בדיקת מיקרוגרעין בלוק ציטוקינזיס (CBMN). מיקרו-גרעינים הם מקטעים כרומוזומליים מפגרים שלא ניתן לשלב אותם בגרעין הבת ולכן נשארים מאחור במהלך מיטוזה.
CBMN היא טכניקה ציטוגנטית נפוצה ואמינה להערכת נזק כרומוזומלי אצל אנשים שנחשפו לקרינה מייננת in vivo או in vitro. ניתן להשתמש בדם מלא טרי או בתאי דם חד-גרעיניים היקפיים מבודדים (PBMCs) בבדיקת CBMN. דם מלא טרי הוא בעיקר החומר הביולוגי הנבחר, שכן בידוד ועיבוד של PBMCs יכול לקחת זמן רב והוא מלווה באובדן פלזמה בסרום המשמש כמדיום תומך להישרדות תאים וגדילה. כדי להשיג תפוקת תאים binucleated טוב, דם שלם טרי צריך להיות מעובד מיד לאחר האיסוף. עם זאת, הצורך בעיבוד מיידי יכול להיות מאתגר מבחינה לוגיסטית במהלך אילוצי זמן. יתר על כן, כאשר דגימות רבות אמורות להירכש במשך תקופה ממושכת או להיאסף בנקודות מרוחקות ממרכזי העיבוד, אחסון דגימות דם טריות יכול להיות גורם מגביל 3,4.
יתר על כן, כדי לאפשר ניתוח MN חוזר באותו אדם / חולה, הקפאה של דגימות דם תהיה מועילה. אחת הדרכים לאחסן לימפוציטים ליישום מאוחר יותר של בדיקת CBMN היא על ידי הקפאת PBMCs 5,6 מבודדים. טכניקה זו, עם זאת, דורשת מספר שלבי עיבוד לפני שניתן יהיה להקפיא את PBMCs. לכן, שימור בהקפאה של דם שלם יהווה חלופה פשוטה וחסכונית בזמן לשימור בהקפאה של PBMCs מבודדים. מידע מועט זמין בנוגע לשימוש בדם שלם קפוא עבור בדיקות ציטוגנטיות או בדיקות הדורשות התפשטות של לימפוציטים. רק מאמר אחד מדווח על שימוש בדם שלם בהקפאה לניתוח מטאפאזות7.
מכיוון ששימור קריוגני של דם שלם יציע יתרונות רבים בתחום הניטור הביולוגי, הביודוזימטריה והערכת רגישות רדיו, הקבוצה שלנו ביצעה אופטימיזציה של פרוטוקול שימור קריוגני לדם שלם המאפשר יישום של בדיקת CBMN8. הראינו כי לימפוציטים הנמצאים בתרביות דם שלמות בהקפאה שומרים על שלמותם הגנומית ועל יכולת ההתרבות שלהם למשך שנה אחת לפחות. במאמר שיטות זה, אנו מתארים בפירוט את הליך השימור בהקפאה ואת פרוטוקול בדיקת CBMN, אשר עבר אופטימיזציה על ידי Beyls et al.8, ומדווחים על ממצאים שהתקבלו עבור דגימות דם קפואות של 30 אנשים בריאים. עבור בדיקת CBMN, תרביות הדם הוקרנו במבחנה עם מינונים של 0.5, 1 ו -2 Gy כדי להעריך את תגובת MN בלימפוציטים של דגימות דם שלמות בהקפאה.
Protocol
לצורך מחקר זה, דגימות דם נאספו על ידי venipuncture מ -30 תורמים בריאים בגילאי 17 עד 65 שנים. נעשה שימוש חוזר בנתוני MN מ -20 תורמים מהמאמר של Beyls et al.8 איסוף דגימות הדם הוא בהתאם להנחיות ועדת האתיקה של בית החולים האוניברסיטאי גנט (מספר רישום:2019/1565), בלגיה. התקבלה הסכמה מדעת בכתב מכל המשתתפים. עיין בטבלת החומרים לקבלת פרטים הקשורים לכל החומרים והריאגנטים המשמשים בפרוטוקול זה.
1. איסוף דגימות דם
- לפני שמתחילים, ודא כי הסכמה מדעת בכתב של המשתתפים זמינה והנחיות אתיות נשמרות כראוי.
- יש לאסוף דם לתוך צינורות Li-Heparin ולאחסן בטמפרטורת החדר עד שהוא מוכן לעיבוד לצורך שימור בהקפאה.
2. שימור בהקפאה של דם שלם
הערה: כל השלבים עד לקצירת תאים מבוצעים באופן אספטי בזרימת אוויר למינרית סטרילית.
- כדי לשמור בהקפאה 1 מ"ל של דם, לעשות 1 מ"ל של מדיום הקפאה על ידי ערבוב 800 μL של סרום עגל העובר (FCS) ו 200 μL של dimethyl sulfoxide (DMSO).
הערה: מדיום ההקפאה מוכן בנפח השווה לדגימות הדם שיש להקפיא. - להקפאה של דם שלם, להעביר את דגימת הדם מן הצינור heparinized 15 או 50 מ"ל צינורות צנטריפוגות
הערה: קיבולת הצינור תלויה בנפח הדם. - מערבלים את הדם במהירות נמוכה עם תוספת רציפה אך טיפתית של נפח שווה של מדיום הקפאה.
- העבר 2 מ"ל של תערובת הקפאת דם לתוך cryovials (2 מ"ל) שבו כל aliquot יש 1 מ"ל של דגימת דם מעורבב עם 1 מ"ל של תערובת הקפאה.
- הקפאה הדרגתית הדרגתית
- מעבירים את הקריוביאלים לקופסה קריובית המכילה איזופרופנול ומכניסים למקפיא (-80°C) למשך הלילה.
- העבר את הקריובלים לחנקן נוזלי לשימוש ארוך טווח.
3. הפשרת דם בהקפאה
הערה: כדי להגביל את הזמן הכולל של תהליך ההפשרה, יש לטפל במקסימום של 8 קריובלים (2 מ"ל כל אחד) בכל פעם.
- הכנה
- יש לחמם מראש 200 מ"ל של מלח סטרילי חוצץ פוספט (PBS) ל-37°C לפני הפשרת הדם.
- להכין פתרון עבודה של מדיום התרבות הנדרש בתנאים סטריליים. ודא כי בינוני לכל תרבית כולל 1.6 מ"ל של מדיום מלא: Rosewell Park Memorial Institute (RPMI) מדיה בתוספת פניצילין/סטרפטומיצין (0.5%), 0.2 מ"ל של FCS, 20 μL של נתרן פירובט, ו 2 μL של β-mercaptoethanol.
הערה: מכיוון שמספר משמעותי של תאי דם יכול ללכת לאיבוד בזמן ההפשרה, הדם המופשר מתורבת בבארות קטנות כמו צלחות 24 בארות בנפח כולל של 2 מ"ל. צלחת אחת מרובת באר לכל מנה משמש. - עבור כל תרבית, ציינו היטב את קוד התורם ואת A/B על המכסה יחד עם התאריך והמנה, כפי שמוצע להלן (איור 1).
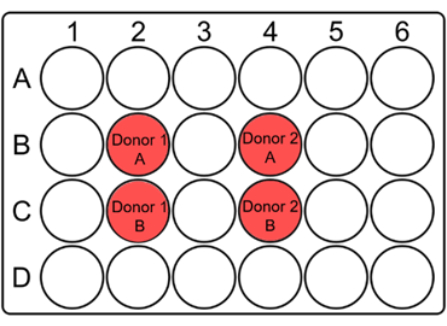
איור 1: פריסה מוצעת של צלחת בת 24 בארות לתרבית דם שלם עבור בדיקת המיקרוגרעין. סמן את הבארות וציין את קודי התורם במקומות המתאימים על המכסה. עבור כל דגימת חולה, בארות כפולות צריכות להיות צמודות זו לזו. שים לב שזוהי פריסה סוגסטיבית עבור קולימטור 10 x 10 וניתן לשנות אותה בהתאם לגודל הקולימטור או הדגימות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- צעדים להפשרה וגידול דם שלם
- מחממים את אמבט המים ל 37 °C (77 °F).
- הוציאו את הקריובלים הנדרשים מהחנקן הנוזלי (המספר תלוי בדרישות כגון מספר המנות).
הערה: קריוביאל אחד מכיל 1 מ"ל דם ו-1 מ"ל מדיום הקפאה. לכן, שתי תרביות ניתן להגדיר עם דם מ cryovial אחד. - הפשירו חלקית את הקריובלים באמבט המים החמים (עד שעדיין יראו גבישי קרח קטנים).
- הוציאו את הבקבוקונים מאמבט המים ונקו את החלק החיצוני של הבקבוקונים בנייר טישו סטרילי.
- במכסה מנוע זרימת אוויר למינרי סטרילי , פתח את הבקבוקונים לאט מאוד כדי למנוע מבועות אוויר שנוצרו בתוך הצינורות להישפך החוצה.
- להשעות מחדש את התוכן של כל בקבוקון ולהעביר אותם בנפרד לצינור צנטריפוגה חרוטי 15 מ"ל (1 צינור לכל בקבוקון).
- לצינורות המתאימים, הוסף טיפה 1 מ"ל של PBS חם (37 ° C) תוך ערבול עדין של הצינור. השהה מחדש עם פיפטה P1000.
- לדילול ושטיפה אחידה, יש להוסיף 7 מ"ל PBS שחומם מראש (37°C) ולהשהות מחדש עם פיפטה P1000.
- צנטריפוגה את הדם במשך 8 דקות ב 180 × גרם (עם הגדרה בהאצה 1, בלם 1) בטמפרטורת החדר.
- במהלך שלב המתנה זה, מלא את הבארות הריקות (מלבד זו שבה תאים יוגדלו בתרבית) עם 500 μL של PBS.
- מחזירים את צלחות הבאר לאינקובטור לחימום מוקדם.
- לאחר השלמת הצנטריפוגה, בזהירות להסיר את supernatant, משאיר מאחור כ 1 מ"ל כדי למנוע הפרעה כדור התא.
- השהה מחדש את הגלולה בסופרנאטנט שנותר עם פיפטה P1000.
- הוסף טיפות 8 מ"ל של PBS חם (37 ° C) לתוך הצינורות המתאימים תוך ערבול עדין של הצינורות. לאחר מכן, השהה מחדש עם פיפטה P1000.
- צנטריפוגה את הדם המושעה למשך 8 דקות ב 180 × גרם (עם הגדרה בהאצה 9, בלם 9).
- במהלך שלב המתנה זה, העבירו 200 מיקרוליטר של מדיום תרבית לכל אחת מהבארות המסומנות.
- שמור את הצלחות בחזרה באינקובטור כדי להישאר ב 37 ° C.
- לאחר הצנטריפוגה, הסירו את הסופרנאטנט בתנועה רציפה (כדי למנוע הפרעה לכדורית התא הרופפת), אך השאירו מאחור כ-80 מיקרוליטר של הסופרנטנט.
- לכדור, הוסף 280 μL של FCS (טמפרטורת החדר) והשהה מחדש (לנפח כולל של 360 μL).
- מעבירים 180 μL של תרחיף התא לכל באר ומשהה מחדש (= 0.5 מ"ל של "דם" / תרבית). הנפח הכולל בכל באר הוא כעת 380 μL, והתוצאה היא שכבה בינונית של 2 מ"מ.
- לדגור את הצלחות באינקובטור CO2 ב 37 ° C לפחות 10 דקות לפני הקרנה.
4. בדיקת G0 MN
- מוציאים את הצלחות מהאינקובטור ומקרינים את תרבית התאים במינונים נדרשים כגון צילומי רנטגן 0.5, 1 ו-2 Gy (220 kV, 13 mA, 0.15 mm Cu) בטמפרטורת החדר. השתמש בדגימות מוקרנות דמה כבקרות לזיהוי תפוקות MN ספונטניות.
- מיד לאחר הקרינה, להוסיף 1.62 מ"ל של מדיום תרבית (37 ° C) לכל באר.
- כדי לעורר את חלוקת התא בלימפוציטים מסוג T, הוסף 40 μL של Phytohemagglutinin (PHA) לכל באר והשהה מחדש ביסודיות.
- מניחים את הלוחות האלה בחזרה באינקובטור (5% CO2, 37 ° C).
הערה: זו תהיה שעת ההתחלה של הבדיקה. - חסום את הציטוקינזיס 23 שעות לאחר הגירוי על ידי הוספת 8 μL של ציטוכלסין B (6 מיקרוגרם / מ"ל) לכל באר והשהה מחדש כראוי.
- קצרו את תרביות התאים 70 שעות לאחר הגירוי/זמן התרבית. השהה מחדש והעבר את התאים לצינור של 15 מ"ל. שטוף כל באר עם 2 מ"ל של PBS והוסף PBS זה לצינור המתאים 15 מ"ל.
- צנטריפוגה את הצינורות במשך 8 דקות ב 180 × גרם, בטמפרטורת החדר.
- יש להשליך את הסופרנאטנט אך להשאיר כ-500 מיקרוליטר מעל הכדורית.
- מערבלים את הגלולה (במלוא המהירות) ותוך כדי מערבולת, מוסיפים באיטיות 2 מ"ל אשלגן כלורי קר (KCl, 4 מעלות צלזיוס).
- מיד צנטריפוגה את התאים ב 180 × גרם במשך 8 דקות.
- השליכו את הסופרנטנט, והשאירו בערך 500 מיקרוליטר של הסופרנטנט.
- מערבלים את הגלולה (במלוא המהירות) ותוך כדי מערבולת, מוסיפים באיטיות 2 מ"ל של קיבוע קר 1 (מתנול/חומצה אצטית/תמיסת רינגר ביחס של 4:1:5).
- השאר את צינורות הדגימה למשך הלילה ב 4 ° C (מינימום 12 שעות ומקסימום 96 שעות).
- צנטריפוגה למשך 8 דקות ב 180 × גרם.
- השליכו את הסופרנטנט.
- מערבלים את הגלולה (במלוא המהירות) ותוך כדי ערבול, מוסיפים באיטיות 2 מ"ל של קיבוע קר 2 (מתנול/חומצה אצטית ביחס של 4:1).
- צנטריפוגה למשך 8 דקות ב 180 × גרם.
- השליכו את הסופרנטנט.
- מערבלים את הגלולה (במלוא המהירות) ואז מוסיפים לאט (טיפה), תוך כדי מערבולת, 2 מ"ל של קיבוע קר 2 לכדור.
- השאר את צינורות הדגימה ב 4 ° C (מינימום 12 שעות ומקסימום 96 שעות).
- נקה את המגלשות עם איזופרופנול ותייג אותן כראוי.
הערה: השתמש במדבקות מודפסות כדי לתייג מכיוון שדיו סמן נמחק בקלות במהלך העיבוד. - צנטריפוגה את צינורות הדגימה במשך 8 דקות ב 180 × גרם.
- מעבירים את הסופרנאטנט לצינור אחר כדי לרכז את התאים בהתאם לגודל הכדורית.
- מערבלים את הכדור.
- זרוק 40 μL של התאים הקבועים על שקופית יבשה ונקייה.
- הניחו למגלשות להתייבש בטמפרטורת החדר. אחסנו את השקופיות בקופסה או בכתם מיד לצורך התבוננות.
5. צביעת תפוז אקרידין (AO)
- טבלו את המגלשות בכתם AO למשך דקה אחת, ולאחר מכן שטפו במהירות את המים המזוקקים, ולאחר מכן, הניחו את המגלשות במאגר פוספט (pH 6.8) למשך דקה אחת.
- הוציאו את השקופיות מתמיסת החיץ ובעזרת נייר טישו נקי, יבשו את גב המגלשות והניחו את השקופיות על נייר טישו נקי.
- זרוק 20 μL של חיץ הפוספט על גבי המגלשה וכסה אותו בעדינות עם כיסוי נקי, תוך הימנעות מבועות אוויר.
- אטמו את המגלשות הללו במלט סיליקון.
הערה: מכיוון ש-AO רגיש לאור ודוהה עם הזמן, לקבלת ניגודיות יפה ופלואורסצנטיות, מומלץ להבקיע את השקופיות תוך 5 ימים מרגע הצביעה. יש לאחסן תמיד שקופיות בחדר קר (4°C), כאשר הן אינן נבדקות.
6. ניקוד שקופיות מוכתמות
- מקם את השקופית תחת מיקרוסקופ פלואורסצנטי ובחן 1,000 תאים דו-חיים (BN). ספירה ידנית של MNs, שהם אחד מששת הסמנים הביולוגיים של רעילות. כדי לעשות זאת, בקש משני קלעים עצמאיים לבחון 500 תאי BN / להחליק תחת אותה הגדלה.
הערה: להלן כמה דגשים של קריטריוני הניקוד, כפי שהומלץ על ידי Fenech כדי לתת ניקוד לשקופיות המוכתמות9- בחר תא BN על ידי חיפוש תאים מעוגלים יפה עם ציטופלסמה שלמה, עם שני גרעינים מובחנים היטב בערך באותו גודל, צורה רגילה ותבנית צביעה. ודא כי הציטופלסמה של תא BN ניתנת להבחנה מהציטופלסמה של התא הסמוך.
- ציון MN, וציין כי הוא זהה מורפולוגית לגרעינים הראשיים אך קטן מהם; אפילו MN הגדול ביותר לא יכול להיות יותר מ 1/3 מקוטר הגרעינים הראשיים. ציון MN רק אם הוא אינו נוגע בגרעינים הראשיים או לפחות ניתן להבחין בין הגבול המיקרו-גרעיני לבין גבול הגרעינים הראשיים.
Representative Results
כדי לאמת את יכולת השחזור של הפרוטוקול, ביצענו את בדיקת MN על דגימות דם שמורות בהקפאה של 30 מתנדבים בריאים בגילאי 17 עד 65 שנים. הגיל הממוצע של הקבוצה הוא 35 שנים. זמן ההקפאה נע בין שבוע אחד ל -154 שבועות. לאחר חשיפת כל תרבית תאי הדם למנות קרינה שונות (0.5, 1 ו-2 Gy), נבדקה תחת מיקרוסקופ תפוקת המיקרו-גרעינים ב-1,000 תאי BN. תאים דו-חיים מעוגלים יפה (כפי שניתן לראות באיור 2) מצביעים על שליפה מוצלחת של תאים בריאים בני קיימא מדגימות דם שלמות שמורות בהקפאה. יש לציין כי תגובת הקרינה של לימפוציטים נותרה יציבה לאחר אחסון ארוך טווח בטמפרטורות נמוכות במיוחד (חנקן נוזלי). תצפית זו עולה בקנה אחד עם התגובה הצפויה מדגימות דם טריות.
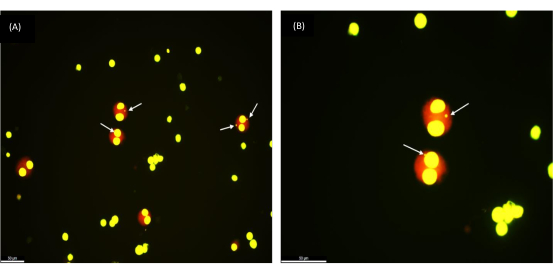
איור 2: מיקרו-גרעינים כפי שנצפו בתאים דו-חיים שנלקחו מדגימת דם שלם קפואה שנשמרה בהקפאה לפני שנה. (א) הגדלה פי 200, (ב) הגדלה פי 400; חצים המצביעים על MNs. סרגל קנה מידה = 50 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
עם מינונים מוגברים של קרינה (0.5, 1 ו-2 Gy), נצפתה עלייה ליניארית-ריבועית בתפוקת המיקרו-גרעין (טבלה 1 ואיור 3). תשואות MN בדגימות בקרה מוקרנות דמה (0 Gy) מייצגות את תשואות MN הרקע שהן בעיקר תוצאה של כרומוזומים מפגרים .
| מינון (Gy) | 0 | 0.5 | 1 | 2 |
| ממוצע | 18 | 107 | 247 | 601 |
| SD | 10.8 | 23.9 | 53.3 | 101.1 |
| קורות חיים (%) | 59.9 | 22.3 | 21.6 | 16.8 |
| טווח | 5-41 | 62-140 | 139-324 | 395-755 |
טבלה 1: טווח ומקדם השונות יחד עם תפוקת MN ממוצעת, כפי שנצפתה בדגימות דם שלמות בהקפאה של 30 תורמים בריאים, דבר המעיד על שונות בין-אישית. קיצורים: CV = מקדם שונות; SD = סטיית תקן.
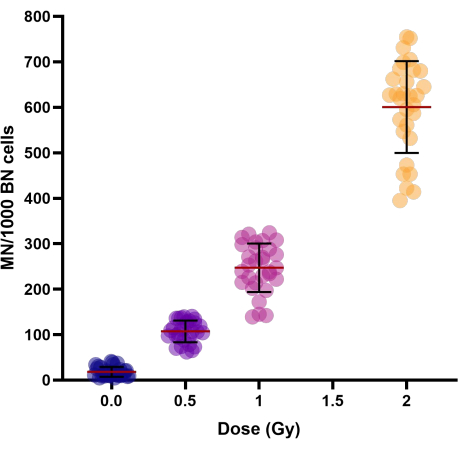
איור 3: מיקרו-גרעינים מניבים כפי שנצפו בבקרה והקרינו דגימות דם שלמות בהקפאה של 30 תורמים. תקופות ההקפאה נעו בין שבוע אחד ל -154 שבועות. תרשים התוויית פיזור מציג ערכים בודדים. קווים באשכולות מייצגים את ממוצע ± SD של הקבוצה. קיצורים: MN = מיקרו-גרעינים; BN = משקפת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כדי לחקור את השונות הבין-אינדיבידואלית בתשואת MN של אנשים, חושב מקדם השונות (CV) (ראה טבלה 1). עבור MN המושרה על ידי קרינה, CV < 25% התקבל עבור כל המינונים (0.5, 1, ו 2 Gy), אשר מצביע על שחזור טוב של פרוטוקול שונה.
Discussion
הפרוטוקול המתוקן ליישום בדיקת CBMN הוא דרך קלה ונוחה יחסית לאחסון דגימות דם בכמויות גדולות. הנוהל מתאר את כל הפרטים הקטנים אך החשובים שיש לטפל בהם במהלך ההקפאה ובדיקת CBMN. פרוטוקולי מעבדה אחרים משתמשים בדרך כלל ב-10% DMSO בתערובת ההקפאה, בעוד שתערובת ההקפאה שלנו מכילה 20% DMSO יחד עם 80% FCS7. מכיוון שתערובת הקפאה זו מתווספת בכמויות שוות לדגימת הדם כולה, הריכוז הסופי הוא גם 10% DMSO. כדי לשפר את שיעור הישרדות התאים ולעורר את חלוקת התא, אנו מוסיפים 1% נתרן פירובט ו-0.1% בטא-מרקפטואתנול למדיום התרבית המלאה (cRPMI). זאת בהתאם לפרוטוקול תרביות התאים שנקבע על ידי קבוצת המחקר שלנו 6,8.
למרות שלא ניתן היה לפתור לחלוטין את בעיית התגבשות התאים בזמן ההפשרה בפרוטוקול זה, הפרדת התאים הייתה טובה יותר מהפרוטוקולים הקונבנציונליים האחרים. במקום הוספה עקבית ופתאומית של אמצעי תרבית כדי לשחזר תאים לאחר ההפשרה, השגנו תוצאות טובות יותר כאשר PBS שחומם מראש (37 מעלות צלזיוס) נוסף בטיפות במהלך שלבי השטיפה. שיפור זה מסייע בהפחתת מתח תאי וממזער גושים עם התאוששות גבוהה מוכחת של תאים. יתר על כן, לא ניתן היה להבחין בהבדל ברור בכדאיות התא כאשר PBS היה בשימוש על RPMI. הקבוצה אימתה כי אורך תקופת השימור בהקפאה (עד שנה) לא ישפיע על תפוקת MN, הן בדגימות מוקרנות והן בדגימות שאינן מוקרנות 6,8. מחקרים מראים כי ניתן להשיג יכולת קיום תאים טובה ושגשוג של PBMCs באמצעות הקפאה הדרגתית בטמפרטורות נמוכות (חנקן נוזלי), ולאחר מכן הוספה הדרגתית של מדיום שחומם מראש תוך הפשרת10,11. חוקרים הראו כי תת-האוכלוסיות של לימפוציטים מסוג T בדם מלא מופשר דומות לאלה שנצפו ב-PBMCs12 מופשר. יתר על כן, הוכח כי תת-סוגים של תאים שנמצאו מדגימות דם שלמות שנשמרו בהקפאה דומים לאלה שנצפו בדגימות דם שלמות טריות13,14.
אם נבחן את התוצאות האינדיקטיביות שהתקבלו בדו"ח, נראה שהגידול הריבועי הליניארי עם המינון (איור 3) תואם לדוחות ספרות אחרים על מיקרו-גרעינים15,16 המושרים על ידי העברת אנרגיה ליניארית (LET). השונות בתפוקת MN שנצפתה בדגימות הדם השלמות השמורות בהקפאה (טבלה 1) נמצאת בטווח עם זו שדווחה עבור תרביות דם שלמות טריות 8,17,18. הפרוטוקול המתואר בפירוט כאן אומת על דם מלא טרי ושמור בהקפאה של 20 מתנדבים בריאים8. מדד החלוקה הגרעינית (NDI), שהוא פרמטר חשוב של תפוצת תאים שנצפה באותו דו"ח8 היה תואם את זה שהוצע עבור דם מלא טרי19,20. יחד, פרוטוקול אופטימלי זה של שימור בהקפאה של דם שלם ובדיקת מיקרו-גרעין שונה מספק תפוקת תאים טובה יותר ולכן מומלץ להתאים פרוטוקול זה להערכות רגישות לרדיו. מכיוון שיכולת השחזור של הפרוטוקול כבר אומתה8, מוצע שיש לו ישימות במחקרים בקנה מידה גדול ורב-מרכזי.
Disclosures
למחברים אין ניגודי עניינים להצהיר.
Acknowledgements
המחברים רוצים להודות ל-L. Pieters, T. Thiron ו-G. De Smet על תמיכתם הטכנית. אנו מודים לכל המתנדבים שתרמו דם למחקר. העבודה נתמכה כספית על ידי קרן המחקר פלנדריה (FWO) תחת גרנט (T000118N).
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tubes | Greiner | 188271 | |
| 24-well cell suspension plate | VWR | 734-2779 | |
| 96% alcohol | ChemLab | CL00.1807.2500 | |
| Acetic acid | Merck life science | 8,18,75,52,500 | |
| Acridine orange | Merck life science | 235474-5g | |
| CaCl2 | Merck life science | C5670-100g | |
| cover slips | VWR | 631-1365 | 22 x 50 |
| Cryobox (Mr.Frosty) | Nalgene, Sigma Aldrich | ||
| Cryovials 2ml | Novolab | A04573 | |
| Cytochalsin B | Merck life science | C6762-10 | 10 mg |
| Dimethyl sulphoxide (DMSO) | Merck life science | D4540-500ml | |
| Fetal calf serum (FCS) | Thermo Fischer scientific | 10270-106 | |
| Fixative 1 | Methanol/acetic acid/ringer in a ratio of 4:1:5 | ||
| Fixative 2 | Methanol/acetic acid in a ratio of 4:1 | ||
| GURR buffer | Thermo Fischer scientific | 10582013 | phosphate buffer (pH 6.8) |
| KCl | Merck life science | 1,04,93,60,250 | 75 mM |
| KH2PO4 | Merck life science | 1,04,87,30,250 | |
| Li-heparin tubes | BD Life sciences | 367526-LH170 I.U. | BD Vacutainer |
| Methanol | fisher scinetific | M/4000/17 | |
| Na2HPO2 | Merck life science | 10,65,80,500 | |
| NaCl | Merck life science | S7653-1kg | |
| Object slides | VWR | MENZAA00000112E04 | |
| Penicillin/Streptomycin | Thermo Fischer scientific | 15140-122 | 10,000 U/mL + 10,000 µg/mL |
| Phytohemagglutinin (PHA-M) | Thermo Fischer scientific | 10576-015 | |
| Ringer solution | contains NaCl, KCl, CaCl2 dissolved in distilled water | ||
| RPMI-1640 | Thermo Fischer scientific | 52400041 | |
| Silicon rubber adhesive sealent | collall | CF-100 | |
| Sodium pyruvate | Thermo Fischer scientific | 11360039 | |
| Sterile warm PBS (37 °C) | contains NaCl, Na2HPO2, KH2PO4 dissolved in distilled water | ||
| β-mercaptoethanol | Thermo Fischer scientific | 31350-010 |
References
- Grade, M., Difilippantonio, M. J., Camps, J. Patterns of chromosomal aberrations in solid tumors. Recent Results in Cancer Research. 200, 115-142 (2015).
- Jiao, Y., Cao, F., Liu, H. Radiation-induced cell death and its mechanisms. Health Physics. 123 (5), 376-386 (2022).
- Roederer, M., et al. The genetic architecture of the human immune system: a bioresource for autoimmunity and disease pathogenesis. Cell. 161 (2), 387-403 (2015).
- Bankoglu, E. E., et al. Effect of cryopreservation on DNA damage and DNA repair activity in human blood samples in the comet assay. Archives of Toxicology. 95, 1831-1841 (2021).
- Zijno, A., Saini, F., Crebelli, R. Suitability of cryopreserved isolated lymphocytes for the analysis of micronuclei with the cytokinesis-block method. Mutagenesis. 22, 311-315 (2007).
- Sioen, S., Cloet, K., Vral, A., Baeyens, A. The cytokinesis-block micronucleus assay on human isolated fresh and cryopreserved peripheral blood mononuclear cells. Journal of Personalized Medicine. 10 (3), 125 (2020).
- Cheng, L., Wang, L. E., Spitz, M. R., Wei, Q. Cryopreserving whole blood for functional assays using viable lymphocytes in molecular epidemiology studies. Cancer Letters. 166 (2), 155-163 (2001).
- Beyls, E., Baeyens, A., Vral, A. The cytokinesis-block micronucleus assay for cryopreserved whole blood. International Journal of Radiation Biology. 97 (9), 1252-1260 (2021).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nature Protocols. 2 (5), 1084-1104 (2007).
- Ramachandran, H., et al. Optimal thawing of cryopreserved peripheral blood mononuclear cells for use in high-throughput human immune monitoring studies. Cells. 1 (3), 313-324 (2012).
- Hønge, B. L., Petersen, M. S., Olesen, R., Møller, B. K., Erikstrup, C. Optimizing recovery of frozen human peripheral blood mononuclear cells for flow cytometry. PLoS One. 12 (11), e0187440-e0187517 (2017).
- Alam, I., Goldeck, D., Larbi, A., Pawelec, G. Flow cytometric lymphocyte subset analysis using material from frozen whole blood. Journal of Immunoassay and Immunochemistry. 33 (2), 128-139 (2012).
- Langenskiöld, C., Mellgren, K., Abrahamsson, J., Bemark, M. Determination of blood cell subtype concentrations from frozen whole blood samples using TruCount beads. Cytometry Part B: Clinical Cytometry. 94B, 660-666 (2018).
- Braudeau, C., et al. An easy and reliable whole blood freezing method for flow cytometry immuno-phenotyping and functional analyses. Cytometry Part B: Clinical Cytometry. 100 (6), 652-665 (2021).
- Thierens, H., Vral, A., De Ridder, L. Biological dosimetry using the micronucleus assay for lymphocytes: interindividual differences in dose response. Health Physics. 61 (5), 623-630 (1991).
- Vral, A., Fenech, M., Thierens, H. The micronucleus assay as a biological dosimeter of in vivo ionising radiation exposure. Mutagenesis. 26 (1), 11-17 (2011).
- Vral, A., Thierens, H., Baeyens, A., De Ridder, L. The micronucleus and G2-phase assays for human blood lymphocytes as biomarkers of individual sensitivity to ionizing radiation: limitations imposed by intraindividual variability. Radiation Research. 157 (4), 472-477 (2002).
- Pajic, J., et al. Inter-individual variability in the response of human peripheral blood lymphocytes to ionizing radiation: comparison of the dicentric and micronucleus assays. Radiation and Environmental Biophysics. 54, 317-325 (2015).
- Fenech, M., et al. Intra- and inter-laboratory variation in the scoring of micronuclei and nucleoplasmic bridges in binucleated human lymphocytes: results of an international slide-scoring exercise by the HUMN project. Mutation Research. 534 (1-2), 45-64 (2003).
- Miszczyk, J., Rawojć, K. Effects of culturing technique on human peripheral blood lymphocytes response to proton and X-ray radiation. International Journal of Radiation Biology. 96 (4), 424-433 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved