Микроядерный анализ криоконсервированной цельной крови
In This Article
Summary
Здесь мы представляем оптимизированный протокол микроядерного анализа с блокированием цитокинеза на криоконсервированных образцах цельной крови. Этот оптимизированный метод криоконсервации цельной крови для анализа микроядер является надежным методом для крупномасштабных образцов и многоцентровых исследований, а также может быть использован для других анализов, связанных с кровью.
Abstract
Анализ микроядер с блокированием цитокинеза in vitro (CBMN) является широко используемым методом в радиобиологических исследованиях, биологической дозиметрии, исследованиях генотоксичности и тестировании радиочувствительности in vitro . Этот цитогенетический метод основан на обнаружении микроядер в двуядерных клетках, возникающих в результате отстающих хромосомных фрагментов при клеточном делении. Свежие образцы цельной крови являются наиболее предпочтительным типом образцов для анализа CBMN. Однако к недостаткам работы со свежими образцами крови можно отнести немедленную обработку после забора крови и ограниченное количество повторных анализов, которые можно выполнить без дополнительного забора крови.
Поскольку потребность в свежих образцах крови может быть сложной с точки зрения логистики, анализ CBMN на криоконсервированных образцах цельной крови будет иметь большое преимущество, особенно в крупномасштабных исследованиях пациентов. В данной статье описывается протокол замораживания образцов цельной крови и проведения анализа CBMN на этих замороженных образцах крови. Образцы крови здоровых добровольцев замораживали и размораживали в разные моменты времени, а затем подвергали модифицированному протоколу анализа микроядер. Результаты показывают, что эта оптимизированная процедура позволяет проводить анализ CBMN на замороженных образцах крови. Описанный протокол криоконсервации также может быть очень полезен для других цитогенетических анализов и различных функциональных анализов, требующих пролиферирующих лимфоцитов.
Introduction
С момента своего открытия использование ионизирующего излучения (ИК) было предметом споров среди исследователей из-за его неблагоприятного воздействия на живые существа. Пагубный эффект обычно проявляется повреждением ДНК, таким как двухцепочечные разрывы (DSB), и неспособность восстановить эти DSB приводит к хромосомным аберрациям и мутациям, которые являются важными отличительными признаками рака 1,2. Такие хромосомные аберрации могут быть изучены с помощью цитогенных анализов, таких как анализ микроядер с блокированием цитокинеза (CBMN). Микроядра представляют собой отстающие хромосомные фрагменты, которые не могут быть включены в дочерние ядра и, следовательно, остаются во время митоза.
CBMN является широко используемым надежным цитогенетическим методом для оценки хромосомных повреждений у лиц, подвергшихся воздействию ионизирующего излучения in vivo или in vitro. В анализе CBMN можно использовать как свежую цельную кровь, так и изолированные мононуклеарные клетки периферической крови (PBMC). Свежая цельная кровь в основном является биологическим материалом выбора, поскольку выделение и обработка МПК может занимать много времени и сопровождается потерей сывороточной плазмы, которая действует как поддерживающая среда для выживания и роста клеток. Для достижения хорошего выхода двуядерных клеток свежая цельная кровь должна быть обработана сразу после сбора. Тем не менее, необходимость немедленной обработки может быть сложной с точки зрения логистики в условиях нехватки времени. Более того, когда предполагается, что большое количество образцов будет получено в течение длительного периода времени или собрано в пунктах, удаленных от центров обработки, хранение свежих образцов крови может быть ограничивающим фактором 3,4.
Кроме того, для повторного анализа МН у одного и того же человека/пациента было бы полезно замораживание образцов крови. Одним из способов хранения лимфоцитов для последующего применения анализа CBMN является замораживание изолированных PBMC 5,6. Однако этот метод требует нескольких этапов обработки, прежде чем PBMC можно будет заморозить. Таким образом, криоконсервация цельной крови представляет собой простую и эффективную по времени альтернативу криоконсервации изолированных ПБМК. Имеется мало информации об использовании замороженной цельной крови для цитогенетических анализов или анализов, требующих пролиферации лимфоцитов. Только в одной статье сообщается об использовании криоконсервированной цельной крови для метафазного анализа7.
Поскольку криоконсервация цельной крови дает много преимуществ в области биомониторинга, биодозиметрии и оценки радиочувствительности, наша группа оптимизировала протокол криоконсервации цельной крови, который позволяет применять анализ CBMN8. Мы продемонстрировали, что лимфоциты, присутствующие в криоконсервированных культурах цельной крови, сохраняют свою геномную целостность и способность к пролиферации в течение не менее 1 года. В данной методической работе мы подробно описываем процедуру криоконсервации и протокол анализа CBMN, который был оптимизирован Beyls et al.8, а также сообщаем о результатах, полученных для замороженных образцов крови 30 здоровых людей. Для анализа CBMN культуры крови облучали in vitro дозами 0,5, 1 и 2 Гр для оценки ответа МН в лимфоцитах криоконсервированных образцов цельной крови.
Protocol
Для этого исследования образцы крови были собраны методом венепункции у 30 здоровых доноров в возрасте от 17 до 65 лет. Данные МН от 20 доноров были повторно использованы из статьи Beyls et al.8 Сбор образцов крови осуществляется в соответствии с рекомендациями Комитета по этике Университетской больницы Гента (регистрационный номер: 2019/1565), Бельгия. От всех участников было получено письменное информированное согласие. Смотрите Таблицу материалов для получения подробной информации, связанной со всеми материалами и реагентами, используемыми в этом протоколе.
1. Забор образцов крови
- Перед началом работы убедитесь в наличии письменного информированного согласия участников и надлежащем соблюдении этических норм.
- Соберите кровь в пробирки с литий-гепарином и храните при комнатной температуре до тех пор, пока не будете готовы к переработке для криоконсервации.
2. Криоконсервация цельной крови
ПРИМЕЧАНИЕ: Все этапы до забора клеток выполняются асептически в стерильном ламинарном потоке воздуха.
- Чтобы криоконсервировать 1 мл крови, сделайте 1 мл замораживающей среды, смешав 800 мкл фетальной телячьей сыворотки (FCS) и 200 мкл диметилсульфоксида (DMSO).
ПРИМЕЧАНИЕ: Замораживающая среда готовится в объеме, равном образцам крови, которые необходимо заморозить. - Для криоконсервации цельной крови переложите образец крови из гепаринизированной пробирки в центрифужные пробирки объемом 15 или 50 мл
ПРИМЕЧАНИЕ: Емкость пробирки зависит от объема крови. - Встряхните кровь на низкой скорости с непрерывным, но капельным добавлением равного объема замораживающей среды.
- Перелейте 2 мл смеси для замораживания крови в криовиалы (2 мл), где каждая аликвота содержит 1 мл образца крови, смешанного с 1 мл замораживающей смеси.
- Ступенчатое постепенное замораживание
- Переложите криовиалы в криобокс, содержащий изопропанол, и поместите в морозильную камеру (-80 °C) на ночь.
- Переведите криовиалы в жидкий азот для длительного использования.
3. Размораживание криоконсервированной крови
ПРИМЕЧАНИЕ: Чтобы ограничить общее время процесса размораживания, одновременно следует обрабатывать не более 8 криовиалов (по 2 мл каждый).
- Подготовка
- Перед размораживанием крови разогрейте 200 мл стерильного фосфатно-солевого буфера (PBS) до 37 °C.
- Готовят рабочий раствор необходимой питательной среды в стерильных условиях. Убедитесь, что среда на культуру включает 1,6 мл полной среды: среда Мемориального института Роузвелл-Парк (RPMI) с добавлением пенициллина/стрептомицина (0,5%), 0,2 мл FCS, 20 мкл пирувата натрия и 2 мкл β-меркаптоэтанола.
ПРИМЕЧАНИЕ: Поскольку при размораживании может быть потеряно значительное количество клеток крови, размороженную кровь культивируют в небольших лунках, таких как 24-луночные планшеты общим объемом 2 мл. Используется одна многолуночная пластина на дозу. - Для каждой лунки для посева укажите на крышке код донора и A/B, а также дату и дозу, как указано ниже (рис. 1).
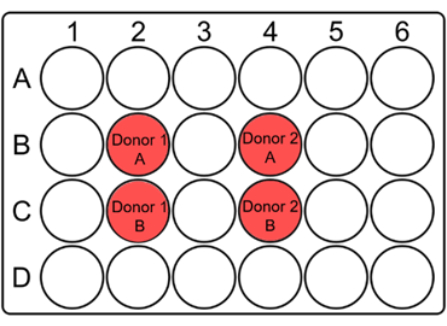
Рисунок 1: Предлагаемая схема 24-луночного планшета для культивирования цельной крови для анализа микроядер. Разметьте лунки и укажите коды доноров в соответствующих местах на крышке. Для каждого образца пациента дубликаты лунок должны быть примыкать друг к другу. Обратите внимание, что это наводящая на размышления компоновка для коллиматора 10 x 10 и может быть изменена в зависимости от размера коллиматора или образцов. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
- Этапы размораживания и культивирования цельной крови
- Подогрейте водяную баню до 37 °C.
- Извлеките необходимые криовиалы из жидкого азота (количество зависит от требований, таких как количество доз).
ПРИМЕЧАНИЕ: Один криовиал содержит 1 мл крови и 1 мл замораживающей среды. Таким образом, можно установить две культуры с кровью из одного криовиала. - Частично разморозьте криовиалы на теплой водяной бане (до тех пор, пока не будут видны мелкие кристаллы льда).
- Выньте флаконы с водяной бани и очистите флаконы снаружи стерильной папиросной бумагой.
- В стерильном ламинарном колпаке открывайте флаконы очень медленно, чтобы предотвратить выливание пузырьков воздуха, образовавшихся внутри пробирок.
- Повторно суспендируйте содержимое каждого флакона и по отдельности переложите его в коническую центрифужную пробирку объемом 15 мл (по 1 пробирке на флакон).
- Добавьте в соответствующие пробирки по каплям 1 мл теплого (37 °C) PBS, осторожно вкручивая пробирку. Ресуспендируйте с помощью пипетки P1000.
- Для разбавления и равномерной стирки добавьте по каплям 7 мл предварительно подогретого PBS (37 °C) и повторно взвесьте пипеткой P1000.
- Центрифугируют кровь в течение 8 мин при 180 × г (с установкой на ускорение 1, тормоз 1) при комнатной температуре.
- На этом этапе ожидания заполните пустые лунки (кроме той, где будут культивироваться клетки) 500 мкл PBS.
- Поместите пластины лунки обратно в инкубатор для предварительного прогрева.
- После завершения центрифугирования осторожно удалите надосадочную жидкость, оставив примерно 1 мл, чтобы не повредить клеточную гранулу.
- Повторно суспендируйте гранулу в оставшейся надосадочной жидкости с помощью пипетки P1000.
- Добавьте по каплям 8 мл теплого PBS (37 °C) в соответствующие пробирки, осторожно встряхивая пробирки. После этого ресуспендируйте с помощью пипетки P1000.
- Центрифугируют ресуспендированную кровь в течение 8 мин при 180 × г (с установкой на ускорение 9, тормоз 9).
- На этом этапе ожидания перенесите 200 мкл питательной среды в каждую из отмеченных лунок.
- Храните планшеты обратно в инкубатор при температуре 37 °C.
- После центрифугирования удалите надосадочную жидкость непрерывным движением (чтобы не повредить гранулы с сыпучими клетками), но оставьте около 80 мкл надосадочной жидкости.
- К грануле добавляют 280 мкл FCS (комнатной температуры) и ресуспендируют (до общего объема 360 мкл).
- Перенесите 180 мкл клеточной суспензии в каждую лунку и ресуспендируйте (= 0,5 мл «крови»/культуры). Общий объем в каждой лунке теперь составляет 380 мкл, в результате чего получается средний слой толщиной 2 мм.
- Перед облучением инкубируют планшеты в инкубатореCO2 при температуре 37 °C не менее 10 мин.
4. Проба G0 MN
- Выньте планшеты из инкубатора и облучите клеточную культуру необходимыми дозами, такими как рентгеновские лучи 0,5, 1 и 2 Гр (220 кВ, 13 мА, 0,15 мм Cu) при комнатной температуре. Используйте бутафорские облученные образцы в качестве контроля для выявления спонтанных выходов МН.
- Сразу после облучения добавьте в каждую лунку по 1,62 мл питательной среды (37 °С).
- Чтобы стимулировать деление клеток в Т-лимфоцитах, добавьте 40 мкл фитогемагглютинина (PHA) в каждую лунку и тщательно ресуспендируйте.
- Поместите эти планшеты обратно в инкубатор (5% CO2, 37 °C).
ПРИМЕЧАНИЕ: Это будет время начала анализа. - Заблокируйте цитокинез через 23 ч после стимуляции, добавив 8 мкл цитохалазина B (6 мкг/мл) на лунку, и ресуспендируйте должным образом.
- Соберите клеточные культуры через 70 часов после стимуляции/посева. Ресуспендируйте и перенесите клетки в пробирку объемом 15 мл. Промойте каждую лунку 2 мл PBS и добавьте этот PBS в соответствующую пробирку объемом 15 мл.
- Центрифугируют пробирки в течение 8 мин при 180 × г при комнатной температуре.
- Выбросьте надосадочную жидкость, но оставьте примерно 500 мкл на гранулу.
- Взбейте гранулу (на полной скорости) и во время вихря медленно добавьте по каплям 2 мл холодного хлорида калия (KCl, 4 °C).
- Немедленно центрифугируют клетки при 180 × г в течение 8 мин.
- Выбросьте надосадочную жидкость, оставив примерно 500 мкл надосадочной жидкости.
- Вмешайте гранулу (на полной скорости) и во время вихря медленно добавьте по каплям 2 мл холодного фиксатора 1 (раствор метанола/уксусной кислоты/Рингера в соотношении 4:1:5).
- Оставьте пробирки с образцами на ночь при температуре 4 °C (минимум 12 ч и максимум 96 ч).
- Центрифугу в течение 8 мин при 180 × г.
- Выбросьте надосадочную жидкость.
- Встряхните гранулу (на полной скорости) и во время вихря медленно добавьте по каплям 2 мл холодного фиксатора 2 (метанол/уксусная кислота в соотношении 4:1).
- Центрифугу в течение 8 мин при 180 × г.
- Выбросьте надосадочную жидкость.
- Вбейте гранулу (на полной скорости), а затем медленно (по каплям), во время перевешивания, добавьте в гранулу 2 мл холодного фиксатора 2 .
- Оставьте пробирки с образцами при температуре 4 °C (минимум 12 ч и максимум 96 ч).
- Очистите предметные стекла изопропанолом и наклейте на них надлежащую маркировку.
ПРИМЕЧАНИЕ: Используйте напечатанные наклейки для маркировки, так как чернила маркера легко стираются во время обработки. - Центрифугируют пробирки с образцами в течение 8 мин при 180 × г.
- Перелейте надосадочную жидкость в другую пробирку, чтобы сконцентрировать клетки в соответствии с размером гранулы.
- Вбейте гранулу.
- Капните 40 мкл неподвижных клеток на сухое и чистое предметное стекло.
- Дайте предметным стеклам высохнуть при комнатной температуре. Храните предметные стекла в коробке или морилке сразу для наблюдения.
5. Окрашивание акридиновым оранжевым (АО)
- Погрузите предметные стекла в краситель АО на 1 минуту, после чего быстро промойте их в дистиллированной воде, а затем поместите предметные стекла в фосфатный буфер (pH 6,8) на 1 минуту.
- Выньте предметные стекла из буферного раствора и чистой папиросной бумагой высушите обратную сторону предметных стекол и положите предметные стекла на чистую папиросную бумагу.
- Капните 20 мкл фосфатного буфера на предметное стекло и аккуратно накройте его чистым покровным стеклом, избегая образования пузырьков воздуха.
- Запечатайте эти предметные стекла силиконовым цементом.
ПРИМЕЧАНИЕ: Поскольку AO чувствителен к свету и со временем тускнеет, для хорошего контраста и флуоресценции рекомендуется сделать надрезы на предметных стеклах в течение 5 дней после окрашивания. Всегда храните предметные стекла в холодном помещении (4 °C), когда они не исследуются.
6. Подрезка окрашенных предметных стекол
- Поместите предметное стекло под флуоресцентный микроскоп и исследуйте 1000 двуядерных клеток (BN). Вручную подсчитайте МН, которые являются одним из шести биомаркеров токсичности. Для этого попросите двух независимых экспертов изучить 500 BN-клеток на предметное стекло при одинаковом увеличении.
ПРИМЕЧАНИЕ: Ниже приведены некоторые основные критерии оценки, рекомендованные Fenech для оценки окрашенных слайдов9- Выберите клетку BN, посмотрев на красиво округлые клетки с неповрежденной цитоплазмой, с двумя хорошо различимыми ядрами примерно одинакового размера, правильной формы и окрашивания. Убедитесь, что цитоплазма клетки BN отличается от цитоплазмы соседней клетки.
- Оцените МН, отметив, что оно морфологически идентично основным ядрам, но меньше их; даже самая большая МН не может быть больше 1/3 диаметра основных ядер. Балл МН можно получить только в том случае, если он не касается основных ядер или, по крайней мере, граница микроядер отличается от границы основных ядер.
Representative Results
Чтобы проверить воспроизводимость протокола, мы провели МН-анализ на криоконсервированных образцах крови 30 здоровых добровольцев в возрасте от 17 до 65 лет. Средний возраст группы – 35 лет. Срок криоконсервации составлял от 1 недели до 154 недель. После облучения культуры клеток цельной крови различными дозами облучения (0,5, 1 и 2 Гр) под микроскопом исследовали выход микроядер в 1000 BN-клеток. Красиво округлые двуядерные клетки (как видно на рисунке 2) указывают на успешное извлечение здоровых жизнеспособных клеток из криоконсервированных образцов цельной крови. Следует отметить, что радиационная реакция лимфоцитов оставалась стабильной после длительного хранения при сверхнизких температурах (жидкий азот). Это наблюдение согласуется с реакцией, ожидаемой от свежих образцов крови.
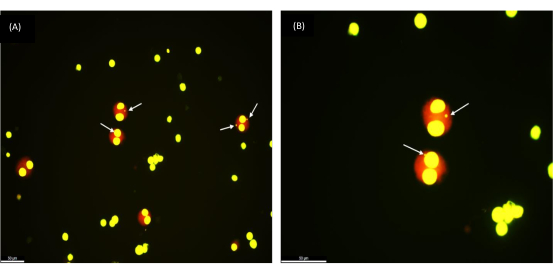
Рисунок 2: Микроядра, наблюдаемые в двуядерных клетках, извлеченных из замороженного образца цельной крови, который был криоконсервирован 1 год назад. (A) Увеличение 200x, (B) Увеличение 400x; Стрелки, указывающие на MN. Масштабная линейка = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
При увеличении доз облучения (0,5, 1 и 2 Гр) наблюдалось линейно-квадратичное увеличение выхода микроядер (табл. 1 и рис. 3). Выходы МН в фиктивных облученных контрольных образцах (0 Гр) представляют собой фоновые выходы МН, которые в основном являются результатом запаздывающих хромосом.
| Доза (Гр) | 0 | 0.5 | 1 | 2 |
| Средний | 18 | 107 | 247 | 601 |
| СД | 10.8 | 23.9 | 53.3 | 101.1 |
| Резюме (%) | 59.9 | 22.3 | 21.6 | 16.8 |
| Диапазон | 5-41 | 62-140 | 139-324 | 395-755 |
Таблица 1: Диапазон и коэффициент вариации наряду со средним выходом МН, наблюдаемые в криоконсервированных образцах цельной крови 30 здоровых доноров, что свидетельствует о межиндивидуальной вариабельности. Сокращения: CV = коэффициент вариации; SD = стандартное отклонение.
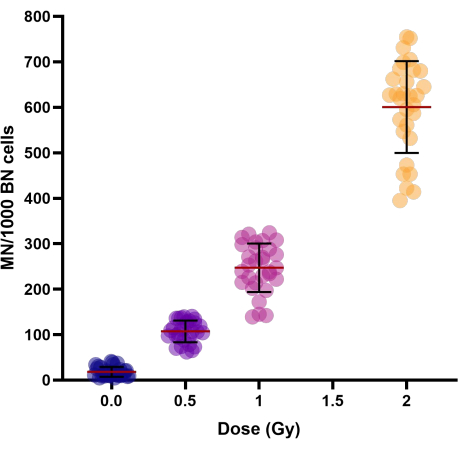
Рисунок 3: Выход микроядер, наблюдаемый в контрольных и облученных криоконсервированных образцах цельной крови 30 доноров. Сроки криоконсервации составляли от 1 недели до 154 недель. Точечная диаграмма показывает отдельные значения. Линии в кластерах представляют среднее ± SD группы. Аббревиатуры: MN = микроядра; BN = двуядерный. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Для исследования межиндивидуальной изменчивости выхода МН лиц был рассчитан коэффициент вариации (CV) (см. табл. 1). Для радиационно-индуцированной МН получен CV < 25% для всех доз (0,5, 1 и 2 Гр), что свидетельствует о хорошей воспроизводимости модифицированного протокола.
Discussion
Модифицированный протокол применения анализа CBMN является относительно простым и удобным способом хранения образцов крови в больших количествах. Процедура описывает все мельчайшие, но важные детали, которые необходимо учесть во время криоконсервации и анализа CBMN. Другие лабораторные протоколы обычно используют 10% ДМСО в замораживающей смеси, в то время как наша замораживающая смесь содержит 20% ДМСО вместе с 80% FCS7. Поскольку эта замораживающая смесь добавляется в равных объемах к образцу цельной крови, конечная концентрация также составляет 10% ДМСО. Для повышения выживаемости клеток и стимуляции клеточного деления в полную питательную среду (cRPMI) добавляем 1% пирувата натрия и 0,1% бета-меркаптоэтанола. Это соответствует протоколу культивирования клеток, установленному нашей исследовательской группой 6,8.
Несмотря на то, что проблема слипания клеток при оттаивании не может быть полностью решена в этом протоколе, клеточная сегрегация была лучше, чем в других традиционных протоколах. Вместо последовательного, резкого добавления питательных сред для восстановления клеток после размораживания, мы получили лучшие результаты при добавлении предварительно подогретого PBS (37 °C) по каплям на этапах промывки. Это улучшение помогает уменьшить клеточный стресс и сводит к минимуму образование комков с доказанным высоким восстановлением клеток. Кроме того, не было выявлено четкой разницы в жизнеспособности клеток при использовании PBS вместо RPMI. Группа подтвердила, что продолжительность периода криоконсервации (до 1 года) не повлияет на выход МН, как в облученных, так и в необлученных образцах 6,8. Исследования показывают, что хорошая жизнеспособность клеток и пролиферация ПБМК могут быть достигнуты при постепенном замораживании при низких температурах (жидкий азот) с последующим постепенным добавлением предварительно подогретой среды при оттаивании10,11. Исследователи показали, что субпопуляции Т-лимфоцитов в размороженной цельной крови сопоставимы с теми, которые наблюдаются в размороженных PBMC12. Кроме того, доказано, что подтипы клеток, извлеченных из криоконсервированных образцов цельной крови, аналогичны тем, которые наблюдаются в свежих образцах цельной крови13,14.
Если мы рассмотрим ориентировочные результаты, полученные в отчете, то увидим, что линейное квадратичное увеличение дозы (рис. 3) согласуется с другими литературными сообщениями по микроядрам, индуцированным линейным переносом энергии (ЛПЭ)15,16. Вариабельность выхода МН, наблюдаемая в криоконсервированных образцах цельной крови (табл. 1), находится в диапазоне от таковой, зарегистрированной для свежих культур цельной крови 8,17,18. Протокол, подробно описанный здесь, был валидирован на свежей и криоконсервированной цельной крови 20 здоровых добровольцев8. Индекс ядерного деления (NDI), который является важным параметром пролиферации клеток, наблюдаемый в этом отчете8, согласуется с индексом, предложенным для свежей цельной крови19,20. В совокупности этот оптимизированный протокол криоконсервации цельной крови и модифицированный микроядерный анализ обеспечивают лучший выход клеток, и, следовательно, рекомендуется адаптировать этот протокол для оценки радиочувствительности. Поскольку воспроизводимость протокола уже подтверждена8, предполагается, что он применим в крупномасштабных и многоцентровых исследованиях.
Disclosures
У авторов нет конфликта интересов, о котором можно было бы заявлять.
Acknowledgements
Авторы выражают благодарность за техническую поддержку Л. Питерсу, Т. Тирону и Г. Де Смету. Мы благодарны всем добровольцам, которые сдали кровь для исследования. Работа была финансово поддержана Исследовательским фондом Фландрии (FWO) под руководством Гранта (T000118N).
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tubes | Greiner | 188271 | |
| 24-well cell suspension plate | VWR | 734-2779 | |
| 96% alcohol | ChemLab | CL00.1807.2500 | |
| Acetic acid | Merck life science | 8,18,75,52,500 | |
| Acridine orange | Merck life science | 235474-5g | |
| CaCl2 | Merck life science | C5670-100g | |
| cover slips | VWR | 631-1365 | 22 x 50 |
| Cryobox (Mr.Frosty) | Nalgene, Sigma Aldrich | ||
| Cryovials 2ml | Novolab | A04573 | |
| Cytochalsin B | Merck life science | C6762-10 | 10 mg |
| Dimethyl sulphoxide (DMSO) | Merck life science | D4540-500ml | |
| Fetal calf serum (FCS) | Thermo Fischer scientific | 10270-106 | |
| Fixative 1 | Methanol/acetic acid/ringer in a ratio of 4:1:5 | ||
| Fixative 2 | Methanol/acetic acid in a ratio of 4:1 | ||
| GURR buffer | Thermo Fischer scientific | 10582013 | phosphate buffer (pH 6.8) |
| KCl | Merck life science | 1,04,93,60,250 | 75 mM |
| KH2PO4 | Merck life science | 1,04,87,30,250 | |
| Li-heparin tubes | BD Life sciences | 367526-LH170 I.U. | BD Vacutainer |
| Methanol | fisher scinetific | M/4000/17 | |
| Na2HPO2 | Merck life science | 10,65,80,500 | |
| NaCl | Merck life science | S7653-1kg | |
| Object slides | VWR | MENZAA00000112E04 | |
| Penicillin/Streptomycin | Thermo Fischer scientific | 15140-122 | 10,000 U/mL + 10,000 µg/mL |
| Phytohemagglutinin (PHA-M) | Thermo Fischer scientific | 10576-015 | |
| Ringer solution | contains NaCl, KCl, CaCl2 dissolved in distilled water | ||
| RPMI-1640 | Thermo Fischer scientific | 52400041 | |
| Silicon rubber adhesive sealent | collall | CF-100 | |
| Sodium pyruvate | Thermo Fischer scientific | 11360039 | |
| Sterile warm PBS (37 °C) | contains NaCl, Na2HPO2, KH2PO4 dissolved in distilled water | ||
| β-mercaptoethanol | Thermo Fischer scientific | 31350-010 |
References
- Grade, M., Difilippantonio, M. J., Camps, J. Patterns of chromosomal aberrations in solid tumors. Recent Results in Cancer Research. 200, 115-142 (2015).
- Jiao, Y., Cao, F., Liu, H. Radiation-induced cell death and its mechanisms. Health Physics. 123 (5), 376-386 (2022).
- Roederer, M., et al. The genetic architecture of the human immune system: a bioresource for autoimmunity and disease pathogenesis. Cell. 161 (2), 387-403 (2015).
- Bankoglu, E. E., et al. Effect of cryopreservation on DNA damage and DNA repair activity in human blood samples in the comet assay. Archives of Toxicology. 95, 1831-1841 (2021).
- Zijno, A., Saini, F., Crebelli, R. Suitability of cryopreserved isolated lymphocytes for the analysis of micronuclei with the cytokinesis-block method. Mutagenesis. 22, 311-315 (2007).
- Sioen, S., Cloet, K., Vral, A., Baeyens, A. The cytokinesis-block micronucleus assay on human isolated fresh and cryopreserved peripheral blood mononuclear cells. Journal of Personalized Medicine. 10 (3), 125 (2020).
- Cheng, L., Wang, L. E., Spitz, M. R., Wei, Q. Cryopreserving whole blood for functional assays using viable lymphocytes in molecular epidemiology studies. Cancer Letters. 166 (2), 155-163 (2001).
- Beyls, E., Baeyens, A., Vral, A. The cytokinesis-block micronucleus assay for cryopreserved whole blood. International Journal of Radiation Biology. 97 (9), 1252-1260 (2021).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nature Protocols. 2 (5), 1084-1104 (2007).
- Ramachandran, H., et al. Optimal thawing of cryopreserved peripheral blood mononuclear cells for use in high-throughput human immune monitoring studies. Cells. 1 (3), 313-324 (2012).
- Hønge, B. L., Petersen, M. S., Olesen, R., Møller, B. K., Erikstrup, C. Optimizing recovery of frozen human peripheral blood mononuclear cells for flow cytometry. PLoS One. 12 (11), e0187440-e0187517 (2017).
- Alam, I., Goldeck, D., Larbi, A., Pawelec, G. Flow cytometric lymphocyte subset analysis using material from frozen whole blood. Journal of Immunoassay and Immunochemistry. 33 (2), 128-139 (2012).
- Langenskiöld, C., Mellgren, K., Abrahamsson, J., Bemark, M. Determination of blood cell subtype concentrations from frozen whole blood samples using TruCount beads. Cytometry Part B: Clinical Cytometry. 94B, 660-666 (2018).
- Braudeau, C., et al. An easy and reliable whole blood freezing method for flow cytometry immuno-phenotyping and functional analyses. Cytometry Part B: Clinical Cytometry. 100 (6), 652-665 (2021).
- Thierens, H., Vral, A., De Ridder, L. Biological dosimetry using the micronucleus assay for lymphocytes: interindividual differences in dose response. Health Physics. 61 (5), 623-630 (1991).
- Vral, A., Fenech, M., Thierens, H. The micronucleus assay as a biological dosimeter of in vivo ionising radiation exposure. Mutagenesis. 26 (1), 11-17 (2011).
- Vral, A., Thierens, H., Baeyens, A., De Ridder, L. The micronucleus and G2-phase assays for human blood lymphocytes as biomarkers of individual sensitivity to ionizing radiation: limitations imposed by intraindividual variability. Radiation Research. 157 (4), 472-477 (2002).
- Pajic, J., et al. Inter-individual variability in the response of human peripheral blood lymphocytes to ionizing radiation: comparison of the dicentric and micronucleus assays. Radiation and Environmental Biophysics. 54, 317-325 (2015).
- Fenech, M., et al. Intra- and inter-laboratory variation in the scoring of micronuclei and nucleoplasmic bridges in binucleated human lymphocytes: results of an international slide-scoring exercise by the HUMN project. Mutation Research. 534 (1-2), 45-64 (2003).
- Miszczyk, J., Rawojć, K. Effects of culturing technique on human peripheral blood lymphocytes response to proton and X-ray radiation. International Journal of Radiation Biology. 96 (4), 424-433 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved