Bioprinting tridimensionale di cocolture neurone-astrociti derivate da iPSC umane per applicazioni di screening
In This Article
Summary
Qui, presentiamo un protocollo per produrre cocolture biostampate in 3D di neuroni e astrociti derivati da iPSC. Questo modello di cocoltura, generato all'interno di un'impalcatura di idrogel in formati a 96 o 384 pozzetti, dimostra un'elevata vitalità post-stampa e la crescita dei neuriti entro 7 giorni e mostra l'espressione di marcatori di maturità per entrambi i tipi di cellule.
Abstract
Affinché un modello cellulare sia utilizzabile per lo screening farmacologico, il sistema deve soddisfare i requisiti di produttività e omogeneità, oltre ad avere un tempo di sviluppo efficiente. Tuttavia, molti modelli 3D pubblicati non soddisfano questi criteri. Questo, quindi, limita la loro utilità nelle prime applicazioni di scoperta di farmaci. La biostampa tridimensionale (3D) è una nuova tecnologia che può essere applicata allo sviluppo di modelli 3D per accelerare i tempi di sviluppo, aumentare la standardizzazione e aumentare la produttività. Qui, presentiamo un protocollo per sviluppare modelli di cocoltura biostampati in 3D di neuroni e astrociti glutammatergici derivati da cellule staminali pluripotenti indotte umane (iPSC). Queste cocolture sono incorporate all'interno di una matrice idrogel di peptidi bioattivi, proteine della matrice extracellulare (ECM) a lunghezza intera e con una rigidità fisiologica di 1,1 kPa. Il modello può essere rapidamente stabilito nei formati a 96 e 384 pozzetti e produce una vitalità media post-stampa del 72%. Il rapporto astrocita/neurone in questo modello è di 1:1,5, che rientra nell'intervallo fisiologico per il cervello umano. Queste popolazioni di cellule biostampate in 3D mostrano anche l'espressione di marcatori di tipo di cellule neurali mature e la crescita delle proiezioni di neuriti e astrociti entro 7 giorni dalla coltura. Di conseguenza, questo modello è adatto per l'analisi utilizzando coloranti cellulari e tecniche di immunocolorazione insieme a saggi di crescita neuritica. La capacità di produrre questi modelli fisiologicamente rappresentativi su larga scala li rende ideali per l'uso in saggi di screening a medio-alto rendimento per bersagli neuroscientifici.
Introduction
La ricerca sulle malattie del sistema nervoso centrale (SNC) nel settore della scoperta di farmaci si sta espandendo1. Tuttavia, molte malattie prevalenti del sistema nervoso centrale come l'epilessia, la schizofrenia e il morbo di Alzheimer non hanno ancora trattamenti curativi 2,3,4. La mancanza di terapie efficaci nelle malattie del sistema nervoso centrale può, almeno in parte, essere attribuita alla mancanza di modelli in vitro accurati del cervello5. Ciò ha comportato un divario traslazionale tra gli attuali modelli in vitro e i dati in vivo e un conseguente collo di bottiglia negli sforzi di ricerca.
Spinto da questo divario traslazionale, negli ultimi anni c'è stato un aumento significativo nello sviluppo di nuovi modelli cellulari 3D, tra cui organoidi neurali, neurosferoidi e modelli basati su scaffold6. La struttura 3D di questi modelli aiuta a ricapitolare il microambiente neurale, compresi gli stress biomeccanici, i contatti cellula-cellula e la matrice extracellulare cerebrale (ECM)7. L'ECM cerebrale è un elemento dinamico della neurofisiologia che occupa lo spazio tra i tipi di cellule neurali, tra cui neuroni, astrociti, oligodendrociti e l'unità neurovascolare7. È stato dimostrato che la ricapitolazione dell'ECM cerebrale influenza la morfologia neuronale e l'attivazione neuronale e molti modelli 3D complessi del cervello hanno dimostrato la deposizione di proteine ECM da parte dei tipi di cellule neurali 8,9,10,11. I modelli basati su scaffold sono costituiti da cocolture neurali mature sospese in una matrice porosa di idrogel sintetico o biologico che rappresenta l'ECM12 del cervello. A differenza dei sistemi organoidi e sferoidi, i modelli 3D basati su scaffold consentono la personalizzazione delle proteine ECM presenti e hanno l'ulteriore vantaggio della sintonizzabilità della rigidità dell'idrogel per imitare le sollecitazioni biomeccaniche13,14.
Sebbene la stragrande maggioranza dei modelli neurali 3D dimostri una maggiore ricapitolazione del microambiente cerebrale, non tutti i modelli sono adatti per l'implementazione di applicazioni di scoperta farmacologica15. Affinché un modello 3D possa essere implementato nei processi industriali, il sistema deve soddisfare i requisiti di produttività per le applicazioni di screening e avere un tempo di sviluppo relativamente breve16. La biostampa 3D è una nuova tecnologia che offre il potenziale per creare modelli neurali basati su scaffold 3D con tempi di sviluppo rapidi, maggiore produttività e livelli più elevati di controllo di precisione, oltre alla rimozione della variabilità causata dall'errore umano17. Questo protocollo presenta un modello di cocoltura 3D di neuroni glutammatergici e astrociti umani derivati da iPSC in un'impalcatura di idrogel. Questa impalcatura in idrogel contiene peptidi bioattivi fisiologicamente rappresentativi (RGD, IKVAV, YIGSR) e proteine ECM all'interno di una rigidità biomeccanica mimetica. Queste proteine ECM a lunghezza intera includono laminina-211 a lunghezza intera e acido ialuronico, abbondanti nella corteccia umana, con una rigidità di 1,1 kPa in linea con le misurazioni in vivo 18. Questo modello è progettato con praticità per la scoperta di farmaci ed è creato utilizzando una biostampante 3D in un formato di piastra a 96 pozzetti o 384 pozzetti adatto per l'analisi di screening utilizzando tecniche di imaging con coloranti cellulari e anticorpi, insieme a saggi di crescita neuritica. Le cellule mostrano l'espressione di marcatori di tipo di cellula neurale e la crescita di proiezioni neuritiche e astrocitarie entro 7 giorni dalla coltura. Pertanto, questo protocollo presenterà la metodologia per sviluppare un modello di cocoltura neurale 3D ad alto rendimento da utilizzare in applicazioni di scoperta di farmaci.
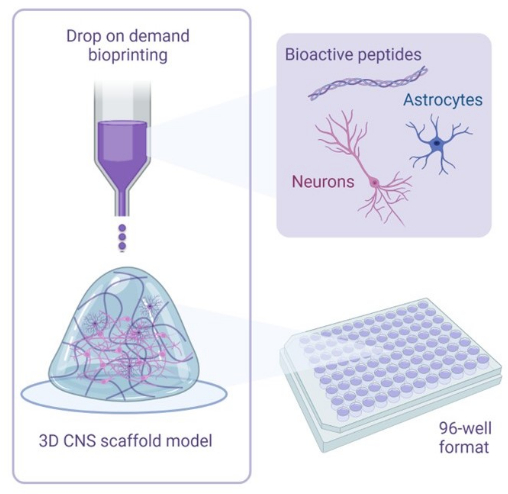
Figura 1: Panoramica illustrativa della metodologia utilizzata per le cocolture di biostampa 3D. I neuroni e gli astrociti umani derivati da iPSC sono combinati con soluzioni attivatrici e bioink contenenti peptidi bioattivi e sono biostampati su scaffold di idrogel in formati a 96 o 384 pozzetti utilizzando la tecnologia di bioprinting drop-on-demand. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocol
1. Bioprinting di modelli 3D
- Generazione della mappa delle lastre e del file di stampa
- Prima di generare il modello, generare una mappa delle lastre, un protocollo e un file di stampa utilizzando il software della mappa delle lastre. Aprire il software di mappatura delle piastre e selezionare l'opzione Celle di coltura in 3D .
- Selezionare il tipo di modello da biostampare tra le opzioni disponibili nel menu a tendina; questo modello è stato convalidato nei formati Imaging Model e HTP model. Selezionare il modello di imaging per le piastre a 96 pozzetti e l'HTP per le piastre a 384 pozzetti.
- Nella finestra Selezione matrice , selezionare Idrogel Px02.53, contenente Laminina-211 e proteine dell'acido ialuronico, con peptidi IKVAV, RGD e YIGSR.
- Nella finestra pop-up, inserisci i tipi di cellule come Neuroni glutammatergici e Astrociti e inserisci la densità cellulare come 20 milioni di cellule/mL.
- Utilizzare il software per progettare la mappa della piastra desiderata evidenziando i pozzetti sulla piastra sullo schermo. Includi almeno 1 riga di controllo 2D su plastica nel progetto. Il controllo 2D su pozzetti plastici è costituito da celle depositate direttamente nel pozzetto senza alcuna impalcatura di idrogel; Rivestire questi pozzetti come indicato al punto 1.2.
- Assicurarsi che il modello di piastra elencato nella parte superiore della finestra sia cambiato nel modello di piastra previsto per l'uso (vedere Tabella dei materiali).
- Scaricare il protocollo e il file di stampa per la mappa delle lastre utilizzando i pulsanti di download e salvarli sul computer collegato alla biostampante.
- Rivestimento di controllo 2D su pozzetti in plastica
- Almeno 24 ore prima della stampa, rivestire i pozzetti per i modelli di controllo 2D per l'aderenza e la crescita cellulare. I pozzetti del modello 3D non richiedono alcun pre-rivestimento. Tutti i processi devono essere eseguiti in una cabina di biosicurezza, salvo diversa indicazione. Le lastre possono essere rivestite e preparate fino a 7 giorni prima della stampa.
- Preparare 50 mL di tampone borato 1x diluendo 2,5 mL di soluzione madre borato 20x con 47,5 mL di dH2O sterile.
- Aggiungere 100 μL di polietilenimmina (PEI) al 50% (p/v) a 50 mL di tampone borato 1x per creare una soluzione PEI allo 0,1% (p/v) e un filtro sterile attraverso un filtro da 0,22 μm.
- Aggiungere una soluzione di PEI allo 0,1% (p/v) a ciascun pozzetto di controllo 2D, come indicato dalla mappa della piastra generata nel passaggio 1.1. Aggiungere 100 μL/pozzetto se si utilizza una piastra da 96 pozzetti o 25 μL/pozzetto se si utilizza una piastra da 384 pozzetti.
- Incubare la piastra per 2 ore a 37 °C prima di aspirare la soluzione di PEI allo 0,1% (p/v) e risciacquare i pozzetti 5 volte con PBS. Lasciare asciugare completamente i pozzetti nell'armadio di biosicurezza.
- Diluire 100 μL di soluzione di laminina 1 mg/mL in 5 mL di terreno neurobasale. Aggiungere 100 μL a ciascun pozzetto di controllo 2D se si utilizza una piastra a 96 pozzetti o 25 μL se si utilizza una piastra a 384 pozzetti. Incubare per 4 ore a 37 °C.
- Se si conservano le piastre, lasciare la soluzione di laminina in posizione dopo l'incubazione e conservare a 4 °C. Preriscaldare le piastre per 1 ora a 37 °C prima dell'uso.
- Bioprinting 3D di modelli di cocultura
- Mantenere sempre una tecnica sterile quando si utilizza la biostampante e pulire guanti, cartucce e piastre di coltura con EtOH al 70% prima di essere inseriti nella stampante. Salvo diversa indicazione, eseguire tutti i processi al di fuori della biostampante in un armadio di sicurezza biologica.
- Accendere il compressore per la biostampante e inizializzare la stampante selezionando il pulsante Inizializza sul software della biostampante. Una volta avviato il flusso d'aria nella stampante, pulire le superfici all'interno della stampante con una salvietta EtOH al 70%.
- Il giorno della stampa, eseguire il processo guidato di illuminazione verde all'inizio della giornata per garantire il corretto stato dell'ugello per la tiratura di stampa (stato minimo dell'ugello 2A2B).
- Prelevare una cartuccia per biostampante dalla confezione sterile, aggiungere 20 mL di dH2O sterile nello scomparto A e aggiungere 6 mL di EtOH al 70% filtrato sterile negli scomparti B1-4. Inserire la cartuccia nel supporto sinistro all'interno della biostampante e posizionare il coperchio della piastra nel supporto del coperchio dedicato.
- Selezionare il pulsante Greenlighting nella schermata iniziale del software e verificare sul software che la cartuccia sia in posizione all'interno della bioprinter e che il coperchio sia stato rimosso. Avviare il processo di semaforo verde.
- Quando richiesto dal software, verificare che non siano visibili gocciolamenti coerenti dagli aghi sinistro o destro. Successivamente, quando richiesto dal software, verificare che l'acqua sia presente negli scomparti B7 e B8.
- Dopo che la biostampante ha completato la fase di illuminazione ecologica autoguidata, inserire una piastra a fondo piatto sterile a 96 pozzetti non rivestita (separata dalla piastra rivestita per le cocolture di bioprinting) e inserire questa nuova piastra nella sezione destra del supporto della piastra della biostampante quando richiesto dal software. Assicurarsi che il supporto della piastra sia impostato su Piastra ad alto profilo e che il coperchio sia stato rimosso e posizionato nell'apposito supporto del coperchio prima di iniziare il passaggio successivo.
- La biostampante depositerà le goccioline d'acqua in ciascun pozzetto della piastra a 96 pozzetti. Una volta completato, posizionare la piastra dalla biostampante e verificare che siano presenti goccioline d'acqua in ogni pozzetto della piastra.
- Smaltire la piastra a 96 pozzetti utilizzata per il greenlighting e consentire alla bioprinter di completare il processo di greenlighting. Una volta completato, il software indicherà lo stato dell'ugello della biostampante e confermerà che la biostampante è pronta per stampare i modelli. Posizionare il coperchio sulla cartuccia di stampa e rimuoverlo nell'armadio di sicurezza biologica per i passaggi successivi.
- Utilizzando il software della biostampante, caricare il file di stampa (generato al punto 1.1) nel software utilizzando il pulsante del software Print Run e aprire il pdf del protocollo di stampa.
- Prelevare i fluidi bioink e attivatori, come indicato nel pdf del protocollo di stampa, da -20 °C e scongelare a temperatura ambiente (RT) per 40 min. Per la matrice di idrogel Px02.53 questo includerà: 1x flaconcino F32, 1xflaconcino F3, 1x flaconcino F261, 1x flaconcino F299. Non scongelare il bioink e i fluidi attivatori nelle mani o a bagnomaria.
- Portare 50 mL di terreno completo con doxiciclina e inibitore ROCK (terreno completo +DOX/ROCKi) (vedere punto 2.2) in RT mentre i fluidi bioink e attivatori si stanno scongelando.
- Una volta scongelati i bioink e gli attivatori, preparare la cartuccia di stampa come indicato nelle ultime due pagine del pdf del protocollo di stampa generato. La cartuccia della stampante greenlighting verrà riutilizzata per le fasi di stampa del modello.
- Assicurarsi che ci siano 40 mL di dH2O nello scomparto A1 e 8 mL di EtOH al 70% negli scomparti B1 e B2. Aggiungere 1,2 mL di attivatore F32 a C1, 1,2 mL di F3 a C2 e 200 μL di F261 a C4.
- Recuperare la piastra rivestita in PEI e laminina dall'incubatrice e posizionarla all'interno della stampante nello scomparto destro del supporto della piastra. A questo punto, non rimuovere la soluzione di laminina dai pozzetti. Assicurarsi che lo scomparto del portapiatti sia impostato su Piastra a basso profilo e che il coperchio sia stato rimosso e inserito nel supporto del coperchio.
- Posizionare la cartuccia di stampa nella biostampante, assicurandosi che il coperchio sia rimosso e posizionato nel supporto, quindi avviare la tiratura di stampa sul software selezionando il pulsante Stampa base inerte sul software della biostampante.
- Mentre la base inerte sta stampando, recuperare le fiale di neuroni glutammatergici e astrociti dall'accumulo di azoto liquido, scongelarle e risospenderle secondo le istruzioni nella sezione 2.
- Una volta che le cellule sono state scongelate e 8 mL di terreno completo +DOX/ROCKi sono stati aggiunti separatamente a ciascun tipo di cellula (come da sezione 2), centrifugare le cellule a 300 x g per 5 minuti a RT.
- Aspirare il surnatante e risospendere entrambi i tipi di cellule separatamente in 1 mL di terreno completo +DOX/ROCKi.
- Aggiungere 20 μL di sospensione cellulare a 20 μL di blu di tripano e mescolare prima di contare le cellule per determinare la concentrazione cellulare vitale per mL per ciascun tipo di cellula.
- Combina un totale di 3 milioni di neuroni glutammatergici con 1 milione di astrociti in una provetta da 15 ml. Aggiungere il terreno per creare un volume totale di 8 ml.
- Centrifugare le cellule a 300 x g per 5 minuti a RT.
- Aspirare la maggior parte possibile del surnatante senza disturbare il pellet cellulare e risospendere il pellet cellulare in 200 μL di fluido attivatore F299.
- Si noti che il fluido attivatore è viscoso; Pipettare su e giù per risospendere completamente il pellet. I tipi di cellule sono delicati; Ridurre al minimo il taglio e le bolle utilizzando un puntale per pipette a foro largo e la tecnica di pipettaggio inverso. Pipettare su e giù con decisione non più di 3 volte per evitare la perdita di cellule.
- Una volta terminata la stampa dello stadio base inerte, posizionare i coperchi sulla cartuccia e sulla piastra di coltura, rimuoverli entrambi dalla biostampante e riporli nell'armadio di sicurezza biologica.
- Aggiungere i 200 μL di sospensione cellulare in F299 al pozzetto C3 della cartuccia di stampa, reinserire la cartuccia nella biostampante, rimuovere il coperchio e posizionarla nel supporto del coperchio. Non reinserire ancora la piastra di coltura.
- Avviare la fase Modelli di stampa della tiratura. Mentre la biostampante sta adescando i fluidi, rimuovere la soluzione di laminina-terreno dai pozzetti di controllo 2D della piastra e sostituirla con 150 μL di terreno completo +DOX/ROCKi in ciascun pozzetto di controllo 2D se si utilizza una piastra a 96 pozzetti e 50 μL di terreno completo +DOX/ROCKi se si utilizza una piastra a 384 pozzetti.
- Dopo che i liquidi sono stati adescati, inserire la piastra di targeting per bioprinting nella biostampante, rimuovere il coperchio e posizionarla nel supporto del coperchio.
- Inizia il processo di targeting della biostampante.
- Quando richiesto dal software di biostampa, rimuovere la piastra di puntamento dalla biostampante.
- Utilizzare la guida per selezionare il punto in cui è possibile osservare le goccioline sulla piastra. Reinserire la piastra di puntamento nella biostampante e ripetere il processo di stampa e selezione delle gocce.
- Quando richiesto, rimuovere nuovamente la piastra di puntamento, quindi sostituirla con la piastra di coltura cellulare (contenente i terreni nei pozzetti di controllo 2D come indicato al punto 1.3.25). Assicurarsi che il coperchio della piastra di coltura sia rimosso e inserito nel supporto. La biostampante terminerà la stampa del modello.
- Una volta completata la stampa del modello, seguire i metodi di coltura cellulare nella sezione 2 (passaggio 2.8) per aggiungere terreni ai pozzetti.
- Iniziare il processo di pulizia della biostampante e, una volta completato, smaltire le cartucce e i liquidi rimanenti secondo i protocolli di laboratorio.
2. Colture cellulari
- I modelli vengono generati utilizzando 1 fiala di neuroni glutammatergici (>5 milioni di cellule per fiala) e 1 fiala di astrociti (>1 milione di cellule per fiala).
- Preriscaldare il bagnomaria a 37 °C.
- Trasportare entrambe le fiale di cellule in laboratorio su ghiaccio secco e immergerle in un bagno d'acqua subito dopo la rimozione dal ghiaccio secco. Scongelare entrambi i flaconcini contemporaneamente.
- Rimuovere i flaconcini dal bagnomaria quando rimane solo un piccolo cristallo di ghiaccio; Ci vorranno circa 3 minuti dopo l'immersione. Non agitare o mescolare le celle nel bagnomaria.
- Spruzzare i flaconcini con EtOH al 70% e trasferirli nell'armadio di biosicurezza.
- Aggiungere 500 μL di terreno completo +DOX/ROCKi goccia a goccia in ciascun flaconcino prima di trasferire ciascuna sospensione in provette separate da 15 mL.
- Rabboccare il terreno in ciascuna provetta a 8 mL e procedere con le fasi di bioprinting come indicato al passaggio 1.3.
- Seguendo i modelli di bioprinting (fase 1.3), aggiungere immediatamente il terreno completo +DOX/ROCKi a tutti i pozzetti di cocoltura 3D e posizionare i modelli in un incubatore a 37 °C e 5% di CO2 . Se si utilizza una piastra a 96 pozzetti, aggiungere 150 μL di terreno per pozzetto; Se si utilizza una piastra da 384 pozzetti, utilizzare 50 μL di terreno per pozzetto.
- Non sono necessarie modifiche ai supporti per le prime 48 ore di coltura.
- Quando si eseguono modifiche dei terreni su controlli e modelli 2D, è necessario prestare attenzione per evitare di indurre sollecitazioni meccaniche, che potrebbero staccare le colture 2D o causare la deformazione dell'idrogel. Eseguire lentamente l'aspirazione e l'aggiunta di terreni utilizzando una micropipetta rivolta verso il basso sul lato del pozzetto.
- Dopo 48 ore, eseguire un cambio del terreno del 90% su tutti i pozzetti e rimuovere ROCKi dalla composizione del terreno (vedere il passaggio 2.14).
- Dopo 96 ore, eseguire un'ulteriore sostituzione del terreno del 90% su tutti i pozzetti per rimuovere DOX dalla composizione del terreno (vedere il passaggio 2.14).
- Dopo i due cambi di terreno al 90% a 48 ore e 96 ore, effettuare il cambio del 50% ogni 48 ore, in cui il 50% del terreno viene aspirato e sostituito con un mezzo completo fresco
- Composizione del supporto:
- Terreni completi: terreni neurobasali con 1x GlutaMAX, 1x B27, 12,5 nM 2-mercaptoetanolo, 10 ng/mL NT3, 5 ng/μL BDNF.
- Terreno completo più doxiciclina (DOX): terreno neurobasale con 1x GlutaMAX, 1x B27, 12,5 nM 2-mercaptoetanolo, 10 ng/mL di neurotrofina-3 (NT3), 5 ng/μL di fattore neurotrofico derivato dal cervello (BDNF) e 1 μg/mL di doxiciclina.
- Terreno completo più inibitore DOX/ROCK (ROCKi): terreno neurobasale con 1x GlutaMAX, 1x B27, 12,5 nM 2-mercaptoetanolo, 10 ng/mL NT3, 5 ng/μL BDNF, 1 μg/mL doxiciclina e 10 μM ROCK inibitore.
3. Analisi della crescita dei neuriti
- Posizionare le cellule in un microscopio a cellule vive per l'imaging in campo chiaro subito dopo l'aggiunta del terreno post-bioprinting.
- Utilizzare il software del microscopio per programmare l'imaging delle cellule con un ingrandimento 4x in ogni pozzetto, compresi i controlli 2D, ogni 12 ore per almeno 7 giorni.
- Effettuare il cambio del terreno ogni 48 ore, come descritto nel paragrafo 2, riposizionando le cellule nel microscopio dopo il cambio del terreno ogni volta.
- Dopo 7 giorni di dati, esporta le immagini dal software in .jpg formato
- Importa tutte le immagini .jpg nel software ImageJ e converti i file in formato a 8 bit. Carica il plug-in NeuronJ e traccia la crescita dei neuriti nelle immagini, inclusi i punti di diramazione, utilizzando lo strumento di tracciamento.
- Usa i dati di tracciamento dei neuriti generati da NeuronJ per tracciare la crescita dei neuriti nel tempo.
4. Analisi della vitalità cellulare
- Ogni 24 ore in coltura, colorare 3 o più pozzetti per l'analisi della vitalità cellulare utilizzando un kit di vitalità vivo/morto. Ripetere questo passaggio a intervalli di tempo di 24 o 48 ore per tutta la durata dello studio.
- Preparare i terreni reagenti vivi/morti sospendendo il reagente a cellule vive (1x Calceina-AM) e il reagente a cellule morte (1x omodimero di etidio-1) e 1x colorante nucleare a cellule vive (Hoechst 33342) in 10 mL di terreno sierico ridotto senza rosso fenolo (Opti-MEM) 30 minuti prima dell'imaging. Lasciare che i terreni reagenti vivi/morti arrivino a RT. Conservare i terreni reagenti vivi/morti al riparo dalla luce diretta a causa dello sbiancamento a fluorescenza.
- Rimuovere i terreni da 3 pozzetti contenenti modelli cellulari/controlli 2D, prevenendo accuratamente il disturbo del gel. Lavare i modelli cellulari una volta con PBS sterile RT. Aggiungere 100 μL di terreno reagente vivo/morto a ciascun pozzetto per una piastra a 96 pozzetti o 25 μL per una piastra a 384 pozzetti.
- Incubare i modelli per 30 minuti a 37 °C e 5% di CO2 .
- Dopo l'incubazione, i modelli sono pronti per l'imaging. Esegui l'imaging su qualsiasi microscopio standard con canali di eccitazione rossi (647 nm, cellule morte), verdi (488 nm, cellule vive) e blu (405 nm, colorazione nucleare). Per ottenere i migliori risultati nei modelli 3D, è possibile modellare l'immagine utilizzando un microscopio confocale ad alto contenuto ed eseguire l'imaging utilizzando una funzione Z-stack con ingrandimento 4x o 10x.
NOTA: In questo studio, i modelli cellulari sono stati sottoposti a imaging utilizzando l'analizzatore INCell 6500HS (sistema di imaging ad alto contenuto) e l'analisi è stata effettuata utilizzando Signals Image Artist (piattaforma di analisi delle immagini, vedere il passaggio 4.7). - Al termine dell'imaging, riportare i modelli cellulari nell'incubatore per colture cellulari a 37 °C e al 5% di CO2 . Tuttavia, omettere i modelli cellulari utilizzati per l'analisi della vitalità da ulteriori studi a causa dei mezzi reagenti vivi/morti sulla vitalità a lungo termine.
- Analisi delle immagini sulla piattaforma di analisi delle immagini
- Selezionare ciascun piano dell'immagine Z-stack nel software. Combina le immagini piane come un'immagine di proiezione alla massima intensità.
- Creare una nuova analisi selezionando il modello biostampato come regione di interesse (ROI) identificando la fluorescenza dal canale delle cellule vive a 488 nm (assicurarsi che tutte le cellule siano selezionate in base al ROI).
- All'interno della regione di interesse, utilizzare il software di imaging per identificare il numero di cellule nella ROI attraverso il canale di colorazione nucleare (405 nm), il numero di cellule vive nella ROI utilizzando il canale 488 nm e il numero di cellule morte nella ROI utilizzando il canale 647 nm.
- Eseguire l'analisi su tutti i pozzetti del modello di cellule vive/morte trattate ed esportare la tabella dei dati contenente l'area ROI, il numero totale di celle, il numero di cellule vive e il numero di cellule morte.
- Calcola il numero di cellule vive e morte come percentuale del numero totale di cellule per giorno di analisi.
5. Immunocolorazione e analisi della popolazione cellulare
- Prima del fissaggio, rimuovere i supporti dai modelli cellulari e lavare i modelli una volta in PBS.
- Fissare le cellule con paraformaldeide al 4% (v/v) in PBS a RT per 20 minuti.
ATTENZIONE: Tutti i lavori con la paraformaldeide devono essere eseguiti secondo le procedure di laboratorio. - Aspirare la soluzione di paraformaldeide al 4% (v/v) dai modelli e lavare i modelli quattro volte in PBS per rimuovere completamente la paraformaldeide.
- Permeabilizzare i modelli cellulari con tritone-X allo 0,2% per 30 minuti a RT e lavare tre volte con PBS.
- Bloccare i modelli cellulari utilizzando il 10% (v/v) di siero d'asina normale (NDS) per 3 ore a RT.
- Rimuovere la soluzione bloccante e aggiungere anticorpi primari (diluiti in NDS all'1% v/v in PBS) ai modelli. Se si esegue l'analisi del rapporto di popolazione cellulare (vedere il passaggio 5.11), assicurarsi di includere modelli cellulari co-colorati per la tubulina Β-III (con coniugazione AF647 rossa) e GFAP (con coniugazione AF488 verde). Incubare i modelli con anticorpi primari per 24 ore a 4 °C.
- Dopo l'incubazione primaria, lavare i modelli colorati con anticorpi primari coniugati tre volte in PBS e controcolorare con Hoechst da 20 μM per 30 minuti. Immagine come descritto al punto 5.10.
- Lavare i modelli colorati con anticorpi primari non coniugati tre volte in PBS e aggiungere anticorpi secondari (diluiti in NDS all'1% v/v in PBS). Incubare per 24 ore a 4 °C.
- Rimuovere gli anticorpi secondari lavando tre volte in PBS e controcolorare i modelli con 20 μM Hoechst per 30 minuti prima dell'imaging.
- Eseguire l'imaging su microscopi standard con canali di eccitazione rossi (647 nm) e verdi (488 nm). Tuttavia, per ottenere i migliori risultati nei modelli 3D, è possibile modellare l'immagine utilizzando un microscopio confocale ad alto contenuto ed eseguire l'imaging utilizzando una funzione Z-stack con ingrandimento 4x o 10x.
- Analisi dei rapporti di popolazione cellulare sulla piattaforma di analisi delle immagini
- Ottenere un'analisi delle popolazioni cellulari utilizzando modelli co-colorati per GFAP (con coniugazione AF488) e tubulina Β-III (con coniugazione AF647).
- Selezionare ciascun piano dell'immagine Z-stack nel software e combinare le immagini del piano come immagine di proiezione alla massima intensità.
- Creare una nuova analisi selezionando il modello biostampato come ROI identificando la fluorescenza dal canale della tubulina Β-III a 647 nm (assicurarsi che tutta l'area contenente le cellule sia selezionata in ROI).
- All'interno della ROI, utilizzare il software per identificare il numero di cellule nel canale Hoechst (405 nm), il numero di astrociti GFAP+ nella ROI utilizzando il canale 488 nm e il numero di cellule Β-III tubulina+ nella ROI utilizzando il canale 647 nm.
- Eseguire l'analisi su tutti i pozzetti del modello di cellule co-colorate ed esportare la tabella dei dati contenente l'area ROI, il numero totale di celle, il numero di cellule GFAP+ e il numero di cellule Β-III tubulin+.
- Calcolare il numero di cellule GFAP+ e Β-III tubulin+ come percentuale del numero totale di cellule.
Representative Results
Analisi della crescita dei neuriti
In questo protocollo, i neuroni glutammatergici e gli astrociti derivati da iPSC sono stati biostampati in cocoltura in una matrice di idrogel utilizzando la biostampante 3D. Nei primi 7 giorni post-stampa, le cellule sono state sottoposte a imaging ogni 12 ore utilizzando un microscopio a cellule vive. Dopo il bioprinting, le cellule dovrebbero avere una morfologia arrotondata e dovrebbero essere disperse in tutta la matrice dell'idrogel, cambiando gradualmente per formare gruppi cellulari più piccoli con poche sporgenze nei primi giorni di coltura (vedere il video supplementare 1 per la crescita di cellule sane rappresentative). Entro il 4° giorno, le cellule sane migreranno in tutto il gel per formare gruppi più grandi, che sono collegati attraverso escrescenze di neuriti. Entro il giorno 7, quasi nessuna singola cellula dovrebbe rimanere, i fasci interconnessi di neuriti e proiezioni astrocitarie dovrebbero apparire fortificati e molte escrescenze di neuriti più piccole possono essere viste formarsi dagli ammassi (Figura 2A). Utilizzando una serie di immagini in campo chiaro di cellule vive scattate durante il periodo di crescita di 7 giorni, è stata eseguita un'analisi della crescita dei neuriti come descritto nella sezione 3. Questa analisi ha dimostrato che la crescita dei neuriti aumenta in modo quasi lineare (valore R2 = 0,84) tra 12 e 156 ore (Figura 2B). Durante questo periodo di crescita dei neuriti, anche i gruppi di corpi cellulari aumentano di dimensioni (vedi video supplementare 1), il che è indicativo della migrazione cellulare in tutto l'idrogel.
Vitalità cellulare e rapporto tra popolazione
In questo protocollo, una concentrazione di 20 milioni di cellule/mL, comprendente 15 milioni di neuroni/mL e 5 milioni di astrociti/mL, viene utilizzata per il bioprinting dei modelli cellulari. Utilizzando la colorazione di cellule vive con calceina-AM (cellule vive), etidio odimero-1 (cellule morte) e una colorazione nucleare, il numero di cellule sopravvissute in un periodo di 7 giorni può essere calcolato come indicato nella sezione 4 (Figura 3A). I risultati di vitalità cellulare per colture rappresentative sono mostrati per il giorno 4, in cui il 72% ± l'1% (media ± SEM) delle cellule totali sono vive e mostrano colorazione per Calceina-AM, mentre il 29% ± 2% (media ± SEM) le cellule totali sono morte e mostrano colorazione con l'omodimero di etidio-1 (Figura 3B). Immagini rappresentative della colorazione cellulare con Calceina-AM e omodimero di etidio-1 possono essere viste nella Figura 1 supplementare. Va notato che i valori di sopravvivenza cellulare per le colture 3D non possono essere confrontati direttamente con le colture 2D, poiché le cellule morte vengono trattenute nell'idrogel e non verranno rimosse durante i processi di alimentazione cellulare.
Utilizzando la colorazione immunofluorescente per la tubulina Β-III e la GFAP, come descritto nel paragrafo 5 e nella Figura 4, è possibile effettuare un'analisi delle immagini per determinare i rapporti di popolazione cellulare tra neuroni e astrociti (Figura 3A). Del totale delle cellule per modello in colture rappresentative, i neuroni positivi alla tubulina Β-III rappresentano il 49% ± il 3% (MES ± media), mentre gli astrociti GFAP positivi rappresentano il 30% ± 4% (SEM ± media). Questo dà un rapporto di 1:1,5, rispettivamente tra astrociti e neuroni. Ciò lascia un resto del 21% di cellule totali per modello, che non si colorano per nessuno dei due marcatori cellulari. Poiché l'analisi della vitalità cellulare ha dimostrato che un valore medio del 29% delle cellule non è vitale al giorno 4, è probabile che queste cellule siano morte all'interno dell'idrogel.
Espressione di marcatori cellulari
La morfologia dei neuroni e degli astrociti biostampati è stata valutata attraverso l'immunocolorazione per il marcatore del tipo di cellula neuronale (tubulina Β-III) e del marcatore astrocitario (GFAP). Nelle colture rappresentative mostrate, l'immunocolorazione è localizzata ai singoli tipi di cellule, mostrando una morfologia cellulare sana, con entrambi i tipi di cellule che mostrano una crescita di protrusioni cellulari (Figura 4A,B). Poiché l'idrogel e le strutture cellulari sono tridimensionali, ogni immagine rappresenta solo una fetta attraverso la struttura nella Figura 4A,B. La Figura 4C mostra una pila di immagini unite in tutto l'idrogel, dimostrando le viste della localizzazione delle cellule nei piani X, Y e Z. La Figura 4D mostra l'immunocolorazione solo per la tubulina Β-III; evidenziando le escrescenze di neuriti più fini dai cluster del corpo cellulare. Per esaminare ulteriormente il fenotipo dei neuroni glutammatergici, è possibile effettuare l'immunocolorazione del marcatore del recettore ionico glutammatergico, GluR2. All'interno della Figura 4E, l'area 4E.1 (riquadro) è stata evidenziata per mostrare una colorazione puntiforme ad alta risoluzione lungo i fasci di neuriti. Questo conferma quindi che i neuroni in questa cocoltura hanno un fenotipo glutammatergico. In tutte le immagini di immunocolorazione, è possibile osservare strutture non cellulari colorate con immunofluorescenza che circondano i cluster cellulari e i neuriti. È probabile che queste strutture rappresentino detriti trattenuti all'interno dell'idrogel in combinazione con piccole quantità di anticorpi non specifici che si legano all'idrogel. Questo è previsto nelle colture biostampate, poiché all'interno dei modelli di scaffold 3D, le cellule morte e i detriti non vengono rimossi durante l'alimentazione cellulare. Un'immagine rappresentativa dell'immunocolorazione di controllo negativo è mostrata nella Figura 2 supplementare per una dimostrazione del legame non specifico dell'idrogel degli anticorpi secondari.
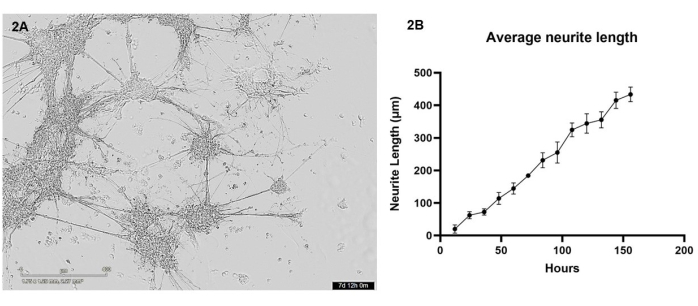
Figura 2: I neuroni glutammatergici e gli astrociti sono stati biostampati nella matrice di idrogel utilizzando la biostampante e sono stati sottoposti a imaging ogni 12 ore utilizzando un microscopio in campo chiaro. (A) Un esempio di immagine in campo chiaro scattata di colture cellulari durante l'analisi. L'immagine rappresenta il punto temporale 156 h e la barra della scala rappresenta 400 μm. (B) La lunghezza media delle escrescenze di neuriti (μm) dalle colture misurate utilizzando il pacchetto NeuronJ per ImageJ. Ogni punto dati è n = 3 neuriti e i dati sono mostrati come media ± SEM. Fare clic qui per visualizzare una versione più grande di questa figura.
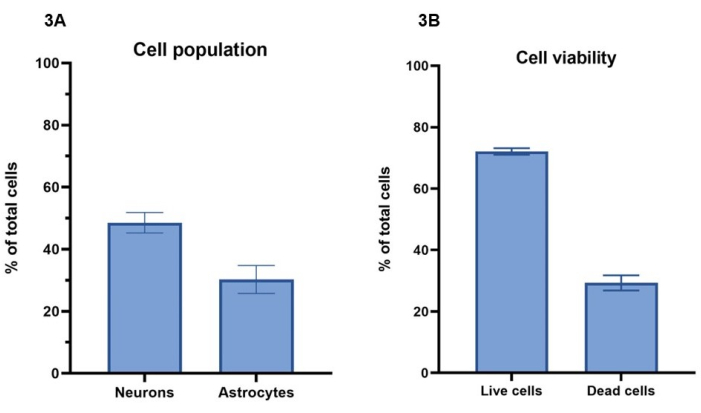
Figura 3: Una concentrazione di 20 milioni di cellule/mL di soluzione attivante è stata utilizzata per il bioprinting dei modelli cellulari. (A) La vitalità cellulare è stata calcolata utilizzando coloranti a cellule vive/morte (rispettivamente calceina-AM ed etidio odimero-1). I valori mostrano che il 72% ± l'1% (media ± SEM, n = 3) delle cellule totali per pozzetto sono vive e il 29% ± 2% (media ± SEM, n = 3) delle cellule sono morte della popolazione cellulare totale per pozzetto al giorno 4. I valori mostrati rappresentano la media ± SEM. (B) La percentuale di popolazioni cellulari di neuroni e astrociti per pozzetto è stata calcolata attraverso l'analisi delle immagini della colorazione mostrata nella Figura 4. I neuroni rappresentano la percentuale di cellule che si colorano positivamente per la tubulina Β-III al giorno 7 (49% ± 3%, media ± SEM, n = 3), mentre gli astrociti rappresentano la percentuale di cellule che colorano positive per GFAP al giorno 7 (30% ± 4%, media ± SEM, n = 3). I valori indicati rappresentano la media ± SEM. Tutte le immagini per i calcoli mostrati nella Figura 3 sono state eseguite su un sistema di imaging confocale e tutte le analisi sono state eseguite sulla piattaforma di analisi delle immagini e sul prisma GraphPad come da metodi. Fare clic qui per visualizzare una versione più grande di questa figura.
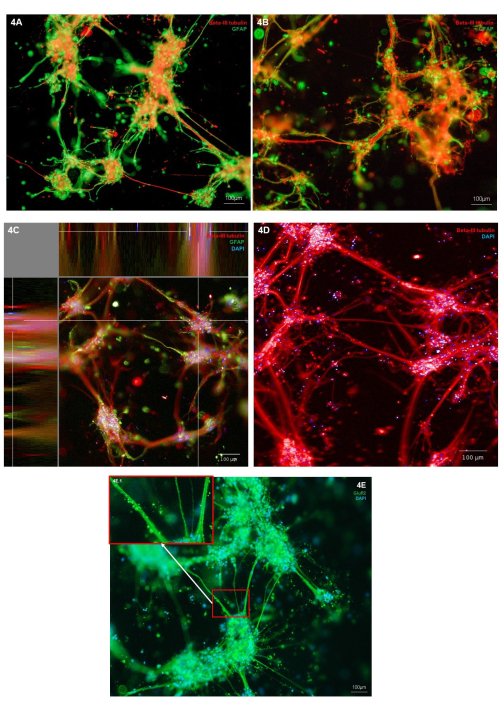
Figura 4: Espressione di marcatori di tipo di cellule neurali in cocolture biostampate in 3D di neuroni glutammatergici e astrociti al giorno 7 . (A,B) Colorazione immunofluorescente del marcatore neuronale Β-III tubulina e del marcatore astrocitario GFAP, ripreso su una piattaforma di microscopio invertito con un ingrandimento di 10x. Le barre della scala rappresentano 100 μm. (C) Colorazione immunofluorescente del marcatore neuronale β-III tubulina e del marcatore astrocitario GFAP co-colorato con Hoechst, mostrato nella vista piana XYZ, ripreso su un sistema di imaging confocale con ingrandimento 10x. Creato sulla piattaforma di analisi delle immagini. La barra della scala rappresenta 100 μm. (D) Colorazione immunofluorescente del marcatore neuronale β-III tubulina co-colorata con Hoechst, ripresa su un sistema di imaging confocale con ingrandimento 20x. La barra della scala rappresenta 100 μm. (E) Colorazione immunofluorescente del marcatore glutammatergico GluR2 co-colorato con Hoechst, ripreso su una piattaforma di microscopio invertito a 10x di ingrandimento. Il riquadro 3E.1 mostra le aree evidenziate della colorazione GluR2. La barra della scala rappresenta 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Video supplementare 1: I neuroni glutammatergici e gli astrociti sono stati biostampati nella matrice di idrogel utilizzando la biostampante e sono stati sottoposti a imaging ogni 12 ore utilizzando un microscopio in campo chiaro. Video di immagini in campo chiaro scattate di colture cellulari durante l'analisi, i punti temporali sono indicati nell'angolo in basso a destra e le barre della scala rappresentano 400 μm. Fare clic qui per scaricare questo file.
Figura supplementare 1: Immagini di esempio di analisi vive/morte di neuroni e astrociti biostampati il giorno 4. La colorazione di calceina-AM è mostrata in verde (488 nm) e la colorazione di omodimero di etidio è mostrata in rosso (647 nm). L'immagine viene mostrata nella vista piana XYZ, creata sulla piattaforma di analisi delle immagini. La barra della scala rappresenta 100 μm. (A) L'imaging è stato effettuato utilizzando un sistema di imaging confocale con ingrandimento 4x. (B) L'imaging è stato effettuato utilizzando un sistema di imaging confocale con ingrandimento 10x Fare clic qui per scaricare questo file.
Figura 2 supplementare: Esempio di immagine di controllo negativo dopo colorazione immunofluorescente. Gli anticorpi primari sono stati omessi e sono stati utilizzati gli anticorpi secondari verdi (488 nm) e rossi (647 nm) secondo i protocolli di immunocolorazione. L'immagine viene mostrata nella vista piana XYZ, creata sulla piattaforma di analisi delle immagini. La barra della scala rappresenta 100 μm. L'imaging è stato effettuato utilizzando un sistema di imaging confocale con un ingrandimento di 10x. Fare clic qui per scaricare il file.
Discussion
La necessità di modelli accurati del sistema nervoso centrale non è mai stata così elevata e i limiti dei modelli di coltura cellulare tradizionali bidimensionali (2D) hanno portato a una generazione di modelli complessi del sistema nervoso centrale negli ultimi anni19. Tuttavia, molti modelli 3D complessi che rappresentano le interazioni tra i tipi di cellule neurali e l'ECM hanno limitazioni che impedirebbero l'applicazione di questi modelli nei processi industriali 6,20,21. In questo protocollo, sviluppiamo un modello di cocoltura 3D di neuroni e astrociti umani derivati da iPSC, che mira a risolvere alcune di queste limitazioni utilizzando la tecnologia di bioprinting 3D per creare un'impalcatura di idrogel bioattivo nei formati a 96 e 384 pozzetti.
La metodologia per lo sviluppo di questi modelli è stata semplificata attraverso il software di progettazione della mappa delle lastre, i protocolli di stampa generati automaticamente e il processo di stampa guidato dalla biostampante. Tuttavia, a causa della natura sensibile dei tipi di cellule sensibili derivate da iPSC utilizzati in questo protocollo, è necessario prestare attenzione alle seguenti fasi critiche dello scongelamento e della coltura. In primo luogo, l'inclusione dell'inibitore ROCK (ROCKi) ha diversi vantaggi durante il processo di bioprinting e durante la coltura precoce. Lo scongelamento cellulare è un punto critico in cui i neuroni possono sperimentare una risposta allo stress e protocolli di scongelamento impropri possono ridurre le possibilità di sopravvivenza22. In genere si consiglia di scongelare le cellule, aggiungere terreni e portare le cellule alla temperatura dell'incubatrice nel modo più efficiente possibile23. Tuttavia, durante il processo di bioprinting descritto in questo protocollo, è necessario che i neuroni e gli astrociti siano risospesi in una soluzione attivatrice piuttosto che in un supporto, e le cellule non saranno sollevate al di sopra della temperatura ambiente fino alla fine della tiratura (fino a 30 minuti dopo il disgelo). Pertanto, l'aggiunta di ROCKi al terreno immediatamente dopo lo scongelamento e l'inclusione di questo durante le due fasi di centrifugazione (fasi 2.1--2.7 e 1.3.15-1.3.20) è indispensabile per inibire le vie di stress cellulare, che si tradurrebbero in livelli di vitalità più bassi24. Inoltre, è stato dimostrato che ROCKi promuove la crescita dei neuriti e migliora la maturazione neuronale25. Pertanto, l'integrazione di ROCKi viene continuata per 48 ore dopo il bioprinting. Tuttavia, è imperativo rimuovere l'integrazione di ROCKi dopo 48 ore per garantire il lavaggio completo durante i successivi cambi di terreno prima che le cellule vengano utilizzate per il saggio.
Un'ulteriore fase che richiede un'attenzione critica è durante l'aggiunta e la sostituzione dei supporti post-stampa (passaggi 2.8-2.13). Lo scaffold in idrogel biostampato ha una rigidità biomeccanica equivalente di soli 1,1 kPa, equivalente alla materia grigia. Come descritto al punto 2.10, è fondamentale pipettare delicatamente nel lato del pozzetto durante l'aggiunta e l'aspirazione del terreno per evitare disturbi. Ciò è particolarmente rilevante per le piastre a 384 pozzetti, dove il livello di gel occupa una percentuale maggiore del volume totale del pozzetto. Questo metodo dovrebbe essere utilizzato anche nei pozzetti di controllo 2D per prevenire il sollevamento dei bordi delle cellule e il taglio delle escrescenze di neuriti. Gli autori vorrebbero anche sottolineare l'importanza della tecnica sterile all'interno della bioprinter, che dovrebbe essere trattata con una cautela equivalente a quella di una cabina di biosicurezza utilizzata per le colture cellulari derivate da iPSC. Ciò include il filtraggio sterile del 70% di EtOH e dH2O utilizzato nelle procedure di illuminazione e stampa, il mantenimento dei coperchi sulle cartucce e sulle piastre mentre si muovono le mani dentro e fuori dalla biostampante e la decontaminazione delle superfici all'interno della biostampante con salviette al 70% di etanolo prima e dopo la stampa.
L'impalcatura di idrogel biostampata, formata da soluzioni di bioink e attivatori, selezionata per sviluppare questo modello è selezionata da una gamma di bioink e soluzioni attivatrici sviluppate da Inventia Life Science per l'uso all'interno della biostampante RASTRUM. La laminina e l'acido ialuronico sono stati identificati come molecole rilevanti per la maturazione neuronale derivata da iPSC a causa del loro ruolo nella guida assonale, nella formazione delle sinapsi e nella formazione della rete perineuronale26,27. Inoltre, è stata selezionata una rigidità biomeccanica di 1,1 kPa, poiché è stato dimostrato che gli idrogel a bassa densità consentono una migliore crescita dei neuriti dai neuroni12. Se vengono apportate modifiche al protocollo utilizzando neuroni e astrociti che sono stati differenziati internamente o da un diverso fornitore commerciale, si consiglia di eseguire un test di selezione della matrice per determinare l'impalcatura di idrogel più favorevole15. Inoltre, potrebbe anche essere necessario ottimizzare la densità cellulare se vengono apportate modifiche alle fonti cellulari per garantire una vitalità ottimale e prevenire il sovraffollamento dell'idrogel. Per tutte le modifiche e la risoluzione dei problemi relativi alla funzione bioprinter, gli autori raccomandano di contattare i produttori e di fare riferimento ai protocolli del produttore.
Il sistema nervoso centrale contiene un'ampia gamma di sottotipi neuronali e cellule gliali, che esistono tutti in diverse nicchie cerebrali e hanno ruoli specifici che contribuiscono alla funzione neurale28. Nel contesto di questo ampio ambito, questo modello rappresenta solo i due tipi cellulari più abbondanti (astrociti e neuroni glutammatergici eccitatori). Importanti tipi di cellule come la microglia, gli oligodendrociti e le cellule endoteliali che formano la barriera emato-encefalica sono omessi da questo sistema. L'inclusione della microglia potrebbe essere rilevante per concentrarsi sulle interazioni neuroimmunitarie e gli oligodendrociti potrebbero essere di interesse nelle malattie che colpiscono la mielinizzazione centrale. Oltre al loro ruolo nella patologia, cellule come le cellule endoteliali che formano la barriera emato-encefalica espellono enzimi che metabolizzano i farmaci, il che potrebbe influenzare l'uso di questo modello per i saggi di farmacocinetica29. Un'ulteriore limitazione del modello potrebbe essere il rapporto tra astrociti e neuroni; Il rapporto tra astrociti e neuroni varia notevolmente tra le regioni del cervello, con valori suggeriti compresi tra 1:1 e 1:330,31. Questo modello ha un rapporto approssimativo di 1:1,5 astrociti rispetto ai neuroni; Pertanto, questo modello potrebbe non essere rilevante per le aree cerebrali modello in cui gli astrociti sono più abbondanti, come nelle aree della sostanza bianca30.
Negli ultimi anni sono stati pubblicati altri protocolli per sviluppare modelli di cocoltura biostampati in 3D. Una pubblicazione di Sullivan et al., 2021, ha presentato un modello neurale biostampato in 3D utilizzando cellule progenitrici neurali derivate da iPSC, che dimostra un'elevata vitalità post-stampa e un miglioramento della funzione neuronale rispetto alle colture 2D32. Tuttavia, in questo protocollo, le cellule progenitrici neurali sono state utilizzate come fonte di cellule e sono state mantenute in coltura per 4 settimane. In questo protocollo, sono stati utilizzati neuroni glutammatergici e astrociti derivati da iPSC disponibili in commercio. Ciò consente di creare una rete 3D di cellule co-coltivate in soli 7 giorni; Come dimostrato dall'analisi della crescita dei neuriti, la crescita dei neuriti inizia entro 24 ore e continua in modo lineare per tutto il periodo di 156 ore per il quale è stata monitorata la crescita cellulare. La rapida costituzione di queste reti può essere in parte attribuita all'uso di neuroni glutammatergici che utilizzano l'espressione genica indotta dalla doxiciclina ottimizzata di NGN2, che mostra l'espressione di marcatori di sottotipo neuronale maturi entro 7 giorni, anche in coltura 2D33. L'accorciamento di questo periodo di crescita con questa tecnica è importante per l'implementazione di modelli all'interno dell'industria biofarmaceutica, poiché lo sviluppo di saggi richiede una rapida inversione di tendenza e lo sviluppo di modelli cellulari15.
In conclusione, questo modello mostra il potenziale per un modello 3D di neuroni e astrociti, che viene stabilito in modo rapido e conveniente per scopi di screening. Le applicazioni future per questo tipo di modello potrebbero riguardare gli sforzi di scoperta di farmaci in diverse malattie del SNC, con l'opportunità di espandersi a diverse malattie utilizzando linee iPSC di pazienti o malattie geneticamente modificate. Inoltre, l'uso di neuroni glutammatergici derivati da iPSC inducibili dalla doxiciclina NGN2 consente alle cellule di raggiungere la maturità in meno tempo, che può essere utilizzato per lo sviluppo di modelli del cervello che invecchia per la ricerca sulla neurodegenerazione. Questo sistema potrebbe anche essere ampliato attraverso l'uso di ulteriori tipi di cellule in cocoltura, tra cui microglia e oligodendrociti.
Disclosures
CW, NC e JB sono dipendenti di Merck Sharp & Dohme (UK) Limited, Londra, Regno Unito. YH è un dipendente di Merck Sharp & Dohme LLC, una filiale di Merck & Co., Inc., Rahway, NJ, USA.
La figura uno è stata creata utilizzando Biorender.com.
Acknowledgements
Gli autori desiderano ringraziare Alex Volkerling, Martin Engel e Rachel Bleach per la loro assistenza nello sviluppo del protocollo e per il feedback sul manoscritto.
Materials
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol | Thermofisher | 31350010 | |
| 384-well plate | PerkinElmer | 6057300 | |
| 96-well plate | PerkinElmer | 6055300 | |
| Activator fluid F299 | Inventia Life Science | N/A | |
| Activator fluid F3 | Inventia Life Science | N/A | |
| B27 (50x) minus Vit A | Thermofisher | 12587010 | |
| Bioink fluid F261 | Inventia Life Science | N/A | |
| Bioink fluid F32 | Inventia Life Science | N/A | |
| Doxycycline hyclate | Sigma Aldrich | D5207 | |
| GlutaMAX (100x) | Thermofisher | 35050061 | |
| Goat anti-mouse IgG H&L Alexa Fluor 647 | Abcam | ab150115 | |
| Goat anti-rabbit IgG H&L Alexa Fluor 488 | Abcam | ab150077 | |
| Hoechst | Abcam | ab228551 | |
| Human BDNF Recombinant Protein | Thermofisher | PHC7074 | |
| Human NT3 Recombinant Protein | Thermofisher | PHC7036 | |
| iCell Astrocytes | Fujifilm CDI | 1434 | |
| INCell Analyser 6500HS | Molecular Devices | N/A | high content imaging system |
| Incucyte S3 | Sartorius | N/A | |
| ioGlutamatergic Neurons (Large vial) | Bit.bio | e001 | |
| Laminin (1 mg/mL) | Sigma Aldrich | L2020 | |
| Live/dead kit (Calcein-AM, Ethidium homo-dimer-1) | Invitrogen | L3224 | |
| Mouse anti-BIII tubulin NL637 conjugated | R&D systems | SC024 | |
| Neurobasal media | Thermofisher | 21103049 | |
| Normal Donkey Serum | Abcam | ab7475 | |
| NucBlue Live (Hoechst 33342) | Thermofisher | R37605 | |
| Opti-MEM | Thermofisher | 11058021 | |
| Paraformaldehyde | Sigma Aldrich | P6148 | |
| PEI 50% in H2O | Sigma Aldrich | 181978 | |
| Pierce Borate Buffer 20x | Thermofisher | 28341 | |
| Prism | GraphPad | Data analysis software | |
| Rabbit anti-ionotropic glutamatre receptor 2 (GluR2) | Abcam | ab206293 | |
| RASTRUM(TM) Bioprinter | Inventia Life Science | N/A | Bioprinter |
| RASTRUM(TM) Bioprinter Cartridges | Inventia Life Science | N/A | Bioprinter Cartridges |
| RASTRUM(TM) Targeting plate | Inventia Life Science | N/A | Targeting plate |
| Rho kinase (ROCK) inhibitor | Abcam | ab120129 | |
| Sheep anti-GFAP NL493 conjugated | R&D systems | SC024 | |
| Signals Image Artist | PerkinElmer | N/A | Image analysis platform |
| Triton X-100 | Thermofisher | HFH10 | |
| Zeiss Axio Observer | Zeiss | N/A | Inverted microscope platform |
References
- Jung, Y. L., Hwang, J., Yoo, H. S. Disease burden metrics the innovations of leading pharmaceutical companies: a global and regional comparative study. Globalization and Health. 16 (1), 80-80 (2020).
- Potkin, S. G., et al. The neurobiology of treatment-resistant schizophrenia: paths to antipsychotic resistance and a roadmap for future research. npj Schizophrenia. 6, 1 (2020).
- Zahra, W., et al., Keswani, C., et al. The Global Economic Impact of Neurodegenerative Diseases: Opportunities and Challenges. Bioeconomy for Sustainable Development. , (2019).
- Perucca, E. The pharmacological treatment of epilepsy: recent advances and future perspectives. Acta Epileptologica. 3 (1), 22 (2021).
- Nikolakopoulou, P., et al. Recent progress in translational engineered in vitro models of the central nervous system. Brain. 143 (11), 3181-3213 (2020).
- Whitehouse, C., Corbett, N., Brownlees, J. 3D models of neurodegeneration: implementation in drug discovery. Trends in Pharmacological Sciences. 44 (4), 208-221 (2023).
- Rauti, R., Renous, N., Maoz, B. M. Mimicking the brain extracellular matrix in vitro: A review of current methodologies and challenges. Israel Journal of Chemistry. 60 (12), 1141-1151 (2020).
- Fawcett, J. W., Oohashi, T., Pizzorusso, T. The roles of perineuronal nets and the perinodal extracellular matrix in neuronal function. Nature Reviews Neuroscience. 20 (8), 451-465 (2019).
- Lam, D., et al. Tissue-specific extracellular matrix accelerates the formation of neural networks and communities in a neuron-glia co-culture on a multi-electrode array. Scientific Reports. 9, 4159 (2019).
- Roll, L., Lessmann, K., Brüstle, O., Faissner, A. Cerebral organoids maintain the expression of neural stem cell-associated glycoepitopes and extracellular matrix. Cells. 11 (5), 760 (2022).
- Yan, Y., Bejoy, J., Marzano, M., Li, Y. The use of pluripotent stem cell-derived organoids to study extracellular matrix development during neural degeneration. Cells. 8 (3), 242 (2019).
- Ma, L., et al. 3D bioprinted hyaluronic acid-based cell-laden scaffold for brain microenvironment simulation. Bio-Design and Manufacturing. 3 (3), 164-174 (2020).
- Liaw, C. -. Y., Ji, S., Guvendiren, M. Engineering 3D hydrogels for personalized in vitro human tissue models. Advanced Healthcare Materials. 7 (4), 1701165 (2018).
- Ma, J., Huang, C. Composition and mechanism of three-dimensional hydrogel system in regulating stem cell fate. Tissue Engineering Part B: Reviews. 26 (6), 498-518 (2020).
- Belfiore, L., et al. Generation and analysis of 3D cell culture models for drug discovery. European Journal of Pharmaceutical Sciences. 163, 105876 (2021).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6 (2018).
- Engel, M., Belfiore, L., Aghaei, B., Sutija, M. Enabling high throughput drug discovery in 3D cell cultures through a novel bioprinting workflow. SLAS Technology. 27 (1), 32-38 (2022).
- Takamura, T., et al. Influence of age on global and regional brain stiffness in young and middle-aged adults. Journal of Magnetic Resonance Imaging. 51 (3), 727-733 (2020).
- Slanzi, A., Iannoto, G., Rossi, B., Zenaro, E., Constantin, G. In vitro models of neurodegenerative diseases. Frontiers in Cell and Developmental Biology. 8, 328 (2020).
- de Souza, N. Organoid variability examined. Nature Methods. 14 (7), 655-655 (2017).
- Hernández, D., et al. Culture variabilities of human iPSC-derived cerebral organoids are a major issue for the modelling of phenotypes observed in Alzheimer's disease. Stem Cell Review and Reports. 18 (2), 718-731 (2022).
- Li, R., et al. Differentiation of human iPS cells into sensory neurons exhibits developmental stage-specific cryopreservation challenges. Frontiers in Cell and Developmental Biology. 9, 796960 (2021).
- Nishiyama, Y., et al. Safe and efficient method for cryopreservation of human induced pluripotent stem cell-derived neural stem and progenitor cells by a programmed freezer with a magnetic field. Neuroscience Research. 107, 20-29 (2016).
- Uhrig, M., Ezquer, F., Ezquer, M. Improving cell recovery: Freezing and thawing optimization of induced pluripotent stem cells. Cells. 11 (5), 799 (2022).
- Harbom, L. J., et al. The effect of rho kinase inhibition on morphological and electrophysiological maturity in iPSC-derived neurons. Cell and Tissue Research. 375 (3), 641-654 (2019).
- Koh, H. S., Yong, T., Chan, C. K., Ramakrishna, S. Enhancement of neurite outgrowth using nano-structured scaffolds coupled with laminin. Biomaterials. 29 (26), 3574-3582 (2008).
- Tarus, D., et al. Design of hyaluronic acid hydrogels to promote neurite outgrowth in three dimensions. ACS Applied Materials & Interfaces. 8 (38), 25051-25059 (2016).
- Brain Initiative Cell Census Network (BICCN). Initiative Cell Census Network (BICCN). A multimodal cell census and atlas of the mammalian primary motor cortex. Nature. 598 (7879), 86-102 (2021).
- Dauchy, S., et al. Expression and transcriptional regulation of ABC transporters and cytochromes P450 in hCMEC/D3 human cerebral microvascular endothelial cells. Biochemical Pharmacology. 77 (5), 897-909 (2009).
- Herculano-Houzel, S. The glia/neuron ratio: How it varies uniformly across brain structures and species and what that means for brain physiology and evolution. Glia. 62 (9), 1377-1391 (2014).
- von Bartheld, C. S., Bahney, J., Herculano-Houzel, S. The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. The Journal of Comparative Neurology. 524 (18), 3865-3895 (2016).
- Sullivan, M. A., et al. 3D bioprinting of stem cell-derived central nervous system cells enables astrocyte growth, vasculogenesis and enhances neural differentiation/function. bioRxiv. , (2022).
- Pawlowski, M., et al. Inducible and deterministic forward programming of human pluripotent stem cells into neurons, skeletal myocytes, and oligodendrocytes. Stem Cell Reports. 8 (4), 803-812 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved