הפעלה עצבית מרחוק יחד עם דגימת דם אוטומטית כדי לגרום ולמדוד הורמון luteinizing במחזור בעכברים
In This Article
Summary
פעימות הורמון luteinizing (LH) הוא סימן היכר של תפקוד הרבייה. אנו מתארים פרוטוקול להפעלה מרחוק של אוכלוסיות נוירונים ספציפיות הקשורות לאיסוף דם אוטומטי סדרתי. טכניקה זו מאפשרת אפנון הורמונלי מתוזמן, ריבוב ומזעור השפעות מניפולציה על רמות LH בבעלי חיים הנעים בחופשיות מודעת, וללא הפרעה.
Abstract
רמות הורמון luteinizing במחזור הדם (LH) הן מדד חיוני לתפקוד הבקרה ההיפותלמוסית-יותרת המוח של רבייה. תפקידם של קלטים רבים ואוכלוסיות עצביות באפנון שחרור LH עדיין אינו ידוע. מדידת שינויים ברמות LH בעכברים היא לעתים קרובות אתגר מכיוון שהם מופרעים בקלות על ידי לחץ סביבתי. הטכניקות הנוכחיות למדידת שחרור LH ופעימה דורשות הכשרה ארוכת טווח לעכברים להסתגל ללחץ מניפולציה, ריסון מסוים, נוכחות החוקר, ועבודה על בעלי חיים בודדים, מה שמקטין את התועלת שלה לשאלות מחקר רבות.
מאמר זה מציג טכניקה להפעלה מרחוק של אוכלוסיות נוירונים ספציפיות באמצעות טכנולוגיית Designer Receptor Exclusivd by Designer Drugs (DREADDs) בשילוב עם דגימת דם אוטומטית רציפה בעכברים מודעים, נעים בחופשיות וללא הפרעות. ראשית אנו מתארים את פרוטוקול הניתוח הסטריאוטקסי כדי לספק וקטורים הקשורים לווירוס אדנו (AAV) המבטאים DREADDs לאוכלוסיות נוירונים ספציפיות. לאחר מכן, אנו מתארים את הפרוטוקול עבור קנולציה של עורק התרדמה ווריד הצוואר וחיבור לאחר ניתוח למערכת דגימת הדם האוטומטית CULEX. לבסוף, אנו מתארים את הפרוטוקול להזרקה תוך ורידית של clozapine-N-oxide להפעלה עצבית מרחוק ואיסוף דם אוטומטי. טכניקה זו מאפשרת דגימה אוטומטית מתוכנתת כל 5 דקות או יותר לתקופה נתונה, יחד עם הזרקת חומר תוך ורידי בנקודת זמן או משך זמן רצויים. בסך הכל, מצאנו שטכניקה זו היא גישה רבת עוצמה למחקר על בקרה נוירואנדוקרינית.
Introduction
ציר ההיפותלמו-יותרת המוח-גונדל (HPG) מווסת באופן מרכזי על ידי שחרור פולסטילי של הורמון משחרר גונדוטרופין (GnRH) למערכת פורטל יותרת המוח. בבלוטת יותרת המוח, GnRH שולט בשחרור פולסטילי של גונדוטרופינים, הורמון luteinizing (LH), והורמון מגרה זקיק (FSH) למערכת הדם. שחרור פולסטיל LH משמש כסימן היכר לתפקוד ציר HPG מרכזי 1,2,3,4. לדוגמה, הוא מציג את ההשפעות של שינויים גנטיים או שינויים בגורמים הורמונליים או סביבתיים על החלק העצבי של ציר 5,6,7. עד לאחרונה, מדידת תבנית פולסטילית LH הייתה מוגבלת ליונקים גדולים8 וחולדות9, בהתחשב בתדירות הגבוהה של הדגימה ובנפחי הדם הגדולים הדרושים לזיהוי הפולסים.
זיהוי פולסי LH בעכברים הוא רצוי מכיוון שלמין זה יש מודלים גנטיים רחבים זמינים וניתן לתמרן אותו בקלות באמצעות טכנולוגיות הנדסה גנומית כדי להמשיך לחקור גנים ספציפיים ואוכלוסיות תאים. בעשור האחרון, התקדמות גדולה בניתוח ריכוזי LH בעכברים באמצעות בדיקת אימונוסורבנט מקושרת אנזים LH סנדוויץ' (ELISA) אפשרה לזהות LH בכמות זעירה של דם10. פיתוח טכניקת דגימת הדם התכופה בקצה הזנב איפשר את הדגימה התכופה הדרושה לאיתור התדירות והמשרעת של פולסי LH בעכברים10,11. עם זאת, דגימת דם בקצה הזנב מוגבלת לשימוש בו בבעלי חיים ערים בהכרה; זה דורש תקופת הכשרה ארוכה לעכברים להסתגל לטיפול ולנוכחות של חוקר ייעודי במהלך הדגימה. הצלחתו רגישה מאוד לגורמי עקה סביבתיים וייתכן שאינה מתאימה לשימוש בזני עכברים המראים רמות גבוהות של חרדה. קנולציה תוך-פרוזדורית שימשה גם לדגימת דם תכופה בעכברים מודעים הנעים בחופשיות12. עם זאת, הגדרה זו עדיין דורשת דגימת דם ידנית חוזרת ומגבילה את מרחב התנועה של בעלי החיים, בעוד קנולציה פרוזדורית יכולה להוביל לשינויים דינמיים בתפקוד הלב. לכן רצוי לבסס שיטה לאיסוף דם בתנאים נטולי לחץ בעכברים מודעים, נעים בחופשיות וללא הפרעות ללא צורך באימון מוקדם או בטיפול או נוכחות אנושית.
דגימת דם או דיאליזה אוטומטית שימשה בעבר למדידת רמות הורמונים שונות (למשל, מלטונין13,14) והפרשת הפעימות שלהם (למשל, הורמון גדילה)15 במכרסמים לא מרוסנים. אנו מציגים כאן פרוטוקול לדגימת דם אוטומטית תכופה לטווח ארוך בבעלי חיים מודעים ובלתי מרוסנים, יחד עם הפעלה מרחוק בזמן של אוכלוסיות נוירונים ספציפיות באמצעות טכנולוגיות כימוגנטיות: קולטני המעצבים המופעלים באופן בלעדי על ידי סמי פיצוציות (DREADDs). נתאר את ההעברה הסטריאוטקסית של וקטור וירוס הקשור לאדנו (AAV) ואת ההפעלה מרחוק על ידי מסירה אוטומטית תוך ורידית (IV) של קלוזאפין-N-אוקסיד (CNO)16,17. פרוטוקול זה מאפשר זיהוי רציף של רמות הבסיס ושינויים מושרים בפעימות LH במספר בעלי חיים בו זמנית. הן דגימת הדם והן מתן העירוי של התרכובת מתבצעות באופן מבוקר בזמן באמצעות תוכנת מחשב המבטלת את נוכחותו הפיזית של החוקר או את הדרישה לאימון עכבר קודם. שיטה זו מתגברת על המגבלות העיקריות של דגימת דם ידנית. הוא מאפשר דגימת דם במצב נטול מתח, ואספקת תרכובת עירוי בו זמנית יחד עם בקרת פעילות עצבית מרחוק. אנו מציגים תוצאות מייצגות של השימוש בדגימת דם אוטומטית לבד או בשילוב עם הפעלה עצבית מרחוק ודנים ביתרונותיה, מגבלותיה ושימושים נוספים.
Protocol
כל ההליכים בבעלי חיים מבוצעים בהתאם למדריך המועצה הלאומית למחקר לטיפול ושימוש בחיות מעבדה18 וכן לחוקים פדרליים, מדינתיים ומקומיים. נקבות עכברים בוגרות (בנות 3-6 חודשים) שימשו להדגמת פרוטוקול זה, כולל ארבע נקבות C57BL/6J וארבע Kiss1-Cre; נקבות ChR2-eYFP (Kiss1-eYFP). עכברים הוחזקו תחת מחזור אור:חושך 12:12, טמפרטורה מבוקרת ב 22 מעלות צלזיוס, והוזנו אד ליביטיום על דיאטה נמוכה phytoestrogen. נהלים ופרוטוקולים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת מישיגן (IACUC, Animal Protocols: PRO00010420 and PRO00010138).
1. העברה סטריאוטקסית של AAVs לאוכלוסיית תאים ספציפית
- הכנה לניתוח
- לעקר את כל הכלים. הכינו חבילות מרובות של כלים כירורגיים כדי להבטיח שכל חבילה תשמש לא יותר מחמישה בעלי חיים. הכינו כפפות סטריליות, מינימום זוג אחד לכל חיה.
- משוך מיקרופיפטות זכוכית להזרקה באמצעות ההגדרות הבאות (ראה טבלת חומרים) עבור מיקרופיפטות דקות וארוכות המזריקות לאט ובהתמדה ואינן נסתמות בקלות: חום 1: 915, חום 2: 630, משיכה: 630. מטב הגדרות אלה עבור כל מושך.
- ביצוע ניתוחים בחלל כירורגי ייעודי. יש לחטא משטחי ניתוח באתנול 70%.
- השתמש וילונות סטריליים כדי לשמור על סטריליות של שדה הניתוח. יש ללבוש מעיל מעבדה נקי או חלוק חד פעמי ומסכה.
- הכינו מערכת הרדמה בשאיפה. פתח את אספקת החמצן ומווסת את קצב הזרימה ל-0.8 ליטר/דקה.
- כירורגיה
- הניחו את העכבר בקופסת הרדמה ופתחו את האיזופלורן ל-2.5%. להפחית את זרימת isoflurane ל 2% לאחר השראה ראשונית; לשמור על זרימה לאורך כל ההליך. לשיטות הרדמה חלופיות, עיין בפרוטוקול בעלי חיים ובהנחיות ועדת האתיקה המקומית.
- יש להזריק משכך כאבים מונע (קרפרופן 5 מ"ג/ק"ג s.c.) בעקבות המלצת הוועדה לשימוש בבעלי חיים והתקנות המקומיות.
- גלח את ראש העכבר באמצעות קוצצים.
- התקינו את בעל החיים על שולחן סטריאוטקסי, הניחו מוטות אוזניים וודאו שהראש קבוע ויציב כראוי. מקבעים את פיו של העכבר לפיה, ומקפידים למקם את הלשון בצד החיצוני של הפה כדי למנוע חנק.
- ודא כי בעל החיים מורדם עמוקות עם צביטת בוהן לפני תחילת הניתוח ועקוב אחר נשימתו וצבעו של העכבר לאורך כל ההליך.
- מקם תמיכת הגבהה מתחת לעכבר כדי לשמור על הגוף והראש מפולסים במצב אופקי. שמור על החיה חמה עם כרית חמה מכוסה נייר. יש למרוח משחת עיניים על שתי העיניים כדי למנוע ייבוש.
- שמור על אזור הניתוח נקי ככל האפשר. יש ללבוש כפפות סטריליות. יש לחטא את ראש העכבר ביוד ואלכוהול לפני פתיחת העור. בעזרת אזמל, חותכים את העור בראש לאורך קו האמצע, בערך מאחורי העיניים עד מאחורי תפר הלמדא. שמרו על הגולגולת חשופה ונקו אותה בעזרת צמר גפן משובץ ב-0.9% NaCl סטרילי.
- מצאו את וריד הרמינל הרוסטרלי (RRV) וסמנו אותו בעיפרון סטרילי. השתמש בסטריאוסקופ עבור שאר ההליך.
הערה: אנו משיגים תוצאות טובות יותר באמצעות RRV כהפניה קדמית, אך מקובל להשתמש בברגמה כהפניה. - באמצעות מחט סטרילית כהפניה, ודא כי כיוון המוח נכון לפני שתמשיך למדידות סטריאוטקסיות. ודא גם כי הגבהים של פני הגולגולת ב RRV ו lambda, כמו גם את הנטייה לרוחב, זהים (± 0.02 מ"מ).
הערה: הנטייה הצידית הופכת רלוונטית יותר להזרקה למבני מוח רוחביים יותר. - לטעון פיפטה זכוכית סטרילית עם פתרון ויראלי להיות מוזרק. הבא אותו להפניה RRV עבור הפניה 0 anteroposterior (AP). התקדמו לאורך תפר הקשת לקואורדינטת AP לפי בחירתכם. סמן עמדה זו עם עיפרון סטרילי, להרים את המחט, ולהמשיך craniotomy.
- בזהירות לקדוח עיגול קטן סביב המיקום המסומן כדי למנוע שבירת הסינוס העליון sagittal. מקם את המקדחה במצב מוטה ולא מאונך כדי להפחית את הלחץ בזמן הקידוח. הסר את חתיכת הגולגולת עם מלקחיים קטנים.
- לאחר חשיפת כלי הדם, השתמש באמצע הסינוס הסגיטלי העליון כדי להשתמש בו כהפניה מדיולטרלית (ML) (נקודה 0); זה מדויק יותר מאשר להשתמש בתפר הסגיטלי. עבור לעמדת ML הנבחרת. מנמיכים את פיפטה כדי לגעת בדורה-מאטר כנקודת הייחוס הגבית (DV) (נקודה 0). מעט לשבור את dura-mater ולרדת פיפטה למצב DV של בחירה.
- הזריקו את הכמות הרצויה של AAV (50-200 nL) והשאירו את הצינורית במקומה למשך 3 דקות כדי לאפשר פיזור נוזלים הולם. הסר את פיפטה בזהירות החוצה מהמוח.
- שחררו את העכבר מהאוזניות. סגור את העור באמצעות קליפסים כירורגיים או כל שיטה לבחירה. שים את החיה בכלוב מחומם נפרד להתאוששות. עקוב אחר התאוששות, תגובתיות ופעילות לאחר שהעכבר ער. לאחר החלמתו המלאה, החזירו את העכבר לכלוב המקורי שלו.
- המתן מינימום של 3-4 שבועות לביטוי ויראלי לפני שתמשיך בחלק השני של ההליך.
2. וריד הצוואר ועורק התרדמה
- הכנה לניתוח
- ביצוע ניתוחים בחלל כירורגי ייעודי. יש לחטא משטחי ניתוח עם אתנול 70% לפני תחילת ההליכים. הכינו חבילות מרובות של כלים כירורגיים כדי להבטיח שכל חבילה תשמש לא יותר מחמישה בעלי חיים.
- Autoclave כל כלי הניתוח. לאחר מכן, נקו במים סטריליים או מלוחים וחיטאו את הכלים במעקר חרוזים חם למשך 15 שניות לפחות (על פי הוראות היצרן) בין ניתוחים.
- השתמש וילונות סטריליים כדי לשמור על סטריליות של שדה הניתוח. יש ללבוש מעיל מעבדה נקי או חלוק חד פעמי ומסכה.
- הכינו מיקרו-צנתרים לקנולציות בעורק התרדמה ובווריד הצוואר. בנה את צנתר העורק על ידי חיבור קטע קטן של צינורות microrenathane (מתוח מ 0.025 אינץ 'קוטר חיצוני [OD] x 0.012 אינץ 'קוטר פנימי [ID]) עם צינורות סילסטיים (0.025 אינץ 'OD x 0.012 אינץ 'ID). בנה את הצנתר הוורידי רק באמצעות צינורות סילסטיים (0.025 אינץ 'OD x 0.012 אינץ 'ID). יש להשרות את כל הצנתרים באתנול 70% למשך הלילה לפני הניתוח.
- שיפוע הקצוות החתוכים של שני הצנתרים ב-45° באורכים משוערים מראש בהתבסס על משקל הגוף והאורך של החיה.
- הליכים כירורגיים
- יש להרדים את בעלי החיים מתחת ל-2% איזופלורן באמצעות מערכת איזופלורן שולחנית בזרימה נמוכה כדי לשלוט במדויק בשלב ההרדמה ובמישור במהלך הניתוח.
- יש להזריק את המינון המקדים של משכך כאבים (קרפרופן 5 מ"ג/ק"ג s.c.) ולמרוח משחה אופתלמית למניעת התייבשות ופציעות בקרנית.
- לגלח את אזורי הגחון והגב של הצוואר ולנקות את העור עם שלושה פילינג יוד לסירוגין עם 70% אתנול. חתכו חתך עור אנכי (12 מ"מ) בין השכמות וכסו אותו בגזה כירורגית לשימוש מאוחר יותר. הניחו את בעל החיים במצב שכיבה עם הראש לכיוון המנתח.
- השתמש בטווח ניתוח סטריאו עבור רוב החלקים של ההליכים המתוארים להלן.
- בצע חתך אנכי קטן (~ 10 מ"מ) בצד ימין של הצוואר, עדיף על עצם הבריח כדי לחשוף את עורק התרדמה הימני ווריד הצוואר. חתכו את העור במספריים ובצעו דיסקציה קהה להפרדת רקמות תת עוריות באמצעות מלקחיים מיקרו ללא שיניים עם קצוות עדינים, תוך חשיפת וריד הצוואר החיצוני הימני ועורק התרדמה המשותף הנכון.
- קשרו את הקצה הדיסטלי של הווריד הצווארי כדי לעצור את זרימת הדם וחתכו חור קטן בווריד שהתמוטט באמצעות מיקרו מלקחיים ומספריים. הכנס את הצנתר הוורידי בשיפוע כלפי מטה ובעזרת זוג מיקרו מלקחיים כדי לקדם אותו דרך הווריד הנבוב העליון כדי להגיע לגובה האטריום הימני. האורך המוכנס הוא ~ 10-12 מ"מ עבור עכבר רזה 30 גרם. קשרו את הצנתר לקיבוע עם כלי הדם באמצעות 7-0 תפרי משי.
הערה: עם קטטר במקום הנכון, דם ניתן למשוך בקלות; אחרת, הצנתר עלול להיות לא במקום לתוך וריד החזה לרוחב ויש צורך להחדיר אותו מחדש. - נתחו בזהירות את רקמות החיבור כדי לחשוף את עורק התרדמה המשותף הימני הממוקם באזור משולש המוקף בשריר הסטרומיואיד, שריר הסטרנומסטואיד ושריר הקיבה. השתמש במחזיר חוטים כדי להפריד שרירים אלה במידת הצורך. קשרו את העורק ברמת הביפורקציה של עורקי התרדמה הפנימיים והחיצוניים באמצעות 7-0 תפרי משי. הנח שתי לולאות תפר לא קשורות בסמיכות.
- עצור זמנית את זרימת הדם על ידי משיכת לולאת תפר מוחלפת וחתך או ניקב חור קטן בדופן כלי הדם באמצעות מספריים זעירים או מחט 27 גרם. יש להכניס את הצנתר העורקי בשיפוע כלפי מטה ובסמיכות לאורך משוער מראש המגיע לקשת אבי העורקים אך מבלי לגעת במסתם אבי העורקים. האורך המוכנס הוא ~ 9-10 מ"מ עבור עכבר רזה של 30 גרם. קשרו את הצנתר לקיבוע בכלי הדם באמצעות שני התפרים המוחלפים.
- מנהרו את כל הצנתרים באופן תת-עורי וחיסלו אותם בחלק האחורי של הצוואר דרך החתך החתוך מראש וחברו אותם ליציאות הוורידיות או העורקיות של מחבר צינורות מצופה סיליקון העשוי מצינורות מחט 25 G: שונה MASA19 באמצעות שני צינורות מחט 25 G ושני צינורות PE-20 בגודל 4.0 ס"מ, עם שרוולים עם 2.0 ס"מ של צינורות סילסטיים ID בגודל 0.062 אינץ 'המחוברים עם טבעת מתכת קטנה עשויה חוט. נפח הלומן הכולל של כל צנתר, כולל המחבר, הוא 6-8 μL (איור 1A).
- סגור את החתך הגחוני וקבע את המחבר תת עורית עם סגירת העור האחורי עם תפרים. מלאו את שני הצנתרים במי מלח הפריניזציה (200 U/mL) וחברו אותם בחוזקה בסוף עם חוטי ניתוח מנירוסטה.
- עכברים מתאוששים מהרדמה איזופלורנית תוך דקות ומתאוששים לחלוטין מהניתוח תוך 5 ימים. הניחו את בעלי החיים בתא איסוף הדם האוטומטי 24 שעות לאחר הניתוח וחברו אותם למערכת על ידי חיבור וו הקשירה של המערכת לטבעת המתכת המחוברת למחבר הצינור המושתל בעורף. חברו את הצנתרים העורקיים והוורידיים לקו ההזרקה והדגימה, בהתאמה, 24 שעות לפני תחילת הדגימה (איור 1B). אורכו הכולל של קו הדגימה הוא 55 ס"מ אורך או 40 מיקרוליטר בנפח לומן.
הערה: הגדרות קווי ההזרקה והדגימה, תכנות שיטת האיסוף ומנגנוני איזון הכלוב של מערכת דוגמי הדם האוטומטית תוארו בפירוט20,21. המערכת שומרת על הצנתר פתוח על ידי אספקה אוטומטית של 10 μL של מי מלח הפריניזציה כל 20 דקות. - הגדר את הזמן והתדירות של הדגימה לפני ההזרקה, ההזרקה ולאחר ההזרקה באמצעות תוכנת המחשב של המערכת. ראה שלב 3.1 להלן לקבלת ההגדרות הנוכחיות.
- המערכת מאפשרת לחיה לנוע בחופשיות מבלי לסבך את קווי הדגימה ו/או העירוי על-ידי חישת תנועת העכבר תוך סיבוב תא הדיור בכיוון הפוך לתנועת העכבר21 (איור 1).
- מלאו מחדש את העירוי או את קו ההזרקה בתרכובת והתחברו מחדש לצנתר הוורידי לפחות שעתיים לפני תחילת העירוי או ההזרקה.
הערה: סיבוכים בניתוח עלולים להתרחש, ובעלי חיים צריכים להיות במעקב צמוד להחלמה ובימים שלאחר הניתוח. עיין בפרוטוקול בעלי החיים לקבלת ניטור נכון, דרישות סיום ונהלים.
3. איסוף דם אוטומטי והזרקה תוך ורידית
- איסוף דם אוטומטי
- כדי לעקוב אחר פרוטוקול זה, השתמש בנפח דגימה של 20.0 μL והגדר מרווח (כלומר, 7.0 דקות) בין כל דגימה לתדירות דגימה של כל 10.0 דקות לדגימה. הקצב המרבי הוא לדגום ברציפות 3.0 דקות לדגימה; נפח הדגימה המינימלי האפשרי הוא 5.0 μL. כמות שווה של מי מלח מוחזרת אוטומטית על ידי המערכת כדי להחליף את הדם שנדגם ולשמור על איזון נוזלי הגוף.
- הגדר את זמן הדגימה הכולל כ - 30 (t = -30 - 0) דקות לפני ו - 30 (t = 0 - 30) דקות לאחר הזרקה תוך ורידית של CNO (0.5 מ"ג/ק"ג, איור 2).
- כל דגימת דם שנאספת (20.0 μL) מדוללת אוטומטית ב-50 μL של מלח (המכיל הפרין ב-10 U/mL) ומאוחסנת בנפרד במיקרו-צינורית המוחזקת בקרוסלת דגימות בקירור על ידי המערכת.
- הזרקה אוטומטית תוך ורידית
- נתק את הקו הוורידי מהקטטר הוורידי כדי למלא מחדש CNO (מינון מחושב בנפרד לפי נפח של ~50-60 μL ב 0.5 מ"ג / ק"ג) לפחות 2 שעות לפני תחילת דגימת הדם.
- משכו ידנית את התמיסה (מעט יותר מהנפח המחושב) מהקו לאחור עם מזרק ההזרקה, תוך השארת בועת אוויר קטנה בין התמיסה לבין המלח הקיים בשורה.
- חבר מחדש את קו ההזרקה לצנתר ורידי וקבע את קצב ההזרקה על 500 μL/min ואת זמן תחילת ההזרקה על 2 דקות לאחר סיום הדגימה t = 0. זמן ההזרקה הכולל לכל חיה הוא 5-6 שניות.
הערה: במידת הצורך, התרכובת יכולה להיות מועברת גם על ידי הזרקה תוך צפקית ידנית (IP), אך הדבר ידרוש הפרעה לבעל החיים במהלך או לפני פרוטוקול איסוף הדם. אנחנו גם מראים את החלופה הזאת בתוצאות.
4. זילוח בעלי חיים ואיסוף מוח (אופציונלי)
הערה: יש לבצע הליך זה רק אם המוח נדרש לנתח את אתר המוח של הפעלה עצבית או תגובות במורד הזרם.
- נתק את העכבר ממערכת איסוף הדם בסוף פרוטוקול האיסוף. שעתיים לאחר ההזרקה לווריד, המשיכו לנקב את בעל החיים עם 10% פורמלין חוצץ נייטרלי (NBF), בשיטה המועדפת או כמתואר במקום אחר22.
- נתחו את המוח ושמרו אותו ב-20% סוכרוז ב-10%-NBF למשך 3 שעות כדי להמשיך בקיבוע.
- לאחר 3 שעות, מעבירים את המוח המקובע ל-20% סוכרוז ב-PBS ושומרים בטמפרטורה של 4°C עד שהם מוכנים לחתך.
הערה: הימנע מקיבוע יתר מכיוון שזה יסווה את האנטיגנים של cFOS. בתמיסת 20% סוכרוז, המוח צריך לשקוע לתחתית המיכל. - צור מקטעים באמצעות מיקרוטום מקפיא או קריוסטט והשתמש בשיטה המועדפת כדי להסתכל על הפעלה עצבית (למשל, cFOS immunohistochemistry מוצג).
הערה: הנוגדנים המשמשים לתוצאות הנוכחיות מתוארים בטבלת החומרים.
5. עיבוד וניתוח דגימות
- הסר דגימות דם מהדוגם האוטומטי מיד לאחר סיום הניסוי והנח אותן על קרח.
- סובבו את הדגימות במשקל של 14,000 × גרם למשך 30 שניות.
- לאסוף את הפלזמה. יש לאחסן אותו בטמפרטורה של -80°C עד לניתוח.
- בדוק את דגימות הדם על ידי LH ELISA כמתואר לפני10,23.
Representative Results
נוירונים המבטאים קיספפטין (גן Kiss1) הממוקמים בגרעין הארקואט של ההיפותלמוס הם ממריץ רב עוצמה של GnRH, ולכן, של שחרור LH מבלוטת יותרת המוח24,25. בהדגמת פרוטוקול זה, השתמשנו בהפרשת LH הנגרמת על ידי קיספפטין כדי להמחיש את תפקוד טכניקת דגימת הדם האוטומטית. איור 2 מראה דפוסי LH מייצגים אצל נקבות Kiss1-eYFP בוגרות שקיבלו בעבר זריקה סטריאוטקסית חד-צדדית של AAV-hM3Dq-mCherry בגרעין הארקואט (AP: -4.95, ML: -0.35, DV: -5.7). ה-ChR2-eYFP שימש ככתב פלורסנט לתאי Kiss1. חודש לאחר הניתוח הסטריאוטקסי, העכברים עברו קנולציה של עורק התרדמה והווריד הצווארי וחוברו לדוגם הדם האוטומטי 4 ימים לאחר הניתוח. איסוף הדם לקביעת רמות LH בסיסיות החל למחרת בתדירות דגימה של 10 דקות (מרווח של 7 דקות בין דגימות ל-3 דקות/דגימה) ולאחר מכן הזרקת CNO אוטומטית בעירוי והמשך דגימת דם כל 10 דקות למשך 30 דקות. רמות LH דיאסטרוטיות הן בדרך כלל נמוכות (איור 2A), אולם בדרך כלל נצפות שינויים בגלל שחרור הפעימה שלו (איור 2B). לאחר הזרקת CNO (והפעלת נוירוני קיספפטין), העלייה ב-LH הייתה חדה (תוך 10 דקות). רמת העלייה ומשך השיא תלויים בגורמים רבים, כולל אתר ההזרקה, מספר תאי העצב שהופעלו או האוכלוסייה הממוקדת.
איור 3 מראה את אתר ההזרקה במוח בגרעין הארקואט של נקבת העכבר המיוצג באיור 2A. תאי עצב Kiss1-eYFP מסומנים בירוק, בעוד שתגובתיות החיסון mCherry מראה את האתר של הזרקת AAV והפעלתו לאחר CNO. תאי עצב פעילים זוהו באמצעות תגובתיות חיסונית cFOS, המסומנת ב-DAB. רוב תאי העצב mCherry לוקליזציה עם Kiss1-eYFP, ורבים הראו תגובתיות חיסונית של cFOS, מה שמוכיח כי ההפעלה הנגיפית והעצבית הייתה ספציפית לאוכלוסיית היעד.
דפוס שחרור פולסטילי מייצג של LH בעכברי דיזטרוס פראי (C57BL/6J) ואחריו התגובה להזרקת IP של קיספפטין-10 מוצג באיור 4. העכבר עבר קנולציה של עורק התרדמה וחובר למערכת דגימת הדם האוטומטית 4 ימים לאחר הניתוח. למחרת בבוקר נבדקו מחזורי הייחום ובוצע איסוף הדם וזריקת קיספפטין-10 ביוםה-26. דגימות הדם נאספו כל 7 דקות במשך שעתיים (מרווח של 4 דקות, בתוספת 3 דקות / דגימה במשך 120 דקות לפני ההזרקה) כדי לקבוע את רמות הבסיס ואת פעימות LH, ולאחר מכן הזרקת IP של קיספפטין-10 (65 מיקרוגרם / ק"ג) והמשך איסוף הדם כל 7 דקות במשך 30 דקות נוספות. נצפו פולסי LH ברורים האופייניים לנקבה בדיסטרוס, המראים רמות LH בסיסיות נמוכות, תדירות דופק של ~2 פולסים / שעה, ומשרעת דופק ~ 1 ng/mL27. עלייה מיידית וחזקה ב- LH זוהתה בתגובה למתן קיספפטין28. דפוסי הפרשת LH והשינויים לאחר הגירוי תואמים מחקרים אחרים המשתמשים באיסוף דם ידני 10,27,29,30. תוצאות אלה מראות כי שיטת דגימת הדם האוטומטית לוכדת הפרשת LH טיפוסית ומגורה במצב ללא לחץ.
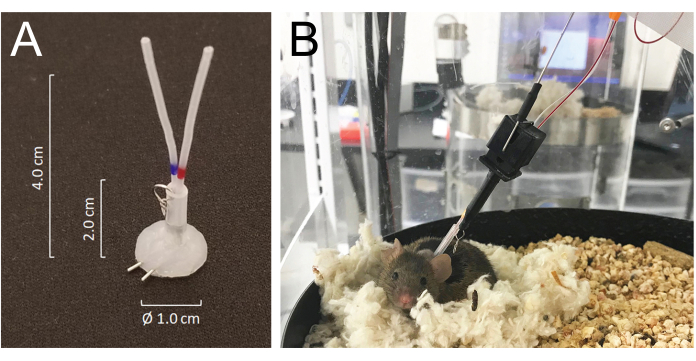
איור 1: פרטים על מערכת המחברים וחיבורי העכבר לצינורות מערכת העירוי והדגימה. (A) מחבר צינורות מצופה סיליקון (MASA) שנבנה באמצעות שני צינורות מחט 25G ושני צינורות PE-20, בשרוול בצינור סילסטי המחובר בטבעת מתכת קטנה. (B) עכבר המחובר לעירוי ולצינור הדגימה בכלוב הדגימה, ונח בקן שלו במהלך דגימת הדם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
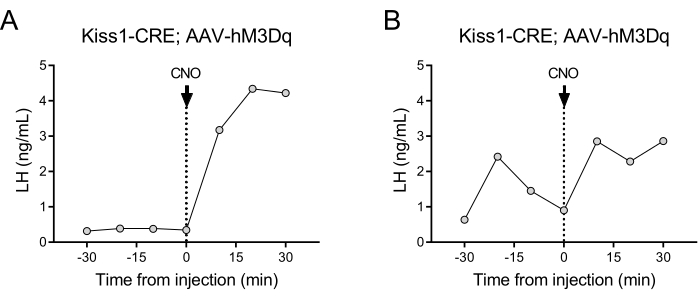
איור 2: תוצאות מייצגות עבור פעימות LH בעכברות נקבות Kiss1-Cre שהוזרקו עם AAV-hM3Dq בגרעין הארקואט ומופעלות מרחוק באמצעות CNO. רמות LH בסיסיות נמדדו כל 10 דקות במשך חצי שעה. בזמן 0 לאחר איסוף הדם, הנקבה קיבלה זריקה תוך ורידית של clozapine-N-oxide (0.5 מ"ג / ק"ג) ודם המשיך להיאסף מעורק התרדמה כל 10 דקות במשך חצי שעה נוספת. (A) מראה נקבה עם רמות LH בסיסיות נמוכות. (B) מראה נקבה המציגה קדם-הזרקה של דופק LH. קיצורים: Kiss1 = Kisspeptin; AAV = וירוס הקשור לאדנו; CNO = clozapine-N-oxide; LH = הורמון luteinization. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
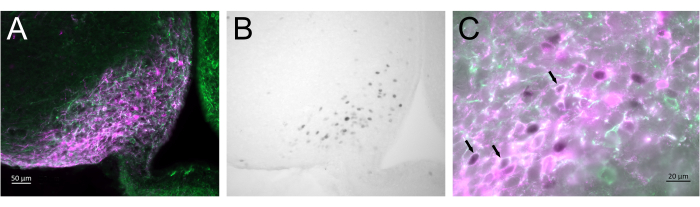
איור 3: פעילות מוחית בגרעין הארקואט של Kiss1-Cre; נקבת Chr2-eYFP (Kiss1-eYFP) המיוצגת באיור 2A. ChR2-eYFP שימש רק כגן עיתונאי כדי לתייג נוירונים של kiss1. (A) תמונה פלואורסצנטית בהגדלה נמוכה המציגה את אתר הזרקת AAV בגרעין הארקואט. ירוק: eYFP immunoreactivity, Magenta: mCherry immunoreactivity. (B) תמונת שדה בהיר בהגדלה נמוכה של האזור המתאים לאיור 3A, המראה תגובתיות חיסונית cFOS (שחור) באתר הזרקת AAV בגרעין ארקואט. (C) פלואורסצנטיות בהגדלה גבוהה ותמונת שדה בהיר בשילוב מראות מבט מקרוב על תאי העצב באיור 3A,B. תאי עצב Kiss1-eYFP המבטאים יחד AAV-mCherry שהופעלו הם אלה עם ציטופלסמה לבנה וגרעין שחור (חצים). פסי קנה מידה = 50 מיקרומטר (A,B), 20 מיקרומטר (C). קיצורים: Kiss1 = Kisspeptin; AAV = וירוס הקשור לאדנו; eYFP = חלבון פלואורסצנטי צהוב משופר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
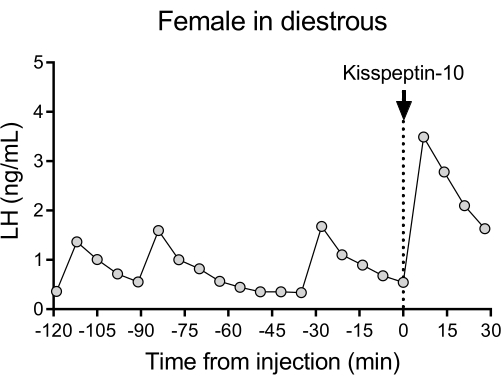
איור 4: פעימות LH בסיסיות בנקבת בר מסוג diestrous נמדדו כל 7 דקות במשך שעתיים. לאחר מכן קיבלה הנקבה זריקה תוך-צפקית של קיספפטין-10 (65 מק"ג/ק"ג) בזמן 0, ודגימות דם נאספו ברציפות כל 7 דקות במשך חצי שעה. קיצור: LH = הורמון luteinize. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
באמצעות פרוטוקול זה הצלחנו להראות פעימות LH בסיסיות והפרשת LH לאחר גירוי של אוכלוסייה עצבית. היתרונות הגדולים של המערכת הם הסביבה נטולת הלחצים בה מתבצעת הדגימה, ללא נוכחות או טיפול אנושי במהלך דגימת הדם. בנוסף, לא נדרשו אילוף מייגע קודם של בעלי חיים והסתגלות לנוכחות או לטיפול אנושי במהלך הניסוי. ניסויים קודמים באמצעות דגימת דם ידנית דרשו כמות גדולה של זמן ומאמץ כדי למזער את גורמי הלחץ 7,31,32. עם זאת, חיתוך הזנב לבדו הוא גורם לחץ33. יישום פרדיגמת סביבה לא מלחיצה ופרדיגמת אילוף במתקני בעלי חיים משותפים, שבהם הפרעות הן בלתי צפויות, עשוי גם הוא להיות אילוץ. במעבדות מסוימות, בעלי חיים לעתים קרובות צריך להיות מועבר לחדרי הליך חלופיים עבור דגימת דם. מגבלות אלה עשויות להפוך את השיטה הידנית ללא מתאימה לזיהוי שינויים עדינים ברמות LH, ולכן, גישה מעשית יכולה להיות מועילה במצבים אלה. הדגימה האוטומטית מתבצעת בחדר שקט שבו מניחים את העכברים מספר ימים מראש כדי להתאקלם בסביבה החדשה. הניסיון הקודם שלנו עם פרוטוקול זה סיפק זיהוי מדויק של דפוסי הפרשת קורטיקוסטרון והורמון גדילה פולסטילי בעכברים, ולא הראה רמות גבוהות של קורטיקוסטרון במהלך הדגימה האוטומטית15. בניסויים הנוכחיים, כל החיות הותאמו היטב למערכת הדגימה שהראתה בניית קן בתא הדגימה לאחר ~24 שעות וצבע שיער בהיר, מה שמצביע על היעדר סטרס ומצב בריאותי כללי טוב (איור 1).
הקושי העיקרי המוביל לתוצאות שליליות הוא כנראה מיקוד לא מתאים של AAV לאוכלוסייה העצבית הנדרשת. דיוק בזריקות הסטריאוטקסיות הוא חיוני ויש לבצע אימון מראש כדי לוודא את הקואורדינטות ואת נפחי ההזרקה. אימון יכול להיעשות על ידי הזרקת כמות קטנה של 0.5-1% אוונס כחול למיקום הרצוי בניתוח ללא התאוששות ולאחר מכן לקחת פרוסה של המוח שזה עתה נותח באמצעות מטריצת מוח עכבר (למשל, טד פלה) כדי לבדוק את האתר ואת גודל הזריקה באמצעות סטריאוסקופ.
חשוב גם לקחת בחשבון שדם ופלזמה שנאספו ממערכת דגימת הדם האוטומטית ידוללו במי מלח הפריניזציה (למשל, 20 מיקרוליטר דם ב-50 מיקרוליטר מי מלח בתוצאות שלנו)20, וייתכן שיהיה צורך להתאים את יחס הדילול לרגישות השיטה האנליטית שנבחרה. בדקנו את רמות ה-LH בדם מלא המדולל ב-BSA-PBS (כפי שמומלץ עבור LH ELISA רגיש במיוחד)10 או במי מלח ולא מצאנו הבדלים בערכי LH. לא ניתן להשתמש בטווין במדלל מכיוון שזה יזרום למערכת הדם כדי לחלץ את הדגימות על ידי החלפת נוזלי הדגימה20. מניסיוננו, דילולים של פחות מ-1:10 נתנו תוצאות LH טובות אך מעט לא העריכו נכון את רמות ה-LH בהשוואה ל-1:3.5. זה מצביע על כך שהדילול עשוי להיות מותאם עוד יותר כדי להפחית את כמות הדם שנאסף, במידת הצורך.
חלופה לאספקת תרכובת אוטומטית היא לבצע הזרקות ידניות דרך הצנתר הוורידי. במקרה זה, החוקר נמצא לזמן קצר בחדר כדי לספק את הזריקה. עם זאת, אין מגע ישיר עם בעלי החיים או עם מגוריהם וסביבתם, ובניגוד לזריקות תוך צפקיות או תת עוריות, ההליך כולו הוא לעתים קרובות מבלי לשים לב על ידי החיה. היתרונות של הזרקה ידנית הם שאין צורך להגדיר מראש את דילול התרכובת, מה שעשוי להיות קריטי עבור תרכובות יקרות מדי לשימוש בנפחים גדולים יותר או רגישות להתכלות לאורך זמן; מכיוון שנפח הפעולה קטן יותר מאשר במשלוח אוטומטי, שם יש למלא מראש את קו העירוי והצנתר בתמיסה מורכבת יותר.
דגימת דם אוטומטית מספקת הזדמנות ייחודית לחקור וריאציות LH במהלך השינה, למשל. אנו צופים באופן קבוע בבעלי חיים ישנים בקינים שלהם בזמן הדגימה. ניתן לקשר דגימה זו עם רישומי EEG כדי ליצור ניתוח מפורט יותר של הקשר בין פעילות עצבית לבין דפוס LH34. כפי שמוצג כאן, האפשרויות לשימוש בדגימת דם אוטומטית הן רבות: החל מדגימת LH בסיסית לבדיקת תגובת LH לתרכובות אנדוגניות או אקסוגניות, או להפעלה או דיכוי של אוכלוסיות עצביות. המניפולציות העצביות יכולות להיות מיושמות בחריפות עם כימוגנטיקה או אופטוגנטיקה, או לצמיתות באמצעות מודלים של עכברים טרנסגניים וכלי השתקה אפופטוטיים או עצביים. דגימת דם אוטומטית מאפשרת גם מדידה של הורמונים אחרים בעלי דפוסי הפרשה פועמים מאוד (למשל, הורמון גדילה15). בנקבות עכברים, אם נדרש שלב מסוים של מחזור הייחום, ניתן לאסוף בזהירות מריחות נרתיקיות שעות לפני תחילת פרוטוקול26 מבלי להפריע לקווי העירוי והדגימה. בעלי חיים יכולים להיות מחוברים למערכת הדגימה למשך 7-10 ימים כאשר הסיכון לקרישת קו העורקים עולה עם הזמן.
טכניקה זו, עם זאת, מוגבלת לשימוש בבעלי חיים יחידים, ולכן, היא עשויה שלא להתאים לחקר אינטראקציות חברתיות. היא גם פולשנית ודורשת ניתוח מאתגר מבחינה טכנית, כך שייתכן שלא ניתן יהיה ליישם אותה עם חיות צעירות או מודלים מסוימים של מחלות. לבסוף, מכיוון שעלות רכישת המערכת עשויה להיות גבוהה מדי עבור מעבדת מחקר בודדת, רצוי להקים אותה במעבדת ליבה המספקת את פרוטוקול הניסוי שהוזכר כשירותים.
לסיכום, פרוטוקול זה מראה כיצד לבצע משלוח סטריאוטקסי של AAV בשילוב עם דגימת דם אוטומטית. השליטה המרחבית והזמנית המדויקת המושגת בטכניקה זו, יחד עם גמישות היישום שלה על מודלים, פרוטוקולי מדידה והורמונים שונים, הופכים אותה לשיטה רבת עוצמה לחקר הבקרה ההורמונלית במכרסמים. והכי חשוב, השיטה מספקת סביבה נטולת מתח על ידי ביטול נוכחות אנושית וטיפול במהלך הזרקה ו / או דגימה, ואילוף קודם של בעלי חיים. יתרונות אלה, יחד עם האפשרות של ריבוב, הופכים שיטה זו לכלי ייחודי לחקר הבקרה העצבית של שינויים הורמונליים בעכברים מודעים, נעים בחופשיות וללא הפרעות.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
אנו מודים לד"ר דניאל הייזנלדר על עזרתו בבדיקת שיטות שונות לדילול דם. בדיקות הורמונים בסרום בוצעו במרכז לחקר הרבייה של אוניברסיטת וירג'יניה, Ligand Assay and Analysis Core, בתמיכת יוניס קנדי שרייבר NICHD Grant R24 HD102061. מרכז הפנוטיפינג המטבולי של עכבר מישיגן - Live נתמך על ידי מרכז NIH Grant U2C DK135066. JF ו- NQ נתמכים על ידי מענקי DK020572 (MDRC) ו- DK089503 (MNORC). CFE ו- CSM נתמכים על ידי מענק NICHD R21 HD109485 ו- R01 HD096324.
Materials
| Name | Company | Catalog Number | Comments |
| AAV8-hSyn-hM3D(Gq)-mCherry | Addgene | 44361 | Not necessarily this virus but this was the one used for representative results |
| Alcohol | Disinfection | ||
| Anesthesia Induction box | Vetequip | ||
| Anesthesia induction machine | Kent Scientific Equipment | SomnoSuite | |
| Anesthesia masks for mice | Kent Scientific Equipment | SOMNO-0801 | |
| Autoclip applier 9 mm | Clay Adams | 427630 | |
| Autoclip remover 9 mm | Clay Adams | 427637 | |
| Autoclips 9 mm | Clay Adams | 427631 | |
| BASi Culex Controller | Culex | SN: 2151, 2152, 2156, 2158 | 4 stations |
| BASi Honey Comb Fraction Collector | Honey Comb | SN: 2105, 2106, 2107, 2108 | 4 stations |
| BASi Ratrun Rotation Control | RATURN 2 | SN: 5680, 5681, 5682, 5683 | 4 stations |
| C57BL/6J mice | JAX # 000664 | ||
| Carprofen | Zoetis | Rimadyl | Analgesic |
| Clippers | Braun | ||
| Clozapine-N-oxide | ENZO | BLM-NS105-0005 | |
| Cotton tipped applicators | |||
| CULEX Automated In Vivo Sampling System | BASi | DS000627 | with CX-4000S Replacement Tubing Sets |
| Curved forceps serrated | FST | 11151-10 | |
| Drill | Dremel | 61100 | |
| Empis control Module | EMPIS CM | SN: 174 | |
| Empis Programmable Infusion System | EMPIS | SN: 2125 , 2126, 2127, 2128 | With CX-7010S 4 BAS-2 Infusion Sets; 4 stations |
| Envigo 2016 diet | low-phytoestrogen diet | ||
| Eye ointment | Dechra | Puralube Vet Ointment | Petrolatum Ophtalmic oinment |
| Glass pipettes | World Precision Instruments | MIB100-6 | |
| Hemostats | Roboz Surgical | RS-7101 | |
| Iodine | Betadine Surgical scrub | ||
| Isoflurane | VetOne | Fluriso | Anesthetic |
| Isoflurane Vaporizer or SomnoSuite Low-Flow Anesthesia System | Surgivet or Kent Scientific Corp | SS-01 | Anesthesia Machine |
| Kiss1-Cre;ChR2-eYFP (Kiss1-eYFP) mice | JAX # 023436 and #024109 | ||
| Kisspeptin-10 | Phoenix Pharmaceuticals | 048-56 | |
| Micro-renathane tubing | Braintree Scientific | MRE025 | Surgical catheterization |
| Micro-Scissors | Roboz Surgical | RS-5606 | |
| Needle Holder | Roboz Surgical | RS-7842 | |
| Picoliter injector | Warner Instruments | PLI-100A | |
| Pipette puller | Sutter Instruments | P30 | |
| Rodent Warmer X2 | Stoelting | 53850 | |
| Scalpel | FST | 10003-12 | |
| Scissors | Roboz Surgical | RS-6808 | |
| Silicon tubing | Liveo Laboratory Tubing | NO.508-001 | 0.012 in I.D x 0.025 in O.D. |
| Stereotaxic table | RWD | E06208 | |
| Sterile 0.9% saline | Baxter | 2F7124 | |
| Sterile towel drapes | Dynarex | 4410 | |
| Surgical blades | SKLAR | 06-3011 | |
| Surgical stereoscope | Zeiss | f-160 | |
| Tweezers | Roboz Surgical | RS-4960 | |
| Tweezers | Roboz Surgical | RS-4972 | |
| Tweezers | Roboz Surgical | RS-5058 | |
| Antibodies | |||
| Anti-cFos | Millipore | ABE457 | Antigen target: N-terminus cFos; Host organism: Rabbit; Dilution used: 1:5,000; RRID: AB_2631318 |
| Anti-GFP | Aves Labs | GFP-1010 | Antigen target: recombinant GFP null; Host organism: Chicken; Dilution used: 1:10,000; RRID: AB_2307313 |
| Biotin-SP-conjugated AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch Labs | 711-065-152 | Antigen target: Rabbit IgG (H+L); Host organism: Donkey; Dilution used: 1:1,000; RRID: AB_2340593 |
| Donkey anti-Rat IgG, AlexaFluor 594 | Thermo Fisher Scientific | A-21209 | Antigen target: Rat IgG (H+L); Host organism: Donkey; Dilution used: 1:500; RRID: AB_2535795 |
| Goat anti-Chicken IgY, Alexa Fluor 488 | Thermo Fisher Scientific | A-11039 | Antigen target: Chicken, IgY (H+L); Host organism: Goat; Dilution used: 1:500; RRID: AB_2534096 |
| mCherry monoclonal (16D7) | Thermo Fisher Scientific | M11217 | Antigen target: mCherry tag; Host organism: Rat; Dilution used: 1:5,000; RRID: AB_2536611 |
References
- Kokoris, G. J., Lam, N. Y., Ferin, M., Silverman, A. J., Gibson, M. J. Transplanted gonadotropin-releasing hormone neurons promote pulsatile luteinizing hormone secretion in congenitally hypogonadal (hpg) male mice. Neuroendocrinology. 48 (1), 45-52 (1988).
- Coquelin, A., Desjardins, C. Luteinizing hormone and testosterone in young and old male mice. American Journal of Physiology - Endocrinology and Metabolism. 243 (3), E257-E263 (1982).
- Carmel, P. W., Araki, S., Ferin, M. Pituitary stalk portal blood collection in rhesus monkeys: Evidence for pulsatile release of gonadotropin-releasing hormone (GnRH). Endocrinology. 99 (1), 243-248 (1976).
- Schuiling, G., Gnodde, H. Site of origin of the pulsatile secretion of luteinizing hormone in long-term ovariectomized rats. Journal of Endocrinology. 70 (1), 97-104 (1976).
- Hackwell, E. C. R., Ladyman, S. R., Brown, R. S. E., Grattan, D. R. Mechanisms of lactation-induced infertility in female mice. Endocrinology. 164 (5), 1-12 (2023).
- Bahougne, T., Kretz, M., Angelopoulou, E., Jeandidier, N., Simonneaux, V. Impact of circadian disruption on female mice reproductive function. Endocrinology. 161 (4), (2020).
- Kreisman, M. J., McCosh, R. B., Tian, K., Song, C. I., Breen, K. M. Estradiol Enables Chronic Corticosterone to Inhibit Pulsatile Luteinizing Hormone Secretion and Suppress Kiss1 Neuronal Activation in Female Mice. Neuroendocrinology. 110 (6), 501-516 (2020).
- Moenter, S. M., Evans, N. P. Gonadotropin-releasing hormone GnRH measurements in pituitary portal blood. Journal of Neuroendocrinology. 34 (5), 13065 (2022).
- Maeda, K. I., et al. The LHRH pulse generator: A mediobasal hypothalamic location. Neuroscience and Biobehavioral Reviews. 19 (3), 427-437 (1995).
- Steyn, F. J., et al. Development of a methodology for and assessment of pulsatile luteinizing hormone secretion in juvenile and adult male mice. Endocrinology. 154 (12), 4939-4945 (2013).
- Steyn, F. J., et al. Development of a method for the determination of pulsatile growth hormone secretion in mice. Endocrinology. 152 (8), 3165-3171 (2011).
- Minabe, S., Uenoyama, Y., Tsukamura, H., Maeda, K. Analysis of pulsatile and surge-like luteinizing hormone secretion with frequent blood sampling in female mice. Journal of Reproduction and Development. 57 (5), 660-664 (2011).
- Perreau-Lenz, S., Kalsbeek, A., Pévet, P., Buijs, R. M. Glutamatergic clock output stimulates melatonin synthesis at night. European Journal of Neuroscience. 19 (2), 318-324 (2004).
- Herwig, A., Pévet, P., Bothorel, B., Steinlechner, S., Saboureau, M. Trans-pineal microdialysis in the Djungarian hamster (Phodopus sungorus): A tool to study seasonal changes of circadian clock activities. Journal of Pineal Research. 40 (2), 177-183 (2006).
- Adams, J. M., Otero-Corchon, V., Hammond, G. L., Veldhuis, J. D., Qi, N., Low, M. J. Somatostatin is essential for the sexual dimorphism of GH secretion, corticosteroid-binding globulin production, and corticosterone levels in mice. Endocrinology. 156 (3), 1052-1065 (2015).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63 (1), 27-39 (2009).
- Krashes, M. J., et al. reversible activation of AgRP neurons drives feeding behavior in mice. Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- National Research Council. Guide for the Care and Use of Laboratory Animals. Eighth edition. National Research Council. , (2011).
- Ayala, J. E., et al. Hyperinsulinemic-euglycemic clamps in conscious, unrestrained mice. Journal of Visualized Experiments. (57), e3188 (2011).
- Peters, S., et al. Culex ABS Part I: Introduction to automated blood sampling. Current Separations. 18 (4), 139-145 (2000).
- Bohs, C., Cregor, M., Gunaratna, G., Kissinger, C. Culex Automated blood sampler part II Managing freely-moving animals and monitoring their activity. Current Separations. 18 (4), 147-151 (2000).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kreisman, M. J., Mccosh, R. B., Breen, K. M. A Modified ultra-sensitive ELISA for measurement of LH in mice. Endocrinology. 163 (9), (2022).
- Pielecka-Fortuna, J., Chu, Z., Moenter, S. M. Kisspeptin acts directly and indirectly to increase gonadotropin-releasing hormone neuron activity and its effects are modulated by estradiol. Endocrinology. 149 (4), 1979-1986 (2008).
- Kumar, D., et al. Specialized subpopulations of kisspeptin neurons communicate with GnRH neurons in female mice. Endocrinology. 156 (1), 32-38 (2015).
- Caligioni, C. S. Assessing reproductive status/stages in mice. Current Protocols in Neuroscience. , 1-8 (2009).
- Czieselsky, K., et al. Pulse and surge profiles of luteinizing hormone secretion in the mouse. Endocrinology. 157 (12), 4794-4802 (2016).
- Wang, L., et al. Genetic dissection of the different roles of hypothalamic kisspeptin neurons in regulating female reproduction. eLife. 8, 43999 (2019).
- McCosh, R. B., Kreisman, M. J., Breen, K. M. Frequent tail-tip blood sampling in mice for the assessment of pulsatile luteinizing hormone secretion. Journal of Visualized Experiments. (137), e57894 (2018).
- Vanacker, C., Defazio, R. A., Sykes, C. M., Moenter, S. M. A role for glial fibrillary acidic protein (Gfap)-expressing cells in the regulation of gonadotropin-releasing hormone (GnRH) but not arcuate kisspeptin neuron output in male mice. eLife. 10, e68205 (2021).
- Dulka, E. A., Defazio, R. A., Moenter, S. M. Chemogenetic suppression of GnRH neurons during pubertal development can alter adult GnRH neuron firing rate and reproductive parameters in female mice. eNeuro. 7 (3), 0223 (2020).
- Talbi, R., et al. Characterization of the Action of Tachykinin Signaling on Pulsatile LH Secretion in Male Mice. Endocrinology. 162 (8), 1-9 (2021).
- Tuli, J., Smith, J., Morton, D. Corticosterone, adrenal and spleen weight in mice after tail bleeding, and its effect on nearby animals. Laboratory Animals. 29 (1), 90-95 (1995).
- Lucien, J. N., Ortega, M. T., Shaw, N. D. Sleep and puberty. Current Opinion in Endocrine and Metabolic Research. 17, 1-7 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved