Ativação Neuronal Remota Acoplada à Coleta Automatizada de Sangue para Induzir e Medir o Hormônio Luteinizante Circulante em Camundongos
In This Article
Summary
A pulsatilidade do hormônio luteinizante (LH) é uma característica da função reprodutiva. Descrevemos um protocolo para ativação remota de populações neuronais específicas ligado à coleta de sangue automatizada seriada. Esta técnica permite modulação hormonal cronometrada, multiplexação e minimização dos efeitos de manipulação sobre os níveis de LH em animais conscientes, em movimento livre e não perturbados.
Abstract
Os níveis circulantes de hormônio luteinizante (LH) são um índice essencial do funcionamento do controle hipotálamo-hipofisário da reprodução. O papel de inúmeras entradas e populações neuronais na modulação da liberação de LH ainda é desconhecido. Medir as mudanças nos níveis de LH em camundongos é muitas vezes um desafio, uma vez que eles são facilmente interrompidos pelo estresse ambiental. As técnicas atuais para medir a liberação e a pulsatilidade de LH requerem treinamento de longo prazo para que camundongos se adaptem ao estresse de manipulação, certa contenção, à presença do investigador e ao trabalho em animais individuais, reduzindo sua utilidade para muitas questões de pesquisa.
Este artigo apresenta uma técnica para ativar remotamente populações neuronais específicas usando a tecnologia Designer Receptor Exclusively Activated by Designer Drugs (DREADDs) acoplada à amostragem sequencial automatizada de sangue em camundongos conscientes, em movimento livre e não perturbados. Primeiramente descrevemos o protocolo de cirurgia estereotáxica para entregar vetores de vírus adenoassociados (AAV) expressando DREADDs para populações neuronais específicas. A seguir, descrevemos o protocolo de canulação da artéria carótida e veia jugular e conexão pós-cirúrgica com o sistema automatizado de coleta de sangue GULEX. Finalmente, descrevemos o protocolo para injeção intravenosa de N-óxido de clozapina para ativação neuronal remota e coleta automatizada de sangue. Essa técnica permite a amostragem automatizada programada a cada 5 min ou mais por um determinado período, juntamente com a injeção intravenosa de substância em um ponto de tempo ou duração desejados. Em geral, encontramos esta técnica para ser uma abordagem poderosa para a pesquisa sobre o controle neuroendócrino.
Introduction
O eixo hipotálamo-hipófise-gonadal (HPG) é regulado centralmente pela liberação pulsátil do hormônio liberador de gonadotrofinas (GnRH) no sistema portal hipofisário. Na hipófise, o GnRH controla a liberação pulsátil de gonadotrofinas, hormônio luteinizante (LH) e hormônio folículo-estimulante (FSH) para o sistema circulatório. A liberação pulsátil de LH serve como uma marca para o funcionamento do eixo HPG central 1,2,3,4. Por exemplo, apresenta os efeitos de alterações genéticas ou alterações em fatores hormonais ou ambientais sobre a parte neural do eixo 5,6,7. Até recentemente, a mensuração do padrão pulsátil do LH era limitada a grandes mamíferos8e ratos9, dada a alta frequência de amostragem e os grandes volumes sanguíneos necessários para identificar os pulsos.
A detecção de pulsos de LH em camundongos é desejável, uma vez que esta espécie tem amplos modelos genéticos disponíveis e pode ser prontamente manipulada usando tecnologias de engenharia genômica para estudar genes e populações celulares específicos. Na última década, um grande avanço na análise das concentrações de LH em camundongos utilizando um ensaio imunoenzimático (ELISA) de LH em sanduíche permitiu detectar LH em uma quantidade diminuta de sangue10. O desenvolvimento da técnica de amostragem frequente de sangue na ponta da cauda possibilitou a amostragem frequente necessária para detectar a frequência e amplitude dos pulsos de LH em camundongos10,11. No entanto, a coleta de sangue na ponta da cauda é limitada ao seu uso em animais acordados conscientes; Exige um longo período de treinamento para que os camundongos se adaptem ao manuseio e à presença de um investigador designado durante a amostragem. Seu sucesso é altamente suscetível a estressores ambientais e pode não ser adequado para uso em linhagens de camundongos com altos níveis de ansiedade. A canulação intra-atrial também tem sido utilizada para coleta frequente de sangue em camundongos conscientes em movimento livre12. No entanto, essa configuração ainda requer repetidas coletas manuais de sangue e restringe o espaço de movimentação dos animais, enquanto a canulação atrial pode levar a alterações dinâmicas na função cardíaca. Portanto, é desejável estabelecer um método para a coleta de sangue em condições livres de estresse em camundongos conscientes, em movimento livre e sem perturbação, sem a necessidade de treinamento prévio ou manipulação ou presença humana.
A coleta automatizada de sangue ou dialisato já foi usada anteriormente para medir diferentes níveis hormonais (por exemplo, melatonina13,14) e sua secreção pulsátil (por exemplo, hormônio do crescimento)15 em roedores desenfreados. Apresentamos aqui um protocolo para coleta de sangue frequente automatizada a longo prazo em animais conscientes e irrestritos, juntamente com uma ativação remota oportuna de populações neuronais específicas usando tecnologias quimiogenéticas: os receptores projetistas ativados exclusivamente por drogas de design (DREADDs). Descreveremos a liberação estereotáxica de um vetor de vírus adenoassociado (AAV) e a ativação remota por uma administração intravenosa (IV) automatizada de N-óxido de clozapina (CNO)16,17. Este protocolo permite a detecção sequencial de níveis basais e alterações induzidas na pulsatilidade do LH em múltiplos animais ao mesmo tempo. Tanto a colheita de sangue como a administração IV do composto são realizadas de forma controlada pelo tempo, através de um programa de computador, eliminando a presença física do investigador ou a necessidade de treino prévio em ratinhos. Este método supera as principais limitações da coleta manual de sangue. Ele permite a amostragem de sangue em uma condição livre de estresse e entrega simultânea de compostos IV juntamente com controle remoto da atividade neuronal. Mostramos resultados representativos do uso de coleta de sangue automatizada isolada ou combinada com ativação neuronal remota e discutimos suas vantagens, limitações e usos adicionais.
Protocol
Todos os procedimentos com animais são realizados de acordo com o Guia do Conselho Nacional de Pesquisa para o Cuidado e Uso de Animais de Laboratório18 , bem como com as leis federais, estaduais e municipais. Camundongos fêmeas adultas (3-6 meses de idade) foram usados para esta demonstração do protocolo, incluindo quatro fêmeas C57BL/6J e quatro Kiss1-Cre; ChR2-eYFP (Kiss1-eYFP) fêmeas. Os camundongos foram mantidos sob um ciclo claro:escuro de 12:12, temperatura controlada a 22 °C e alimentados ad libitum com uma dieta pobre em fitoestrógenos. Os procedimentos e protocolos foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Michigan (IACUC, Animal Protocols: PRO00010420 and PRO00010138).
1. Entrega estereotáxica de AAVs a uma população celular específica
- Preparo para a cirurgia
- Esterilize todas as ferramentas. Prepare vários pacotes de ferramentas cirúrgicas para garantir que cada pacote seja usado em no máximo cinco animais. Prepare luvas estéreis, no mínimo um par para cada animal.
- Puxe micropipetas de vidro para injeções usando as seguintes configurações (consulte a Tabela de Materiais) para micropipetas longas e finas que injetam lenta e constantemente e não obstruem facilmente: Calor 1: 915, Calor 2: 630, Puxe: 630. Otimize essas configurações para cada puxador.
- Realizar cirurgias em um espaço cirúrgico designado. Desinfetar superfícies cirúrgicas com etanol 70%.
- Use campos estéreis para manter a esterilidade do campo cirúrgico. Use um jaleco limpo ou avental descartável e uma máscara.
- Preparar sistema de anestesia inalatória. Abra o fornecimento de oxigênio e regule a taxa de fluxo para 0,8 L/min.
- Cirurgia
- Coloque o rato numa caixa de anestesia e abra o isoflurano a 2,5%. Reduzir o fluxo de isoflurano para 2% após a indução inicial; manter o fluxo durante todo o procedimento. Para métodos alternativos de anestesia, consulte o protocolo animal e as diretrizes do comitê de ética local.
- Injetar analgésico preemptivo (carprofeno 5 mg/kg s.c.) seguindo a recomendação do comitê de uso animal e as regulamentações locais.
- Faça a barba da cabeça do mouse usando cortadores.
- Instale o animal em uma mesa estereotáxica, coloque barras auriculares e certifique-se de que a cabeça esteja corretamente fixada e estável. Fixe a boca do rato no bocal, certificando-se de colocar a língua para o lado fora da boca para evitar sufocamento.
- Verifique se o animal está profundamente anestesiado com uma pitada no dedo do pé antes de iniciar a cirurgia e monitore a respiração e a cor do rato durante todo o procedimento.
- Coloque o suporte de elevação sob o mouse para manter o corpo e a cabeça nivelados em uma posição horizontal. Mantenha o animal aquecido com uma almofada quente coberta de papel. Aplique pomada ocular em ambos os olhos para evitar o ressecamento.
- Mantenha a área cirúrgica o mais limpa possível. Use luvas estéreis. Desinfete a cabeça do rato com iodo e álcool antes de abrir a pele. Com bisturi, corte a pele da cabeça ao longo da linha média, aproximadamente por trás dos olhos até atrás da sutura lambda. Mantenha o crânio exposto e limpe-o com um cotonete embutido em NaCl 0,9% estéril.
- Encontre a veia rhinal rostral (RRV) e marque-a com um lápis estéril. Use o estereoscópio para o restante do procedimento.
OBS: Obtemos melhores resultados utilizando a VRR como referência anteroposterior, mas é padrão utilizar o bregma como referência. - Usando uma agulha estéril como referência, certifique-se de que a orientação do cérebro está correta antes de proceder às medições estereotáxicas. Certifique-se também de que as alturas da superfície do crânio no RRV e lambda, bem como a inclinação lateral, sejam as mesmas (± 0,02 mm).
NOTA: A inclinação lateral torna-se mais relevante para injeção em estruturas cerebrais mais laterais. - Coloque uma pipeta de vidro estéril com a solução viral a ser injetada. Trazê-lo para a referência RRV para referência 0 anteroposterior (AP). Avançar ao longo da sutura sagital até a coordenada AP de escolha. Marque essa posição com um lápis estéril, levante a agulha e proceda à craniotomia.
- Perfure cuidadosamente um pequeno círculo ao redor da posição marcada para evitar a quebra do seio sagital superior. Posicione a broca em uma posição inclinada em vez de perpendicular para reduzir a pressão durante a perfuração. Retire o pedaço do crânio com pinças pequenas.
- Uma vez exposta a vasculatura, utilizar o meio do seio sagital superior para utilizar como referência médio-lateral (ML) (ponto 0); Isso é mais preciso do que usar a sutura sagital. Mover para a posição de ML de escolha. Abaixe a pipeta para tocar a dura-máter como referência dorsoventral (DV) (ponto 0). Quebre ligeiramente a dura-máter e desça a pipeta até a posição DV de escolha.
- Injetar a quantidade desejada de AAV (50-200 nL) e deixar a cânula no lugar por 3 min para permitir a dispersão adequada do líquido. Retire a pipeta cuidadosamente do cérebro.
- Solte o mouse das barras auriculares. Feche a pele usando clipes cirúrgicos ou qualquer método de escolha. Coloque o animal em uma gaiola aquecida separada para recuperação. Monitore a recuperação, a reatividade e a atividade depois que o mouse estiver acordado. Quando estiver totalmente recuperado, mova o mouse de volta para sua gaiola original.
- Aguarde um mínimo de 3-4 semanas para a expressão viral antes de prosseguir com a segunda parte do procedimento.
2. Canulação da veia jugular e artéria carótida
- Preparo para a cirurgia
- Realizar cirurgias em um espaço cirúrgico designado. Desinfetar as superfícies cirúrgicas com etanol 70% antes de iniciar os procedimentos. Prepare vários pacotes de ferramentas cirúrgicas para garantir que cada pacote seja usado em no máximo cinco animais.
- Autoclave de todos os instrumentos cirúrgicos. Em seguida, limpe com água estéril ou soro fisiológico e desinfete as ferramentas com um esterilizador de esferas quentes por pelo menos 15 s (de acordo com as instruções do fabricante) entre as cirurgias.
- Use campos estéreis para manter a esterilidade do campo cirúrgico. Use um jaleco limpo ou avental descartável e uma máscara.
- Preparar microcateteres para canulações na artéria carótida e veia jugular. Construa o cateter arterial unindo um pequeno segmento de tubo de microrrenathane (esticado de 0,025 polegadas de diâmetro externo [OD] x 0,012 polegadas de diâmetro interno [ID]) com tubo de silastic (0,025 polegadas OD x 0,012 polegadas ID). Construa o cateter venoso apenas com sonda de silicone (0,025 polegadas OD x 0,012 polegadas ID). Mergulhe todos os cateteres em etanol a 70% durante a noite antes da cirurgia.
- Bifurar as pontas de corte de ambos os cateteres a 45° para comprimentos pré-estimados com base no peso corporal e comprimento do animal.
- Procedimentos cirúrgicos
- Anestesiar os animais sob isoflurano a 2% com um sistema de isoflurano de baixo fluxo de mesa para controlar precisamente o estágio e o plano da anestesia durante a cirurgia.
- Injetar a dose preemptiva de analgésico (carprofeno 5 mg/kg s.c.) e aplicar pomada oftálmica para prevenir dessecação e lesões na córnea.
- Raspar as áreas ventral e posterior do pescoço e limpar a pele com três esfoliantes de iodo alternados com etanol 70%. Cortar uma incisão vertical da pele (12 mm) entre as omoplatas e cobri-la com gaze cirúrgica para uso posterior. Coloque o animal em decúbito dorsal com a cabeça em direção ao cirurgião.
- Use um escopo de dissecação estéreo para a maioria das partes dos procedimentos descritos abaixo.
- Fazer uma pequena incisão vertical (~10 mm) no lado direito do pescoço, superior à clavícula para expor a artéria carótida direita e veia jugular. Cortar a pele com tesoura e realizar dissecção romba para separar os tecidos subcutâneos utilizando micropinças não dentadas com pontas finas, expondo a veia jugular externa direita e a artéria carótida comum direita.
- Amarre a extremidade distal da veia jugular para interromper o fluxo sanguíneo e corte um pequeno orifício na veia colapsada usando micropinça e tesoura. Inserir o cateter venoso bisel para baixo e proximalmente utilizando um par de micropinças para avançá-lo através da veia cava superior até atingir o nível do átrio direito. O comprimento inserido é de ~10-12 mm para um mouse magro de 30 g. Amarre o cateter para fixar com o vaso usando suturas de seda 7-0.
NOTA: Com o cateter no lugar certo, o sangue pode ser facilmente retirado; caso contrário, o cateter pode ser extraviado na veia torácica lateral e precisa ser reinserido. - Dissecar cuidadosamente os tecidos conjuntivos para expor a artéria carótida comum direita localizada em uma área triangular circundada pelo músculo esterno-hioideo, músculo esternomastoideo e músculo digástrico. Use um afastador de arame para separar esses músculos, se necessário. Amarrar a artéria ao nível da bifurcação das artérias carótidas interna e externa usando pontos de seda 7-0. Pré-colocar duas alças de sutura desamarradas proximalmente.
- Pare temporariamente o fluxo sanguíneo puxando uma alça de sutura substituída e corte ou perfure um pequeno orifício na parede do vaso usando microtesoura ou uma agulha de 27 G. Inserir o cateter arterial, bisel para baixo e proximalmente a um comprimento pré-estimado, atingindo o arco da aorta, mas sem tocar a valva aórtica. O comprimento inserido é de ~9-10 mm para um mouse magro de 30 g. Amarre o cateter para fixar com o vaso usando as duas suturas substituídas.
- Tunelizar todos os cateteres por via subcutânea e exteriorizá-los na parte posterior do pescoço através da incisão pré-cortada e uni-los aos orifícios venosos ou arteriais de um conector de tubo revestido de silicone feito de tubo de agulha de 25 G: MASA19 modificado usando dois tubos de agulha de 25 G e dois tubos de PE-20 de 4,0 cm, com manga de 2,0 cm de tubo de silicone ID de 0,062 polegadas acoplado com um pequeno anel de arame metálico. O volume total do lúmen de cada cateter, incluindo o conector, é de 6-8 μL (Figura 1A).
- Fechar a incisão ventral e fixar o conector por via subcutânea sobre o fechamento da pele posterior com suturas. Preencher ambos os cateteres com soro fisiológico heparinizado (200 U/mL) e plugá-los firmemente na extremidade com fios cirúrgicos de aço inoxidável.
- Os ratos recuperam-se da anestesia com isoflurano em poucos minutos e recuperam-se totalmente da cirurgia no prazo de 5 dias. Colocar os animais na câmara de coleta de sangue automatizada 24 h após a cirurgia e conectá-los ao sistema unindo o gancho de amarração do sistema ao anel metálico acoplado ao conector da tubulação implantado na parte de trás do pescoço. Conectar os cateteres arterial e venoso às linhas de injeção e amostragem, respectivamente, 24 h antes do início da amostragem (Figura 1B). O comprimento total da linha de amostragem é de 55 cm de comprimento ou 40 μL por volume de lúmen.
NOTA: As configurações das linhas de injeção e amostragem, a programação do método de coleta e os mecanismos de balanço da gaiola do sistema automatizado de coleta de sangue foram descritos em detalhes20,21. O sistema mantém o cateter aberto entregando automaticamente 10 μL de solução salina heparinizada a cada 20 min. - Defina o tempo e a frequência de amostragem pré-injeção, injeção e pós-injeção através do programa de computador do sistema. Consulte a etapa 3.1 abaixo para obter as configurações atuais.
- O sistema permite que o animal se mova livremente sem emaranhar as linhas de amostragem e/ou infusão, detectando o movimento do mouse enquanto gira a câmara de alojamento em direção oposta ao movimento do mouse21 (Figura 1).
- Reencha a perfusão ou a linha de injeção com o composto e volte a ligar ao cateter venoso pelo menos 2 h antes do início da perfusão ou injeção.
NOTA: Complicações da cirurgia podem ocorrer, e os animais precisam ser monitorados de perto para recuperação e nos dias seguintes à cirurgia. Consulte o protocolo animal para o monitoramento correto, requisitos de terminação e procedimentos.
3. Coleta automatizada de sangue e injeção intravenosa
- Coleta de sangue automatizada
- Para seguir esse protocolo, use um volume de amostragem de 20,0 μL e defina um intervalo (ou seja, 7,0 min) entre cada amostragem para ter uma frequência de amostragem de cada 10,0 min por amostra. A taxa máxima é de amostragem contínua a 3,0 min/amostra; o volume mínimo de amostragem possível é de 5,0 μL. Uma quantidade igual de soro fisiológico é automaticamente devolvida pelo sistema para substituir o sangue coletado e manter o equilíbrio de fluidos corporais.
- Definir o tempo total de amostragem como 30 (t = -30 - 0) min antes e 30 (t = 0 - 30) min após a injeção intravenosa de CNO (0,5 mg/kg, Figura 2).
- Cada amostra de sangue coletada (20,0 μL) é diluída automaticamente em 50 μL de solução salina (contendo heparina a 10 U/mL) e armazenada individualmente em um microtubo mantido em carrossel de amostras refrigerado pelo sistema.
- Injeção intravenosa automatizada
- Desconecte a linha venosa do cateter venoso para reencher CNO (dose calculada individualmente pelo volume de ~50-60 μL a 0,5 mg/kg) pelo menos 2 h antes do início da coleta de sangue.
- Retire manualmente a solução (ligeiramente mais do que o volume calculado) da linha retrogradamente com a seringa de injeção, deixando uma pequena bolha de ar entre a solução e o soro fisiológico existente na linha.
- Reconecte a linha de injeção ao cateter venoso e ajuste a taxa de injeção em 500 μL/min e o tempo de início da injeção em 2 min após t = 0 término da amostragem. O tempo total de injeção para cada animal é de 5-6 s.
NOTA: Se necessário, o composto também pode ser administrado por uma injeção intraperitoneal manual (IP), mas isso exigirá perturbar o animal durante ou antes do protocolo de coleta de sangue. Também mostramos essa alternativa nos resultados.
4. Perfusão animal e coleta cerebral (OPCIONAL)
NOTA: Este procedimento deve ser seguido apenas se o cérebro for necessário para analisar o local cerebral de ativação neuronal ou respostas a jusante.
- Desconecte o mouse do sistema de coleta de sangue ao final do protocolo de coleta. Duas horas após a injeção intravenosa, proceder-se à perfusão do animal com formalina tamponada neutra (FBN) a 10%, utilizando-se o método preferido ou conforme descrito anteriormente22.
- Dissecar o cérebro e conservá-lo em sacarose a 20% em FBN a 10% por 3 h para continuar a fixação.
- Após 3 h, transferir o cérebro fixo para sacarose a 20% em PBS e conservar a 4 °C até estar pronto para a secção.
NOTA: Evite a sobrefixação, pois isso mascarará os antígenos cFOS. Na solução de sacarose a 20%, o cérebro deve afundar no fundo do recipiente. - Faça cortes usando um micrótomo de congelamento ou criostato e use o método preferido para observar a ativação neuronal (por exemplo, a imuno-histoquímica cFOS é mostrada).
NOTA: Os anticorpos usados para os resultados atuais estão descritos na Tabela de materiais.
5. Processamento e análise das amostras
- Retirar amostras de sangue do amostrador automático imediatamente após o final da experiência e colocá-las no gelo.
- Gire as amostras a 14.000 × g por 30 s.
- Colete o plasma. Conservar a -80 °C até à análise.
- Dosar as amostras de sangue por ELISA de LH conforme descrito anteriormente10,23.
Representative Results
Os neurônios que expressam kisspeptina (gene Kiss1) localizados no núcleo arqueado do hipotálamo são um potente estimulador do GnRH e, portanto, da liberação de LH pela hipófise24,25. Nesta demonstração de protocolo, usamos a secreção de LH induzida por kisspeptina para ilustrar o funcionamento da técnica de coleta automática de sangue. A Figura 2 mostra padrões representativos de LH em fêmeas adultas de Kiss1-eYFP que receberam previamente uma injeção estereotáxica unilateral de AAV-hM3Dq-mCherry no núcleo arqueado (AP: -4,95, ML: -0,35, DV: -5,7). O ChR2-eYFP foi usado como repórter fluorescente para células Kiss1. Um mês após a cirurgia estereotáxica, os camundongos foram submetidos à canulação da artéria carótida e veia jugular e conectados ao amostrador automático de sangue 4 dias após a cirurgia. As coletas de sangue para determinação dos níveis basais de LH foram iniciadas no dia seguinte com 10 min de frequência de amostragem (intervalo de 7 min entre as amostras e 3 min/amostragem), seguidas por uma injeção automática de CNO IV e coleta de sangue contínua a cada 10 min por 30 min. Os níveis diestros de LH são geralmente baixos (Figura 2A), mas variações são geralmente observadas devido à sua liberação pulsátil (Figura 2B). Após a injeção de CNO (e ativação dos neurônios kisspeptin), o aumento do LH foi acentuado (dentro de 10 min). O nível de aumento e a duração do pico dependem de inúmeros fatores, incluindo o local da injeção, o número de neurônios ativados ou a população alvo.
A Figura 3 mostra o local de injeção cerebral no núcleo arqueado da fêmea de camundongo representado na Figura 2A. Os neurônios Kiss1-eYFP são marcados em verde, enquanto a imunorreatividade mCherry mostra o local da injeção e ativação do AAV após CNO. Neurônios ativados foram detectados usando imunorreatividade cFOS, marcada com DAB. A maioria dos neurônios mCherry colocalizou com Kiss1-eYFP, e muitos mostraram imunorreatividade cFOS, demonstrando que a ativação viral e neuronal foi específica para a população-alvo.
Um padrão representativo de liberação pulsátil de LH em camundongos diestros selvagens (C57BL/6J) seguido pela resposta a uma injeção IP de kisspeptina-10 é mostrado na Figura 4. O camundongo foi submetido à canulação da artéria carótida e conectado ao sistema automático de coleta de sangue 4 dias após a cirurgia. Na manhã seguinte, os ciclos estrais foram verificados e a coleta de sangue e a injeção de kisspeptina-10 foram realizadas no dia26 diestra. Amostras de sangue foram coletadas a cada 7 min por 2 h (intervalo de 4 min, mais 3 min/amostragem por 120 min antes da injeção) para determinar os níveis basais e pulsatilidade de LH, seguida por uma injeção IP de kisspeptina-10 (65 μg/kg) e coleta de sangue contínua a cada 7 min por mais 30 min. Pulsos claros de LH típicos para uma fêmea em diestro foram observados, mostrando baixos níveis basais de LH, frequência de pulso de ~2 pulsos/h e amplitude de pulso de ~1 ng/mL27. Um aumento imediato e robusto do LH foi detectado em resposta à administração de kisspeptina28. Os padrões de secreção de LH e as alterações após estimulação estão de acordo com outros estudos que utilizaram coleta manual de sangue 10,27,29,30. Esses resultados demonstram que o método automatizado de coleta de sangue capta a secreção típica e estimulada de LH sob uma condição livre de estresse.
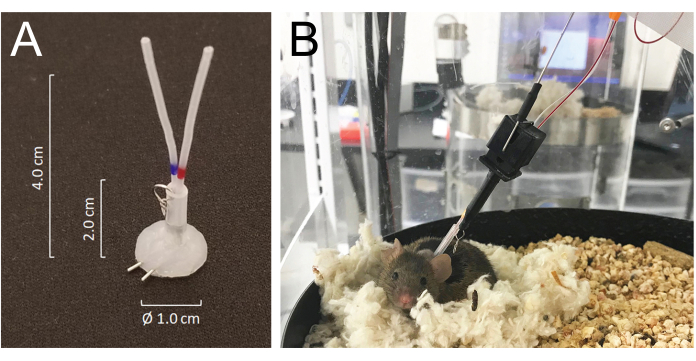
Figura 1: Detalhes do sistema de conectores e conexões do mouse para a tubulação do sistema de infusão e amostragem. (A) Um conector de tubo revestido de silicone (MASA) construído usando dois tubos de agulha 25G e dois tubos PE-20, encapuzados em um tubo de silicone conectado com um pequeno anel de metal. (B) Um rato ligado à sonda de perfusão e recolha de amostras na gaiola de amostragem, descansando no seu ninho durante a colheita de sangue. Clique aqui para ver uma versão maior desta figura.
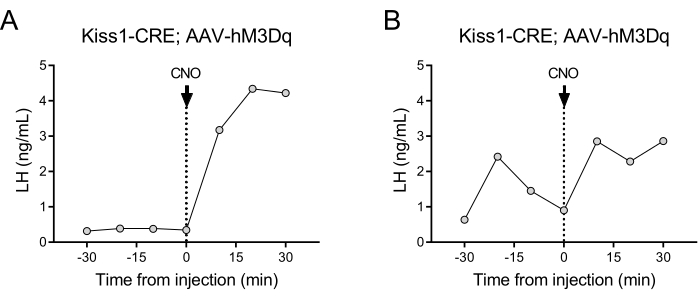
Figura 2: Resultados representativos para pulsos de LH em camundongos fêmeas Kiss1-Cre injetados com AAV-hM3Dq no núcleo arqueado e ativados remotamente com CNO. Os níveis basais de LH foram medidos a cada 10 min por meia hora. No tempo 0 após a coleta de sangue, a fêmea recebeu uma injeção intravenosa de N-óxido de clozapina (0,5 mg/kg) e o sangue continuou a ser coletado da artéria carótida a cada 10 min por mais meia hora. (A) Mostra uma fêmea com baixos níveis basais de LH. (B) Mostra uma fêmea exibindo uma pré-injeção de pulso de LH. Abreviações: Kiss1 = Kisspeptin; AAV = vírus adenoassociado; CNO = N-óxido de clozapina; LH = hormônio luteinizante. Clique aqui para ver uma versão maior desta figura.
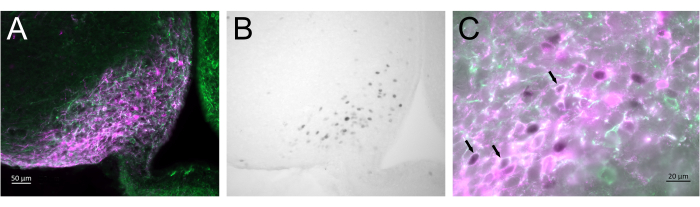
Figura 3: Ativação cerebral no núcleo arqueado do Kiss1-Cre; Chr2-eYFP (Kiss1-eYFP) feminino representado na Figura 2A. ChR2-eYFP foi usado apenas como um gene repórter para rotular neurônios kiss1. (A) Imagem de fluorescência de baixa magnificação mostrando o local da injeção de AAV no núcleo arqueado. Verde: imunorreatividade eYFP, Magenta: imunorreatividade mCherry. (B) Imagem de campo claro de baixa magnificação da área correspondente à Figura 3A, mostrando imunorreatividade cFOS (preto) no local da injeção de AAV no núcleo de Arcuate. (C) Fluorescência de alta magnificação e imagem de campo brilhante combinadas mostrando um olhar mais atento dos neurônios na Figura 3A,B. Os neurônios Kiss1-eYFP que coexpressam AAV-mCherry que foram ativados são aqueles com citoplasma branco e núcleo preto (setas). Barras de escala = 50 μm (A,B), 20 μm (C). Abreviações: Kiss1 = Kisspeptin; AAV = vírus adenoassociado; eYFP = proteína fluorescente amarela aumentada. Clique aqui para ver uma versão maior desta figura.
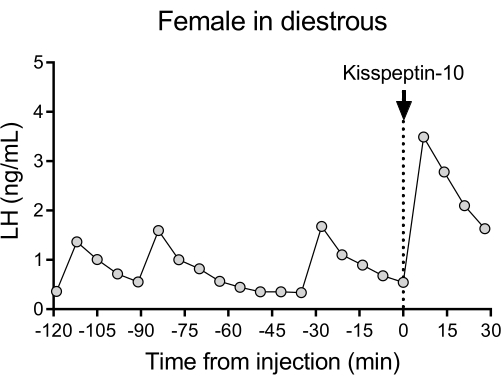
Figura 4: Pulsatilidade basal de LH em fêmea selvagem diestra medida a cada 7 min por 2 h. A fêmea então recebeu uma injeção intraperitoneal de kisspeptina-10 (65 μg/kg) no tempo 0, e amostras de sangue foram coletadas continuamente a cada 7 min por meia hora. Abreviação: LH = hormônio luteinizante. Clique aqui para ver uma versão maior desta figura.
Discussion
Usando este protocolo, pudemos mostrar pulsatilidade basal de LH e secreção de LH após estimulação de uma população neuronal. As grandes vantagens do sistema são o ambiente livre de estresse no qual a amostragem ocorre, sem a presença humana ou manipulação durante a coleta de sangue. Além disso, não foi necessário treinamento prévio e adaptação dos animais à presença ou manuseio humano durante o experimento. Experimentos anteriores com coleta manual de sangue exigiram grande quantidade de tempo e esforço para minimizar os estressores 7,31,32. No entanto, cortar a cauda sozinho é um estressor33. A implementação de um ambiente não estressante e paradigma de treinamento em instalações compartilhadas para animais, onde as interrupções são imprevisíveis, também pode ser uma limitação. Em alguns laboratórios, os animais muitas vezes precisam ser transportados para salas de procedimentos alternativos para coleta de sangue. Essas limitações podem tornar o método manual inadequado para a detecção de alterações sutis nos níveis de LH e, portanto, uma abordagem hands-off pode ser útil nessas situações. A amostragem automatizada é definida em uma sala silenciosa, onde os ratos são colocados com vários dias de antecedência para se aclimatarem ao novo ambiente. Nossa experiência prévia com esse protocolo forneceu detecção precisa dos padrões de secreção de corticosterona e hormônio de crescimento pulsátil em camundongos, não mostrando níveis elevados de corticosterona durante a amostragem automatizada15. Nos experimentos atuais, todos os animais estavam bem adaptados ao sistema de amostragem, mostrando a construção de ninhos na câmara de amostragem após ~24 h e cor brilhante do cabelo, indicando ausência de estresse e bom estado geral de saúde (Figura 1).
A principal dificuldade que leva a resultados negativos é provavelmente o direcionamento inadequado da AAV para a população neuronal necessária. A precisão nas injeções estereotáxicas é essencial e o treinamento deve ser feito com antecedência para verificar as coordenadas e os volumes de injeção. O treinamento pode ser feito injetando uma pequena quantidade de 0,5-1% de azul de Evans no local desejado em uma cirurgia de não recuperação e, em seguida, tomando uma fatia do cérebro recém-dissecado usando uma matriz cerebral de camundongo (por exemplo, Ted Pella) para verificar o local e o tamanho da injeção usando um estereoscópio.
Também é importante levar em conta que o sangue e o plasma coletados do sistema automatizado de coleta de sangue serão diluídos em solução salina heparinizada (por exemplo, 20 μL de sangue em 50 μL de solução salina em nossos resultados)20, e a razão de diluição pode precisar ser ajustada para a sensibilidade do método analítico selecionado. Testamos os níveis de LH no sangue total diluído em BSA-PBS (conforme recomendado para ELISA de LH ultrassensível)10 ou soro fisiológico e não encontramos diferenças nos valores de LH. A interpolação não pode ser utilizada no diluente, uma vez que este circulará no sistema sanguíneo para extrair as amostras substituindo os fluidos da amostra20. Em nossa experiência, diluições menores que 1:10 deram bons resultados de LH, mas subestimaram ligeiramente os níveis de LH em comparação com 1:3,5. Isso indica que a diluição pode ser ajustada para reduzir a quantidade de sangue coletado, se necessário.
Uma alternativa à administração automática de compostos é fazer injeções manuais através do cateter venoso. Neste caso, o investigador está brevemente presente na sala para aplicar a injeção. No entanto, não há contato direto com os animais ou com seu alojamento e entorno e, ao contrário das injeções intraperitoneais ou subcutâneas, todo o procedimento muitas vezes passa despercebido pelo animal. As vantagens de uma injeção manual são que a diluição do composto não precisa ser configurada com antecedência, o que pode ser crítico para compostos que são muito caros para uso em volumes maiores ou são sensíveis à degradação ao longo do tempo; uma vez que o volume operacional é menor do que na entrega automatizada, onde a linha de infusão e o cateter precisam ser pré-preenchidos com solução mais composta.
A amostragem automática de sangue oferece uma oportunidade única de estudar as variações do LH durante o sono, por exemplo. Temos observado regularmente animais dormindo em seus ninhos durante o período de amostragem. É possível relacionar essa amostragem com registros de EEG para gerar uma análise mais detalhada da relação entre a atividade neural e o padrão de LH34. Como mostrado aqui, as possibilidades de uso de amostragem de sangue automatizada são muitas: desde a amostragem basal de LH até o teste da resposta do LH a compostos endógenos ou exógenos, ou à ativação ou supressão de populações neuronais. As manipulações neuronais podem ser implementadas agudamente com quimiogenética ou optogenética, ou permanentemente usando modelos de camundongos transgênicos e ferramentas de silenciamento apoptótico ou neuronal. A coleta automatizada de sangue também permite a medição de outros hormônios com padrões secretores altamente pulsáteis (por exemplo, hormônio do crescimento15). Em camundongos fêmeas, se uma fase específica do ciclo estral for necessária, esfregaços vaginais podem ser cuidadosamente coletados horas antes do início do protocolo26 sem interromper as linhas de infusão e amostragem. Os animais podem ser conectados ao sistema de amostragem por 7-10 dias com o risco de coagulação da linha arterial aumentando com o tempo.
Essa técnica, no entanto, é limitada ao uso em animais de alojamento único e, portanto, pode não ser adequada para o estudo de interações sociais. Também é invasivo e requer cirurgia tecnicamente desafiadora, por isso pode não ser possível implementá-lo com animais juvenis ou certos modelos de doenças. Finalmente, como o custo de aquisição do sistema pode ser muito alto para um único laboratório de pesquisa, seria aconselhável instalá-lo em um laboratório central que fornecesse o protocolo experimental mencionado como serviço.
Em conclusão, este protocolo mostra como realizar a liberação estereotáxica de AAV combinada com coleta de sangue automatizada. O controle espacial e temporal preciso alcançado com esta técnica, juntamente com sua flexibilidade de aplicação a diferentes modelos, protocolos de medição e hormônios, a torna um método poderoso para o estudo da regulação hormonal em roedores. Mais importante ainda, o método proporciona um ambiente livre de estresse, eliminando a presença humana e o manuseio durante a injeção e/ou amostragem, e o treinamento prévio dos animais. Essas vantagens, juntamente com a possibilidade de multiplexação, tornam este método uma ferramenta única para estudar o controle neural de mudanças hormonais em camundongos conscientes, em movimento livre e não perturbados.
Disclosures
Os autores não têm conflitos de interesse a declarar.
Acknowledgements
Agradecemos ao Dr. Daniel Haisenleder por sua ajuda em testar diferentes métodos de diluição de sangue. Os ensaios hormonais séricos foram realizados no Centro de Pesquisa em Reprodução da Universidade da Virgínia Ligante Assay and Analysis Core apoiado pelo HD102061 Eunice Kennedy Shriver NICHD Grant R24. O Michigan Mouse Metabolic Phenotyping Center-Live é apoiado pelo NIH Center Grant U2C DK135066. JF e NQ são apoiados por DK020572 (MDRC) e DK089503 (MNORC) subvenções. CFE e CSM são apoiados pela bolsa NICHD R21 HD109485 e R01 HD096324.
Materials
| Name | Company | Catalog Number | Comments |
| AAV8-hSyn-hM3D(Gq)-mCherry | Addgene | 44361 | Not necessarily this virus but this was the one used for representative results |
| Alcohol | Disinfection | ||
| Anesthesia Induction box | Vetequip | ||
| Anesthesia induction machine | Kent Scientific Equipment | SomnoSuite | |
| Anesthesia masks for mice | Kent Scientific Equipment | SOMNO-0801 | |
| Autoclip applier 9 mm | Clay Adams | 427630 | |
| Autoclip remover 9 mm | Clay Adams | 427637 | |
| Autoclips 9 mm | Clay Adams | 427631 | |
| BASi Culex Controller | Culex | SN: 2151, 2152, 2156, 2158 | 4 stations |
| BASi Honey Comb Fraction Collector | Honey Comb | SN: 2105, 2106, 2107, 2108 | 4 stations |
| BASi Ratrun Rotation Control | RATURN 2 | SN: 5680, 5681, 5682, 5683 | 4 stations |
| C57BL/6J mice | JAX # 000664 | ||
| Carprofen | Zoetis | Rimadyl | Analgesic |
| Clippers | Braun | ||
| Clozapine-N-oxide | ENZO | BLM-NS105-0005 | |
| Cotton tipped applicators | |||
| CULEX Automated In Vivo Sampling System | BASi | DS000627 | with CX-4000S Replacement Tubing Sets |
| Curved forceps serrated | FST | 11151-10 | |
| Drill | Dremel | 61100 | |
| Empis control Module | EMPIS CM | SN: 174 | |
| Empis Programmable Infusion System | EMPIS | SN: 2125 , 2126, 2127, 2128 | With CX-7010S 4 BAS-2 Infusion Sets; 4 stations |
| Envigo 2016 diet | low-phytoestrogen diet | ||
| Eye ointment | Dechra | Puralube Vet Ointment | Petrolatum Ophtalmic oinment |
| Glass pipettes | World Precision Instruments | MIB100-6 | |
| Hemostats | Roboz Surgical | RS-7101 | |
| Iodine | Betadine Surgical scrub | ||
| Isoflurane | VetOne | Fluriso | Anesthetic |
| Isoflurane Vaporizer or SomnoSuite Low-Flow Anesthesia System | Surgivet or Kent Scientific Corp | SS-01 | Anesthesia Machine |
| Kiss1-Cre;ChR2-eYFP (Kiss1-eYFP) mice | JAX # 023436 and #024109 | ||
| Kisspeptin-10 | Phoenix Pharmaceuticals | 048-56 | |
| Micro-renathane tubing | Braintree Scientific | MRE025 | Surgical catheterization |
| Micro-Scissors | Roboz Surgical | RS-5606 | |
| Needle Holder | Roboz Surgical | RS-7842 | |
| Picoliter injector | Warner Instruments | PLI-100A | |
| Pipette puller | Sutter Instruments | P30 | |
| Rodent Warmer X2 | Stoelting | 53850 | |
| Scalpel | FST | 10003-12 | |
| Scissors | Roboz Surgical | RS-6808 | |
| Silicon tubing | Liveo Laboratory Tubing | NO.508-001 | 0.012 in I.D x 0.025 in O.D. |
| Stereotaxic table | RWD | E06208 | |
| Sterile 0.9% saline | Baxter | 2F7124 | |
| Sterile towel drapes | Dynarex | 4410 | |
| Surgical blades | SKLAR | 06-3011 | |
| Surgical stereoscope | Zeiss | f-160 | |
| Tweezers | Roboz Surgical | RS-4960 | |
| Tweezers | Roboz Surgical | RS-4972 | |
| Tweezers | Roboz Surgical | RS-5058 | |
| Antibodies | |||
| Anti-cFos | Millipore | ABE457 | Antigen target: N-terminus cFos; Host organism: Rabbit; Dilution used: 1:5,000; RRID: AB_2631318 |
| Anti-GFP | Aves Labs | GFP-1010 | Antigen target: recombinant GFP null; Host organism: Chicken; Dilution used: 1:10,000; RRID: AB_2307313 |
| Biotin-SP-conjugated AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch Labs | 711-065-152 | Antigen target: Rabbit IgG (H+L); Host organism: Donkey; Dilution used: 1:1,000; RRID: AB_2340593 |
| Donkey anti-Rat IgG, AlexaFluor 594 | Thermo Fisher Scientific | A-21209 | Antigen target: Rat IgG (H+L); Host organism: Donkey; Dilution used: 1:500; RRID: AB_2535795 |
| Goat anti-Chicken IgY, Alexa Fluor 488 | Thermo Fisher Scientific | A-11039 | Antigen target: Chicken, IgY (H+L); Host organism: Goat; Dilution used: 1:500; RRID: AB_2534096 |
| mCherry monoclonal (16D7) | Thermo Fisher Scientific | M11217 | Antigen target: mCherry tag; Host organism: Rat; Dilution used: 1:5,000; RRID: AB_2536611 |
References
- Kokoris, G. J., Lam, N. Y., Ferin, M., Silverman, A. J., Gibson, M. J. Transplanted gonadotropin-releasing hormone neurons promote pulsatile luteinizing hormone secretion in congenitally hypogonadal (hpg) male mice. Neuroendocrinology. 48 (1), 45-52 (1988).
- Coquelin, A., Desjardins, C. Luteinizing hormone and testosterone in young and old male mice. American Journal of Physiology - Endocrinology and Metabolism. 243 (3), E257-E263 (1982).
- Carmel, P. W., Araki, S., Ferin, M. Pituitary stalk portal blood collection in rhesus monkeys: Evidence for pulsatile release of gonadotropin-releasing hormone (GnRH). Endocrinology. 99 (1), 243-248 (1976).
- Schuiling, G., Gnodde, H. Site of origin of the pulsatile secretion of luteinizing hormone in long-term ovariectomized rats. Journal of Endocrinology. 70 (1), 97-104 (1976).
- Hackwell, E. C. R., Ladyman, S. R., Brown, R. S. E., Grattan, D. R. Mechanisms of lactation-induced infertility in female mice. Endocrinology. 164 (5), 1-12 (2023).
- Bahougne, T., Kretz, M., Angelopoulou, E., Jeandidier, N., Simonneaux, V. Impact of circadian disruption on female mice reproductive function. Endocrinology. 161 (4), (2020).
- Kreisman, M. J., McCosh, R. B., Tian, K., Song, C. I., Breen, K. M. Estradiol Enables Chronic Corticosterone to Inhibit Pulsatile Luteinizing Hormone Secretion and Suppress Kiss1 Neuronal Activation in Female Mice. Neuroendocrinology. 110 (6), 501-516 (2020).
- Moenter, S. M., Evans, N. P. Gonadotropin-releasing hormone GnRH measurements in pituitary portal blood. Journal of Neuroendocrinology. 34 (5), 13065 (2022).
- Maeda, K. I., et al. The LHRH pulse generator: A mediobasal hypothalamic location. Neuroscience and Biobehavioral Reviews. 19 (3), 427-437 (1995).
- Steyn, F. J., et al. Development of a methodology for and assessment of pulsatile luteinizing hormone secretion in juvenile and adult male mice. Endocrinology. 154 (12), 4939-4945 (2013).
- Steyn, F. J., et al. Development of a method for the determination of pulsatile growth hormone secretion in mice. Endocrinology. 152 (8), 3165-3171 (2011).
- Minabe, S., Uenoyama, Y., Tsukamura, H., Maeda, K. Analysis of pulsatile and surge-like luteinizing hormone secretion with frequent blood sampling in female mice. Journal of Reproduction and Development. 57 (5), 660-664 (2011).
- Perreau-Lenz, S., Kalsbeek, A., Pévet, P., Buijs, R. M. Glutamatergic clock output stimulates melatonin synthesis at night. European Journal of Neuroscience. 19 (2), 318-324 (2004).
- Herwig, A., Pévet, P., Bothorel, B., Steinlechner, S., Saboureau, M. Trans-pineal microdialysis in the Djungarian hamster (Phodopus sungorus): A tool to study seasonal changes of circadian clock activities. Journal of Pineal Research. 40 (2), 177-183 (2006).
- Adams, J. M., Otero-Corchon, V., Hammond, G. L., Veldhuis, J. D., Qi, N., Low, M. J. Somatostatin is essential for the sexual dimorphism of GH secretion, corticosteroid-binding globulin production, and corticosterone levels in mice. Endocrinology. 156 (3), 1052-1065 (2015).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63 (1), 27-39 (2009).
- Krashes, M. J., et al. reversible activation of AgRP neurons drives feeding behavior in mice. Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- National Research Council. Guide for the Care and Use of Laboratory Animals. Eighth edition. National Research Council. , (2011).
- Ayala, J. E., et al. Hyperinsulinemic-euglycemic clamps in conscious, unrestrained mice. Journal of Visualized Experiments. (57), e3188 (2011).
- Peters, S., et al. Culex ABS Part I: Introduction to automated blood sampling. Current Separations. 18 (4), 139-145 (2000).
- Bohs, C., Cregor, M., Gunaratna, G., Kissinger, C. Culex Automated blood sampler part II Managing freely-moving animals and monitoring their activity. Current Separations. 18 (4), 147-151 (2000).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kreisman, M. J., Mccosh, R. B., Breen, K. M. A Modified ultra-sensitive ELISA for measurement of LH in mice. Endocrinology. 163 (9), (2022).
- Pielecka-Fortuna, J., Chu, Z., Moenter, S. M. Kisspeptin acts directly and indirectly to increase gonadotropin-releasing hormone neuron activity and its effects are modulated by estradiol. Endocrinology. 149 (4), 1979-1986 (2008).
- Kumar, D., et al. Specialized subpopulations of kisspeptin neurons communicate with GnRH neurons in female mice. Endocrinology. 156 (1), 32-38 (2015).
- Caligioni, C. S. Assessing reproductive status/stages in mice. Current Protocols in Neuroscience. , 1-8 (2009).
- Czieselsky, K., et al. Pulse and surge profiles of luteinizing hormone secretion in the mouse. Endocrinology. 157 (12), 4794-4802 (2016).
- Wang, L., et al. Genetic dissection of the different roles of hypothalamic kisspeptin neurons in regulating female reproduction. eLife. 8, 43999 (2019).
- McCosh, R. B., Kreisman, M. J., Breen, K. M. Frequent tail-tip blood sampling in mice for the assessment of pulsatile luteinizing hormone secretion. Journal of Visualized Experiments. (137), e57894 (2018).
- Vanacker, C., Defazio, R. A., Sykes, C. M., Moenter, S. M. A role for glial fibrillary acidic protein (Gfap)-expressing cells in the regulation of gonadotropin-releasing hormone (GnRH) but not arcuate kisspeptin neuron output in male mice. eLife. 10, e68205 (2021).
- Dulka, E. A., Defazio, R. A., Moenter, S. M. Chemogenetic suppression of GnRH neurons during pubertal development can alter adult GnRH neuron firing rate and reproductive parameters in female mice. eNeuro. 7 (3), 0223 (2020).
- Talbi, R., et al. Characterization of the Action of Tachykinin Signaling on Pulsatile LH Secretion in Male Mice. Endocrinology. 162 (8), 1-9 (2021).
- Tuli, J., Smith, J., Morton, D. Corticosterone, adrenal and spleen weight in mice after tail bleeding, and its effect on nearby animals. Laboratory Animals. 29 (1), 90-95 (1995).
- Lucien, J. N., Ortega, M. T., Shaw, N. D. Sleep and puberty. Current Opinion in Endocrine and Metabolic Research. 17, 1-7 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved