Дистанционная активация нейронов в сочетании с автоматическим забором крови для индуцирования и измерения циркулирующего лютеинизирующего гормона у мышей
In This Article
Summary
Пульсация лютеинизирующего гормона (ЛГ) является отличительным признаком репродуктивной функции. Мы описываем протокол удаленной активации определенных популяций нейронов, связанных с серийным автоматизированным сбором крови. Этот метод позволяет синхронизировать гормональную модуляцию, мультиплексировать и минимизировать манипулятивные эффекты на уровнях ЛГ у сознательных, свободно движущихся и непотревоженных животных.
Abstract
Уровень циркулирующего лютеинизирующего гормона (ЛГ) является важным показателем функционирования гипоталамо-гипофизарного контроля репродукции. Роль многочисленных входов и популяций нейронов в модуляции высвобождения ЛГ до сих пор неизвестна. Измерение изменений уровня ЛГ у мышей часто является сложной задачей, поскольку они легко нарушаются стрессом окружающей среды. Современные методы измерения высвобождения ЛГ и пульсации требуют длительного обучения мышей, чтобы адаптироваться к манипулятивному стрессу, определенной сдержанности, присутствию исследователя и работе с отдельными животными, что снижает его полезность для многих исследовательских вопросов.
В данной статье представлена методика дистанционной активации определенных популяций нейронов с использованием технологии Designer Receptor Exclusive Activated by Designer Drugs (DREADDs) в сочетании с автоматизированным последовательным забором крови у мышей, находящихся в сознании, свободно движущихся и не испытывающих беспокойства. Сначала мы опишем протокол стереотаксической хирургии для доставки аденоассоциированных вирусных векторов (AAV), экспрессирующих DREADD, в определенные популяции нейронов. Далее мы опишем протокол канюляции сонной артерии и яремной вены и послеоперационное подключение к автоматизированной системе забора крови CULEX. Наконец, мы описываем протокол внутривенной инъекции клозапина-N-оксида для удаленной активации нейронов и автоматизированного забора крови. Этот метод позволяет программировать автоматический отбор проб каждые 5 минут или дольше в течение заданного периода времени в сочетании с внутривенным введением вещества в желаемый момент времени или продолжительность. В целом, мы обнаружили, что эта техника является мощным подходом для исследования нейроэндокринного контроля.
Introduction
Гипоталамо-гипофизарно-гонадная ось (ГПГ) централизованно регулируется пульсирующим выбросом гонадотропин-рилизинг-гормона (ГнРГ) в портальную систему гипофиза. В гипофизе ГнРГ контролирует пульсирующее высвобождение гонадотропинов, лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ) в кровеносную систему. Пульсирующее высвобождение ЛГ служит отличительной чертой функционирования центральной оси ГПГ 1,2,3,4. Например, он отображает влияние генетических изменений или изменений гормональных факторов или факторов окружающей среды на нервную часть оси 5,6,7. До недавнего времени измерение пульсирующего паттерна ЛГ ограничивалось крупными млекопитающими8 и крысами9, учитывая высокую частоту отбора проб и большие объемы крови, необходимые для идентификации пульса.
Обнаружение импульсов ЛГ у мышей является желательным, поскольку этот вид имеет широкие генетические модели и может быть легко манипулирован с помощью технологий геномной инженерии для дальнейшего изучения конкретных генов и клеточных популяций. В последнее десятилетие большой прогресс в анализе концентраций ЛГ у мышей с использованием сэндвич-иммуноферментного анализа ЛГ (ИФА) позволил обнаружить ЛГ в незначительном количестве крови10. Разработка метода частого забора крови на кончике хвоста сделала возможным необходимый частый отбор проб для определения частоты и амплитуды импульсов ЛГ у мышей10,11. Тем не менее, забор крови с кончика хвоста ограничен его использованием у бодрствующих животных, находящихся в сознании; Это требует длительного периода обучения, чтобы мыши адаптировались к обращению и присутствию назначенного исследователя во время отбора проб. Его успех очень восприимчив к стрессовым факторам окружающей среды и может не подходить для использования на линиях мышей, демонстрирующих высокий уровень тревожности. Внутрипредсердная канюляция также использовалась для частого забора крови у свободно движущихся мышей в сознании12. Тем не менее, эта установка по-прежнему требует повторного ручного забора крови и ограничивает пространство для движения животного, в то время как канюляция предсердий может привести к динамическим изменениям сердечной функции. Поэтому желательно разработать метод забора крови в условиях отсутствия стресса у сознательных, свободно движущихся и непотревоженных мышей без необходимости предварительного обучения или манипуляций или присутствия человека.
Автоматизированный забор крови или диализата использовался ранее для измерения различных уровней гормонов (например, мелатонина13,14) и их пульсирующей секреции (например, гормона роста)15 у неконтролируемых грызунов. В данной статье мы представляем протокол автоматизированного длительного частого забора крови у животных, находящихся в сознании, и животных, находящихся в бессознательном состоянии, в сочетании со своевременной дистанционной активацией специфических популяций нейронов с использованием хемогенетических технологий: рецепторов-дизайнеров, активируемых исключительно дизайнерскими препаратами (DREADD). Мы опишем стереотаксическую доставку аденоассоциированного вирусного вектора (AAV) и дистанционную активацию путем автоматизированной внутривенной (IV) доставки клозапин-N-оксида (CNO)16,17. Этот протокол позволяет последовательно обнаруживать базальные уровни и индуцированные изменения пульсации ЛГ у нескольких животных одновременно. Как забор крови, так и внутривенное введение соединения проводятся с контролем времени с помощью компьютерной программы, исключающей физическое присутствие исследователя или необходимость предварительного обучения мышей. Этот метод преодолевает основные ограничения ручного забора крови. Он позволяет проводить забор крови в условиях отсутствия стресса и одновременную внутривенную доставку соединения в сочетании с дистанционным контролем активности нейронов. Мы показываем репрезентативные результаты использования автоматизированного забора крови отдельно или в сочетании с дистанционной активацией нейронов, а также обсуждаем его преимущества, ограничения и дополнительные применения.
Protocol
Все процедуры на животных проводятся в соответствии с Руководством Национального исследовательского совета по уходу и использованию лабораторныхживотных, а также федеральными, государственными и местными законами. Для демонстрации протокола были использованы взрослые самки мышей (в возрасте 3-6 месяцев), в том числе четыре самки C57BL/6J и четыре самки Kiss1-Cre; Самки ChR2-eYFP (Kiss1-eYFP). Мышей содержали в цикле 12:12 свет:12, с контролируемой температурой 22 °C и кормили вволю на диете с низким содержанием фитоэстрогенов. Процедуры и протоколы были одобрены Комитетом по уходу и использованию животных Мичиганского университета (IACUC, Animal Protocols: PRO00010420 and PRO00010138).
1. Стереотаксическая доставка AAV в конкретную клеточную популяцию
- Подготовка к операции
- Простерилизуйте все инструменты. Подготовьте несколько упаковок хирургических инструментов, чтобы гарантировать, что каждая упаковка будет использована не более чем для пяти животных. Подготовьте стерильные перчатки, минимум по одной паре для каждого животного.
- Вытягивайте стеклянные микропипетки для инъекций, используя следующие настройки (см. Таблицу материалов) для длинных тонких микропипеток, которые вводятся медленно и равномерно и не забиваются: Heat 1: 915, Heat 2: 630, Pull: 630. Оптимизируйте эти настройки для каждого съемника.
- Проводите операции в специально отведенном для этого хирургическом пространстве. Дезинфицируйте хирургические поверхности 70% этиловым спиртом.
- Используйте стерильные простыни для поддержания стерильности операционного поля. Наденьте чистый лабораторный халат или одноразовый халат и маску.
- Подготовьте ингаляционную наркозную систему. Откройте подачу кислорода и отрегулируйте расход до 0,8 л/мин.
- Хирургия
- Поместите мышь в бокс для анестезии и откройте изофлуран до 2,5%. Снижение расхода изофлурана до 2% после первоначальной индукции; Поддерживайте поток на протяжении всей процедуры. Для получения информации об альтернативных методах анестезии обратитесь к протоколу для животных и рекомендациям местного этического комитета.
- Вводите упреждающий анальгетик (карпрофен 5 мг/кг.к.) в соответствии с рекомендациями комитета по использованию животных и местными правилами.
- Побрейте голову мыши с помощью машинки для стрижки.
- Установите животное на стереотаксический стол, разместите ушные штанги и убедитесь, что голова правильно зафиксирована и устойчива. Прикрепите рот мыши к мундштуку, расположив язык сбоку за пределами рта, чтобы избежать удушья.
- Перед началом операции убедитесь, что животное находится под глубоким наркозом с помощью щипки пальца ноги, и следите за дыханием и цветом мыши на протяжении всей процедуры.
- Разместите опору для возвышения под мышью, чтобы удерживать тело и голову в горизонтальном положении. Держите животное в тепле с помощью теплой подушки, покрытой бумагой. Нанесите глазную мазь на оба глаза, чтобы избежать сухости.
- Содержите операционную область как можно более чистой. Наденьте стерильные перчатки. Продезинфицируйте голову мыши йодом и спиртом перед вскрытием кожи. Скальпелем разрежьте кожу на голове по средней линии, примерно от задней части глаз до зашва-лямбда-шва. Держите череп открытым и очищайте его ватным тампоном, погруженным в стерильный 0,9% NaCl.
- Найдите ростральную ринальную вену (RRV) и отметьте ее стерильным карандашом. Используйте стереоскоп для остальной части процедуры.
ПРИМЕЧАНИЕ: Мы получаем лучшие результаты, используя RRV в качестве переднезаднего эталона, но стандартным является использование брегмы в качестве эталона. - Используя стерильную иглу в качестве эталона, убедитесь, что ориентация мозга правильная, прежде чем приступать к стереотаксическим измерениям. Убедитесь также, что высота поверхности черепа в местах RRV и лямбда, а также боковой наклон одинаковы (± 0,02 мм).
ПРИМЕЧАНИЕ: Боковой наклон становится более актуальным для инъекций в более латеральные структуры мозга. - Загрузите в стерильную стеклянную пипетку раствор вируса, который необходимо ввести. Поднесите его к эталону RRV для референса 0 переднезадний (AP). Продвигайтесь по сагиттальному шву до выбранной координаты АР. Отметьте это положение стерильным карандашом, приподнимите иглу и приступайте к трепанации черепа.
- Осторожно просверлите небольшой круг вокруг отмеченного положения, чтобы не сломать верхний сагиттальный синус. Расположите сверло под наклоном, а не перпендикулярно, чтобы уменьшить давление во время сверления. Удалите кусочек черепа маленькими щипцами.
- После того, как сосудистая сеть обнажена, используйте середину верхнего сагиттального синуса в качестве медиолатерального (ML) ориентира (точка 0); Это более точно, чем использование сагиттального шва. Перейдите на выбранную позицию машинного обучения. Опустите пипетку так, чтобы она касалась твердой мозговой оболочки в качестве дорсовентрального (DV) эталона (точка 0). Слегка разбейте твердую мозговую оболочку и опустите пипетку в выбранное положение DV.
- Введите желаемое количество AAV (50-200 нл) и оставьте канюлю на месте на 3 минуты, чтобы обеспечить достаточное диспергирование жидкости. Осторожно извлеките пипетку из мозга.
- Освободите мышь от ушных планок. Закройте кожу хирургическими зажимами или любым другим методом по выбору. Поместите животное в отдельную утепленную клетку для восстановления. Отслеживайте восстановление, реакцию и активность после того, как мышь выйдет из спящего режима. Когда мышь полностью восстановится, переместите ее обратно в исходную клетку.
- Подождите не менее 3-4 недель для вирусной экспрессии, прежде чем приступать ко второй части процедуры.
2. Канюляция яремной вены и сонной артерии
- Подготовка к операции
- Проводите операции в специально отведенном для этого хирургическом пространстве. Перед началом процедур продезинфицируйте хирургические поверхности 70% этанолом. Подготовьте несколько упаковок хирургических инструментов, чтобы гарантировать, что каждая упаковка будет использована не более чем для пяти животных.
- Автоклавирование всех хирургических инструментов. Затем промыть стерильной водой или физиологическим раствором и продезинфицировать инструменты с помощью стерилизатора с горячими шариками в течение не менее 15 с (в соответствии с инструкциями производителя) между операциями.
- Используйте стерильные простыни для поддержания стерильности операционного поля. Наденьте чистый лабораторный халат или одноразовый халат и маску.
- Подготовьте микрокатетеры для канюляций в сонной артерии и яремной вене. Сконструируйте артериальный катетер, соединив небольшой сегмент трубки из микроренатана (растянутой от 0,025 дюйма наружного диаметра [OD] x 0,012 дюйма внутреннего диаметра [ID]) с силастической трубкой (0,025 дюйма наружного диаметра x 0,012 дюйма внутреннего диаметра). Сконструируйте венозный катетер только с помощью силастической трубки (наружный диаметр 0,025 дюйма x внутренний диаметр 0,012 дюйма). Замочите все катетеры в 70% этаноле на ночь перед операцией.
- Скосите срезанные кончики обоих катетеров под углом 45° до предварительно рассчитанной длины в зависимости от массы тела и длины животного.
- Хирургические процедуры
- Обезболивайте животных под действием 2% изофлурана с помощью настольной системы изофлурана с низким расходом, чтобы точно контролировать стадию и плоскость анестезии во время операции.
- Введите предварительную дозу анальгетика (карпрофен 5 мг/кг.к.) и нанесите офтальмологическую мазь для предотвращения высыхания и травмирования роговицы.
- Побрейте брюшную и заднюю части шеи и очистите кожу тремя йодными скрабами, чередующимися с 70% этанолом. Сделайте вертикальный разрез кожи (12 мм) между лопатками и накройте его хирургической марлей для последующего использования. Поместите животное в положение лежа на спине головой к хирургу.
- Используйте стереоскоп для большинства процедур, описанных ниже.
- Сделайте небольшой вертикальный разрез (~10 мм) на правой стороне шеи, выше ключицы, чтобы обнажить правую сонную артерию и яремную вену. Разрежьте кожу ножницами и выполните тупое рассечение для отделения подкожных тканей с помощью беззубых микрощипцов с тонкими кончиками, обнажив правую наружную яремную вену и правую общую сонную артерию.
- Перевяжите дистальный конец яремной вены, чтобы остановить кровоток, и вырежьте небольшое отверстие в разрушенной вене с помощью микрощипцов и ножниц. Введите венозный катетер скосом вниз и проксимально с помощью пары микрощипцов, чтобы продвинуть его через верхнюю полую вену, чтобы достичь уровня правого предсердия. Длина вставленной мыши ~10-12 мм для 30-граммовой мыши. Завяжите катетер для фиксации с сосудом с помощью шелковых швов 7-0.
ПРИМЕЧАНИЕ: Когда катетер находится в правильном месте, кровь может быть легко взята; В противном случае катетер может быть неправильно размещен в боковой грудной вене и его необходимо будет ввести повторно. - Осторожно рассекают соединительные ткани, чтобы обнажить правую общую сонную артерию, расположенную в треугольной области, окруженной грудино-подъязычной мышцей, грудино-сосцевидной мышцей и двуглавой мышцей. При необходимости используйте проволочное втягивающее устройство, чтобы разделить эти мышцы. Перевяжите артерию на уровне бифуркации внутренней и наружной сонных артерий шелковыми швами 7-0. Наложите две развязанные шовные петли проксимально.
- Временно остановите кровоток, потянув за предварительно установленную шовную петлю, и вырежьте или пробейте небольшое отверстие на стенке сосуда с помощью микроножниц или иглы 27 G. Введите артериальный катетер скосом вниз и проксимально на заданную длину, достигая дуги аорты, но не касаясь аортального клапана. Длина вставленной мыши ~9-10 мм для мыши весом 30 г. Завяжите катетер, чтобы зафиксировать его с сосудом, используя два предварительно наложенных шва.
- Туннелируйте все катетеры подкожно и экстериоризируйте их в задней части шеи через предварительно вырезанный разрез и присоедините их к венозным или артериальным портам соединителя трубок с силиконовым покрытием, изготовленного из игольчатых трубок 25 G: модифицированный MASA19 с использованием двух игольчатых трубок 25 G и двух трубок из полиэтилена PE-20 длиной 4,0 см с оболочкой диаметром 2,0 см диаметром 0,062 дюйма, прикрепленных небольшим металлическим кольцом из проволоки. Общий объем просвета каждого катетера, включая коннектор, составляет 6-8 мкл (рис. 1А).
- Закройте вентральный разрез и зафиксируйте коннектор подкожно при закрытии кожи спины швами. Заполните оба катетера гепаринизированным физиологическим раствором (200 Ед/мл) и плотно заткните их на конце хирургическими проволоками из нержавеющей стали.
- Мыши восстанавливаются после анестезии изофлураном в течение нескольких минут и полностью восстанавливаются после операции в течение 5 дней. Поместите животных в камеру для автоматического сбора крови через 24 часа после операции и подключите их к системе, присоединив крючок системы к металлическому кольцу, прикрепленному к соединителю трубки, имплантированному на задней части шеи. Подключите артериальный и венозный катетеры к линиям для инъекций и забора проб соответственно за 24 ч до начала забора (Рисунок 1B). Общая длина линии отбора проб составляет 55 см в длину или 40 мкл по объему люмена.
ПРИМЕЧАНИЕ: Настройка линий инъекций и отбора проб, программирование метода забора и механизмы балансировки клетки автоматизированной системы отбора проб крови были подробно описаны20,21. Система удерживает катетер открытым, автоматически подавая 10 мкл гепаринизированного физиологического раствора каждые 20 минут. - Установите время и частоту отбора проб до впрыска, впрыска и после впрыска с помощью компьютерной программы системы. Текущие настройки см. в шаге 3.1 ниже.
- Система позволяет животному свободно перемещаться, не запутывая линии отбора проб и/или инфузии, ощущая движение мыши при одновременном вращении камеры корпуса в направлении, противоположном движению мыши21 (рисунок 1).
- Наполните инфузионную или инъекционную линию препаратом и снова подключите к венозному катетеру не менее чем за 2 часа до начала инфузии или инъекции.
ПРИМЕЧАНИЕ: Могут возникнуть осложнения после операции, и животные должны находиться под тщательным наблюдением для восстановления и в течение нескольких дней после операции. Обратитесь к протоколу для животных, чтобы узнать о правильном мониторинге, требованиях к прекращению беременности и процедурах.
3. Автоматизированный забор крови и внутривенное введение
- Автоматизированный забор крови
- Чтобы следовать этому протоколу, используйте объем отбора проб 20,0 мкл и установите интервал (т. е. 7,0 мин) между каждым отбором проб , чтобы частота отбора проб составляла каждые 10,0 мин на образец. Максимальная скорость отбора проб составляет непрерывно со скоростью 3,0 мин/образец; минимально возможный объем отбора проб составляет 5,0 мкл. Равное количество физиологического раствора автоматически возвращается системой для замены взятой крови и поддержания баланса жидкости в организме.
- Общее время отбора проб составляет 30 (t = -30 - 0) мин до и 30 (t = 0 - 30) мин после внутривенного введения CNO (0,5 мг/кг, рисунок 2).
- Каждый собранный образец крови (20,0 мкл) автоматически разводят в 50 мкл физиологического раствора (содержащего гепарин в концентрации 10 Ед/мл) и хранят индивидуально в микропробирке, удерживаемой системой в охлаждаемой карусели образцов.
- Автоматизированная внутривенная инъекция
- Отсоедините венозный катетер от венозного катетера для пополнения CNO (индивидуально рассчитанная доза по объему ~50-60 мкл в дозе 0,5 мг/кг) не менее чем за 2 ч до начала забора крови.
- Вручную ретроградно извлекают раствор (чуть больше расчетного объема) из линии инъекционным шприцем, оставляя небольшой пузырь воздуха между раствором и имеющимся физиологическим раствором в магистрали.
- Снова подсоедините инъекционный катетер к венозному катетеру и установите скорость инъекции на уровне 500 мкл/мин и время начала инъекции на 2 минуты после окончания t = 0 отбора проб. Общее время инъекции для каждого животного составляет 5-6 с.
ПРИМЕЧАНИЕ: При необходимости соединение также может быть введено путем ручной внутрибрюшинной инъекции (ВП), но для этого потребуется потревожить животное во время или до протокола забора крови. Мы также показываем эту альтернативу в результатах.
4. Перфузия животных и забор мозга (ПО ЖЕЛАНИЮ)
ПРИМЕЧАНИЕ: Эту процедуру следует выполнять только в том случае, если мозг должен проанализировать мозговой участок нейронной активации или нисходящих реакций.
- Отключите мышь от системы забора крови в конце протокола забора. Через два часа после внутривенной инъекции приступают к перфузии животного 10%-ным нейтральным буферным формалином (НБФ), используя предпочтительный метод или так, как описано в другом месте22.
- Рассекают мозг и консервируют его в 20% сахарозе в 10%-ном NBF в течение 3 ч для продолжения фиксации.
- Через 3 ч перенесите неподвижный мозг на 20% сахарозу в PBS и консервируйте при 4 °C до тех пор, пока не будут готовы к секционированию.
ПРИМЕЧАНИЕ: Избегайте чрезмерной фиксации, так как это маскирует антигены цФОС. В 20%-ном растворе сахарозы мозг должен опуститься на дно емкости. - Сделайте срезы с помощью замораживающего микротома или криостата и используйте предпочтительный метод для изучения активации нейронов (например, показана иммуногистохимия цФОС).
ПРИМЕЧАНИЕ: Антитела, используемые для получения текущих результатов, описаны в таблице материалов.
5. Обработка и анализ проб
- Сразу после окончания эксперимента извлеките образцы крови из автоматического пробоотборника и положите их на лед.
- Отжим образцы при массе 14 000 × г в течение 30 с.
- Соберите плазму. Хранить при температуре -80 °C до проведения анализа.
- Анализ образцов крови методом ЛГ ИФА, как описано выше10,23.
Representative Results
Кисспептин-экспрессирующие нейроны (ген Kiss1), расположенные в дугообразном ядре гипоталамуса, являются мощным стимулятором ГнРГ и, следовательно, высвобождения ЛГ из гипофиза24,25. В этой демонстрации протокола мы использовали индуцированную кисспептином секрецию ЛГ, чтобы проиллюстрировать работу автоматизированной техники забора крови. На рисунке 2 показаны репрезентативные паттерны ЛГ у взрослых самок Kiss1-eYFP, которые ранее получали одностороннюю стереотаксическую инъекцию AAV-hM3Dq-mCherry в дугообразное ядро (AP: -4,95, ML: -0,35, DV: -5,7). ChR2-eYFP использовали в качестве флуоресцентного репортера для клеток Kiss1. Через месяц после стереотаксической операции мышам была проведена канюляция сонной артерии и яремной вены, а через 4 дня после операции они были подключены к автоматическому анализатору крови. Забор крови для определения базального уровня ЛГ начинался на следующий день с частотой забора проб 10 мин (интервал между образцами 7 мин и 3 мин/забор) с последующей автоматической внутривенной инъекцией CNO и продолжением забора крови каждые 10 мин в течение 30 мин. Дистровидные уровни ЛГ, как правило, низкие (рис. 2А), но колебания обычно наблюдаются из-за его пульсирующего высвобождения (рис. 2В). После инъекции CNO (и активации нейронов кисспептина) повышение ЛГ было резким (в течение 10 мин). Уровень увеличения и продолжительность пика зависит от множества факторов, включая место инъекции, количество активированных нейронов или целевую популяцию.
На рисунке 3 показан участок инъекции в дугообразное ядро самки мыши, представленный на рисунке 2А. Нейроны Kiss1-eYFP помечены зеленым цветом, в то время как иммунореактивность mCherry показывает место инъекции AAV и активации после CNO. Активированные нейроны детектировали с помощью иммунореактивности цФОС, меченой DAB. Большинство нейронов mCherry были локализованы с Kiss1-eYFP, и многие из них показали иммунореактивность цФОС, демонстрируя, что вирусная и нейрональная активация была специфичной для целевой популяции.
На рисунке 4 показан репрезентативный пульсирующий паттерн высвобождения ЛГ у мышей дикого типа (C57BL/6J) с последующим ответом на IP-инъекцию кисспептина-10. Мышь была подвергнута канюляции сонной артерии и подключена к автоматической системе забора крови через 4 дня после операции. На следующее утро проверяли эстральные циклы, а на26-й день проводили забор крови и инъекцию кисспептина-10. Образцы крови собирали каждые 7 мин в течение 2 ч (интервал 4 мин, плюс 3 мин/забор за 120 мин до инъекции) для определения исходного уровня и пульсации ЛГ, после чего вводили кисспептин-10 (65 мкг/кг) и продолжали забор крови каждые 7 мин в течение дополнительных 30 мин. Наблюдались четкие импульсы ЛГ, характерные для женщин в дистро, с низким базальным уровнем ЛГ, частотой импульсов ~2 ш/ч и амплитудой импульсов ~1 нг/мл27. Немедленное и устойчивое повышение уровня ЛГ было выявлено в ответ на введение кисспептина28. Характер секреции ЛГ и изменения после стимуляции согласуются с другими исследованиями с использованием ручного забора крови 10,27,29,30. Эти результаты показывают, что автоматизированный метод забора крови фиксирует типичную и стимулированную секрецию ЛГ в условиях отсутствия стресса.
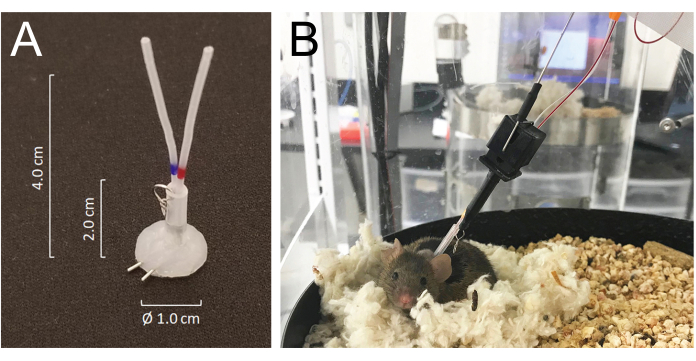
Иллюстрация 1: Подробная информация о соединительной системе и соединениях мыши с трубками системы инфузии и пробоотборника. (A) Соединитель трубок с силиконовым покрытием (MASA), изготовленный из двух игольчатых трубок 25G и двух трубок из ПЭ-20, загнанных в силастиковую трубку, прикрепленную небольшим металлическим кольцом. (B) Мышь, подключенная к инфузионной трубке и трубке для отбора проб в клетке для отбора проб, отдыхающая в своем гнезде во время забора крови. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
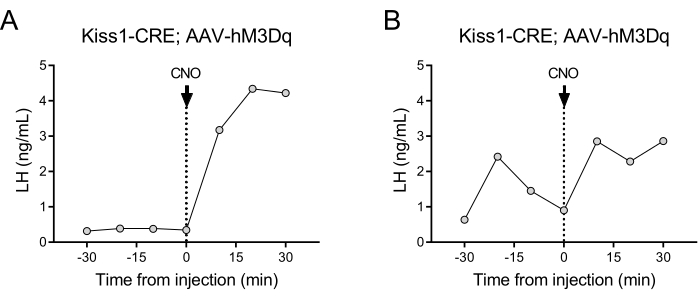
Рисунок 2: Репрезентативные результаты импульсов ЛГ у самок мышей Kiss1-Cre, которым вводили AAV-hM3Dq в дугообразное ядро и дистанционно активировали CNO. Базальный уровень ЛГ измеряли каждые 10 минут в течение получаса. Через 0 минут после забора крови женщине была введена внутривенная инъекция клозапин-N-оксида (0,5 мг/кг), и забор крови из сонной артерии продолжался каждые 10 мин в течение дополнительных получаса. (А) Показывает самку с низким базальным уровнем ЛГ. (B) Показывает женщину, демонстрирующую предварительную инъекцию импульса ЛГ. Сокращения: Kiss1 = Kisspeptin; AAV = аденоассоциированный вирус; CNO = клозапин-N-оксид; ЛГ = лютеинизирующий гормон. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
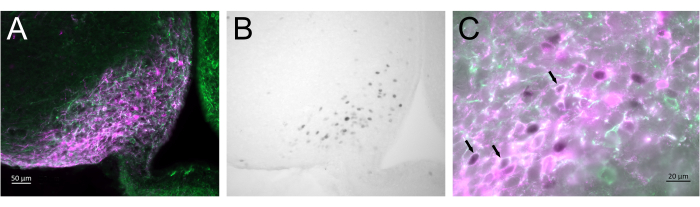
Рисунок 3: Активация мозга в дугообразном ядре Kiss1-Cre; Самка Chr2-eYFP (Kiss1-eYFP) представлена на рисунке 2A. ChR2-eYFP использовался только в качестве репортерного гена для мечения нейронов kiss1. (А) Флуоресцентное изображение с малым увеличением, показывающее место инъекции AAV в дугообразном ядре. Зеленый: иммунореактивность eYFP, пурпурный: иммунореактивность mCherry. (B) Светлопольное изображение области, соответствующей рисунку 3A, с малым увеличением, показывающее иммунореактивность цФОС (черный) в месте инъекции AAV в дугообразном ядре. (C) Комбинация флуоресценции и светлого поля с большим увеличением, показывающая более близкий вид нейронов на рисунке 3A,B. Нейроны Kiss1-eYFP, коэкспрессирующие AAV-mCherry, которые были активированы, являются нейронами с белой цитоплазмой и черным ядром (стрелки). Масштабные линейки = 50 мкм (A,B), 20 мкм (C). Сокращения: Kiss1 = Kisspeptin; AAV = аденоассоциированный вирус; eYFP = усиленный желтый флуоресцентный белок. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
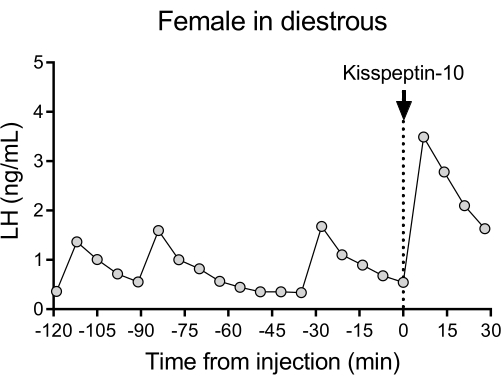
Рисунок 4: Базальная пульсация ЛГ у самок дикого типа, измеренная каждые 7 мин в течение 2 ч. Затем самка получала внутрибрюшинную инъекцию кисспептина-10 (65 мкг/кг) в момент 0, и образцы крови непрерывно собирались каждые 7 минут в течение получаса. Аббревиатура: ЛГ = лютеинизирующий гормон. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Discussion
Используя этот протокол, мы смогли показать базальную пульсацию ЛГ и секрецию ЛГ после стимуляции популяции нейронов. Большим преимуществом системы является отсутствие стресса, в которой происходит забор крови, без присутствия человека или манипуляций во время забора крови. Кроме того, не потребовалось никакой предварительной кропотливой дрессировки животных и адаптации к присутствию человека или обращению с ними во время эксперимента. Предыдущие эксперименты с использованием ручного забора крови требовали большого количества времени и усилий для минимизации стрессоров 7,31,32. Тем не менее, отрезание хвоста само по себе является стрессовым фактором33. Внедрение нестрессовой среды и парадигмы дрессировки в общих животноводческих помещениях, где перерывы непредсказуемы, также может быть сдерживающим фактором. В некоторых лабораториях животных часто приходится транспортировать в альтернативные процедурные кабинеты для забора крови. Эти ограничения могут сделать ручной метод неподходящим для обнаружения тонких изменений уровня ЛГ, и поэтому в таких ситуациях может быть полезен подход «невмешательство». Автоматический отбор проб устанавливается в тихой комнате, куда мышей помещают за несколько дней, чтобы они могли акклиматизироваться в новой среде. Наш предыдущий опыт работы с этим протоколом обеспечил точное обнаружение паттернов секреции кортикостерона и пульсирующего гормона роста у мышей, не показав повышенных уровней кортикостерона во время автоматического отбора проб15. В текущих экспериментах все животные были хорошо адаптированы к системе отбора проб, что показало строительство гнезда в пробоотборной камере через ~24 ч и яркий цвет шерсти, что указывает на отсутствие стресса и общее хорошее состояние здоровья (рис. 1).
Основная трудность, приводящая к отрицательным результатам, вероятно, заключается в неправильном нацеливании AAV на требуемую популяцию нейронов. Точность стереотаксических инъекций имеет важное значение, и необходимо заранее провести обучение, чтобы проверить координаты и объемы инъекций. Тренировка может быть проведена путем инъекции небольшого количества 0,5-1% Evans Blue в желаемое место при невосстановительной операции, а затем взятия среза только что препарированного мозга с помощью матрицы мозга мыши (например, Ted Pella) для проверки места и размера инъекции с помощью стереоскопа.
Также важно учитывать, что кровь и плазма, собранные с помощью автоматизированной системы забора крови, будут разбавлены гепаринизированным физиологическим раствором (например, 20 мкл крови в 50 мкл физиологического раствора в наших результатах)20, и может потребоваться корректировка коэффициента разведения в соответствии с чувствительностью выбранного аналитического метода. Мы проверили уровень ЛГ в цельной крови, разбавленной БСА-ПБС (в соответствии с рекомендациями для сверхчувствительного ИФА ЛГ)10 или физиологическим раствором, и не обнаружили различий в значениях ЛГ. Твин нельзя использовать в разбавителе, так как он будет циркулировать в системе крови для извлечения образцов путем замены жидкостей образца20. По нашему опыту, разведения менее 1:10 давали хорошие результаты ЛГ, но немного занижали уровень ЛГ по сравнению с 1:3,5. Это указывает на то, что при необходимости разведение может быть дополнительно скорректировано для уменьшения количества собираемой крови.
Альтернативой автоматизированной доставке соединения является ручное введение через венозный катетер. В этом случае исследователь ненадолго присутствует в комнате, чтобы сделать инъекцию. Тем не менее, нет прямого контакта с животными или их жильем и окружающей средой, и, в отличие от внутрибрюшинных или подкожных инъекций, вся процедура часто остается незаметной для животного. Преимущества ручного впрыска заключаются в том, что разбавление компаунда не нужно настраивать заранее, что может быть критично для соединений, которые слишком дороги для использования в больших объемах или чувствительны к разложению с течением времени; Поскольку рабочий объем меньше, чем при автоматизированных родах, где инфузионная линия и катетер должны быть предварительно заполнены большим количеством составного раствора.
Автоматический забор крови дает уникальную возможность изучать вариации ЛГ, например, во время сна. Мы регулярно наблюдали за животными, спящими в своих гнездах во время отбора проб. Эту выборку можно связать с записями ЭЭГ для более детального анализа взаимосвязи между нейронной активностью и паттерномЛГ 34. Как показано здесь, существует множество возможностей для использования автоматизированного забора крови: от базального забора ЛГ до тестирования ответа ЛГ на эндогенные или экзогенные соединения, или до активации или подавления популяций нейронов. Манипуляции с нейронами могут быть реализованы с помощью хемогенетики или оптогенетики, или постоянно с использованием трансгенных мышиных моделей и инструментов апоптотического или нейронального молчания. Автоматический забор крови также позволяет измерять другие гормоны с высокопульсирующим секреторным паттерном (например, гормон роста15). У самок мышей, если требуется определенная фаза эстрального цикла, мазки из влагалища могут быть тщательно собраны за несколько часов до начала протокола26 , не нарушая линии инфузии и отбора проб. Животные могут быть подключены к системе отбора проб на 7-10 дней, при этом риск свертывания артериальной линии со временем увеличивается.
Этот метод, однако, ограничен использованием у однодомашних животных, и поэтому он может не подходить для изучения социальных взаимодействий. Кроме того, она является инвазивной и требует технически сложного хирургического вмешательства, поэтому ее может быть невозможно реализовать на молодых животных или на определенных моделях заболеваний. Наконец, поскольку стоимость приобретения системы может быть слишком высокой для одной исследовательской лаборатории, было бы целесообразно установить ее в основной лаборатории, предоставляющей упомянутый экспериментальный протокол в качестве услуг.
В заключение, этот протокол показывает, как выполнять стереотаксическую доставку AAV в сочетании с автоматизированным забором крови. Точный пространственный и временной контроль, достигаемый с помощью этого метода, вместе с гибкостью применения к различным моделям, протоколам измерений и гормонам, делает его мощным методом для изучения гормональной регуляции у грызунов. Самое главное, что этот метод обеспечивает среду, свободную от стресса, исключая присутствие человека и манипуляцию во время инъекции и/или отбора проб, а также предварительную дрессировку животных. Эти преимущества, вместе с возможностью мультиплексирования, делают этот метод уникальным инструментом для изучения нейронного контроля гормональных изменений у сознательных, свободно движущихся и непотревоженных мышей.
Disclosures
У авторов нет конфликта интересов, который можно было бы раскрыть.
Acknowledgements
Мы благодарим доктора Даниэля Хайзенледера за его помощь в тестировании различных методов разведения крови. Анализы на сывороточные гормоны были проведены в Центре исследований в области репродуктивного лигандного анализа и анализа Центра анализа лигандов при поддержке гранта Юнис Кеннеди Шрайвер NICHD R24 HD102061. Мичиганский центр метаболического фенотипирования мышей-Live поддерживается грантом Центра NIH U2C DK135066. JF и NQ поддерживаются грантами DK020572 (MDRC) и DK089503 (MNORC). CFE и CSM поддерживаются грантами NICHD R21 HD109485 и R01 HD096324.
Materials
| Name | Company | Catalog Number | Comments |
| AAV8-hSyn-hM3D(Gq)-mCherry | Addgene | 44361 | Not necessarily this virus but this was the one used for representative results |
| Alcohol | Disinfection | ||
| Anesthesia Induction box | Vetequip | ||
| Anesthesia induction machine | Kent Scientific Equipment | SomnoSuite | |
| Anesthesia masks for mice | Kent Scientific Equipment | SOMNO-0801 | |
| Autoclip applier 9 mm | Clay Adams | 427630 | |
| Autoclip remover 9 mm | Clay Adams | 427637 | |
| Autoclips 9 mm | Clay Adams | 427631 | |
| BASi Culex Controller | Culex | SN: 2151, 2152, 2156, 2158 | 4 stations |
| BASi Honey Comb Fraction Collector | Honey Comb | SN: 2105, 2106, 2107, 2108 | 4 stations |
| BASi Ratrun Rotation Control | RATURN 2 | SN: 5680, 5681, 5682, 5683 | 4 stations |
| C57BL/6J mice | JAX # 000664 | ||
| Carprofen | Zoetis | Rimadyl | Analgesic |
| Clippers | Braun | ||
| Clozapine-N-oxide | ENZO | BLM-NS105-0005 | |
| Cotton tipped applicators | |||
| CULEX Automated In Vivo Sampling System | BASi | DS000627 | with CX-4000S Replacement Tubing Sets |
| Curved forceps serrated | FST | 11151-10 | |
| Drill | Dremel | 61100 | |
| Empis control Module | EMPIS CM | SN: 174 | |
| Empis Programmable Infusion System | EMPIS | SN: 2125 , 2126, 2127, 2128 | With CX-7010S 4 BAS-2 Infusion Sets; 4 stations |
| Envigo 2016 diet | low-phytoestrogen diet | ||
| Eye ointment | Dechra | Puralube Vet Ointment | Petrolatum Ophtalmic oinment |
| Glass pipettes | World Precision Instruments | MIB100-6 | |
| Hemostats | Roboz Surgical | RS-7101 | |
| Iodine | Betadine Surgical scrub | ||
| Isoflurane | VetOne | Fluriso | Anesthetic |
| Isoflurane Vaporizer or SomnoSuite Low-Flow Anesthesia System | Surgivet or Kent Scientific Corp | SS-01 | Anesthesia Machine |
| Kiss1-Cre;ChR2-eYFP (Kiss1-eYFP) mice | JAX # 023436 and #024109 | ||
| Kisspeptin-10 | Phoenix Pharmaceuticals | 048-56 | |
| Micro-renathane tubing | Braintree Scientific | MRE025 | Surgical catheterization |
| Micro-Scissors | Roboz Surgical | RS-5606 | |
| Needle Holder | Roboz Surgical | RS-7842 | |
| Picoliter injector | Warner Instruments | PLI-100A | |
| Pipette puller | Sutter Instruments | P30 | |
| Rodent Warmer X2 | Stoelting | 53850 | |
| Scalpel | FST | 10003-12 | |
| Scissors | Roboz Surgical | RS-6808 | |
| Silicon tubing | Liveo Laboratory Tubing | NO.508-001 | 0.012 in I.D x 0.025 in O.D. |
| Stereotaxic table | RWD | E06208 | |
| Sterile 0.9% saline | Baxter | 2F7124 | |
| Sterile towel drapes | Dynarex | 4410 | |
| Surgical blades | SKLAR | 06-3011 | |
| Surgical stereoscope | Zeiss | f-160 | |
| Tweezers | Roboz Surgical | RS-4960 | |
| Tweezers | Roboz Surgical | RS-4972 | |
| Tweezers | Roboz Surgical | RS-5058 | |
| Antibodies | |||
| Anti-cFos | Millipore | ABE457 | Antigen target: N-terminus cFos; Host organism: Rabbit; Dilution used: 1:5,000; RRID: AB_2631318 |
| Anti-GFP | Aves Labs | GFP-1010 | Antigen target: recombinant GFP null; Host organism: Chicken; Dilution used: 1:10,000; RRID: AB_2307313 |
| Biotin-SP-conjugated AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch Labs | 711-065-152 | Antigen target: Rabbit IgG (H+L); Host organism: Donkey; Dilution used: 1:1,000; RRID: AB_2340593 |
| Donkey anti-Rat IgG, AlexaFluor 594 | Thermo Fisher Scientific | A-21209 | Antigen target: Rat IgG (H+L); Host organism: Donkey; Dilution used: 1:500; RRID: AB_2535795 |
| Goat anti-Chicken IgY, Alexa Fluor 488 | Thermo Fisher Scientific | A-11039 | Antigen target: Chicken, IgY (H+L); Host organism: Goat; Dilution used: 1:500; RRID: AB_2534096 |
| mCherry monoclonal (16D7) | Thermo Fisher Scientific | M11217 | Antigen target: mCherry tag; Host organism: Rat; Dilution used: 1:5,000; RRID: AB_2536611 |
References
- Kokoris, G. J., Lam, N. Y., Ferin, M., Silverman, A. J., Gibson, M. J. Transplanted gonadotropin-releasing hormone neurons promote pulsatile luteinizing hormone secretion in congenitally hypogonadal (hpg) male mice. Neuroendocrinology. 48 (1), 45-52 (1988).
- Coquelin, A., Desjardins, C. Luteinizing hormone and testosterone in young and old male mice. American Journal of Physiology - Endocrinology and Metabolism. 243 (3), E257-E263 (1982).
- Carmel, P. W., Araki, S., Ferin, M. Pituitary stalk portal blood collection in rhesus monkeys: Evidence for pulsatile release of gonadotropin-releasing hormone (GnRH). Endocrinology. 99 (1), 243-248 (1976).
- Schuiling, G., Gnodde, H. Site of origin of the pulsatile secretion of luteinizing hormone in long-term ovariectomized rats. Journal of Endocrinology. 70 (1), 97-104 (1976).
- Hackwell, E. C. R., Ladyman, S. R., Brown, R. S. E., Grattan, D. R. Mechanisms of lactation-induced infertility in female mice. Endocrinology. 164 (5), 1-12 (2023).
- Bahougne, T., Kretz, M., Angelopoulou, E., Jeandidier, N., Simonneaux, V. Impact of circadian disruption on female mice reproductive function. Endocrinology. 161 (4), (2020).
- Kreisman, M. J., McCosh, R. B., Tian, K., Song, C. I., Breen, K. M. Estradiol Enables Chronic Corticosterone to Inhibit Pulsatile Luteinizing Hormone Secretion and Suppress Kiss1 Neuronal Activation in Female Mice. Neuroendocrinology. 110 (6), 501-516 (2020).
- Moenter, S. M., Evans, N. P. Gonadotropin-releasing hormone GnRH measurements in pituitary portal blood. Journal of Neuroendocrinology. 34 (5), 13065 (2022).
- Maeda, K. I., et al. The LHRH pulse generator: A mediobasal hypothalamic location. Neuroscience and Biobehavioral Reviews. 19 (3), 427-437 (1995).
- Steyn, F. J., et al. Development of a methodology for and assessment of pulsatile luteinizing hormone secretion in juvenile and adult male mice. Endocrinology. 154 (12), 4939-4945 (2013).
- Steyn, F. J., et al. Development of a method for the determination of pulsatile growth hormone secretion in mice. Endocrinology. 152 (8), 3165-3171 (2011).
- Minabe, S., Uenoyama, Y., Tsukamura, H., Maeda, K. Analysis of pulsatile and surge-like luteinizing hormone secretion with frequent blood sampling in female mice. Journal of Reproduction and Development. 57 (5), 660-664 (2011).
- Perreau-Lenz, S., Kalsbeek, A., Pévet, P., Buijs, R. M. Glutamatergic clock output stimulates melatonin synthesis at night. European Journal of Neuroscience. 19 (2), 318-324 (2004).
- Herwig, A., Pévet, P., Bothorel, B., Steinlechner, S., Saboureau, M. Trans-pineal microdialysis in the Djungarian hamster (Phodopus sungorus): A tool to study seasonal changes of circadian clock activities. Journal of Pineal Research. 40 (2), 177-183 (2006).
- Adams, J. M., Otero-Corchon, V., Hammond, G. L., Veldhuis, J. D., Qi, N., Low, M. J. Somatostatin is essential for the sexual dimorphism of GH secretion, corticosteroid-binding globulin production, and corticosterone levels in mice. Endocrinology. 156 (3), 1052-1065 (2015).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63 (1), 27-39 (2009).
- Krashes, M. J., et al. reversible activation of AgRP neurons drives feeding behavior in mice. Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- National Research Council. Guide for the Care and Use of Laboratory Animals. Eighth edition. National Research Council. , (2011).
- Ayala, J. E., et al. Hyperinsulinemic-euglycemic clamps in conscious, unrestrained mice. Journal of Visualized Experiments. (57), e3188 (2011).
- Peters, S., et al. Culex ABS Part I: Introduction to automated blood sampling. Current Separations. 18 (4), 139-145 (2000).
- Bohs, C., Cregor, M., Gunaratna, G., Kissinger, C. Culex Automated blood sampler part II Managing freely-moving animals and monitoring their activity. Current Separations. 18 (4), 147-151 (2000).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kreisman, M. J., Mccosh, R. B., Breen, K. M. A Modified ultra-sensitive ELISA for measurement of LH in mice. Endocrinology. 163 (9), (2022).
- Pielecka-Fortuna, J., Chu, Z., Moenter, S. M. Kisspeptin acts directly and indirectly to increase gonadotropin-releasing hormone neuron activity and its effects are modulated by estradiol. Endocrinology. 149 (4), 1979-1986 (2008).
- Kumar, D., et al. Specialized subpopulations of kisspeptin neurons communicate with GnRH neurons in female mice. Endocrinology. 156 (1), 32-38 (2015).
- Caligioni, C. S. Assessing reproductive status/stages in mice. Current Protocols in Neuroscience. , 1-8 (2009).
- Czieselsky, K., et al. Pulse and surge profiles of luteinizing hormone secretion in the mouse. Endocrinology. 157 (12), 4794-4802 (2016).
- Wang, L., et al. Genetic dissection of the different roles of hypothalamic kisspeptin neurons in regulating female reproduction. eLife. 8, 43999 (2019).
- McCosh, R. B., Kreisman, M. J., Breen, K. M. Frequent tail-tip blood sampling in mice for the assessment of pulsatile luteinizing hormone secretion. Journal of Visualized Experiments. (137), e57894 (2018).
- Vanacker, C., Defazio, R. A., Sykes, C. M., Moenter, S. M. A role for glial fibrillary acidic protein (Gfap)-expressing cells in the regulation of gonadotropin-releasing hormone (GnRH) but not arcuate kisspeptin neuron output in male mice. eLife. 10, e68205 (2021).
- Dulka, E. A., Defazio, R. A., Moenter, S. M. Chemogenetic suppression of GnRH neurons during pubertal development can alter adult GnRH neuron firing rate and reproductive parameters in female mice. eNeuro. 7 (3), 0223 (2020).
- Talbi, R., et al. Characterization of the Action of Tachykinin Signaling on Pulsatile LH Secretion in Male Mice. Endocrinology. 162 (8), 1-9 (2021).
- Tuli, J., Smith, J., Morton, D. Corticosterone, adrenal and spleen weight in mice after tail bleeding, and its effect on nearby animals. Laboratory Animals. 29 (1), 90-95 (1995).
- Lucien, J. N., Ortega, M. T., Shaw, N. D. Sleep and puberty. Current Opinion in Endocrine and Metabolic Research. 17, 1-7 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved