Создание двумерной однослойной системы культивирования первичного энтероида крупного рогатого скота для применения в трансляционных биомедицинских исследованиях
In This Article
Summary
Энтероиды становятся новой моделью для изучения физиологии и патофизиологии тканей, разработки лекарств и регенеративной медицины. Здесь мы описываем 2D-систему культивирования первичных клеток крупного рогатого скота, полученную из энтероидов, которая позволяет проводить совместное культивирование с соответствующими типами клеток тканей. Эта модель предлагает трансляционное преимущество для моделирования исследований желудочно-кишечного тракта.
Abstract
Системы культивирования органоидных клеток могут повторить сложность, наблюдаемую в тканях, что делает их полезными при изучении взаимодействий патогена и хозяина, оценке эффективности и токсичности лекарств, а также в биоинженерии тканей. Однако применение этих моделей по описанным причинам может быть ограничено из-за трехмерной (3D) природы этих моделей. Например, использование 3D-систем энтероидных культур для изучения заболеваний органов пищеварения является сложной задачей из-за недоступности просвета кишечника и секретируемых им веществ. Действительно, стимуляция 3D-органоидов патогенами требует либо просветной микроинъекции, либо механического разрушения трехмерной структуры, либо генерации апикальных энтероидов. Более того, эти органоиды не могут культивироваться совместно с иммунными и стромальными клетками, что ограничивает углубленный механистический анализ патофизиологической динамикой. Чтобы обойти эту проблему, мы оптимизировали двухмерную (2D) однослойную систему культивирования первичных клеток крупного рогатого скота, полученную из энтероидов, что позволило проводить совместное культивирование с другими соответствующими типами клеток. Подвздошные крипты, выделенные из здорового взрослого крупного рогатого скота, культивировались для получения 3D-органоидов, которые были криоконсервированы для будущего использования. Двухмерный монослой был создан с использованием реанимированных 3D-энтероидов, которые пассировались и разрушались с получением одиночных клеток, которые были высеяны на покрытые базальной мембраной трансвелл-клеточные вставки, покрытые экстрактом, тем самым обнажая их апикальную поверхность. Полярность монослоя кишечника, клеточная дифференцировка и барьерная функция были охарактеризованы с помощью иммунофлуоресцентной микроскопии и измерения трансэпителиального электрического сопротивления. Стимуляция апикальной поверхности монослоя выявила ожидаемую функциональность монослоя, о чем свидетельствует секреция цитокинов как из апикальных, так и из базальных компартментов. Описанная 2D-модель монослоя, полученная из энтероидов, имеет большие перспективы в исследовании взаимодействий между хозяином и патогеном, физиологии кишечника, разработке лекарств и регенеративной медицины.
Introduction
Животные модели в исследованиях играют решающую роль в углублении нашего понимания патофизиологии заболевания и динамики иммунного ответа хозяина во время инфекции и поддерживают разработку новых профилактических и терапевтических стратегий 1,2,3,4. Эти модели поддерживают научные открытия и прогресс в области животных и являются ключом к прогрессу исследований в области здоровья человека. На протяжении десятилетий модели грызунов лежали в основе достижений в области иммунных механизмов и фундаментальных биологических исследований болезней человека 3,5,6,7. В то время как модели грызунов имеют решающее значение для скрининга и исследований на ранних стадиях развития, модели крупных животных предлагают более уместное сравнение при изучении болезней человека как на ранних стадиях, так и в более поздних исследованиях развития, включая тестирование терапевтической эффективности и безопасности 1,3,4,5. Животноводство имеет явные преимущества по сравнению с моделями грызунов для более эффективной трансляции для применения человеком при некоторых заболеваниях, включая криптоспоридиоз, сальмонеллез, туберкулез, респираторно-синцитиальный вирус и бруцеллез 1,7,8. Действительно, эти и другие заболевания спонтанно развиваются у крупного рогатого скота, который имеет несколько схожих патогенеза и иммунных процессов с людьми, и, как беспородная популяция, крупный рогатый скот имитирует генетическую и экологическую гетерогенность, влияющую на иммунные реакции человека 5,8,9,10 . Преимущества моделей крупного рогатого скота для исследования инфекционных заболеваний могут быть максимизированы, если сначала использовать сложную систему культивирования, а затем поэтапно внедрять исследования in vivo. Первоначальное использование очень сложной системы культивирования крупного рогатого скота может значительно сократить количество исследований на живых животных, одновременно повышая шансы на успешные трансляционные и прикладные исследования. Культуральные модели должны повторять процессы заболевания на уровне органов для оптимальной прогностической валидности, сохраняя нативное тканевое микроокружение пространственно и функционально.
Иммунный ответ слизистой оболочки представляет собой многогранную систему, состоящую из высокоэффективного барьера, образованного энтероцитами желудочно-кишечного тракта, и разнообразными популяциями иммунных клеток, расположенных под поверхностью слизистой оболочки11. Эта очень сложная система имеет решающее значение во время инфекции для поддержания гомеостаза желудочно-кишечного тракта и инициирования иммунной защиты против кишечных патогенов11. Связь между энтероцитами и нижележащими клетками врожденного иммунитета инициирует развитие защитных иммунных реакций против патогенных микроорганизмов. Таким образом, системы культивирования, которые являются сравнительными по своему уровню сложности, необходимы для оптимального исследования взаимодействий патогенов между хозяином и кишечными патогенами и очень эффективны в понимании физиологии кишечника, а также в открытии и разработке лекарств12,13. Органоиды представляют собой устойчивую культуральную систему, которая напоминает архитектуру и функции исходной ткани14,15. Многоклеточность этих моделей позволяет исследовать роль различных клеточных популяций и клеточных взаимодействий, участвующих в здоровье и заболеваниях кишечника12,14. Тем не менее, модели органоидов человеческого происхождения в исследованиях в настоящее время ограничены сложностью получения достаточного количества и стабильного качества эпителиальных клеток кишечника человека и ограниченной жизнеспособностью клеток в культуре. Иммортализированные клеточные линии могут быть использованы для получения высоких выходов гомологичных культур в этих моделях последовательно; Однако трансформированные клетки по своей природе лишены разнообразия и функциональной сложности нетрансформированных эпителиальных клеток16,17. Преимущества использования культур, полученных из бычьей ткани, в качестве модели для исследования заболеваний и физиологии желудочно-кишечного тракта включают легкость, с которой образцы тканей могут быть последовательно получены от здоровых доноров, улучшенную жизнеспособность клеток и большее клеточное разнообразие, достижимое только с неиммортализированной тканью. Сравнительная транскриптомика тканей и характеристика кишечных органоидов выявили сходство консервативных ортологичных генов и клеточных потенциалов между человеком и крупным рогатым скотом18. Таким образом, система культивирования бычьих органоидов может быть полезна при исследовании кишечных заболеваний человека, с результатами, которые могут быть легко перенесены на медицину человека.
Протокол, описанный в настоящем документе, детализирует эффективную платформу для оценки реакции организма на кишечные патогены или соединения и физиологии кишечника с использованием 2D-системы первичной клеточной культуры бычьего энтероида. В отличие от 3D-органоидов, 2D-системы культивирования, генерируемые на трансвелл-вставках, позволяют проводить двойную культуру кишечных клеток с иммунными или стромальными клетками, что позволяет изучать динамику на тканевом уровне. Эта физиологически значимая модель, применяемая в биомедицинских исследованиях, фармацевтических разработках и испытаниях эффективности, может принести пользу здоровью и развитию как крупного рогатого скота, так и людей.
Protocol
Все протоколы были выполнены в соответствии с институциональными и национальными руководящими принципами и правилами по благополучию животных.
1. Приготовление реагента
ПРИМЕЧАНИЕ: Запасы и конечные концентрации реагентов, использованных в данном исследовании, приведены в таблице 1.
- Подготовьте буфер для взятия проб: смешайте 1 л ледяного фосфатно-солевого буфера (PBS), содержащего пенициллин (100 ед/мл), стрептомицин (100 мкг/мл), гентамицин (25 мкг/мл) и каспофунгин (2,5 мкг/мл). Храните исходный раствор при температуре 4 °C.
- Приготовьте реагент для диссоциации #1: смешайте 18,55 мл буфера для сбора образцов (как описано на шаге 1.1), 1,422 мл этилендиаминтетрауксусной кислоты (ЭДТА, 0,422 М/pH 7,4), 20 мкл 1 М раствора 1,4-дитиотрейтола (DTT), 4 мкл раствора Y-27632 (5000x/50 мМ). Хранить раствор при температуре 4 °C.
- Приготовьте диссоциационный реагент #2: смешайте 18,57 мл буфера для сбора (как описано в шаге 1.1), 1,422 мл ЭДТА (0,422 М/рН 7,4), 4 мкл раствора Y-27632 (5000x/50 мМ). Хранить раствор при температуре 37 °C.
- Подготовьте запас питательной среды для энтероидов: смешайте 9,875 мл органоидной питательной среды плюс добавку, 100 мкл пенициллина (100 ед/мл), стрептомицина (100 мкг/мл), 5 мкл гентамицина (25 мкг/мл) и 20 мкл каспофунгина (2,5 мкг/мл). Хранить раствор при температуре 4 °C.
- Подготовьте материал для дифференцировки энтероидов: смешайте 10 мл среды для дифференцировки органоидов с добавкой, 100 мкл пенициллина (100 ед/мл), стрептомицина (100 мкг/мл), 5 мкл гентамицина (25 мкг/мл) и 20 мкл каспофунгина (2,5 мкг/мл). Хранить раствор при температуре -20 °C.
- Подготовьте промывочную среду: смешайте 48,45 мл среды DMEM/F-12 1,1 (с L-глютамином, без HEPES), 1 мл добавки B27 без витамина A (50x бульона), 500 мкл пенициллина (100 ед/мл), стрептомицина (100 мкг/мл), 25 мкл гентамицина (50 мг/мл бульона) и 25 мкл каспофунгина (5 мг/мл бульона). Хранить раствор при температуре 4 °C.
- Подготовьте буфер для покрытия: смешайте 25 мл полной среды DMEM: F12 без ингибиторов и 25 мг бычьего сывороточного альбумина (BSA). Хранить раствор при температуре 4 °C.
2. Выделение кишечных крипт из цельной ткани (рисунок 1)
ПРИМЕЧАНИЕ: Энтероиды тонкого кишечника крупного рогатого скота были получены из подвздошной ткани, полученной от здоровых взрослых бычков голштинской породы (>2 года) с местного завода по переработке говядины. Для этой серии экспериментов был использован один донор.
- Подготовка образцов тканей кишечника
- Поместите собранные образцы кишечной ткани размером ~10 дюймов (25 см) в ~400 мл ледяного буфера для сбора (антибиотики/антимикотики PBS+) и положите на лед для транспортировки в лабораторию.
- С помощью хирургических ножниц (например, ножниц Майо) и щипцов (например, щипцов Адсона) удалите лишний жир и брыжейку из образца ткани кишечника.
- Разрежьте ткань на две равные части.
- Хирургическими ножницами вскрыть ткань в продольном направлении и промыть ткань в стерильном ПБС.
- Аккуратно удалите слой слизи образца кишечника с помощью предметного стекла стерильного стекла для микроскопа и промойте ткань свежим PBS.
ПРИМЕЧАНИЕ: Этот этап помогает удалить ворсинки и способствует повышению чистоты фракций крипты на последующих этапах. - Для каждого кусочка размером 5 дюймов (13 см) разрежьте ткань на две части по 2,5 дюйма (6,5 см), а затем разрежьте каждый кусок на 4 примерно равных маленьких кусочка, чтобы облегчить диссоциацию тканей.
- Диссоциация тканей кишечника
- Приготовьте объем 20 мл реагента для диссоциации ткани #1 в стерильной конической пробирке объемом 50 мл и поместите небольшие образцы тканей в коническую пробирку до тех пор, пока объемное смещение не переместит мениск с отметки 20 мл на отметку 35 мл на конической пробирке.
- Повторите описанный выше шаг для оставшихся кусочков образца ткани тонкой кишки.
- Запечатайте конические трубки парапленкой и вручную встряхните коническую трубку 10 раз.
ПРИМЕЧАНИЕ: На протяжении всего протокола ручное встряхивание должно выполняться обдуманно, но осторожно. - Поместите конические трубки горизонтально на лед в контейнере на орбитальной встряхивающей платформе.
- Встряхните конические трубки на льду в контейнере в течение 30 минут со скоростью 80 оборотов в минуту (об/мин). Каждые 10 минут вручную встряхивайте коническую трубку.
- Приготовьте 20 мл предварительно нагретого (37 °C) тканевого реагента для диссоциации #2 (формула, как указано выше, но без DTT) в конической пробирке объемом 50 мл. Поместите образцы тканей из конических пробирок, содержащих диссоциационный реагент #1, в конические пробирки, содержащие диссоциационный реагент #2.
- Запечатайте конические трубки парапленкой и вручную встряхните конические трубки 10 раз.
- Поместите конические пробирки на предварительно разогретую (37 °C) водяную баню для встряхивания, наклоненную под углом примерно 60 °C, и встряхивайте при 150 об/мин в течение 10 минут, с ручным встряхиванием через 5 минут и снова после общей 10-минутной инкубации.
- Изоляция фрагментов крипты
- Наклейте этикетку на 10 стерильных конических пробирок #1 - #10. Добавьте 20 мл стерильного ледяного PBS в каждую коническую пробирку с маркировкой.
- Переложите кусочки ткани из конических пробирок, содержащих реагент для диссоциации #2, в новую стерильную коническую пробирку объемом 50 мл, содержащую ледяной PBS #1.
- Вручную встряхните конические трубки 10 раз.
- Заклейте конические трубки парапленкой и положите их горизонтально на лед. Встряхивайте конические трубки на орбитальном шейкере в течение 10 мин при 80 об/мин. Через 10 минут вручную встряхните коническую трубку #1 10 раз. Это считается стиркой #1.
- Аккуратно перенесите образцы тканей с помощью хирургических щипцов в коническую трубку #2.
- Повторите шаги 2.3.2 - 2.3.4, это считается Wash #2.
- Повторяйте стирки до стирки #10.
- Надосадочная жидкость из каждой промывки содержит крипты, которые будут использоваться для генерации энтероидов. Держите пробирки с надосадочной жидкостью при температуре 4 °C до тех пор, пока не будут завершены все 10 стирок.
- После того, как10-я промывка будет завершена и срез ткани будет отброшен, центрифугируют надосадочную жидкость конических пробирок #6-#10 при 400 x g в течение 2 мин при 4 °C, чтобы гранулировать изолированные крипты.
ПРИМЕЧАНИЕ: Промывки 6-10 содержат самые чистые фракции неповрежденных склепов с ограниченным количеством мусора и одиночных ячеек. Таким образом, рекомендуется использовать только эти фракции для генерации энтероидов, а более ранние промывки (#2-#5) отбрасывать) - Выбросьте надосадочную жидкость и добавьте 4 мл свежего, ледяного ПБС в крипты, не подвергая их ресуспендированию (это помогает сохранить фрагменты нетронутыми до микроскопии).
- Оценивают чистоту диссоциированных крипт для каждой конической пробирки #6-#10 с помощью микроскопии.
- Добавьте 50 мкл PBS в 384-луночный планшет.
- Добавьте 10 мкл суспензии крипт в PBS и используйте объектив с 40-кратным увеличением, чтобы определить чистоту, целостность и количество крипт.
ПРИМЕЧАНИЕ: Рисование креста на нижней части пластины облегчает подсчет.
3. Генерация ex vivo и пассаж бычьих подвздошных энтероидов (рис. 2)
ПРИМЕЧАНИЕ: Крипты из конических пробирок с наиболее чистыми, неповрежденными кишечными криптами будут использоваться для последующих анализов. Для всех этапов, связанных с криптами и энтероидами, наконечники пипеток, скребки для клеток и пробирки должны быть предварительно покрыты буфером для покрытия, и следует избегать пузырьков, чтобы предотвратить потерю крипт. Если не указано иное, следует использовать наконечник для пипетки объемом 1000 мкл, чтобы предотвратить разрушение фрагментов крипты.
- Генерация энтероидов из фрагментов крипты
- Смешайте самые чистые фракции крипты (обычно #6-#10) в одну коническую трубку.
- Центрифугируют коническую пробирку, содержащую крипты, при 400 x g в течение 2 мин при 4 °C.
- Выбросьте надосадочную жидкость, аспирировав ее пипеткой, и повторно суспендируйте гранулу крипты в промывочной среде.
- Центрифуга, как показано на шаге 3.1.2. Сцедите надосадочную жидкость и добавьте 2 мл промывочного средства к грануле крипты.
- Подсчитайте количество крипт, как описано в шаге 2.3.11.1.
- Центрифугу, как показано на шаге 3.1.2, гранулируют крипты, отбрасывают надосадочную жидкость и повторно суспендируют во внеклеточном матриксе (BME) базальной мембраны (BME) с 100% сниженным фактором роста, чтобы достичь концентрации примерно 400 крипт/100 мкл.
ПРИМЕЧАНИЕ: важно правильно размораживать BME при 4 °C, так как изменения температуры изменяют его консистенцию. Преждевременное затвердевание BME можно предотвратить с помощью охлаждающего блока и предварительно охлажденных наконечников пипеток.- Использование другой рецептуры матрицы базальной мембраны может потребовать разбавления BME при создании куполов. Обратитесь к инструкциям производителя, относящимся к используемому BME.
- Пипетируйте вверх и вниз, чтобы полностью подвесить крипты в BME.
- Изготовьте купола crypt-BME, медленно пипетируя 50 мкл суспензии crypt-BME на 6-луночный планшет для культуры тканей на нагревательной пластине, установленной на 37 °C, до 8 куполов на лунку.
ПРИМЕЧАНИЕ: 6-луночная пластина должна быть предварительно прогрета в инкубаторе при 37 °C в течение ночи перед обшивкой куполов. - Держите планшет с 6 лунками на нагревательной пластине в течение 1 минуты, прежде чем осторожно переместить планшет в инкубатор с температурой 37 °C, 5%CO2 .
- Через 2 минуты переверните 6-луночную пластину так, чтобы крышка была обращена вниз, и инкубируйте еще 30 минут, чтобы купола полимеризовались.
- Через 30 мин осторожно добавьте 3 мл энтероидной питательной среды комнатной температуры (RT) с добавлением 10 мкМ SB202190, 0,5 мкМ LY2157299 и 10 мкМ Y-27632 в лунки, содержащие купола.
- Инкубируют при 37 °C, 5%СО2.
- Каждые 2-3 дня удаляйте среду и заменяйте ее свежей средой для роста энтероидов с добавлением ингибиторов.
- Пассаж энтероидов
- Через 7-10 дней убедитесь, что крипты сформировали 3D-энтероиды с множеством почковавшихся структур, как показано на рисунке 2E, и готовы к выходу.
- Выбросьте фильтрующий материал из колодцев, содержащих купола.
- На каждые 4 купола в лунке добавьте 1 мл ледяного раствора для неферментативной диссоциации клеток с добавлением 10 мкМ Y-27632 в каждую лунку, содержащую купола.
- С помощью скребка для клеток с предварительно нанесенным покрытием аккуратно отделите купол от планшета для культуры тканей.
- Соберите энтероиды в коническую пробирку объемом 15 мл и растирайте пипетками вверх и вниз 10 раз.
- Коническую пробирку, содержащую фрагментированные энтероиды, инкубируют при РТ на орбитальном шейкере при 80 об/мин в течение 10 мин.
- Добавьте к энтероидам 10 мл ледяной промывочной среды с 10 мкМ Y-27632.
- Центрифугируйте коническую пробирку при 300 x g в течение 5 мин при RT.
- Выбросьте надосадочную жидкость и повторно суспендируйте гранулу в 10 мл свежей промывочной среды и перелейте в новую коническую пробирку объемом 15 мл.
- Центрифугируйте коническую пробирку при 300 x g в течение 5 мин при RT.
- Выбросьте надосадочную жидкость и повторно суспендируйте гранулу в 1 мл энтероидной питательной среды в пробирке микроцентрифуги объемом 1,5 мл.
- Центрифугу микроцентрифужной пробирки при 300 x g в течение 5 мин при RT и выбросьте надосадочную жидкость.
- Ресуспендируйте энтероидную гранулу в ледяной 100% BME и выполните шаги 3.1.6-3.1.13.
- Репассаж энтероидов каждые 7 дней. Время расширения может варьироваться в зависимости от плотности, жизнеспособности и степени бутонизации. Множественные зарождающиеся структуры, создающие большие энтероидные структуры, указывают на то, что энтероиды нуждаются в прохождении.
- Криоконсервация энтероидов
- Для криоконсервации убедитесь, что энтероиды пассируют в культуре не более пяти раз.
ПРИМЕЧАНИЕ: Это не было проверено экспериментально и основано на наблюдении авторов о том, что более поздние пассажи снижают жизнеспособность и дают переменные результаты. - Для сбора энтероидов используйте буфер диссоциации, как описано в шагах 3.2.2-3.2.9.
ПРИМЕЧАНИЕ: Механически диссоциируют энтероиды с помощью пипетки объемом 5 мл. - Подсчитайте количество энтероидных фрагментов, как описано в шаге 2.3.11.1.
- Центрифугируйте коническую пробирку при 300 x g в течение 5 мин при RT.
- Выбросьте надосадочную жидкость и повторно суспендируйте энтероидные фрагменты в криоконсервационной среде с добавлением 10 мкМ Y-27632 для достижения концентрации ~2000 энтероидных фрагментов/мл и аликвоты 1 мл в предварительно меченных криовиалах.
- Поместите криовиалы в контейнер с контролируемой заморозкой и храните при температуре -80 °C в течение ночи.
- Переведите криовиалы в жидкий азот в паровой фазе для длительного хранения.
- Для криоконсервации убедитесь, что энтероиды пассируют в культуре не более пяти раз.
- Реанимация фрагментов кишечных крипт
- Поместите 6-луночную тарелку на ночь внутрь инкубатора.
- Предварительно покройте пробирку объемом 5 мл 5 мл средства для покрытия.
- Извлеките криовиалы из хранилища жидкого азота.
- Сразу после размораживания перенесите крипты из криовиальной пробирки в предварительно покрытую пробирку объемом 5 мл. Промойте криовиал промывочным средством и добавьте в пробирку объемом 5 мл. Избегайте пузырей.
- Доведите объем до 5 мл с помощью промывочной среды и центрифуги при 400 x g в течение 5 минут при 4 °C.
- Во время центрифугирования предварительно покрыте пробирку объемом 1,5 мл средой для покрытия.
- После центрифугирования слейте надосадочную жидкость, повторно суспендируйте гранулу в среде, оставшейся в пробирке, и переложите в предварительно покрытую пробирку объемом 1,5 мл. Промойте пробирку объемом 5 мл средством для промывки и перелейте ее в пробирку объемом 1,5 мл. Центрифуга при 400 x g в течение 5 мин при 4 °C.
- Доведите объем до 1,5 мл с помощью питательной среды для энтероидов.
- Центрифугу, как описано выше (шаг 3.4.7), и осторожно аспирируйте.
- Возьмите BME от 4 °C и положите на лед/ледяную глыбу.
- Ресуспендируйте энтероидную гранулу в ледяном 100% BME и выполните шаги 3.1.6-3.1.12.
- Меняйте носитель каждые 2-3 дня.
4. Генерация и оценка 2D монослоев из 3D энтероидов
ПРИМЕЧАНИЕ: Как и выше, на всех этапах, связанных с криптами и энтероидами, наконечники пипеток, скребки для клеток и пробирки должны быть предварительно покрыты буфером для покрытия, и следует избегать пузырьков, чтобы предотвратить потерю крипт.
- Подготовка трансвеллерных вставок для формирования 2D монослоя
- Поместите вкладыши в 24-луночный адаптер для тканевой культуры и предварительно покройте апикальную сторону 24-луночных вставок для клеточных культур ПЭТ размером 1 мкм 100 мкл разведения 1:15 BME в энтероидной питательной среде. Всегда наносите дополнительную вставку, которая будет использоваться в качестве контрольной при измерении целостности барьера.
- Поместите вкладыш с покрытием в 24-луночный планшет-адаптер для тканевой культуры в инкубаторе.
ПРИМЕЧАНИЕ: С трансвелл-вставками необходимо использовать специальный адаптер или планшет-компаньон для культуры тканей. - Инкубируйте культуральные вставки при 37 °C, 5% CO2 в течение 1 ч для полимеризации.
ПРИМЕЧАНИЕ: Прозрачники с покрытием BME можно загерметизировать парапленкой и хранить при температуре 4 °C до 1 недели, если они не используются немедленно. - По окончании инкубации аспирируют 3D энтероидную питательную среду.
- Диссоциация 3D энтероидов
- Генерация 2D-энтероидных монослоев из криоконсервированных энтероидных фрагментов, которые были реанимированы, покрыты и культивированы, как описано выше в разделе 3.1, для формирования 3D-энтероидов. Оттопленные энтероиды проводят не менее двух раз, при этом последний пассаж культивируют не менее 5 дней перед обработкой для получения 2D-монослойных культур.
- Соберите энтероиды, добавив ледяную промывочную среду с добавлением 10 мкМ Y-27632 в купола энтероидов (используйте примерно 1 мл диссоциационного буфера для 4 куполов)
- Отсоедините купола скребком для ячеек и соберите их в коническую пробирку объемом 15 мл.
- Тритурируйте 30 раз с помощью наконечника пипетки объемом 1 мл для получения энтероидных фрагментов.
- Тритурируйте 40 раз наконечником пипетки на 200 мкл для дальнейшего разрушения фрагментов энтероидов.
- Доведите объем конической пробирки объемом 15 мл с фрагментами энтероидов до 10 мл с помощью ледяной промывочной среды.
- Центрифугируйте коническую пробирку при 300 x g в течение 5 мин при RT.
- Аспирируйте надосадочную жидкость, включая слой BME, стараясь не повредить энтероидную гранулу.
ПРИМЕЧАНИЕ: Слой BME будет выглядеть как мутный желатиновый слой прямо над гранулой. - На каждые 4 купола повторно суспендируйте гранулу в 1 мл предварительно подогретого экспресс-фермента TrypLE с добавлением 10 мкМ Y-27632.
- Добавьте смесь энтероида и трипЛЭ в 24-луночный планшет и инкубируйте при 37 °C, 5% CO2 в течение 10 мин.
- Через 10 мин процедите смесь энтероидов и трипЛЭ 40 раз с помощью пипетки объемом 1 мл для дальнейшего фрагментирования энтероидов.
- Затем пипетку 40 раз профилируют пипеткой на 200 мкл, чтобы разбить фрагменты на отдельные клетки.
- Используя шприц объемом 3 мл или 5 мл с прикрепленной стерильной иглой 22-G, аспирируйте и дозируйте клеточную суспензию 4 раза, чтобы получить одноклеточную суспензию.
- Контролируйте диссоциацию клеток с помощью микроскопии, как описано в шаге 2.3.11.1, до тех пор, пока 80% энтероидов не будут расщеплены на отдельные клетки.
- Соберите клеточную суспензию в коническую пробирку объемом 15 мл и погасите ферментативную реакцию, добавив 4-кратный объем промывочной среды с добавлением 10% FBS.
- Дважды отфильтруйте энтероиды через предварительно покрытое ситечко с 40 мкм в коническую пробирку объемом 50 мл.
- Гранулируйте отдельные ячейки, центрифугируя коническую пробирку при 300 x g в течение 5 минут.
- 2D однослойный посев на трансвеллерных вставках.
- Декантируют надосадочную жидкость и ресуспендируют гранулу в небольшом объеме (~600 мкл) органоидной питательной среды, дополненной 20% фетальной бычьей сывороткой (FBS) при ОТ.
- Определите плотность и жизнеспособность энтероидных клеток с помощью метода исключения красителя Trypan Blue, гемацитометра или автоматического счетчика клеток. Средняя жизнеспособность ожидается на уровне 75%.
- Осторожно удалите излишки раствора покрытия, нанесенного на шаге 1.3, с вкладыша для клеточных культур непосредственно перед посевом клеток.
- Высевают одиночные клетки по 1 x 105 клеток в объеме 200 мкл на вставку на апикальную поверхность предварительно покрытой клеточной культуры.
- Добавьте 700 мкл полной среды с добавлением 20% FBS на базолатеральную сторону вставки для клеточной культуры.
- Переместите пластину 10 раз в форме цифры 8, чтобы ячейки равномерно распределились по вставке.
- Держите тарелку на тарелке в теплом месте в течение 10 минут в шкафу биобезопасности.
- Инкубируйте планшет при температуре 37 °C и 5% CO2.
- Через 48 ч замените питательную среду на апикальном и базальном компартментах свежей питательной средой для энтероидов с добавлением 20% FBS и ингибиторов.
- На третий день удалите среду из апикального и базолатерального отделов, тщательно промойте вкладыш 1x PBS и замените его средой для дифференцировки энтероидов, дополненной только ингибиторами.
- Меняйте носители в обоих отсеках каждые 2-3 дня.
- Количественное измерение целостности эпителиального барьера и слияния монослоев
ПРИМЕЧАНИЕ: Целостность барьера может быть оценена с помощью эпителиального вольтомметра для измерения трансэпителиального электрического сопротивления (TEER).- Извлеките планшет для культуры из инкубатора и дайте ей уравновеситься при RT в течение нескольких минут в шкафу биобезопасности.
- Убедитесь, что электроды STX2 были предварительно подготовлены, а вольтомметр откалиброван до 1000 Ом в соответствии с инструкциями производителя.
- Введите длинную палочку зонда в базолатеральный отдел, а короткий конец в апикальный отсек культуры эпителиальных клеток трансвелла. Следите за тем, чтобы не нарушить монослой и не повредить пластину.
- После стабилизации запишите 3 измерения TEER на каждую вставку Transwell, включая вставку без ячеек. Сделайте среднее значение измерений для каждой пластины.
- Рассчитайте скорректированное значение TEER, вычитая среднее измерение пустой лунки из средних измерений экспериментальных лунок и затем умножая его на площадь поверхности вставки для определения сопротивления эпителиального барьера (TEER [Ω.см2] = [Rcell layer - Rblank] × Area).
Representative Results
Первым шагом в создании 2D-монослоев, полученных из энтероидов, является подготовка участка ткани кишечника (рис. 1А) к диссоциации тканей. Это делается путем удаления прикрепленного жира и брыжейки из ткани (рис. 1B) с последующим разрезанием ткани в продольном направлении, чтобы обнажить поверхность просвета, чтобы слой слизи кишечника можно было удалить путем осторожного соскабливания с помощью предметного стекла. Затем собранный срез кишечника разрезают на постепенно более мелкие участки ткани (рис. 1C), чтобы облегчить диссоциацию. Затем крипты диссоциируют от подлежащей подслизистой ткани с помощью серии промывок, состоящих из хелатных буферов (рис. 1D, E) и PBS. Изолированные кишечные крипты (рис. 1F) затем встраивают в матричные купола базальной мембраны (рис. 2A) и культивируют в течение нескольких дней для получения 3D-энтероидов. Из 10-дюймового участка подвздошной кишки крупного рогатого скота можно выделить около 900 000 крипт и использовать их для формирования энтероидов. Уже через несколько часов в культуре покрытые пластинами крипты начинают удлиняться и превращаться в энтеросферы (рис. 2B). Через 2 дня можно наблюдать четко выраженный просвет (рис. 2C), а почкование структур отмечается уже на 4-й день в культуре (рис. 2D). К 7-му дню развиваются зрелые энтероиды (рис. 2E). Иммунофлуоресцентное окрашивание 7-дневного 3D-энтероида демонстрирует наличие различных клеточных линий. Конфокальная микроскопия энтероидов демонстрирует локализацию ядерного окрашивания DAPI, белка Е-кадгерина в адгезивном соединении, окрашивание хромогранином-А (Chr-A) с присутствием энтероэндокринных клеток, лизоцима (LYZ), демонстрирующего клетки Панета, и цитокератина-18 (CK-18), представляющего клетки энтероцитов на рисунке 3. После 7-10 дней в культуре энтероиды следует пассировать, чтобы обеспечить дальнейшее расширение и предотвратить скученность. Было определено, что оптимальное время пассажа энтероидов составляет 7-10 дней после первичной изоляции крипты и в конечном итоге зависит от здоровья и скорости роста энтероидов в культуре. Оптимальная плотность посева для достижения желаемой морфологии и жизнеспособности энтероидов, как показано на рисунке 2E, составляет 400 крипт на купол. Энтероиды легко поддаются криоконсервации, а размороженные фрагменты энтероидов полностью восстанавливаются для экспериментального использования после двух пассажей после оттаивания. Примечательно, что перед криоконсервацией рекомендуется, по крайней мере, два пассажа первичной культуры крипты.
Для получения монослоя, полученного из 2D-энтероидов, 3D-энтероиды собирают и в течение ряда этапов механически растирают в присутствии раствора диссоциации (рис. 4A) на отдельные клетки. Затем эти одиночные клетки могут быть высеяны на трансвелл-вкладыш, предварительно покрытый раствором матриксной питательной среды базальной мембраны. В среднем, четыре трансвелла могут быть засеяны из четырех 3D-куполов энтероида. Таким образом, количество обработанных 3D-энтероидов зависит от количества трансвеллов, необходимых для эксперимента. Покрытие одиночных клеток при плотности посева 1 x 10,5 и их первоначальное культивирование в присутствии 20% FBS (рис. 4B-D) позволяет создать сливающийся монослой менее чем за 1 неделю. Прогрессирующее слияние 2D-монослоя в культуре можно отслеживать с течением времени с помощью световой микроскопии (рис. 4E, F). Измерения трансэпителиального электрического сопротивления (TEER) могут подтвердить слияние и охарактеризовать целостность эпителиального барьера с течением времени и в ответ на экспериментальную стимуляцию (рис. 5A). В среднем, после семи дней культивирования примерно 100% сливающийся монослой будет иметь соответствующее значение TEER ~1500 Ω·см2. Лонгитюдная оценка значений TEER 2D энтероидного монослоя демонстрирует устойчивый рост значений TEER в течение семи дней, достигая максимального среднего значения 1546 Ω·см2, а затем снижаясь с самым низким значением 11,5 Ω·см2, полученным на двенадцатый день (рис. 5B). Иммунофлуоресцентное мечение дифференцированных монослоев свидетельствует о том, что по этому протоколу формируются интактные, организованные, поляризованные эпителиальные листы кишечника (рис. 6). Конфокальная микроскопия окрашенного 2D-монослоя демонстрирует локализацию окраски ядерным DAPI, E-кадгерином и F-актином (рис. 6A-D). Флуоресцентная микроскопия 2D-монослоя показывает признаки дифференцированных клеток кишечного эпителия с окрашиванием хромогранином-А (Chr-A), демонстрирующим наличие энтероэндокринных клеток, лизоцимом (LYZ), демонстрирующим клетки Панета, и цитокератином-18 (CK-18), указывающим на клеточные линии энтероцитов (рис. 6E-L). Моделирование Z-стека показывает ожидаемую поляризацию 2D монослойной культуры с характерным отложением F-актина, который обнаруживается в микроворсинках, покрывающих апикальную сторону дифференцированных энтероцитов, и Е-кадгерина, белка, расположенного в адгезивных соединениях, расположенных между эпителиальными клетками (рис. 6M).
Функциональность монослоя может быть оценена путем апикальной стимуляции различными компонентами, включая лиганды Toll-подобных рецепторов (TLR) или патогены, с последующим количественным определением цитокинов надосадочных продуктов клеточных культур, полученных из апикальных и базальных компартментов. Действительно, при стимуляции апикального аспекта монослоя в течение 24 ч агонистом TLR 1/2 Pam3csk4 на 4-й день культивирования наблюдается повышенная продукция цитокинов в обоих компартментах по сравнению с необработанными монослоями (рис. 7A, B).
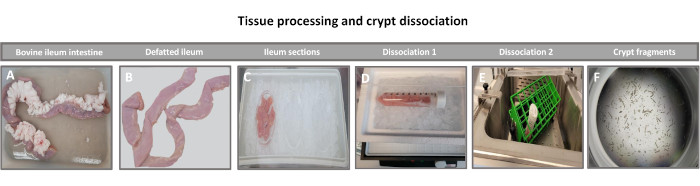
Рисунок 1: Выделение крипты кишечника крупного рогатого скота от здорового взрослого крупного рогатого скота. Изображения, иллюстрирующие обработку тканей (A) цельной подвзрослой подвздошной кишки крупного рогатого скота, (B) обезжиренной подвздошной кишки, (C) подвздошной кишки, разрезанной на кусочки размером 2,5 дюйма (6,3 см) в PBS на льду, (D) срезов подвздошной ткани в диссоциационном буфере #1 при 4 °C, и (E) в диссоциационном буфере 2 во встряхивающей водяной бане при 37 °C, и (F) изолированных фрагментов подвздошной крипты. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
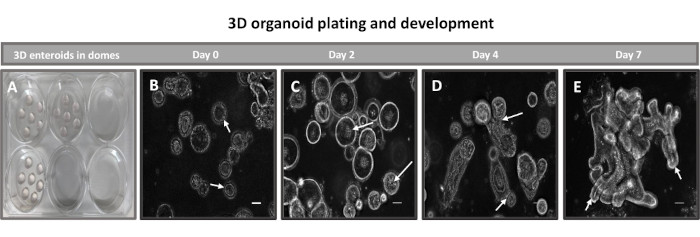
Рисунок 2: Развитие первичного 3D подвздошного энтероида крупного рогатого скота в матрице базальной мембраны. Репрезентативные изображения (A) 3D-купола энтероида, созданного в 6-луночном планшете для культивирования тканей, и (B-E) 3D-развития энтероидов на 0, 2, 4 и 7-й дни культивирования. Масштабная линейка = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
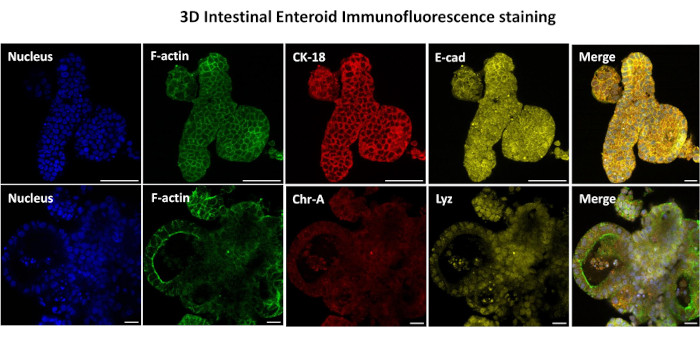
Рисунок 3: Трехмерные кишечные энтероиды показывают окрашивание эпителиальных клеток. Репрезентативные изображения 3D-энтероидов через 7 дней в культуре демонстрируют наличие ядерного окрашивания, F-актина, цитокератина-18 (CK-18), хромогранина-А (Chr-A), экадгерина (E-cad), лизоцима (Lyz) и наложения изображений (Merge). Масштабная линейка 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
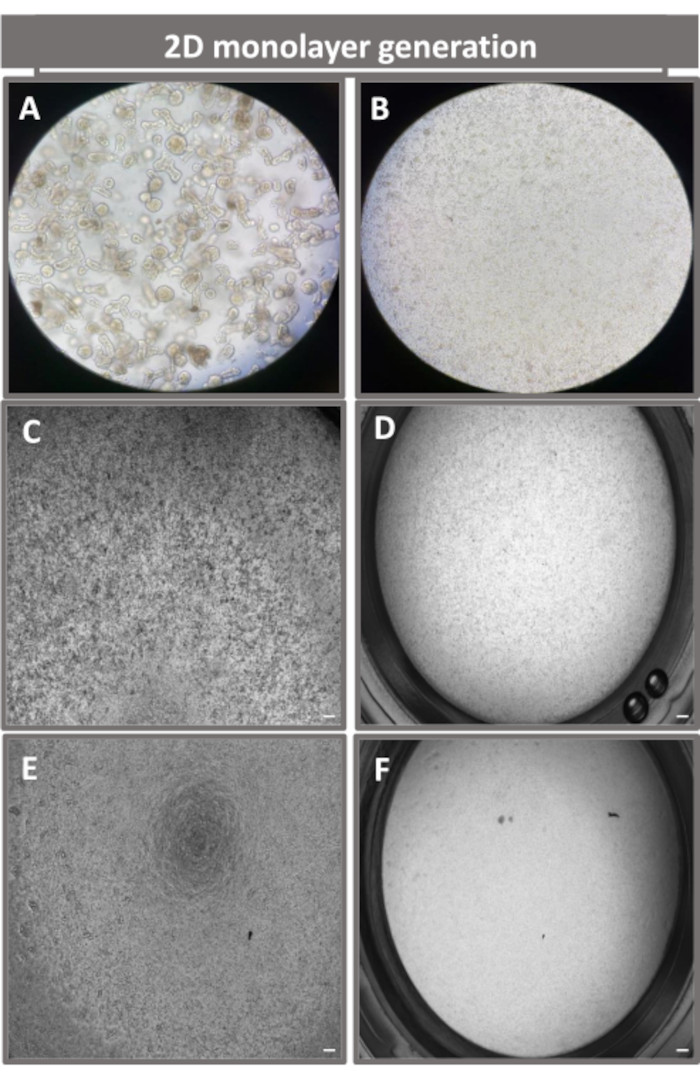
Рисунок 4: Создание 2D монослоя, полученного из энтероидов подвздошной кишки. Репрезентативные изображения (A) 3D-фрагментов энтероидов в диссоциационном растворе при подготовке к монослойному посеву, одиночных клеток, нанесенных на транслунжерную вставку с плотностью затравки 1 x 10,5, полученные на 0-й день с использованием (B) света, (C) фазового контраста и (D) яркой полевой микроскопии, а также развития монослоя на трансвелловых вставках, полученных на пятый день с использованием фазового контраста (E) и (F)) светлопольная микроскопия. 40-кратное увеличение и масштабная линейка = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
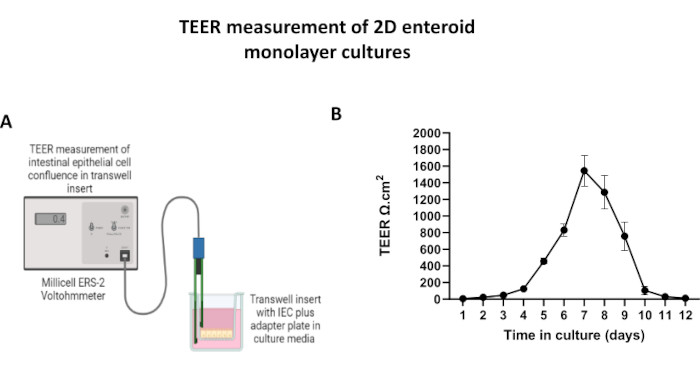
Рисунок 5: Измерения трансэпителиального электрического сопротивления (TEER) 2D-монослоя, полученного из энтероидов, на вставках трансвелла. (A) Принципиальная диаграмма того, как TEER измерения монослоя кишечных эпителиальных клеток (IEC) получены с помощью электродов STX2 из палочек для еды вольтомметра, (B) Продольный мониторинг 2D измерений монослоя TEER в течение 12 дней в клеточной культуре. Каждая точка данных представляет собой среднее значение TEER и стандартную ошибку среднего значения (SEM), полученные из двух технических реплик. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
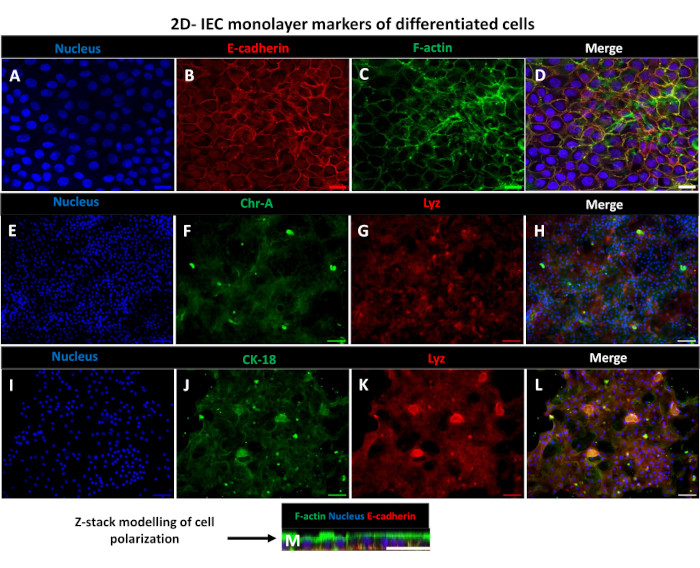
Рисунок 6:Дифференцированные 2D монослои, полученные из энтероидов, на трансвелл-вставках превращаются в поляризованные эпителиальные пластинки кишечника. (А-М) Репрезентативные иммунофлуоресцентные изображения 2D-монослоя, полученного из энтероидов, на трансвелл-вставке через 5 дней в культуре, показывающие (A) ядро (синий), (B) E-кадгерин (красный), (C) F-актин (зеленый) и (D) наложение 3 изображений (слияние), (E, I) ядерное окрашивание, (F) хромогранин-A, (J) цитокератин-18, (G,K) лизоцим и (H,L) слияние изображений. (M) Моделирование Z-стека, показывающее распределение одних и тех же белков-маркеров эпителиальных клеток 2D-монослойного листа. Изображения были получены с 2 биологических репликатов. Масштабная линейка = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
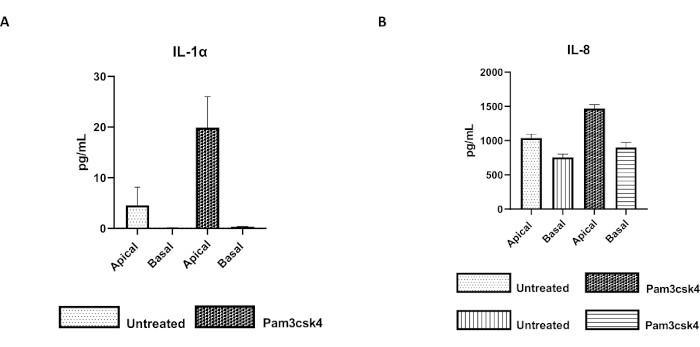
Рисунок 7: Первичные 2D-монослои, полученные из энтероидов крупного рогатого скота, на трансвеллерных вставках функционально активны. Секреция супернатантных цитокинов апикальной и базальной культуры клеток (A) IL-1α и (B) IL-8 2D монослоями на трансвелл-вставках через 5 дней в культуре, которая не лечилась или стимулировалась Pam3csk4 в течение 24 ч. Данные репрезентативны для средних уровней цитокинов и SEM из монослоев, полученных из замороженных запасов крипт от одного животного и трех независимых экспериментов. Цитокины количественно определяли с помощью мультиплексного анализа на основе шариков (Таблица материалов) в соответствии с инструкциями производителя и анализировали на компактном блоке мультиплексирования (Таблица материалов) и программном обеспечении для подгонки кривой иммуноанализа (Таблица материалов). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Таблица 1: Запасы и конечные концентрации реагентов. Пожалуйста, нажмите здесь, чтобы скачать таблицу.
Discussion
Представленный здесь протокол описывает физиологически релевантную модель для исследования физиологии кишечника и кишечных расстройств. Несколько исследовательских групп описали генерацию бычьих энтероидных культур, включая 2D монослои 16,19,20,21,22,23,24. Несмотря на то, что генерация монослоев не является технически сложной задачей, несколько минимальных шагов имеют решающее значение для последовательного развития успешных культур. Таким образом, воспроизводимость 2D-монослоев с использованием кратко описанных в опубликованной литературе методов может быть сложной задачей для исследователя, начинающего изучать органоиды. Протокол, описанный в настоящем документе, адаптирован из этих протоколов и протоколов, опубликованных в других видах, и представляет собой пошаговое руководство по созданию монослоя на трансвелловых вставках, которое отличается высокой воспроизводимостью.
Протокол, изложенный в настоящем документе, может быть легко изменен в соответствии с конкретными целями плана эксперимента или доступностью реагентов. Действительно, следуя этому протоколу, успешные культуры могут быть достигнуты путем посева монослоев при более низкой плотности клеток (например, 2,5 x 104) или при отсутствии FBS, как описано в других публикациях24. Однако для изменения этих параметров может потребоваться увеличение культивирования для создания сливающегося монослоя. Таким образом, если другие факторы, неотъемлемые от дизайна исследования, в том числе совместное культивирование с иммунными клетками, диктуют конкретный временной ход для эксперимента, плотность посева может быть изменена по мере необходимости. Несмотря на то, что другие составы базальных мембран могут быть заменены на те, которые используются в этом протоколе для генерации 3D-энтероидов и 2D-монослоев, они потребуют некоторой оптимизации для определения оптимального соотношения базальной мембраны к среде.
Применение трансвелл-вставок в описанной методике имеет много преимуществ по сравнению с монослойным выращиванием на обычной пластиковой посуде и 3D-энтероидных культурах. По сравнению со стандартными тканевыми культуральными планшетами, использование трансвеллов для монослойных культур способствует клеточной дифференцировке и организации таким образом, что сохраняет сходство с кишечными криптами14,25. Эпителиальный барьер кишечника жизненно важен для предотвращения транслокации токсинов и микроорганизмов в организм, одновременно облегчая всасывание питательных веществ. Таким образом, очень важно понимать, как барьерная целостность кишечника функционирует у здоровых людей и как она изменяется при кишечных расстройствах или в ответ на соединения. В отличие от 3D-энтероидных культур, объективная оценка целостности кишечного барьера возможна при совмещении монослоев на трансвеллах и измерении TEER, как показано в настоящемдокументе 14,25. Генерация 2D-монослоев на трансвеллах также позволяет проводить двойную культуру с соответствующими типами клеток, такими как иммунные или стромальные клетки. Это позволяет охарактеризовать критически важные перекрестные помехи между клетками кишечника и клетками тканевого микроокружения, чего невозможно достичь с помощью 3D-культур. Обнажение апикальной поверхности монослоя позволяет не только экспериментально контактировать с патогенами и соединениями и собирать продукты просвета, но и позволяет изучать другие аспекты физиологии и заболеваний кишечника, включая изучение микробиоты кишечника и физиологии молекулярного всасывания или транспорта13. Независимый контроль над апикальной и базальной поверхностями кишечника является неоспоримым преимуществом перед 3D моделями энтероидов.
Проведя несколько пробных экспериментов, мы определили ключевые шаги, которые способствовали успеху протокола. В то время как образцы цельной кишечной ткани можно хранить в холодильнике в течение ночи и обрабатывать на следующий день, этапы диссоциации тканей и изоляции фрагментов крипт должны быть выполнены быстро, чтобы предотвратить распад изолированных фракций крипты. После завершения промывки PBS центрифугирование крипт в промывочной среде может помочь предотвратить разрушение крипты, как описано в шаге 2.3.10. При прохождении энтероидов или их сборе для формирования монослоя важно отделить энтероиды от куполов BME. Промывочный материал должен быть ледяным, чтобы помочь растворить BME. Напротив, использование предварительно нагретого трипЛЭ и двойная фильтрация клеточной суспензии может помочь сформировать одиночные клетки, необходимые для образования монослоя. Наконец, ручное перемещение пластины в форме цифры 8 может помочь равномерно распределить отдельные ячейки по трансвелл-вставке.
Важным ограничением этого протокола является то, что 2D-монослои были получены из энтероидных пород, полученных от зрелого бычка голштинской породы (>2 года). Созревание желудочно-кишечного тракта у телят может потребовать незначительных изменений в описанном протоколе для получения оптимальных результатов. Породоспецифические различия в физиологии кишечника пород крупного рогатого скота описаны в литературе26. Хотя неизвестно, могут ли эти различия повлиять на энтероиды и последующее образование монослоев, мы подозреваем, что любые различия приведут лишь к незначительным изменениям в нашем протоколе. Кроме того, 2D-модель культуры имеет ряд недостатков. По сравнению с 3D-моделями энтероидов, в 2D-культурах могут отсутствовать некоторые аспекты архитектуры кишечной ткани и клеточного разнообразия, что создает ограничения и проблемы, связанные с распространением 2D-культуры13. Тем не менее, исследования показывают, что некоторые монослои могут эмулировать ожидаемую организацию крипт27, а некоторые из этих ограничений могут быть даже преодолены путем создания 2D-культур с интерфейсом воздух-жидкость. Тем не менее, ограничения этой модели должны быть полностью учтены, чтобы определить, подходит ли ее применение для задаваемого экспериментального вопроса.
Этот протокол описывает оптимизированную систему культивирования, которая моделирует желудочно-кишечный тракт крупного рогатого скота с использованием энтероидов, полученных из подвздошной кишки крупного рогатого скота, для формирования монослоев на трансвелл-вкладышах. Обладая широким спектром применений от исследований инфекционных заболеваний до разработки лекарств и регенеративной медицины, эта высокопроизводительная система культивирования может привести к беспрецедентной разработке профилактических и терапевтических стратегий, которые могут быть взаимовыгодными для здоровья животных и человека.
Disclosures
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Acknowledgements
Мы выражаем признательность за использование Центра клеточного и молекулярного ядра в Университете Среднего Запада.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 mL pipette tip | MidSci | PR-200RK-S | |
| 1 µm PET 24-well cell culture inserts | Corning | 353104 | |
| 1000 mL pipette tip | MidSci | PR-1250RK-S | |
| 22 G needle | Becton, Dickinson and Company | 305156 | |
| 24-well culture vessel | Corning | 353504 | |
| 40 μm cell strainer | Corning | 431750 | |
| 50 mL centrifuge tube | Fisher scientific | 14-955-240 | |
| 5-mL pipet tip | Fisher scientific | 30075307 | |
| 5 mL syringe | Becton, Dickinson and Company | 309647 | |
| 5 mL tube | Eppendorf | 30119401 | |
| Anti-Cytokeratin -18 (C-04) | Abcam | AB668-1001 | |
| B-27 supplement without vitamin A | Gibco | 12-587-010 | |
| Belysa software | Luminex | 40-122 | Immunoassay curve fitting software |
| Bovine serum albumin (BSA) | Fisher bioreagents | BP9704-100 | |
| Caspofungin acetate | Selleckchem | S3073 | |
| Cell lifter | Fisher Scientific | 08-100-241 | |
| Chromogranin-A (E-5) | Santa Cruz Biotechnology | SC-271738 | |
| Coverslips | Fisher scientific | 12-540-C | |
| Cryovials | Neptune scientific | 3471.X | |
| Cultrex Ultimatrix RGF BME | R&D Systems | BME001-05 | |
| DAPI | MilliporeSigma | D9542-5MG | |
| Dissecting scissors | VWR | 82027-588 | |
| Dithiothreitol (DTT) solution | Thermo Scientific | FERR0861 | |
| DMEM/ F-12 1.1 medium (with L-glutamine, without HEPES) | Cytiva | SH30271.01 | |
| E-cadherin | Cell Signaling Technology | #3195 | |
| Ethylenediaminetetraacetic acid | Fisher Scientific | BP2482500 | |
| FBS | Corning | MT35070CV | |
| Gentamicin | Gibco | 15710064 | |
| Glass microscope slide | Fisher scientific | 12-550-07 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11001 | |
| Goat anti-mouse Alexa Fluor 647 | Invitrogen | A21235 | |
| Goat anti-rabbit Alexa Fluor 555 | Invitrogen | A21428 | |
| Hemacytometer | Bio-Rad | 1450015 | |
| IntestiCult organoid Differentiation medium (Human) | StemCell Technologies | 100-0214 | |
| IntestiCult organoid growth medium (Human) | StemCell Technologies | 0-6010 | |
| Keyence BZ-X700 | Keyence | BZ-X700 | |
| LY2157299 (Galunisertib) | Selleckchem | S2230 | |
| MAGPIX system | Luminex | Magpix system | Compact multiplexing unit |
| Microscope | Keyence | BZ-X700 | |
| MILLIPLEX Bovine Cytokine/Chemokine Magnetic Bead Panel | MilliporeSigma | BCYT1-33K | Bead-based multiplex assay |
| Mr. Frosty container | Nalgene | 5100-0001 | |
| Non-Enzymatic Cell Dissociation Solution | ATCC | 30-2103 | |
| NutriFreeze D10 Cryopreservation Media | Biological Industries | 05-713-1B | |
| Orbital shaking platform | Thermo Fisher | 88880021 | |
| Pam3Csk4 | invivogen | tlrl-pms | |
| Parafilm sealing film | dot scientific inc. | #HS234526C | |
| Paraformaldehyde 16% solution | Electron Microscopy Sciences | 15710 | |
| Phalloidin-FITC | R&D Systems | 5782/12U | |
| Phosphate buffered saline | Fisher Scientific | BP399-20 | |
| Prolong Glass Antifade | Invitrogen | P36982 | |
| Rabbit anti-human Lyzozyme (EC3.2.1.17) | Agilent technologies | A009902-2 | |
| SB202190 (FHPI) | Selleckchem | S1077 | |
| Shaking water bath | Thermo Fisher | MaxQ 7000 | |
| Sodium Azide | VWR | BDH7465-2 | |
| Streptomycin | Teknova | S6525 | |
| Trypan Blue dye | Gibco | 15250-061 | |
| TrypLE express enzyme | Life technologies | 12604013 | |
| Tween 20 | Fisher Scientific | BP337 | |
| Voltohmmeter | MilliporeSigma | Millicell ERS-2 | |
| Y-27632 | Selleckchem | S1049 |
References
- Gerdts, V., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Reza Khorramizadeh, M., Saadat, F. Animal models for human disease. Animal Biotechnology. Chapter 8, 153-171 (2020).
- Meyerholz, D. K., Beck, A. P., Singh, B. Innovative use of animal models to advance scientific research. Cell and Tissue Research. 380 (2), 205-206 (2020).
- Hamernik, D. L. Farm animals are important biomedical models. Animal Frontiers. 9 (3), (2019).
- Ribitsch, I., et al. Large animal models in regenerative medicine and tissue engineering: To do or not to do. Frontiers in Bioengineering and Biotechnology. 8, 972 (2020).
- Wagar, L. E., DiFazio, R. M., Davis, M. M. Advanced model systems and tools for basic and translational human immunology. Genome Medicine. 10 (1), 73 (2018).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Roth, J. A., Tuggle, C. K. Livestock models in translational medicine. ILAR Journal. 56 (1), 1-6 (2015).
- Schultz, R. D., Dunne, H. W., Heist, C. E. Ontogeny of the bovine immune response. Infection and Immunity. 7 (6), 981-991 (1973).
- Potter, A. A., et al. Large animal models for vaccine development and testing. ILAR Journal. 56 (1), 53-62 (2015).
- Ahluwalia, B., Magnusson, M. K., Öhman, L. Mucosal immune system of the gastrointestinal tract: maintaining balance between the good and the bad. Scandinavian Journal of Gastroenterology. 52 (11), 1185-1193 (2017).
- Roodsant, T., et al. A human 2D primary organoid-derived epithelial monolayer model to Study host-pathogen interaction in the small intestine. Frontiers in Cellular and Infection Microbiology. 10, 272 (2020).
- Liu, Y., Chen, Y. G. 2D- and 3D-based intestinal stem cell cultures for personalized medicine. Cells. 7 (12), 225 (2018).
- Duque-Correa, M. A., Maizels, R. M., Grencis, R. K., Berriman, M. Organoids - New models for host-helminth interactions. Trends in Parasitology. 36 (2), 170-181 (2020).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 43 (2021).
- Hamilton, C. A., et al. Development of in vitro enteroids derived from bovine small intestinal crypts. Veterinary Research. 49 (1), 54 (2018).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33 (2021).
- Lee, B. R., et al. Robust three-dimensional (3D) expansion of bovine intestinal organoids: An in vitro model as a potential alternative to an in vivo system. Animals (Basel). 11 (7), 2115 (2021).
- Töpfer, E., et al. Bovine colon organoids: From 3D bioprinting to cryopreserved multi-well screening platforms. Toxicology in Vitro. 61, 104606 (2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Rusu, D., Loret, S., Peulen, O., Mainil, J., Dandrifosse, G. Immunochemical, biomolecular and biochemical characterization of bovine epithelial intestinal primocultures. BMC Cell Biology. 6, 42 (2005).
- Dibb-Fuller, M. P., Best, A., Stagg, D. A., Cooley, W. A., Woodward, M. J. An in-vitro model for studying the interaction of Escherichia coli O157:H7 and other enteropathogens with bovine primary cell cultures. Journal of Medical Microbiology. 50 (9), 759-769 (2001).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15 (2022).
- Barrila, J., et al. Modeling host-pathogen interactions in the context of the microenvironment: Three-dimensional cell culture comes of age. Infection and Immunity. 86 (11), e00282-e00318 (2018).
- Carvalho, P. H. V., Pinto, A. C. J., Millen, D. D., Felix, T. L. Effect of cattle breed and basal diet on digestibility, rumen bacterial communities, and eating and rumination activity. Journal of Animal Science. 98 (5), skaa114 (2020).
- Thorne, C. A., et al. Enteroid monolayers reveal an autonomous WNT and BMP circuit controlling intestinal epithelial growth and organization. Developmental Cell. 44 (5), 624-633 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved