Coltivazione di organoidi di glioma derivati da pazienti ex vivo utilizzando un tritatutto di tessuti
In This Article
Summary
Questo studio introduce un metodo automatizzato per generare organoidi tridimensionali di glioblastoma derivati da pazienti utilizzando un tritatutto di tessuti. Il metodo fornisce un approccio adeguato ed efficace per ottenere tali organoidi per i test terapeutici.
Abstract
Il glioblastoma, tipo IDH-wild, SNC di grado 4 (GBM) è un tumore cerebrale primario associato a scarsa sopravvivenza dei pazienti nonostante il trattamento aggressivo. Lo sviluppo di modelli ex vivo realistici rimane una sfida. I modelli di organoidi tridimensionali (PDO) derivati da pazienti offrono piattaforme innovative che catturano l'eterogeneità fenotipica e molecolare del GBM, preservando al contempo le caratteristiche chiave dei tumori originali. Tuttavia, la dissezione manuale per la generazione di PDO è dispendiosa in termini di tempo, costosa e può portare a un numero di PDO di dimensioni irregolari e non uniformi. Questo studio presenta un metodo innovativo per la produzione di DOP utilizzando un tritatutto automatizzato. I campioni tumorali di quattro pazienti con GBM e uno con astrocitoma, mutante IDH, SNC di grado 2 sono stati processati manualmente e utilizzando il tritatutto. Nell'approccio manuale, il materiale tumorale è stato sezionato utilizzando bisturi sotto controllo microscopico, mentre il tritatutto di tessuto è stato impiegato a tre diverse angolazioni. Dopo la coltura su un agitatore orbitale a 37 °C, i cambiamenti morfologici sono stati valutati utilizzando la microscopia in campo chiaro, mentre la proliferazione (Ki67) e l'apoptosi (CC3) sono state valutate mediante immunofluorescenza dopo 6 settimane. Il metodo del tritatutto tissutale ha ridotto di quasi il 70% il tempo di produzione e ha portato a un conteggio medio dei PDO significativamente più elevato rispetto al tessuto lavorato manualmente dalla seconda settimana in poi (settimana 2: 801 vs. 601, P = 0,018; settimana 3: 1105 vs. 771, P = 0,032; e settimana 4: 1195 vs. 784, P < 0,01). La valutazione della qualità ha rivelato tassi simili di apoptosi e proliferazione delle cellule tumorali per entrambi i metodi di produzione. Pertanto, il metodo automatizzato del trituratore di tessuti offre un approccio più efficiente in termini di tempo e resa DOP. Questo metodo è promettente per lo screening farmacologico o immunoterapico dei pazienti affetti da GBM.
Introduction
I gliomi di basso grado (LGG) sono un gruppo di tumori cerebrali relativamente rari che in genere si presentano come a crescita lenta e meno aggressivi rispetto ai gliomi di alto grado come il glioblastoma. Possono verificarsi sia negli adulti che nei bambini, con una prevalenza leggermente superiore negli adulti. La prevalenza esatta varia a seconda della regione e della popolazione, ma gli LGG rappresentano circa il 15%-20% di tutti i tumori cerebrali primari1. Le strategie di trattamento per le LGG spesso comportano una combinazione di chirurgia, radioterapia e chemioterapia, con l'obiettivo di massimizzare la resezione del tumore preservando la funzione neurologica. La gestione delle LGG può essere complessa e la scelta della terapia può dipendere da fattori quali la localizzazione del tumore e le caratteristiche molecolari2. I progressi nella comprensione delle basi genetiche e molecolari degli LGG hanno portato a terapie più mirate e la ricerca in corso continua a perfezionare gli approcci terapeutici.
Il glioblastoma, tipo selvaggio IDH, SNC di grado 4 (GBM), d'altra parte, è il tumore cerebrale primario più diffuso riscontrato negli adulti, con un tasso di incidenza compreso tra 3,19-4,17 casi per 100.000 anni-persona3. Il GBM provoca sintomi come mal di testa, convulsioni, deficit neurologici focali, cambiamenti nella personalità e aumento della pressione intracranica. Il trattamento standard per il GBM prevede il debulking del tumore, se possibile, seguito da radioterapia combinata con Temozolomide4. Inoltre, la combinazione di Temozolomide e Lomustina può migliorare il tasso di sopravvivenza globale mediano nei pazienti con metilazione5 del promotore della O 6-metilguanina-metiltransferasi (MGMT). Tuttavia, nonostante questi recenti approcci terapeutici, il GBM rimane una malattia incurabile con prognosi infausta, caratterizzata da un tasso di sopravvivenza globale mediano dei pazienti da 16 mesi fino a 20,9 mesi quandosi aggiungono i campi di trattamento dei tumori (TTFields) 3,6. Diversi approcci immunoterapeutici sono stati studiati nel GBM, ma hanno dimostrato un'efficacia limitata in vivo. Inoltre, le limitazioni cliniche e precliniche ostacolano le scoperte terapeutiche7. La creazione di un modello ex vivo adeguato e realistico è stata impegnativa a causa dell'eterogeneità inter-8 e intratumorale 9 del GBM.
Le linee cellulari di pazienti convenzionali bidimensionali (2D) rappresentano popolazioni cellulari omogenee e sono adatte per lo screening di farmaci ad alto rendimento. Tuttavia, le linee cellulari derivate da pazienti e immortalizzate non riescono a imitare adeguatamente il GBM a causa delle differenze nelle condizioni di crescita e delle deviazioni nelle caratteristiche genotipiche e fenotipiche dopo passaggi multipli 10,11,12.
D'altra parte, i modelli di organoidi 3D sono recentemente emersi come sistemi promettenti che replicano l'eterogeneità fenotipica e molecolare degli organi e dei vari tipi di cancro 13,14,15,16,17,18. Nel contesto del GBM, gli organoidi cerebrali sono stati geneticamente modificati per simulare caratteristiche simili al tumore16,17 o co-coltivati con GSC o sferoidi per indurre l'infiltrazione delle cellule tumorali18,19. Mentre gli organoidi GBM derivati da pazienti coltivati con Matrigel e EGF/bFGF mostrano segni distintivi del GBM come l'eterogeneità delle cellule staminali e l'ipossia20, rimane incerto fino a che punto questo modello possa rappresentare le proprietà molecolari chiave delle neoplasie dei pazienti.
Gli organoidi GBM derivati da pazienti (PDO) sono modelli promettenti in grado di mantenere le caratteristiche predominanti dei loro tumori parentali analoghi, comprese le caratteristiche istologiche, la diversità cellulare, l'espressione genica e i profili mutazionali. Inoltre, vengono rapidamente infiltrati dopo l'impianto nel cervello di roditori adulti, fornendo un modello realistico per i test farmacologici e la terapia personalizzata21. Tuttavia, la dissezione manuale del tessuto tumorale per generare PDO richiede tempo e denaro. Pertanto, esiste un urgente bisogno di un metodo rapido in grado di produrre un gran numero di PDO, consentendo una valutazione completa dei diversi approcci terapeutici promettenti per la sperimentazione personalizzata dei farmaci. Questo studio descrive un nuovo metodo per la produzione di PDO direttamente da tessuto tumorale appena sezionato utilizzando un tritatutto automatico. Inoltre, i PDO generati con questo metodo sono stati confrontati con i PDO sezionati manualmente dagli stessi pazienti in termini di conta dei DOP, caratteristiche morfologiche, apoptosi e proliferazione delle cellule tumorali.
Protocol
Tutti i pazienti sono stati trattati presso il Dipartimento di Neurochirurgia dell'Ospedale Universitario di Würzburg, in Germania, dopo aver dato il consenso informato scritto in conformità con la dichiarazione di Helsinki e come approvato dall'Institutional Review Board dell'Università di Würzburg (#22/20-me). Il materiale di tessuto tumorale di quattro pazienti con GBM e di un astrocitoma, con mutazione IDH, pazienti con SNC di grado 2 dell'OMS (glioma di basso grado, LGG) (Tabella 1) è stato ottenuto chirurgicamente e processato utilizzando il seguente protocollo. Il processo automatizzato di generazione di PDO utilizzando un tritatutto per tessuti è indicato come trituratore (C) e il processo di taglio manuale del tessuto con due bisturi sotto controllo microscopico come manuale (M). Sei sezioni di uguali dimensioni (1-2 cm3) sono state sezionate dal campione tumorale, quindi ciascuna è stata tagliata a metà e processata in modo omogeneo utilizzando i due metodi. A causa della suddetta eterogeneità intratumorale, è stata generata una piastra a 6 pozzetti per ciascun approccio da ciascun paziente, con ogni pozzetto che rappresentava PDO da un sito diverso all'interno del tumore originale. Entrambe le procedure si sono svolte in un armadio a flusso d'aria laminare e tutti gli strumenti utilizzati sono stati sterilizzati prima dell'uso. La panoramica dell'approccio è illustrata nella Figura 1.
1. Preparazione dei blocchi di agarosio (solo per l'approccio C, facoltativo)
- Versare 50 mL di soluzione salina tamponata con fosfato (PBS) in un becher, aggiungere una compressa di agarosio (vedere la tabella dei materiali) e mescolare bene fino a quando non è sospesa.
- Scaldare il composto nel microonde per 30-40 secondi, evitando che bolle. Quindi raffreddare il composto fino a raggiungere i 47 °C.
- Versare la miscela di agarosio in uno stampo da colata sigillato a forma di cilindro ed evitare la formazione di bolle. Raffreddare immediatamente il getto utilizzando una pinza congelata (-20 °C) o mettendolo su ghiaccio secco per 30 min.
2. Lavorazione del materiale tumorale
- Preparare una scatola di ghiaccio per mantenere raffreddato il materiale tumorale durante il tragitto dalla sala operatoria al laboratorio.
- Trasferire il tessuto tumorale (4-5 cm³) in una provetta sterile da 50 mL contenente 25 mL di Hibernate A (vedi Tabella dei materiali) che copre il tumore e posizionare la provetta nella ghiacciaia.
- Sotto una cabina a flusso d'aria laminare, trasferire il materiale tumorale insieme all'ibernato A in una capsula di Petri in vetro sterilizzato.
- Eliminare il tessuto necrotico e sezionare attentamente i vasi sanguigni utilizzando un bisturi e una pinza tissutale sotto controllo microscopico. Identificare il tessuto necrotico in base alle aree emorragiche che presentano una tonalità brunastra derivante dal sanguinamento o al tessuto che mostra un aspetto più pallido o più bianco rispetto al tessuto vitale adiacente. Prestare attenzione a non schiacciare o rompere il tessuto.
- Tagliare il materiale tumorale in sei pezzi con una dimensione approssimativa di 1-2 cm3. Distribuire i pezzi in piastre di Petri di plastica (n = 6) preriempite con 3 mL di terreno H-GPSA (Tabella 2), ciascuno22. Metti le piastre di Petri sul ghiaccio.
3. Impostazione del tritatutto
- Posizionare la lama come descritto nel manuale del produttore23.
- Regolare lo spessore della fetta a 0,45-0,50 mm. Impostare la forza della lama su media. Fissare la manopola di rilascio del tavolo in modalità "start".
4. Lavorazione dei pezzi di tessuto tumorale
- Processamento del tessuto tumorale con il tritatutto (metodo C)
- Tagliare i blocchi di agarosio in cilindri di 2 cm di lunghezza e incollare uno di questi cilindri sul piatto di plastica circolare del tritatutto utilizzando la colla istoacrilica (vedi Tabella dei materiali).
- Creare un approfondimento nel cilindro di agarosio usando un bisturi, quindi inserire il tessuto tumorale del primo pozzetto (passaggio 2.5) all'interno di questa fossa.
NOTA: Il materiale tumorale deve essere maneggiato con cura e non deve essere schiacciato o spinto nella fessura. Lo spazio dovrebbe essere abbastanza grande da adattarsi facilmente al tumore, ma abbastanza piccolo da mantenere stabile il materiale tumorale durante il processo di taglio. Passaggi 4.1.1. e 4.1.2. sono facoltativi. - Posizionare il disco di plastica sul disco di montaggio del tavolo da taglio (vedi Tabella dei materiali).
- Accendere il tritatutto e premere il pulsante di ripristino. A questo punto il tritatutto inizia a tagliare (primo giro). La macchina si arresta automaticamente dopo che il tavolo raggiunge la fine e sia l'agarosio che il tessuto tumorale vengono tagliati nel diametro desiderato.
- Ruotare il disco di montaggio di 90°, quindi regolare la manopola del tavolo di rilascio sulla modalità di avvio.
- Premere il pulsante di reset e lasciare che la macchina tagli nuovamente il tessuto creando un tessuto di forma rettangolare (secondo giro).
- Rimuovere il disco di plastica con il materiale lavorato e ruotare con cautela solo il tessuto tumorale di 90° utilizzando una spatola per tessuti.
- Posizionare il disco di plastica sul tavolo da taglio, quindi regolare la manopola del tavolo di rilascio sulla modalità di avvio e premere il pulsante di ripristino per un ultimo giro di taglio (terzo giro).
- Spegnere il tritatutto e rimuovere il disco di plastica. Pulisci il tritatutto e le lame.
- Utilizzando una pipetta monocanale da 5 ml, aspirare il materiale trattato insieme al terreno nella pipetta e risciacquare la sospensione nel piatto.
- Ripetere il passaggio precedente 2-3 volte per separare correttamente il tessuto.
- Riposizionare la capsula di Petri sul ghiaccio e ripetere i passaggi (4.1.1-4.1.12.) con le altre 5 piastre di ciascun tumore.
- Elaborazione manuale del tessuto tumorale (metodo M)
- Trasferire il tessuto tumorale dalla prima capsula di Petri in plastica (fase 2.5) insieme a 3 mL di terreno H-GPSA (Tabella 2) in una capsula di Petri in vetro. Sezionare manualmente il segmento al microscopio in sezioni di 0,5 mm utilizzando due bisturi.
- Trasferire il tessuto sezionato nella sua capsula di Petri di plastica utilizzando una pipetta da 2 ml.
- Ripetere i passaggi (4.2.1.-4.2.3.) per le sezioni tumorali nelle altre cinque piastre di Petri (passaggio 2.5).
5. Lavaggio del tessuto tumorale
- Inclinare ciascuna capsula di Petri verso l'alto fino a 45° e attendere 30 secondi fino a quando i pezzi tumorali affondano sul fondo della capsula.
- Aspirare con cautela 2,5 mL di terreno H-GPSA (Tabella 2) utilizzando una pipetta da 1 mL e fare attenzione a non prelevare tessuto tumorale.
- Aggiungere 2 mL di tampone di lisi per globuli rossi (vedere Tabella dei materiali) a ciascun campione. I pezzi di tumore trattati devono essere completamente coperti dal tampone di lisi.
- Posizionare le 6 piastre su una macchina per agitare orbitale da laboratorio a bassa velocità per 10 minuti.
- Aspirare con cura 2 mL del tampone di lisi per non prelevare tessuto tumorale.
- Ripetere le fasi di lavaggio precedenti (passaggio 5.1-5.5) due volte utilizzando ogni volta 2 mL di terreno H-GPSA (Tabella 2) invece del tampone di lisi.
6. Coltura del tessuto tumorale
- Aspirare il terreno H-GPSA (Tabella 2) da ciascuna capsula e sostituirlo con 4 mL di terreno PDO (Tabella 2).
- Trasferire i pezzi di tessuto di ciascuna piastra in un rispettivo pozzetto di una piastra a 6 pozzetti con attacco ultrabasso (vedere la tabella dei materiali).
- Posizionare la piastra su un agitatore orbitale all'interno di un incubatore e incubare a 37 °C, 5% di CO2 e 150 giri/min per 2-4 settimane.
- Effettuare un mezzo cambio di terreno ogni due giorni aspirando 2 mL di terreno da ciascun pozzetto e sostituendolo con 2 mL di terreno DOP fresco (Tabella 2) preriscaldato a 37 °C.
- Osservare il tessuto al microscopio (morfologia, crescita, colore medio) e tagliare i PDO in crescita (>0,7 mm) o il tessuto adesivo per prevenire l'ipossia tissutale.
- Per fare ciò, trasferire i PDO dal pozzetto di attacco ultra-basso a una capsula di Petri in vetro sterilizzato e utilizzare un bisturi per il taglio. In alternativa, i PDO adesivi possono essere risolti aspirandoli con una pipetta da 1 mL. Fare attenzione a non schiacciare le DOP e maneggiarle delicatamente.
- Valutare la formazione di PDO contando la DOP ogni due giorni e controllare accuratamente la morfologia rotonda desiderata (Figura 2).
7. Fissazione e integrazione delle DOP
- Fissare due PDO da ciascun pozzetto di ciascun paziente con formalina al 4% per 24 ore dopo 6 settimane di coltura.
- Immergere le DOP fissate in formalina tamponata neutra (fosfato di sodio) fino all'inclusione.
- Mettere ogni PDO in una cassetta (vedi Tabella dei materiali) per un'ulteriore lavorazione.
- Avviare un processo di disidratazione immergendo la cassetta nelle seguenti soluzioni come indicato nella NOTA seguente:
NOTA: etanolo al 50% per 20 min, etanolo al 70% per 20 min, etanolo all'80% per 20 min, etanolo al 96% per 20 min, etanolo al 100% per 20 min, etanolo al 100% per 30 min, etanolo al 100% + cloroformio (rapporto 1:1) per 30 min, etanolo al 100% + cloroformio (rapporto 1:1) per 30 minuti, cloroformio assoluto per 30 min, cloroformio assoluto per 30 min, Paraffina per 30 min, Paraffina per 30 min con l'STP 120. - Incorporare le DOP disidratate in cera di paraffina a 58-60 °C.
- Affettare i PDO incorporati a uno spessore di 2,5 μm e montarli su vetrini per la colorazione.
8. Colorazione a immunofluorescenza
- Montare i PDO dopo 6 settimane di coltura.
- Successivamente, eseguire una doppia colorazione contro la proteina acida fibrillare gliale (GFAP, diluizione: 1:100) e il marcatore di proliferazione Ki67 (diluizione: 1:1000) (vedi Tabella dei Materiali), come precedentemente riportato22.
- Allo stesso modo, valutare l'apoptosi mediante doppia colorazione dei PDO contro GFAP e anti-caspasi-3 (CC3, diluizione: 1:400) (vedi Tabella dei materiali).
- Cattura le immagini dei PDO utilizzando un microscopio a fluorescenza con un ingrandimento di 40x.
- Analizza le immagini per le cellule GFAP-, Ki67- e CC3-positive, nonché per le cellule GFAP/Ki67 e GFAP/CC3 doppie positive.
- Utilizza il programma open-source Fiji (ImageJ-win 32) per l'analisi delle immagini.
9. Valutazione e analisi dei dati
- Cattura ogni giorno immagini microscopiche in campo chiaro durante la prima settimana di coltura con impostazioni standard e ingrandimento 5x.
- Osserva i cambiamenti morfologici e monitora il processo di stagionatura sia con approcci di lavorazione manuali che automatizzati.
- Eseguire l'analisi morfologica utilizzando il microscopio in modalità campo chiaro standard.
- Valutare il numero e la morfologia della PDO durante le prime 4 settimane di coltura nei PDO di tutti e cinque i pazienti.
- Ottenere tre letture di ciascun conteggio PDO da ciascun paziente per calcolare la media e l'errore standard della media (SEM).
- Studiare la proliferazione e l'apoptosi nei PDO di tre pazienti.
- Analizzare i dati utilizzando un pacchetto software statistico disponibile in commercio (vedere la tabella dei materiali).
- Applicare i test Students-T e Mann-Whitney U per determinare le differenze tra la generazione manuale e automatizzata di PDO in termini di conteggio, proliferazione e apoptosi dei DOP.
Representative Results
Quattro pazienti con GBM e uno con LGG sono stati inclusi dopo la conferma patologica da parte di un neuropatologo esperto (CMM). La maggior parte dei pazienti presentava un promotore di MGMT non metilato e tutti i pazienti affetti da GBM erano IDH1 e IDH2 wild type (Tabella 1). In media, il processo di produzione è durato 88,8 minuti (+/- 6,3 minuti) nell'approccio C e 322 minuti (+/- 17,2 minuti) nell'approccio M. Il tasso di successo complessivo è stato dell'87% nell'approccio manuale e del 93% nell'approccio chopper dopo 4 settimane di coltura (n = 5). Inoltre, i PDO derivati dal gruppo C hanno raggiunto la forma arrotondata desiderata entro 1 settimana ed erano abbastanza maturi da poter essere utilizzati in esperimenti in vitro , mentre i PDO del gruppo M sono rimasti per lo più nettamente spigolosi e indefiniti (Figura 2). Il tessuto tumorale processato con l'approccio C ha portato a un totale di 281 PDO (Media per paziente = 56 +/- 43) dopo la prima settimana di coltura, mentre 250 PDO (Media per paziente = 50 +/- 41) si sono sviluppati con l'approccio M. Durante la seconda settimana di coltura, il tessuto di tutti e cinque i pazienti ha prodotto un numero più elevato di PDO quando sono stati generati con l'approccio C (801; Media per paziente = 130 +/- 38) rispetto all'approccio M (601; Media per paziente= 76 +/- 44; P = 0,018). Durante la terza settimana di coltura, l'approccio C ha accumulato complessivamente 1105 PDO da tutti i pazienti (Media per paziente = 221 +/- 32) rispetto a 771 PDO (Media per paziente = 155 +/- 34) nell'approccio M (P = 0,032). Inoltre, un totale di 1195 PDO (Media per paziente = 239 +/- 50) si è formato dopo quattro settimane di coltura quando è stato generato con l'approccio C rispetto a 784 (Media per paziente = 157 +/- 36) utilizzando l'approccio M (P < 0,01). Pertanto, il metodo C ha mostrato un numero significativamente più elevato di PDO a partire dalla seconda settimana (Figura 3). Inoltre, sono state valutate le fluttuazioni relative nella conta dei PDO per esplorare le tendenze dinamiche tra le settimane successive. L'analisi ha rivelato un'impressionante impennata del numero di PDO durante la transizione iniziale dalla prima alla seconda settimana nell'approccio C (265%), che è stato indicativo di rapidi progressi. Successivamente, c'è stato un aumento inferiore dei conteggi durante la terza settimana (75%), riflettendo un aggiustamento temporaneo. Al contrario, l'approccio M ha dimostrato un aumento consistente e costante della conta dei PDO (92% nella seconda settimana, rispettivamente 67% nella terza settimana), che ha contribuito a una notevole stabilità della conta durante la quarta settimana. Questa costante tendenza al rialzo del numero di PDO sottolinea l'affidabilità e la resilienza dell'approccio C per tutto il periodo di osservazione.
Due pazienti con GBM e un paziente con LGG sono stati inclusi per l'analisi del numero di astrociti (GFAP) all'interno dei PDO, della proliferazione delle cellule PDO (Ki67) e dell'apoptosi (CC3). La conta degli astrociti determinata non ha rivelato differenze significative tra i due metodi di elaborazione, con una media del 43% nell'approccio C e del 45% nell'approccio M (Figura 4 e Figura 5, Figura 1 supplementare e Figura 2 supplementare). Analogamente, i tassi di proliferazione all'interno delle DOP erano comparabili tra gli approcci C (3%) e M (1%). Solo i PDO generati con l'approccio C dal paziente 5 hanno mostrato un tasso di proliferazione del 26% rispetto all'1% con l'approccio M (P = 0,001; Figura 4C). Nel complesso, sono stati rilevati bassi tassi di apoptosi nei PDO trattati con l'approccio C (3%) rispetto al 2% dell'approccio M per tutti i pazienti, che non erano significativamente diversi (Figura 5C). Inoltre, non c'era alcuna differenza significativa tra i due metodi per quanto riguarda il numero di astrociti sottoposti ad apoptosi (Figura 5D).
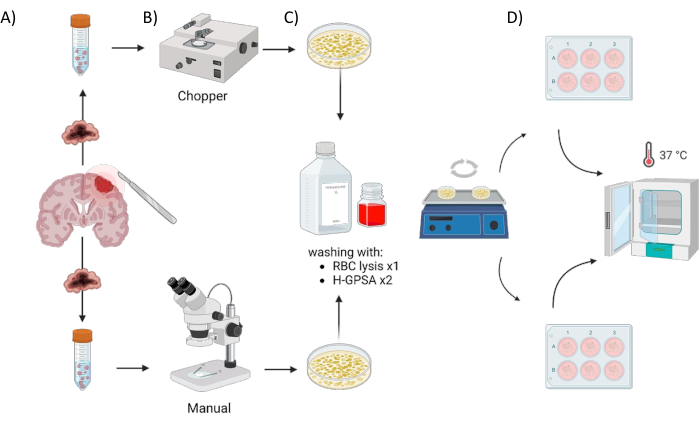
Figura 1: Panoramica grafica del processo di produzione di organoidi derivati dal paziente (PDO) utilizzando un chopper automatizzato rispetto a un approccio manuale. L'illustrazione illustra le varie fasi coinvolte, tra cui (A) la raccolta del campione, (B) la dissezione del materiale tumorale, (C) il lavaggio e (D) l'incubazione. Fare clic qui per visualizzare una versione più grande di questa figura.
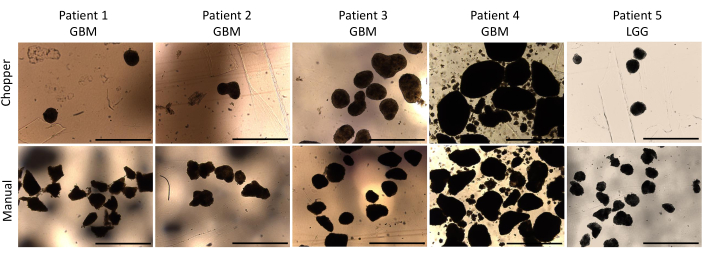
Figura 2: Morfologia della DOP durante la prima settimana di coltura. Confronto della formazione di PDO dopo la dissezione utilizzando sia il trituratore automatizzato che il metodo manuale. Barre di scala = 1000 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
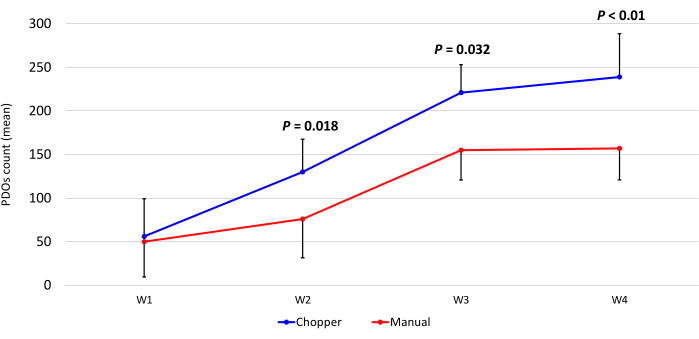
Figura 3: Conta dei PDO durante le prime quattro settimane di coltura. L'asse x visualizza il tempo in settimane (W) e l'asse y il numero di PDO dell'approccio C (blu) e M (rosso) (n = 5). Ogni punto dati rappresenta il conteggio medio, con barre di errore che indicano l'errore standard della media. Fare clic qui per visualizzare una versione più grande di questa figura.
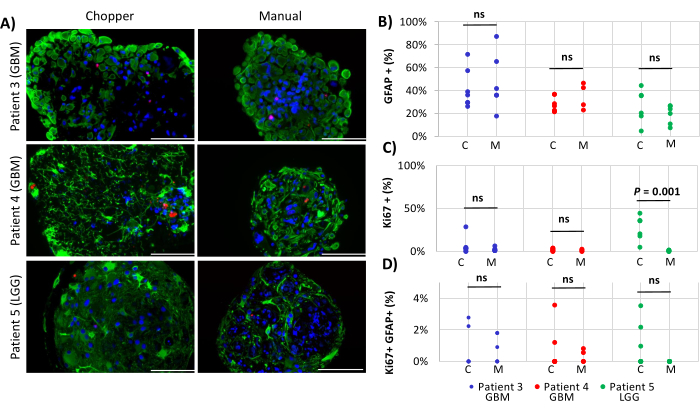
Figura 4: Tassi di proliferazione cellulare all'interno dei PDO. (A) Immagini rappresentative di immunofluorescenza (n = 3) di cellule GFAP-positive (verde), cellule Ki67-positive (rosse) e DAPI (blu) nei PDO dei pazienti 3, 4 e 5 (Tabella 1). Tutte le DOP sono state lavorate utilizzando i metodi trituratore (C) e manuale (M). Barre di scala = 100 μm. (B) Confronto dei due metodi per quanto riguarda il numero relativo di cellule GFAP-positive, (C) cellule Ki67-positive e (D) Ki67/GFAP-doppie positive. I risultati non significativi sono indicati da "ns". Fare clic qui per visualizzare una versione più grande di questa figura.
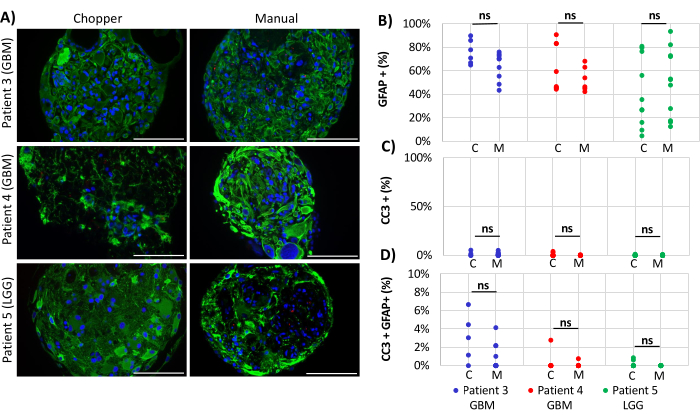
Figura 5: Tassi di apoptosi all'interno dei PDO. (A) Immagini rappresentative di immunofluorescenza (n = 3) di cellule GFAP-positive (verde), cellule CC3-positive (rosso) e DAPI (blu) nei PDO dei pazienti 3, 4 e 5 (Tabella 1). Tutte le DOP sono state lavorate utilizzando i metodi trituratore (C) e manuale (M). Barre di scala = 100 μm. (B) Confronto dei due metodi per quanto riguarda il numero relativo di cellule GFAP-positive, (C) cellule CC3-positive, e (D) CC3/GFAP-doppie positive. I risultati non significativi sono indicati da "ns". Fare clic qui per visualizzare una versione più grande di questa figura.
Tabella 1: Caratteristiche dei pazienti e parametri clinici. GBM = glioblastoma, tipo IDH-wild, SNC WHO grado 4; LGG = glioma di basso grado; KPS = punteggio delle prestazioni di Karnofsky; MGMT = O 6-metilguanina-DNA metiltransferasi; IDH1 = isocitrato deidrogenasi 1, IDH2 = isocitrato deidrogenasi 2, ATRX = α-talassemia/ritardo mentale, gene legato all'X; M = morfologia; CC = numero di cellule; p = proliferazione; A = apoptosi. Clicca qui per scaricare questa tabella.
Tabella 2: Composizioni medie. H-GPSA = Ibernate A-Glutamax pencillin streptomicina amfotericina B. PDO = organoidi derivati da pazienti DMEM: Dulbecco's Modified Eagle's Medium. NEAA: aminoacidi non essenziali. Pen Strep: Penicillina/Streptomicina Fare clic qui per scaricare questa tabella.
Tabella 3: Panoramica delle tecniche utilizzate per generare modelli di coltura cellulare. Clicca qui per scaricare questa tabella.
Figura supplementare 1: Singoli canali di colorazione della proliferazione delle DOP. (A) DAPI (blu), (B) cellule GFAP-positive (verde), (C) cellule Ki67-positive (rosso) e (D) canale di sovrapposizione nei PDO dei pazienti 3, 4 e 5. Barre di scala = 100 μm. Clicca qui per scaricare questo file.
Figura 2 supplementare: Singoli canali di colorazione per apoptosi dei PDO. (A) DAPI (blu), (B) cellule GFAP-positive (verde), (C) cellule CC3-positive (rosso) e (D) canale di sovrapposizione nei PDO dei pazienti 3, 4 e 5. Barre di scala = 100 μm. Clicca qui per scaricare questo file.
Discussion
Questo studio presenta un metodo rapido ed efficiente per la generazione di DOP. Il GBM rimane un tumore difficile da trattare, spesso caratterizzato da recidive e da un elevato carico di malattia 3,6. Sono urgentemente necessari approcci terapeutici innovativi, poiché i risultati promettenti osservati in vitro spesso non riescono a dimostrare l'efficacia in vivo durante gli studi di fase I. Una delle ragioni di questa discrepanza potrebbe essere la limitata capacità delle linee cellulari immortalizzate derivate da pazienti, cresciute in colture monostrato, di riflettere le complesse interazioni cellula-cellula e le proprietà genetiche del tumore parentale. Data l'elevata eterogeneità inter- e intratumorale del GBM 8,9, le terapie mirate personalizzate sono preferibili e possono essere promettenti per applicazioni future. A differenza delle linee cellulari aderenti 2D, gli organoidi hanno la capacità di mantenere le proprietà del tessuto parentale21, ma le complesse interazioni cellula-cellula tra il tumore e il cervello normale sono di fondamentale importanza e potrebbero potenzialmente essere trascurate da questo modello. Tuttavia, la generazione manuale di PDO è un processo che richiede molto tempo e il danno tissutale causato dalla spremitura con bisturi durante il taglio può ostacolare la crescita di PDO di successo. Pertanto, è stato ottimizzato un metodo automatizzato che utilizza un tritatutto per tessuti per generare un numero maggiore di DOP con tempi e sforzi ridotti. Inoltre, abbiamo dimostrato che i tassi complessivi di proliferazione e apoptosi non differivano tra i due approcci.
L'approccio C è semplice, facile da implementare e consente la generazione di un numero maggiore di PDO (Figura 3). La rotazione del tessuto tra il secondo e il terzo ciclo di taglio è stata identificata come un passaggio critico nel protocollo. In questa fase, il tessuto ha già perso la sua integrità e può facilmente sfaldarsi, risultando in pezzi più grandi che richiedono un ulteriore taglio o dissezione manuale al microscopio. Mentre l'approccio del chopper automatizzato consente di ottenere una dimensione di taglio preimpostata con maggiore precisione, l'approccio manuale manca di precisione nel determinare la dimensione dei PDO, portando a PDO di forma e dimensioni non uniformi, il che rappresenta uno svantaggio per lo screening comparativo dei farmaci (Figura 2). Tuttavia, con il metodo proposto, la standardizzazione del numero di cellule per PDO non è raggiunta, ponendo potenzialmente uno svantaggio per i protocolli standardizzati di screening dei farmaci. I vantaggi e gli svantaggi delle diverse tecniche di generazione di organoidi 18,19,20,24,25,26,27,28,29,30,31,32,33,34,35,36,
37,38,39,40,41,42 e le loro applicazioni sono riassunte nella Tabella 3.
Il tessuto GBM può variare in consistenza, da duro (zona di infiltrazione) a morbido (nucleo necrotico), il che può rappresentare una sfida per l'approccio chopper automatizzato. Se il tessuto è troppo duro, il tritatutto potrebbe comprimerlo e danneggiarlo, mentre un tessuto troppo morbido potrebbe essere schiacciato. Il tessuto scelto ha mostrato attributi distintivi, tra cui un livello intermedio di compattezza, sporadicamente caratterizzato da una colorazione rosa-grigiastra piuttosto che manifestare uno scolorimento marrone o giallo. Il tessuto che possedeva una consistenza spugnosa e facilmente friabile ha dimostrato una conservazione superiore all'interno dei blocchi di agarosio, mentre il tessuto tumorale estremamente delicato e liquefatto è stato omesso dalla procedura di campionamento. Tuttavia, l'approccio chopper ha consentito di generare con successo un numero maggiore di PDO rispetto all'approccio manuale, anche con tessuti di consistenza non ottimale. La soluzione chiave è mantenere una stretta interazione con il chirurgo che esegue la resezione del tumore per elaborare il tessuto proveniente da diverse aree del tumore. Nei casi di consistenza non ottimale del tessuto, la rilavorazione manuale del tessuto al microscopio è stata un'aggiunta utile dopo il taglio. Per tenere conto dell'eterogeneità, il tessuto tumorale è stato inizialmente diviso in sei segmenti, ciascuno successivamente dimezzato per l'approccio C o M. All'interno di queste sei sezioni distinte, si prevede un notevole grado di eterogeneità. Inoltre, anche all'interno delle DOP della stessa sezione o pozzo, è plausibile la presenza di sottopopolazioni distinte.
Come prova di concetto, i dati di proliferazione e apoptosi sono stati riportati da due pazienti con GBM e un paziente con LGG, che non mostrano differenze significative tra i due metodi. La generazione di PDO non è limitata ai tumori cerebrali altamente maligni, ma può essere applicata anche alle LGG. Questo studio evidenzia che le LGG raramente mostrano una crescita nella cultura 2D, rendendo lo sviluppo di un modello accurato per il loro studio molto prezioso. Questo protocollo mira a dimostrare la versatilità di questo approccio nella generazione di PDO da GBM e LGG in modo rapido ed efficace.
Nel complesso, i PDO potrebbero essere utilizzati in futuro per test pre-terapeutici orientati al paziente di terapie mirate nei tumori cerebrali maligni. Fornire un metodo rapido ed efficiente per lo screening farmacologico individualizzato è fondamentale, poiché la progressione del tumore si verifica rapidamente e le opzioni di trattamento di salvataggio sono disperatamente necessarie. Come passo successivo, il modello PDO potrebbe essere valutato con vari approcci immunoterapeutici per imitare meglio le risposte reali al trattamento. In futuro, i PDO potrebbero essere utilizzati per trarre conclusioni sofisticate sulla necessità di ulteriori esplorazioni e valutazioni delle terapie in ambito clinico.
Disclosures
Gli autori non hanno nulla da rivelare.
Acknowledgements
Questa ricerca è stata finanziata dal Centro Interdisciplinare di Ricerca Clinica (IZKF, B-450) di Würzburg, dal Centro Bavarese di Ricerca sul Cancro (BZKF) e la pubblicazione è stata finanziata dall'Open Access Publishing Fund dell'Università di Würzburg. Ringraziamo Dagmar Hemmerich e Siglinde Kühnel, entrambe Sezione di Neurochirurgia Sperimentale, Dipartimento di Neurochirurgia, Ospedale Universitario di Würzburg, per il supporto tecnico. La Figura 1 è stata creata utilizzando www.biorender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol (1000x) | Gibco | 21985023 | |
| 30% formaldehyde methanol-free | Carl Roth | 4235.1 | Used in 4% concentration |
| 70% ethanol solution | For sterilisation | ||
| Agarose tablets 0.5 g | Carl Roth | HP67.7 | |
| Amphotericin B 250 µg/mL | Gibco | 15290018 | |
| Anatomical forceps | Hartstein | N/A | |
| Anatomical spatula | Hartstein | N/A | |
| B-27 Supplement without vitamin A (50x) | Gibco | 12587010 | |
| Biopsy cassette with cover | Resolab | 37001-b | |
| Blades for McIlwain Tissue Chopper | Campden instruments | Model TC752-1 | |
| CC3 antibody (Asp 175) | Cells signaling technology | 9661 | |
| Disposable scalpel | Feather | 0200130015 | |
| Distilled water | Gibco | 15230089 | To dilute the formaldehyd |
| Dulbecco's Modified Eagle Serum Nutrient Mixture (DMEM) F-12 (1:1) (1x) | Gibco | 11330032 | Includes L-Glutamine and 15 mM HEPES |
| Dulbecco's Phosphate Buffered Saline (PBS) | Sigma Life Sciences | D8537-500ML | Modified, without calcium, chloride and magnesium chloride, liquid, sterile-filtered, suitable for cell culture |
| eBioscience 1x RBC Lysis Buffer | Invitrogen | 433357 | |
| Falcon tube 50 ml Cellstar | Greiner Bio-One | 227261 | |
| GFAP antibody | Santa Cruz Biotechnology | sc33673 | |
| Glass beaker | N/A | N/A | |
| Glass petri dish | N/A | N/A | |
| GlutaMAX (100x) | Gibco | 35050061 | |
| Heracell 240i CO2 Incubator | Thermo scientific | 51032875 | |
| Herasafe 2025 Biological Safety Cabinet | Thermo scientific | 5016643 | |
| Hibernate-A | Gibco | A1247501 | |
| Histoacryl glue | B. Braun surgical | 1050052 | |
| Human Insulin, Solution | Santa Cruz Biotechnology | sc-360248 | |
| Ice box | N/A | N/A | |
| Ki67 antibody | Abcam | ab16667 | |
| McIlwain Tissue Chopper | Cavey Laboratory Engineering | 51350V | |
| Microscope Leica DMI 3000B, DMI 4000B, DMI 6000B | Leica | DMI6000B | For brightfield and immunofluorescence pictures |
| Microscope stereozoom S9D | Leica | W841832 | For manual cutting and to organoids monitoring |
| Microwave | Bosch | N/A | To heat the agarose solution |
| Mounting plastic discs | Cavey Laboratory Engineering | 51354 | |
| N-2 Supplement (100x) | Gibco | 17502048 | |
| NEM Non-Essential Amino Acids (NEAA) (100x) | Gibco | 11140050 | |
| Neurobasal (1x) | Gibco | 21103049 | |
| Orbital shaking machine Rotamax120 | Heidolph | 10304491 | |
| Penicilin Streptomycin | Gibco | 15140122 | |
| Plastic petri dishes Cellstar | greiner bio-one | 628160 | n = 12 |
| Single channel pipette 1000 µm | Eppendorf | 4924000010 | |
| Single channel pipette 5000 µm | Eppendorf | EP3123000276 | |
| Statistical Package for the Social Sciences (SPSS) version 23.0 | IBM | ||
| Surgipath Paraplast | Leica | 39601006 | Embedding medium |
| Ultra-low attachment Nucleon Sphera 6-well plate | Thermo Scientific | 174932 |
References
- Gatto, L., et al. IDH inhibitors and beyond: the cornerstone targeted glioma treatment. Mol Diagn Ther. 25 (4), 457-473 (2021).
- Buckner, J. C., et al. Radiation plus Procarbazine, CCNU, and Vincristine in low-grade glioma. N Engl J Med. 374 (14), 1344-1355 (2016).
- Grochans, S., et al. Epidemiology of glioblastoma multiforme-literature review. Cancers (Basel). 14 (10), 2412 (2022).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma). N Engl J Med. 352 (10), 987-996 (2005).
- Herrlinger, U., et al. Lomustine-temozolomide combination therapy versus standard temozolomide therapy in patients with newly diagnosed glioblastoma with methylated MGMT promoter (CeTeG/NOA-09): a randomised, open-label, phase 3 trial. Lancet. 393 (10172), 678-688 (2019).
- Stupp, R., et al. Effect of tumor-treating fields plus maintenance temozolomide vs maintenance temozolomide alone on survival in patients with glioblastoma: a randomized clinical trial. Jama. 318 (23), 2306-2316 (2017).
- Desbaillets, N., Hottinger, A. F. Immunotherapy in glioblastoma: a clinical perspective. Cancers (Basel). 13 (15), 3721 (2021).
- Gularyan, S. K., et al. Investigation of inter- and intratumoral heterogeneity of glioblastoma using TOF-SIMS). Mol Cell Proteomics. 19 (6), 960-970 (2020).
- Brennan, C. W., et al. The somatic genomic landscape of glioblastoma. Cell. 155 (2), 462-477 (2013).
- Lathia, J. D., Mack, S. C., Mulkearns-Hubert, E. E., Valentim, C. L., Rich, J. N. Cancer stem cells in glioblastoma. Genes Dev. 29 (12), 1203-1217 (2015).
- Pollard, S. M., et al. Glioma stem cell lines expanded in adherent culture have tumor-specific phenotypes and are suitable for chemical and genetic screens. Cell Stem Cell. 4 (6), 568-580 (2009).
- Timerman, D., Yeung, C. M. Identity confusion of glioma cell lines. Gene. 536 (1), 221-222 (2014).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Kopper, O., et al. An organoid platform for ovarian cancer captures intra- and interpatient heterogeneity. Nat Med. 25 (5), 838-849 (2019).
- Lee, S. H., et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer. Cell. 173 (2), 515-528 (2018).
- Bian, S., et al. Genetically engineered cerebral organoids model brain tumor formation. Nat Methods. 15 (8), 631-639 (2018).
- Ogawa, J., Pao, G. M., Shokhirev, M. N., Verma, I. M. Glioblastoma model using human cerebral organoids. Cell Rep. 23 (4), 1220-1229 (2018).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Rep. 26 (12), 3203-3211 (2019).
- da Silva, B., Mathew, R. K., Polson, E. S., Williams, J., Wurdak, H. Spontaneous glioblastoma spheroid infiltration of early-stage cerebral organoids models brain tumor invasion. SLAS Discov. 23 (8), 862-868 (2018).
- Hubert, C. G., et al. A three-dimensional organoid culture system derived from human glioblastomas recapitulates the hypoxic gradients and cancer stem cell heterogeneity of tumors found in vivo. Cancer Res. 76 (8), 2465-2477 (2016).
- Jacob, F., et al. A patient-derived glioblastoma organoid model and biobank recapitulates inter- and intra-tumoral heterogeneity. Cell. 180 (1), 188-204 (2020).
- Nickl, V., et al. Glioblastoma-derived three-dimensional ex vivo models to evaluate effects and efficacy of tumor treating fields (TTFields). Cancers (Basel). 14 (21), 5177 (2022).
- Klein, E., Hau, A. C., Oudin, A., Golebiewska, A., Niclou, S. P. Glioblastoma organoids: pre-clinical applications and challenges in the context of immunotherapy. Front Oncol. 10, 604121 (2020).
- Golebiewska, A., et al. Patient-derived organoids and orthotopic xenografts of primary and recurrent gliomas represent relevant patient avatars for precision oncology. Acta Neuropathol. 140 (6), 919-949 (2020).
- Bougnaud, S., et al. Molecular crosstalk between tumour and brain parenchyma instructs histopathological features in glioblastoma. Oncotarget. 7 (22), 31955-31971 (2016).
- Chua, C. W., et al. Single luminal epithelial progenitors can generate prostate organoids in culture. Nat Cell Biol. 16 (10), 951-954 (2014).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. J Neurosci Methods. 59 (1), 5-9 (1995).
- Kato, H., Ogawa, T. A technique for preparing in vitro slices of cat's visual cortex for electrophysiological experiments. J Neurosci Methods. 4 (1), 33-38 (1981).
- Teyler, T. J. Brain slice preparation: hippocampus. Brain Res Bull. 5 (4), 391-403 (1980).
- Schulz, E., et al. Preparation and culture of organotypic hippocampal slices for the analysis of brain metastasis and primary brain tumor growth. Methods Mol Biol. 2294, 59-77 (2021).
- Driehuis, E., Gracanin, A., Vries, R. G. J., Clevers, H., Boj, S. F. Establishment of pancreatic organoids from normal tissue and tumors. STAR Protoc. 1 (3), 100192 (2020).
- Driehuis, E., et al. Pancreatic cancer organoids recapitulate disease and allow personalized drug screening. Proc Natl Acad Sci U S A. 116 (52), 26580-26590 (2019).
- Neal, J. T., et al. Organoid modeling of the tumor immune microenvironment. Cell. 175 (7), 1972-1988 (2018).
- Li, X., et al. Oncogenic transformation of diverse gastrointestinal tissues in primary organoid culture. Nat Med. 20 (7), 769-777 (2014).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nat Med. 15 (6), 701-706 (2009).
- Zhao, Z., et al. Organoids. Nat Rev Methods Primers. 2, 94 (2022).
- Toh, Y. C., et al. A novel 3D mammalian cell perfusion-culture system in microfluidic channels. Lab Chip. 7 (3), 302-309 (2007).
- Zhang, C., Zhao, Z., Abdul Rahim, N. A., van Noort, D., Yu, H. Towards a human-on-chip: culturing multiple cell types on a chip with compartmentalized microenvironments. Lab Chip. 9 (22), 3185-3192 (2009).
- Homan, K. A., et al. Flow-enhanced vascularization and maturation of kidney organoids in vitro. Nat Methods. 16 (3), 255-262 (2019).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Kengla, C., Atala, A., Sang Jin, L. Bioprinting of organoids. Essentials of 3D Biofabrication and Translation. , 271-282 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved