الحفظ بالتبريد للخلايا الجرثومية البدائية وإحياء سلالات ذبابة الفاكهة
* These authors contributed equally
In This Article
Summary
من المرغوب فيه للغاية اتباع طريقة طويلة الأجل للحفاظ على سلالات ذبابة الفاكهة كبديل للنقل المتكرر للذباب البالغ إلى قوارير الطعام الطازج. يصف هذا البروتوكول الحفظ بالتبريد للخلايا الجرثومية البدائية لذبابة الفاكهة وإحياء السلالة عن طريق زرعها في أجنة مضيفة غير متجانسة.
Abstract
يجب الحفاظ على سلالات ذبابة الفاكهة عن طريق النقل المتكرر للذباب البالغ إلى قوارير جديدة. هذا يحمل خطر التدهور الطفري والتغيرات المظهرية. لذلك فإن تطوير طريقة بديلة للحفظ على المدى الطويل دون مثل هذه التغييرات أمر حتمي. على الرغم من المحاولات الناجحة السابقة ، لا يزال الحفظ بالتبريد لأجنة ذبابة الفاكهة غير مفيد عمليا بسبب انخفاض قابلية التكاثر. هنا ، نصف بروتوكولا للحفظ بالتبريد للخلايا الجرثومية البدائية (PGC) وإحياء السلالة عن طريق زرع PGCs المحفوظة بالتبريد في الأجنة المضيفة لذبابة الفاكهة الميلانية (D. melanogaster). تعتبر PGCs عالية النفاذية لعوامل الحماية بالتبريد (CPAs) ، والتباين التنموي والمورفولوجي بين السلالات أقل إشكالية من الحفظ بالتبريد للأجنة. في هذه الطريقة ، يتم جمع PGCs من حوالي 30 جنينا مانحا ، ويتم تحميلها في إبرة بعد علاج CPA ، ثم يتم حفظها بالتبريد في النيتروجين السائل. لإنتاج الأمشاج المشتقة من المتبرعين، يتم إذابة الخلايا الجذعية المركزة المحفوظة بالتبريد في إبرة ثم ترسبها في حوالي 15 جنينا مضيفا أجاميا. تم تحقيق تردد لا يقل عن 15٪ من الذباب الخصب باستخدام هذا البروتوكول ، وكان عدد النسل لكل زوجين خصبين دائما أكثر من كاف لإحياء السلالة الأصلية (متوسط عدد النسل هو 77.2 ± 7.1) ، مما يشير إلى قدرة PGCs المحفوظة بالتبريد على أن تصبح خلايا جذعية جرثومية. كان متوسط عدد الذباب الخصب لكل إبرة 1.1 ± 0.2 ، و 9 من أصل 26 إبرة أنتجت ذريتين خصبتين أو أكثر. وقد وجد أن 11 إبرة تكفي لإنتاج 6 ذرية أو أكثر ، حيث من المحتمل أن يتم تضمين أنثى واحدة على الأقل ورجل واحد. يجعل المضيف agametic من الممكن إحياء السلالة بسرعة ببساطة عن طريق عبور الذباب الإناث والذكور الناشئين حديثا. بالإضافة إلى ذلك ، فإن PGCs لديها القدرة على استخدامها في تطبيقات الهندسة الوراثية ، مثل تحرير الجينوم.
Introduction
إن الحفاظ على سلالات ذبابة الفاكهة عن طريق نقل الذباب البالغ إلى قوارير طعام جديدة يؤدي حتما إلى تراكم الطفرات والتغيرات اللاجينية بمرور الوقت. من الضروري تطوير طريقة بديلة للصيانة طويلة الأجل لسلالات ذبابة الفاكهة دون مثل هذه التغييرات ، خاصة بالنسبة للسلالات المرجعية التي يجب الحفاظ على الجينوم بأكمله فيها. تم وصف العديد من المحاولات الناجحة لحفظ أجنة ذبابة الفاكهة أو المبايض بالتبريد1،2،3. لسوء الحظ ، لا تزال غير ذات فائدة عملية بسبب انخفاض قابلية التكاثر. في الواقع ، تتمتع الأجنة في المراحل المبكرة بمعدل بقاء منخفض بعد الحفظ بالتبريد بسبب محتواها العالي من صفار البيض ، مما يعيق تغلغل عامل الحماية بالتبريد (CPA) وانتشاره 2,3. كما أن نفاذية CPA محدودة للغاية بسبب الطبقات الشمعية للأجنة في المرحلة المتأخرة. من الصعب ويستغرق وقتا طويلا العثور على فترة زمنية خاصة بالسلالة يكون فيها للأجنة معدل بقاء مرتفع وطبقة شمعية أرق. في الآونة الأخيرة ، قام Zhan et al.4 بتحسين طرق نفاذية الجنين ، وتحميل CPA ، والتزجيج وحفظ الأجنة بالتبريد بنجاح من سلالات متعددة. ومع ذلك ، فإن الطرق ليست سهلة التطبيق لأن صلاحية الأجنة بعد النفاذية تميل إلى أن تكون ضعيفة. ولذلك، لا تزال هناك حاجة إلى مزيد من التحسين وتطوير النهج البديلة. الطرق التي تنطوي على الحفظ بالتبريد للخلايا الجرثومية البدائية (PGCs) هي نهج بديل للصيانة طويلة الأجل لسلالات ذبابة الفاكهة.
تم استخدام زرع PGC (وتسمى أيضا خلية القطب) لتوليد الوهم الجرثومي ، وخاصة الإناث ، لدراسة عمليات مثل التأثيرات الأمومية للطفرات القاتلة الوزيجوتية وتحديد جنس الخلايا الجرثومية5،6،7،8،9،10،11،12. PGCs أصغر بكثير من الأجنة ومن المحتمل أن تكون عالية النفاذية لمعظم المواد الواقية بالتبريد. علاوة على ذلك ، فإن التباين التنموي والمورفولوجي بين السلالات أقل إشكالية ، والمضيف الأمامي يتيح الاستعادة السريعة للجينومات الكاملة. لقد طورنا مؤخرا طريقة جديدة للحفظ بالتبريدPGC 13 ، والتي تمنع التغيرات الجينية واللاجينية الحتمية في سلالات ذبابة الفاكهة . هنا ، نقدم البروتوكول المفصل.
تتطلب طريقة الحفظ بالتبريد هذه خبرة محددة في التعامل مع PGC والأجهزة. في حين أن النهج التدريجي قد يكون حلا فعالا لأولئك الذين ليسوا على دراية به ، فقد يكون غير مناسب للمختبرات الصغيرة بسبب متطلبات الأجهزة. يمكن تكييف بروتوكول الحفظ بالتبريد PGC هذا بسهولة أكبر للاستخدام مع أنواع مختلفة من ذبابة الفاكهة وأنواع مختلفة من الحشرات مقارنة ببروتوكولات الحفظ بالتبريد للأجنة بسبب الاختلافات التنموية والمورفولوجية الأصغر. يمكن أيضا استخدام PGCs في تطبيقات الهندسة الوراثية ، مثل تحرير الجينوم14،15،16. باختصار ، يمكن استخدام هذه الطريقة في مراكز المخزون والمختبرات الأخرى للحفاظ على سلالات الذباب والحشرات الأخرى لفترات طويلة من الزمن دون تغييرات.
Protocol
1. إعداد المعدات
- نظام المناور الدقيق: قم بتجميع نظام micromanipulator لجمع الخلايا وزرعها (الشكل 1 أ).
- شرائح زجاجية من مجموعة PGC (الشكل 2 أ)
- لتحضير غراء الهيبتان ، اقطع شريطا على الوجهين بطول 30 سم تقريبا وانقعه طوال الليل في 7 مل من محلول الهيبتان التقني (العادي).
- ارسم خطين مرجعيين متوازيين لمحاذاة الجنين على ظهر شريحة زجاجية.
- انشر قطرات من غراء السباعي أعلاه على الشريحة الزجاجية (على الجانب بدون الخطوط) باستخدام ماصة باستور. جفف سطح الشريحة في الهواء حتى يصبح لونه أبيض.
- كرر إضافة ونشر قطرات الغراء السباعي وجفف الشريحة مرة أخرى.
ملاحظة: يمنع الغراء المحاليل السائلة من الانتشار على السطح المستوي ويسهل تحميل المحاليل المائية في إبرة. - لصنع إطارات تجمع الأجنة ، قم بلصق ثلاث طبقات من شريط الفينيل القياسي بسمك 0.2 مم ، مثل الشريط الكهربائي ، على لوح التقطيع. قطع الشريط إلى مستطيلات بعرض 1.5 سم. بعد ذلك ، قم بقطع جميع طبقات الشريط الثلاث ، وترك إطارا من 2 إلى 3 مم.
ملاحظة: يتم تثبيت إطار تجمع الأجنة بعد محاذاة الأجنة ، لتشكيل تجمع للأجنة.
- إبر الزرع
ملاحظة: كانت جميع الإبر المتاحة تجاريا في وقت هذه الدراسة ضيقة جدا أو واسعة جدا بحيث لا يمكن حفظها بالتبريد PGC.- اصنع إبرة باستخدام شعرية زجاجية ومجتذب. نستخدم مجتذب NARISHIGE PN-31 بمستوى سخان عند 85.0-98.4 ، والمستوى الرئيسي للمغناطيس عند 57.8 ، والمستوى الفرعي للمغناطيس عند 45.0.
- لصنع إبرة بسمك جدار تقريبي يبلغ 1 ميكرومتر وطرف يبلغ طوله حوالي 200 ميكرومتر بقطر داخلي يتراوح بين 10 و 12 ميكرومتر ، قم بتلميع طرف الإبرة في العملية التالية المكونة من ثلاث خطوات (الشكل 3). أولا ، قم بطحن طرف الإبرة بزاوية 30 درجة بسرعة 780 دورة في الدقيقة حتى يبلغ قطر الطرف الداخلي 10-12 ميكرومتر. تستغرق خطوة الطحن الأولى حوالي 1 ساعة.
ملاحظة: لتجنب كسر طرف الإبرة ، قم أولا بتدوير حجر الطحن ثم حرك الإبرة برفق لأسفل على حجر الطحن. - ارسم خطا أعلى الإبرة لتتبع الزاوية المطلوبة. قم بتدوير الإبرة عكس اتجاه عقارب الساعة عند 90 درجة وقم بتلميعها مرة أخرى بسرعة 180 دورة في الدقيقة. يستغرق هذا حوالي 5 دقائق.
- قم بتدوير الإبرة في اتجاه عقارب الساعة 45 درجة وقم بتلميعها بسرعة 180 دورة في الدقيقة لمدة ثانية واحدة.
- ضع شريحة زجاجية مع قطرة من خليط حمض الكروم (تنبيه: سامة) على مرحلة المجهر. قم بتوصيل الإبرة بالحامل الشعري (الشكل 1 د) بزاوية 10 درجات -13 درجة بالنسبة لسطح الشريحة ، وحرك الإبرة بعناية لأسفل ، واغمر الطرف في خليط حمض الكروم.
- عن طريق سحب المكبس ودفعه (الشكل 1 ب) ، قم بتحميل المحلول وتفريغه ميكانيكيا من الإبرة عدة مرات لإزالة حطام الزجاج في الإبرة. تأكد من تنظيف الجدار الخارجي أيضا.
- اغسل الإبرة من الداخل والخارج مرتين بالماء المقطر لإزالة حمض الكروميك تماما.
2. جمع وحفظ PGCs بالتبريد
- جمع الأجنة
- نقل عدد مناسب من الذباب من سلالة المتبرع محل الاهتمام (حوالي 450 لكل جنس لكوب جمع الأجنة) إلى كوب جمع الأجنة مع لوحة جمع الأجنة (الشكل 1E) واحتضانها عند 25 درجة مئوية. عادة ما نستخدم الذباب الأبوي البالغ من العمر 3 إلى 5 أيام والذي يتم تربيته في ظل ظروف أقل ازدحاما في درجة حرارة الغرفة (23-25 درجة مئوية).
- قم بإجراء مجموعتين مسبقتين لمدة 30 دقيقة وتخلص من أي بيض تم وضعه. نظرا لأن الإناث يمكنها الاحتفاظ بالبويضات المخصبة التي تتطور في قناة البيض ، فإن هذه الخطوة مطلوبة لمزامنة وضع البيض في الخطوة 2.1.3 (الشكل 4).
- بعد المجموعتين المسبقتين ، اجمع الأجنة لمدة 50 دقيقة ثم احتضان الأجنة المجمعة في غرفة رطبة عند 25 درجة مئوية للسماح للأجنة بالتطور إلى مرحلة البلاستوديرم (المرحلة المبكرة 517). عادة ما يكون وقت الحضانة 100 دقيقة ولكن يمكن تمديده حتى 120 دقيقة ، اعتمادا على السلالة (الشكل 4).
ملاحظة: يتم عمل غرفة مرطبة عن طريق وضع منشفة ورقية رطبة في قاع صندوق بلاستيكي ورشها برذاذ من الماء قبل الاستخدام. في المرحلة المبكرة من الأجنة 5 ، يكتمل تكوين PGC ، لكن الخلوية الجسدية ليست كذلك. يتم تحديد المرحلة الدقيقة للجنين تحت المجهر المركب في الخطوة 2.4.
- إزالة الأجنة المؤينة
- قم بإيداع قطرة من الماء المقطر على مصفاة شبكية من الفولاذ المقاوم للصدأ (150 شبكة ، فتحة 109 ميكرومتر ، قطر سلك 60 ميكرومتر ؛ الشكل 1F). باستخدام ملقط ، اجمع الأجنة من لوحة جمع الأجنة وضعها في قطرة الماء.
- اضغط على المناديل الورقية على المصفاة من الأسفل لامتصاص الماء. أضف قطرات من محلول هيبوكلوريت الصوديوم الطازج بنسبة 5٪ (مثل Cl) إلى الأجنة واضغط باستمرار على المصفاة لمدة 10 ثوان.
- اغسل الأجنة عن طريق رشها مباشرة بالماء المقطر واضغط على المناديل الورقية على المصفاة من الأسفل لامتصاص الماء. كرر هذه الخطوة 3x.
- محاذاة الأجنة المنزوعة الأيونات
- تحت المجهر المجسم ، استخدم ملقط لنقل الأجنة. قم بمحاذاة الأجنة المنزوعة الأيونات في صفين على شريحة زجاجية من مجموعة PGC على طول الخطين المرجعيين (الشكل 2 أ). يتم توجيه الأجنة مع الجزء الأمامي إلى اليمين (الجانب المراد التلاعب به) والجانب البطني لأعلى.
ملاحظة: يجب الانتهاء من هذه الخطوة في غضون 20 دقيقة ، حيث نقوم عادة بمحاذاة ما يقرب من 40 جنينا. - قم بتثبيت إطار تجمع الأجنة حول الأجنة على الشريحة الزجاجية لمجموعة PGC. قم بإسقاط 1 ميكرولتر من محلول CPA (1x محلول Ephrussi-Beadle Ringer ، EBR ، يحتوي على 20٪ إيثيلين جلايكول و 1 متر سكروز ؛ 1x EBR: 130 mM NaCl ، 5 mM KCl ، 2 mM CaCl2 ، و 10 mM Hepes عند درجة الحموضة 6.9) في نقطتين منفصلتين في المنطقة المحاطة بالإطار واملأ المسبح بزيت السيليكون لمنع الأجنة من الجفاف (الشكل 2 أ).
ملاحظة: لتحضير محلول CPA ، قم بإذابة 10.26 جم من السكروز تماما في حوالي 20 مل من H2O المقطر الذي يحتوي على 3 مل من 10 × محلول EBR. أضف 6 مل من جلايكول الإيثيلين ثم أضف H2O المقطر حتى 30 مل. بعد الخلط الشامل ، قم بتصفية المحلول من خلال غشاء يمكن التخلص منه 0.22 مم.
- تحت المجهر المجسم ، استخدم ملقط لنقل الأجنة. قم بمحاذاة الأجنة المنزوعة الأيونات في صفين على شريحة زجاجية من مجموعة PGC على طول الخطين المرجعيين (الشكل 2 أ). يتم توجيه الأجنة مع الجزء الأمامي إلى اليمين (الجانب المراد التلاعب به) والجانب البطني لأعلى.
- جمع PGCs
- ضع الشريحة الزجاجية لمجموعة PGC للخطوة 2.3.2 على مرحلة المجهر المجهز بنظام مناور دقيق. قم بتوصيل الإبرة بالحامل الشعري وجلب الجنين الأول في الصف الأيسر وطرف الإبرة إلى نفس المستوى البؤري. قم بتحميل زيت السيليكون في الإبرة لمدة 2-3 ثوان.
- ابدأ جمع PGC من الأجنة في الصف الأيسر. باستخدام عدسة موضوعية 20x ، حرك طرف الإبرة برفق إلى سطح الطرف الأمامي للجنين واخترق الجنين نحو الطرف الخلفي ، ليس عن طريق تحريك الإبرة ولكن عن طريق تحريك مرحلة المجهر.
- عندما يصل طرف الإبرة إلى الطرف الخلفي ، اسحب الإبرة قليلا وقم بتفريغ أي صفار في الإبرة داخل طبقة الخلية الجسدية مباشرة.
- مع الحفاظ على الضغط في الإبرة ثابتا ، انقل طرف الإبرة إلى PGCs داخل القطب الخلفي مباشرة وبرفق ، ولكن دون أخذ الكثير من الوقت ، قم بتحميل PGCs.
- اسحب الإبرة من الجنين بسرعة وقم بتفريغ صفار البيض والملوثات الأخرى من الإبرة إلى حوض زيت السيليكون ، مع إبقاء PGCs في الإبرة. ثم قم بتحميل زيت السيليكون النظيف من حمام السباحة.
- كرر الخطوات من 2.4.2 إلى 2.4.5 للأجنة الأخرى في الصف الأيسر. قبل جمع PGCs من جنين جديد ، قم بإيداع أكبر قدر ممكن من زيت السيليكون المحمل في الخطوة 2.4.5 داخل طبقة الخلية الجسدية قدر الإمكان مع الاحتفاظ ب PGCs المحملة في الإبرة. وهذا يضمن أن تكون PGCs المحملة حديثا مجاورة ل PGCs التي تم جمعها مسبقا دون أي مواد متداخلة بينها.
- بعد الانتهاء من جمع PGC من الأجنة في الصف الأيسر ، افصل PGCs عن صفار البيض والملوثات الأخرى قدر الإمكان. لتحقيق ذلك ، قم بإيداع جميع PGCs في الإبرة على سطح الجنين وإزالة أي صفار أو ملوثات أخرى إلى جنين مجاور آخر.
- بعد ذلك ، اجمع PGCs من الأجنة في الصف الأيمن. اجمع بين PGCs التي تم جمعها من الصفين الأيمن والأيسر.
- تطبيق عامل الحماية بالتبريد (CPA) على PGCs
- بعد غسل الإبرة باستخدام CPA في قطرة واحدة ، قم بتحميل CPA جديد في قطرة أخرى في الإبرة وأضف CPA إلى PGCs المودعة على الجنين. يجب أن يكون حجم CPA معادلا لحجم PGCs.
- قم بإزالة أكبر قدر ممكن من CPA من مجموعة PGCs 1-2 s بعد إضافة CPA. تتقلص PGCs قليلا وتصبح مربعة الشكل مباشرة بعد إضافة CPA.
- أفرغ الإبرة ثم قم بتحميل زيت السيليكون لمدة 5 ثوان أو أكثر. قم بتحميل جميع PGCs المجمعة ثم قم بتحميل زيت السيليكون مرة أخرى لمدة 5 ثوان أو أكثر. تقع PGCs الآن بين طبقتين من زيت السيليكون (الشكل 2B).
ملاحظة: من المهم إزالة أكبر قدر ممكن من صفار البيض و CPA والملوثات الأخرى.
- PGCs الحفظ بالتبريد
- افتح المحبس ثلاثي الاتجاهات (الشكل 1C) ثم افصل الإبرة عن المعالج الدقيق. امسح الزيت عن سطح الإبرة بورق مناديل ناعم. لا تلمس طرف الإبرة مباشرة بالمنديل.
- قم بتوصيل الإبرة بحامل الإبرة وثبتها في موضعها عند القاعدة باستخدام شريط فينيل (الشكل 1H). ضع ملصقا على أنبوب الحامل.
- قم بتجميد الحامل مع توجيه الإبرة لأسفل عن طريق غمرها في النيتروجين السائل. لا تحرر الحامل حتى يتوقف السائل عن الخروج من الرف.
- قم بتخزين الحامل في خزان تخزين النيتروجين السائل في منطقة الطور السائل ، وليس منطقة طور البخار.
3. إذابة وزرع PGCs
- جمع الأجنة وتفكيكها ومحاذاتها من الذباب المضيف الأمامي
- جمع وتفكيك الأجنة من الذباب المضيف الأمامي باتباع الخطوة 2.
- قم بمحاذاة أجنة المضيف الأمشامي من المرحلة 5 على شريحة زجاجية للزراعة. ومع ذلك ، هذه المرة ، قم بتوجيه الخلف إلى اليمين (الجانب المراد التلاعب به) والبطني إلى الأعلى (الشكل 5). اصطف ما يقرب من 30 جنينا في صفين في 20 دقيقة.
- أثناء محاذاة الأجنة ، قم بتشغيل المرطب لمدة 2-10 دقائق إذا كانت رطوبة الغرفة تتطلب ذلك (الجدول 1). الرطوبة المثالية هي 30٪ إلى 40٪ ، ولكن هذا يمكن أن يختلف حسب الظروف الحرارية.
- إذابة وزرع PGCs في الأجنة المضيفة
- لإذابة PGCs المحفوظة بالتبريد بسرعة ، قم بإدخال الحامل الذي يحتوي على الإبرة في محلول EBR بدرجة حرارة الغرفة 1x مع توجيه الإبرة لأسفل واحتفظ بها مغمورة لمدة 10 ثوان.
- ضع الشريحة الزجاجية للزراعة على مسرح المجهر. قم بتوصيل الإبرة المذابة بالتجميد بحامل الشعيرات الدموية وجلب الجنين الأول في الصف الأيسر وطرف الإبرة إلى نفس المستوى البؤري.
- باستخدام عدسة موضوعية 20x ، حرك طرف الإبرة برفق إلى سطح الطرف الخلفي للجنين.
- حرك الجزء الخارجي من كل جنين برفق وتأكد من عودته ببطء إلى شكله الأصلي. سيؤكد الحث أن الضغط الداخلي للجنين ليس مرتفعا جدا أو منخفضا جدا.
- حرك الإبرة برفق واخترق الجنين من القطب الخلفي.
- قم بإيداع ما يقرب من 10-20 PGCs برفق داخل القطب الخلفي مباشرة ، على وجه التحديد بين غشاء vitelline وطبقة الخلايا الجسدية للجنين. تجنب إيداعها في طبقة الخلايا الجسدية. إذا تسرب السائل المحيطي من الجنين ، فقم بامتصاص السائل المتسرب في الإبرة وإزالته.
- سحب الإبرة من الجنين. كرر الخطوتين 3.2.5 و3.2.6 للأجنة اللاحقة.
4. احتضان الأجنة واستعادة سلالات المتبرعين
- قم بإزالة أي أجنة لا تتلقى PGCs المزروعة واحتضان الأجنة المتبقية في غرفة مرطبة (الشكل 1G) عند 25 درجة مئوية.
- في 24 ساعة أو أكثر بعد الزرع وفي أقرب وقت ممكن بعد الفقس ، استخدم الملقط لالتقاط ونقل اليرقات المفرغة إلى قوارير طعام ذبابة الفاكهة القياسية واحتضانها عند 25 درجة مئوية.
- لإحياء السلالة ، اعبر الإناث والذكور الذين ظهروا حديثا (الشكل 6).
ملاحظة: المضيفات الأمجمية تجعل من الممكن استعادة الجينوم بأكمله مرة واحدة دون العبور إلى سلالات كروموسوم الموازن. لن يكون التعايش بين الذكور الأمشامية في قارورة مهما لأن الإناث ، حتى لو تزاوجن معهم ، لا تظهر استجابات طويلة الأجل بعد التزاوج ، بما في ذلك انخفاض تقبل إعادة18,19.
Representative Results
تم الإبلاغ عن كفاءة زرع PGC المحفوظة بالتبريد بواسطة Asaoka et al.13 وترد في الجدول 2 لزراعة PGCs المحفوظة بالتبريد لمدة يوم واحد أو أكثر في النيتروجين السائل. كان معدل الفقس 168/208 أجنة مزروعة (80.8٪) ، وكانت صلاحية الجنين إلى البالغين 87/208 (41.8٪). كان تواتر الذباب الخصب 28/87 (32.2٪). لم يختلف هذا التردد بين PGCs المحفوظة بالتبريد لمدة 8 إلى 30 يوما وتلك المحفوظة بالتبريد لمدة 31-150 يوما (20/57 مقابل 8/30 ، G '= 0.63 ، p >0.1 ، d.f. = 1). كان متوسط عدد النسل لكل زوجين 77.2 ± 7.1 (ن = 18 ، 28-122) ، مما يشير إلى قدرة PGCs المحفوظة بالتبريد على أن تصبح خلايا جذعية جرثومية. من بين 26 إبرة ، أنتجت 10 إبر ذرية خصبة ، وأنتجت 7 إبر ذرية خصبة واحدة ، وأنتجت 7 إبر ذرية خصبة 2 ، وأنتجت 2 إبر 3 أو 4 ذرية خصبة. كان متوسط عدد الذباب الخصب لكل إبرة 1.1 ± 0.2. بناء على هذه البيانات ، بثقة 95٪ ، تكفي 11 إبرة لإنتاج 6 ذرية أو أكثر ، حيث من المحتمل أن يتم تضمين أنثى واحدة على الأقل ورجل واحد.
في التجارب المذكورة أعلاه ، استخدمنا الأجنة التي تعبر عن ovo-A mRNA في PGCs (nanos >ovo-A ، OvoA_OE embryos) كمضيف أجامي. من بين 669 أنثى F1 و 720 من ذكور F1 المنتجة من الأزواج النانوية > البيضو-A المزروعة ، لم يكن هناك هروب مشتق من PGCs المضيفة. العديد من طفرات أوسكار (osk) هي أيضا جامية حساسة لدرجة الحرارة20,21. نظرا لأن متحولة osk ذات الصلاحية العالية للزيجوت المتماثل والنمط الظاهري الأمامي لم تعد متوفرة ، فقد أعدنا إنشاء osk [8] متحولة خاطئة20 بواسطة تحرير الجينوم بمساعدة CRISPR / Cas9. كانت هذه الذباب غير متجانسة تماما (0 هاربين من أصل 230 أنثى و 192 ذكرا) عند 25 درجة مئوية ، لكن عددا قليلا من الهاربين ظهروا عند 23 درجة مئوية (1 من 248 أنثى و 1 من 290 ذكرا). وبالتالي يوصى باستخدام nanos>ovo-A كأجنة مضيفة غير أجامية. سيتوفر كل من مخزون UASp-ovo-A و nanos-Gal4 13 قريبا من مركز KYOTO Drosophila Stock Center.

الشكل 1: المعدات المطلوبة. أ: جهاز مناور دقيق لجمع الخلايا وزرعها. ط) المجهر المقلوب ، ب) ميكرومانيبولاتور ميكانيكي ، ج) حقنة ، د) حامل شعري ، v) محبس ثلاثي الاتجاهات ، السادس) مرطب ، و vii) مجهر ستيريو. ب: حقنة. (ج) أنبوب محبس ثلاثي الاتجاهات وأنبوب سيليكون يربطان حقنة وحاملا شعريا. (د) ترتبط إبرة وحامل شعري بمناولة دقيقة. ه: كوب جمع الأجنة مع صفيحة جمع الأجنة (قطرها ٦ سم، ارتفاعها ٧٫٧ سم). (F) مصفاة شبكية من الفولاذ المقاوم للصدأ. (ز) وعاء يستخدم كغرفة رطبة مع شريحة زجاجية. للحفاظ على الرطوبة ، ضع الورق المبلل في الأسفل وأغلق الغطاء. (ح) حامل إبرة بإبرة للحفظ بالتبريد. (ط) رف تخزين للحفظ بالتبريد وصندوق به إبر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
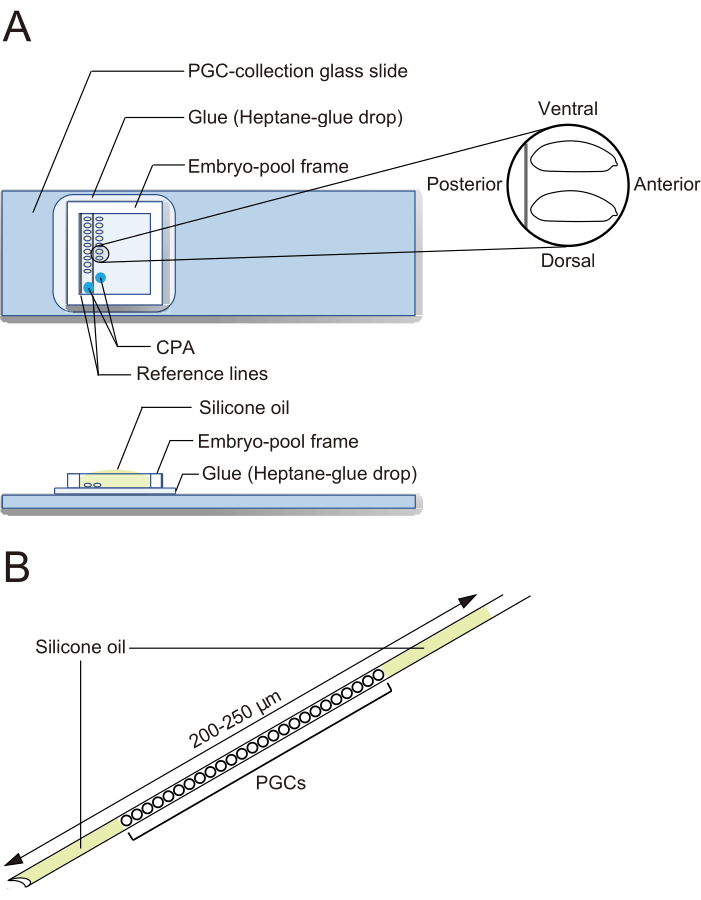
الشكل 2: شريحة زجاجية من مجموعة PGC وإبرة حفظ بالتبريد. (أ) شريحة زجاجية من مجموعة الخلايا الجرثومية البدائية (PGC) مغلفة بالغراء. يتم محاذاة الأجنة المنزوعة الأيونات في صفين وتوجيهها مع الجزء الأمامي إلى اليمين (الجانب المراد التلاعب به) والجانب البطني لأعلى. يتم تثبيت إطار تجمع الأجنة ، ويتم ترسيب قطرتين من محلول عوامل الحماية بالتبريد (CPA) ، ويتم ملء المسبح بزيت السيليكون. (ب) يجب أن تحتوي الإبرة على كمية صغيرة قدر الإمكان من صفار البيض والملوثات الأخرى. تقع PGCs بين طبقتين من زيت السيليكون عند حفظها بالتبريد في النيتروجين السائل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
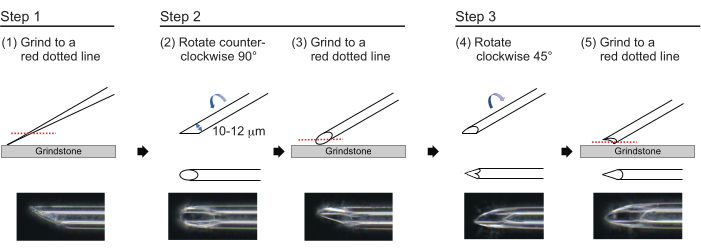
الشكل 3: صنع الإبرة. طريقة تلميع الطرف المكونة من ثلاث خطوات لعمل إبرة بحجم ثقب مناسب وطرف حاد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
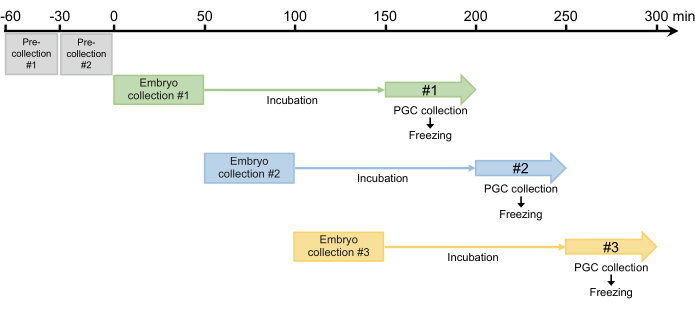
الشكل 4: مخطط جمع الأجنة. بعد مجموعتين مسبقتين ، نجمع عادة ثلاث أو أربع مرات في اليوم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
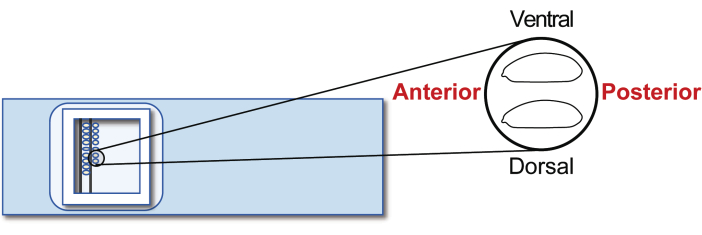
الشكل 5: محاذاة جنين المضيف. محاذاة الأجنة المضيفة على شريحة زجاجية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
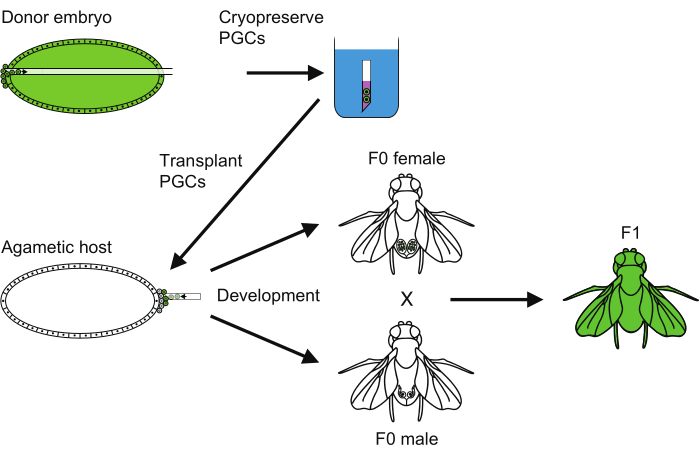
الشكل 6: نظرة عامة على طريقة الحفظ بالتبريد PGC. نظرة عامة على جميع الخطوات المتبعة لتنفيذ الحفظ بالتبريد للخلية الجرثومية البدائية (PGC). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| رطوبة الغرفة | |||
| < 30٪ | ~ 30٪ | > 30٪ | |
| محاذاة الأجنة المضيفة (~20 دقيقة) | استخدم مرطب لمدة 2 - 10 دقائق | استخدم مرطب بشكل متقطع لمدة 1 دقيقة | لا تستخدم المرطب |
| ذوبان الجليد PGCs المانحة | لا ينطبق | لا ينطبق | لا ينطبق |
| PGCs الجافة بالهواء | حذف هذه الخطوة | حذف هذه الخطوة | 5 دقائق |
| ضع زيت السيليكون | لا ينطبق | لا ينطبق | لا ينطبق |
| زرع PGCs | لا ينطبق | لا ينطبق | لا ينطبق |
| يجب التخلص من كل هذه الخطوات في 50 دقيقة. | |||
الجدول 1: تجفيف الأجنة أثناء محاذاة الجنين وذوبان PGC.
| سلالة المتبرعين | فترة الحفظ بالتبريد | عدد الأجنة المزروعة (أ) | عدد اليرقات المفرغة (ب) (الفقس ، ب / أ) | عدد البالغين المغلقين (C) (صلاحية البيض إلى البالغين ، C / A) | عدد البالغين الخصبين (د) (تواتر الذباب الخصيب ، D / C) |
| م17 | 8 - 30 يوما | 134 | 108 (80.6%) | 57 (42.5%) | 20 (35.1%) |
| م17 | 31 - 150 يوما | 74 | 60 (81.1%) | 30 (40.5%) | 8 (26.7%) |
| M17: الطقسوس. TM6B, P{Dfd-GMR-nvYFP}4, Sb[1] Tb[1] ca[1]/ Pri[1] | |||||
الجدول 2: كفاءة زراعة PGC المحفوظة بالتبريد. تم تعديل هذا الجدول من13. جميع البيانات من مضيفين agametic.
Discussion
أحد العوامل الحاسمة للنجاح في الحفظ بالتبريد PGC وإحيائه هو استخدام أجنة جيدة. يجب استخدام الإناث الشابات (على سبيل المثال ، من 3 إلى 5 أيام) لجمع الأجنة. يتم تقييم كل من الأجنة المانحة والمضيفة عن طريق الفحص المجهري ، ويتم استخدام فقط تلك الموجودة في مرحلة البلاستوديرم (المرحلة 5)12. بالنسبة لجمع PGC ، نقوم عادة بمحاذاة ما يقرب من 40 جنينا متبرعا في فترة 20 دقيقة ونجمع PGCs من حوالي 30 جنينا في المرحلة المبكرة 5 ؛ لا يتم استخدام الأجنة القديمة والمعيبة. بعد الحفظ بالتبريد والذوبان ، يجب أن تحافظ PGCs على شكلها ؛ تمزق PGCs في الحفظ غير الناجح. يجب أن تكون الأجنة المضيفة أيضا في المرحلة 5 ولها ضغط داخلي معتدل. يجب أن تعود الأجنة ببطء إلى شكلها الأصلي بعد الحث اللطيف. لن تتطور الأجنة المجففة بشكل مفرط وغير كاف بشكل طبيعي بعد الزرع. نظرا لأن زرع PGCs من جنسين مختلفين يفشل في إنتاج الأمشاج في ذبابة الفاكهة 5,10 ، فمن المرجح أن يؤدي زرع PGCs من أجنة مانحة متعددة إلى أجنة مضيفة إلى إنتاج بالغين خصبين. تحقيقا لهذه الغاية ، نقوم عادة بجمع PGCs من حوالي 30 جنينا لكل إبرة.
كمواد واقية من البرودة ، جربنا جلايكول الإيثيلين وثنائي ميثيل سلفوكسيد والجلسرين مع السكروز بتركيزات مختلفة. قررنا EBR التي تحتوي على 20٪ جلايكول الإيثيلين والسكروز 1 M لتكون أفضل13. ومع ذلك ، فإن استخدام مواد واقية مختلفة من التبريد قد يحسن حفظ PGC22.
تتطلب طريقة الحفظ بالتبريد هذه مهارات متخصصة في التعامل مع PGC ، وهناك حاجة إلى ما يقرب من 6 أسابيع من التدريب لجمع وزرع PGCs بشكل مريح. لتقييم وتحسين الكفاءة في المهارات ، يمكن تقسيم ذلك إلى ست خطوات تدريبية: 1) محاذاة الأجنة على شريحة زجاجية ، 2) التحكم في مناور ، 3) زرع PGCs من جنين إلى جنين آخر دون الحفظ بالتبريد ، 4) زرع PGCs من 10 أجنة أو أكثر إلى 5 إلى 10 أجنة ، 5) زرع PGCs بعد تطبيق CPA ، و 6) زرع PGCs بعد ذوبان الجليد. كل خطوة قد تستغرق 1 أسبوع. الأهداف قصيرة المدى في الخطوة 3 هي معدل الفقس بنسبة 40٪ ، وقابلية بقاء الجنين إلى البالغين بنسبة 10٪ -20٪ ، وتكرار الذباب الخصب بنسبة 20٪.
يتطلب الحفظ بالتبريد PGC أجهزة مكلفة وموظفين ذوي مهارات عالية. لذلك ، قد لا يتم اعتماد هذه الطريقة من قبل العديد من المختبرات. ومع ذلك ، فإن طريقة PGC الحالية لها عدة جوانب مهمة. أولا، PGCs أصغر بكثير من الأجنة وهي شديدة النفاذية للمواد الواقية بالتبريد. في المقابل ، فإن نفاذية الحماية بالتبريد محدودة للغاية بسبب الطبقات الشمعية لأجنة ذبابة الفاكهة ، وهي أخطر مشكلة في حفظ الأجنة بالتبريد. في الواقع ، بذلت الدراسات السابقة جهودا كبيرة لإيجاد نافذة زمنية تتمتع فيها الأجنة بمعدل بقاء مرتفع وطبقة شمعية أرق. والثاني يتعلق بالتباين التنموي والمورفولوجي بين السلالات. يتم جمع PGCs من أجنة المرحلة المبكرة من 5 (2 ساعة و 30 دقيقة - 3 ساعات و 20 دقيقة بعد وضع البويضة) ، بينما يتم إجراء الحفظ بالتبريد للأجنة على أجنة المرحلة 16 (14-22 ساعة بعد وضع البيض). وبالتالي ، فإن الأجنة أقدم بكثير وتظهر تباينا أكبر بكثير في السلالة في النافذة الزمنية المثلى للحفظ بالتبريد مقارنة بالحفظ بالتبريد PGC. في الواقع ، لم يختلف تواتر المضيفين الذين ينتجون ذرية مشتقة من المانحين بين خمس سلالات درسها Asaoka et al.13 ، على الرغم من أن المضيفين لم يكونوا أجاميين. علاوة على ذلك ، فإن PGCs لديها القدرة على استخدامها في تطبيقات الهندسة الوراثية ، مثل تحرير الجينوم14،15،16.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
نشكر مركز كيوتو لذبابة الفاكهة على سلالات الذباب. كما نشكر السيدة واندا مياتا على تحرير المخطوطة باللغة الإنجليزية والدكتور جيريمي ألين من Edanz (https://jp.edanz.com/ac) لتحرير مسودة هذه المخطوطة. تم دعم هذا العمل بمنح (JP16km0210072 ، JP17km0210146 ، JP18km0210146) من الوكالة اليابانية للبحث والتطوير الطبي (AMED) إلى T.T.-S.-K. ، والمنح (JP16km0210073 ، JP17km0210147 ، JP18km0210145) من AMED إلى S.K. ، منحة (JP20km0210172) من AMED إلى T.T.-S.-K. و S.K. ، منحة مساعدة للبحث العلمي (C) (JP19K06780) من الجمعية اليابانية لتعزيز العلوم (JSPS) إلى T.T.-S.-K. ، ومنحة مساعدة للبحث العلمي في المجالات المبتكرة (JP18H05552) من JSPS إلى S.K.
Materials
| Name | Company | Catalog Number | Comments |
| Acetic acid | FUJIFILM Wako Pure Chemical Corporation | 017-00256 | For embryo collection |
| Agar powder | FUJIFILM Wako Pure Chemical Corporation | 010-08725 | For embryo collection |
| Calcium chloride | FUJIFILM Wako Pure Chemical Corporation | 038-24985 | For EBR solution |
| Capillary | Sutter Instrument | B100-75-10-PT | BOROSILICATE GLASS; O.D: 1.0mm, I.D: 0.75mm , length: 10cm, 225Pcs |
| Capillary holder | Eppendorf | 5196 081.005 | Capillary holder 4; for micromanipulation |
| Chromic acid mixture | FUJIFILM Wako Pure Chemical Corporation | 037-05415 | For needle washing |
| CPA solution | 1x EBR containing 20% ethylene glycol and 1M sucrose | ||
| Double-sided tape | 3M | Scotch w-12 | For glue extracting |
| Ephrussi–Beadle Ringer solution (EBR) | 130 mM NaCl, 5 mM KCl, 2 mM CaCl2, and 10 mM Hepes at pH 6.9 | ||
| Ethanol (99.5) | FUJIFILM Wako Pure Chemical Corporation | 057-00451 | For embryo collection |
| Ethylene glycol | FUJIFILM Wako Pure Chemical Corporation | 054-00983 | For CPA solution |
| Falcon 50 mm x 9 mm bacteriological petri dish | Corning Inc. | 351006 | For embryo collection |
| Forceps | Vigor | Type5 Titan | For embryo handling |
| Grape juice | Asahi Soft Drinks Co., LTD. | Welch's Grape 100 | For embryo collection |
| Grape juice agar plate | 50% grape juice, 2% agar, 1% ethanol, 1% acetic acid | ||
| Heptane | FUJIFILM Wako Pure Chemical Corporation | 084-08105 | For glue extracting |
| Humidifier | APIX INTERNATIONAL CO., LTD. | FSWD2201-WH | For embryo preparation |
| Inverted microscope | Leica Microsystems GmbH | Leica DM IL LED | For micromanipulation |
| Luer-lock glass syringe | Tokyo Garasu Kikai Co., Ltd. | 0550 14 71 08 | Coat a plunger with silicon oil (FL-100-450CS);for micromanipulation |
| Mechanical micromanipulator | Leica Microsystems GmbH | For micromanipulation | |
| Micro slide glass | Matsunami Glass Ind., Ltd. | S-2441 | For embryo aligning |
| Microgrinder | NARISHIGE Group | Custom order | EG-401-S combined EG-401 and MF2 (with ocular lens MF2-LE15 ); for needle preparation |
| Microscope camera | Leica Microsystems GmbH | Leica MC170 HD | For micromanipulation |
| Needle holder | Merck KGaA | Eppendorf TransferTip (ES) | For cryopreservation |
| Potassium chloride | Nacalai Tesque, Inc. | 28514-75 | For EBR solution |
| Puller | NARISHIGE Group | PN-31 | For needle preparation; the heater level is set to 85.0-98.4, the magnet main level to 57.8, and the magnet sub level to 45.0. |
| PVC adhesive tape for electric insulation | Nitto Denko Corporation | J2515 | For embryo-pool frame |
| Silicon oil | Shin-Etsu Chemical, Co, Ltd. | FL-100-450CS | For embryo handling |
| Sodium chloride | Nacalai Tesque, Inc. | 31320-05 | For EBR solution |
| Sodium hypochlorite solution | FUJIFILM Wako Pure Chemical Corporation | 197-02206 | Undiluted and freshly prepared; for embryo breaching |
| Sucrose | Nacalai Tesque, Inc. | 30404-45 | For CPA solution |
References
- Brüschweiler, W., Gehring, W. A method for freezing living ovaries of Drosophila melanogaster larvae and its application to the storage of mutant stocks. Experientia. 29, 134-135 (1973).
- Steponkus, P. L., et al. Cryopreservation of Drosophila melanogaster embryos. Nature. 345, 170-172 (1990).
- Mazur, P., Cole, K. W., Hall, J. W., Schreuders, P. D., Mahowald, A. P. Cryobiological preservation of Drosophila embryos. Science. 258 (5090), 1932-1935 (1992).
- Zhan, L., Li, M. G., Hays, T., Bischof, J. Cryopreservation method for Drosophila melanogaster embryos. Nat Comm. 12, 2412 (2021).
- Van Deusen, E. B. Sex determination in germ line chimeras of Drosophila melanogaster. Development. 37 (1), 173-185 (1977).
- Breen, T. R., Duncan, I. M. Maternal expression of genes that regulate the bithorax complex of Drosophila melanogaster. Dev Biol. 118, 442-456 (1986).
- Schupbach, T., Wieschaus, E. Germline autonomy of maternal-effect mutations altering the embryonic body pattern of Drosophila. Dev Biol. 113, 443-448 (1986).
- Irish, V., Lehmann, R., Akam, M. The Drosophila posterior-group gene nanos functions by repressing hunchback activity. Nature. 338, 646-648 (1989).
- Hülskamp, M., Schröder, C., Pfeifle, C., Jäckle, H., Tautz, D. Posterior segmentation of the Drosophila embryo in the absence of a maternal posterior organizer gene. Nature. 338, 629-632 (1989).
- Steinmann-Zwicky, M., Schmid, H., Nöthiger, R. Cell-autonomous and inductive signals can determine the sex of the germ line of Drosophila by regulating the gene Sxl. Cell. 57 (1), 157-166 (1989).
- Stein, D., Roth, S., Vogelsang, E., Nüsslein-Volhard, C. The polarity of the dorsoventral axis in the drosophila embryo is defined by an extracellular signal. Cell. 65 (5), 725-735 (1991).
- Kobayashi, S., Yamada, M., Asaoka, M., Kitamura, T. Essential role of the posterior morphogen nanos for germline development in Drosophila. Nature. 380, 708-711 (1996).
- Asaoka, M., et al. Offspring production from cryopreserved primordial germ cells in Drosophila. Comm Biol. 4 (1), 1159 (2021).
- Blitz, I. L., Fish, M. B., Cho, K. W. Y. Leapfrogging: primordial germ cell transplantation permits recovery of CRISPR/Cas9-induced mutations in essential genes. Development. 143 (15), 2868-2875 (2016).
- Koslová, A., et al. Precise CRISPR/Cas9 editing of the NHE1 gene renders chickens resistant to the J subgroup of avian leukosis virus. Proc Natl Acad Sci U S A. 117 (4), 2108-2112 (2020).
- Zhang, F. Efficient generation of zebrafish maternal-zygotic mutants through transplantation of ectopically induced and Cas9/gRNA targeted primordial germ cells. J Genet Genom. 47 (1), 37-47 (2020).
- Campos-Ortega, J. A., Hartenstein, V. Stages of Drosophila Embryogenesis. The Embryonic Development of Drosophila. , (1997).
- Manning, A. A sperm factor affecting the receptivity of Drosophila melanogaster females. Nature. 194, 252-253 (1962).
- Kubli, E. Sex-peptides: seminal peptides of the Drosophila male. Cell Mol Life Sci. 60, 1689-1704 (2003).
- Lehmann, R., Nüsslein-Volhard, C. Abdominal segmentation, pole cell formation, and embryonic polarity require the localized activity of oskar, a maternal gene in drosophila. Cell. 47 (1), 141-152 (1986).
- Kiger, A. A., Gigliotti, S., Fuller, M. T. Developmental genetics of the essential Drosophila Nucleoporin nup154: allelic differences due to an outward-directed promoter in the P-element 3′ end. Genetics. 153 (2), 799-812 (1999).
- Rienzi, L. F., et al. Perspectives in gamete and embryo cryopreservation. Semin Reprod Med. 36 (5), 253-264 (2018).
Explore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved