ショウ ジョウバエ 株の原始生殖細胞凍結保存と復活
* これらの著者は同等に貢献しました
要約
ショウ ジョウバエ 株の長期保存方法は、成虫のハエの生鮮食品バイアルへの頻繁な移送の代替として非常に望ましい。このプロトコルはショウ ジョウバエ の原始生殖細胞のcryopreagingを記述し、agametic宿主の胚への移植によって緊張の復活。
要約
ショウジョウバエ 株は、成虫のハエを新しいバイアルに頻繁に移すことによって維持されなければなりません。これは、突然変異の悪化や表現型の変化の危険性を伴います。したがって、そのような変更を伴わない長期保存のための代替方法の開発が不可欠です。ショウ ジョウバエ 胚の凍結保存は、これまでの成功例にもかかわらず、再現性が低いため、まだ実用化されていません。ここでは、原始生殖細胞(PGC)の凍結保存と、無ガメティック ショウジョウバエ (D. melanogaster)宿主胚への凍結保存PGCの移植による株復活のプロトコルについて説明します。PGCは凍結保護剤(CPA)に対する透過性が高く、菌株間の発生的および形態学的変異は、胚凍結保存よりも問題が少ない。この方法では、約30個のドナー胚からPGCを採取し、CPA処理後にニードルに装填した後、液体窒素で凍結保存します。ドナー由来の配偶子を作製するには、針状に凍結保存されたPGCを解凍し、約15個の無配偶性宿主胚に沈着させます。このプロトコルでは、少なくとも15%の繁殖力のあるハエの頻度が達成され、受胎可能なカップルあたりの子孫の数は、常に元の株を復活させるのに十分すぎるほどであり(平均子孫数は77.2±7.1)、凍結保存されたPGCが生殖細胞幹細胞になる能力を示しています。針1本当たりの繁殖可能なハエの平均数は1.1±0.2であり、26本の針のうち9本が2つ以上の繁殖可能な子孫を産んだ。11本の針で6匹以上の子孫を産むことができ、少なくとも1匹の雌と1匹の雄が含まれている可能性が高いことがわかった。無ガメティック宿主は、新しく出現した雌と雄のハエを交配するだけで、株を迅速に復活させることができます。さらに、PGCはゲノム編集などの遺伝子工学的応用にも利用できる可能性があります。
概要
成虫のハエを新しい食用バイアルに移すことによるショウジョウバエ株の維持は、必然的に時間の経過とともに突然変異とエピジェネティックな変化の蓄積をもたらします。このような変化を伴わないショウジョウバエ株の長期維持のための代替法の開発は、特に全ゲノムを維持しなければならない参照株にとって不可欠である。ショウジョウバエの胚または卵巣を凍結保存するいくつかの成功した試みが報告されています1,2,3。残念ながら、再現性が低いため、まだ実用化されていません。実際、初期段階の胚は卵黄含有量が高いため、凍結保存後の生存率が低く、凍結保護剤(CPA)の浸透と拡散が妨げられます2,3。CPAの透過性は、後期胚のワックス状の層によっても厳しく制限されます。胚の生存率が高く、ワックス層が薄い菌株特異的な期間を見つけることは困難で時間がかかります。最近、Zhanら4は、胚の透過処理、CPAローディング、およびガラス化の方法を改善し、複数の株の胚の凍結保存に成功しました。しかし、透過処理後の胚の生存率が悪くなる傾向があるため、適用は容易ではありません。したがって、代替アプローチのさらなる改善と開発が依然として必要です。始原生殖細胞(PGC)の凍結保存を含む方法は、ショウジョウバエ株の長期維持のための代替アプローチです。
PGC(極細胞とも呼ばれる)移植は、接合性致死突然変異の母体への影響や生殖細胞の性決定などのプロセスを研究するために、生殖細胞キメラ、特に女性を生成するために使用されてきました5,6,7,8,9,10,11,12 .PGCは胚よりもはるかに小さく、ほとんどの凍結保護剤に対して高い透過性を持つ可能性があります。さらに、菌株間の発生的および形態学的変異は問題が少なく、非ガメティック宿主は全ゲノムの迅速な復元を可能にします。私たちは最近、ショウジョウバエ株の避けられない遺伝的およびエピジェネティックな変化を防ぐPGC凍結保存13の新しい方法を開発しました。ここでは、詳細なプロトコルを紹介します。
この凍結保存法には、PGCの取り扱いと装置に関する特別な専門知識が必要です。ステップバイステップのアプローチは、不慣れな人にとっては効率的なソリューションかもしれませんが、機器の要件により、小規模なラボには適さない場合があります。このPGC凍結保存プロトコルは、発生および形態学的の違いが小さいため、胚凍結保存プロトコルよりも異なるショウジョウバエ種および異なる昆虫種での使用により簡単に適応できます。PGCは、ゲノム編集14,15,16などの遺伝子工学的応用にも使用できる可能性がある。要約すると、この方法は、ストックセンターやその他の研究所で、ハエやその他の昆虫株を変化させることなく長期間維持するために使用できます。
プロトコル
1. 機器の準備
- マイクロマニピュレーターシステム:マイクロマニピュレーターシステムを組み立てて、細胞を採取して移植します(図1A)。
- PGC採取スライドガラス(図2A)
- ヘプタン接着剤を調製するには、長さ約30cmの両面テープをカットし、7 mLの工業用(レギュラー)グレードのヘプタン溶液に一晩浸します。
- スライドガラスの背面に胚の位置合わせのために2本の平行な基準線を描きます。
- 上記のヘプタン接着剤をパスツールピペットを使用してスライドガラス(線のない側)に滴下します。スライドの表面が白くなるまで風乾します。
- ヘプタン接着剤の滴の添加と拡散を繰り返し、スライドを再び乾かします。
注意: 接着剤は、液体溶液が平らな面に広がるのを防ぎ、水溶液を針にロードしやすくします。 - 胎児プールのフレームを作るには、まな板に厚さ0.2mmの電気テープなどの標準的なビニールテープを3枚重ねます。テープを1.5cm幅の長方形にカットします。次に、2〜3mmのフレームを残して、3層のテープをすべて切り取ります。
注:胚を整列させた後、胚プールフレームを貼り付けて、胚のプールを形成します。
- 移植用針
注:この研究の時点で市販されているすべての針は、PGC凍結保存には狭すぎたり広すぎたりしました。- ガラスの毛細管と引き手を使って針を作ります。ナリシゲPN-31のプーラーは、ヒーターレベルが85.0-98.4、マグネットメインレベルが57.8、マグネットサブレベルが45.0です。
- 肉厚1μm、先端約200μm、内径10〜12μmの針を作るには、次の3つの工程で針先を研磨します(図3)。まず、針先の内径が10〜12μmになるまで、針先を780rpmの速度で30°の角度で研磨します。この最初の粉砕ステップには約1時間かかります。
注意: 針先が折れないように、最初に砥石を回転させてから、針を砥石の上にそっと動かします。 - 針の上部に線を引いて、希望の角度を追跡します。針を反時計回りに90°回転させ、180rpmの速度で再度研磨します。これには約5分かかります。
- 針を時計回りに45°回転させ、180rpmの速度で1秒間研磨します。
- クロム酸混合物(注意:有毒)を滴下した収集スライドガラスを顕微鏡ステージに置きます。針をキャピラリーホルダー(図1D)にスライド面に対して10°〜13°の角度で取り付け、針を慎重に下に動かし、先端をクロム酸混合物に浸します。
- プランジャーを引っ張ったり押したりして(図1B)、針から溶液を機械的に数回装填して排出し、針内のガラス破片を除去します。外壁も必ず掃除してください。
- 針の内側と外側を蒸留水で2回洗い、クロム酸を完全に取り除きます。
2. PGCの採取と凍結保存
- 胚の採取
- 目的のドナー株の適切な数のハエ(胚採取カップでは雌雄ごとに約450匹)を胚採取プレート(図1E)を備えた胚採取カップに移し、25°Cでインキュベートします。 私たちは通常、室温(23〜25°C)の混雑の少ない条件下で飼育される生後3〜5日の親バエを使用します。
- 30分間の事前収集を2回行い、産卵した卵を捨てます。雌は卵管内で発育した受精卵を保持できるため、ステップ2.1.3の産卵を同期させるためにこのステップが必要です(図4)。
- 2回のプレコレクションの後、胚を50分間収集し、収集した胚を25°Cの加湿チャンバーでインキュベートして、胚を胚盤葉段階(初期段階517)に発達させます。インキュベーション時間は通常100分ですが、菌株によっては最大120分まで延長できます(図4)。
注意: 加湿チャンバーは、湿らせたペーパータオルをプラスチックの箱の底に置き、使用前に水の霧を吹きかけることによって作成されます。初期段階の5胚では、PGCの形成は完了していますが、体細胞化は完了していません。胚の正確な段階は、ステップ2.4の複合顕微鏡で決定されます。
- 脱絨毛胚
- ステンレス製のメッシュストレーナー(150メッシュ、開口部109μm、線径60μm; 図1F)。鉗子を使用して、胚採取プレートから胚を採取し、水滴に入れます。
- ティッシュペーパーを下からストレーナーに押し付けて水を吸収します。新鮮な5%(Clとして)次亜塩素酸ナトリウム溶液の液滴を胚に加え、ストレーナーを10秒間連続的に叩きます。
- 胚に直接蒸留水をかけて洗浄し、ティッシュペーパーを下からストレーナーに押し付けて水分を吸収させます。この手順を3回繰り返します。
- 脱毛胚のアライメント
- 実体顕微鏡下で、鉗子を使用して胚を移植します。脱毛した胚を、PGC採取スライドガラス上で2列に並べます(図2A)。胚は、前側を右(操作する側)に向け、腹側を上にして配向します。
注:このステップは20分で完了する必要があり、その間に通常約40個の胚を整列させます。 - PGCコレクションスライドガラス上の胚の周りに胚プールフレームを取り付けます。1 μL の CPA 溶液(20% エチレングリコールと 1 M スクロースを含む 1x Ephrussi-Beadle Ringer 溶液、EBR、1x EBR:130 mM NaCl、5 mM KCl、2 mM CaCl2、10 mM Hepes、pH 6.9)をフレームで囲まれた領域の 2 つの別々のスポットに滴下し、胚が乾燥しないようにプールにシリコンオイルを充填します(図 2A)。
注:CPA溶液を調製するには、10.26gのスクロースを、3mLの10 x EBR溶液を含む約20 mLの蒸留H2Oに完全に溶解します。6mLのエチレングリコールを加え、次いで蒸留H2Oを最大30mLまで加える。完全に混合した後、0.22 mmのディスポーザブルメンブレンで溶液をろ過します。
- 実体顕微鏡下で、鉗子を使用して胚を移植します。脱毛した胚を、PGC採取スライドガラス上で2列に並べます(図2A)。胚は、前側を右(操作する側)に向け、腹側を上にして配向します。
- PGC の収集
- ステップ2.3.2のPGCコレクションスライドガラスを、マイクロマニピュレーターシステムを備えた顕微鏡のステージに置きます。針をキャピラリーホルダーに取り付け、左列の最初の胚と針先を同じ焦点面に持ってきます。シリコーンオイルを針に2〜3秒間入れます。
- 左列の胚からPGCの採取を開始します。20倍の対物レンズを使用して、針を動かすのではなく顕微鏡ステージを動かすことによって、針先を胚の前端の表面にそっと動かし、胚を後端に向かって貫通させます。
- 針先が後端に達したら、針を少し引っ込め、針の中の卵黄を体細胞層のすぐ内側に完全に排出します。
- 針の圧力を一定に保ちながら、針先を後極のすぐ内側のPGCに移動し、ゆっくりと、しかし時間をかけずにPGCをロードします。
- 針を胚からすばやく引き出し、針から卵黄やその他の汚染物質を針からシリコーンオイルプールに排出し、PGCを針に保持します。次に、プールからきれいなシリコーンオイルをロードします。
- 左の行の他の胚について、手順2.4.2から2.4.5を繰り返します。新しい胚からPGCを採取する前に、ステップ2.4.5でロードしたシリコーンオイルをできるだけ多くのシリコーンオイルを体細胞層内に堆積させ、ロードしたPGCを針に保持します。これにより、新しくロードされた PGC が、以前に収集された PGC に隣接し、それらの間に材料が介在することがありません。
- 左列の胚からのPGC採取が完了したら、卵黄やその他の汚染物質からPGCを可能な限り分離します。これを達成するには、針のすべてのPGCを胚の表面に堆積させ、卵黄やその他の汚染物質を隣接する別の胚に取り除きます。
- 次に、右列の胚からPGCを収集します。右と左の行から収集した PGC を結合します。
- PGCへの凍結保護剤(CPA)の塗布
- CPAで針を1滴洗った後、別の滴で新しいCPAを針にロードし、胚に沈着したPGCにCPAを追加します。CPAのボリュームはPGCのボリュームと同等である必要があります。
- CPA の追加後、PGC 1 から 2 のクラスタからできるだけ多くの CPA を削除します。PGCはわずかに収縮し、CPA添加直後に正方形になります。
- ニードルを空にしてから、シリコーンオイルを5秒以上ロードします。回収したすべてのPGCをロードしてから、シリコンオイルをもう一度5秒以上ロードします。PGCは、2層のシリコーンオイルで挟まれています(図2B)。
注意: 卵黄、CPA、およびその他の汚染物質をできるだけ多く取り除くことが重要です。
- PGCの凍結保存
- 三方活栓(図1C)を開き、針をマイクロマニピュレーターから取り外します。針の表面についた油分をソフトティッシュペーパーで拭き取ります。針の先端にティッシュを直接触れないでください。
- 針をニードルホルダーに取り付け、ビニールテープを使用して根元の所定の位置にロックします(図1H)。ホルダーチューブにラベルを貼付します。
- ホルダーを液体窒素に浸して、針を下に向けて瞬間凍結します。液体がラックから泡立つのを止めるまで、ホルダーを離さないでください。
- ホルダーは、気相領域ではなく、液相領域の液体窒素貯蔵タンクに保管してください。
3. PGCの融解と移植
- 無ガメティック宿主ハエからの胚の収集、脱摩擦、および整列
- ステップ2に従って、無ガメティック宿主ハエから胚を収集して脱chorionateします。
- ステージ5の無配球性宿主胚を移植スライドガラスに合わせます。ただし、今回は後部を右(操作する側)に向け、腹側を上部に向けます(図5)。約30個の胚を2列に並べて20分で行います。
- 胚を整列させながら、部屋の湿度で必要な場合は加湿器を2〜10分間操作します(表1)。理想的な湿度は30%から40%ですが、これは温度条件によって異なる場合があります。
- 宿主胚におけるPGCの融解と移植
- 凍結保存されたPGCを迅速に融解するには、ニードルを含むホルダーを、ニードルを下に向けて室温の1x EBR溶液に滑り込ませ、10秒間浸しておきます。
- 移植用スライドガラスを顕微鏡のステージに置きます。凍結融解した針をキャピラリーホルダーに取り付け、左列の最初の胚と針先を同じ焦点面に持ってきます。
- 20倍の対物レンズを使用して、針先を胚の後端の表面にそっと動かします。
- 各胚の外側をそっと突いて、ゆっくりと元の形に戻ることを確認します。突っ込むことで、胚の内圧が高すぎたり低すぎたりしないことを確認します。
- 針を静かに動かし、後極から胚を貫通させます。
- 胚の硝子膜と体細胞層の間に、正確に後極のすぐ内側に約10〜20個のPGCを静かに堆積させます。体細胞層に沈着させないでください。ペリビテリン液が胚から漏れた場合は、漏れた液体を針に吸い込んで取り除きます。
- 針を胚から引っ込めます。後続の胚について、手順3.2.5と3.2.6を繰り返します。
4. 胚のインキュベートとドナー株の回復
- 移植されたPGCを受けない胚をすべて除去し、残りの胚を加湿チャンバー(図1G)で25°Cでインキュベートします。
- 移植後24時間以上経過し、孵化後できるだけ早く、鉗子を使用して孵化した幼虫を拾い上げ、標準的な ショウジョウバエ の餌バイアルに移し、25°Cでインキュベートします。
- 株を復活させるには、新たに出現した雌雄を交配します(図6)。
注:無閤性宿主は、バランサー染色体株に交配することなく、ゲノム全体を一度に復元することを可能にします。バイアル内での無ガメティックオスの共存は、メスが交配したとしても、再交配に対する受容性の低下を含む長期的な交配後の反応を示さないため、問題にはなりません18,19。
結果
凍結保存されたPGC移植の効率は、浅岡らによって報告されており13 、液体窒素中で1日以上凍結保存されたPGCの移植について表 2 に示されています。孵化率は移植胚208体中168体(80.8%)、胚から成体までの生存率は208体中87体(41.8%)であった。繁殖力のあるハエの頻度は28/87(32.2%)であった。この頻度は、8〜30日間凍結保存したPGCと31〜150日間凍結保存したPGCで差はありませんでした(20/57 vs. 8/30、G' = 0.63、p >0.1、d.f. = 1)。夫婦当たりの平均子孫数は77.2±7.1(n = 18, 28-122)であり、凍結保存されたPGCが生殖細胞幹細胞になる能力を示している。26本の針のうち、10本は繁殖力のない子孫を生み、7本の針は1本の肥沃な子孫を産み、7本の針は2本の肥沃な子孫を生み、2本の針は3本または4本の肥沃な子孫を産みました。針1本当たりの平均繁殖力のあるハエ数は1.1±0.2であった。このデータに基づくと、95%の信頼度で、11本の針で6本以上の子孫を産むことができ、少なくとも1匹の雌と1匹の雄が含まれている可能性があります。
上記の実験では、PGCでovo-A mRNAを発現する胚(nanos>ovo-A、OvoA_OE胚)を非配球性宿主として使用しました。移植されたナノ>ovo-Aカップルから産出された669匹のF1メスと720匹のF1オスのうち、宿主PGCに由来するエスケープは存在しなかった。いくつかのオスカー(osk)変異体も温度感受性非ガメティックである20,21。ホモ接合体生存率が高く、非ガメティック表現型を持つosk変異体はもはや入手できないため、CRISPR/Cas9支援ゲノム編集によりosk[8]ミスセンス変異体20を再現した。これらのハエは、25°Cでは完全に非ガメティック(雌230匹中0匹、雄192匹)であったが、23°Cでは少数の脱走虫(雌248匹中1匹、雄290匹中1匹)が出現した。したがって、nanos>ovo-Aは非ガメティック宿主胚として推奨されます。UASp-ovo-Aとnanos-Gal4 13は、近日中に京都ショウジョウバエストックセンターから入手可能になります。

図1:必要な機器。 (A)細胞を採取して移植するマイクロマニピュレーターシステム。i)倒立顕微鏡、ii)機械式マイクロマニピュレーター、iii)シリンジ、iv)キャピラリーホルダー、v)三方活栓、vi)加湿器、vii)実体顕微鏡。(B)注射器。(C)三方活栓とシリコンチューブがシリンジとキャピラリーホルダーを接続します。(D)マイクロマニピュレーターに針とキャピラリーホルダーを取り付ける。(E)胚採取プレート(直径6cm、高さ7.7cm)を備えた胚採取カップ。(F)ステンレスメッシュストレーナー。(g)スライドガラスを備えた湿潤チャンバーとして使用される容器。湿気を保つために、底に濡れた紙を置き、蓋を閉めます。(h)凍結保存用の針を備えたニードルホルダー。(I)凍結保存用の保管ラックと針の入った箱。 この図の拡大版をご覧になるには、ここをクリックしてください。
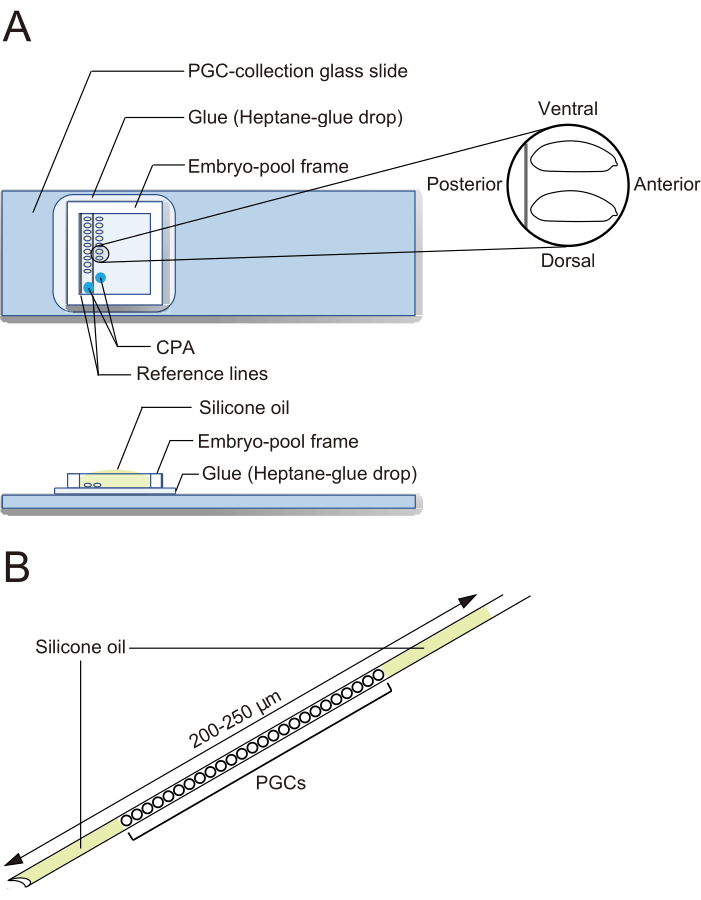
図2:PGC採取スライドガラスと凍結保存針。 (A)接着剤でコーティングされた原始生殖細胞(PGC)収集スライドガラス。脱絨毛胚は2列に並び、前側を右(操作する側)に、腹側を上にして配向します。胚プールフレームを貼り付け、凍結保護剤(CPA)溶液を2滴沈着させ、プールをシリコーンオイルで満たします。(B)針には、卵黄やその他の汚染物質をできるだけ少量含める必要があります。PGCは、液体窒素中で凍結保存する際に、2層のシリコーンオイルで挟まれます。 この図の拡大版をご覧になるには、ここをクリックしてください。
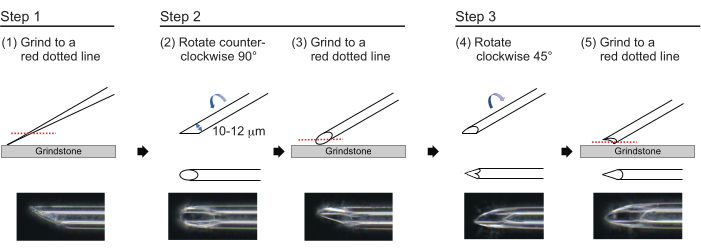
図3:針の作り方 適切な穴径と鋭い先端を持つ針を作るための3段階の先端研磨法。 この図の拡大版をご覧になるには、ここをクリックしてください。
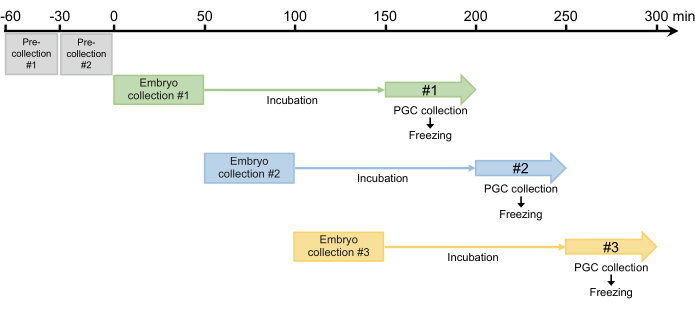
図4:胚採取スキーム。 2回の事前収集の後、通常は1日に3〜4回収集します。 この図の拡大版をご覧になるには、ここをクリックしてください。
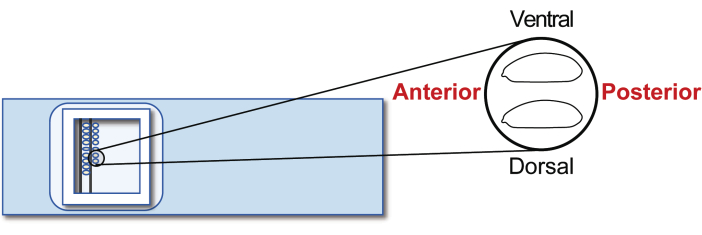
図5:宿主胚のアライメント。 スライドガラス上の宿主胚のアライメント。 この図の拡大版をご覧になるには、ここをクリックしてください。
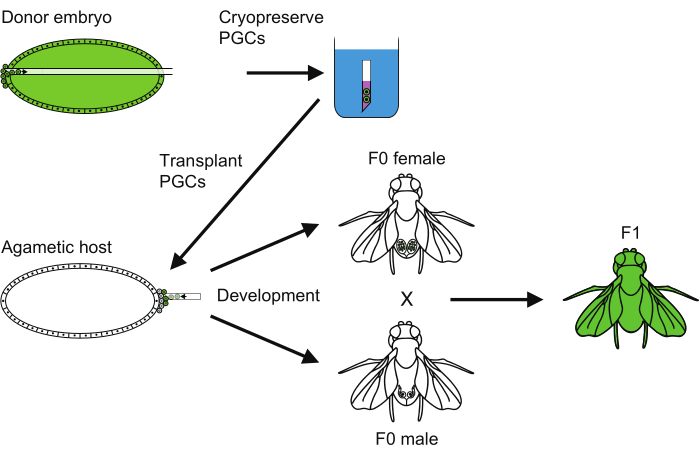
図6:PGC凍結保存法の概要。 原始生殖細胞(PGC)凍結保存を実施するためのすべてのステップの概要。 この図の拡大版をご覧になるには、ここをクリックしてください。
| 部屋の湿度 | |||
| < 30% | ~ 30% | > 30% | |
| 宿主胚のアライメント (~20分) | 加湿器を2〜10分間使用します | 加湿器を断続的に1分間使用する | 加湿器は使用しないでください |
| ドナーPGCの融解 | 該当なし | 該当なし | 該当なし |
| PGCを風乾 | この手順は省略します | この手順は省略します | 5分 |
| シリコーンオイルを塗る | 該当なし | 該当なし | 該当なし |
| PGCの移植 | 該当なし | 該当なし | 該当なし |
| これらのステップはすべて50分で完了する必要があります。 | |||
表1:胚のアライメントおよびPGC融解中の胚の乾燥。
| ドナー負担 | 凍結保存期間 | 移植胚数(A) | 孵化した幼虫の数(B) (孵化率、B/A) | 閉鎖された成人の数(C) (卵から成体への生存率、C / A) | 受胎可能可能成人数(D) (繁殖力のあるハエの頻度、D / C) |
| M17の | 8 - 30 日間 | 134 | 108 (80.6%) | 57 (42.5%) | 20 (35.1%) |
| M17の | 31 から 150 日間 | 74 | 60 (81.1%) | 30 (40.5%) | 8 (26.7%) |
| M17: yw;TM6B, P{Dfd-GMR-nvYFP}4, Sb[1] Tb[1] ca[1]/ Pri[1] | |||||
表2:凍結保存PGC移植の効率。 このテーブルは13から変更されています。すべてのデータは非ガメティック宿主からのものです。
ディスカッション
PGCの凍結保存と蘇生を成功させるための重要な要素は、良質な胚を使用することです。若い女性(例:.、3〜5日齢)は、胚の収集に使用する必要があります。ドナー胚と宿主胚の両方が顕微鏡検査によって評価され、胚盤葉段階(ステージ5)の胚のみが使用されます12。PGCの採取では、通常、20分間に約40個のドナー胚をアライメントし、初期段階5で約30個の胚からPGCを採取します。古い胚や欠陥のある胚は使用されません。凍結保存および融解後、PGCはその形状を維持する必要があります。PGCは保存に失敗すると破裂します。宿主胚もステージ5にあり、適度な内圧を持っている必要があります。胚は、穏やかに突っ込んだ後、ゆっくりと元の形に戻るはずです。過度に乾燥した胚や不十分な胚は、移植後に正常に発育しません。PGCの異性愛移植はショウジョウバエ5,10の配偶子を産生しないため、複数のドナー胚から宿主胚へのPGCの移植は、肥沃な成体をもたらす可能性が高くなります。この目的のために、私たちは通常、針ごとに約30個の胚からPGCを収集します。
凍結保護剤として、エチレングリコール、ジメチルスルホキシド、グリセロールをスクロースと様々な濃度で試しました。20%のエチレングリコールと1Mのスクロースを含むEBRが最良の13であると判断しました。しかしながら、異なる凍結保護剤の使用は、PGCの保存を改善するかもしれない22。
この凍結保存法にはPGCの取り扱いに関する専門的なスキルが必要であり、PGCを快適に採取して移植するには約6週間のトレーニングが必要です。技能の習熟度を評価・向上させるために、1)スライドガラス上で胚を整列させる、2)マニピュレーターを制御する、3)凍結保存せずに胚から別の胚にPGCを移植する、4)10個以上の胚から5〜10個の胚にPGCを移植する、5)CPAを適用した後のPGCの移植、6)凍結融解後のPGCの移植の6つのトレーニングステップに分けることができる。各ステップには1週間かかる場合があります。ステップ3の短期目標は、孵化率40%、胚から成体までの生存率10%〜20%、繁殖力のあるハエの頻度20%です。
PGC凍結保存には、高価な機器と高度なスキルを持つ人材が必要です。したがって、この方法は多くの研究室で採用されていない可能性があります。ただし、現在のPGC法にはいくつかの重要な側面があります。第一に、PGCは胚よりもはるかに小さく、凍結保護剤に対して非常に透過性があります。対照的に、凍結保護剤の透過性は、ショウジョウバエ胚のワックス状の層によって厳しく制限されており、これは胚の凍結保存における最も深刻な問題です。実際、これまでの研究では、胚の生存率が高く、ワックス層が薄い時間枠を見つけるために多大な努力が払われてきました。2つ目は、菌株間の発生的および形態学的変異に関係しています。PGCは初期段階の5胚(産卵後2時間30分〜3時間20分)から採取され、胚凍結保存はステージ16の胚(産卵後14〜22時間)で行われます。したがって、胚ははるかに古く、PGC凍結保存と比較して、凍結保存に最適な時間枠ではるかに大きな菌株変動を示します。実際、宿主がドナー由来の子孫を産生する頻度は、宿主が非ガメティックではなかったものの、Asaoka et al.13が研究した5つの系統間で変化はなかった。さらに、PGCはゲノム編集14,15,16などの遺伝子工学的応用にも利用できる可能性がある。
開示事項
著者は、宣言すべき利益相反を持っていません。
謝辞
KYOTO Drosophila Stock Centerのハエ株に感謝します。また、原稿の英文校正をしてくださった宮田ワンダさんと、この原稿の草稿を編集してくださったエダンツ(https://jp.edanz.com/ac)のジェレミー・アレン博士にも感謝します。本研究は、国立研究開発法人日本医療研究開発機構(AMED)から東京証券取引所への助成金(JP16km0210072、JP17km0210146、JP18km0210146)、AMEDから株式会社への助成金(JP16km0210073、JP17km0210147、JP18km0210145)、AMEDから台湾株式会社への助成金(JP20km0210172)の支援を受けて行われました。日本学術振興会(JSPS)からT.T.S.-K.への基盤研究(C)(JP19K06780)および日本学術振興会からS.K.への新学術領域研究(JP18H05552)です。
資料
| Name | Company | Catalog Number | Comments |
| Acetic acid | FUJIFILM Wako Pure Chemical Corporation | 017-00256 | For embryo collection |
| Agar powder | FUJIFILM Wako Pure Chemical Corporation | 010-08725 | For embryo collection |
| Calcium chloride | FUJIFILM Wako Pure Chemical Corporation | 038-24985 | For EBR solution |
| Capillary | Sutter Instrument | B100-75-10-PT | BOROSILICATE GLASS; O.D: 1.0mm, I.D: 0.75mm , length: 10cm, 225Pcs |
| Capillary holder | Eppendorf | 5196 081.005 | Capillary holder 4; for micromanipulation |
| Chromic acid mixture | FUJIFILM Wako Pure Chemical Corporation | 037-05415 | For needle washing |
| CPA solution | 1x EBR containing 20% ethylene glycol and 1M sucrose | ||
| Double-sided tape | 3M | Scotch w-12 | For glue extracting |
| Ephrussi–Beadle Ringer solution (EBR) | 130 mM NaCl, 5 mM KCl, 2 mM CaCl2, and 10 mM Hepes at pH 6.9 | ||
| Ethanol (99.5) | FUJIFILM Wako Pure Chemical Corporation | 057-00451 | For embryo collection |
| Ethylene glycol | FUJIFILM Wako Pure Chemical Corporation | 054-00983 | For CPA solution |
| Falcon 50 mm x 9 mm bacteriological petri dish | Corning Inc. | 351006 | For embryo collection |
| Forceps | Vigor | Type5 Titan | For embryo handling |
| Grape juice | Asahi Soft Drinks Co., LTD. | Welch's Grape 100 | For embryo collection |
| Grape juice agar plate | 50% grape juice, 2% agar, 1% ethanol, 1% acetic acid | ||
| Heptane | FUJIFILM Wako Pure Chemical Corporation | 084-08105 | For glue extracting |
| Humidifier | APIX INTERNATIONAL CO., LTD. | FSWD2201-WH | For embryo preparation |
| Inverted microscope | Leica Microsystems GmbH | Leica DM IL LED | For micromanipulation |
| Luer-lock glass syringe | Tokyo Garasu Kikai Co., Ltd. | 0550 14 71 08 | Coat a plunger with silicon oil (FL-100-450CS);for micromanipulation |
| Mechanical micromanipulator | Leica Microsystems GmbH | For micromanipulation | |
| Micro slide glass | Matsunami Glass Ind., Ltd. | S-2441 | For embryo aligning |
| Microgrinder | NARISHIGE Group | Custom order | EG-401-S combined EG-401 and MF2 (with ocular lens MF2-LE15 ); for needle preparation |
| Microscope camera | Leica Microsystems GmbH | Leica MC170 HD | For micromanipulation |
| Needle holder | Merck KGaA | Eppendorf TransferTip (ES) | For cryopreservation |
| Potassium chloride | Nacalai Tesque, Inc. | 28514-75 | For EBR solution |
| Puller | NARISHIGE Group | PN-31 | For needle preparation; the heater level is set to 85.0-98.4, the magnet main level to 57.8, and the magnet sub level to 45.0. |
| PVC adhesive tape for electric insulation | Nitto Denko Corporation | J2515 | For embryo-pool frame |
| Silicon oil | Shin-Etsu Chemical, Co, Ltd. | FL-100-450CS | For embryo handling |
| Sodium chloride | Nacalai Tesque, Inc. | 31320-05 | For EBR solution |
| Sodium hypochlorite solution | FUJIFILM Wako Pure Chemical Corporation | 197-02206 | Undiluted and freshly prepared; for embryo breaching |
| Sucrose | Nacalai Tesque, Inc. | 30404-45 | For CPA solution |
参考文献
- Brüschweiler, W., Gehring, W. A method for freezing living ovaries of Drosophila melanogaster larvae and its application to the storage of mutant stocks. Experientia. 29, 134-135 (1973).
- Steponkus, P. L., et al. Cryopreservation of Drosophila melanogaster embryos. Nature. 345, 170-172 (1990).
- Mazur, P., Cole, K. W., Hall, J. W., Schreuders, P. D., Mahowald, A. P. Cryobiological preservation of Drosophila embryos. Science. 258 (5090), 1932-1935 (1992).
- Zhan, L., Li, M. G., Hays, T., Bischof, J. Cryopreservation method for Drosophila melanogaster embryos. Nat Comm. 12, 2412 (2021).
- Van Deusen, E. B. Sex determination in germ line chimeras of Drosophila melanogaster. Development. 37 (1), 173-185 (1977).
- Breen, T. R., Duncan, I. M. Maternal expression of genes that regulate the bithorax complex of Drosophila melanogaster. Dev Biol. 118, 442-456 (1986).
- Schupbach, T., Wieschaus, E. Germline autonomy of maternal-effect mutations altering the embryonic body pattern of Drosophila. Dev Biol. 113, 443-448 (1986).
- Irish, V., Lehmann, R., Akam, M. The Drosophila posterior-group gene nanos functions by repressing hunchback activity. Nature. 338, 646-648 (1989).
- Hülskamp, M., Schröder, C., Pfeifle, C., Jäckle, H., Tautz, D. Posterior segmentation of the Drosophila embryo in the absence of a maternal posterior organizer gene. Nature. 338, 629-632 (1989).
- Steinmann-Zwicky, M., Schmid, H., Nöthiger, R. Cell-autonomous and inductive signals can determine the sex of the germ line of Drosophila by regulating the gene Sxl. Cell. 57 (1), 157-166 (1989).
- Stein, D., Roth, S., Vogelsang, E., Nüsslein-Volhard, C. The polarity of the dorsoventral axis in the drosophila embryo is defined by an extracellular signal. Cell. 65 (5), 725-735 (1991).
- Kobayashi, S., Yamada, M., Asaoka, M., Kitamura, T. Essential role of the posterior morphogen nanos for germline development in Drosophila. Nature. 380, 708-711 (1996).
- Asaoka, M., et al. Offspring production from cryopreserved primordial germ cells in Drosophila. Comm Biol. 4 (1), 1159 (2021).
- Blitz, I. L., Fish, M. B., Cho, K. W. Y. Leapfrogging: primordial germ cell transplantation permits recovery of CRISPR/Cas9-induced mutations in essential genes. Development. 143 (15), 2868-2875 (2016).
- Koslová, A., et al. Precise CRISPR/Cas9 editing of the NHE1 gene renders chickens resistant to the J subgroup of avian leukosis virus. Proc Natl Acad Sci U S A. 117 (4), 2108-2112 (2020).
- Zhang, F. Efficient generation of zebrafish maternal-zygotic mutants through transplantation of ectopically induced and Cas9/gRNA targeted primordial germ cells. J Genet Genom. 47 (1), 37-47 (2020).
- Campos-Ortega, J. A., Hartenstein, V. Stages of Drosophila Embryogenesis. The Embryonic Development of Drosophila. , (1997).
- Manning, A. A sperm factor affecting the receptivity of Drosophila melanogaster females. Nature. 194, 252-253 (1962).
- Kubli, E. Sex-peptides: seminal peptides of the Drosophila male. Cell Mol Life Sci. 60, 1689-1704 (2003).
- Lehmann, R., Nüsslein-Volhard, C. Abdominal segmentation, pole cell formation, and embryonic polarity require the localized activity of oskar, a maternal gene in drosophila. Cell. 47 (1), 141-152 (1986).
- Kiger, A. A., Gigliotti, S., Fuller, M. T. Developmental genetics of the essential Drosophila Nucleoporin nup154: allelic differences due to an outward-directed promoter in the P-element 3′ end. Genetics. 153 (2), 799-812 (1999).
- Rienzi, L. F., et al. Perspectives in gamete and embryo cryopreservation. Semin Reprod Med. 36 (5), 253-264 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved