Criopreservação de células germinativas primordiais e renascimento de cepas de Drosophila
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Um método de preservação a longo prazo para cepas de Drosophila como uma alternativa à transferência frequente de moscas adultas para frascos de alimentos frescos é altamente desejável. Este protocolo descreve a criopreservação de células germinativas primordiais de Drosophila e o renascimento de cepas através de seu transplante para embriões hospedeiros agaméticos.
Resumo
As estirpes de Drosophila devem ser mantidas através da transferência frequente de moscas adultas para novos frascos para frascos para injetáveis. Isso traz um perigo de deterioração mutacional e alterações fenotípicas. O desenvolvimento de um método alternativo para a preservação a longo prazo sem tais alterações é, portanto, imperativo. Apesar de tentativas anteriores bem-sucedidas, a criopreservação de embriões de Drosophila ainda não é de uso prático devido à baixa reprodutibilidade. Aqui, descrevemos um protocolo para criopreservação de células germinativas primordiais (PGC) e renascimento de cepas via transplante de PGCs criopreservados em embriões hospedeiros agaméticos de Drosophila melanogaster (D. melanogaster). Os PGCs são altamente permeáveis aos agentes crioprotetores (CPAs), e a variação de desenvolvimento e morfológica entre as cepas é menos problemática do que na criopreservação de embriões. Nesse método, os PGCs são coletados de aproximadamente 30 embriões doados, carregados em uma agulha após o tratamento com CPA e, em seguida, criopreservados em nitrogênio líquido. Para produzir gametas derivados de doadores, as CPGs criopreservadas em uma agulha são descongeladas e, em seguida, depositadas em aproximadamente 15 embriões hospedeiros agaméticos. Uma frequência de pelo menos 15% de moscas férteis foi alcançada com este protocolo, e o número de descendentes por casal fértil foi sempre mais do que suficiente para reviver a cepa original (o número médio de progênie foi de 77,2 ± 7,1), indicando a capacidade das CPGs criopreservadas de se tornarem células-tronco germinativas. O número médio de moscas férteis por agulha foi de 1,1 ± 0,2, e 9 das 26 agulhas produziram duas ou mais progênies férteis. Verificou-se que 11 agulhas são suficientes para produzir 6 ou mais progênies, nas quais pelo menos uma fêmea e um macho provavelmente estão incluídos. O hospedeiro agamético torna possível reviver a cepa rapidamente simplesmente cruzando moscas fêmeas e machos recém-emergidos. Além disso, os PGCs têm potencial para serem usados em aplicações de engenharia genética, como edição de genoma.
Introdução
A manutenção de cepas de Drosophila pela transferência de moscas adultas para novos frascos de alimentos resulta inevitavelmente no acúmulo de mutações e alterações epigenéticas ao longo do tempo. O desenvolvimento de um método alternativo para a manutenção a longo prazo de cepas de Drosophila sem tais alterações é imperativo, especialmente para cepas de referência nas quais todo o genoma deve ser mantido. Várias tentativas bem-sucedidas de criopreservar embriões ou ovários de Drosophila têm sido descritas 1,2,3. Infelizmente, ainda não são de uso prático devido à baixa reprodutibilidade. De fato, embriões em estágio inicial apresentam baixa taxa de sobrevivência após criopreservação devido ao seu alto teor de gema, o que impede a permeação e difusão do agente crioprotetor (CPA) 2,3. A permeabilidade ao CPA também é severamente limitada pelas camadas cerosas de embriões em estágio avançado. É difícil e demorado encontrar um período de tempo específico da cepa em que os embriões tenham uma alta taxa de sobrevivência e uma camada de cera mais fina. Recentemente, Zhan et al.4 aprimoraram métodos de permeabilização embrionária, carga de CPA e vitrificação e criopreservados com sucesso em embriões de múltiplas linhagens. No entanto, os métodos não são de fácil aplicação, pois a viabilidade dos embriões após a permeabilização tende a ser pobre. Por conseguinte, ainda é necessário melhorar e desenvolver abordagens alternativas. Métodos envolvendo a criopreservação de células germinativas primordiais (PGCs) são uma abordagem alternativa para a manutenção a longo prazo de cepas de Drosophila.
O transplante de PGC (também chamado de célula polar) tem sido utilizado para gerar quimeras germinativas, especialmente do sexo feminino, para estudar processos como os efeitos maternos de mutações zigóticas letais e a determinação do sexo de células germinativas 5,6,7,8,9,10,11,12 . Os PGCs são muito menores do que os embriões e provavelmente são altamente permeáveis à maioria dos crioprotetores. Além disso, a variação de desenvolvimento e morfológica entre as cepas é menos problemática, e um hospedeiro agamético permite a restauração rápida de genomas inteiros. Recentemente, desenvolvemos um novo método de criopreservação PGC13, que previne as inevitáveis alterações genéticas e epigenéticas em cepas de Drosophila. Aqui, apresentamos o protocolo detalhado.
Este método de criopreservação requer conhecimentos específicos em manuseio e instrumentação de PGC. Embora uma abordagem passo a passo possa ser uma solução eficiente para aqueles que não estão familiarizados com ela, ela pode ser inadequada para pequenos laboratórios devido aos requisitos de instrumentação. Este protocolo de criopreservação de PGC pode ser mais facilmente adaptado para uso com diferentes espécies de Drosophila e diferentes espécies de insetos do que protocolos de criopreservação de embriões devido a menores diferenças de desenvolvimento e morfologia. Os PGCs também podem ser potencialmente utilizados em aplicações de engenharia genética, como a edição do genoma 14,15,16. Em resumo, este método pode ser usado em centros de estoque e outros laboratórios para manter moscas e outras cepas de insetos por períodos prolongados de tempo sem alterações.
Protocolo
1. Preparação do equipamento
- Sistema micromanipulador: Montar um sistema micromanipulador para coleta e transplante de células (Figura 1A).
- Lâminas de vidro para coleta de PGC (Figura 2A)
- Para preparar a cola de heptano, corte a fita dupla face de aproximadamente 30 cm de comprimento e mergulhe-a durante a noite em 7 mL de solução técnica (regular) de heptano.
- Desenhe duas linhas de referência paralelas para o alinhamento do embrião na parte de trás de uma lâmina de vidro.
- Espalhe gotas da cola de heptano acima na lâmina de vidro (no lado sem as linhas) usando uma pipeta Pasteur. Seque ao ar a superfície da lâmina até que fique branca.
- Repita a adição e espalhamento de gotas de heptano-cola e seque a lâmina novamente.
NOTA: A cola impede que as soluções líquidas se espalhem sobre a superfície plana e facilita o carregamento de soluções aquosas em uma agulha. - Para fazer armações de piscina de embriões, cole três camadas de fita vinílica padrão de 0,2 mm de espessura, como fita elétrica, em uma tábua de corte. Corte a fita em retângulos de 1,5 cm de largura. Em seguida, corte as três camadas de fita, deixando uma moldura de 2 a 3 mm.
NOTA: Uma estrutura de pool de embriões é afixada após o alinhamento de embriões, para formar um pool para embriões.
- Agulhas para transplante
NOTA: Todas as agulhas disponíveis comercialmente no momento deste estudo eram muito estreitas ou muito largas para criopreservação de PGC.- Faça uma agulha usando um capilar de vidro e um puxador. Usamos um extrator NARISHIGE PN-31 com o nível do aquecedor em 85,0-98,4, o nível principal do ímã em 57,8 e o subnível do ímã em 45,0.
- Para fazer uma agulha com uma espessura de parede aproximada de 1 μm e uma ponta de aproximadamente 200 μm de comprimento com um diâmetro interno de 10-12 μm, polir a ponta da agulha no processo seguinte de três etapas (Figura 3). Primeiro, triture a ponta da agulha em um ângulo de 30° a uma velocidade de 780 rpm até que a ponta tenha um diâmetro interno de 10-12 μm. Esta primeira etapa de moagem leva aproximadamente 1 h.
NOTA: Para evitar quebrar a ponta da agulha, primeiro gire o rebolo e, em seguida, mova suavemente a agulha para baixo sobre o rebolo. - Desenhe uma linha na parte superior da agulha para rastrear o ângulo desejado. Gire a agulha no sentido anti-horário a 90° e poli-a novamente a uma velocidade de 180 rpm. Isso leva aproximadamente 5 min.
- Gire a agulha no sentido horário 45° e poli-a a uma velocidade de 180 rpm por um segundo.
- Coloque uma lâmina de vidro de coleta com uma gota de mistura de ácido crômico (CUIDADO: tóxico) no palco do microscópio. Fixe a agulha ao suporte capilar (Figura 1D) em um ângulo de 10°-13° em relação à superfície da lâmina, mova cuidadosamente a agulha para baixo e mergulhe a ponta na mistura de ácido crômico.
- Ao puxar e empurrar o êmbolo (Figura 1B), carregar e descarregar mecanicamente a solução da agulha várias vezes para remover restos de vidro na agulha. Certifique-se de limpar a parede externa também.
- Lave o interior e o exterior da agulha duas vezes com água destilada para remover completamente o ácido crômico.
2. Coleta e criopreservação de CPGs
- Coleta de embriões
- Transferir um número adequado de moscas da estirpe dadora de interesse (cerca de 450 para cada sexo para o copo de colheita de embriões) para um copo de colheita de embriões com uma placa de colheita de embriões (Figura 1E) e incubá-las a 25 °C. Geralmente usamos moscas parentais de 3 a 5 dias de idade que são criadas em condições menos lotadas à temperatura ambiente (23-25 °C).
- Realize duas pré-coletas de 30 minutos e descarte os ovos colocados. Como as fêmeas podem reter ovos fertilizados que se desenvolvem no oviduto, esta etapa é necessária para sincronizar a postura de ovos na etapa 2.1.3 (Figura 4).
- Após as duas pré-coletas, coletar embriões por 50 min e, em seguida, incubar os embriões coletados em câmara umidificada a 25 °C para permitir que os embriões se desenvolvam até o estágio blastoderma (estágio inicial 517). O tempo de incubação é geralmente de 100 min, mas pode ser estendido até 120 min, dependendo da deformação (Figura 4).
NOTA: Uma câmara umidificada é feita colocando uma toalha de papel úmida no fundo de uma caixa de plástico e pulverizando-a com uma névoa de água antes de usar. Em embriões em estágio inicial 5, a formação de PGC é completa, mas a celularização somática não. O estágio exato de um embrião é determinado sob um microscópio composto na etapa 2.4.
- Embriões descorionantes
- Depositar uma gota de água destilada sobre um filtro de malha de aço inoxidável (150 mesh, abertura de 109 μm, diâmetro de fio de 60 μm; Figura 1F). Usando pinças, colete embriões da placa de coleta de embriões e coloque-os na gota de água.
- Pressione papel de seda contra o filtro por baixo para absorver a água. Adicione gotículas de solução fresca de hipoclorito de sódio a 5% (como Cl) aos embriões e bata continuamente no filtro durante 10 s.
- Lave os embriões salpicando-os diretamente com água destilada e pressione papel de seda contra o filtro por baixo para absorver a água. Repita esta etapa 3x.
- Alinhamento de embriões descorionados
- Sob um microscópio estéreo, use fórceps para transferir embriões. Alinhar os embriões descorionados em duas fileiras em uma lâmina de vidro de coleta de PGC ao longo das duas linhas de referência (Figura 2A). Os embriões são orientados com o seu lado anterior para a direita (o lado a ser manipulado) e ventral para cima.
NOTA: Esta etapa deve ser concluída em 20 min, durante o qual costumamos alinhar aproximadamente 40 embriões. - Afixe uma estrutura de piscina de embriões ao redor dos embriões na lâmina de vidro da coleta de PGC. Gotejar 1 μL da solução de CPA (1x solução de Ephrussi-Beadle Ringer, EBR, contendo 20% de etilenoglicol e 1 M de sacarose; 1x EBR: 130 mM de NaCl, 5 mM de KCl, 2 mM de CaCl2 e 10 mM de Hepes a pH 6,9) em dois pontos separados na área delimitada pela armação e encher a piscina com óleo de silicone para evitar que os embriões sequem (Figura 2A).
NOTA: Para preparar a solução de CPA, dissolver completamente 10,26 g de sacarose em aproximadamente 20 mL de H2O destilado contendo 3 mL de solução 10 x EBR. Adicionar 6 mL de etilenoglicol e, em seguida, adicionar H2O destilado até 30 mL. Após uma mistura completa, filtrar a solução através de uma membrana descartável de 0,22 mm.
- Sob um microscópio estéreo, use fórceps para transferir embriões. Alinhar os embriões descorionados em duas fileiras em uma lâmina de vidro de coleta de PGC ao longo das duas linhas de referência (Figura 2A). Os embriões são orientados com o seu lado anterior para a direita (o lado a ser manipulado) e ventral para cima.
- Coletando PGCs
- Coloque a lâmina de vidro de recolha de PGC do passo 2.3.2 no palco de um microscópio equipado com um sistema micromanipulador. Fixar a agulha no suporte capilar e trazer o primeiro embrião na fileira esquerda e a ponta da agulha para o mesmo plano focal. Coloque óleo de silicone na agulha por 2-3 s.
- Iniciar a coleta de PGC de embriões na linha esquerda. Usando uma lente objetiva de 20x, mova suavemente a ponta da agulha para a superfície da extremidade anterior do embrião e penetre o embrião em direção à extremidade posterior, não movendo a agulha, mas movendo o estágio do microscópio.
- Quando a ponta da agulha atingir a extremidade posterior, retraia levemente a agulha e descarregue completamente qualquer gema na agulha dentro da camada de células somáticas.
- Mantendo a pressão na agulha constante, mova a ponta da agulha para os CPGs apenas dentro do polo posterior e suavemente, mas sem levar muito tempo, carregue os CPGs.
- Puxe a agulha para fora do embrião rapidamente e despeje gema e outros contaminantes da agulha na piscina de óleo de silicone, mantendo os PGCs na agulha. Em seguida, carregue óleo de silicone limpo da piscina.
- Repita os passos 2.4.2 a 2.4.5 para os outros embriões na linha da esquerda. Antes de coletar PGCs de um novo embrião, deposite o máximo possível do óleo de silicone carregado na etapa 2.4.5 dentro da camada de células somáticas, mantendo os PGCs carregados na agulha. Isso garante que os PGCs recém-carregados sejam adjacentes aos PGCs coletados anteriormente, sem qualquer material interveniente entre eles.
- Depois de completar a coleta de PGC de embriões na fileira esquerda, separe os PGCs da gema e de outros contaminantes tanto quanto possível. Para conseguir isso, deposite todos os PGCs na agulha na superfície de um embrião e remova qualquer gema ou outros contaminantes para outro embrião vizinho.
- Em seguida, colete PGCs de embriões na fileira direita. Combine os PGCs coletados das linhas direita e esquerda.
- Aplicação de agente crioprotetor (CPA) em CPGs
- Depois de lavar a agulha com CPA em uma gota, carregar CPA fresco em outra gota na agulha e adicionar CPA aos CPG depositados no embrião. O volume de CPA deve ser equivalente ao dos CPG.
- Remova o máximo de CPA possível do cluster de PGCs 1-2 s após a adição de CPA. Os PGCs encolhem ligeiramente e tornam-se quadrados em forma imediatamente após a adição de CPA.
- Esvazie a agulha e, em seguida, carregue o óleo de silicone por 5 s ou mais. Carregue todos os PGCs coletados e, em seguida, carregue o óleo de silicone novamente por 5 s ou mais. Os PGCs agora são prensados entre duas camadas de óleo de silicone (Figura 2B).
NOTA: É importante remover o máximo possível de gema, CPA e outros contaminantes.
- PGCs criopreservadores
- Abra a torneira de três vias (Figura 1C) e, em seguida, desconecte a agulha do micromanipulador. Limpe o óleo da superfície da agulha com papel de seda macio. Não toque diretamente a ponta da agulha com o tecido.
- Fixe a agulha a um suporte de agulha e trave-a na posição na base com fita adesiva (Figura 1H). Afixe uma etiqueta no tubo do suporte.
- Congele rapidamente o suporte com a agulha apontada para baixo, submergindo-o em azoto líquido. Não solte o suporte até que o líquido pare de sair do rack.
- Armazene o suporte em um tanque de armazenamento de nitrogênio líquido na área de fase líquida, não na área de fase de vapor.
3. Descongelamento e transplante de CPG
- Coleta, descorionação e alinhamento de embriões de moscas hospedeiras agâmicas
- Coletar e descorionar embriões de moscas hospedeiras agaméticas seguindo a etapa 2.
- Alinhar os embriões hospedeiros agaméticos estágio 5 em uma lâmina de vidro de transplante. Porém, desta vez, orientar o posterior para a direita (lado a ser manipulado) e ventral para o topo (Figura 5). Alinhe aproximadamente 30 embriões em duas fileiras em 20 min.
- Durante o alinhamento dos embriões, operar um umidificador por 2-10 min se a umidade ambiente exigir (Tabela 1). A umidade ideal é de 30% a 40%, mas isso pode variar dependendo das condições térmicas.
- Descongelamento e transplante de PGCs em embriões hospedeiros
- Para descongelar rapidamente os PGCs criopreservados deslize o suporte que contém a agulha para a solução de EBR à temperatura ambiente 1x com a agulha apontando para baixo e mantenha-a submersa por 10 s.
- Coloque a lâmina de vidro do transplante no palco de um microscópio. Fixe a agulha congelada ao suporte capilar e coloque o primeiro embrião na fileira esquerda e a ponta da agulha no mesmo plano focal.
- Usando uma lente objetiva de 20x, mova suavemente a ponta da agulha para a superfície da extremidade posterior do embrião.
- Cutuque suavemente a parte externa de cada embrião e certifique-se de que eles retornem lentamente à sua forma original. A cutucada confirmará que a pressão interna do embrião não é muito alta ou muito baixa.
- Mova suavemente a agulha e penetre um embrião a partir do polo posterior.
- Depositar suavemente cerca de 10-20 PGCs apenas dentro do polo posterior, precisamente entre a membrana vitelínica e a camada de células somáticas do embrião. Evite depositá-los na camada de células somáticas. Se o líquido perivitelino vazar para fora do embrião, sugue o líquido vazado para dentro da agulha e remova-o.
- Retraia a agulha do embrião. Repetir as etapas 3.2.5 e 3.2.6 para os embriões subsequentes.
4. Incubação de embriões e recuperação de estirpes dadoras
- Remover os embriões que não recebem PGCs transplantados e incubar os embriões restantes em uma câmara umidificada (Figura 1G) a 25 °C.
- Em 24 h ou mais após o transplante e o mais rápido possível após a eclosão, use fórceps para pegar e transferir larvas eclodidas para frascos de alimentos padrão de Drosophila e incubar a 25 °C.
- Para reanimar a cepa, cruze fêmeas e machos recém-emergidos (Figura 6).
NOTA: Os hospedeiros agamáticos tornam possível restaurar todo o genoma de uma só vez sem cruzar para cepas de cromossomos balanceadores. A coexistência de machos agaméticos em um frasco não importa, pois as fêmeas, mesmo acasaladas com eles, não apresentam respostas pós-acasalamento em longo prazo, incluindo diminuição da receptividade à remação18,19.
Resultados
A eficiência do transplante criopreservado de PGC foi relatada por Asaoka et al.13 e é dada na Tabela 2 para transplante de PGCs criopreservados por 1 dia ou mais em nitrogênio líquido. A taxa de eclosão foi de 168/208 embriões transplantados (80,8%) e a viabilidade embrião-adulto foi de 87/208 (41,8%). A frequência de moscas férteis foi de 28/87 (32,2%). Essa frequência não diferiu entre os CPGs criopreservados por 8 a 30 dias e os criopreservados por 31-150 dias (20/57 vs. 8/30, G' = 0,63, p >0,1, g.l. = 1). O número médio de descendentes por casal foi de 77,2 ± 7,1 (n = 18, 28-122), indicando a capacidade das CPGs criopreservadas de se tornarem células-tronco germinativas. Das 26 agulhas, 10 não produziram descendência fértil, 7 agulhas produziram 1 progênie fértil, 7 agulhas produziram 2 progênie fértil e 2 agulhas produziram 3 ou 4 progênie fértil. O número médio de moscas férteis por agulha foi de 1,1 ± 0,2. Com base nesses dados, com 95% de confiança, 11 agulhas são suficientes para produzir 6 ou mais progênies, nas quais pelo menos uma fêmea e um macho provavelmente estão incluídos.
Nos experimentos acima, utilizamos embriões expressando mRNA de ovo-A em PGCs (nanos>ovo-A, OvoA_OE embriões) como hospedeiro agamético. De 669 fêmeas F1 e 720 machos F1 produzidos a partir de casais nanos>ovo-A transplantados, não houve escape derivado dos PGCs hospedeiros. Vários mutantes oskar (osk) também são agaméticos sensíveis à temperatura20,21. Como um mutante osk com alta viabilidade homozigótica e fenótipo agamético não está mais disponível, recriamos o mutante missense osk[8] 20 por edição do genoma assistida por CRISPR/Cas9. Essas moscas eram completamente agaméticas (0 escapadores de 230 fêmeas e 192 machos) a 25 °C, mas alguns escapadores emergiram a 23 °C (1 de 248 fêmeas e 1 de 290 machos). nanos>ovo-A são, portanto, recomendados como embriões hospedeiros agaméticos. Ambos os estoques UASp-ovo-A e nanos-Gal4 13 estarão disponíveis em breve no KYOTO Drosophila Stock Center.

Figura 1: Equipamento necessário. (A) Um sistema micromanipulador para coletar e transplantar células. i) microscópio invertido, ii) micromanipulador mecânico, iii) seringa, iv) suporte capilar, v) torneira de três vias, vi) umidificador e vii) estereomicroscópio. (B) Uma seringa. (C) Uma torneira de três vias e tubos de silicone conectam uma seringa e um suporte capilar. (D) Uma agulha e um suporte capilar são acoplados a um micromanipulador. (E) Copo de coleta de embriões com placa de coleta de embriões (6 cm de diâmetro e 7,7 cm de altura). (F) Um filtro de malha de aço inoxidável. (G) Um recipiente usado como câmara úmida com uma lâmina de vidro. Para manter a umidade, coloque papel molhado no fundo e feche a tampa. (H) Um porta-agulha com uma agulha para criopreservação. (I) Uma prateleira de armazenamento para criopreservação e uma caixa com agulhas. Clique aqui para ver uma versão maior desta figura.
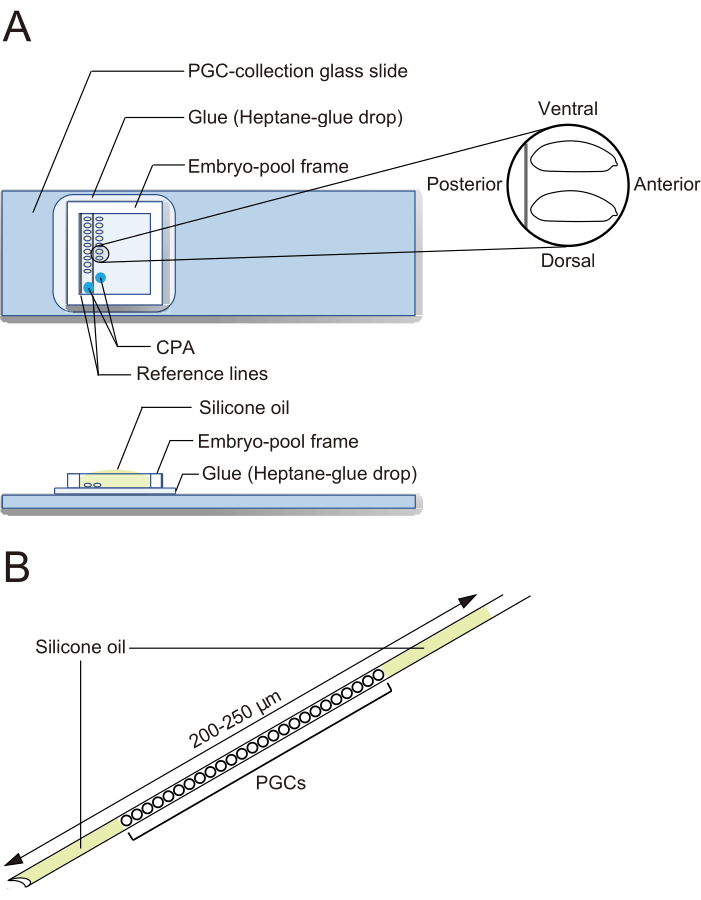
Figura 2: Lâmina de vidro coletora de PGC e agulha de criopreservação. (A) Uma lâmina de vidro de coleta de células germinativas primordiais (PGC) revestida com cola. Os embriões descorionados são alinhados em duas fileiras e orientados com o seu lado anterior para a direita (o lado a ser manipulado) e ventral para cima. Uma estrutura de piscina de embriões é afixada, duas gotas de solução de agentes crioprotetores (CPA) são depositadas e a piscina é preenchida com óleo de silicone. (B) Uma agulha deve conter a menor quantidade possível de gema e outros contaminantes. Os PGCs são prensados entre duas camadas de óleo de silicone quando criopreservados em nitrogênio líquido. Clique aqui para ver uma versão maior desta figura.
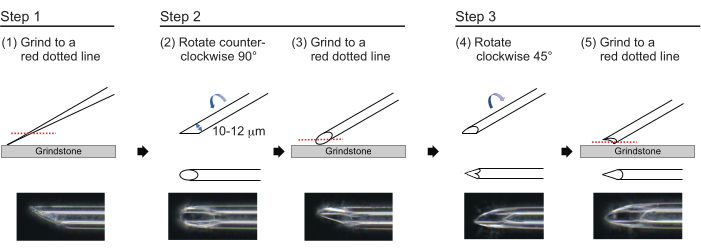
Figura 3: Confecção da agulha. Método de polimento de ponta em três etapas para fazer uma agulha com um tamanho de furo apropriado e uma ponta afiada. Clique aqui para ver uma versão maior desta figura.
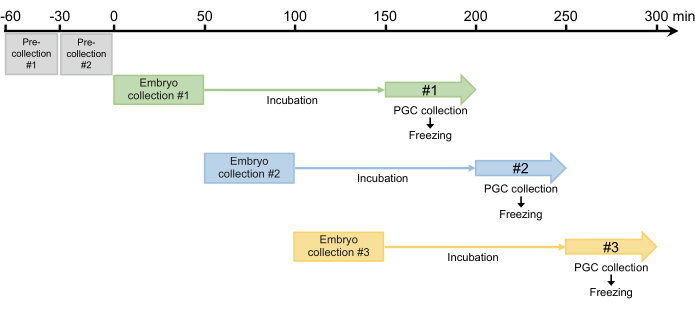
Figura 4: Esquema de colheita de embriões. Após duas pré-coletas, costumamos coletar três ou quatro vezes por dia. Clique aqui para ver uma versão maior desta figura.
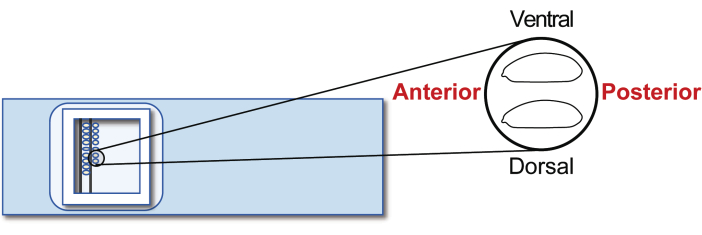
Figura 5: Alinhamento do embrião hospedeiro. Alinhamento dos embriões hospedeiros sobre uma lâmina de vidro. Clique aqui para ver uma versão maior desta figura.
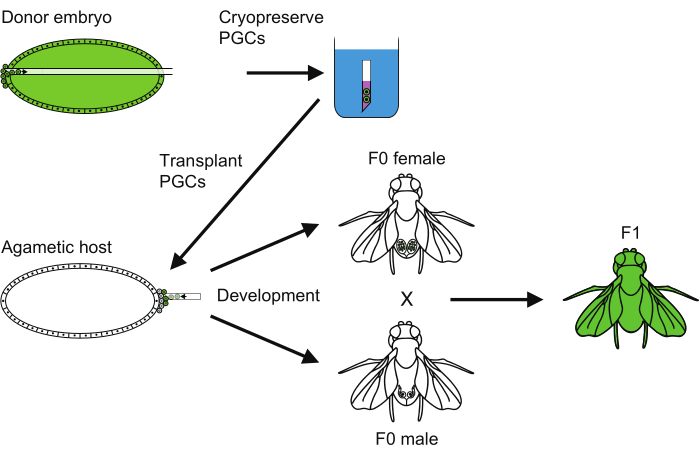
Figura 6: Visão geral do método de criopreservação PGC. Uma visão geral de todos os passos seguidos para realizar a criopreservação de células germinativas primordiais (PGC). Clique aqui para ver uma versão maior desta figura.
| Umidade ambiente | |||
| < 30% | ~ 30% | > 30% | |
| Alinhar embriões hospedeiros (~20 min) | Use um umidificador por 2 - 10 min | Use um umidificador intermitentemente por 1 min | Não use umidificador |
| Descongelar PGCs de doadores | Não aplicável | Não aplicável | Não aplicável |
| PGCs secos ao ar | Omitir esta etapa | Omitir esta etapa | 5 minutos |
| Aplicar óleo de silicone | Não aplicável | Não aplicável | Não aplicável |
| PGCs de transplante | Não aplicável | Não aplicável | Não aplicável |
| Todas essas etapas devem ser afinadas em 50 min. | |||
Tabela 1: Secagem dos embriões durante o alinhamento embrionário e descongelamento do PGC.
| Cepa do doador | Período de criopreservação | Número de embriões transplantados (A) | Número de larvas eclodidas (B) (eclosão, B/A) | Número de adultos fechados (C) (viabilidade ovo-adulto, C/A) | Número de adultos férteis (D) (frequência de moscas férteis, D/C) |
| M17 | 8 - 30 dias | 134 | 108 (80.6%) | 57 (42.5%) | 20 (35.1%) |
| M17 | 31 - 150 dias | 74 | 60 (81.1%) | 30 (40.5%) | 8 (26.7%) |
| M17: p.a.; TM6B, P{Dfd-GMR-nvYFP}4, Sb[1] Tb[1] ca[1]/ Pri[1] | |||||
Tabela 2: Eficiência do transplante criopreservado de PGC. Esta tabela é modificada de13. Todos os dados são de hospedeiros agaméticos.
Discussão
Um fator crítico para o sucesso na criopreservação e revitalização do PGC é o uso de bons embriões. Fêmeas jovens (por exemplo, de 3 a 5 dias de idade) devem ser usadas para a coleta de embriões. Tanto os embriões doadores quanto os hospedeiros são avaliados por inspeção microscópica, sendo utilizados apenas aqueles na fase blastodérmica (estágio 5)12. Para a coleta de PGC, geralmente alinhamos aproximadamente 40 embriões doadores em um período de 20 min e coletamos PGCs de aproximadamente 30 embriões no estágio inicial 5; embriões mais velhos e defeituosos não são usados. Após a criopreservação e descongelamento, os PGCs devem manter sua forma; Os PGCs rompem em preservação malsucedida. Os embriões hospedeiros também devem estar no estágio 5 e ter uma pressão interna moderada; Os embriões devem retornar lentamente à sua forma original após cutucar suavemente. Embriões excessivamente secos e insuficientemente secos não se desenvolverão normalmente após o transplante. Como o transplante heterossexual de PGCs não produz gametas em Drosophila 5,10, o transplante de PGCs de embriões de múltiplos doadores em embriões hospedeiros tem maior probabilidade de produzir adultos férteis. Para isso, costumamos coletar CPGs de aproximadamente 30 embriões por agulha.
Como crioprotetores, experimentamos etilenoglicol, dimetilsulfóxido e glicerol juntamente com sacarose em várias concentrações. Determinamos que o EBR contendo 20% de etilenoglicol e 1 M de sacarose é o melhor13; no entanto, o uso de diferentes crioprotetores pode melhorar a preservação do PGC22.
Este método de criopreservação requer habilidades especializadas no manuseio de PGC, e aproximadamente 6 semanas de treinamento são necessárias para coletar e transplantar PCGs confortavelmente. Para avaliar e melhorar a proficiência em habilidades, isso pode ser dividido em seis etapas de treinamento: 1) alinhar embriões em uma lâmina de vidro, 2) controlar um manipulador, 3) transplantar PGCs de um embrião para outro embrião sem criopreservação, 4) transplantar PGCs de 10 ou mais embriões em 5 a 10 embriões, 5) transplantar PGCs após a aplicação de CPA e 6) transplantar PGCs após congelamento-descongelamento. Cada etapa pode levar 1 semana. As metas de curto prazo na etapa 3 são uma taxa de eclosão de 40%, viabilidade embrião-adulto de 10%-20% e uma frequência de moscas férteis de 20%.
A criopreservação PGC requer instrumentação dispendiosa e pessoal altamente qualificado. Portanto, este método pode não ser adotado por muitos laboratórios. No entanto, o método atual de PGC tem vários aspectos importantes. Primeiro, os PGCs são muito menores que os embriões e são muito permeáveis aos crioprotetores. Em contraste, a permeabilidade crioprotetora é severamente limitada pelas camadas cerosas dos embriões de Drosophila, que é o problema mais sério na criopreservação de embriões. De fato, estudos anteriores fizeram grandes esforços para encontrar uma janela de tempo na qual os embriões têm uma alta taxa de sobrevivência e uma camada de cera mais fina. A segunda diz respeito à variação de desenvolvimento e morfológica entre as linhagens. As CPGs são coletadas de embriões em estágio inicial 5 (2 h 30 min-3 h 20 min após a postura dos óvulos), enquanto a criopreservação embrionária é realizada em embriões em estágio 16 (14-22 h após a postura). Os embriões são, portanto, muito mais velhos e apresentam variação de deformação muito maior na janela de tempo ideal para criopreservação em comparação com a criopreservação por PGC. De fato, a frequência de hospedeiros produzindo progênie derivada de doadores não variou entre as cinco cepas estudadas por Asaoka et al.13, embora os hospedeiros não fossem agaméticos. Além disso, as CPGs têm potencial para serem utilizadas em aplicações de engenharia genética, como a edição do genoma 14,15,16.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Agradecemos ao KYOTO Drosophila Stock Center pelas cepas de moscas. Agradecemos também à Sra. Wanda Miyata pela edição do manuscrito em inglês e ao Dr. Jeremy Allen de Edanz (https://jp.edanz.com/ac) pela edição de um rascunho deste manuscrito. Este trabalho foi apoiado por subsídios (JP16km0210072, JP17km0210146, JP18km0210146) da Agência Japonesa de Pesquisa e Desenvolvimento Médico (AMED) para T.T.-S.-K., subsídios (JP16km0210073, JP17km0210147, JP18km0210145) da AMED para S.K., uma concessão (JP20km0210172) da AMED para T.T.-S.-K. e S.K., um Grant-in-Aid for Scientific Research (C) (JP19K06780) da Japan Society for the Promotion of Science (JSPS) para T.T.-S.-K., e um Grant-in-Aid for Scientific Research on Innovative Areas (JP18H05552) da JSPS para S.K.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetic acid | FUJIFILM Wako Pure Chemical Corporation | 017-00256 | For embryo collection |
| Agar powder | FUJIFILM Wako Pure Chemical Corporation | 010-08725 | For embryo collection |
| Calcium chloride | FUJIFILM Wako Pure Chemical Corporation | 038-24985 | For EBR solution |
| Capillary | Sutter Instrument | B100-75-10-PT | BOROSILICATE GLASS; O.D: 1.0mm, I.D: 0.75mm , length: 10cm, 225Pcs |
| Capillary holder | Eppendorf | 5196 081.005 | Capillary holder 4; for micromanipulation |
| Chromic acid mixture | FUJIFILM Wako Pure Chemical Corporation | 037-05415 | For needle washing |
| CPA solution | 1x EBR containing 20% ethylene glycol and 1M sucrose | ||
| Double-sided tape | 3M | Scotch w-12 | For glue extracting |
| Ephrussi–Beadle Ringer solution (EBR) | 130 mM NaCl, 5 mM KCl, 2 mM CaCl2, and 10 mM Hepes at pH 6.9 | ||
| Ethanol (99.5) | FUJIFILM Wako Pure Chemical Corporation | 057-00451 | For embryo collection |
| Ethylene glycol | FUJIFILM Wako Pure Chemical Corporation | 054-00983 | For CPA solution |
| Falcon 50 mm x 9 mm bacteriological petri dish | Corning Inc. | 351006 | For embryo collection |
| Forceps | Vigor | Type5 Titan | For embryo handling |
| Grape juice | Asahi Soft Drinks Co., LTD. | Welch's Grape 100 | For embryo collection |
| Grape juice agar plate | 50% grape juice, 2% agar, 1% ethanol, 1% acetic acid | ||
| Heptane | FUJIFILM Wako Pure Chemical Corporation | 084-08105 | For glue extracting |
| Humidifier | APIX INTERNATIONAL CO., LTD. | FSWD2201-WH | For embryo preparation |
| Inverted microscope | Leica Microsystems GmbH | Leica DM IL LED | For micromanipulation |
| Luer-lock glass syringe | Tokyo Garasu Kikai Co., Ltd. | 0550 14 71 08 | Coat a plunger with silicon oil (FL-100-450CS);for micromanipulation |
| Mechanical micromanipulator | Leica Microsystems GmbH | For micromanipulation | |
| Micro slide glass | Matsunami Glass Ind., Ltd. | S-2441 | For embryo aligning |
| Microgrinder | NARISHIGE Group | Custom order | EG-401-S combined EG-401 and MF2 (with ocular lens MF2-LE15 ); for needle preparation |
| Microscope camera | Leica Microsystems GmbH | Leica MC170 HD | For micromanipulation |
| Needle holder | Merck KGaA | Eppendorf TransferTip (ES) | For cryopreservation |
| Potassium chloride | Nacalai Tesque, Inc. | 28514-75 | For EBR solution |
| Puller | NARISHIGE Group | PN-31 | For needle preparation; the heater level is set to 85.0-98.4, the magnet main level to 57.8, and the magnet sub level to 45.0. |
| PVC adhesive tape for electric insulation | Nitto Denko Corporation | J2515 | For embryo-pool frame |
| Silicon oil | Shin-Etsu Chemical, Co, Ltd. | FL-100-450CS | For embryo handling |
| Sodium chloride | Nacalai Tesque, Inc. | 31320-05 | For EBR solution |
| Sodium hypochlorite solution | FUJIFILM Wako Pure Chemical Corporation | 197-02206 | Undiluted and freshly prepared; for embryo breaching |
| Sucrose | Nacalai Tesque, Inc. | 30404-45 | For CPA solution |
Referências
- Brüschweiler, W., Gehring, W. A method for freezing living ovaries of Drosophila melanogaster larvae and its application to the storage of mutant stocks. Experientia. 29, 134-135 (1973).
- Steponkus, P. L., et al. Cryopreservation of Drosophila melanogaster embryos. Nature. 345, 170-172 (1990).
- Mazur, P., Cole, K. W., Hall, J. W., Schreuders, P. D., Mahowald, A. P. Cryobiological preservation of Drosophila embryos. Science. 258 (5090), 1932-1935 (1992).
- Zhan, L., Li, M. G., Hays, T., Bischof, J. Cryopreservation method for Drosophila melanogaster embryos. Nat Comm. 12, 2412 (2021).
- Van Deusen, E. B. Sex determination in germ line chimeras of Drosophila melanogaster. Development. 37 (1), 173-185 (1977).
- Breen, T. R., Duncan, I. M. Maternal expression of genes that regulate the bithorax complex of Drosophila melanogaster. Dev Biol. 118, 442-456 (1986).
- Schupbach, T., Wieschaus, E. Germline autonomy of maternal-effect mutations altering the embryonic body pattern of Drosophila. Dev Biol. 113, 443-448 (1986).
- Irish, V., Lehmann, R., Akam, M. The Drosophila posterior-group gene nanos functions by repressing hunchback activity. Nature. 338, 646-648 (1989).
- Hülskamp, M., Schröder, C., Pfeifle, C., Jäckle, H., Tautz, D. Posterior segmentation of the Drosophila embryo in the absence of a maternal posterior organizer gene. Nature. 338, 629-632 (1989).
- Steinmann-Zwicky, M., Schmid, H., Nöthiger, R. Cell-autonomous and inductive signals can determine the sex of the germ line of Drosophila by regulating the gene Sxl. Cell. 57 (1), 157-166 (1989).
- Stein, D., Roth, S., Vogelsang, E., Nüsslein-Volhard, C. The polarity of the dorsoventral axis in the drosophila embryo is defined by an extracellular signal. Cell. 65 (5), 725-735 (1991).
- Kobayashi, S., Yamada, M., Asaoka, M., Kitamura, T. Essential role of the posterior morphogen nanos for germline development in Drosophila. Nature. 380, 708-711 (1996).
- Asaoka, M., et al. Offspring production from cryopreserved primordial germ cells in Drosophila. Comm Biol. 4 (1), 1159 (2021).
- Blitz, I. L., Fish, M. B., Cho, K. W. Y. Leapfrogging: primordial germ cell transplantation permits recovery of CRISPR/Cas9-induced mutations in essential genes. Development. 143 (15), 2868-2875 (2016).
- Koslová, A., et al. Precise CRISPR/Cas9 editing of the NHE1 gene renders chickens resistant to the J subgroup of avian leukosis virus. Proc Natl Acad Sci U S A. 117 (4), 2108-2112 (2020).
- Zhang, F. Efficient generation of zebrafish maternal-zygotic mutants through transplantation of ectopically induced and Cas9/gRNA targeted primordial germ cells. J Genet Genom. 47 (1), 37-47 (2020).
- Campos-Ortega, J. A., Hartenstein, V. Stages of Drosophila Embryogenesis. The Embryonic Development of Drosophila. , (1997).
- Manning, A. A sperm factor affecting the receptivity of Drosophila melanogaster females. Nature. 194, 252-253 (1962).
- Kubli, E. Sex-peptides: seminal peptides of the Drosophila male. Cell Mol Life Sci. 60, 1689-1704 (2003).
- Lehmann, R., Nüsslein-Volhard, C. Abdominal segmentation, pole cell formation, and embryonic polarity require the localized activity of oskar, a maternal gene in drosophila. Cell. 47 (1), 141-152 (1986).
- Kiger, A. A., Gigliotti, S., Fuller, M. T. Developmental genetics of the essential Drosophila Nucleoporin nup154: allelic differences due to an outward-directed promoter in the P-element 3′ end. Genetics. 153 (2), 799-812 (1999).
- Rienzi, L. F., et al. Perspectives in gamete and embryo cryopreservation. Semin Reprod Med. 36 (5), 253-264 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados