Criopreservación de células germinales primordiales y reactivación de cepas de Drosophila
* These authors contributed equally
In This Article
Summary
Es muy deseable un método de conservación a largo plazo para las cepas de Drosophila como alternativa a la transferencia frecuente de moscas adultas a viales de alimentos frescos. Este protocolo describe la criopreservación de células germinales primordiales de Drosophila y la reactivación de cepas a través de su trasplante a embriones de huésped agavésico.
Abstract
Las cepas de Drosophila deben mantenerse mediante la transferencia frecuente de moscas adultas a nuevos viales. Esto conlleva un peligro de deterioro mutacional y cambios fenotípicos. Por lo tanto, es imperativo desarrollar un método alternativo para la conservación a largo plazo sin tales cambios. A pesar de los intentos exitosos anteriores, la criopreservación de embriones de Drosophila todavía no es de utilidad práctica debido a su baja reproducibilidad. Aquí, describimos un protocolo para la criopreservación de células germinales primordiales (PGC) y la reactivación de cepas mediante el trasplante de PGC criopreservadas en embriones hospedadores de Drosophila melanogaster (D. melanogaster) agastéticos. Las CGP son altamente permeables a los agentes crioprotectores (CPA), y la variación morfológica y de desarrollo entre cepas es menos problemática que en la criopreservación de embriones. En este método, las PGC se recolectan de aproximadamente 30 embriones de donantes, se cargan en una aguja después del tratamiento con CPA y luego se criopreservan en nitrógeno líquido. Para producir gametos derivados de donantes, las PGC criopreservadas en una aguja se descongelan y luego se depositan en aproximadamente 15 embriones de huésped agastético. Con este protocolo se logró una frecuencia de al menos un 15% de moscas fértiles, y el número de progenie por pareja fértil fue siempre más que suficiente para revivir la cepa original (el número promedio de progenie es de 77,2 ± 7,1), lo que indica la capacidad de las PGC criopreservadas para convertirse en células madre de la línea germinal. El número promedio de moscas fértiles por acícula fue de 1,1 ± 0,2, y 9 de 26 acículas produjeron dos o más progenies fértiles. Se encontró que 11 agujas son suficientes para producir 6 o más descendientes, en las que probablemente se incluyan al menos una hembra y un macho. El huésped agagmático permite revivir la cepa rápidamente simplemente cruzando moscas hembra y macho recién emergidas. Además, las PGC tienen el potencial de ser utilizadas en aplicaciones de ingeniería genética, como la edición del genoma.
Introduction
El mantenimiento de cepas de Drosophila mediante la transferencia de moscas adultas a nuevos viales de alimento resulta inevitablemente en la acumulación de mutaciones y cambios epigenéticos a lo largo del tiempo. Es imperativo desarrollar un método alternativo para el mantenimiento a largo plazo de las cepas de Drosophila sin tales cambios, especialmente para las cepas de referencia en las que se debe mantener el genoma completo. Se han descrito varios intentos exitosos de criopreservar embriones u ovarios de Drosophila 1,2,3. Desafortunadamente, todavía no son de uso práctico debido a su baja reproducibilidad. De hecho, los embriones en estadios tempranos tienen una baja tasa de supervivencia después de la criopreservación debido a su alto contenido en yema, lo que impide la permeabilidad y difusión del agente crioprotector (CPA) 2,3. La permeabilidad a la CPA también está severamente limitada por las capas cerosas de los embriones en etapa tardía. Es difícil y requiere mucho tiempo encontrar un período de tiempo específico de la cepa en el que los embriones tengan una alta tasa de supervivencia y una capa de cera más delgada. Recientemente, Zhan et al.4 mejoraron los métodos de permeabilización embrionaria, carga de CPA y vitrificación y criopreservaron con éxito embriones de múltiples cepas. Sin embargo, los métodos no son fáciles de aplicar porque la viabilidad de los embriones después de la permeabilización tiende a ser pobre. Por lo tanto, todavía es necesario seguir mejorando y desarrollando enfoques alternativos. Los métodos que implican la criopreservación de células germinales primordiales (PGC) son un enfoque alternativo para el mantenimiento a largo plazo de las cepas de Drosophila.
El trasplante de PGC (también llamado de células polares) se ha utilizado para generar quimeras de la línea germinal, especialmente en hembras, para estudiar procesos como los efectos maternos de las mutaciones letales cigóticas y la determinación del sexo de las células germinales 5,6,7,8,9,10,11,12 . Las CGP son mucho más pequeñas que los embriones y es probable que sean muy permeables a la mayoría de los crioprotectores. Además, la variación morfológica y de desarrollo entre cepas es menos problemática, y un huésped agastático permite una rápida restauración de genomas completos. Recientemente hemos desarrollado un nuevo método de criopreservación de PGC13, que previene los cambios genéticos y epigenéticos que de otro modo serían inevitables en las cepas de Drosophila. A continuación, presentamos el protocolo detallado.
Este método de criopreservación requiere conocimientos específicos en el manejo e instrumentación de PGC. Si bien un enfoque paso a paso puede ser una solución eficiente para aquellos que no están familiarizados con él, puede no ser adecuado para laboratorios pequeños debido a los requisitos de instrumentación. Este protocolo de criopreservación de PGC se puede adaptar más fácilmente para su uso con diferentes especies de Drosophila y diferentes especies de insectos que los protocolos de criopreservación de embriones debido a las diferencias morfológicas y de desarrollo más pequeñas. Las PGC también pueden utilizarse potencialmente en aplicaciones de ingeniería genética, como la edición del genoma 14,15,16. En resumen, este método se puede utilizar en centros de almacenamiento y otros laboratorios para mantener las cepas de moscas y otros insectos durante períodos prolongados de tiempo sin cambios.
Protocol
1. Preparación del equipo
- Sistema de micromanipulación: Ensamble un sistema de micromanipulador para recolectar y trasplantar células (Figura 1A).
- Portaobjetos de vidrio de recolección de PGC (Figura 2A)
- Para preparar el pegamento de heptano, corte cinta adhesiva de doble cara de aproximadamente 30 cm de largo y sumérjala durante la noche en 7 ml de solución de heptano de grado técnico (regular).
- Dibuja dos líneas de referencia paralelas para la alineación de embriones en la parte posterior de un portaobjetos de vidrio.
- Extienda gotas del pegamento de heptano anterior en el portaobjetos de vidrio (en el lado sin las líneas) con una pipeta Pasteur. Seque al aire la superficie del portaobjetos hasta que se vuelva blanca.
- Repita la adición y extensión de gotas de pegamento de heptano y seque el portaobjetos nuevamente.
NOTA: El pegamento evita que las soluciones líquidas se esparzan sobre la superficie plana y facilita la carga de soluciones acuosas en una aguja. - Para hacer marcos de piscinas embrionarias, pegue tres capas de cinta de vinilo estándar de 0,2 mm de grosor, como cinta aislante, en una tabla de cortar. Corta la cinta en rectángulos de 1,5 cm de ancho. A continuación, corta las tres capas de cinta adhesiva, dejando un marco de 2 a 3 mm.
NOTA: Después de alinear los embriones, se coloca un marco de reserva de embriones para formar una piscina para los embriones.
- Agujas de trasplante
NOTA: Todas las agujas disponibles comercialmente en el momento de este estudio eran demasiado estrechas o demasiado anchas para la criopreservación de PGC.- Haz una aguja con un capilar de vidrio y un extractor. Utilizamos un extractor NARISHIGE PN-31 con el nivel del calentador en 85.0-98.4, el nivel principal del imán en 57.8 y el subnivel del imán en 45.0.
- Para hacer una aguja con un grosor de pared aproximado de 1 μm y una punta de aproximadamente 200 μm de longitud con un diámetro interior de 10-12 μm, pula la punta de la aguja en el siguiente proceso de tres pasos (Figura 3). Primero, muela la punta de la aguja en un ángulo de 30° a una velocidad de 780 rpm hasta que la punta tenga un diámetro interior de 10-12 μm. Este primer paso de molienda dura aproximadamente 1 h.
NOTA: Para evitar romper la punta de la aguja, primero gire la piedra de afilar y luego mueva suavemente la aguja hacia abajo sobre la piedra de afilar. - Dibuja una línea en la parte superior de la aguja para trazar el ángulo deseado. Gire la aguja en sentido contrario a las agujas del reloj a 90° y vuelva a pulirla a una velocidad de 180 rpm. Esto toma aproximadamente 5 min.
- Gire la aguja en el sentido de las agujas del reloj 45° y pula a una velocidad de 180 rpm durante un segundo.
- Coloque un portaobjetos de vidrio de recolección con una gota de mezcla de ácido crómico (PRECAUCIÓN: tóxico) en la platina del microscopio. Coloque la aguja en el soporte capilar (Figura 1D) en un ángulo de 10°-13° con respecto a la superficie del portaobjetos, mueva con cuidado la aguja hacia abajo y sumerja la punta en la mezcla de ácido crómico.
- Al tirar y empujar el émbolo (Figura 1B), cargue y descargue mecánicamente la solución de la aguja varias veces para eliminar los restos de vidrio en la aguja. Asegúrese de limpiar también la pared exterior.
- Lave el interior y el exterior de la aguja dos veces con agua destilada para eliminar el ácido crómico por completo.
2. Recolección y criopreservación de PGCs
- Recolección de embriones
- Transferir un número adecuado de moscas de la cepa donante de interés (aproximadamente 450 para cada sexo para el vaso de recogida de embriones) a un vaso de recogida de embriones con una placa de recogida de embriones (Figura 1E) e incubarlas a 25 °C. Por lo general, utilizamos moscas parentales de 3 a 5 días de edad que se crían en condiciones de hacinamiento a temperatura ambiente (23-25 °C).
- Realice dos precolectas de 30 minutos y deseche los huevos puestos. Debido a que las hembras pueden retener los huevos fertilizados que se desarrollan en el oviducto, este paso es necesario para sincronizar la puesta de huevos en el paso 2.1.3 (Figura 4).
- Después de las dos pre-recolecciones, recolectar embriones durante 50 min y luego incubar los embriones recolectados en una cámara humidificada a 25 °C para permitir que los embriones se desarrollen hasta la etapa de blastodermo (etapa temprana 517). El tiempo de incubación suele ser de 100 min, pero puede extenderse hasta 120 min, dependiendo de la cepa (Figura 4).
NOTA: Una cámara humidificada se hace colocando una toalla de papel húmeda en el fondo de una caja de plástico y rociándola con una niebla de agua antes de usarla. En los embriones de la etapa 5 temprana, la formación de PGC está completa, pero la celularización somática no lo está. El estadio exacto de un embrión se determina bajo un microscopio compuesto en el paso 2.4.
- Embriones decorionantes
- Depositar una gota de agua destilada en un colador de malla de acero inoxidable (malla de 150, abertura de 109 μm, diámetro de alambre de 60 μm; Figura 1F). Con unas pinzas, recoja los embriones de la placa de recolección de embriones y colóquelos en la gota de agua.
- Presiona el papel de seda contra el colador desde abajo para absorber el agua. Añadir gotas de solución fresca de hipoclorito sódico al 5% (como Cl) a los embriones y golpear continuamente el colador durante 10 s.
- Lava los embriones salpicándolos directamente con agua destilada y presiona papel de seda contra el colador desde abajo para absorber el agua. Repita este paso 3 veces.
- Alineación de embriones decorionados
- Bajo un microscopio estereoscópico, use fórceps para transferir embriones. Alinee los embriones decorionados en dos filas en un portaobjetos de vidrio de recolección de PGC a lo largo de las dos líneas de referencia (Figura 2A). Los embriones están orientados con su lado anterior a la derecha (el lado a manipular) y ventral hacia arriba.
NOTA: Este paso debe terminarse en 20 min, durante los cuales solemos alinear aproximadamente 40 embriones. - Coloque un marco de reserva de embriones alrededor de los embriones en el portaobjetos de vidrio de recolección de PGC. Dejar caer 1 μL de solución de CPA (1x solución Ephrussi-Beadle Ringer, EBR, que contiene 20% de etilenglicol y 1 M de sacarosa; 1x EBR: 130 mM de NaCl, 5 mM de KCl, 2 mM de CaCl2 y 10 mM de Hepes a pH 6,9) en dos puntos separados en el área encerrada por el marco y llenar la piscina con aceite de silicona para evitar que los embriones se sequen (Figura 2A).
NOTA: Para preparar la solución de CPA, disuelva completamente 10,26 g de sacarosa en aproximadamente 20 ml de H2O destilado que contenga 3 ml de solución 10 x EBR. Agregue 6 mL de etilenglicol y luego agregue H2O destilado hasta 30 mL. Después de mezclar bien, filtre la solución a través de una membrana desechable de 0,22 mm.
- Bajo un microscopio estereoscópico, use fórceps para transferir embriones. Alinee los embriones decorionados en dos filas en un portaobjetos de vidrio de recolección de PGC a lo largo de las dos líneas de referencia (Figura 2A). Los embriones están orientados con su lado anterior a la derecha (el lado a manipular) y ventral hacia arriba.
- Recolección de PGC
- Coloque el portaobjetos de vidrio de recogida de PGC del paso 2.3.2 en la platina de un microscopio equipado con un sistema de micromanipulación. Coloque la aguja en el soporte capilar y coloque el primer embrión de la fila izquierda y la punta de la aguja en el mismo plano focal. Cargue aceite de silicona en la aguja durante 2-3 s.
- Comience la recolección de PGC de los embriones de la fila izquierda. Usando una lente de objetivo de 20x, mueva suavemente la punta de la aguja hacia la superficie del extremo anterior del embrión y penetre el embrión hacia el extremo posterior, no moviendo la aguja sino moviendo la platina del microscopio.
- Cuando la punta de la aguja llegue al extremo posterior, retraiga ligeramente la aguja y descargue completamente la yema de la aguja justo dentro de la capa de células somáticas.
- Mientras mantiene constante la presión en la aguja, mueva la punta de la aguja hacia los PGC justo dentro del polo posterior y suavemente, pero sin tomar mucho tiempo, cargue los PGC.
- Saque la aguja del embrión rápidamente y descargue la yema y otros contaminantes de la aguja en la piscina de aceite de silicona, manteniendo los PGC en la aguja. Luego, cargue aceite de silicona limpio de la piscina.
- Repita los pasos 2.4.2 a 2.4.5 para los otros embriones de la fila izquierda. Antes de recolectar PGC de un nuevo embrión, deposite la mayor cantidad posible de aceite de silicona cargado en el paso 2.4.5 dentro de la capa de células somáticas mientras mantiene las PGC cargadas en la aguja. Esto garantiza que los PGC recién cargados sean adyacentes a los PGC recolectados previamente sin ningún material intermedio entre ellos.
- Después de completar la recolección de PGC de los embriones de la fila izquierda, separe los PGC de la yema y otros contaminantes tanto como sea posible. Para lograr esto, deposite todas las PGC en la aguja sobre la superficie de un embrión y elimine la yema u otros contaminantes a otro embrión vecino.
- A continuación, recoja las CGP de los embriones de la fila derecha. Combine los PGC recopilados de las filas derecha e izquierda.
- Aplicación de un agente crioprotector (CPA) a los PGC
- Después de lavar la aguja con CPA en una gota, cargue CPA fresco en otra gota en la aguja y agregue CPA a las PGC depositadas en el embrión. El volumen de CPA debe ser equivalente al de los PGC.
- Elimine la mayor cantidad posible de CPA del grupo de PGC 1-2 s después de la adición de CPA. Los PGC se encogen ligeramente y adquieren forma cuadrada inmediatamente después de la adición de CPA.
- Vacíe la aguja y luego cargue aceite de silicona durante 5 s o más. Cargue todos los PGC recolectados y luego cargue el aceite de silicona una vez más durante 5 s o más. Los PGC ahora están intercalados entre dos capas de aceite de silicona (Figura 2B).
NOTA: Es importante eliminar la mayor cantidad posible de yema, CPA y otros contaminantes.
- Cría de PGC
- Abra la llave de paso de tres vías (Figura 1C) y luego separe la aguja del micromanipulador. Seca el aceite de la superficie de la aguja con papel de seda suave. No toque directamente la punta de la aguja con el pañuelo.
- Fije la aguja a un portaagujas y asegúrela en su posición en la base con cinta de vinilo (Figura 1H). Coloque una etiqueta en el tubo de soporte.
- Congele rápidamente el soporte con la aguja apuntando hacia abajo sumergiéndolo en nitrógeno líquido. No suelte el soporte hasta que el líquido deje de salir burbujeando de la rejilla.
- Guarde el soporte en un tanque de almacenamiento de nitrógeno líquido en el área de la fase líquida, no en el área de la fase de vapor.
3. Descongelación y trasplante de PGC
- Recolección, descorionación y alineación de embriones de moscas hospedadoras agamáticas
- Recoja y decorione embriones de moscas hospedadoras agamáticas siguiendo el paso 2.
- Alinee los embriones del huésped agámax en etapa 5 en un portaobjetos de vidrio para trasplantes. Sin embargo, esta vez, orienta la posterior hacia la derecha (el lado a manipular) y la ventral hacia arriba (Figura 5). Alinee aproximadamente 30 embriones en dos filas en 20 minutos.
- Mientras alinea los embriones, opere un humidificador durante 2-10 minutos si la humedad de la habitación lo requiere (Tabla 1). La humedad ideal es del 30% al 40%, pero esto puede variar dependiendo de las condiciones térmicas.
- Descongelación y trasplante de CGP en embriones hospedadores
- Para descongelar rápidamente los PGC criopreservados, deslice el soporte que contiene la aguja en una solución 1x EBR a temperatura ambiente con la aguja apuntando hacia abajo y manténgalo sumergido durante 10 s.
- Coloque el portaobjetos de vidrio para trasplantes en la platina de un microscopio. Coloque la aguja liofilizada y descongelada en el soporte capilar y coloque el primer embrión de la fila izquierda y la punta de la aguja en el mismo plano focal.
- Con una lente de objetivo de 20x, mueva suavemente la punta de la aguja hacia la superficie del extremo posterior del embrión.
- Pincha suavemente el exterior de cada embrión y asegúrate de que poco a poco vuelvan a su forma original. La punzada confirmará que la presión interna del embrión no es ni demasiado alta ni demasiado baja.
- Mueva suavemente la aguja y penetre un embrión desde el polo posterior.
- Depositar suavemente aproximadamente 10-20 PGCs justo dentro del polo posterior, precisamente entre la membrana vitelina y la capa de células somáticas del embrión. Evite depositarlos en la capa de células somáticas. Si el líquido perivitelina se escapa del embrión, succiona el líquido filtrado en la aguja y retíralo.
- Retraiga la aguja del embrión. Repita los pasos 3.2.5 y 3.2.6 para los embriones siguientes.
4. Incubación de embriones y restauración de cepas donantes
- Extraer los embriones que no reciban PGC trasplantados e incubar los embriones restantes en una cámara humidificada (Figura 1G) a 25 °C.
- A las 24 h o más después del trasplante y tan pronto como sea posible después de la eclosión, utilice fórceps para recoger y transferir las larvas eclosionadas a viales de alimento estándar de Drosophila e incubar a 25 °C.
- Para revivir la cepa, cruce hembras y machos recién emergidos (Figura 6).
NOTA: Los huéspedes agastéticos permiten restaurar todo el genoma a la vez sin cruzarse con cepas cromosómicas equilibradas. La coexistencia de machos agaméticos en un vial no importará porque las hembras, incluso si se aparean con ellos, no muestran respuestas posteriores al apareamiento a largo plazo, incluida la disminución de la receptividad a la regeneración18,19.
Representative Results
La eficacia del trasplante de PGC criopreservado ha sido reportada por Asaoka et al.13 y se indica en la Tabla 2 para el trasplante de PGC criopreservadas durante 1 día o más en nitrógeno líquido. La tasa de eclosión fue de 168/208 embriones trasplantados (80,8%) y la viabilidad de embrión a adulto fue de 87/208 (41,8%). La frecuencia de moscas fértiles fue de 28/87 (32,2%). Esta frecuencia no difirió entre las CGP criopreservadas durante 8 a 30 días y para las criopreservadas durante 31-150 días (20/57 vs. 8/30, G' = 0,63, p >0,1, d.f. = 1). El número promedio de descendientes por pareja fue de 77,2 ± 7,1 (n = 18, 28-122), lo que indica la capacidad de las PGC criopreservadas para convertirse en células madre de la línea germinal. De las 26 agujas, 10 no produjeron progenie fértil, 7 agujas produjeron 1 progenie fértil, 7 agujas produjeron 2 progenie fértil y 2 agujas produjeron 3 o 4 progenie fértil. El número promedio de moscas fértiles por acícula fue de 1,1 ± 0,2. Con base en estos datos, con un 95% de confianza, 11 agujas son suficientes para producir 6 o más descendientes, en los que es probable que se incluyan al menos una hembra y un macho.
En los experimentos anteriores, utilizamos embriones que expresan ARNm de ovo-A en PGC (nanos>ovo-A, OvoA_OE embriones) como huésped agástico. De las 669 hembras F1 y 720 machos F1 producidos a partir de parejas nanos>ovo-A trasplantadas, no hubo ningún escapante derivado de las PGC del huésped. Varios mutantes oskar (osk) también son gaméticos sensibles a la temperatura20,21. Debido a que ya no se dispone de un mutante osk con alta viabilidad homocigota y el fenotipo agavésico, recreamos el mutante20 con cambio de sentido osk[8] mediante edición genómica asistida por CRISPR/Cas9. Estas moscas eran completamente agamáticas (0 escapadas de 230 hembras y 192 machos) a 25 °C, pero algunas escapadas emergieron a 23 °C (1 de 248 hembras y 1 de 290 machos). Por lo tanto, los nanos>ovo-A se recomiendan como embriones de huésped agastético. Tanto las existencias de UASp-ovo-A como las de nanos-Gal4 13 estarán disponibles pronto en el Centro de Existencias de Drosophila de KYOTO.

Figura 1: Equipo necesario. (A) Un sistema de micromanipulación para recolectar y trasplantar células. i) microscopio invertido, ii) micromanipulador mecánico, iii) jeringa, iv) soporte capilar, v) llave de paso de tres vías, vi) humidificador y vii) microscopio estereoscópico. (B) Una jeringa. (C) Una llave de paso de tres vías y tubos de silicona conectan una jeringa y un soporte capilar. (D) Una aguja y un soporte capilar están unidos a un micromanipulador. (E) Un vaso de recolección de embriones con una placa de recolección de embriones (6 cm de diámetro, 7,7 cm de alto). (F) Un colador de malla de acero inoxidable. (G) Un recipiente utilizado como cámara húmeda con un portaobjetos de vidrio. Para mantener la humedad, coloque papel mojado en el fondo y cierre la tapa. (H) Un soporte de aguja con una aguja para criopreservación. (I) Un estante de almacenamiento para criopreservación y una caja con agujas. Haga clic aquí para ver una versión más grande de esta figura.
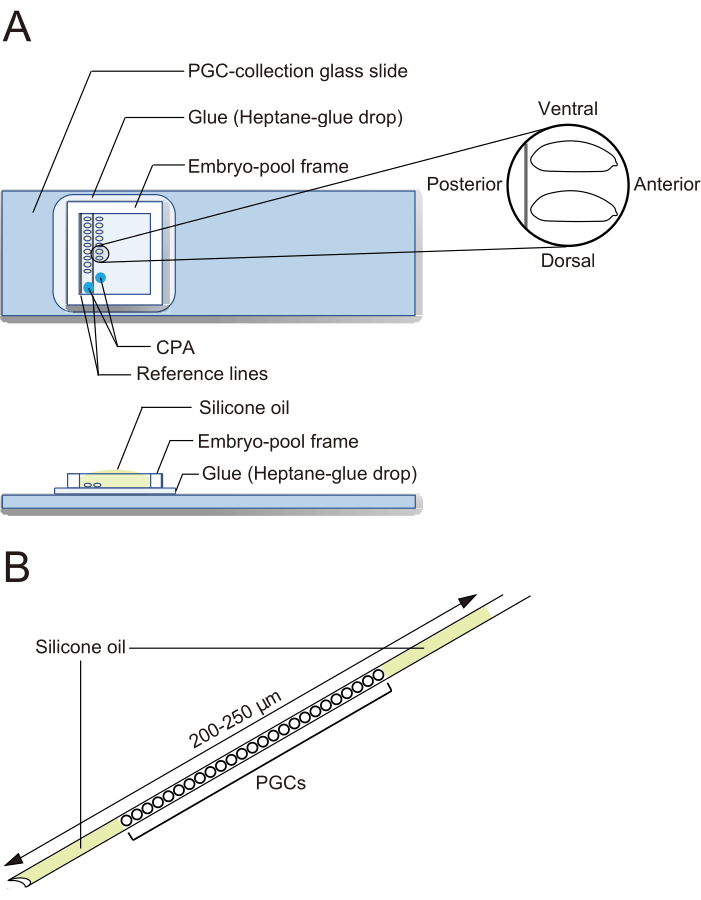
Figura 2: Un portaobjetos de vidrio de recolección de PGC y una aguja de criopreservación. (A) Un portaobjetos de vidrio de recolección de células germinales primordiales (PGC) recubierto con pegamento. Los embriones decorionados se alinean en dos filas y se orientan con la parte anterior hacia la derecha (el lado a manipular) y el lado ventral hacia arriba. Se coloca un marco de piscina de embriones, se depositan dos gotas de solución de agentes crioprotectores (CPA) y la piscina se llena con aceite de silicona. (B) Una aguja debe contener la menor cantidad posible de yema y otros contaminantes. Los PGC se intercalan entre dos capas de aceite de silicona cuando se criopreservan en nitrógeno líquido. Haga clic aquí para ver una versión más grande de esta figura.
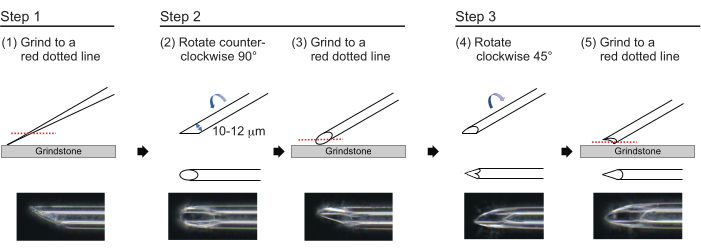
Figura 3: Fabricación de la aguja. Método de pulido de punta de tres pasos para hacer una aguja con un tamaño de orificio apropiado y una punta afilada. Haga clic aquí para ver una versión más grande de esta figura.
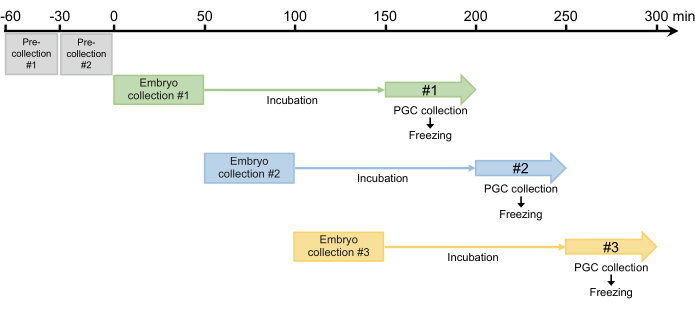
Figura 4: Esquema de recolección de embriones. Después de dos pre-recolecciones, solemos recolectar tres o cuatro veces al día. Haga clic aquí para ver una versión más grande de esta figura.
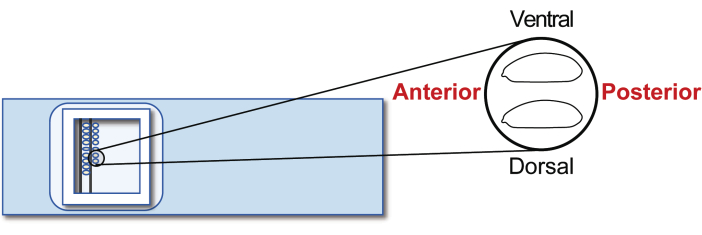
Figura 5: Alineación del embrión huésped. Alineación de embriones hospedadores en un portaobjetos de vidrio. Haga clic aquí para ver una versión más grande de esta figura.
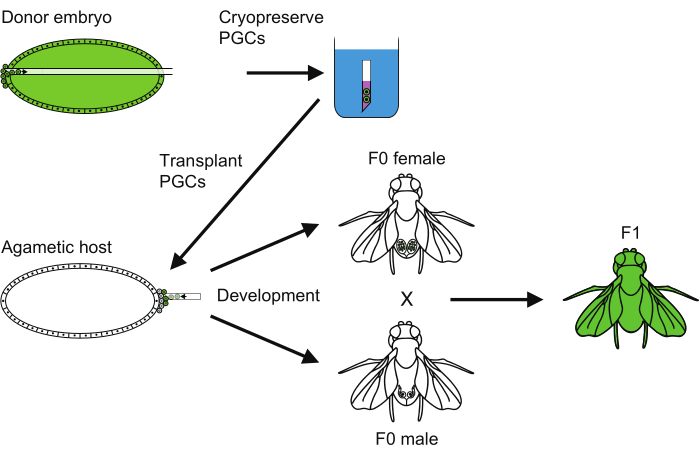
Figura 6: Descripción general del método de criopreservación de PGC. Una visión general de todos los pasos seguidos para llevar a cabo la criopreservación de células germinales primordiales (CGP). Haga clic aquí para ver una versión más grande de esta figura.
| Humedad ambiental | |||
| < 30% | ~ 30% | > 30% | |
| Alinear los embriones del huésped (~20 minutos) | Use un humidificador durante 2 a 10 minutos | Use un humidificador de forma intermitente durante 1 minuto | No utilice un humidificador |
| Descongelar los PGC de donantes | No aplicable | No aplicable | No aplicable |
| Secado al aire libre de PGC | Omitir este paso | Omitir este paso | 5 minutos |
| Aplicar aceite de silicona | No aplicable | No aplicable | No aplicable |
| Trasplante de PGC | No aplicable | No aplicable | No aplicable |
| Todos estos pasos deben completarse en 50 minutos. | |||
Tabla 1: Secado de embriones durante el alineamiento embrionario y descongelación de PGC.
| Cepa donante | Periodo de criopreservación | Número de embriones trasplantados (A) | Número de larvas eclosionadas (B) (incubabilidad, B/A) | Número de adultos encerrados (C) (viabilidad del huevo al adulto, C/A) | Número de adultos fértiles (D) (frecuencia de moscas fértiles, D/C) |
| M17 | 8 - 30 días | 134 | 108 (80.6%) | 57 (42.5%) | 20 (35.1%) |
| M17 | 31 - 150 días | 74 | 60 (81.1%) | 30 (40.5%) | 8 (26.7%) |
| M17: yw; TM6B, P{Dfd-GMR-nvYFP}4, Sb[1] Tb[1] ca[1]/ Pri[1] | |||||
Tabla 2: Eficiencia del trasplante de PGC criopreservado. Esta tabla es una modificación dela 13. Todos los datos provienen de hosts agávicos.
Discussion
Un factor crítico para el éxito en la criopreservación y reactivación de PGC es el uso de buenos embriones. Se deben utilizar hembras jóvenes (p. ej., de 3 a 5 días de edad) para la recolección de embriones. Tanto los embriones de la donante como los del huésped se evalúan mediante inspección microscópica, y solo se utilizan los que se encuentran en la etapa de blastodermo (etapa 5)12. Para la recolección de PGC, generalmente alineamos aproximadamente 40 embriones de donantes en un período de 20 minutos y recolectamos PGC de aproximadamente 30 embriones en la etapa temprana 5; No se utilizan embriones más viejos y defectuosos. Después de la criopreservación y descongelación, los PGC deben mantener su forma; Las CGP se rompen en la preservación infructuosa. Los embriones huéspedes también deben estar en la etapa 5 y tener una presión interna moderada; Los embriones deben volver lentamente a su forma original después de un suave pinchazo. Los embriones excesivamente secos e insuficientemente secos no se desarrollarán normalmente después del trasplante. Debido a que el trasplante heterosexual de PGCs no produce gametos en Drosophila 5,10, es más probable que el trasplante de PGCs de múltiples embriones de donantes a embriones hospedadores produzca adultos fértiles. Para ello, solemos recolectar PGCs de aproximadamente 30 embriones por aguja.
Como crioprotectores, probamos etilenglicol, dimetilsulfóxido y glicerol junto con sacarosa en varias concentraciones. Determinamos que el EBR que contenía 20% de etilenglicol y 1 M de sacarosa era el mejor13; sin embargo, el uso de diferentes crioprotectores puede mejorar la preservación de los PGC22.
Este método de criopreservación requiere habilidades especializadas en el manejo de PGC, y se necesitan aproximadamente 6 semanas de capacitación para recolectar y trasplantar cómodamente PGC. Para evaluar y mejorar el dominio de las habilidades, esto se puede dividir en seis pasos de entrenamiento: 1) alinear los embriones en un portaobjetos de vidrio, 2) controlar un manipulador, 3) trasplantar PGC de un embrión a otro embrión sin criopreservación, 4) trasplantar PGC de 10 o más embriones a 5 a 10 embriones, 5) trasplantar PGC después de aplicar CPA y 6) trasplantar PGC después de la congelación-descongelación. Cada paso puede tardar 1 semana. Los objetivos a corto plazo en el paso 3 son una tasa de eclosión del 40%, una viabilidad de embrión a adulto del 10%-20% y una frecuencia de moscas fértiles del 20%.
La criopreservación de PGC requiere instrumentación costosa y personal altamente calificado. Por lo tanto, es posible que muchos laboratorios no adopten este método. Sin embargo, el método actual de PGC tiene varios aspectos importantes. En primer lugar, las CGP son mucho más pequeñas que los embriones y son muy permeables a los crioprotectores. Por el contrario, la permeabilidad de los crioprotectores está severamente limitada por las capas cerosas de los embriones de Drosophila, que es el problema más grave en la criopreservación de embriones. De hecho, estudios anteriores han hecho grandes esfuerzos para encontrar una ventana de tiempo en la que los embriones tengan una alta tasa de supervivencia y una capa de cera más delgada. El segundo se refiere a la variación morfológica y de desarrollo entre cepas. Las CGP se recogen de embriones en estadio 5 temprano (2 h 30 min-3 h 20 min después de la puesta de huevos), mientras que la criopreservación de embriones se realiza en embriones de estadio 16 (14-22 h después de la puesta de huevos). Por lo tanto, los embriones son mucho más viejos y muestran una variación de cepa mucho mayor en la ventana de tiempo óptima para la criopreservación en comparación con la criopreservación de PGC. De hecho, la frecuencia de hospederos productores de progenie derivada del donante no varió entre las cinco cepas estudiadas por Asaoka et al.13, aunque los hospedadores no eran agastáticos. Además, las PGC tienen el potencial de ser utilizadas en aplicaciones de ingeniería genética, como la edición del genoma 14,15,16.
Acknowledgements
Agradecemos al KYOTO Drosophila Stock Center por las cepas de moscas. También agradecemos a la Sra. Wanda Miyata por la edición en inglés del manuscrito y al Dr. Jeremy Allen de Edanz (https://jp.edanz.com/ac) por editar un borrador de este manuscrito. Este trabajo contó con el apoyo de subvenciones (JP16km0210072, JP17km0210146, JP18km0210146) de la Agencia Japonesa de Investigación y Desarrollo Médico (AMED) a T.T.-S.-K., subvenciones (JP16km0210073, JP17km0210147, JP18km0210145) de AMED a S.K., una subvención (JP20km0210172) de AMED a T.T.-S.-K. y S.K., una subvención para la investigación científica (C) (JP19K06780) de la Sociedad Japonesa para la Promoción de la Ciencia (JSPS) a T.T.-S.-K., y una subvención para la investigación científica en áreas innovadoras (JP18H05552) de JSPS a S.K.
Materials
| Name | Company | Catalog Number | Comments |
| Acetic acid | FUJIFILM Wako Pure Chemical Corporation | 017-00256 | For embryo collection |
| Agar powder | FUJIFILM Wako Pure Chemical Corporation | 010-08725 | For embryo collection |
| Calcium chloride | FUJIFILM Wako Pure Chemical Corporation | 038-24985 | For EBR solution |
| Capillary | Sutter Instrument | B100-75-10-PT | BOROSILICATE GLASS; O.D: 1.0mm, I.D: 0.75mm , length: 10cm, 225Pcs |
| Capillary holder | Eppendorf | 5196 081.005 | Capillary holder 4; for micromanipulation |
| Chromic acid mixture | FUJIFILM Wako Pure Chemical Corporation | 037-05415 | For needle washing |
| CPA solution | 1x EBR containing 20% ethylene glycol and 1M sucrose | ||
| Double-sided tape | 3M | Scotch w-12 | For glue extracting |
| Ephrussi–Beadle Ringer solution (EBR) | 130 mM NaCl, 5 mM KCl, 2 mM CaCl2, and 10 mM Hepes at pH 6.9 | ||
| Ethanol (99.5) | FUJIFILM Wako Pure Chemical Corporation | 057-00451 | For embryo collection |
| Ethylene glycol | FUJIFILM Wako Pure Chemical Corporation | 054-00983 | For CPA solution |
| Falcon 50 mm x 9 mm bacteriological petri dish | Corning Inc. | 351006 | For embryo collection |
| Forceps | Vigor | Type5 Titan | For embryo handling |
| Grape juice | Asahi Soft Drinks Co., LTD. | Welch's Grape 100 | For embryo collection |
| Grape juice agar plate | 50% grape juice, 2% agar, 1% ethanol, 1% acetic acid | ||
| Heptane | FUJIFILM Wako Pure Chemical Corporation | 084-08105 | For glue extracting |
| Humidifier | APIX INTERNATIONAL CO., LTD. | FSWD2201-WH | For embryo preparation |
| Inverted microscope | Leica Microsystems GmbH | Leica DM IL LED | For micromanipulation |
| Luer-lock glass syringe | Tokyo Garasu Kikai Co., Ltd. | 0550 14 71 08 | Coat a plunger with silicon oil (FL-100-450CS);for micromanipulation |
| Mechanical micromanipulator | Leica Microsystems GmbH | For micromanipulation | |
| Micro slide glass | Matsunami Glass Ind., Ltd. | S-2441 | For embryo aligning |
| Microgrinder | NARISHIGE Group | Custom order | EG-401-S combined EG-401 and MF2 (with ocular lens MF2-LE15 ); for needle preparation |
| Microscope camera | Leica Microsystems GmbH | Leica MC170 HD | For micromanipulation |
| Needle holder | Merck KGaA | Eppendorf TransferTip (ES) | For cryopreservation |
| Potassium chloride | Nacalai Tesque, Inc. | 28514-75 | For EBR solution |
| Puller | NARISHIGE Group | PN-31 | For needle preparation; the heater level is set to 85.0-98.4, the magnet main level to 57.8, and the magnet sub level to 45.0. |
| PVC adhesive tape for electric insulation | Nitto Denko Corporation | J2515 | For embryo-pool frame |
| Silicon oil | Shin-Etsu Chemical, Co, Ltd. | FL-100-450CS | For embryo handling |
| Sodium chloride | Nacalai Tesque, Inc. | 31320-05 | For EBR solution |
| Sodium hypochlorite solution | FUJIFILM Wako Pure Chemical Corporation | 197-02206 | Undiluted and freshly prepared; for embryo breaching |
| Sucrose | Nacalai Tesque, Inc. | 30404-45 | For CPA solution |
References
- Brüschweiler, W., Gehring, W. A method for freezing living ovaries of Drosophila melanogaster larvae and its application to the storage of mutant stocks. Experientia. 29, 134-135 (1973).
- Steponkus, P. L., et al. Cryopreservation of Drosophila melanogaster embryos. Nature. 345, 170-172 (1990).
- Mazur, P., Cole, K. W., Hall, J. W., Schreuders, P. D., Mahowald, A. P. Cryobiological preservation of Drosophila embryos. Science. 258 (5090), 1932-1935 (1992).
- Zhan, L., Li, M. G., Hays, T., Bischof, J. Cryopreservation method for Drosophila melanogaster embryos. Nat Comm. 12, 2412 (2021).
- Van Deusen, E. B. Sex determination in germ line chimeras of Drosophila melanogaster. Development. 37 (1), 173-185 (1977).
- Breen, T. R., Duncan, I. M. Maternal expression of genes that regulate the bithorax complex of Drosophila melanogaster. Dev Biol. 118, 442-456 (1986).
- Schupbach, T., Wieschaus, E. Germline autonomy of maternal-effect mutations altering the embryonic body pattern of Drosophila. Dev Biol. 113, 443-448 (1986).
- Irish, V., Lehmann, R., Akam, M. The Drosophila posterior-group gene nanos functions by repressing hunchback activity. Nature. 338, 646-648 (1989).
- Hülskamp, M., Schröder, C., Pfeifle, C., Jäckle, H., Tautz, D. Posterior segmentation of the Drosophila embryo in the absence of a maternal posterior organizer gene. Nature. 338, 629-632 (1989).
- Steinmann-Zwicky, M., Schmid, H., Nöthiger, R. Cell-autonomous and inductive signals can determine the sex of the germ line of Drosophila by regulating the gene Sxl. Cell. 57 (1), 157-166 (1989).
- Stein, D., Roth, S., Vogelsang, E., Nüsslein-Volhard, C. The polarity of the dorsoventral axis in the drosophila embryo is defined by an extracellular signal. Cell. 65 (5), 725-735 (1991).
- Kobayashi, S., Yamada, M., Asaoka, M., Kitamura, T. Essential role of the posterior morphogen nanos for germline development in Drosophila. Nature. 380, 708-711 (1996).
- Asaoka, M., et al. Offspring production from cryopreserved primordial germ cells in Drosophila. Comm Biol. 4 (1), 1159 (2021).
- Blitz, I. L., Fish, M. B., Cho, K. W. Y. Leapfrogging: primordial germ cell transplantation permits recovery of CRISPR/Cas9-induced mutations in essential genes. Development. 143 (15), 2868-2875 (2016).
- Koslová, A., et al. Precise CRISPR/Cas9 editing of the NHE1 gene renders chickens resistant to the J subgroup of avian leukosis virus. Proc Natl Acad Sci U S A. 117 (4), 2108-2112 (2020).
- Zhang, F. Efficient generation of zebrafish maternal-zygotic mutants through transplantation of ectopically induced and Cas9/gRNA targeted primordial germ cells. J Genet Genom. 47 (1), 37-47 (2020).
- Campos-Ortega, J. A., Hartenstein, V. Stages of Drosophila Embryogenesis. The Embryonic Development of Drosophila. , (1997).
- Manning, A. A sperm factor affecting the receptivity of Drosophila melanogaster females. Nature. 194, 252-253 (1962).
- Kubli, E. Sex-peptides: seminal peptides of the Drosophila male. Cell Mol Life Sci. 60, 1689-1704 (2003).
- Lehmann, R., Nüsslein-Volhard, C. Abdominal segmentation, pole cell formation, and embryonic polarity require the localized activity of oskar, a maternal gene in drosophila. Cell. 47 (1), 141-152 (1986).
- Kiger, A. A., Gigliotti, S., Fuller, M. T. Developmental genetics of the essential Drosophila Nucleoporin nup154: allelic differences due to an outward-directed promoter in the P-element 3′ end. Genetics. 153 (2), 799-812 (1999).
- Rienzi, L. F., et al. Perspectives in gamete and embryo cryopreservation. Semin Reprod Med. 36 (5), 253-264 (2018).
Explore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved