प्राइमर्डियल जर्म सेल क्रायोप्रिजर्वेशन और ड्रोसोफिला उपभेदों का पुनरुद्धार
* These authors contributed equally
In This Article
Summary
ताजा खाद्य शीशियों के लिए वयस्क मक्खियों के लगातार हस्तांतरण के विकल्प के रूप में ड्रोसोफिला उपभेदों के लिए एक दीर्घकालिक संरक्षण विधि अत्यधिक वांछनीय है। यह प्रोटोकॉल ड्रोसोफिला प्राइमर्डियल जर्म कोशिकाओं के क्रायोप्रिजर्वेशन का वर्णन करता है और एगेमेटिक होस्ट भ्रूण में उनके प्रत्यारोपण के माध्यम से तनाव पुनरुद्धार का वर्णन करता है।
Abstract
ड्रोसोफिला उपभेदों को वयस्क मक्खियों के नए शीशियों में लगातार हस्तांतरण द्वारा बनाए रखा जाना चाहिए। इससे म्यूटेशनल बिगड़ने और फेनोटाइपिक परिवर्तनों का खतरा होता है। इसलिए इस तरह के परिवर्तनों के बिना दीर्घकालिक संरक्षण के लिए एक वैकल्पिक विधि का विकास अनिवार्य है। पिछले सफल प्रयासों के बावजूद, ड्रोसोफिला भ्रूण का क्रायोप्रिजर्वेशन अभी भी कम प्रजनन क्षमता के कारण व्यावहारिक उपयोग का नहीं है। यहां, हम प्राइमर्डियल जर्म सेल (पीजीसी) क्रायोप्रेज़र्वेशन के लिए एक प्रोटोकॉल का वर्णन करते हैं और क्रायोप्रेज़र्व्ड पीजीसी के प्रत्यारोपण के माध्यम से एगेमेटिक ड्रोसोफिला मेलानोगास्टर (डी. मेलानोगास्टर) मेजबान भ्रूण में प्रजनन करते हैं। पीजीसी क्रायोप्रोटेक्टिव एजेंटों (सीपीए) के लिए अत्यधिक पारगम्य हैं, और भ्रूण क्रायोप्रिजर्वेशन की तुलना में उपभेदों के बीच विकासात्मक और रूपात्मक भिन्नता कम समस्याग्रस्त है। इस विधि में, पीजीसी को लगभग 30 दाता भ्रूणों से एकत्र किया जाता है, सीपीए उपचार के बाद एक सुई में लोड किया जाता है, और फिर तरल नाइट्रोजन में क्रायोप्रेज़र्ड किया जाता है। दाता-व्युत्पन्न युग्मकों का उत्पादन करने के लिए, एक सुई में क्रायोप्रिजर्व पीजीसी को पिघलाया जाता है और फिर लगभग 15 एगेमेटिक मेजबान भ्रूण में जमा किया जाता है। इस प्रोटोकॉल के साथ कम से कम 15% उपजाऊ मक्खियों की आवृत्ति हासिल की गई थी, और प्रति उपजाऊ जोड़े में संतान की संख्या हमेशा मूल तनाव को पुनर्जीवित करने के लिए पर्याप्त से अधिक थी (औसत संतान संख्या 77.2 ± 7.1 थी), जो क्रायोप्रेज़र्व्ड पीजीसी की जर्मलाइन स्टेम सेल बनने की क्षमता को दर्शाता है। प्रति सुई उपजाऊ मक्खियों की औसत संख्या 1.1 ± 0.2 थी, और 26 सुइयों में से 9 ने दो या अधिक उपजाऊ संतान का उत्पादन किया। यह पाया गया कि 11 सुइयां 6 या अधिक संतान पैदा करने के लिए पर्याप्त हैं, जिसमें कम से कम एक महिला और एक नर शामिल होने की संभावना है। एगैमेटिक होस्ट केवल नई उभरी हुई मादा और नर मक्खियों को पार करके तनाव को जल्दी से पुनर्जीवित करना संभव बनाता है। इसके अलावा, पीजीसी में जेनेटिक इंजीनियरिंग अनुप्रयोगों में उपयोग किए जाने की क्षमता है, जैसे कि जीनोम संपादन।
Introduction
नई खाद्य शीशियों के लिए वयस्क मक्खियों के हस्तांतरण से ड्रोसोफिला उपभेदों के रखरखाव अनिवार्य रूप से समय के साथ उत्परिवर्तन और epigenetic परिवर्तन के संचय में परिणाम. इस तरह के परिवर्तनों के बिना ड्रोसोफिला उपभेदों के दीर्घकालिक रखरखाव के लिए एक वैकल्पिक विधि का विकास अनिवार्य है, विशेष रूप से संदर्भ उपभेदों के लिए जिसमें पूरे जीनोम को बनाए रखा जाना है। ड्रोसोफिला भ्रूण या अंडाशय क्रायोप्रिजर्व करने के कई सफल प्रयासों का वर्णन किया गया है: 1,2,3। दुर्भाग्य से, वे अभी भी कम प्रजनन क्षमता के कारण व्यावहारिक उपयोग के नहीं हैं। दरअसल, प्रारंभिक चरण के भ्रूण में क्रायोप्रेज़र्वेशन के बाद उनकी उच्च जर्दी सामग्री के कारण जीवित रहने की दर कम होती है, जो क्रायोप्रोटेक्टिव एजेंट (सीपीए) पारगम्यता औरप्रसार 2,3 को बाधित करती है। सीपीए पारगम्यता भी देर से चरण भ्रूण की मोमी परतों द्वारा गंभीर रूप से सीमित है। यह मुश्किल और समय लेने वाली एक तनाव विशिष्ट समय अवधि है जिसमें भ्रूण एक उच्च जीवित रहने की दर और एक पतली मोम परत है खोजने के लिए है. हाल ही में, झान एट अल.4 भ्रूण पारगम्यता, सीपीए लोडिंग, और विट्रीफिकेशन और कई उपभेदों के सफलतापूर्वक क्रायोप्रेज़र्व्ड भ्रूण के लिए बेहतर तरीके। हालांकि, विधियों को लागू करना आसान नहीं है क्योंकि पारगम्यता के बाद भ्रूण की व्यवहार्यता खराब हो जाती है। इसलिए, वैकल्पिक दृष्टिकोणों के आगे सुधार और विकास की अभी भी आवश्यकता है। प्राइमर्डियल जर्म सेल (पीजीसी) के क्रायोप्रिजर्वेशन से जुड़े तरीके ड्रोसोफिला उपभेदों के दीर्घकालिक रखरखाव के लिए एक वैकल्पिक दृष्टिकोण हैं।
पीजीसी (जिसे पोल सेल भी कहा जाता है) प्रत्यारोपण का उपयोग जर्मलाइन काइमेरा, विशेष रूप से महिलाओं को उत्पन्न करने के लिए किया गया है, ताकि जाइगोटिक घातक उत्परिवर्तन के मातृ प्रभाव और रोगाणु कोशिकाओं के लिंग निर्धारणजैसी प्रक्रियाओं का अध्ययन किया जा सके 5,6,7,8,9,10,11,12 . पीजीसी भ्रूण की तुलना में बहुत छोटे होते हैं और अधिकांश क्रायोप्रोटेक्टेंट के लिए अत्यधिक पारगम्य होने की संभावना है। इसके अलावा, उपभेदों के बीच विकासात्मक और रूपात्मक भिन्नता कम समस्याग्रस्त है, और एक एगामेटिक होस्ट पूरे जीनोम की त्वरित बहाली को सक्षम बनाता है। हमने हाल ही में पीजीसी क्रायोप्रिजर्वेशन13 की एक नई विधि विकसित की है, जो ड्रोसोफिला उपभेदों में अन्यथा अपरिहार्य आनुवंशिक और एपिजेनेटिक परिवर्तनों को रोकता है। यहां, हम विस्तृत प्रोटोकॉल प्रस्तुत करते हैं।
इस क्रायोप्रिजर्वेशन विधि के लिए पीजीसी हैंडलिंग और इंस्ट्रूमेंटेशन में विशिष्ट विशेषज्ञता की आवश्यकता होती है। जबकि चरण-दर-चरण दृष्टिकोण उन लोगों के लिए एक कुशल समाधान हो सकता है जो इससे अपरिचित हैं, यह इंस्ट्रूमेंटेशन आवश्यकताओं के कारण छोटी प्रयोगशालाओं के लिए अनुपयुक्त हो सकता है। इस पीजीसी क्रायोप्रेज़र्वेशन प्रोटोकॉल को छोटे विकास और रूपात्मक मतभेदों के कारण भ्रूण क्रायोप्रेज़र्वेशन प्रोटोकॉल की तुलना में विभिन्न ड्रोसोफिला प्रजातियों और विभिन्न कीट प्रजातियों के साथ उपयोग के लिए अधिक आसानी से अनुकूलित किया जा सकता है। पीजीसी का उपयोग संभावित रूप से जेनेटिक इंजीनियरिंग अनुप्रयोगों में भी किया जा सकता है, जैसे जीनोम संपादन 14,15,16। सारांश में, इस पद्धति का उपयोग स्टॉक केंद्रों और अन्य प्रयोगशालाओं में बिना किसी बदलाव के लंबे समय तक मक्खी और अन्य कीट उपभेदों को बनाए रखने के लिए किया जा सकता है।
Protocol
1. उपकरण तैयार करना
- माइक्रोमैनिपुलेटर सिस्टम: कोशिकाओं को इकट्ठा करने और प्रत्यारोपण करने के लिए एक माइक्रोमैनिपुलेटर सिस्टम इकट्ठा करें (चित्र 1ए)।
- पीजीसी-संग्रह ग्लास स्लाइड (चित्रा 2 ए)
- हेप्टेन गोंद तैयार करने के लिए, लगभग 30 सेमी लंबे दो तरफा टेप को काट लें और इसे तकनीकी (नियमित) -ग्रेड हेप्टेन समाधान के 7 एमएल में रात भर भिगो दें।
- एक गिलास स्लाइड के पीछे भ्रूण संरेखण के लिए दो समानांतर संदर्भ लाइनों ड्रा.
- एक पाश्चर विंदुक का उपयोग कर ग्लास स्लाइड (लाइनों के बिना पक्ष पर) पर उपरोक्त हेप्टेन गोंद की बूंदों को फैलाएं। स्लाइड की सतह को तब तक हवा में सुखाएं जब तक कि वह सफेद न हो जाए।
- हेप्टेन-गोंद बूंदों के अलावा और प्रसार को दोहराएं और स्लाइड को फिर से सूखें।
नोट: गोंद तरल समाधान को सपाट सतह पर फैलने से रोकता है और जलीय घोल को सुई में लोड करना आसान बनाता है। - भ्रूण-पूल फ्रेम बनाने के लिए, एक कटिंग बोर्ड पर 0.2 मिमी-मोटी मानक विनाइल टेप की तीन परतें, जैसे कि बिजली के टेप चिपकाएं। टेप को 1.5 सेमी-चौड़े आयतों में काटें। फिर, टेप की सभी तीन परतों को काट लें, जिससे 2 से 3 मिमी का फ्रेम निकल जाए।
नोट: भ्रूण के लिए एक पूल बनाने के लिए, भ्रूण को संरेखित करने के बाद एक भ्रूण-पूल फ्रेम चिपका दिया जाता है।
- प्रत्यारोपण सुई
नोट: इस अध्ययन के समय सभी व्यावसायिक रूप से उपलब्ध सुई पीजीसी क्रायोप्रिजर्वेशन के लिए बहुत संकीर्ण या बहुत व्यापक थीं।- एक ग्लास केशिका और एक पुलर का उपयोग करके एक सुई बनाएं। हम 31-85.0 पर हीटर स्तर के साथ NARISHIGE PN-98.4 पुलर का उपयोग करते हैं, चुंबक मुख्य स्तर 57.8 पर, और चुंबक उप-स्तर 45.0 पर।
- 1 माइक्रोन की अनुमानित दीवार मोटाई और 10-12 माइक्रोन के आंतरिक व्यास के साथ लंबाई में लगभग 200 माइक्रोन की एक टिप के साथ एक सुई बनाने के लिए, निम्नलिखित तीन-चरण प्रक्रिया (चित्रा 3) में सुई टिप पॉलिश करें। सबसे पहले, 780 आरपीएम की गति से 30 डिग्री के कोण पर सुई टिप को पीसें जब तक कि टिप का आंतरिक व्यास 10-12 माइक्रोन न हो। इस पहले पीसने वाले कदम में लगभग 1 घंटे लगते हैं।
नोट: सुई की नोक को तोड़ने से बचने के लिए, पहले ग्रिंडस्टोन को घुमाएं और फिर धीरे से सुई को ग्रिंडस्टोन पर नीचे ले जाएं। - वांछित कोण को ट्रैक करने के लिए सुई के शीर्ष पर एक रेखा खींचें। सुई को वामावर्त 90° पर घुमाएं और इसे 180 आरपीएम की गति से फिर से पॉलिश करें। यह लगभग 5 मिनट लगते हैं.
- सुई को दक्षिणावर्त 45° घुमाएं और इसे एक सेकंड के लिए 180 आरपीएम की गति से पॉलिश करें।
- माइक्रोस्कोप मंच पर क्रोमिक एसिड मिश्रण (सावधानी: विषाक्त) की एक बूंद के साथ एक संग्रह ग्लास स्लाइड रखें। स्लाइड सतह के सापेक्ष 10 डिग्री -13 डिग्री कोण पर केशिका धारक (चित्रा 1 डी) को सुई संलग्न करें, ध्यान से सुई को नीचे ले जाएं, और क्रोमिक एसिड मिश्रण में टिप को विसर्जित करें।
- प्लंजर (चित्रा 1 बी) को खींचकर और धक्का देकर, सुई में कांच के मलबे को हटाने के लिए कई बार सुई से समाधान को यंत्रवत् रूप से लोड और निर्वहन करें। बाहरी दीवार को भी साफ करना सुनिश्चित करें।
- क्रोमिक एसिड को पूरी तरह से हटाने के लिए आसुत जल के साथ सुई के अंदर और बाहर दो बार धोएं।
2. पीजीसी का संग्रह और क्रायोप्रिजर्वेशन
- भ्रूण एकत्रित करना
- ब्याज के दाता तनाव की मक्खियों की एक उचित संख्या (भ्रूण-संग्रह कप के लिए प्रत्येक सेक्स के लिए लगभग 450) एक भ्रूण-संग्रह प्लेट(चित्रा 1ई)के साथ भ्रूण-संग्रह कप में स्थानांतरित करें और उन्हें 25 डिग्री सेल्सियस पर इनक्यूबेट करें। हम आमतौर पर 3- से 5 दिन पुरानी माता-पिता की मक्खियों का उपयोग करते हैं जिन्हें कमरे के तापमान (23-25 डिग्री सेल्सियस) पर कम भीड़ वाली परिस्थितियों में पाला जाता है।
- दो 30 मिनट पूर्व संग्रह प्रदर्शन और रखी किसी भी अंडे त्यागें. क्योंकि मादाएं डिंबवाहिनी में विकसित होने वाले निषेचित अंडे को बनाए रख सकती हैं, इस कदम को चरण 2.1.3 (चित्रा 4) में अंडे देने को सिंक्रनाइज़ करने की आवश्यकता होती है।
- दो पूर्व संग्रह के बाद, 50 मिनट के लिए भ्रूण इकट्ठा और फिर भ्रूण ब्लास्टोडर्म चरण (प्रारंभिक चरण 517) को विकसित करने के लिए अनुमति देने के लिए 25 डिग्री सेल्सियस पर एक humidified कक्ष में एकत्रित भ्रूण सेते हैं. इनक्यूबेशन समय आमतौर पर 100 मिनट है, लेकिन तनाव (चित्रा 4) के आधार पर 120 मिनट तक बढ़ाया जा सकता है।
नोट: एक आर्द्रीकृत कक्ष एक प्लास्टिक बॉक्स के तल पर एक नम कागज तौलिया रखकर और उपयोग करने से पहले पानी की धुंध के साथ छिड़काव करके बनाया जाता है। प्रारंभिक चरण -5 भ्रूण में, पीजीसी गठन पूरा हो गया है, लेकिन दैहिक सेलुलराइजेशन नहीं है। भ्रूण का सटीक चरण चरण 2.4 में एक यौगिक माइक्रोस्कोप के तहत निर्धारित किया जाता है।
- भ्रूण को नष्ट करना
- एक स्टेनलेस स्टील जाल छलनी (150 जाल, 109 माइक्रोन खोलने, 60 माइक्रोन तार व्यास) पर आसुत जल की एक बूंद जमा; चित्रा 1 एफ)। संदंश का प्रयोग, भ्रूण संग्रह प्लेट से भ्रूण इकट्ठा और उन्हें पानी की बूंद में डाल दिया.
- पानी को सोखने के लिए छलनी के खिलाफ टिशू पेपर को नीचे से दबाएं। भ्रूण के लिए ताजा 5% (सीएल के रूप में) सोडियम हाइपोक्लोराइट समाधान की बूंदों जोड़ें और लगातार 10 एस के लिए छलनी नल.
- सीधे आसुत जल के साथ उन्हें छिड़कने और पानी को अवशोषित करने के लिए नीचे से छलनी के खिलाफ टिशू पेपर प्रेस द्वारा भ्रूण धो लें. इस चरण को 3x दोहराएं।
- dechorionated भ्रूण संरेखित
- एक स्टीरियो खुर्दबीन के तहत, भ्रूण हस्तांतरण करने के लिए संदंश का उपयोग करें. दो संदर्भ लाइनों (चित्रा 2 ए) के साथ एक पीजीसी संग्रह ग्लास स्लाइड पर दो पंक्तियों में dechorionated भ्रूण संरेखित. भ्रूण अपने पूर्वकाल के साथ दाईं ओर उन्मुख होते हैं (पक्ष में हेरफेर किया जाता है) और उदर पक्ष ऊपर।
नोट: यह कदम 20 मिनट में समाप्त हो जाना चाहिए, जिसके दौरान हम आमतौर पर लगभग 40 भ्रूण संरेखित करते हैं। - पीजीसी संग्रह ग्लास स्लाइड पर भ्रूण के चारों ओर एक भ्रूण-पूल फ्रेम प्रत्यय. सीपीए समाधान के 1 माइक्रोन ड्रॉप (1x एफ्रुसी-बीडल रिंगर समाधान, ईबीआर, जिसमें 20% एथिलीन ग्लाइकॉल और 1 एम सुक्रोज होता है; 1x ईबीआर: 130 एमएम एनएसीएल, 5 एमएम केसीएल, 2 एमएम सीएसीएल2, और पीएच 6.9 पर 10 एमएम हेप्स) फ्रेम से घिरे क्षेत्र में दो अलग-अलग स्थानों पर और भ्रूण को सूखने से रोकने के लिए सिलिकॉन तेल के साथ पूल भरें (चित्रा 2ए)।
नोट: सीपीए समाधान तैयार करने के लिए, आसुत एच2ओ के लगभग 20 एमएल में 10.26 ग्राम सुक्रोज को पूरी तरह से भंग कर दें जिसमें 10 एक्स ईबीआर समाधान के 3 एमएल होते हैं। एथिलीन ग्लाइकॉल के 6 एमएल जोड़ें और फिर आसुत एच2ओ को 30 एमएल तक जोड़ें। पूरी तरह से मिश्रण के बाद, 0.22 मिमी डिस्पोजेबल झिल्ली के माध्यम से समाधान को फ़िल्टर करें।
- एक स्टीरियो खुर्दबीन के तहत, भ्रूण हस्तांतरण करने के लिए संदंश का उपयोग करें. दो संदर्भ लाइनों (चित्रा 2 ए) के साथ एक पीजीसी संग्रह ग्लास स्लाइड पर दो पंक्तियों में dechorionated भ्रूण संरेखित. भ्रूण अपने पूर्वकाल के साथ दाईं ओर उन्मुख होते हैं (पक्ष में हेरफेर किया जाता है) और उदर पक्ष ऊपर।
- पीजीसी एकत्रित करना
- एक माइक्रोमैनिपुलेटर सिस्टम से लैस माइक्रोस्कोप के मंच पर चरण 2.3.2 के पीजीसी-संग्रह ग्लास स्लाइड रखें। केशिका धारक को सुई संलग्न करें और बाईं पंक्ति में पहला भ्रूण और सुई की नोक को एक ही फोकल विमान में लाएं। 2-3 एस के लिए सुई में सिलिकॉन तेल लोड करें।
- बाईं पंक्ति में भ्रूण से पीजीसी संग्रह शुरू करें। एक 20x उद्देश्य लेंस का प्रयोग, धीरे भ्रूण के पूर्वकाल अंत की सतह के लिए सुई टिप ले जाएँ और पीछे अंत की ओर भ्रूण घुसना, सुई चलती से नहीं बल्कि खुर्दबीन चरण चलती से.
- सुई टिप पीछे अंत तक पहुँच जाता है, सुई थोड़ा वापस लेने और पूरी तरह से दैहिक सेल परत के अंदर सुई में किसी भी जर्दी का निर्वहन.
- सुई में दबाव स्थिर रखते हुए, सुई की नोक को पीछे के ध्रुव के अंदर पीजीसी में ले जाएं और धीरे से, लेकिन ज्यादा समय लिए बिना, पीजीसी लोड करें।
- सुई को भ्रूण से जल्दी से बाहर निकालें और सुई से जर्दी और अन्य दूषित पदार्थों को सिलिकॉन तेल पूल में निर्वहन करें, पीजीसी को सुई में रखें। फिर, पूल से साफ सिलिकॉन तेल लोड करें।
- बाईं पंक्ति में अन्य भ्रूण के लिए 2.4.2 से 2.4.5 कदम दोहराएँ. एक नए भ्रूण से पीजीसी इकट्ठा करने से पहले, सुई में लोड पीजीसी रखते हुए संभव के रूप में दैहिक सेल परत के अंदर चरण 2.4.5 में लोड सिलिकॉन तेल के रूप में ज्यादा जमा. इससे यह सुनिश्चित होता है कि नए लोड किए गए पीजीसी पहले से एकत्र किए गए पीजीसी के आस-पास हैं और उनके बीच कोई हस्तक्षेप सामग्री नहीं है।
- बाईं पंक्ति में भ्रूण से पीजीसी संग्रह पूरा करने के बाद, जितना संभव हो सके जर्दी और अन्य दूषित पदार्थों से पीजीसी को अलग करें। इसे प्राप्त करने के लिए, एक भ्रूण की सतह पर सुई में सभी पीजीसी जमा करें और किसी भी जर्दी या अन्य दूषित पदार्थों को दूसरे पड़ोसी भ्रूण में हटा दें।
- अगला, सही पंक्ति में भ्रूण से पीजीसी इकट्ठा. दाएं और बाएं पंक्तियों से एकत्र किए गए पीजीसी को मिलाएं।
- पीजीसी में क्रायोप्रोटेक्टिव एजेंट (सीपीए) लागू करना
- एक बूंद में सीपीए के साथ सुई धोने के बाद, सुई में एक और बूंद में ताजा सीपीए लोड और भ्रूण पर जमा पीजीसी के लिए सीपीए जोड़ें. सीपीए की मात्रा पीजीसी के बराबर होनी चाहिए।
- सीपीए के अलावा के बाद पीजीसी 1-2 एस के क्लस्टर से जितना संभव हो उतना सीपीए निकालें। सीपीए जोड़ने के तुरंत बाद पीजीसी थोड़ा सिकुड़ जाते हैं और आकार में चौकोर हो जाते हैं।
- सुई खाली करें और फिर 5 एस या उससे अधिक समय के लिए सिलिकॉन तेल लोड करें। सभी एकत्रित पीजीसी लोड करें और फिर सिलिकॉन तेल को एक बार फिर 5 एस या उससे अधिक समय तक लोड करें। पीजीसी अब सिलिकॉन तेल (चित्रा 2 बी) की दो परतों के बीच सैंडविच कर रहे हैं.
नोट: जितना संभव हो उतना जर्दी, सीपीए और अन्य दूषित पदार्थों को निकालना महत्वपूर्ण है।
- क्रायोप्रेज़र्विंग पीजीसी
- तीन-तरफा पानी निकलने की टोंटी(चित्रा 1सी)खोलें और फिर माइक्रोमैनिपुलेटर से सुई को अलग करें। नरम टिशू पेपर के साथ सुई की सतह से तेल को धब्बा दें। ऊतक के साथ सुई की नोक को सीधे स्पर्श न करें।
- सुई धारक को सुई संलग्न करें और इसे विनाइल टेप(चित्रा 1एच)का उपयोग करके आधार पर स्थिति में लॉक करें। धारक ट्यूब पर एक लेबल चिपकाएं।
- फ्लैश धारक को तरल नाइट्रोजन में डुबोकर नीचे की ओर इशारा करते हुए सुई के साथ फ्रीज करें। होल्डर को तब तक न छोड़ें जब तक कि रैक से तरल फिजना बंद न हो जाए।
- धारक को तरल चरण क्षेत्र में तरल नाइट्रोजन भंडारण टैंक में स्टोर करें, वाष्प चरण क्षेत्र नहीं।
3. पीजीसी को विगलन और प्रत्यारोपण
- एगेमेटिक मेजबान मक्खियों से भ्रूण को इकट्ठा करना, dechorionating और संरेखित करना
- लीजिए और agametic मेजबान मक्खियों से dechorionate चरण 2 के बाद मक्खियों.
- एक प्रत्यारोपण ग्लास स्लाइड पर चरण 5 agametic मेजबान भ्रूण संरेखित करें. हालांकि, इस बार, दाईं ओर पीछे उन्मुख (पक्ष में हेरफेर करने के लिए) और शीर्ष पर उदर (चित्रा 5)। 20 मिनट में दो पंक्तियों में लगभग 30 भ्रूण लाइन.
- भ्रूण संरेखित करते समय, 2-10 मिनट के लिए एक ह्यूमिडिफायर संचालित करें यदि कमरे की आर्द्रता को इसकी आवश्यकता होती है (तालिका 1)। आदर्श आर्द्रता 30% से 40% है, लेकिन यह थर्मल स्थितियों के आधार पर भिन्न हो सकती है।
- मेजबान भ्रूण में पीजीसी को विगलन और प्रत्यारोपण
- क्रायोप्रेज़र्ड पीजीसी को जल्दी से पिघलाने के लिए, सुई युक्त धारक को कमरे के तापमान 1x EBR समाधान में नीचे की ओर इशारा करते हुए सुई के साथ खिसकाएं और इसे 10 s के लिए जलमग्न रखें।
- एक खुर्दबीन के मंच पर प्रत्यारोपण ग्लास स्लाइड रखें. केशिका धारक को फ्रीज-पिघली हुई सुई संलग्न करें और बाईं पंक्ति में पहला भ्रूण और सुई की नोक को एक ही फोकल विमान में लाएं।
- एक 20x उद्देश्य लेंस का प्रयोग, धीरे भ्रूण के पीछे अंत की सतह के लिए सुई टिप कदम.
- धीरे प्रत्येक भ्रूण के बाहर ठेस और सुनिश्चित करें कि वे धीरे-धीरे अपने मूल आकार में लौटने. प्रोडिंग इस बात की पुष्टि करेगा कि भ्रूण का आंतरिक दबाव बहुत अधिक या बहुत कम नहीं है।
- धीरे सुई ले जाने और पीछे ध्रुव से एक भ्रूण घुसना.
- धीरे सिर्फ पीछे ध्रुव के अंदर लगभग 10-20 PGCs जमा, ठीक vitelline झिल्ली और भ्रूण के दैहिक कोशिका परत के बीच. उन्हें दैहिक कोशिका परत में जमा करने से बचें। यदि पेरिविटेलिन द्रव भ्रूण से बाहर निकलता है, तो लीक हुए तरल पदार्थ को सुई में चूसें और इसे हटा दें।
- भ्रूण से सुई वापस लेना. बाद के भ्रूण के लिए कदम 3.2.5 और 3.2.6 दोहराएँ.
4. भ्रूण को सेते हुए और दाता उपभेदों को बहाल करना
- प्रत्यारोपित पीजीसी प्राप्त नहीं है कि किसी भी भ्रूण निकालें और 25 डिग्री सेल्सियस पर एक humidified कक्ष(चित्रा 1G)में शेष भ्रूण सेते हैं.
- प्रत्यारोपण के बाद 24 घंटे या उससे अधिक पर और जितनी जल्दी हो सके अंडे सेने के बाद, संदंश का उपयोग करने के लिए मानक ड्रोसोफिला खाद्य शीशियों के लिए लार्वा लेने और स्थानांतरित करने और 25 डिग्री सेल्सियस पर सेते हैं।
- तनाव को पुनर्जीवित करने के लिए, नई उभरी महिलाओं और पुरुषों (चित्रा 6) को पार करें।
नोट: एगामेटिक मेजबान बैलेंसर-गुणसूत्र उपभेदों को पार किए बिना एक बार में पूरे जीनोम को बहाल करना संभव बनाते हैं। एक शीशी में युग्मक पुरुषों के सह-अस्तित्व कोई फर्क नहीं पड़ेगा क्योंकि महिलाओं, भले ही उनके साथ संभोग किया गया हो, लंबे समय तक संभोग के बाद प्रतिक्रियाओं को नहीं दिखाते हैं, जिसमें18,19 को पुनः प्राप्त करने के लिए ग्रहणशीलता में कमी आई है।
Representative Results
क्रायोप्रेज़र्ड पीजीसी प्रत्यारोपण की दक्षता असाओका एट अल.13 द्वारा बताई गई है और तरल नाइट्रोजन में 1 दिन या उससे अधिक समय के लिए संरक्षित पीजीसी क्रायोप्रेक्षित के प्रत्यारोपण के लिए तालिका 2 में दी गई है। हैचिंग दर 168/208 प्रत्यारोपित भ्रूण (80.8%) थी, और भ्रूण-से-वयस्क व्यवहार्यता 87/208 (41.8%) थी। उपजाऊ मक्खियों की आवृत्ति 28/87 (32.2%) थी। यह आवृत्ति 8 से 30 दिनों के लिए पीजीसी क्रायोप्रेज़्ड और 31-150 दिनों (20/57 बनाम 8/30, जी' = 0.63, पी >0.1, डीएफ = 1) के लिए क्रायोप्रेज़्ड लोगों के बीच भिन्न नहीं थी। प्रति जोड़े संतान की औसत संख्या 77.2 ± 7.1 (एन = 18, 28-122) थी, जो क्रायोप्रिजर्व पीजीसी की जर्मलाइन स्टेम सेल बनने की क्षमता को दर्शाता है। 26 सुइयों में से 10 सुइयों ने कोई उपजाऊ संतान पैदा नहीं की, 7 सुइयों ने 1 उपजाऊ संतान का उत्पादन किया, 7 सुइयों ने 2 उपजाऊ संतान का उत्पादन किया, और 2 सुइयों ने 3 या 4 उपजाऊ संतान का उत्पादन किया। प्रति सुई उपजाऊ मक्खियों की औसत संख्या 1.1 ± 0.2 थी। इस डेटा के आधार पर, 95% आत्मविश्वास के साथ, 11 सुइयां 6 या अधिक संतान पैदा करने के लिए पर्याप्त हैं, जिसमें कम से कम एक महिला और एक नर शामिल होने की संभावना है।
उपरोक्त प्रयोगों में, हमने पीजीसी (नैनो>ओवो-ए, OvoA_OE भ्रूण) में ओवो-ए एमआरएनए को एक युग्मक मेजबान के रूप में व्यक्त करने वाले भ्रूण का उपयोग किया। प्रत्यारोपित नैनो>ओवो-ए जोड़ों से उत्पादित 669 एफ 1 महिलाओं और 720 एफ 1 पुरुषों में से, कोई भी भागने वाला नहीं था जो मेजबान पीजीसी से प्राप्त हुआ था। कई ऑस्कर (ओस्क) म्यूटेंट भी तापमान संवेदनशील अगामेटिक20,21 हैं। क्योंकि उच्च समरूप व्यवहार्यता और एगामेटिक फेनोटाइप के साथ एक ओस्क उत्परिवर्ती अब उपलब्ध नहीं है, हमने CRISPR / Cas9-असिस्टेड जीनोम एडिटिंग द्वारा osk [8] missense mutant20 को फिर से बनाया। ये मक्खियाँ 25 डिग्री सेल्सियस पर पूरी तरह से अयुग्मित (230 महिलाओं और 192 पुरुषों में से 0 भागने वाले) थीं, लेकिन कुछ भागने वाले 23 डिग्री सेल्सियस (248 महिलाओं में से 1 और 290 पुरुषों में से 1) पर उभरे। नैनोस>ओवो-ए को इस प्रकार एगामेटिक होस्ट भ्रूण के रूप में अनुशंसित किया जाता है। UASp-ovo-A और nanos-Gal4 स्टॉक13 दोनों जल्द ही KYOTO ड्रोसोफिला स्टॉक सेंटर से उपलब्ध होंगे।

चित्रा 1: उपकरण की आवश्यकता। (ए) कोशिकाओं को इकट्ठा करने और प्रत्यारोपण करने के लिए एक माइक्रोमैनिपुलेटर सिस्टम। i) उल्टे माइक्रोस्कोप, ii) मैकेनिकल माइक्रोमैनिपुलेटर, iii) सिरिंज, iv) केशिका धारक, v) तीन-तरफा स्टॉपकॉक, vi) ह्यूमिडिफायर, और vii) स्टीरियो माइक्रोस्कोप। (बी) एक सिरिंज। (सी) एक तीन-तरफा पानी निकलने की टोंटी और सिलिकॉन ट्यूब एक सिरिंज और एक केशिका धारक को जोड़ते हैं। (डी) एक सुई और एक केशिका धारक एक माइक्रोमैनिपुलेटर से जुड़े होते हैं। (ई) एक भ्रूण-संग्रह प्लेट (6 सेमी व्यास, 7.7 सेमी ऊंचा) के साथ एक भ्रूण-संग्रह कप। (एफ) एक स्टेनलेस स्टील जाल छलनी। (छ) एक कंटेनर एक गिलास स्लाइड के साथ एक नम कक्ष के रूप में इस्तेमाल किया. नमी बनाए रखने के लिए, तल पर गीला कागज रखें और ढक्कन बंद करें। (एच) क्रायोप्रिजर्वेशन के लिए सुई के साथ एक सुई धारक। (I) क्रायोप्रिजर्वेशन के लिए एक भंडारण रैक और सुइयों के साथ एक बॉक्स। कृपया इस चित्र का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
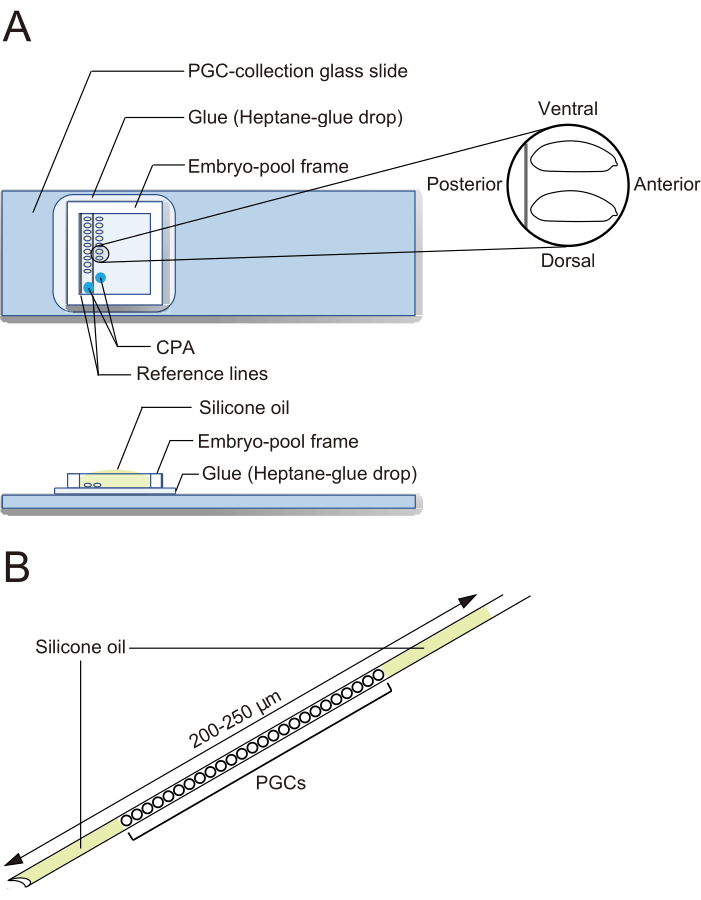
चित्रा 2: एक पीजीसी-संग्रह ग्लास स्लाइड और एक क्रायोप्रेज़र्वेशन सुई। (ए) एक प्राइमर्डियल जर्म सेल (पीजीसी) -संग्रह ग्लास स्लाइड गोंद के साथ लेपित। Dechorionated भ्रूण दो पंक्तियों में गठबंधन कर रहे हैं और सही करने के लिए उनके पूर्वकाल के साथ उन्मुख (पक्ष हेरफेर किया जा करने के लिए) और उदर पक्ष ऊपर. एक भ्रूण-पूल फ्रेम चिपका दिया जाता है, क्रायोप्रोटेक्टिव एजेंट (सीपीए) समाधान की दो बूंदें जमा की जाती हैं, और पूल सिलिकॉन तेल से भर जाता है। (बी) एक सुई में जर्दी और अन्य संदूषकों की थोड़ी मात्रा यथासंभव होनी चाहिए। तरल नाइट्रोजन में क्रायोप्रेज़र्ड होने पर पीजीसी को सिलिकॉन तेल की दो परतों के बीच सैंडविच किया जाता है। कृपया इस चित्र का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
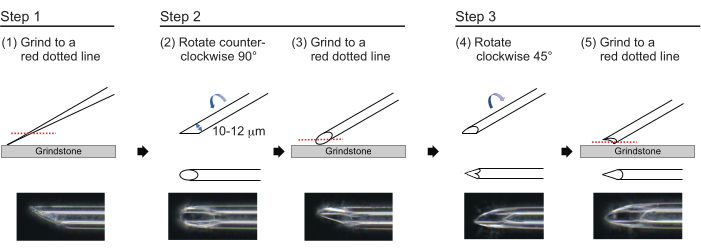
चित्रा 3: सुई बनाना। एक उपयुक्त छेद आकार और एक तेज टिप के साथ एक सुई बनाने के लिए तीन-चरण टिप-पॉलिशिंग विधि। कृपया इस चित्र का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
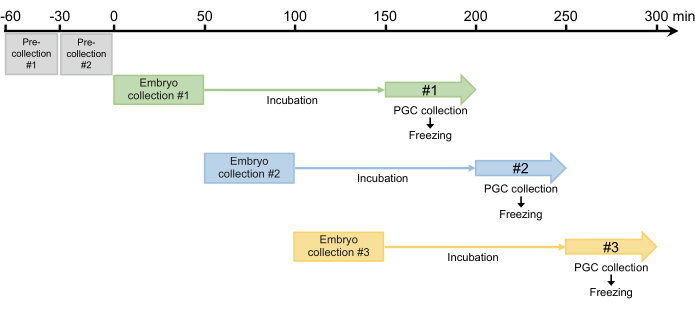
चित्रा 4: भ्रूण संग्रह योजना। दो पूर्व-संग्रह के बाद, हम आमतौर पर प्रति दिन तीन या चार बार एकत्र करते हैं। कृपया इस चित्र का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
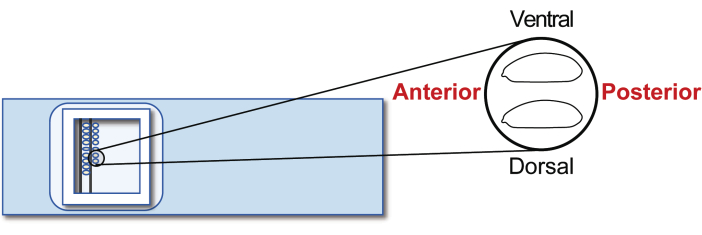
चित्रा 5: मेजबान भ्रूण संरेखण। एक ग्लास स्लाइड पर मेजबान भ्रूण का संरेखण। कृपया इस चित्र का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
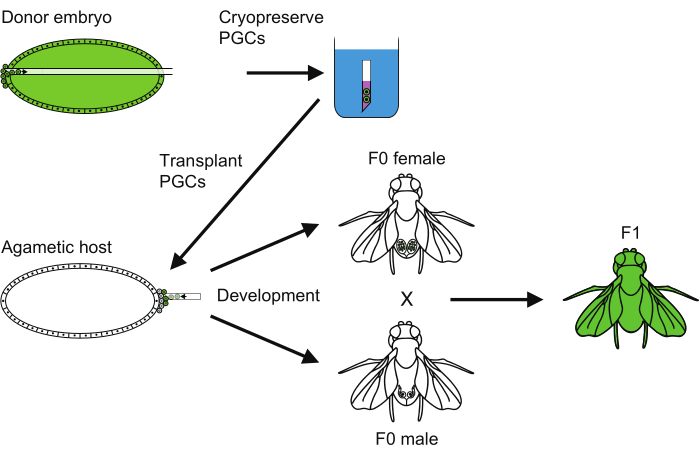
चित्रा 6: पीजीसी क्रायोप्रिजर्वेशन विधि का अवलोकन। प्राइमर्डियल जर्म सेल (पीजीसी) क्रायोप्रिजर्वेशन को पूरा करने के लिए पालन किए गए सभी चरणों का अवलोकन। कृपया इस चित्र का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
| कमरे की आर्द्रता | |||
| < 30% | ~ 30% | > 30% | |
| मेजबान भ्रूण संरेखित करें (~ 20 मिनट) | 2 - 10 मिनट के लिए ह्यूमिडिफर का प्रयोग करें | 1 मिनट के लिए रुक-रुक कर ह्यूमिडिफर का उपयोग करें | ह्यूमिडिफ़र का उपयोग न करें |
| पिघलना दाता पीजीसी | लागू नहीं | लागू नहीं | लागू नहीं |
| हवा में सुखाने वाले PGCs | इस चरण को छोड़ दें | इस चरण को छोड़ दें | 5 मिन |
| सिलिकॉन तेल लागू करें | लागू नहीं | लागू नहीं | लागू नहीं |
| प्रत्यारोपण PGCs | लागू नहीं | लागू नहीं | लागू नहीं |
| इन सभी चरणों को 50 मिनट में समाप्त किया जाना चाहिए। | |||
तालिका 1: भ्रूण संरेखण और पीजीसी विगलन के दौरान भ्रूण का सूखना।
| दाता तनाव | क्रायोप्रिजर्वेशन अवधि | प्रत्यारोपित भ्रूण की संख्या (ए) | रची लार्वा की संख्या (बी) (हैचबिलिटी, बी/ए) | बंद वयस्कों की संख्या (सी) (अंडे से वयस्क व्यवहार्यता, सी / | उपजाऊ वयस्कों की संख्या (डी) (उपजाऊ मक्खियों की आवृत्ति, डी/सी) |
| एम17 | 8 - 30 दिन | 134 | 108 (80.6%) | 57 (42.5%) | 20 (35.1%) |
| एम17 | 31 - 150 दिन | 74 | 60 (81.1%) | 30 (40.5%) | 8 (26.7%) |
| एम 17: वाईडब्ल्यू; TM6B, P{Dfd-GMR-nvYFP}4, Sb[1] Tb[1] ca[1]/ Pri[1] | |||||
तालिका 2: क्रायोप्रेज़र्ड पीजीसी प्रत्यारोपण की दक्षता। यह तालिका13 से संशोधित की गई है। सभी डेटा एगामेटिक होस्ट से हैं।
Discussion
पीजीसी क्रायोप्रिजर्वेशन और पुनरुद्धार में सफलता के लिए एक महत्वपूर्ण कारक अच्छे भ्रूण का उपयोग करना है। भ्रूण संग्रह के लिए युवा महिलाओं (जैसे, 3- से 5 दिन पुरानी) का उपयोग किया जाना चाहिए। दोनों दाता और मेजबान भ्रूण सूक्ष्म निरीक्षण द्वारा मूल्यांकन कर रहे हैं, और केवल ब्लास्टोडर्म चरण (चरण 5) में उन12 का उपयोग किया जाता है. पीजीसी संग्रह के लिए, हम आम तौर पर 20 मिनट की अवधि में लगभग 40 दाता भ्रूण संरेखित करते हैं और प्रारंभिक चरण 5 में लगभग 30 भ्रूण से पीजीसी एकत्र करते हैं; पुराने और दोषपूर्ण भ्रूण का उपयोग नहीं किया जाता है। क्रायोप्रेज़र्वेशन और विगलन के बाद, पीजीसी को अपना आकार बनाए रखना चाहिए; पीजीसी असफल संरक्षण में टूटते हैं। मेजबान भ्रूण भी चरण 5 पर होना चाहिए और एक मध्यम आंतरिक दबाव होना चाहिए; कोमल प्रोडिंग के बाद भ्रूण को धीरे-धीरे अपने मूल आकार में लौटना चाहिए। अत्यधिक और अपर्याप्त रूप से सूखे भ्रूण प्रत्यारोपण के बाद सामान्य रूप से विकसित नहीं होंगे। क्योंकि पीजीसी का विषमलैंगिक प्रत्यारोपण ड्रोसोफिला 5,10 में युग्मकों का उत्पादन करने में विफल रहता है, मेजबान भ्रूण में कई दाता भ्रूण से पीजीसी का प्रत्यारोपण उपजाऊ वयस्कों की उपज की अधिक संभावना है। यह अंत करने के लिए, हम आम तौर पर सुई प्रति लगभग 30 भ्रूण से पीजीसी इकट्ठा.
क्रायोप्रोटेक्टेंट के रूप में, हमने विभिन्न सांद्रता में सुक्रोज के साथ एथिलीन ग्लाइकॉल, डाइमिथाइल सल्फ़ोक्साइड और ग्लिसरॉल की कोशिश की। हमने ईबीआर को 20% एथिलीन ग्लाइकॉल और 1 एम सुक्रोज युक्त सर्वश्रेष्ठ13 के रूप में निर्धारित किया; हालांकि, विभिन्न क्रायोप्रोटेक्टेंट्स के उपयोग से पीजीसी संरक्षण22में सुधार हो सकता है।
इस क्रायोप्रिजर्वेशन विधि के लिए पीजीसी हैंडलिंग में विशेष कौशल की आवश्यकता होती है, और पीजीसी को आराम से इकट्ठा करने और प्रत्यारोपण करने के लिए लगभग 6 सप्ताह के प्रशिक्षण की आवश्यकता होती है। कौशल प्रवीणता का आकलन और सुधार करने के लिए, इसे छह प्रशिक्षण चरणों में विभाजित किया जा सकता है: 1) एक ग्लास स्लाइड पर भ्रूण को संरेखित करना, 2) एक मैनिपुलेटर को नियंत्रित करना, 3) क्रायोप्रिजर्वेशन के बिना एक भ्रूण से दूसरे भ्रूण में पीजीसी प्रत्यारोपण, 4) 10 या अधिक भ्रूणों से पीजीसी को 5 से 10 भ्रूणों में प्रत्यारोपित करना, 5) सीपीए लागू करने के बाद पीजीसी प्रत्यारोपण, और 6) फ्रीज-विगलन के बाद पीजीसी प्रत्यारोपण। प्रत्येक चरण में 1 सप्ताह लग सकता है। चरण 3 में अल्पकालिक लक्ष्य 40% की हैचिंग दर, 10% -20% की भ्रूण-से-वयस्क व्यवहार्यता और 20% की उपजाऊ मक्खियों की आवृत्ति है।
पीजीसी क्रायोप्रिजर्वेशन के लिए महंगे इंस्ट्रूमेंटेशन और अत्यधिक कुशल कर्मियों की आवश्यकता होती है। इसलिए, इस पद्धति को कई प्रयोगशालाओं द्वारा नहीं अपनाया जा सकता है। हालांकि, वर्तमान पीजीसी पद्धति के कई महत्वपूर्ण पहलू हैं। सबसे पहले, पीजीसी भ्रूण की तुलना में बहुत छोटे होते हैं और क्रायोप्रोटेक्टेंट के लिए बहुत पारगम्य होते हैं। इसके विपरीत, क्रायोप्रोटेक्टेंट पारगम्यता ड्रोसोफिला भ्रूण की मोमी परतों द्वारा गंभीर रूप से सीमित है, जो भ्रूण क्रायोप्रिजर्वेशन में सबसे गंभीर समस्या है। दरअसल, पिछले अध्ययनों ने एक समय खिड़की खोजने के लिए बहुत प्रयास किए हैं जिसमें भ्रूण में उच्च जीवित रहने की दर और एक पतली मोम परत होती है। दूसरा उपभेदों के बीच विकासात्मक और रूपात्मक भिन्नता से संबंधित है। पीजीसी प्रारंभिक चरण -5 भ्रूण (अंडे देने के बाद 2 घंटे 30 मिनट -3 घंटे 20 मिनट) से एकत्र किए जाते हैं, जबकि भ्रूण क्रायोप्रिजर्वेशन चरण -16 भ्रूण (अंडे देने के बाद 14-22 घंटे) पर किया जाता है। इसलिए, भ्रूण बहुत पुराने हैं और पीजीसी क्रायोप्रिजर्वेशन की तुलना में क्रायोप्रिजर्वेशन के लिए इष्टतम समय खिड़की में बहुत अधिक तनाव भिन्नता दिखाते हैं। दरअसल, दाता-व्युत्पन्न संतान पैदा करने वाले मेजबानों की आवृत्ति असाओका एट अल.13 द्वारा अध्ययन किए गए पांच उपभेदों के बीच भिन्न नहीं थी, हालांकि मेजबान अगामेटिक नहीं थे। इसके अलावा, पीजीसी में जेनेटिक इंजीनियरिंग अनुप्रयोगों में उपयोग किए जाने की क्षमता है, जैसे जीनोम संपादन 14,15,16।
Acknowledgements
हम मक्खी उपभेदों के लिए क्योटो ड्रोसोफिला स्टॉक सेंटर को धन्यवाद देते हैं। हम पांडुलिपि के अंग्रेजी भाषा संपादन के लिए सुश्री वांडा मियाता और इस पांडुलिपि के मसौदे को संपादित करने के लिए एडान्ज़ (https://jp.edanz.com/ac) से डॉ. जेरेमी एलन को भी धन्यवाद देते हैं। इस काम को जापान एजेंसी फॉर मेडिकल रिसर्च एंड डेवलपमेंट (AMED) से T.T.-S.K., अनुदान (JP16km0210073, JP18km0210145, JP18km0210145) से अनुदान (JP16km0210073, JP17km0210147, JP18km0210145) द्वारा समर्थित किया गया था। और एस.के., जापान सोसाइटी फॉर द प्रमोशन ऑफ साइंस (JSPS) से T.T.-S.-K तक वैज्ञानिक अनुसंधान (C) (JP19K06780) के लिए अनुदान, और JSPS से S.K. तक अभिनव क्षेत्रों (JP18H05552) पर वैज्ञानिक अनुसंधान के लिए अनुदान-सहायता
Materials
| Name | Company | Catalog Number | Comments |
| Acetic acid | FUJIFILM Wako Pure Chemical Corporation | 017-00256 | For embryo collection |
| Agar powder | FUJIFILM Wako Pure Chemical Corporation | 010-08725 | For embryo collection |
| Calcium chloride | FUJIFILM Wako Pure Chemical Corporation | 038-24985 | For EBR solution |
| Capillary | Sutter Instrument | B100-75-10-PT | BOROSILICATE GLASS; O.D: 1.0mm, I.D: 0.75mm , length: 10cm, 225Pcs |
| Capillary holder | Eppendorf | 5196 081.005 | Capillary holder 4; for micromanipulation |
| Chromic acid mixture | FUJIFILM Wako Pure Chemical Corporation | 037-05415 | For needle washing |
| CPA solution | 1x EBR containing 20% ethylene glycol and 1M sucrose | ||
| Double-sided tape | 3M | Scotch w-12 | For glue extracting |
| Ephrussi–Beadle Ringer solution (EBR) | 130 mM NaCl, 5 mM KCl, 2 mM CaCl2, and 10 mM Hepes at pH 6.9 | ||
| Ethanol (99.5) | FUJIFILM Wako Pure Chemical Corporation | 057-00451 | For embryo collection |
| Ethylene glycol | FUJIFILM Wako Pure Chemical Corporation | 054-00983 | For CPA solution |
| Falcon 50 mm x 9 mm bacteriological petri dish | Corning Inc. | 351006 | For embryo collection |
| Forceps | Vigor | Type5 Titan | For embryo handling |
| Grape juice | Asahi Soft Drinks Co., LTD. | Welch's Grape 100 | For embryo collection |
| Grape juice agar plate | 50% grape juice, 2% agar, 1% ethanol, 1% acetic acid | ||
| Heptane | FUJIFILM Wako Pure Chemical Corporation | 084-08105 | For glue extracting |
| Humidifier | APIX INTERNATIONAL CO., LTD. | FSWD2201-WH | For embryo preparation |
| Inverted microscope | Leica Microsystems GmbH | Leica DM IL LED | For micromanipulation |
| Luer-lock glass syringe | Tokyo Garasu Kikai Co., Ltd. | 0550 14 71 08 | Coat a plunger with silicon oil (FL-100-450CS);for micromanipulation |
| Mechanical micromanipulator | Leica Microsystems GmbH | For micromanipulation | |
| Micro slide glass | Matsunami Glass Ind., Ltd. | S-2441 | For embryo aligning |
| Microgrinder | NARISHIGE Group | Custom order | EG-401-S combined EG-401 and MF2 (with ocular lens MF2-LE15 ); for needle preparation |
| Microscope camera | Leica Microsystems GmbH | Leica MC170 HD | For micromanipulation |
| Needle holder | Merck KGaA | Eppendorf TransferTip (ES) | For cryopreservation |
| Potassium chloride | Nacalai Tesque, Inc. | 28514-75 | For EBR solution |
| Puller | NARISHIGE Group | PN-31 | For needle preparation; the heater level is set to 85.0-98.4, the magnet main level to 57.8, and the magnet sub level to 45.0. |
| PVC adhesive tape for electric insulation | Nitto Denko Corporation | J2515 | For embryo-pool frame |
| Silicon oil | Shin-Etsu Chemical, Co, Ltd. | FL-100-450CS | For embryo handling |
| Sodium chloride | Nacalai Tesque, Inc. | 31320-05 | For EBR solution |
| Sodium hypochlorite solution | FUJIFILM Wako Pure Chemical Corporation | 197-02206 | Undiluted and freshly prepared; for embryo breaching |
| Sucrose | Nacalai Tesque, Inc. | 30404-45 | For CPA solution |
References
- Brüschweiler, W., Gehring, W. A method for freezing living ovaries of Drosophila melanogaster larvae and its application to the storage of mutant stocks. Experientia. 29, 134-135 (1973).
- Steponkus, P. L., et al. Cryopreservation of Drosophila melanogaster embryos. Nature. 345, 170-172 (1990).
- Mazur, P., Cole, K. W., Hall, J. W., Schreuders, P. D., Mahowald, A. P. Cryobiological preservation of Drosophila embryos. Science. 258 (5090), 1932-1935 (1992).
- Zhan, L., Li, M. G., Hays, T., Bischof, J. Cryopreservation method for Drosophila melanogaster embryos. Nat Comm. 12, 2412 (2021).
- Van Deusen, E. B. Sex determination in germ line chimeras of Drosophila melanogaster. Development. 37 (1), 173-185 (1977).
- Breen, T. R., Duncan, I. M. Maternal expression of genes that regulate the bithorax complex of Drosophila melanogaster. Dev Biol. 118, 442-456 (1986).
- Schupbach, T., Wieschaus, E. Germline autonomy of maternal-effect mutations altering the embryonic body pattern of Drosophila. Dev Biol. 113, 443-448 (1986).
- Irish, V., Lehmann, R., Akam, M. The Drosophila posterior-group gene nanos functions by repressing hunchback activity. Nature. 338, 646-648 (1989).
- Hülskamp, M., Schröder, C., Pfeifle, C., Jäckle, H., Tautz, D. Posterior segmentation of the Drosophila embryo in the absence of a maternal posterior organizer gene. Nature. 338, 629-632 (1989).
- Steinmann-Zwicky, M., Schmid, H., Nöthiger, R. Cell-autonomous and inductive signals can determine the sex of the germ line of Drosophila by regulating the gene Sxl. Cell. 57 (1), 157-166 (1989).
- Stein, D., Roth, S., Vogelsang, E., Nüsslein-Volhard, C. The polarity of the dorsoventral axis in the drosophila embryo is defined by an extracellular signal. Cell. 65 (5), 725-735 (1991).
- Kobayashi, S., Yamada, M., Asaoka, M., Kitamura, T. Essential role of the posterior morphogen nanos for germline development in Drosophila. Nature. 380, 708-711 (1996).
- Asaoka, M., et al. Offspring production from cryopreserved primordial germ cells in Drosophila. Comm Biol. 4 (1), 1159 (2021).
- Blitz, I. L., Fish, M. B., Cho, K. W. Y. Leapfrogging: primordial germ cell transplantation permits recovery of CRISPR/Cas9-induced mutations in essential genes. Development. 143 (15), 2868-2875 (2016).
- Koslová, A., et al. Precise CRISPR/Cas9 editing of the NHE1 gene renders chickens resistant to the J subgroup of avian leukosis virus. Proc Natl Acad Sci U S A. 117 (4), 2108-2112 (2020).
- Zhang, F. Efficient generation of zebrafish maternal-zygotic mutants through transplantation of ectopically induced and Cas9/gRNA targeted primordial germ cells. J Genet Genom. 47 (1), 37-47 (2020).
- Campos-Ortega, J. A., Hartenstein, V. Stages of Drosophila Embryogenesis. The Embryonic Development of Drosophila. , (1997).
- Manning, A. A sperm factor affecting the receptivity of Drosophila melanogaster females. Nature. 194, 252-253 (1962).
- Kubli, E. Sex-peptides: seminal peptides of the Drosophila male. Cell Mol Life Sci. 60, 1689-1704 (2003).
- Lehmann, R., Nüsslein-Volhard, C. Abdominal segmentation, pole cell formation, and embryonic polarity require the localized activity of oskar, a maternal gene in drosophila. Cell. 47 (1), 141-152 (1986).
- Kiger, A. A., Gigliotti, S., Fuller, M. T. Developmental genetics of the essential Drosophila Nucleoporin nup154: allelic differences due to an outward-directed promoter in the P-element 3′ end. Genetics. 153 (2), 799-812 (1999).
- Rienzi, L. F., et al. Perspectives in gamete and embryo cryopreservation. Semin Reprod Med. 36 (5), 253-264 (2018).
Explore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved