Primordial Germ Cell Cryopreservation and Revival of Drosophila Strains(초파리 균주의 원시 생식세포 냉동 보존 및 부활)
* These authors contributed equally
In This Article
Summary
성충 파리를 신선한 식품 바이알로 자주 옮기는 것에 대한 대안으로 초파리 균주에 대한 장기 보존 방법은 매우 바람직합니다. 이 프로토콜은 초파리 원시 생식 세포의 동결 보존과 무생식 숙주 배아로의 이식을 통한 균주 부활을 설명합니다.
Abstract
초파리 균주는 성충 파리를 새 유리병으로 자주 옮겨 유지해야 합니다. 이것은 돌연변이 악화 및 표현형 변화의 위험을 수반합니다. 따라서 이러한 변화 없이 장기 보존을 위한 대체 방법을 개발하는 것이 필수적입니다. 이전의 성공적인 시도에도 불구하고 초파리 배아의 냉동 보존은 낮은 재현성으로 인해 여전히 실용적이지 않습니다. 여기서는 동결 보존된 PGC를 agametic Drosophila melanogaster (D. melanogaster) 숙주 배아에 이식하여 원시 생식 세포(PGC) 동결 보존 및 균주 부활을 위한 프로토콜을 설명합니다. PGC는 동결보호제(CPA)에 대한 투과성이 높으며, 균주 간의 발달 및 형태학적 변이는 배아 동결 보존보다 문제가 적습니다. 이 방법에서는 약 30개의 기증자 배아에서 PGC를 수집하여 CPA 처리 후 바늘에 삽입한 다음 액체 질소에서 냉동 보존합니다. 기증자 유래 배우자를 생산하기 위해 바늘에서 동결 보존된 PGC를 해동한 다음 약 15개의 비생식 숙주 배아에 증착합니다. 이 프로토콜로 최소 15%의 번식 가능한 파리의 빈도를 달성했으며, 가임 부부당 자손 수는 항상 원래 균주를 되살리기에 충분하고도 남았으며(평균 자손 수는 77.2 ± 7.1), 이는 동결 보존된 PGC가 생식세포 줄기세포가 될 수 있는 능력을 나타냅니다. 바늘 당 평균 번식 가능 파리 수는 1.1 ± 0.2 개였으며 26 개의 바늘 중 9 개는 2 개 이상의 번식 가능한 자손을 낳았습니다. 11개의 바늘은 6개 이상의 자손을 낳기에 충분하며, 적어도 한 마리의 암컷과 한 마리의 수컷이 포함될 가능성이 있음이 밝혀졌습니다. agametic 숙주는 새로 출현한 암컷과 수컷 파리를 교배하는 것만으로도 균주를 빠르게 되살릴 수 있습니다. 또한 PGC는 게놈 편집과 같은 유전 공학 응용 분야에 사용될 수 있는 잠재력을 가지고 있습니다.
Introduction
성충 파리를 새로운 먹이 바이알로 옮겨 초파리 균주를 유지하는 것은 필연적으로 시간이 지남에 따라 돌연변이와 후성유전학적 변화의 축적을 초래합니다. 이러한 변화 없이 초파리 균주를 장기간 유지하기 위한 대체 방법의 개발은 필수적이며, 특히 전체 게놈을 유지해야 하는 참조 균주의 경우 더욱 그렇습니다. 초파리 배아 또는 난소를 냉동 보존하기 위한 몇 가지 성공적인 시도가 기술되었습니다 1,2,3. 불행히도 재현성이 낮기 때문에 여전히 실용적이지 않습니다. 실제로, 초기 단계의 배아는 난황 함량이 높기 때문에 냉동 보존 후 생존율이 낮으며, 이는 동결 보호제(CPA) 투과 및 확산을 방해합니다 2,3. CPA 투과성은 또한 후기 단계 배아의 왁스 층에 의해 심각하게 제한됩니다. 배아의 생존율이 높고 왁스 층이 더 얇은 균주별 기간을 찾는 것은 어렵고 시간이 많이 걸립니다. 최근 Zhan et al.4은 배아 투과화, CPA 로딩 및 유리화 방법을 개선하고 여러 균주의 배아를 성공적으로 냉동 보존했습니다. 그러나 투과화 후 배아의 생존력이 떨어지는 경향이 있기 때문에 방법을 적용하기가 쉽지 않습니다. 따라서 대안적 접근법의 추가 개선과 개발이 여전히 필요합니다. 원시 생식 세포(PGC)의 동결 보존과 관련된 방법은 초파리 균주의 장기 유지를 위한 대안적인 접근 방식입니다.
PGC(극 세포라고도 함) 이식은 접합 치사 돌연변이의 모계 효과 및 생식 세포의 성별 결정과 같은 과정을 연구하기 위해 생식세포 키메라, 특히 암컷을 생성하는 데 사용되었습니다 5,6,7,8,9,10,11,12 . PGC는 배아보다 훨씬 작으며 대부분의 동결 보호제에 대한 투과성이 높을 수 있습니다. 또한, 균주 간의 발달 및 형태학적 변이는 문제가 적으며, 무생식 숙주는 전체 게놈의 빠른 복원을 가능하게 합니다. 당사는 최근 PGC 동결 보존의 새로운 방법을 개발했으며,이는 초파리 균주에서 불가피한 유전적 및 후성유전학적 변화를 방지합니다. 여기에서는 자세한 프로토콜을 제시합니다.
이 냉동 보존 방법은 PGC 취급 및 기기에 대한 특정 전문 지식이 필요합니다. 단계별 접근 방식은 익숙하지 않은 사람들에게는 효율적인 솔루션일 수 있지만 기기 요구 사항으로 인해 소규모 실험실에는 적합하지 않을 수 있습니다. 이 PGC 동결 보존 프로토콜은 발달 및 형태학적 차이가 더 작기 때문에 배아 동결 보존 프로토콜보다 다른 초파리 종 및 다른 곤충 종에 사용하도록 더 쉽게 조정할 수 있습니다. PGC는 게놈 편집(genome editing)과 같은 유전 공학 응용 분야에서도 잠재적으로 사용될 수 있다 14,15,16. 요약하면, 이 방법은 재고 센터 및 기타 실험실에서 파리 및 기타 곤충 균주를 변경 없이 장기간 유지하는 데 사용할 수 있습니다.
Protocol
1. 장비 준비
- Micromanipulator 시스템: Micromanipulator 시스템을 조립하여 세포를 수집하고 이식합니다(그림 1A).
- PGC 수집 유리 슬라이드(그림 2A)
- 헵탄 접착제를 준비하려면 약 30cm 길이의 양면 테이프를 자르고 기술(일반) 등급 헵탄 용액 7mL에 밤새 담그십시오.
- 배아 정렬을 위해 유리 슬라이드 뒷면에 두 개의 평행한 기준선을 그립니다.
- 파스퇴르 피펫을 사용하여 유리 슬라이드(선이 없는 쪽)에 위의 헵탄 접착제 방울을 펴 바릅니다. 슬라이드 표면이 하얗게 될 때까지 자연 건조시킵니다.
- 헵탄 접착제 방울을 넣고 펴 바르는 것을 반복하고 슬라이드를 다시 말리십시오.
알림: 접착제는 액체 용액이 평평한 표면에 퍼지는 것을 방지하고 수용액을 바늘에 더 쉽게 로드할 수 있도록 합니다. - 배아 풀 프레임을 만들려면 전기 테이프와 같은 0.2mm 두께의 표준 비닐 테이프를 도마에 3겹 붙입니다. 테이프를 1.5cm 너비의 직사각형으로 자릅니다. 그런 다음 세 겹의 테이프를 모두 잘라내어 2-3mm 프레임을 남깁니다.
알림: 배아 풀 프레임은 배아를 정렬한 후 부착되어 배아를 위한 풀을 형성합니다.
- 이식 바늘
참고: 이 연구 당시 시중에서 판매되는 모든 바늘은 PGC 동결 보존을 하기에는 너무 좁거나 너무 넓었습니다.- 유리 모세관과 풀러를 사용하여 바늘을 만드십시오. 히터 레벨이 85.0-98.4, 마그넷 메인 레벨이 57.8, 마그넷 서브 레벨이 45.0인 NARISHIGE PN-31 풀러를 사용합니다.
- 대략 벽 두께가 1μm이고 팁 길이가 약 200μm이고 내경이 10-12μm인 바늘을 만들려면 다음 3단계 공정으로 바늘 끝을 연마합니다(그림 3). 먼저 팁의 내경이 10-12μm가 될 때까지 780rpm의 속도로 바늘 끝을 30° 각도로 연마합니다. 이 첫 번째 연삭 단계는 약 1시간이 걸립니다.
알림: 바늘 끝이 부러지지 않도록 하려면 먼저 숫돌을 돌린 다음 바늘을 숫돌 위로 부드럽게 아래로 움직입니다. - 바늘 상단에 선을 그려 원하는 각도를 추적합니다. 바늘을 시계 반대 방향으로 90° 돌리고 180rpm의 속도로 다시 연마합니다. 약 5분 정도 소요됩니다.
- 바늘을 시계 방향으로 45° 돌리고 180rpm의 속도로 1초 동안 연마합니다.
- 크롬산 혼합물(주의: 독성) 한 방울이 있는 수집 유리 슬라이드를 현미경 s에 놓습니다.tag이자형. 슬라이드 표면을 기준으로 1°-10° 각도로 바늘을 모세관 홀더(그림 13D)에 부착하고 바늘을 조심스럽게 아래로 이동한 다음 팁을 크롬산 혼합물에 담그십시오.
- 플런저를 당기고 밀면서(그림 1B) 바늘에서 용액을 기계적으로 여러 번 로드하고 배출하여 바늘의 유리 파편을 제거합니다. 외벽도 반드시 청소하십시오.
- 바늘의 안쪽과 바깥쪽을 증류수로 두 번 씻어 크롬산을 완전히 제거합니다.
2. PGC의 수집 및 동결 보존
- 배아 채취
- 관심 있는 기증자 균주의 적절한 수의 파리(배아 수집 컵의 경우 각 성별에 대해 약 450마리)를 배아 수집 플레이트(그림 1E)가 있는 배아 수집 컵에 옮기고 25°C에서 배양합니다. 우리는 보통 실온(23-25°C)의 덜 붐비는 조건에서 사육되는 생후 3-5일 된 부모 파리를 사용합니다.
- 30분 동안 두 번의 사전 수집을 수행하고 낳은 알은 버립니다. 암컷은 난관에서 발달하는 수정란을 유지할 수 있기 때문에 이 단계는 2.1.3단계에서 알을 낳는 것을 동기화하는 데 필요합니다(그림 4).
- 두 번의 사전 채취 후 50분 동안 배아를 채취한 다음 채취한 배아를 25°C의 가습 챔버에서 배양하여 배아가 배배엽 단계(초기 단계 517)로 발달할 수 있도록 합니다. 배양 시간은 일반적으로 100분이지만 균주에 따라 최대 120분까지 연장할 수 있습니다(그림 4).
알림: 가습 챔버는 플라스틱 상자 바닥에 축축한 종이 타월을 놓고 사용 전에 물 미스트를 뿌려 만듭니다. 초기 5기 배아에서는 PGC 형성이 완료되지만 체세포 형성은 완료되지 않습니다. 배아의 정확한 단계는 2.4 단계에서 복합 현미경으로 결정됩니다.
- 탈코리오네이션 배아
- 스테인리스 스틸 메쉬 스트레이너(150메쉬, 109μm 개구부, 60μm 와이어 직경; 그림 1F). 겸자를 사용하여 배아 수집 플레이트에서 배아를 수집하여 물방울에 넣습니다.
- 티슈 페이퍼를 아래에서 여과기에 대고 눌러 물을 흡수합니다. 신선한 5%(Cl) 차아염소산나트륨 용액 방울을 배아에 추가하고 10초 동안 여과기를 계속 두드립니다.
- 배아에 증류수를 직접 뿌려 씻고 티슈 페이퍼를 아래에서 여과기에 대고 눌러 물을 흡수합니다. 이 단계를 3번 반복합니다.
- 탈융모 배아 정렬
- 실체 현미경에서 겸자를 사용하여 배아를 이식합니다. 탈코리온화된 배아를 두 개의 기준선을 따라 PGC-수집 유리 슬라이드에서 두 줄로 정렬합니다(그림 2A). 배아는 앞쪽이 오른쪽(조작되는 쪽)과 복쪽이 위로 향하도록 되어 있습니다.
참고: 이 단계는 20분 안에 완료되어야 하며, 그 동안 일반적으로 약 40개의 배아를 정렬합니다. - PGC-collection 유리 슬라이드의 배아 주위에 배아 풀 프레임을 부착합니다. 1μL의 CPA 용액(20% 에틸렌 글리콜 및 1M 자당 함유, 1x EBR, 1x EBR: 130mM NaCl, 5mM KCl, 2mM CaCl2 및 pH 6.9에서 10mM Hepes)을 프레임으로 둘러싸인 영역의 두 개별 지점에 떨어뜨리고 배아가 건조되는 것을 방지하기 위해 풀에 실리콘 오일을 채웁니다(그림 2A).
참고 : CPA 용액을 제조하려면 10 x EBR 용액 3mL를 포함하는 증류 된 H2O 약 20mL에 자당 10.26g을 완전히 용해시킵니다. 에틸렌 글리콜 6mL를 첨가한 후 증류된H2O를 최대 30mL까지 첨가한다. 완전히 혼합한 후 0.22mm 일회용 멤브레인을 통해 용액을 여과합니다.
- 실체 현미경에서 겸자를 사용하여 배아를 이식합니다. 탈코리온화된 배아를 두 개의 기준선을 따라 PGC-수집 유리 슬라이드에서 두 줄로 정렬합니다(그림 2A). 배아는 앞쪽이 오른쪽(조작되는 쪽)과 복쪽이 위로 향하도록 되어 있습니다.
- PGC 수집
- 2.3.2단계의 PGC 수집 유리 슬라이드를 마이크로 매니퓰레이터 시스템이 장착된 현미경의 스테이지에 놓습니다. 바늘을 모세관 홀더에 부착하고 왼쪽 줄의 첫 번째 배아와 바늘 끝을 동일한 초점면으로 가져옵니다. 실리콘 오일을 바늘에 2-3초 동안 넣습니다.
- 왼쪽 줄에 있는 배아에서 PGC 채취를 시작합니다. 20x 대물 렌즈를 사용하여 바늘 끝을 배아의 앞쪽 끝 표면으로 부드럽게 이동하고 바늘을 움직이지 않고 현미경 스테이지를 움직여 배아를 뒤쪽 끝 쪽으로 관통합니다.
- 바늘 끝이 뒤쪽 끝에 도달하면 바늘을 약간 집어넣고 체세포층 바로 안쪽에 있는 바늘의 노른자를 완전히 배출합니다.
- 바늘의 압력을 일정하게 유지하면서 바늘 끝을 후극 바로 안쪽의 PGC로 이동하고 부드럽게, 그러나 많은 시간을 들이지 않고 PGC를 로드합니다.
- 바늘을 배아에서 빠르게 빼내고 바늘에서 난황 및 기타 오염 물질을 실리콘 오일 풀로 배출하여 PGC를 바늘에 유지합니다. 그런 다음 수영장에서 깨끗한 실리콘 오일을 넣으십시오.
- 왼쪽 줄의 다른 배아에 대해 2.4.2-2.4.5단계를 반복합니다. 새로운 배아에서 PGC를 채취하기 전에, 2.4.5 단계에서 로딩된 실리콘 오일을 체세포층 내부에 가능한 한 많이 증착시키면서 로드된 PGC를 바늘에 보관합니다. 이렇게 하면 새로 로드된 PGC가 이전에 수집된 PGC에 인접해 있으며 PGC 사이에 중간 물질이 없습니다.
- 왼쪽 줄의 배아에서 PGC 채취를 완료한 후 PGC를 노른자 및 기타 오염 물질에서 최대한 분리합니다. 이를 위해 바늘에 있는 모든 PGC를 배아 표면에 증착하고 다른 이웃 배아의 난황 또는 기타 오염 물질을 제거합니다.
- 다음으로, 오른쪽 줄의 배아에서 PGC를 수집합니다. 오른쪽 행과 왼쪽 행에서 수집된 PGC를 결합합니다.
- PGC에 동결보호제(CPA) 적용
- 한 방울에 CPA로 바늘을 씻은 후, 다른 방울에 새 CPA를 바늘에 넣고 배아에 침착된 PGC에 CPA를 추가합니다. CPA의 거래량은 PGC의 거래량과 동일해야 합니다.
- CPA를 추가한 후 1-2초 후에 PGC 클러스터에서 가능한 한 많은 CPA를 제거합니다. PGC는 CPA 첨가 직후 약간 줄어들고 정사각형 모양이 됩니다.
- 바늘을 비운 다음 실리콘 오일을 5초 이상 로드합니다. 수집된 모든 PGC를 로드한 다음 실리콘 오일을 다시 한 번 5초 이상 로드합니다. PGC는 이제 두 층의 실리콘 오일 사이에 끼워져 있습니다(그림 2B).
알림: 가능한 한 많은 노른자, CPA 및 기타 오염 물질을 제거하는 것이 중요합니다.
- 동결 보존 PGC
- 3방향 마개(그림 1C)를 연 다음 미세 조작기에서 바늘을 분리합니다. 부드러운 티슈 페이퍼로 바늘 표면의 기름을 닦아냅니다. 티슈로 바늘 끝을 직접 만지지 마십시오.
- 바늘을 바늘 홀더에 부착하고 비닐 테이프를 사용하여 바닥의 제자리에 고정합니다(그림 1H). 홀더 튜브에 라벨을 부착합니다.
- 바늘이 아래쪽을 향하도록 홀더를 액체 질소에 담가 급속 동결합니다. 액체가 랙에서 거품을 멈출 때까지 홀더를 놓지 마십시오.
- 홀더를 증기상 영역이 아닌 액상 영역의 액체 질소 저장 탱크에 보관하십시오.
3. PGC 해동 및 이식
- agametic 숙주 파리의 배아 수집, 탈코리오네이션 및 정렬
- 2단계에 따라 agametic 숙주 파리에서 배아를 수집하고 탈코리오네이트합니다.
- 5단계 무생식 숙주 배아를 이식 유리 슬라이드에 맞춥니다. 그러나 이번에는 후방을 오른쪽(조작할 쪽)으로, 복부를 위쪽으로 향하게 합니다(그림 5). 20분 안에 약 30개의 배아를 두 줄로 정렬합니다.
- 배아를 정렬하는 동안 실내 습도에 필요한 경우 가습기를 2-10분 동안 작동하십시오(표 1). 이상적인 습도는 30%에서 40%이지만 열 조건에 따라 달라질 수 있습니다.
- 숙주 배아에서 PGC를 해동하고 이식하기
- 동결 보존된 PGC를 빠르게 해동하려면 바늘이 들어 있는 홀더를 바늘이 아래를 향하도록 하여 실온 1x EBR 용액에 밀어 넣고 10초 동안 담가 둡니다.
- 이식 유리 슬라이드를 s에 놓습니다.tag현미경의 s. 동결 해동된 바늘을 모세관 홀더에 부착하고 왼쪽 줄의 첫 번째 배아와 바늘 끝을 동일한 초점면으로 가져옵니다.
- 20x 대물 렌즈를 사용하여 바늘 끝을 배아의 뒤쪽 끝 표면으로 부드럽게 움직입니다.
- 각 배아의 바깥쪽을 부드럽게 찔러 천천히 원래 모양으로 돌아오도록 합니다. 찌르기는 배아의 내부 압력이 너무 높거나 낮지 않은지 확인할 것입니다.
- 바늘을 부드럽게 움직여 후극에서 배아를 관통합니다.
- 약 10-20개의 PGC를 후극 바로 안쪽, 정확하게 유리체 막과 배아의 체세포층 사이에 부드럽게 증착시킵니다. 체세포층에 침전시키지 마십시오. 배아에서 주위액이 새어 나오면 누출된 액체를 바늘 안으로 빨아들여 제거합니다.
- 배아에서 바늘을 빼냅니다. 후속 배아에 대해 3.2.5단계와 3.2.6단계를 반복합니다.
4. 배아 배양 및 기증자 균주 복원
- 이식된 PGC를 받지 않은 배아를 제거하고 나머지 배아를 25°C의 가습 챔버(그림 1G)에서 배양합니다.
- 이식 후 24시간 이상, 부화 후 가능한 한 빨리 겸자를 사용하여 부화한 유충을 집어 표준 초파리 먹이 바이알로 옮기고 25°C에서 배양합니다.
- 균주를 되살리려면 새로 출현한 암컷과 수컷을 교배해야 합니다(그림 6).
참고: Agametic 숙주를 사용하면 균형기 염색체 균주를 교차하지 않고 전체 게놈을 한 번에 복원할 수 있습니다. 바이알에서 agametic 수컷의 공존은 암컷이 그들과 짝짓기를 하더라도 짝짓기에 대한 수용성 감소를 포함하여 장기적인 짝짓기 후 반응을 보이지 않기 때문에 중요하지 않습니다18,19.
Representative Results
동결보존된 PGC 이식의 효율은 Asaoka et al.13 에 의해 보고되었으며, 액체 질소에서 1일 이상 동결보존된 PGC의 이식에 대해 표 2 에 나와 있습니다. 부화율은 이식된 배아의 168/208(80.8%)이었고, 배아에서 성체로의 생존율은 87/208(41.8%)이었다. 번식 파리의 빈도는 28/87(32.2%)이었다. 이 빈도는 8 내지 30일 동안 냉동 보존된 PGC와 31 내지 150일 동안 냉동 보존된 PGC 간에 차이가 없었다(20/57 vs. 8/30, G' = 0.63, p >0.1, d.f. = 1). 부부당 평균 자손 수는 77.2 ± 7.1 (n = 18, 28-122)이었으며, 이는 동결 보존된 PGC가 생식세포 줄기세포가 될 수 있는 능력을 나타냅니다. 26개의 바늘 중 10개는 불임 자손을 낳지 않았고, 7개의 바늘은 1개의 가임 자손을 낳았고, 7개의 바늘은 2개의 가임 자손을 낳았고, 2개의 바늘은 3개 또는 4개의 가임 자손을 낳았다. 바늘 당 평균 번식 파리 수는 1.1 ± 0.2 마리였습니다. 이 데이터에 따르면 95%의 신뢰도로 11개의 바늘은 6개 이상의 자손을 생산하기에 충분하며, 여기에는 최소 한 마리의 암컷과 한 마리의 수컷이 포함될 가능성이 있습니다.
위의 실험에서는 PGC(nanos>ovo-A, OvoA_OE embryos)에서 ovo-A mRNA를 발현하는 배아를 agametic 숙주로 사용했습니다. 이식된 nanos>ovo-A 커플에서 생산된 669마리의 F1 암컷과 720마리의 F1 수컷 중에서, 숙주 PGC에서 유래한 탈출자는 없었습니다. 몇몇 oskar (osk) 돌연변이체는 또한 온도에 민감한 agametic20,21이다. 동형접합 생존율이 높고 agametic 표현형을 가진 osk 돌연변이는 더 이상 사용할 수 없기 때문에 CRISPR/Cas9 보조 게놈 편집을 통해 osk[8] missense 돌연변이20을 재현했습니다. 이 파리들은 25°C에서 완전히 비생식적이었지만(암컷 230마리 중 탈출자 0마리, 수컷 192마리) 23°C에서 탈출한 파리가 몇 마리 나타났다(암컷 248마리 중 1마리, 수컷 290마리 중 1마리). 따라서 nanos>ovo-A는 agametic 숙주 배아로 권장됩니다. UASp-ovo-A와 nanos-Gal4 스톡13은 모두 KYOTO Drosophila Stock Center에서 곧 구입할 수 있습니다.

그림 1: 필요한 장비 (A) 세포를 수집하고 이식하기 위한 미세 조작기 시스템. i) 도립 현미경, ii) 기계식 미세 조작기, iii) 주사기, iv) 모세관 홀더, v) 3방향 마개, vi) 가습기 및 vii) 실체 현미경. (B) 주사기. (C) 3방향 마개와 실리콘 튜브가 주사기와 모세관 홀더를 연결합니다. (D) 바늘과 모세관 홀더가 마이크로 매니퓰레이터에 부착되어 있습니다. (E) 배아 채취판(직경 6cm, 높이 7.7cm)이 있는 배아 채취 컵. (F) 스테인리스 스틸 메쉬 스트레이너. (G) 유리 슬라이드가 있는 습한 챔버로 사용되는 용기. 습도를 유지하려면 젖은 종이를 바닥에 놓고 뚜껑을 닫으십시오. (H) 냉동 보존용 바늘이 있는 바늘 홀더. (I) 냉동 보존을 위한 보관 선반과 바늘이 있는 상자. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
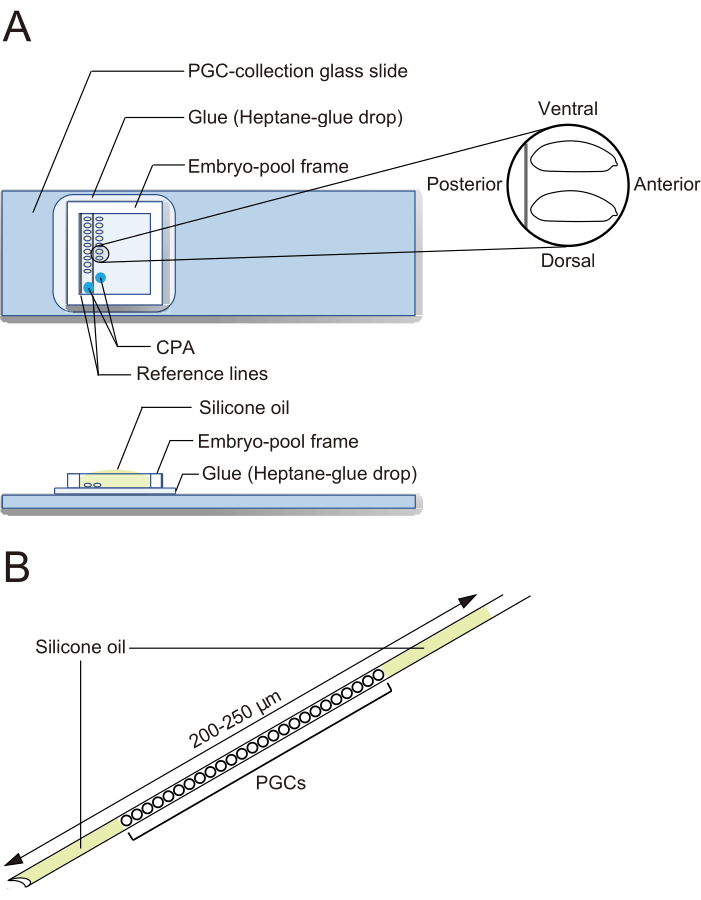
그림 2: PGC 수집 유리 슬라이드와 동결 보존 바늘. (A) 접착제로 코팅된 원시 생식 세포(PGC) 수집 유리 슬라이드. 탈융모 배아는 두 줄로 정렬되어 있으며 앞쪽이 오른쪽(조작될 쪽)과 복쪽이 위로 향하도록 되어 있습니다. 배아 풀 프레임을 부착하고 냉동 보호제(CPA) 용액 두 방울을 침전하고 풀을 실리콘 오일로 채웁니다. (B) 바늘에는 가능한 한 적은 양의 노른자 및 기타 오염 물질이 포함되어야 합니다. PGC는 액체 질소에서 동결 보존될 때 두 층의 실리콘 오일 사이에 끼워집니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
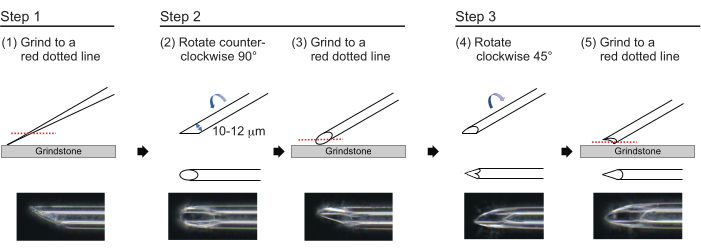
그림 3: 바늘 만들기. 적절한 구멍 크기와 날카로운 팁을 가진 바늘을 만드는 3단계 팁 연마 방법. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
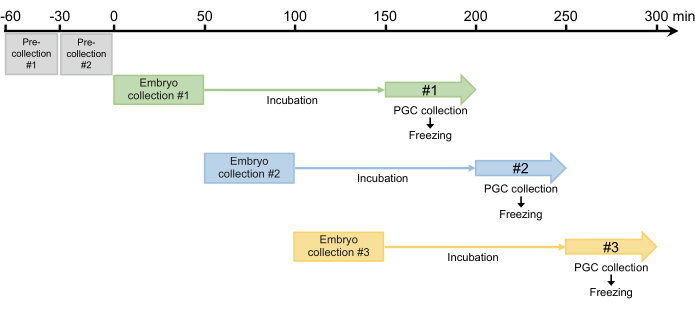
그림 4: 배아 채취 계획. 두 번의 사전 수거 후 보통 하루에 3-4번 수거합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
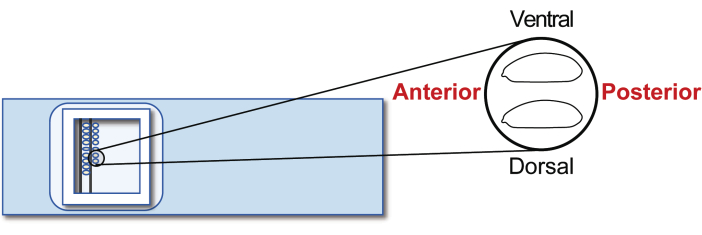
그림 5: 숙주 배아 정렬. 유리 슬라이드에서 숙주 배아의 정렬. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
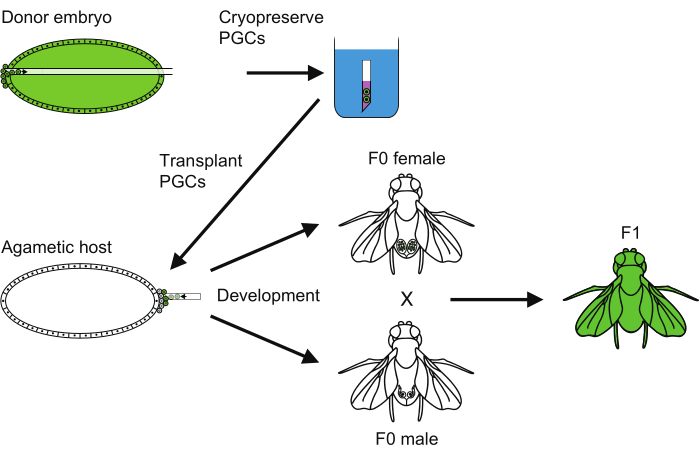
그림 6: PGC 동결 보존 방법의 개요. 원시 생식 세포(PGC) 동결 보존을 수행하기 위해 따라야 하는 모든 단계에 대한 개요. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 실내 습도 | |||
| < 30% | ~ 30% | > 30% | |
| 숙주 배아 정렬 (~20분) | 2 - 10분 동안 가습기를 사용하십시오. | 가습기를 1분 동안 간헐적으로 사용하십시오. | 가습기를 사용하지 마십시오 |
| 기증자 PGC 해동 | 해당 사항 없음 | 해당 사항 없음 | 해당 사항 없음 |
| 공기 건조 PGC | 이 단계 생략 | 이 단계 생략 | 5 민 |
| 실리콘 오일 바르기 | 해당 사항 없음 | 해당 사항 없음 | 해당 사항 없음 |
| 이식 PGC | 해당 사항 없음 | 해당 사항 없음 | 해당 사항 없음 |
| 이 모든 단계는 50분 안에 완료되어야 합니다. | |||
표 1: 배아 정렬 및 PGC 해동 중 배아 건조.
| 기증자 균주 | 냉동 보존 기간 | 이식된 배아의 수(A) | 부화한 유충의 수(B) (부화력, B/A) | 폐쇄된 성인 수(C) (난자에서 성체로의 생존력, C/A) | 가임 성인 수(D) (번식 파리의 빈도, D/C) |
| M17 시리즈 | 8 - 30 일 | 134 | 108 (80.6%) | 57 (42.5%) | 20 (35.1%) |
| M17 시리즈 | 31 - 150 일 | 74 | 60 (81.1%) | 30 (40.5%) | 8 (26.7%) |
| M17: yw; TM6B, P{Dfd-GMR-nvYFP}4, Sb[1] Tb[1] ca[1]/ Pri[1] | |||||
표 2: 동결 보존된 PGC 이식의 효율성. 이 테이블은13에서 수정되었습니다. 모든 데이터는 agametic 호스트에서 가져온 것입니다.
Discussion
PGC 냉동 보존 및 소생의 성공을 위한 중요한 요소는 좋은 배아를 사용하는 것입니다. 어린 암컷(예: 생후 3-5일)은 배아 채취에 사용해야 합니다. 기증자 배아와 숙주 배아 모두 현미경 검사로 평가되며, 배배엽 단계(5기)에 있는 배아만 사용한다12. PGC 채취의 경우, 보통 20분 동안 약 40개의 기증자 배아를 정렬하고 초기 5단계에서 약 30개의 배아에서 PGC를 채취합니다. 더 오래되고 결함이 있는 배아는 사용되지 않습니다. 동결 보존 및 해동 후 PGC는 모양을 유지해야 합니다. PGC는 보존에 실패하여 파열됩니다. 숙주 배아도 5단계에 있어야 하며 적당한 내부 압력을 가져야 합니다. 배아는 부드럽게 찔러준 후 천천히 원래 모양으로 돌아와야 합니다. 과도하게 불충분하게 건조된 배아는 이식 후 정상적으로 발달하지 않습니다. PGC의 이성애 이식은 초파리 5,10에서 배우자를 생산하지 못하기 때문에 여러 기증자 배아에서 숙주 배아로 PGC를 이식하면 가임기 성인을 생산할 가능성이 더 높습니다. 이를 위해 일반적으로 바늘당 약 30개의 배아에서 PGC를 수집합니다.
동결 보호제로서 에틸렌 글리콜, 디메틸 설폭사이드, 글리세롤을 다양한 농도의 자당과 함께 사용해 보았습니다. 우리는 20 % 에틸렌 글리콜과 1 M 자당을 함유 한 EBR을 베스트13으로 결정했습니다. 그러나, 상이한 동결 보호제의 사용은 PGC 보존을 향상시킬 수있다 22.
이 동결 보존 방법은 PGC 취급에 대한 전문 기술이 필요하며, PGC를 편안하게 채취하고 이식하려면 약 6주간의 교육이 필요합니다. 기술 숙련도를 평가하고 향상시키기 위해 1) 유리 슬라이드에 배아 정렬, 2) 조작기 제어, 3) 동결 보존 없이 배아의 PGC를 다른 배아에 이식, 4) 10개 이상의 배아에서 5-10개의 배아에 PGC 이식, 5) CPA 적용 후 PGC 이식, 6) 동결-해동 후 PGC 이식의 6가지 교육 단계로 나눌 수 있습니다. 각 단계는 1주일이 소요될 수 있습니다. 3단계의 단기 목표는 부화율 40%, 배아에서 성체로의 생존력 10%-20%, 번식 가능 파리 빈도 20%입니다.
PGC 동결 보존에는 값비싼 기기와 고도로 숙련된 인력이 필요합니다. 따라서 이 방법은 많은 실험실에서 채택되지 않을 수 있습니다. 그러나 현재의 PGC 방법에는 몇 가지 중요한 측면이 있습니다. 첫째, PGC는 배아보다 훨씬 작으며 동결 보호제에 매우 잘 투과됩니다. 대조적으로, 동결 보호제 투과성은 배아 동결 보존에서 가장 심각한 문제인 초파리 배아의 왁스 층에 의해 심각하게 제한됩니다. 실제로, 이전 연구들은 배아가 높은 생존율과 더 얇은 왁스 층을 갖는 시간대를 찾기 위해 많은 노력을 기울였습니다. 두 번째는 균주 간의 발달 및 형태 학적 변화와 관련이 있습니다. PGC는 초기 5기 배아(산란 후 2시간 30분-3시간 20분)에서 채취하는 반면, 배아 동결보존은 16기 배아(산란 후 14-22시간)에서 수행됩니다. 따라서 배아는 훨씬 더 오래되었으며 PGC 동결 보존에 비해 동결 보존을 위한 최적의 시간 창에서 훨씬 더 큰 균주 변화를 보여줍니다. 실제로, 기증자 유래 자손을 생산하는 숙주의 빈도는 아사오카 등이 연구한 5가지 균주 사이에서 다르지 않았지만, 숙주는 무생식물이 아니었다. 더욱이, PGC는 게놈 편집(genome editing)과 같은 유전 공학 응용 분야에서 사용될 수 있는 잠재력을 가지고있다 14,15,16.
Acknowledgements
우리는 파리 균주에 대해 KYOTO Drosophila Stock Center에 감사드립니다. 또한 원고의 영문 편집에 대해 Ms. Wanda Miyata와 이 원고의 초안을 편집해 준 Edanz(https://jp.edanz.com/ac)의 Jeremy Allen 박사에게도 감사드립니다. 이 연구는 일본 의학 연구 개발기구(AMED)가 T.T.-S.-K.에 보조금(JP16km0210072, JP17km0210146, JP18km0210146)을, AMED에서 S.K.에 보조금(JP16km0210073, JP17km0210147, JP18km0210145)을, AMED에서 T.T.-S.-K.에 보조금(JP20km0210172)을 지원했습니다. 및 S.K., 일본 과학 진흥 협회 (JSPS)에서 T.T.-S.-K.에 대한 과학 연구 보조금 (C) (JP19K06780) 및 JSPS에서 S.K.에 대한 혁신 분야에 대한 과학 연구 보조금 (JP18H05552)
Materials
| Name | Company | Catalog Number | Comments |
| Acetic acid | FUJIFILM Wako Pure Chemical Corporation | 017-00256 | For embryo collection |
| Agar powder | FUJIFILM Wako Pure Chemical Corporation | 010-08725 | For embryo collection |
| Calcium chloride | FUJIFILM Wako Pure Chemical Corporation | 038-24985 | For EBR solution |
| Capillary | Sutter Instrument | B100-75-10-PT | BOROSILICATE GLASS; O.D: 1.0mm, I.D: 0.75mm , length: 10cm, 225Pcs |
| Capillary holder | Eppendorf | 5196 081.005 | Capillary holder 4; for micromanipulation |
| Chromic acid mixture | FUJIFILM Wako Pure Chemical Corporation | 037-05415 | For needle washing |
| CPA solution | 1x EBR containing 20% ethylene glycol and 1M sucrose | ||
| Double-sided tape | 3M | Scotch w-12 | For glue extracting |
| Ephrussi–Beadle Ringer solution (EBR) | 130 mM NaCl, 5 mM KCl, 2 mM CaCl2, and 10 mM Hepes at pH 6.9 | ||
| Ethanol (99.5) | FUJIFILM Wako Pure Chemical Corporation | 057-00451 | For embryo collection |
| Ethylene glycol | FUJIFILM Wako Pure Chemical Corporation | 054-00983 | For CPA solution |
| Falcon 50 mm x 9 mm bacteriological petri dish | Corning Inc. | 351006 | For embryo collection |
| Forceps | Vigor | Type5 Titan | For embryo handling |
| Grape juice | Asahi Soft Drinks Co., LTD. | Welch's Grape 100 | For embryo collection |
| Grape juice agar plate | 50% grape juice, 2% agar, 1% ethanol, 1% acetic acid | ||
| Heptane | FUJIFILM Wako Pure Chemical Corporation | 084-08105 | For glue extracting |
| Humidifier | APIX INTERNATIONAL CO., LTD. | FSWD2201-WH | For embryo preparation |
| Inverted microscope | Leica Microsystems GmbH | Leica DM IL LED | For micromanipulation |
| Luer-lock glass syringe | Tokyo Garasu Kikai Co., Ltd. | 0550 14 71 08 | Coat a plunger with silicon oil (FL-100-450CS);for micromanipulation |
| Mechanical micromanipulator | Leica Microsystems GmbH | For micromanipulation | |
| Micro slide glass | Matsunami Glass Ind., Ltd. | S-2441 | For embryo aligning |
| Microgrinder | NARISHIGE Group | Custom order | EG-401-S combined EG-401 and MF2 (with ocular lens MF2-LE15 ); for needle preparation |
| Microscope camera | Leica Microsystems GmbH | Leica MC170 HD | For micromanipulation |
| Needle holder | Merck KGaA | Eppendorf TransferTip (ES) | For cryopreservation |
| Potassium chloride | Nacalai Tesque, Inc. | 28514-75 | For EBR solution |
| Puller | NARISHIGE Group | PN-31 | For needle preparation; the heater level is set to 85.0-98.4, the magnet main level to 57.8, and the magnet sub level to 45.0. |
| PVC adhesive tape for electric insulation | Nitto Denko Corporation | J2515 | For embryo-pool frame |
| Silicon oil | Shin-Etsu Chemical, Co, Ltd. | FL-100-450CS | For embryo handling |
| Sodium chloride | Nacalai Tesque, Inc. | 31320-05 | For EBR solution |
| Sodium hypochlorite solution | FUJIFILM Wako Pure Chemical Corporation | 197-02206 | Undiluted and freshly prepared; for embryo breaching |
| Sucrose | Nacalai Tesque, Inc. | 30404-45 | For CPA solution |
References
- Brüschweiler, W., Gehring, W. A method for freezing living ovaries of Drosophila melanogaster larvae and its application to the storage of mutant stocks. Experientia. 29, 134-135 (1973).
- Steponkus, P. L., et al. Cryopreservation of Drosophila melanogaster embryos. Nature. 345, 170-172 (1990).
- Mazur, P., Cole, K. W., Hall, J. W., Schreuders, P. D., Mahowald, A. P. Cryobiological preservation of Drosophila embryos. Science. 258 (5090), 1932-1935 (1992).
- Zhan, L., Li, M. G., Hays, T., Bischof, J. Cryopreservation method for Drosophila melanogaster embryos. Nat Comm. 12, 2412 (2021).
- Van Deusen, E. B. Sex determination in germ line chimeras of Drosophila melanogaster. Development. 37 (1), 173-185 (1977).
- Breen, T. R., Duncan, I. M. Maternal expression of genes that regulate the bithorax complex of Drosophila melanogaster. Dev Biol. 118, 442-456 (1986).
- Schupbach, T., Wieschaus, E. Germline autonomy of maternal-effect mutations altering the embryonic body pattern of Drosophila. Dev Biol. 113, 443-448 (1986).
- Irish, V., Lehmann, R., Akam, M. The Drosophila posterior-group gene nanos functions by repressing hunchback activity. Nature. 338, 646-648 (1989).
- Hülskamp, M., Schröder, C., Pfeifle, C., Jäckle, H., Tautz, D. Posterior segmentation of the Drosophila embryo in the absence of a maternal posterior organizer gene. Nature. 338, 629-632 (1989).
- Steinmann-Zwicky, M., Schmid, H., Nöthiger, R. Cell-autonomous and inductive signals can determine the sex of the germ line of Drosophila by regulating the gene Sxl. Cell. 57 (1), 157-166 (1989).
- Stein, D., Roth, S., Vogelsang, E., Nüsslein-Volhard, C. The polarity of the dorsoventral axis in the drosophila embryo is defined by an extracellular signal. Cell. 65 (5), 725-735 (1991).
- Kobayashi, S., Yamada, M., Asaoka, M., Kitamura, T. Essential role of the posterior morphogen nanos for germline development in Drosophila. Nature. 380, 708-711 (1996).
- Asaoka, M., et al. Offspring production from cryopreserved primordial germ cells in Drosophila. Comm Biol. 4 (1), 1159 (2021).
- Blitz, I. L., Fish, M. B., Cho, K. W. Y. Leapfrogging: primordial germ cell transplantation permits recovery of CRISPR/Cas9-induced mutations in essential genes. Development. 143 (15), 2868-2875 (2016).
- Koslová, A., et al. Precise CRISPR/Cas9 editing of the NHE1 gene renders chickens resistant to the J subgroup of avian leukosis virus. Proc Natl Acad Sci U S A. 117 (4), 2108-2112 (2020).
- Zhang, F. Efficient generation of zebrafish maternal-zygotic mutants through transplantation of ectopically induced and Cas9/gRNA targeted primordial germ cells. J Genet Genom. 47 (1), 37-47 (2020).
- Campos-Ortega, J. A., Hartenstein, V. Stages of Drosophila Embryogenesis. The Embryonic Development of Drosophila. , (1997).
- Manning, A. A sperm factor affecting the receptivity of Drosophila melanogaster females. Nature. 194, 252-253 (1962).
- Kubli, E. Sex-peptides: seminal peptides of the Drosophila male. Cell Mol Life Sci. 60, 1689-1704 (2003).
- Lehmann, R., Nüsslein-Volhard, C. Abdominal segmentation, pole cell formation, and embryonic polarity require the localized activity of oskar, a maternal gene in drosophila. Cell. 47 (1), 141-152 (1986).
- Kiger, A. A., Gigliotti, S., Fuller, M. T. Developmental genetics of the essential Drosophila Nucleoporin nup154: allelic differences due to an outward-directed promoter in the P-element 3′ end. Genetics. 153 (2), 799-812 (1999).
- Rienzi, L. F., et al. Perspectives in gamete and embryo cryopreservation. Semin Reprod Med. 36 (5), 253-264 (2018).
Explore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved