Primordial cellkryokonservering och återupplivande av Drosophila-stammar
* These authors contributed equally
In This Article
Summary
En långsiktig konserveringsmetod för Drosophila-stammar som ett alternativ till den frekventa överföringen av vuxna flugor till färskfoderflaskor är mycket önskvärd. Detta protokoll beskriver kryokonservering av Drosophila primordiala könsceller och stamåterupplivning via deras transplantation till agametiska värdembryon.
Abstract
Drosophila-stammar måste upprätthållas genom frekvent överföring av vuxna flugor till nya injektionsflaskor. Detta medför en risk för mutationsförsämring och fenotypiska förändringar. Det är därför absolut nödvändigt att utveckla en alternativ metod för långtidsbevarande utan sådana förändringar. Trots tidigare framgångsrika försök är kryokonservering av Drosophila-embryon fortfarande inte till praktisk nytta på grund av låg reproducerbarhet. Här beskriver vi ett protokoll för kryokonservering av primordiala könsceller (PGC) och stamåterupplivning via transplantation av kryokonserverade PGC:er till agametiska Drosophila melanogaster (D. melanogaster) värdembryon. PGC:er är mycket permeabla för kryoprotektiva medel (CPA), och utvecklingsmässig och morfologisk variation mellan stammar är mindre problematisk än vid kryokonservering av embryon. I denna metod samlas PGC in från cirka 30 donatorembryon, laddas i en nål efter CPA-behandling och kryokonserveras sedan i flytande kväve. För att producera könsceller från donatorer tinas de kryokonserverade PGC:erna i en nål och deponeras sedan i cirka 15 agametiska värdembryon. En frekvens på minst 15 % fertila flugor uppnåddes med detta protokoll, och antalet avkommor per fertilt par var alltid mer än tillräckligt för att återuppliva den ursprungliga stammen (det genomsnittliga antalet avkommor var 77,2 ± 7,1), vilket indikerar förmågan hos kryokonserverade PGC:er att bli stamceller från könsceller. Det genomsnittliga antalet fertila flugor per nål var 1,1 ± 0,2, och 9 av 26 nålar producerade två eller fler fertila avkommor. Det visade sig att 11 nålar är tillräckligt för att producera 6 eller fler avkommor, i vilka minst en hona och en hane sannolikt ingår. Den agametiska värden gör det möjligt att snabbt återuppliva stammen genom att helt enkelt korsa nyuppkomna hon- och hanflugor. Dessutom har PGC potential att användas i gentekniska tillämpningar, såsom genredigering.
Introduction
Upprätthållandet av Drosophila-stammar genom överföring av vuxna flugor till nya matflaskor resulterar oundvikligen i ackumulering av mutationer och epigenetiska förändringar över tid. Det är absolut nödvändigt att utveckla en alternativ metod för långsiktigt underhåll av Drosophila-stammar utan sådana förändringar, särskilt för referensstammar där hela genomet måste bevaras. Flera lyckade försök att kryokonservera Drosophila-embryon eller äggstockar har beskrivits 1,2,3. Tyvärr är de fortfarande inte till praktisk nytta på grund av låg reproducerbarhet. Faktum är att embryon i tidiga stadier har en låg överlevnadsgrad efter kryokonservering på grund av deras höga innehåll av äggulor, vilket hindrar kryoskyddande medel (CPA) genomträngning och diffusion 2,3. CPA-permeabiliteten är också starkt begränsad av de vaxartade skikten hos embryon i sent stadium. Det är svårt och tidskrävande att hitta en stamspecifik tidsperiod där embryon har en hög överlevnadsgrad och ett tunnare vaxlager. Nyligen förbättrade Zhan et al.4 metoder för embryopermeabilisering, CPA-laddning och vitrifiering och kryokonserverade framgångsrikt embryon av flera stammar. Metoderna är dock inte lätta att tillämpa eftersom embryonas livsduglighet efter permeabilisering tenderar att vara dålig. Därför behövs det fortfarande ytterligare förbättringar och utveckling av alternativa metoder. Metoder som involverar kryokonservering av primordiala könsceller (PGC) är ett alternativt tillvägagångssätt för långsiktigt underhåll av Drosophila-stammar.
PGC-transplantation (även kallad polcellstransplantation) har använts för att generera könsceller, särskilt honor, för att studera processer som maternella effekter av zygotiska letala mutationer och könsbestämning av könsceller 5,6,7,8,9,10,11,12 . PGC är mycket mindre än embryon och är sannolikt mycket permeabla för de flesta kryoprotektiva medel. Dessutom är utvecklingsmässig och morfologisk variation mellan stammar mindre problematisk, och en agametisk värd möjliggör snabb restaurering av hela genom. Vi har nyligen utvecklat en ny metod för PGC-kryokonservering13, som förhindrar de annars oundvikliga genetiska och epigenetiska förändringarna i Drosophila-stammar. Här presenterar vi det detaljerade protokollet.
Denna kryokonserveringsmetod kräver specifik expertis inom PGC-hantering och instrumentering. Även om ett steg-för-steg-tillvägagångssätt kan vara en effektiv lösning för dem som inte är bekanta med det, kan det vara olämpligt för små laboratorier på grund av instrumentkrav. Detta PGC-kryokonserveringsprotokoll kan lättare anpassas för användning med olika Drosophila-arter och olika insektsarter än embryokryokonserveringsprotokoll på grund av mindre utvecklingsmässiga och morfologiska skillnader. PGC kan också potentiellt användas i gentekniska tillämpningar, såsom genomredigering 14,15,16. Sammanfattningsvis kan denna metod användas i beståndscentra och andra laboratorier för att upprätthålla flugor och andra insektsstammar under längre perioder utan förändringar.
Protocol
1. Förberedelse av utrustning
- Mikromanipulatorsystem: Montera ett mikromanipulatorsystem för att samla in och transplantera celler (Figur 1A).
- Glasskivor från PGC-samlingen (figur 2A)
- För att förbereda heptanlim, klipp av cirka 30 cm lång dubbelhäftande tejp och blötlägg den över natten i 7 ml teknisk (vanlig) heptanlösning.
- Rita två parallella referenslinjer för embryoanpassning på baksidan av ett glasglas.
- Sprid droppar av ovanstående heptanlim på glasglaset (på sidan utan linjerna) med hjälp av en Pasteur-pipett. Lufttorka ytan på objektglaset tills den blir vit.
- Upprepa tillsatsen och spridningen av heptanlimdroppar och torka objektglaset igen.
OBS: Limmet förhindrar att flytande lösningar sprids över den plana ytan och gör det lättare att ladda vattenlösningar i en nål. - För att göra embryopoolramar fäster du tre lager 0,2 mm tjock standardvinyltejp, t.ex. eltejp, på en skärbräda. Klipp tejpen i 1,5 cm breda rektanglar. Klipp sedan bort alla tre lagren tejp och lämna en ram på 2 till 3 mm.
OBS: En embryopoolram fästs efter att embryon har anpassats för att bilda en pool för embryon.
- Nålar för transplantation
OBS: Alla kommersiellt tillgängliga nålar vid tidpunkten för denna studie var för smala eller för breda för PGC-kryokonservering.- Gör en nål med hjälp av en glapillär och en avdragare. Vi använder en NARISHIGE PN-31-avdragare med värmenivån på 85.0-98.4, magnetens huvudnivå på 57.8 och magnetens undernivå på 45.0.
- För att tillverka en nål med en ungefärlig väggtjocklek på 1 μm och en spets på cirka 200 μm med en innerdiameter på 10–12 μm, polera nålspetsen i följande trestegsprocess (figur 3). Slipa först ner nålspetsen i en vinkel på 30° med en hastighet av 780 rpm tills spetsen har en innerdiameter på 10-12 μm. Detta första malningssteg tar cirka 1 timme.
OBS: För att undvika att nålspetsen går sönder, vrid först slipstenen och flytta sedan försiktigt ner nålen på slipstenen. - Rita en linje på toppen av nålen för att spåra önskad vinkel. Vrid nålen moturs i 90° och polera den igen med en hastighet av 180 rpm. Detta tar ca 5 min.
- Vrid nålen medurs 45° och polera den med en hastighet av 180 rpm i en sekund.
- Placera ett uppsamlingsglasglas med en droppe kromsyrablandning (VARNING: giftigt) på mikroskopetage. Fäst nålen på kapillärhållaren (Figur 1D) i en vinkel på 10°-13° i förhållande till objektglasytan, flytta försiktigt nålen nedåt och sänk ner spetsen i kromsyrablandningen.
- Genom att dra och trycka på kolven (Figur 1B), ladda och töm lösningen mekaniskt från nålen flera gånger för att avlägsna glasskräp i nålen. Var noga med att rengöra ytterväggen också.
- Tvätta insidan och utsidan av nålen två gånger med destillerat vatten för att ta bort kromsyran helt.
2. Insamling och kryokonservering av PGC
- Insamling av embryon
- Överför ett lämpligt antal flugor av donatorstammen av intresse (cirka 450 för varje kön för embryosamlingskoppen) till en embryosamlingskopp med en embryosamlingsplatta (figur 1E) och inkubera dem vid 25 °C. Vi använder vanligtvis 3 till 5 dagar gamla föräldraflugor som föds upp under mindre trånga förhållanden i rumstemperatur (23-25 °C).
- Utför två 30-minuters förinsamlingar och kassera alla ägg som lagts. Eftersom honor kan behålla befruktade ägg som utvecklas i äggledaren, krävs detta steg för att synkronisera äggläggningen i steg 2.1.3 (figur 4).
- Efter de två församlingarna samlas embryona in i 50 minuter och de inkuberas sedan i en fuktkammare vid 25 °C så att embryona kan utvecklas till blastodermstadiet (tidigt stadium 517). Inkubationstiden är vanligtvis 100 minuter men kan förlängas upp till 120 minuter, beroende på stammen (figur 4).
OBS: En fuktad kammare görs genom att placera en fuktig pappershandduk i botten av en plastlåda och spraya den med en vattendimma före användning. I tidiga stadie-5-embryon är PGC-bildningen fullständig, men somatisk cellularisering är det inte. Det exakta stadiet av ett embryo bestäms under ett sammansatt mikroskop i steg 2.4.
- Dekorionerande embryon
- Deponera en droppe destillerat vatten på en nätsil av rostfritt stål (150 mesh, 109 μm öppning, 60 μm tråddiameter; Figur 1F). Använd en pincett, samla embryon från embryouppsamlingsplattan och lägg dem i vattendroppen.
- Pressa silkespapper mot silen underifrån för att absorbera vattnet. Tillsätt droppar av färsk 5 % (som Cl) natriumhypokloritlösning till embryona och knacka kontinuerligt på silen i 10 sekunder.
- Tvätta embryona genom att direkt stänka dem med destillerat vatten och tryck silkespapper mot silen underifrån för att absorbera vattnet. Upprepa detta steg 3 gånger.
- Anpassning av dekorionerade embryon
- Använd en pincett under ett stereomikroskop för att överföra embryon. Rikta in de dekorionerade embryona i två rader på ett objektglas för PGC-uppsamling längs de två referenslinjerna (figur 2A). Embryona är orienterade med den främre till höger (den sida som ska manipuleras) och den ventrala sidan uppåt.
OBS: Detta steg bör vara klart på 20 minuter, under vilket vi vanligtvis anpassar cirka 40 embryon. - Fäst en embryopoolram runt embryona på PGC-samlingens glasglas. Droppa 1 μl CPA-lösning (1x Ephrussi-Beadle Ringer-lösning, EBR, innehållande 20 % etylenglykol och 1 M sackaros; 1x EBR: 130 mM NaCl, 5 mM KCl, 2 mM CaCl2 och 10 mM Hepes vid pH 6,9) på två separata ställen i det område som omges av ramen och fyll poolen med silikonolja för att förhindra att embryona torkar ut (figur 2A).
OBS: För att bereda CPA-lösningen, lös upp 10,26 g sackaros helt i cirka 20 ml destillerad H2O innehållande 3 ml 10 x EBR-lösning. Tillsätt 6 ml etylenglykol och tillsätt sedan destillerad H2O upp till 30 ml. Efter noggrann blandning, filtrera lösningen genom ett 0,22 mm engångsmembran.
- Använd en pincett under ett stereomikroskop för att överföra embryon. Rikta in de dekorionerade embryona i två rader på ett objektglas för PGC-uppsamling längs de två referenslinjerna (figur 2A). Embryona är orienterade med den främre till höger (den sida som ska manipuleras) och den ventrala sidan uppåt.
- Insamling av PGC:er
- Placera PGC-uppsamlingsglaset i steg 2.3.2 på stage av ett mikroskop utrustat med ett mikromanipulatorsystem. Fäst nålen på kapillärhållaren och för det första embryot i den vänstra raden och nålspetsen till samma fokalplan. Fyll på silikonolja i nålen i 2-3 s.
- Börja PGC-insamling från embryon i den vänstra raden. Använd en 20x objektivlins och flytta försiktigt nålspetsen till ytan av embryots främre ände och penetrera embryot mot den bakre änden, inte genom att flytta nålen utan genom att flytta mikroskopetage.
- När nålspetsen når den bakre änden, dra tillbaka nålen något och töm helt eventuell äggula i nålen precis innanför det somatiska celskiktet.
- Medan du håller trycket i nålen konstant, flytta nålspetsen till PGC:erna precis innanför den bakre polen och ladda PGC:erna försiktigt, men utan att ta mycket tid.
- Dra snabbt ut nålen ur embryot och töm ut äggula och andra föroreningar från nålen i silikonoljepoolen, håll PGC:erna i nålen. Ladda sedan ren silikonolja från poolen.
- Upprepa steg 2.4.2 till 2.4.5 för de andra embryona i den vänstra raden. Innan du samlar in PGC från ett nytt embryo, deponera så mycket av silikonoljan som laddades i steg 2.4.5 inuti det somatiska cellagret som möjligt samtidigt som du behåller laddade PGC i nålen. Detta säkerställer att nyladdade PGC:er ligger intill de tidigare insamlade PGC:erna utan något mellanliggande material mellan dem.
- Efter att ha avslutat PGC-insamlingen från embryon i den vänstra raden, separera PGC från äggulan och andra föroreningar så mycket som möjligt. För att uppnå detta, deponera alla PGC i nålen på ytan av ett embryo och ta bort eventuell äggula eller andra föroreningar till ett annat närliggande embryo.
- Samla sedan PGC från embryon i den högra raden. Kombinera PGC:erna som samlats in från höger och vänster rad.
- Applicering av kryoskyddande medel (CPA) på PGC
- Efter att ha tvättat nålen med CPA i en droppe, fyll på färsk CPA i ytterligare en droppe i nålen och tillsätt CPA till de PGC som deponerats på embryot. Volymen av CPA bör motsvara volymen för PGC.
- Ta bort så mycket CPA som möjligt från klustret av PGC 1-2 s efter tillsats av CPA. PGC:er krymper något och blir fyrkantiga i formen omedelbart efter CPA-tillsats.
- Töm nålen och fyll sedan på silikonolja i 5 s eller längre. Ladda alla uppsamlade PGC:er och fyll sedan på silikonolja igen i 5 s eller längre. PGC:er är nu inklämda mellan två lager silikonolja (figur 2B).
OBS: Det är viktigt att ta bort så mycket äggula, CPA och andra föroreningar som möjligt.
- Kryokonserverande PGC:er
- Öppna trevägskranen (Figur 1C) och lossa sedan nålen från mikromanipulatorn. Torka av oljan från nålens yta med mjuksilkespapper. Rör inte nålspetsen direkt med vävnaden.
- Fäst nålen på en nålhållare och lås den på plats vid basen med vinyltejp (Figur 1H). Fäst en etikett på hållarröret.
- Blixtfrys hållaren med nålen pekande nedåt genom att sänka ner den i flytande kväve. Släpp inte hållaren förrän vätskan slutar bubbla ut ur stället.
- Förvara hållaren i en förvaringstank för flytande kväve i området för vätskefas, inte i området för ångfas.
3. Upptining och omplantering av PGC:er
- Insamling, dekorionering och anpassning av embryon från agametiska värdflugor
- Samla in och dekorionera embryon från agametiska värdflugor enligt steg 2.
- Rikta in de agametiska värdembryona i steg 5 på ett glasglas för transplantation. Men den här gången, orientera den bakre till höger (den sida som ska manipuleras) och ventralt till toppen (Figur 5). Rada upp cirka 30 embryon i två rader på 20 minuter.
- När du riktar in embryon, använd en luftfuktare i 2-10 minuter om luftfuktigheten i rummet kräver det (tabell 1). Den idealiska luftfuktigheten är 30 % till 40 %, men detta kan variera beroende på termiska förhållanden.
- Upptining och transplantation av PGC i värdembryon
- För att snabbt tina kryokonserverade PGC:er, skjut in hållaren som innehåller nålen i rumstemperatur 1x EBR-lösning med nålen pekande nedåt och håll den nedsänkt i 10 s.
- Placera transplantationsglaset på mikroskopstadiet. Fäst den frystinade nålen på kapillärhållaren och för det första embryot i den vänstra raden och nålspetsen till samma fokalplan.
- Använd en 20x objektivlins och flytta försiktigt nålspetsen till ytan av den bakre änden av embryot.
- Stryk försiktigt på utsidan av varje embryo och se till att de långsamt återgår till sin ursprungliga form. Stötningen kommer att bekräfta att det inre trycket i embryot inte är för högt eller för lågt.
- Flytta försiktigt nålen och penetrera ett embryo från den bakre polen.
- Placera försiktigt cirka 10-20 PGC precis innanför den bakre polen, exakt mellan vitellinmembranet och embryots somatiska cellager. Undvik att deponera dem i det somatiska celskiktet. Om perivitellinvätskan läcker ut ur embryot, sug in den läckta vätskan i nålen och ta bort den.
- Dra ut nålen från embryot. Upprepa steg 3.2.5 och 3.2.6 för efterföljande embryon.
4. Inkubation av embryon och återställande av donatorstammar
- Ta bort alla embryon som inte får transplanterade PGC och inkubera de återstående embryona i en fuktad kammare (figur 1G) vid 25 °C.
- Vid 24 timmar eller mer efter transplantation och så snart som möjligt efter kläckning ska kläckta larver plockas upp och överföras till vanliga Drosophila-foderflaskor och inkuberas vid 25 °C.
- För att återuppliva stammen, korsa nyuppkomna honor och hanar (Figur 6).
OBS: Agametiska värdar gör det möjligt att återställa hela genomet på en gång utan att korsa sig till balanserar-kromosomstammar. Samexistensen av agametiska hanar i en injektionsflaska kommer inte att spela någon roll eftersom honor, även om de paras med dem, inte visar långsiktiga reaktioner efter parning, inklusive minskad mottaglighet för att reproducera18,19.
Representative Results
Effektiviteten av kryokonserverad PGC-transplantation har rapporterats av Asaoka et al.13 och anges i tabell 2 för transplantation av PGC:er kryokonserverade i 1 dag eller längre i flytande kväve. Kläckningsfrekvensen var 168/208 transplanterade embryon (80,8 %) och viabiliteten från embryo till vuxen var 87/208 (41,8 %). Frekvensen av fertila flugor var 28/87 (32,2 %). Denna frekvens skilde sig inte mellan PGC:er kryokonserverade i 8 till 30 dagar och för de kryokonserverade i 31-150 dagar (20/57 vs. 8/30, G' = 0,63, p >0,1, d.f. = 1). Det genomsnittliga antalet avkommor per par var 77,2 ± 7,1 (n = 18, 28-122), vilket indikerar förmågan hos kryokonserverade PGC:er att bli könsstamceller. Av de 26 nålarna gav 10 ingen fertil avkomma, 7 nålar gav 1 fertil avkomma, 7 nålar gav 2 fertila avkommor och 2 nålar gav 3 eller 4 fertila avkommor. Det genomsnittliga antalet fertila flugor per nål var 1,1 ± 0,2. Baserat på dessa data, med 95 % konfidens, räcker det med 11 nålar för att producera 6 eller fler avkommor, i vilka minst en hona och en hane sannolikt ingår.
I ovanstående experiment använde vi embryon som uttrycker ovo-A-mRNA i PGC (nanos>ovo-A, OvoA_OE embryon) som en agametisk värd. Av 669 F1-honor och 720 F1-hanar som producerats från transplanterade nanos>ovo-A-par, fanns det ingen rymling som härstammade från värd-PGC:erna. Flera oskar (osk) mutanter är också temperaturkänsliga agametiska20,21. Eftersom en osk-mutant med hög homozygot livskraft och den agametiska fenotypen inte längre är tillgänglig, återskapade vi osk[8] missense-mutanten20 genom CRISPR/Cas9-assisterad genomredigering. Dessa flugor var helt agametiska (0 rymlingar av 230 honor och 192 hanar) vid 25 °C, men ett fåtal rymlingar kom ut vid 23 °C (1 av 248 honor och 1 av 290 hanar). nanos>ovo-A rekommenderas därför som agametiska värdembryon. Både UASp-ovo-A och nanos-Gal4 lager13 kommer snart att finnas tillgängliga från KYOTO Drosophila Stock Center.

Figur 1: Utrustning som krävs. A) Ett mikromanipulatorsystem för insamling och transplantation av celler. i) inverterat mikroskop, ii) mekanisk mikromanipulator, iii) spruta, iv) kapillärhållare, v) trevägskran, vi) luftfuktare och vii) stereomikroskop. (B) En spruta. (C) En trevägskran och silikonrör förbinder en spruta och en kapillärhållare. D) En nål och en kapillärhållare är fästa vid en mikromanipulator. E) En embryosamlingskopp med en embryosamlingsplatta (6 cm i diameter, 7,7 cm hög). (F) En nätsil av rostfritt stål. G) En behållare som används som fuktkammare med glasglas. För att bibehålla luftfuktigheten, lägg vått papper på botten och stäng locket. H) En nålhållare med en nål för kryokonservering. (I) Ett förvaringsställ för kryokonservering och en låda med nålar. Klicka här för att se en större version av denna figur.
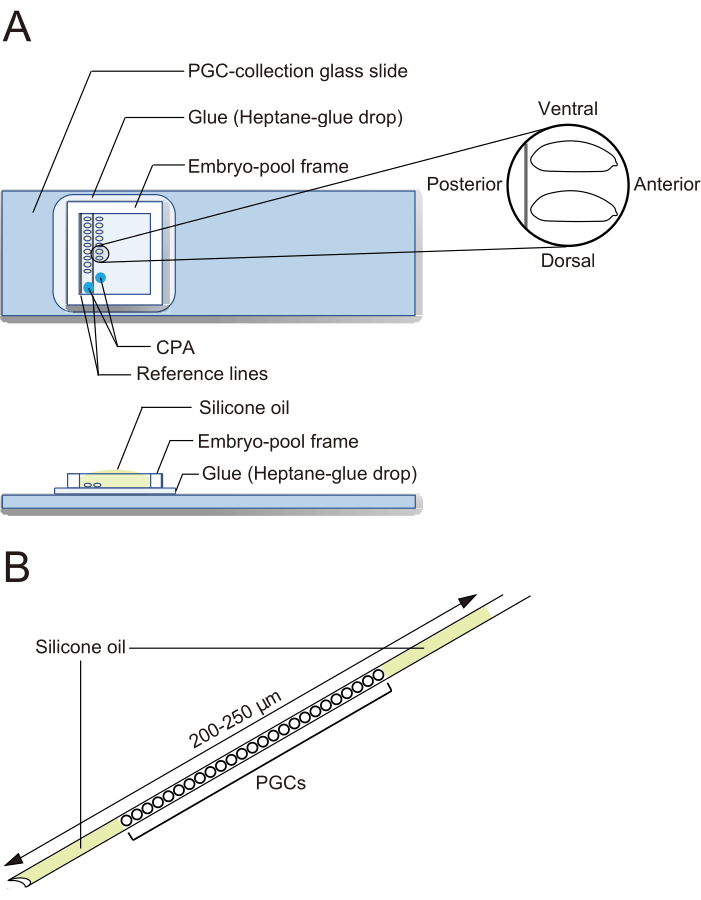
Figur 2: En glasskiva från PGC-samlingen och en nål för kryokonservering. A) Ett glasglas från urcellssamling (PGC) som är belagt med lim. Deforionerade embryon är uppställda i två rader och orienterade med sin främre till höger (den sida som ska manipuleras) och den ventrala sidan uppåt. En embryopoolram fästs, två droppar kryoprotektiv lösning (CPA) deponeras och poolen fylls med silikonolja. (B) En nål ska innehålla en så liten mängd äggula och andra föroreningar som möjligt. PGC:er är inklämda mellan två lager silikonolja när de kryokonserveras i flytande kväve. Klicka här för att se en större version av denna figur.
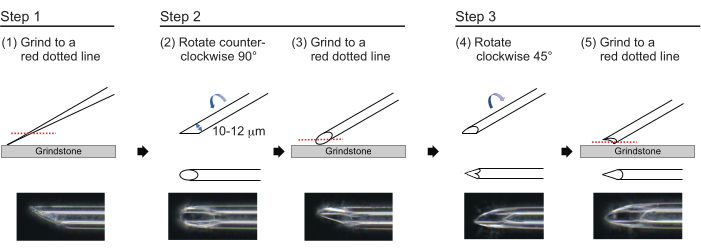
Figur 3: Tillverkning av nålen. Trestegs spetspoleringsmetod för att göra en nål med lämplig hålstorlek och en vass spets. Klicka här för att se en större version av denna figur.
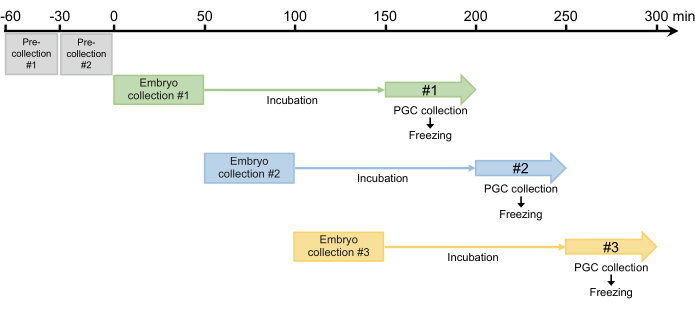
Figur 4: System för embryosamling. Efter två förinsamlingar brukar vi samla in tre eller fyra gånger per dag. Klicka här för att se en större version av denna figur.
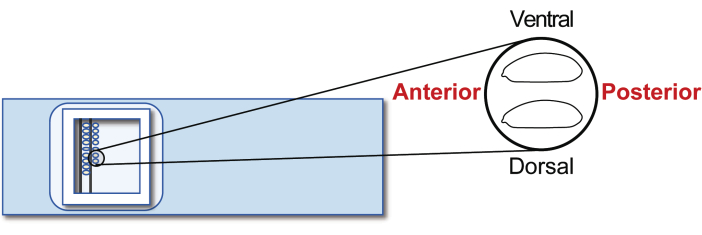
Figur 5: Värdembryots inriktning. Inriktning av värdembryon på ett glasglas. Klicka här för att se en större version av denna figur.
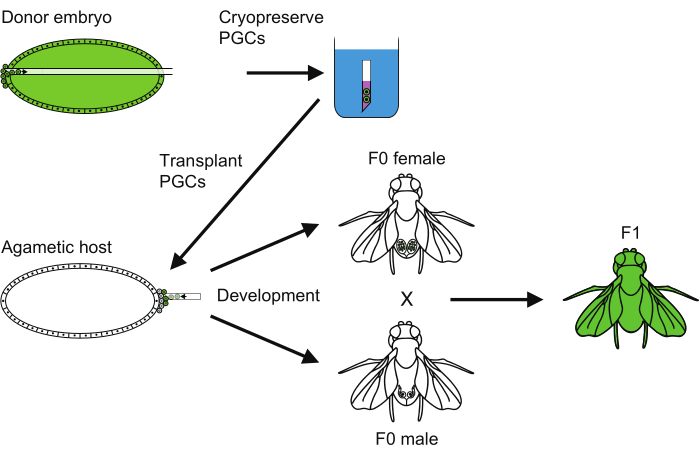
Figur 6: En översikt över PGC-kryokonserveringsmetoden. En översikt över alla steg som följs för att utföra kryokonservering av primordiala könsceller (PGC). Klicka här för att se en större version av denna figur.
| Luftfuktighet i rummet | |||
| < 30 % | ~ 30% | > 30 % | |
| Rikta in värdembryon (~20 minuter) | Använd en luftfuktare i 2 - 10 min | Använd en luftfuktare intermittent i 1 min | Använd inte en luftfuktare |
| PGC:er för upptining av donatorer | Ej tillämpligt | Ej tillämpligt | Ej tillämpligt |
| Lufttorka PGC:er | Utelämna det här steget | Utelämna det här steget | 5 minuter |
| Applicera silikonolja | Ej tillämpligt | Ej tillämpligt | Ej tillämpligt |
| PGC:er för transplantation | Ej tillämpligt | Ej tillämpligt | Ej tillämpligt |
| Alla dessa steg bör slutföras på 50 minuter. | |||
Tabell 1: Torkning av embryon under embryoinriktning och PGC-upptining.
| Donator stam | Kryokonserveringsperiod | Antal transplanterade embryon (A) | Antal kläckta larver (B) (kläckbarhet, B/A) | Antal vuxna som är instängda (C) (ägg-till-vuxen viabilitet, C/A) | Antal fertila vuxna (D) (frekvens av fertila flugor, D/C) |
| M17 | 8 - 30 dagar | 134 | 108 (80.6%) | 57 (42.5%) | 20 (35.1%) |
| M17 | 31 - 150 dagar | 74 | 60 (81.1%) | 30 (40.5%) | 8 (26.7%) |
| M17: yw; TM6B, P{Dfd-GMR-nvYFP}4, Sb[1] Tb[1] ca[1]/ Pri[1] | |||||
Tabell 2: Effektivitet av kryokonserverad PGC-transplantation. Denna tabell är ändrad från13. All data kommer från agametiska värdar.
Discussion
En kritisk faktor för framgång i PGC-kryokonservering och återupplivning är att använda bra embryon. Unga honor (t.ex. 3 till 5 dagar gamla) bör användas för embryoinsamling. Både donator- och värdembryon bedöms genom mikroskopisk inspektion, och endast de som befinner sig i blastodermstadiet (stadium 5) används12. För PGC-insamling anpassar vi vanligtvis cirka 40 donatorembryon under en 20-minutersperiod och samlar in PGC från cirka 30 embryon i ett tidigt skede 5; Äldre och defekta embryon används inte. Efter kryokonservering och upptining bör PGC:er behålla sin form; PGC:er brister vid misslyckad konservering. Värdembryon bör också befinna sig i stadium 5 och ha ett måttligt inre tryck. Embryon ska långsamt återgå till sin ursprungliga form efter försiktig petning. Alltför och otillräckligt torkade embryon utvecklas inte normalt efter transplantationen. Eftersom heterosexuell transplantation av PGC misslyckas med att producera könsceller i Drosophila 5,10, är det mer sannolikt att transplantation av PGC från flera donatorembryon till värdembryon ger fertila vuxna. För detta ändamål samlar vi vanligtvis in PGC från cirka 30 embryon per nål.
Som kryoprotektiva medel provade vi etylenglykol, dimetylsulfoxid och glycerol tillsammans med sackaros i olika koncentrationer. Vi bestämde att EBR som innehåller 20 % etylenglykol och 1 M sackaros var debästa 13; Användningen av olika kryoprotektorer kan dock förbättra PGC-konserveringen22.
Denna kryokonserveringsmetod kräver specialiserade färdigheter i PGC-hantering, och cirka 6 veckors utbildning behövs för att bekvämt samla in och transplantera PGC. För att bedöma och förbättra färdigheten kan detta delas upp i sex träningssteg: 1) rikta in embryon på ett glasglas, 2) kontrollera en manipulator, 3) transplantera PGC från ett embryo till ett annat embryo utan kryokonservering, 4) transplantera PGC från 10 eller fler embryon till 5 till 10 embryon, 5) transplantera PGC efter applicering av CPA och 6) transplantera PGC efter frysupptining. Varje steg kan ta 1 vecka. De kortsiktiga målen i steg 3 är en kläckningsgrad på 40 %, embryo-till-vuxen livsduglighet på 10-20 % och en frekvens av fertila flugor på 20 %.
PGC-kryokonservering kräver kostsam instrumentering och högkvalificerad personal. Därför kanske denna metod inte används av många laboratorier. Den nuvarande PGC-metoden har dock flera viktiga aspekter. För det första är PGC mycket mindre än embryon och är mycket permeabla för kryoprotektiva medel. Däremot är kryoprotektiv permeabilitet starkt begränsad av de vaxartade skikten hos Drosophila-embryon, vilket är det allvarligaste problemet vid kryokonservering av embryon. Tidigare studier har gjort stora ansträngningar för att hitta ett tidsfönster där embryon har en hög överlevnadsgrad och ett tunnare vaxlager. Den andra handlar om utvecklingsmässig och morfologisk variation mellan stammar. PGC samlas in från embryon i tidigt stadium 5 (2 timmar 30 min-3 timmar 20 minuter efter äggläggning), medan kryokonservering av embryon utförs på embryon i stadium 16 (14-22 timmar efter äggläggning). Embryona är därför mycket äldre och uppvisar mycket större stamvariation i det optimala tidsfönstret för kryokonservering jämfört med PGC-kryokonservering. Faktum är att frekvensen av värdar som producerade donatorhärstamning inte varierade mellan fem stammar som studerades av Asaoka et al.13, även om värdarna inte var agametiska. Dessutom har PGC potential att användas i gentekniska tillämpningar, såsom genomredigering 14,15,16.
Acknowledgements
Vi tackar KYOTO Drosophila Stock Center för flugstammar. Vi tackar också Wanda Miyata för engelskspråkig redigering av manuskriptet och Dr. Jeremy Allen från Edanz (https://jp.edanz.com/ac) för redigering av ett utkast av detta manuskript. Detta arbete stöddes av anslag (JP16km0210072, JP17km0210146, JP18km0210146) från Japan Agency for Medical Research and Development (AMED) till T.T.-S.-K., anslag (JP16km0210073, JP17km0210147, JP18km0210145) från AMED till S.K., ett bidrag (JP20km0210172) från AMED till T.T.-S.-K. och S.K., ett bidrag till stöd för vetenskaplig forskning (C) (JP19K06780) från Japan Society for the Promotion of Science (JSPS) till T.T.-S.-K., och ett bidrag till stöd för vetenskaplig forskning inom innovativa områden (JP18H05552) från JSPS till S.K.
Materials
| Name | Company | Catalog Number | Comments |
| Acetic acid | FUJIFILM Wako Pure Chemical Corporation | 017-00256 | For embryo collection |
| Agar powder | FUJIFILM Wako Pure Chemical Corporation | 010-08725 | For embryo collection |
| Calcium chloride | FUJIFILM Wako Pure Chemical Corporation | 038-24985 | For EBR solution |
| Capillary | Sutter Instrument | B100-75-10-PT | BOROSILICATE GLASS; O.D: 1.0mm, I.D: 0.75mm , length: 10cm, 225Pcs |
| Capillary holder | Eppendorf | 5196 081.005 | Capillary holder 4; for micromanipulation |
| Chromic acid mixture | FUJIFILM Wako Pure Chemical Corporation | 037-05415 | For needle washing |
| CPA solution | 1x EBR containing 20% ethylene glycol and 1M sucrose | ||
| Double-sided tape | 3M | Scotch w-12 | For glue extracting |
| Ephrussi–Beadle Ringer solution (EBR) | 130 mM NaCl, 5 mM KCl, 2 mM CaCl2, and 10 mM Hepes at pH 6.9 | ||
| Ethanol (99.5) | FUJIFILM Wako Pure Chemical Corporation | 057-00451 | For embryo collection |
| Ethylene glycol | FUJIFILM Wako Pure Chemical Corporation | 054-00983 | For CPA solution |
| Falcon 50 mm x 9 mm bacteriological petri dish | Corning Inc. | 351006 | For embryo collection |
| Forceps | Vigor | Type5 Titan | For embryo handling |
| Grape juice | Asahi Soft Drinks Co., LTD. | Welch's Grape 100 | For embryo collection |
| Grape juice agar plate | 50% grape juice, 2% agar, 1% ethanol, 1% acetic acid | ||
| Heptane | FUJIFILM Wako Pure Chemical Corporation | 084-08105 | For glue extracting |
| Humidifier | APIX INTERNATIONAL CO., LTD. | FSWD2201-WH | For embryo preparation |
| Inverted microscope | Leica Microsystems GmbH | Leica DM IL LED | For micromanipulation |
| Luer-lock glass syringe | Tokyo Garasu Kikai Co., Ltd. | 0550 14 71 08 | Coat a plunger with silicon oil (FL-100-450CS);for micromanipulation |
| Mechanical micromanipulator | Leica Microsystems GmbH | For micromanipulation | |
| Micro slide glass | Matsunami Glass Ind., Ltd. | S-2441 | For embryo aligning |
| Microgrinder | NARISHIGE Group | Custom order | EG-401-S combined EG-401 and MF2 (with ocular lens MF2-LE15 ); for needle preparation |
| Microscope camera | Leica Microsystems GmbH | Leica MC170 HD | For micromanipulation |
| Needle holder | Merck KGaA | Eppendorf TransferTip (ES) | For cryopreservation |
| Potassium chloride | Nacalai Tesque, Inc. | 28514-75 | For EBR solution |
| Puller | NARISHIGE Group | PN-31 | For needle preparation; the heater level is set to 85.0-98.4, the magnet main level to 57.8, and the magnet sub level to 45.0. |
| PVC adhesive tape for electric insulation | Nitto Denko Corporation | J2515 | For embryo-pool frame |
| Silicon oil | Shin-Etsu Chemical, Co, Ltd. | FL-100-450CS | For embryo handling |
| Sodium chloride | Nacalai Tesque, Inc. | 31320-05 | For EBR solution |
| Sodium hypochlorite solution | FUJIFILM Wako Pure Chemical Corporation | 197-02206 | Undiluted and freshly prepared; for embryo breaching |
| Sucrose | Nacalai Tesque, Inc. | 30404-45 | For CPA solution |
References
- Brüschweiler, W., Gehring, W. A method for freezing living ovaries of Drosophila melanogaster larvae and its application to the storage of mutant stocks. Experientia. 29, 134-135 (1973).
- Steponkus, P. L., et al. Cryopreservation of Drosophila melanogaster embryos. Nature. 345, 170-172 (1990).
- Mazur, P., Cole, K. W., Hall, J. W., Schreuders, P. D., Mahowald, A. P. Cryobiological preservation of Drosophila embryos. Science. 258 (5090), 1932-1935 (1992).
- Zhan, L., Li, M. G., Hays, T., Bischof, J. Cryopreservation method for Drosophila melanogaster embryos. Nat Comm. 12, 2412 (2021).
- Van Deusen, E. B. Sex determination in germ line chimeras of Drosophila melanogaster. Development. 37 (1), 173-185 (1977).
- Breen, T. R., Duncan, I. M. Maternal expression of genes that regulate the bithorax complex of Drosophila melanogaster. Dev Biol. 118, 442-456 (1986).
- Schupbach, T., Wieschaus, E. Germline autonomy of maternal-effect mutations altering the embryonic body pattern of Drosophila. Dev Biol. 113, 443-448 (1986).
- Irish, V., Lehmann, R., Akam, M. The Drosophila posterior-group gene nanos functions by repressing hunchback activity. Nature. 338, 646-648 (1989).
- Hülskamp, M., Schröder, C., Pfeifle, C., Jäckle, H., Tautz, D. Posterior segmentation of the Drosophila embryo in the absence of a maternal posterior organizer gene. Nature. 338, 629-632 (1989).
- Steinmann-Zwicky, M., Schmid, H., Nöthiger, R. Cell-autonomous and inductive signals can determine the sex of the germ line of Drosophila by regulating the gene Sxl. Cell. 57 (1), 157-166 (1989).
- Stein, D., Roth, S., Vogelsang, E., Nüsslein-Volhard, C. The polarity of the dorsoventral axis in the drosophila embryo is defined by an extracellular signal. Cell. 65 (5), 725-735 (1991).
- Kobayashi, S., Yamada, M., Asaoka, M., Kitamura, T. Essential role of the posterior morphogen nanos for germline development in Drosophila. Nature. 380, 708-711 (1996).
- Asaoka, M., et al. Offspring production from cryopreserved primordial germ cells in Drosophila. Comm Biol. 4 (1), 1159 (2021).
- Blitz, I. L., Fish, M. B., Cho, K. W. Y. Leapfrogging: primordial germ cell transplantation permits recovery of CRISPR/Cas9-induced mutations in essential genes. Development. 143 (15), 2868-2875 (2016).
- Koslová, A., et al. Precise CRISPR/Cas9 editing of the NHE1 gene renders chickens resistant to the J subgroup of avian leukosis virus. Proc Natl Acad Sci U S A. 117 (4), 2108-2112 (2020).
- Zhang, F. Efficient generation of zebrafish maternal-zygotic mutants through transplantation of ectopically induced and Cas9/gRNA targeted primordial germ cells. J Genet Genom. 47 (1), 37-47 (2020).
- Campos-Ortega, J. A., Hartenstein, V. Stages of Drosophila Embryogenesis. The Embryonic Development of Drosophila. , (1997).
- Manning, A. A sperm factor affecting the receptivity of Drosophila melanogaster females. Nature. 194, 252-253 (1962).
- Kubli, E. Sex-peptides: seminal peptides of the Drosophila male. Cell Mol Life Sci. 60, 1689-1704 (2003).
- Lehmann, R., Nüsslein-Volhard, C. Abdominal segmentation, pole cell formation, and embryonic polarity require the localized activity of oskar, a maternal gene in drosophila. Cell. 47 (1), 141-152 (1986).
- Kiger, A. A., Gigliotti, S., Fuller, M. T. Developmental genetics of the essential Drosophila Nucleoporin nup154: allelic differences due to an outward-directed promoter in the P-element 3′ end. Genetics. 153 (2), 799-812 (1999).
- Rienzi, L. F., et al. Perspectives in gamete and embryo cryopreservation. Semin Reprod Med. 36 (5), 253-264 (2018).
Explore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved