אקס ויוו תרבית של תאי גידול במחזור הדם בנוזל השדרה המוחי מחולי מלנומה לחקר מחלת לפטומנינגה הקשורה למלנומה
In This Article
Summary
מאמר זה מתאר פרוטוקול להתפשטות תאי גידול במחזור נוזל המוח בעמוד השדרה (CSF-CTCs) שנאסף מחולים עם מחלת לפטומנינגיאלית הקשורה למלנומה (M-LMD) כדי לפתח מודלים פרה-קליניים לחקר M-LMD.
Abstract
מחלת לפטומנינגיאלית הקשורה למלנומה (M-LMD) מתרחשת כאשר תאי גידול במחזור הדם (CTCs) נכנסים לנוזל השדרה המוחי (CSF) ומאכלסים את קרומי המוח, שכבות הממברנה המגנות על המוח וחוט השדרה. לאחר שנקבע, הפרוגנוזה עבור חולי M-LMD היא עגומה, עם הישרדות כוללת הנעה בין שבועות לחודשים. זה נובע בעיקר ממיעוט בהבנה שלנו את המחלה, וכתוצאה מכך, את הזמינות של אפשרויות טיפול יעילות. הגדרת הביולוגיה הבסיסית של M-LMD תשפר באופן משמעותי את היכולת להתאים טיפולים זמינים לטיפול ב- M-LMD או לתכנן מעכבים חדשניים למחלה קטלנית אוניברסלית זו. מחסום עיקרי, עם זאת, טמון בהשגת כמויות מספיקות של CTCs מה- CSF הנגזר מהמטופל CSF (CSF-CTCs) לביצוע ניסויים פרה-קליניים, כגון אפיון מולקולרי, אנליזה פונקציונלית ומחקרי יעילות in vivo . טיפוח CSF-CTCs ex vivo הוכיח גם הוא את עצמו כמאתגר. כדי להתמודד עם זה, פותח פרוטוקול חדשני לתרבות של M-LMD CSF-CTCs ex vivo ו - in vivo הנגזרים מהמטופל. שילוב של מדיה מותנית המיוצרת על ידי תאי קרום המוח האנושיים (HMCs) נמצא קריטי להליך. ניתוח מערך ציטוקינים מגלה כי גורמים המיוצרים על ידי HMCs, כגון חלבונים קושרי גורמי גדילה דמויי אינסולין (IGFBPs) וגורם גדילה אנדותל כלי דם A (VEGF-A), חשובים לתמיכה בהישרדות CSF-CTC ex vivo. כאן, התועלת של קווי CSF-CTC שבודדו שמקורם במטופל מודגמת בקביעת היעילות של מעכבים המכוונים למסלולי האיתות של גורם גדילה דמוי אינסולין (IGF) וחלבון קינאז המופעל על ידי מיטוגן (MAPK). בנוסף, מוצגת היכולת לחסן תאים אלה in vivo באופן תוך-תתי כדי ליצור מודלים מורינים של M-LMD שניתן להשתמש בהם לבדיקות פרה-קליניות של טיפולים מאושרים או חדשניים. כלים אלה יכולים לעזור לפענח את הביולוגיה הבסיסית המניעה את התבססות CSF-CTC בקרומי המוח ולזהות טיפולים חדשניים להפחתת התחלואה והתמותה הקשורים ל- M-LMD.
Introduction
מחלת Leptomeningeal (LMD) מתרחשת כאשר תאי גידול במחזור הדם (CTCs) מפיצים לתוך נוזל השדרה המוחי (CSF) ולהקים בקרומי המוח, את הקרום המקיף את המוח ואת חוט השדרה 1,2. LMD יכול להתרחש במספר סוגי סרטן אך שכיח במיוחד במלנומה. בשלבים מתקדמים של מלנומה, כ-5% מהחולים יפתחו M-LMD 2,3 הקשור למלנומה. בעוד נמוך יחסית ביחס לאתרים אחרים של גרורות, ההשלכות של M-LMD הן הרסניות, עם הישרדות כוללת הנעה בין שבועות לחודשים, והוא תורם משמעותי לתחלואה של חולים 1,3,4. הסיבה העיקרית לכך היא מיעוט אפשרויות טיפול יעילות בשילוב עם פערים גדולים בידע שלנו לגבי האופן שבו הלפטומנינגים מאוכלסים על ידי תאי מלנומה2. לכן, הבנת הביולוגיה של M-LMD תקל על תכנון טיפולים חדשניים לשיפור התוצאות הקליניות.
דיווחים אחרונים הראו כיצד CTCs מאכלסים את המיקרו-סביבה הייחודית של CSF. לדוגמה, משלים C3 מקדם פלישה של תאי גידול לתוך CSF דרך מקלעת כורואידים, רשת מורכבת של כלי דם בכל חדר במוח5. יתר על כן, בתגובה למיקרונוטריאנטים הנדירים ב- CSF, CTCs יכולים לווסת את ליפוקלין-2, חלבון המנטרל ברזל, ואת SLC22A17 הקולטן שלו כדי לשפר את הישרדותו6. באמצעות ניתוחים מבוססי omic של CSF, הקבוצה שלנו מצאה גם כי CSF מועשר בחלבונים המווסתים איתות גורם גדילה דמוי אינסולין (IGF), כמו גם חסינות מולדת3. יחד, נתונים אלה מדגישים את הערך של CSF-CTCs מביופסיות נוזליות לחקר M-LMD.
בעוד שלעיתים ניתן לזהות CSF-CTCs על ידי דגימת CSF של המטופל באמצעות ניקור מותני, מאגר אומאיה או נתיחות מהירות, מגבלה עיקרית היא השגת מספר מספיק של תאים נדירים ושבריריים אלה 1,7. לדוגמה, באמצעות טכניקת ספירת CTC, רק כמה מאות עד כמה אלפי תאים סרטניים ניתנים לזיהוי לכל דגימת CSF7 של המטופל, מה שמקשה על ביצוע ניתוחים מולקולריים ופונקציונליים במבחנה או in vivo. למרות שהיו דיווחים על הצלחה בגידול קצר של CTCs ex vivo מדם היקפי (כלומר, CTCs סרטן השד)8,9,10, תאים אלה בדרך כלל גדלים רק לטווח קצר, ולא דווח על מקרים של יכולת לגדל CTCs מלנומה ב- CSF. לפיכך, מציאת דרכים להפיץ מלנומה CSF-CTCs, או CTCs באופן כללי, יהיה מועיל מאוד לחקור את הביולוגיה של M-LMD 7,11.
לראשונה מתוארת טכניקה חדשנית להפצת CSF-CTCs מחולי M-LMD ex vivo. כאן בדו"ח זה, פותח פרוטוקול מפורט המאפשר תרבית והרחבה של CSF-CTCs מחולי M-LMD. מכיוון שקרומי המוח מפרישים מגוון גורמי גדילה כגון FGF, IGF, VEGF-A ו- IGFBPs התומכים בצמיחה סביב סביבתו 12,13,14,15,16, הוסבר כי CSF-CTCs עשויים לדרוש מרכיבים אלה לגדול בתנאי ex vivo. לכן, פרוטוקול זה משתמש במדיה מותנית הנוצרת על ידי גידול תאי קרום המוח האנושיים (HMCs-) במבחנה. עבור חיסון in vivo, תאים שמקורם בחולה מחוסנים לעכברים מדוכאי חיסון כדי ליצור קווי CSF-CTCs (PD-CSF-CTCs) שמקורם בחולה. הזמינות של תאי M-LMD שמקורם במטופל תתמוך בבדיקות תאיות, מולקולריות ותפקודיות כדי לחקור M-LMD ולהציע אסטרטגיות טיפול חדשניות למחלה קטלנית זו.
Protocol
איסוף דגימות CSF של מטופלים לא מזוהים אושר על ידי מועצת הביקורת המוסדית של אוניברסיטת דרום פלורידה (IRB) (MCC 50103, 50172 ו-19332). חולים עם M-LMD עשויים להיות מאובחנים במספר דרכים, כולל ציטולוגיה CSF חיובית, דימות תהודה מגנטית אופייני (MRI) של המוח ו / או עמוד השדרה, או שילוב של ממצאים קליניים עם ממצאי MRI סוגסטיביים. CSF מחולי M-LMD אלה נאספו באופן שגרתי כחלק מהטיפול הקליני הסטנדרטי שלהם. לא מבוצע הליך אלא אם כן יש התוויה קלינית. התקבלה הסכמה מדעת של המטופלים לאיסוף דגימות ולשימוש בהן למחקר ולפרסום. הדור של מודלים in vivo murine-LMD אושר על ידי אוניברסיטת דרום פלורידה מוסדי טיפול ושימוש בבעלי חיים הוועדה (IACUC # IS00010398). התוכנית הכוללת של פרוטוקול זה מסוכמת באיור 1. פרטי הריאגנטים והציוד ששימשו במחקר מפורטים בטבלת החומרים.
1. הכנת מדיה מותנית HMC
- צפו מראש בקבוק T175 בפולי-ל-ליזין ב-2 מק"ג/ס"מ2.
- מניחים את הבקבוק באינקובטור של 37 מעלות צלזיוס למשך שעה אחת.
- שאפו את תמיסת הפולי-ל-ליזין באמצעות פיפטה סרולוגית סטרילית. הוא אינו נדרש לשטוף את הצלוחית, והוא מוכן לתרבות HMC.
- תרבית כ 1.0 x 106 HMCs ב 30 מ"ל של מדיום תרבית קרום המוח המלאה (MenCM), המכיל 5% נסיוב בקר עוברי, 1% תוספת צמיחת תאי קרום המוח, ו 100 IU / mL פניצילין-סטרפטומיצין תמיסת אנטיביוטיקה לכל בקבוק. תרבית התאים באינקובטור תרבית התאים בתנאי תרבית רקמה סטנדרטיים בטמפרטורה של 37°C ו-5% CO2.
- החליפו מדיה כל 3 ימים.
- כאשר התאים מגיעים למפגש של 75%-80%, יש לאסוף ולשמור את המדיה המתורבת של HMC בצינור חרוטי של 50 מ"ל.
- פצל את HMCs לצלוחיות T175 חדשות ו-MenCM שלם ורענן אם יש צורך במדיה מתורבתת נוספת של HMC.
- למדיה התרבותית של HMC, הוסף יחס של 1:1 של MenCM שלם.
- הוסף 20 ng/mL פיברובלסט גורם גדילה (FGF), ו 20 ng/mL גורם גדילה אפידרמיס (EGF), אשר יהפוך מדיה מותנית HMC עבור CSF-CTCs.
הערה: מומלץ להוסיף FGF ו-EGF טריים כאשר CTCs מוכנים לתרבית. - אחסן מדיה ממוזגת HMC ב 50 מ"ל aliquots ב 4 ° C.
הערה: מומלץ לאחסן מדיה מותנית HMC ב aliquots ב 4 ° C אבל לא יותר מ 4 שבועות.
2. איסוף CSF ועיבוד דגימות
- Prechill צנטריפוגה על ידי הגדרתו ל 4 °C (75 °F).
- לאחר שנלקח מהמטופל, הניחו את דגימת CSF בצינור חרוטי של 15 מ"ל על קרח באופן מיידי כדי לשמור על קרירותו.
הערה: פרוטוקול IRB המאושר שלנו מאפשר ציור CSF של 7.5 מ"ל מהמטופל המוסכם. - צנטריפוגה CSF ב 257 x גרם במשך 5 דקות ב 4 ° C.
- הסר, שמור, ולעשות aliquots של supernatant CSF מבלי להפריע את גלולת התא בתחתית. ניתן לאחסן Aliquots סופרנאטנט CSF בטמפרטורה של -80°C במידת הצורך לצורך ניתוח נוסף.
הערה: ייתכן שהגלולה לא תהיה גלויה לעין בלתי; לפיכך, מומלץ להשאיר ~ 40-50 μL בתחתית הצינור. - באותו צינור, הוסף 1 מ"ל של מלח סטרילי חוצץ פוספט (PBS) כדי להשהות ולשטוף תאים, וחזור על הספין ב 257 x גרם במשך 5 דקות ב 4 ° C.
הערה: (אופציונלי) בצע ליזה של תאי דם אדומים (RBC) אם הדגימה מכילה זיהום דם. עם זאת, יש לזכור כי תאים מסוימים עלולים ללכת לאיבוד במהלך התהליך, כולל CTCs. CTCs יכולים להיות מופצים ללא הליך ליזה RBC. - הסר והשלך PBS מבלי להפריע לכדורית התא, והשאר ~ 50 μL בתחתית.
- בצע ספירת תאים כדי לקבוע את כדאיות התא. מכאן, ישנן שתי אפשרויות להמשיך עם גידול CSF-CTCs: תרבית חוץ גופית (שלב 3) או ניסיון in vivo הנגזר ממטופל xenograft הרחבה (שלב 4).
הערה: אם CSF-CTCs רוצים להיות בתרבית במועד מאוחר יותר, cryoלשמר את התאים בתרבית תאים להקפיא מדיה עד שהוא מוכן להתפשטות. ניתן לבצע הקפאת תרבית תאים באמצעות 90% FBS + 10% DMSO. אם עודף CSF זמין (כלומר, יותר מאוסף CSF אחד מחולים או CSF נאסף בנתיחה שלאחר המוות), CTCs ניתן להעריך על ידי שליחת הדגימה עבור בדיקת ספירת CTC17, או צביעת immunofluorescence (IF) עבור סמן מלנומה (כלומר, anti-MLANA) אשר עשוי לספק תובנות על כמות וכדאיות של CTCs. תאים לא ניתן לשחזר לאחר ביצוע ניסויים אלה. לכן, לא מומלץ אם אין דגימות CSF גיבוי מהמטופל.
3. תרבות חוץ גופית והרחבת CSF-CTCs
- השהה מחדש CSF-CTCs במדיה מותנית HMC. אם CSF-CTCs נשמרים בהקפאה, הפשירו את התאים, סובבו אותם ושטפו אותם בעדינות עם PBS.
- לפצל את כל התאים בבארות משולשות בצלחת של 96 בארות עם נפח של 150 μL לכל באר. רק תאים בני קיימא יידבקו קלות לפני השטח במהלך הלילה.
הערה: המספרים של CSF-CTCs יכולים להשתנות במידה רבה לכל דגימה של מטופל בודד (טבלה 1). עבור חולים עם ספירת CTC נמוכה, צלחת 96 בארות משמשת כנקודת מוצא לתרבית, והגלולה כולה מצופה ללא ספירה מחשש לאבד CTCs. עם זאת, אם יש כמות גדולה יותר של CSF (כלומר, מתקבל מנתיחה שלאחר המוות), ניתן לספור את התאים. לא כל תאי הגידול יכולים לגדול ex vivo; חלקם יתרחבו לאט במשך כמה מעברים לפני שהם הופכים סטטיים. נכון לעכשיו, הסיכוי להצלחה של גידול מלנומה CSF-CTCs ex vivo הוא כ 60%7. - עבור כל 3 ימים, יש למלא על ידי הוספת מדיה ממוזגת HMC טרייה או להסיר בעדינות את המדיה על ידי הנחת קצה פיפטה בצד הבאר, להשאיר קצת נוזל מאחור מבלי להפריע לתחתית הבאר, ולאחר מכן להחליף אותו עם מדיה ממוזגת HMC טרי.
- כאשר CSF-CTCs ex vivo מתרחבים והופכים ל-90% מתמזגים, טריפסינים ומעבירים את כל הבאר לבאר חדשה בצלחת של 24 בארות. כאשר הבאר בבאר 24 מתמזגת, מעבירים אותה לצלחת של 12 בארות, ואז לצלחת של 6 בארות וכן הלאה.
הערה: לאחר טריפסיניזציה, שקול שימור בהקפאה של תת-קבוצה קטנה של CTCs במדיית הקפאת תרבית תאים (10% DMSO + 90% FBS) לפני ציפוי כגיבוי. - המשך לטפח CTCs. תאים מסוימים עשויים להתפשט לטווח קצר ובסופו של דבר להיות סטטיים. אולם שיבוט אחד או יותר עשויים להשתנות ולהתרחב באופן מעריכי (איור 2A). בחר שיבוטים אלה, אשר יהפכו לתרבויות CSF-CTC (PD-CSF-CTCs) הנגזרים ממטופל במבחנה.
הערה: אם שיבוטים אלה נעשים צפופים מדי או מתקבצים, טריפסין ולוחית מחדש את התאים בצלוחית/בקבוק תרבית רקמה טרייה.
4. חיסון In vivo של CSF-CTCs ליצירת מודל xenograft נגזר קו תאים (CDX) או xenograft נגזר המטופל (PDX)
הערה: מודל PDX כולל קליטה של תאים סרטניים ישירות מחולה סרטן (ללא תרבית ex vivo ), בעוד שמודל CDX משתמש בקווי תאים סרטניים או, במקרה זה, CTCs שהופצו והונצחו18.
- השתמש 6-8 שבועות נקבות עכברים NOD SCID גמא (NSG) עבור חיסון CSF-CTCs. NSGs משמשים מכיוון שהם מדוכאי חיסון חמורים ופתוחים מאוד לקליטת תאי גידול אנושיים19. בשל הליקויים החיסוניים שלהם, עכברים אלה צריכים להישמר בסביבה היגיינית מבוקרת בקפידה ויש לאחסן אותם בבידוד מזני עכברים אחרים. השיטה לעיבוד murine-LMD תוארה בפירוט במקום אחר20.
הערה: תאי ex vivo (CSF-CTCs של מטופלים שעובדו רק בשלב 2 ללא תרבית) משמשים ליצירת מודל PDX; יש צורך בתצפית פיזית על החיה וב-MRI של המוח כדי לקבוע את התקדמות ה-LMD. מצד שני, עם מודל CDX באמצעות מבחנה, PD-CSF-CTCs ניתן לתייג עם כתב luciferase, ואת המצב של LMD ניתן להעריך על ידי הדמיה bioluminescent (BLI). מערכת תיוג התאים המשמשת בדו"ח זה היא מדווח NanoLuc (NL) המשתמש בפורימזין כמצע, אשר הוכח כמגביר את הרגישות ביחס לצמיחת הגידול21. לא נצפתה הפרעה של צמיחת תאי CTC (in vitro או in vivo) על ידי ביטוי NL. - בדוק סימנים של התקדמות LMD באמצעות שיטות אלה: התבוננות גופנית: ירידה במשקל, הטיית הראש וגב כפוף. MRI: חדרים מוגדלים וסימנים של הידרוצפליה (איור 2B). BLI: אותות ביולומינסנטיים חיוביים באזור מערכת העצבים המרכזית (איור 2C).
5. איסוף CSF מעכברים עם LMD להרחבת שיבוט לאחר מכן
- מרדימים את עכבר NSG עם LMD עם 4% isoflurane (בהתאם לפרוטוקולים שאושרו מוסדית) עד שהוא לא מראה סימנים של רפלקס הנכון.
- הכן את העכבר על ידי גילוח הפרווה של כל משטח הגחון של הראש ולהכין את העור באמצעות טכניקה סטרילית.
- מקמו את האף באמצעות חרוט אף בצורת L שונה של המנגנון הסטריאוטקטי, כדי להבטיח שהנחיריים יישארו ללא הפרעה. אבטחו את העור על ידי משיכתו קדימה בעדינות על פני משטחי הגחון של שתי הפינות בעזרת נייר דבק, הצמדתו לקונוס האף, ולאחר מכן כיפוף הצוואר בזווית של כ-90 מעלות לאחר אבטחתו. מתן איזופלורן 1.5%-3% לשמירה על הרדמה.
- הארכה מלאה של הצוואר והתחלה ממש בין הפינה, מנחה את קצות המספריים הכירורגיים כלפי מטה על פני עצם העורפית בלחץ קל.
הערה: במצב קו אמצע זה, ניתן להבחין בשקע עדין כאשר קצות המספריים נכנסים לאזור הקעור מעל מגנת הסיסטרנה. - צור חתך קטן בקו האמצע בגודל 5-7 מ"מ ממש מעל הקרום המישוש.
- השתמשו במלקחיים קהים עם קצוות של 1-2 מ"מ כדי להפעיל בעדינות לחץ על מגננת הסיסטרנה. הציגו טיפים במצב סגור ופתחו אותם תוך הפעלת לחץ כלפי מטה על הדורה.
- חזור על תהליך הדיסקציה הקהה כמתואר בשלב 6 עד שניתן להבחין בבירור בקרום הדוראלי, וכלי הדם הקשורים נראים בתוך האזור החשוף.
- תוך שמירה על המלקחיים פתוחים כדי למשוך את השרירים שמסביב, הכנס מחט 27-29 G המחוברת מזרק 1 מ"ל מתחת לדורה כדי לדמיין את השיפוע. ודא שהמחט חודרת ממש מעבר לשיפוע. בהדרגה למשוך את הבוכנה מזרק.
- יש לאסוף כמה שיותר CSF (בדרך כלל בין 15-30 μL) לפני המתת חסד של עכבר.
הערה: המתת חסד מושגת, בהתאם לפרוטוקולים שאושרו על ידי מוסדות, על ידי חשיפת הנושא לריכוזים הולכים וגדלים של גז CO2 דחוס. לדוגמה, שיעור תזוזה מ -30% עד 70% מנפח התא לדקה יופעל כדי למנוע או להפחית אי נוחות או מצוקה. זה ואחריו להבטיח את הפסקת תנועות הלב וכלי הדם והנשימה באמצעות תצפית ממושכת באוויר החדר במשך יותר מ -10 דקות. - פרוס את ה- CSF מהמזרק לצינור מיקרוצנטריפוגה והנח אותו על קרח.
- סובב את הדגימה ב 257 x גרם במשך 5 דקות ב 4 ° C, ובעדינות להסיר את הנוזל (להקפיא את דגימת CSF העכבר ב -80 ° C במידת הצורך לניתוח נוסף) מבלי להפריע את גלולת התא.
- מוסיפים 500 μL של PBS סטרילי ושוטפים את גלולת התא; חזור על הסחיטה ב 257 x גרם במשך 5 דקות בטמפרטורת החדר.
- תאי השהיה מחדש במדיה מותנית HMC בלוח של 96 בארות.
הערה: CSF-CTCs שהושתלו in vivo וגדלו בהצלחה לתוך LMD צריכים להיות מסוגלים לגדול כמו תרביות תאים רגילות. המשך להתרחב על ידי החלפת מדיה כל 3 ימים. טריפסינזציה והעברת תאים למנגנון גידול תאים גדול יותר כאשר התאים נפגשים. תאים אלה יהפכו לתרביות in vivo PD-CSF-CTC. בדו"ח הנוכחי, היו 100% הצלחה עם מודל CDX, ועדיין לא יצרו PDX M-LMD.
Representative Results
הבנת הדרישות לצמיחה מוצלחת של CSF-CTCs ex vivo היא מאמץ מתמשך. לשם כך, הוא האמין כי מתן גורמים חיוניים המחקים את microenvironment CSF הוא בעל חשיבות מרכזית22. תאי קרום המוח האנושיים (HMCs) מפרישים מגוון גורמי גדילה לתוך CSF, כולל FGF-2, EGF, IGFBP2 ו- IGFBP6, וידועים כתומכים בצמיחה של תאי CTC 12,13,14,23,24. לכן, ניתוח מערך ציטוקינים אנושי בוצע על מדיה מותנית HMC כדי לזהות רכיבים חשובים פוטנציאליים הדרושים להישרדות CTC. ואכן, מספר גורמי גדילה עברו רגולציה מוגברת במדיה המותאמת ל-HMCs (איור 3A). לדוגמה, גורם מגרה מושבת גרנולוציטים-מקרופאגים (GM-CSF), VEGF-A ו-IGFBPs (IGFBP2, 3, 4 ו-6).
רכיבי תאי CSF מחולים עשויים להיות מורכבים ממספר סוגי תאים, כגון CTCs, תאי חיסון ופיברובלסטים. אנשים שאינם CTC יפסיקו בסופו של דבר להעביר שעות נוספות. בדרך כלל, תאים שמתרבים בהצלחה ונשארים בשגשוג הם תאים סרטניים (M-LMD). תיקוף של תאים גדלים בתרבית הוא אכן תאי M-LMD, אשר יכול להיעשות על ידי זיהוי IF של ביטוי MLANA ואנליזות שעתוק שהוכחו בעבר7.
כהוכחת היתכנות להצגת השימוש והיישום הפוטנציאליים של קווי PD-CSF-CTC מבוססים במבחנה ו-in vivo, נעשה שימוש בניתוח ריצוף RNA חד-תאי (scRNA-seq), והתוצאות חשפו מספר גנים שהועשרו ונשמרו מהחולה הלא מתורבת CSF-CTCs7. שניים מהם כוללים קולטן טירוזין-חלבון קינאז ErbB3 ו- IGF-1R, שיש להם השלכות על התקדמות מלנומה ועמידות לכימותרפיה 25,26,27.
כדי לבדוק אם הם מילאו תפקיד בהישרדות CSF-CTC, נערכה בדיקת התפשטות קריסטל סגול על PD-CSF-CTCs שטופלו בתרופות שאושרו על ידי ה- FDA טוקאטיניב וצריטיניב המכוונות ל- ErbB28 ו- IGF-1R 7,29 בהתאמה. נוגדן Anti-IGFBP2 נכלל כבקרה חיובית שאמורה לעכב את הצמיחה של תרביות PD-CSF-CTC. התוצאות הראו כי היעדר IGFBP2 או IGF-1R היה יעיל בהפחתת ההתפשטות של PD-CSF-CTCs (איור 3B). בהתחשב בכך שאיתות MAPK נמצא במורד הזרם של IGF-1R, צביעת תאים חיים calcein-AM ומבחני הישרדות של תאי MTT בוצעו גם בשלושה קווי M-LMD PD-CSF-CTC על ידי טיפול בהם עם ceritinib או מעכבי MAPK, dabrafenib ו trametinib או שילוב של כל השלושה. הנתונים הראו כי הכדאיות של כל שלושת קווי התאים הופחתה באופן משמעותי על-ידי צריטיניב, בעוד שלדברפניב ולטרמטיניב היו השפעות מעורבות (איור 3C). התוצאה של טיפולי דברפניב וטרמטיניב הייתה מפתיעה. כל שלושת קווי PD-CSF-CTC נגזרו מחולי M-LMD שנשאו מוטציה BRAFV600E 7. זה עשוי להצביע על אפקט עמידות לכימותרפיה נרכש של CSF-CTCs, וזה משהו שייחקר בעתיד.
לאחר מכן, כדוגמה לאופן שבו PD-CSF-CTCs יכולים לשמש in vivo, מודלים של murine-M-LMD הוקמו על ידי חיסון תוך-תתי עם מספר משתנה של PD-CSF-CTCs. זמני ההישרדות החציוניים בעכברים נקבעו (איור 3D). כדי להמחיש את התקדמות M-LMD, קווי PD-CSF-CTC תויגו עם סמן ביולומינסנטי, כגון מערכת NL reporter21, ונלכדו על-ידי BLI (איור 2C). המיקום של גרורות LMD הודגם גם באמצעות אימונוהיסטוכימיה עם חלבון melan-A (MLANA)30 כסמן של תאי המלנומה (איור 3E). כהוכחת היתכנות לבדיקת אסטרטגיות טיפוליות נגד M-LMD in vivo, קבוצות murine-M-LMD קיבלו מונותרפיה פומית יומית של ceritinib או trametinib, או שילוב של dabrafenib ו trametinib או ceritinib ו trametinib. קבוצת הביקורת (שלא טופלה) קיבלה מי מלח פומיים כהשוואה. התוצאות הראו הישרדות ממושכת משמעותית (איור 3F) וגילוי מחלה מאוחר יותר (איור 3G) בקבוצה שטופלה בצריטיניב וטרמטיניב (הישרדות חציונית לא מטופלת של M-LMD: 28.5 ימים לעומת צריטיניב וטרמטיניב שטופלו ב-M-LMD הישרדות חציונית: 38.5 ימים; ערך P = 0.0052). נתונים אלה מדגישים את התועלת הפוטנציאלית של קווי M-LMD PD-CSF-CTC שפותחו לביצוע מחקרים פרה-קליניים כדי לקבוע את יעילותם של טיפולים חדשניים.
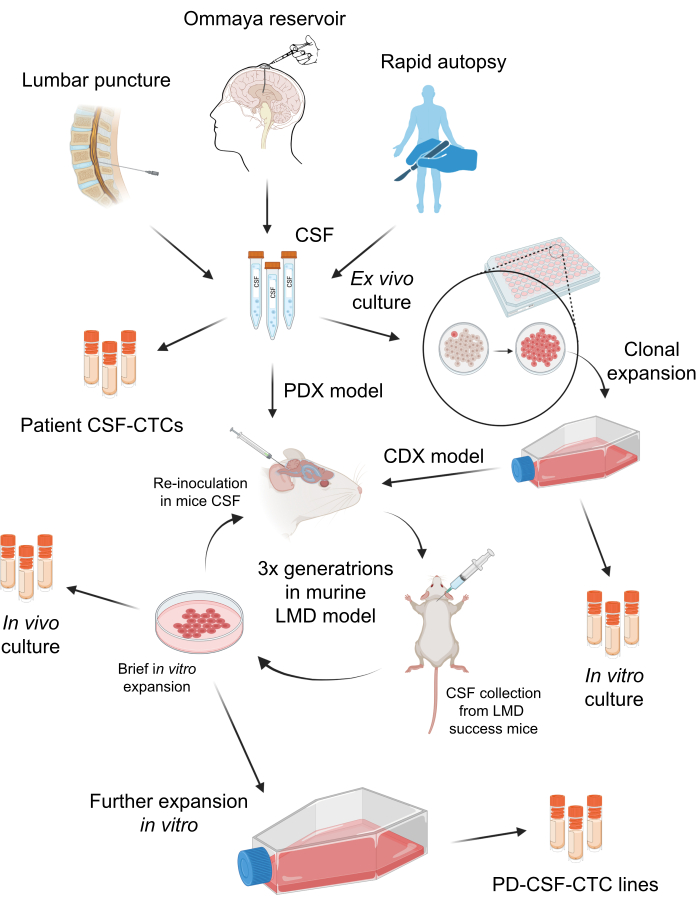
איור 1: סקירה סכמטית של תהליך ההקמה של תאי גידול במחזור CSF שמקורם במטופל (PD-CSF-CTCs). CSF מחולים ניתן לדגום באמצעות ניקור מותני, מאגר Ommaya, או נתיחות מהירות. באמצעות סדרה של התפשטויות in vitro ו-in vivo , כל שלב יוצר תרבית CSF-CTC בינונית (כלומר, CSF-CTCs של מטופלים, בתרבות מבחנה , בתרבות in vivo ) עד להקמת קו PD-CSF-CTC. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
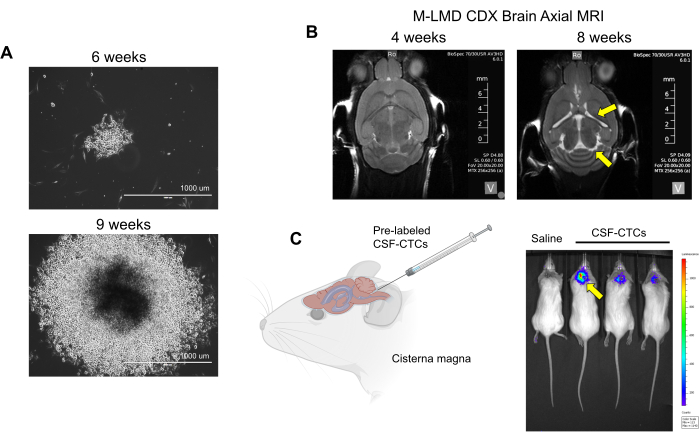
איור 2: דוגמאות לתרבית in vitro ו-in vivo של CSF-CTCs שמקורם בחולי M-LMD. (A) תמונות מייצגות של שדה בהיר המראות את הצמיחה במבחנה של מושבת M-LMD CSF-CTC לאחר 6 שבועות ו-9 שבועות במדיה ממוזגת HMC. סרגל קנה מידה: 1000 מיקרומטר. (B) תמונות MRI לאחר 4 שבועות ו -8 שבועות לאחר חיסון תוך-תתי עם PD-CSF-CTCs; הקמה מוצלחת של מודל מורין של M-LMD. חיצים צהובים מצביעים על חדרים מוגדלים והידרוצפליה אפשרית בעכבר M-LMD זה. (C) הדמיה מייצגת של BLI של התפתחות M-LMD בעכברים. האיור נלקח מ-Law et al.7. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
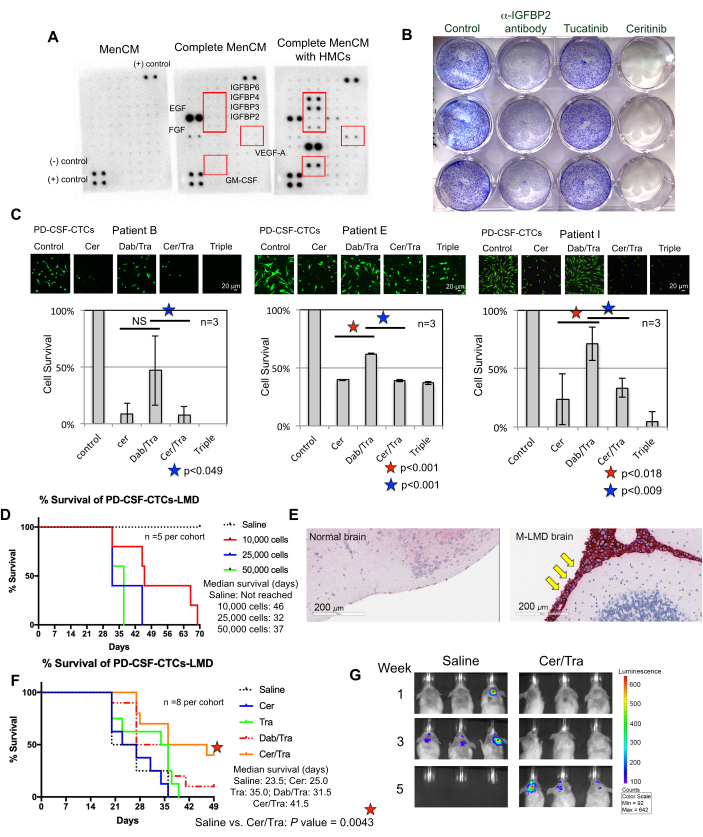
איור 3: קווי PD-CSF-CTC משמשים בניסויים פרה-קליניים שונים לחקר M-LMD. (A) מערך ציטוקינים אנושי המראה עלייה של גורמי גדילה מופרשים שונים (כלומר, IGFBPs, VEGF-A ו-GM-CSF) בתרבית מדיה (MenCM) בנוכחות תאי קרום המוח האנושיים (HMC). (B) תמונה סרוקה של בדיקת התפשטות תאים סגולים גבישיים כדי לקבוע את היעילות של נוגדן אנטי-IGFBP2, טוקאטיניב וצריטיניב כנגד אחד מקווי PD-CSF-CTC. לתנאי הבקרה ניתן טיפול ברכב. הניסוי בוצע בשיטת טריפליקט. (C) בדיקת הישרדות תאים של שלושה קווי PD-CSF-CTC שונים (ממטופלים 09, 12 ו-16) במבחנה. התאים טופלו בצריטיניב (cer), שילוב של dabrafenib (dab) + trametinib (tra), cer + tra, או שלושתם. התאים נאספו לאחר 72 שעות לאחר הטיפול. צביעת Calcein-AM שימשה להמחשת כדאיות התא, ובדיקת MTT שימשה לקביעת הישרדות התא. מבחן t מדגם זוגי שימש לניתוח סטטיסטי. פסי קנה מידה: 20 מיקרומטר. (D) עקומת הישרדות של מודל M-LMD מוריני. עכברי NSG חוסנו באופן תוך-תתי (באמצעות cisterna magna) עם אחד מקווי PD-CSF-CTC ב-10,000, 20,000 ו-50,000 תאים. ההישרדות החציונית של עכברי M-LMD נקבעה. (E) זיהוי IHC עבור MLANA, סמן למלנומה, באזורי המוח של עכברי M-LMD. MLANA חיובי נמצא בקרומי המוח (מוכתמים באדום; מחודדים על ידי חצים צהובים), בעוד שהמוח הרגיל (בריא) לא הראה צמיחה סרטנית (שלילי עבור MLANA). פסי קנה מידה: 200 מיקרומטר. (F) ניסוי יעילות מייצג של קבוצות M-LMD מורין שניתן מדי יום במי מלח, cer, tra, dab/tra או cer/tra. הישרדותם של עכברים נקבעה. מבחן לוג-דרג (Mantel-Cox) שימש לניתוח סטטיסטי. (G) תמונות BLI מייצגות של התקדמות M-LMD תוך 5 שבועות, תוך השוואת בקרה (מלוחים) שטופלו לעומת cer / tra טיפל מורין M-LMD עוקבות. לוח (C) של האיור נלקח מ-Law et al.7. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: סיכום של CSF-CTCs קליניים שהתקבלו עבור תרבית ex vivo בחולי M-LMD. טבלה מסכמת של 11 חולי M-LMD, אשר CSF-CTCs שלהם ניסו להפיץ. המטופלים בטבלה אופיינו בעבר בחוק ואח' 7. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
M-LMD היא מחלה הרסנית, קטלנית אוניברסלית, ויש צורך דחוף למצוא אסטרטגיות טיפול טובות יותר. אחד החסמים העיקריים לחקר M-LMD הוא חוסר היכולת לרכוש מספיק CSF-CTCs לביצוע מחקרים מולקולריים ופונקציונליים 1,7. למרות שקיימות שיטות לתרבית CTCs מדם היקפי ו- CSF מסוגי סרטן אחרים, כגון סרטן השד והשחלות 11,31,32, שיטות התפשטות CTC אלה הן בדרך כלל קצרות טווח, ולא דווח על הצלחה בגידול CSF-CTCs ממלנומה. בנוסף, המתודולוגיות הנוכחיות להפצת CTCs קיימות בסביבות ex vivo קצרות טווח וטרם הניבו מודל LMD in vivo הנגזר מתאי LMD של מטופלים. כאן, פרוטוקול חדשני מוצג לתרבית תאים אלה במבחנה ו- in vivo, המוביל לקווי תאים ייחודיים שמקורם בחולה. נכון לעכשיו, מתוך 11 חולי M-LMD במחקר, היה סיכוי של כ 60% (7 מתוך 11) להצלחה בהפצת M-LMD CSF-CTC במבחנה, ובעוד זה הופחת ל~ 20% (2 מתוך 11) in vivo באמצעות שיטת CDX7.
ברור כי בתנאי מבחנה אינם מחזירים את המיקרו-סביבה של CSF. עם זאת, גישות פרוטאומיות בוצעו בעבר כדי לחקור רכיבי חלבון ב- CSF וסיפקו כמה תובנות לגבי גורמי מפתח שנדרשו לצמיחת CTC ex vivo3. לדוגמה, זוהה כי אחד המסלולים העיקריים המקדמים הישרדות CTC בחולי M-LMD היה קשור לפעילויות מוגברות הקשורות ל- IGF 3,7. יתר על כן, מחקרים הראו כי הלפטומנינגים מפרישים מגוון ציטוקינים/גורמי גדילה לתוך CSF, כולל FGF-2, EGF, GM-CSF וחלבונים הקשורים לאיתות IGF12. ואכן, זה היה reatutulated בתקשורת תרבותית עם HMCs, תמיכה בתפקיד פוטנציאלי עבור גורמי צמיחה אלה בקידום הצמיחה CSF-CTC.
יתרון מרכזי ביצירת מודל PDX (או CDX) הוא היכולת לקבל תובנות עמוקות יותר על הפתולוגיה של המחלה, דבר שחסר בתנאי מבחנה . באופן אידיאלי, גישת PDX מועדפת מכיוון שה- CSF-CTCs יהיו ישירות מחולים ללא תרבית ex vivo . בתחילה, נעשו ניסיונות ליצור M-LMD באמצעות גישה זו, אך הם לא הצליחו עד כה. ייתכן שהקושי ביצירת עכברי PDX קשור לשפע ולשלמות של חומר המוצא (כלומר, מעט מאוד CTCs בני קיימא ב- CSF של המטופל באיסוף שגרתי במרפאה). זה עשוי להסביר מדוע הייתה לנו הצלחה גדולה יותר בגידול CTCs מ- CSF שנאספו בנתיחה7. כדי להגדיל את ההסתברות להתפשטות in vivo , פרוטוקול זה שונה כדי לספק גישת CDX חלופית. ניתן להרחיב תחילה CSF-CTCs במבחנה (שלב 3) כדי ליצור קווי PD-CSF-CTC בעלי פוטנציאל צמיחה ארוך טווח וגדול יותר. תאים אלה מחוסנים בעכברים כדי ליצור M-LMD. למרות שהשיטה הנוכחית יצרה מספר מוגבל של מודלים in vivo CDX M-LMD (~ 20%), זה עשוי לשקף את מגוון השעתוק של CSF-CTCs, את המורכבות של מיקרו-סביבה CSF, ואת הקושי בגידול תאים אלה באופן כללי. אנו מניחים כי פיתוח עתידי של מודל עכבר אנושי עשוי לשפר את שיעור ההצלחה של קליטה בהתחשב בחשיבות של מיקרו-סביבה בתמיכה בכדאיות תאים סרטניים33.
מגבלה של גישת CDX היא שרק שיבוטים מסוימים נבחרו מדגימות חולים, וסחף גנטי של תאים סרטניים באמצעות תרבית ex vivo עשוי שלא לשקף עוד את פרופיל השעתוק של המקור המקורי. עם זאת, דווח כי למרות תרבית חוץ גופית , קווי PD-CSF-CTC שמרו על דמיון של כ-97% בביטוי גנים לחולים מבודדים ולא מתורבתים CSF-CTCs7. במחקר זה, ניתוחי scRNA-seq חשפו חתימות גנים מועשרות חופפות בין PD-CSF-CTCs לא מתורבתים, במבחנה ו-in vivo PD-CSF-CTCs, כגון SOX9, ErbB3 ו-IGF-1R7, דבר המצביע על כך שאלו עשויות להיות מטרות טיפוליות פוטנציאליות. בנוסף, גנים מועשרים אלה מעורבים במסלולים ביולוגיים הקשורים לבקרת שעתוק ומטבוליזם7. באופן קולקטיבי, זה מדגיש את הערך התרגומי של תרבויות PD-CSF-CTC להבנה טובה יותר של הביולוגיה של M-LMD, זיהוי מנגנונים מולקולריים ממוקדים ומסלולים המניעים את המחלה, ועיצוב טיפולים רציונליים במחקרים עתידיים.
למרות שהמתודולוגיה הנוכחית נותרה לא מושלמת, מכיוון שאין דרך לקבוע מראש את המצב והכדאיות של CSF-CTCs בחולי M-LMD, נעשו מספר תצפיות שיגבירו את סיכויי ההצלחה מכיוון שה- CTCs נמוכים במספרם ושבריריים למדי. צעדים קריטיים אלה כוללים תיאום עם המרפאה כדי להניח דגימות CSF על קרח מיד עם לקינתן ולהעביר אותן במהירות למעבדה כדי לשמור על שלמות התאים. לאחר מכן, CSF-CTCs צריך להיות מעובד מיד, או על ידי ציפוי אותם בתרבית או cryoשימור התאים.
בסך הכל, תרבית והרחבה של CSF-CTCs הייתה תהליך של ניסוי וטעייה, אך הקמת פרוטוקול זה ליצירת תאי M-LMD שמקורם במטופל תעניק לחוקרים את המשאבים הדרושים לביצוע ניסויים עם דגימות חולים, דבר שלא ניתן היה לעשות בעבר. מטרה עיקרית קדימה היא להשתמש ב- M-LMD PD-CSF-CTCs לביצוע אפיון מולקולרי, סינון תרופות בתפוקה גבוהה, ומחקרי יעילות תרופות in vivo כדי לתכנן טיפולים רציונליים לטיפול ב- M-LMD. ההערכה היא כי גישה זו תוביל לאסטרטגיות טיפול שיפחיתו מאוד את התחלואה והתמותה הקשורות להיבט קטלני זה של מלנומה גרורתית מתקדמת.
Disclosures
פיטר פורסיית' מכהן בוועדות מייעצות עבור Abvie Inc, Bayer, Bristol Meyers Squib, BTG, Inovio, Novocure, Tocagen ו- Ziopharm, מחוץ לעבודה שהוגשה. לכל המחברים האחרים אין מה לחשוף.
Acknowledgements
ברצוננו להודות לחולים ולמשפחות על נדיבותם יוצאת הדופן בתרומת רקמות למחקר מדעי זה. עבודה זו נתמכה על ידי מענקים מהמכונים הלאומיים לבריאות P50 CA168536, R21 CA256289, R21 CA216756 (ל- KSMS ו- PAF) K99 CA226679 (ל- IS). קרן מופיט להאצת מחקר (ל-BC ול-PAF), התוכנית לביולוגיה כימית ורפואה מולקולרית ע"ש מופיט (PAF ו-DD), קרן מופיט (PAF). ליבות המשאבים המשותפים לגנומיקה מולקולרית, רקמות וביואינפורמטיקה וביוסטטיסטיקה במופיט נתמכות בחלקן על ידי המכון הלאומי לסרטן באמצעות מענק תמיכה של מרכז הסרטן (P30-CA076292) וקרן מופיט.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringe 27 - 29 G needles | Any vendor | n/a | 0.1 mm Sterile Filtered |
| 1.5 mL Eppendorf tubes | Any vendor | ||
| 15 ml and 50 mL polystyrene centrifuge tubes | Any vendor | n/a | |
| 6 - 8 weeks females NOD SCID gamma (NSG) mice | Charles River | Males optional | |
| Buprenorphine Sustained-Release (Bup-SR) | Zoopharm | DEA controlled | |
| Fetal bovine serum (FBS) | ScienCell | #0010 | |
| Gas inhalation anestehsia system | VeteEquip | #901812 | COMPAC5 |
| Hamilton microliter syringes | Hamilton | 10, 25, 50, and 100ml | 30 G for cisterna magna injection |
| Human basic fibroblast growth factor (bFGF) | Milipore Sigma (or any vender) | #F0291 | |
| Human epidermal growth factor (EGF) | Milipore Sigma (or any vender) | #SRP3027 | |
| Human meningeal cells (HMCs) isolated from human leptomeninges | ScienCell | #1400 | |
| IVIS 200 imaging system | Caliper Life Sciences | n/a | |
| Magnifying glass with light | Any vendor | n/a | |
| Meningeal Cell Culture Media (MenCM) | ScienCell | #1401 | |
| Meningeal cell growth supplement (MCGS) | ScienCell | #1452 | |
| MRI imaging | Bruker | BioSpec series | Optional |
| P1000, P200, P20 pipettes/ pipette tips | |||
| penicillin-streptomycin Antibiotic solution | ScienCell (or any vender) | #0503 | |
| Phosphate buffered saline (PBS) | Any vendor | n/a | 0.1 mm Sterile Filtered |
| Rodent Surgical Instruments (Scissors, Forceps) | Roboz Surgical Instrument (or any vendor) | ||
| Screw cap cryo tubes | |||
| Sterile blue paper/ drape covering | Any vendor | n/a | n/a |
| Sterile cotton sticks | Any vendor | n/a | |
| Tissue culture plates/flasks (96-well, 24-well, 12-well, 6-well, T175 etc.) |
References
- Glitza, I. C., et al. Leptomeningeal disease in melanoma patients: An update to treatment, challenges, and future directions. Pigment Cell Melanoma Res. 33 (4), 527-541 (2020).
- Khaled, M. L., Tarhini, A. A., Forsyth, P. A., Smalley, I., Pina, Y. Leptomeningeal disease (LMD) in patients with melanoma metastases. Cancers (Basel). 15 (6), 1884 (2023).
- Smalley, I., et al. Proteomic analysis of CSF from patients with leptomeningeal melanoma metastases identifies signatures associated with disease progression and therapeutic resistance). Clin Cancer Res. 26 (9), 2163-2175 (2020).
- Larkin, J., et al. Five-year survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med. 381, 1535-1546 (2019).
- Boire, A., et al. Complement component 3 adapts the cerebrospinal fluid for leptomeningeal metastasis. Cell. 168 (6), 1101-1113 (2017).
- Chi, Y., et al. Cancer cells deploy lipocalin-2 to collect limiting iron in leptomeningeal metastasis. Science. 369 (6501), 276-282 (2020).
- Law, V., et al. A preclinical model of patient-derived cerebrospinal fluid circulating tumor cells for experimental therapeutics in leptomeningeal disease from melanoma. Neuro Oncol. 24 (10), 1673-1686 (2022).
- Carmona-Ule, N., et al. Short-term ex vivo culture of CTCs from advance breast cancer patients: Clinical implications. Cancers (Basel). 13 (11), 2668 (2021).
- Zhang, L., et al. The identification and characterization of breast cancer CTCs competent for brain metastasis. Sci Transl Med. 5 (180), (2013).
- Yu, M., et al. Cancer therapy: Ex vivo culture of circulating breast tumor cells for individualized testing of drug susceptibility. Science. 345 (6193), 216-220 (2014).
- Mohamed, B. M., et al. Ex vivo expansion of circulating tumour cells (CTCs). Sci Rep. 13 (1), 3704 (2023).
- Decimo, I., Fumagalli, G., Berton, V., Krampera, M., Bifari, F. Meninges: From protective membrane to stem cell niche. Am J Stem Cells. 1 (2), 92-105 (2012).
- Mercier, F., Hatton, G. I. Connexin 26 and basic fibroblast growth factor are expressed primarily in the subpial and subependymal layers in adult brain parenchyma: Roles in stem cell proliferation and morphological plasticity. J Comp Neurol. 431 (1), 88-104 (2001).
- Stylianopoulou, F., Herbert, J., Soares, M. B., Efstratiadis, A. Expression of the insulin-like growth factor II gene in the choroid plexus and the leptomeninges of the adult rat central nervous system. Proc Natl Acad Sci U S A. 85 (1), 141-145 (1988).
- Nordqvist, A. C., Mathiesen, T. Expression of IGF-II, IGFBP-2, -5, and -6 in meningiomas with different brain invasiveness. J Neurooncol. 5, 19-26 (2002).
- Zumkeller, W., Westphal, M. The IGF/IGFBP system in CNS malignancy. Mol Pathol. 54 (4), 227-229 (2001).
- Wang, L., et al. Promise and limits of the CellSearch platform for evaluating pharmacodynamics in circulating tumor cells. Semin Oncol. 43 (4), 464-475 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8, 160 (2023).
- Chen, J., et al. The development and improvement of immunodeficient mice and humanized immune system mouse models. Front Immunol. 13, 1007579 (2022).
- Law, V., et al. A Murine Ommaya xenograft model to study direct-targeted therapy of leptomeningeal disease. J Vis Exp. (167), e62033 (2021).
- Stacer, A. C., et al. NanoLuc reporter for dual luciferase imaging in living animals. Mol Imaging. 12 (7), 1-13 (2013).
- Luo, Y. T., et al. The viable circulating tumor cells with cancer stem cells feature, where is the way out. J Exp Clin Cancer Res. 37, 38 (2018).
- Stumm, R., Kolodziej, A., Schulz, S., Kohtz, J. D., Hollt, V. Patterns of SDF-1alpha and SDF-1gamma mRNAs, migration pathways, and phenotypes of CXCR4-expressing neurons in the developing rat telencephalon. J Comp Neurol. 502 (3), 382-399 (2007).
- Aviezer, D., et al. basal lamina proteoglycan, promotes basic fibroblast growth factor-receptor binding, mitogenesis, and angiogenesis. Cell. 79 (6), 1005-1013 (1994).
- Tiwary, S., et al. ERBB3 is required for metastasis formation of melanoma cells. Oncogenesis. 3 (7), e110 (2014).
- Sun, X., et al. miR-7 reverses the resistance to BRAFi in melanoma by targeting EGFR/IGF-1R/CRAF and inhibiting the MAPK and PI3K/AKT signaling pathways. Oncotarget. 7 (33), 53558-53570 (2016).
- Satyamoorthy, K., Li, G., Vaidya, B., Patel, D., Herlyn, M. Insulin-like growth factor-1 induces survival and growth of biologically early melanoma cells through both the mitogen-activated protein kinase and beta-catenin pathways. Cancer Res. 61 (19), 7318-7324 (2001).
- Lin, N. U., et al. Tucatinib vs Placebo, both in combination with Trastuzumab and Capecitabine, for previously treated ERBB2 (HER2)-positive metastatic breast cancer in patients with brain metastases: Updated exploratory analysis of the HER2CLIMB randomized clinical trial. JAMA Oncol. 9 (2), 197-205 (2023).
- Russo, A., et al. Ceritinib-induced regression of an insulin-like growth factor-driven neuroepithelial brain tumor. Int J Mol Sci. 20 (17), 4267 (2019).
- Ohsie, S. J., Sarantopoulos, G. P., Cochran, A. J., Binder, S. W. Immunohistochemical characteristics of melanoma. J Cutan Pathol. 35 (5), 433-444 (2008).
- Kulasinghe, A., et al. Short term ex-vivo expansion of circulating head and neck tumour cells. Oncotarget. 7 (37), 60101-60109 (2016).
- Li, X., et al. Clinical significance of detecting CSF-derived tumor cells in breast cancer patients with leptomeningeal metastasis. Oncotarget. 9 (2), 2705-2714 (2018).
- Lelliott, E. J., et al. A novel immunogenic mouse model of melanoma for the preclinical assessment of combination targeted and immune-based therapy. Sci Rep. 9 (1), 1225 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved