Ex Vivo Coltura di cellule tumorali circolanti nel liquido cerebrospinale da pazienti con melanoma per studiare la malattia leptomeningea associata al melanoma
In This Article
Summary
Questo articolo descrive un protocollo per la propagazione delle cellule tumorali circolanti nel liquido cerebrospinale (CSF-CTC) raccolte da pazienti con malattia leptomeningea associata a melanoma (M-LMD) per sviluppare modelli preclinici per lo studio di M-LMD.
Abstract
La malattia leptomeningea associata al melanoma (M-LMD) si verifica quando le cellule tumorali circolanti (CTC) entrano nel liquido cerebrospinale (CSF) e colonizzano le meningi, gli strati di membrana che proteggono il cervello e il midollo spinale. Una volta stabilita, la prognosi per i pazienti con M-LMD è infausta, con una sopravvivenza globale che varia da settimane a mesi. Ciò è dovuto principalmente alla scarsità di comprensione della malattia e, di conseguenza, alla disponibilità di opzioni terapeutiche efficaci. La definizione della biologia alla base della M-LMD migliorerà significativamente la capacità di adattare le terapie disponibili per il trattamento della M-LMD o di progettare nuovi inibitori per questa malattia universalmente fatale. Un ostacolo importante, tuttavia, risiede nell'ottenere quantità sufficienti di CTC dal CSF derivato dal paziente (CSF-CTC) per condurre esperimenti preclinici, come la caratterizzazione molecolare, l'analisi funzionale e gli studi di efficacia in vivo . Anche la coltura di CSF-CTC ex vivo si è dimostrata impegnativa. Per affrontare questo problema, è stato sviluppato un nuovo protocollo per la coltura di M-LMD CSF-CTC derivate da pazienti ex vivo e in vivo . L'incorporazione di terreni condizionati prodotti da cellule meningee umane (HMC) si è rivelata fondamentale per la procedura. L'analisi dell'array di citochine rivela che i fattori prodotti dalle HMC, come le proteine leganti il fattore di crescita insulino-simile (IGFBP) e il fattore di crescita dell'endotelio vascolare-A (VEGF-A), sono importanti nel sostenere la sopravvivenza ex vivo del CSF-CTC. Qui, l'utilità delle linee CSF-CTC isolate derivate da pazienti è dimostrata nel determinare l'efficacia degli inibitori che hanno come bersaglio le vie di segnalazione del fattore di crescita insulino-simile (IGF) e della proteina chinasi attivata dal mitogeno (MAPK). Inoltre, è stata dimostrata la capacità di inoculare intratecale queste cellule in vivo per stabilire modelli murini di M-LMD che possono essere impiegati per test preclinici di terapie approvate o nuove. Questi strumenti possono aiutare a svelare la biologia sottostante che guida l'insediamento di CSF-CTC nelle meningi e identificare nuove terapie per ridurre la morbilità e la mortalità associate a M-LMD.
Introduction
La malattia leptomeningea (LMD) si verifica quando le cellule tumorali circolanti (CTC) si disseminano nel liquido cerebrospinale (CSF) e si stabiliscono nelle meningi, la membrana che circonda il cervello e il midollo spinale 1,2. La LMD può verificarsi in diversi tumori, ma è particolarmente prevalente nel melanoma. Negli stadi avanzati del melanoma, circa il 5% dei pazienti svilupperà M-LMD 2,3 associato al melanoma. Sebbene relativamente basse rispetto ad altre sedi di metastasi, le conseguenze della M-LMD sono devastanti, con una sopravvivenza globale che varia da settimane a mesi, e contribuisce in modo significativo alla morbilità dei pazienti 1,3,4. Ciò è dovuto principalmente alla scarsità di opzioni di trattamento efficaci combinate con importanti lacune nelle nostre conoscenze su come le leptomeningi sono colonizzate dalle cellule di melanoma2. Pertanto, la comprensione della biologia di M-LMD faciliterà la progettazione di nuove terapie per migliorare i risultati clinici.
Recenti rapporti hanno dimostrato come le CTC colonizzano l'esclusivo microambiente del liquido cerebrospinale. Ad esempio, il complemento C3 promuove l'invasione delle cellule tumorali nel liquido cerebrospinale attraverso il plesso coroideo, un'intricata rete di vasi sanguigni in ciascun ventricolo del cervello5. Inoltre, in risposta agli scarsi micronutrienti nel liquido cerebrospinale, le CTC possono sovraregolare la lipocalina-2, una proteina che elimina il ferro, e il suo recettore SLC22A17 per migliorare la sopravvivenza6. Utilizzando analisi omiche del liquido cerebrospinale, il nostro gruppo ha anche scoperto che il liquido cerebrospinale è arricchito con proteine che regolano la segnalazione del fattore di crescita insulino-simile (IGF), nonché l'immunità innata3. Insieme, questi dati sottolineano il valore delle CTC del CSF dalle biopsie liquide per lo studio di M-LMD.
Mentre le CTC del CSF possono talvolta essere identificate campionando il CSF del paziente tramite puntura lombare, serbatoio di Ommaya o autopsie rapide, una delle principali limitazioni è ottenere un numero sufficiente di queste cellule rare e fragili 1,7. Ad esempio, utilizzando la tecnica di enumerazione CTC, solo da alcune centinaia a diverse migliaia di cellule tumorali sono identificabili per ogni campione di CSF7 del paziente, il che rende difficile eseguire analisi molecolari e funzionali in vitro o in vivo. Sebbene ci siano state segnalazioni di successo nel far crescere brevemente le CTC ex vivo dal sangue periferico (cioè le CTC del cancro al seno)8,9,10, queste cellule di solito crescono solo per il breve periodo e non sono stati segnalati casi di essere in grado di far crescere CTC del melanoma nel liquido cerebrospinale. Quindi, trovare modi per propagare le CTC CSF-CTC del melanoma, o CTC in generale, sarà molto utile per studiare la biologia di M-LMD 7,11.
Per la prima volta, viene descritta una nuova tecnica per propagare ex vivo le CTC del CSF da pazienti con M-LMD. In questo rapporto, è stato sviluppato un protocollo dettagliato che consente la coltura e l'espansione di CSF-CTC da pazienti con M-LMD. Poiché le meningi secernono una varietà di fattori di crescita come FGF, IGF, VEGF-A e IGFBP che supportano la crescita che circonda il suo ambiente 12,13,14,15,16, è stato razionalizzato che le CTC del CSF possono richiedere che questi componenti crescano in condizioni ex vivo. Pertanto, questo protocollo utilizza terreni condizionati generati dalla coltura di cellule meningee umane (HMCs-) in vitro. Per l'inoculazione in vivo, le cellule derivate dal paziente vengono inoculate in topi immunodeficienti per generare linee di C. (PD-CSF-CTC) derivate dal paziente. La disponibilità di cellule M-LMD derivate da pazienti supporterà saggi cellulari, molecolari e funzionali per studiare M-LMD e proporre nuove strategie di trattamento per questa malattia mortale.
Protocol
La raccolta di campioni di liquido cerebrospinale di pazienti anonimizzati è stata approvata dall'Institutional Review Board (IRB) dell'Università della Florida del Sud (MCC 50103, 50172 e 19332). I pazienti con M-LMD possono essere diagnosticati in diversi modi, tra cui citologia CSF positiva, una risonanza magnetica (MRI) caratteristica del cervello e/o della colonna vertebrale o una combinazione di reperti clinici con risultati suggestivi di risonanza magnetica. Il liquido cerebrospinale di questi pazienti M-LMD è stato raccolto di routine come parte delle loro cure cliniche standard. Nessuna procedura viene eseguita a meno che non vi sia un'indicazione clinica. Il consenso informato è stato ottenuto dai pazienti per la raccolta dei campioni e il loro utilizzo per la ricerca e la pubblicazione. La generazione di modelli murino-LMD in vivo è stata approvata dal Comitato Istituzionale per la Cura e l'Uso degli Animali dell'Università della Florida del Sud (IACUC# IS00010398). Lo schema generale di questo protocollo è riassunto nella Figura 1. I dettagli dei reagenti e delle attrezzature utilizzate nello studio sono elencati nella tabella dei materiali.
1. Preparazione di fluidi condizionati con HMC
- Prerivestire un matraccio T175 con poli-l-lisina a 2 μg/cm2.
- Porre il matraccio in un'incubatrice a 37 °C per 1 ora.
- Aspirare la soluzione di poli-l-lisina utilizzando una pipetta sierologica sterile. Non è necessario sciacquare il pallone ed è pronto per la coltura HMC.
- Coltura di circa 1,0 x 106 HMC in 30 mL di terreno di coltura meningea completo (MenCM), che contiene il 5% di siero fetale bovino, l'1% di integratore per la crescita delle cellule meningee e 100 U.I./mL di soluzione antibiotica di penicillina-streptomicina per pallone. Colture di cellule nell'incubatore per colture cellulari in condizioni standard di coltura tissutale a 37 °C e 5% di CO2.
- Cambia i media ogni 3 giorni.
- Quando le cellule raggiungono circa il 75%-80% di confluenza, raccogliere e conservare il terreno di coltura HMC in una provetta conica da 50 mL.
- Dividete gli HMC in nuovi flaconi T175 e nuovi MenCM completi se sono necessari più terreni coltivati HMC.
- Ai terreni coltivati HMC, aggiungere un rapporto 1:1 di MenCM completo.
- Aggiungere 20 ng/mL di fattore di crescita dei fibroblasti (FGF) e 20 ng/mL di fattore di crescita epidermico (EGF), che diventeranno i terreni condizionati con HMC per CSF-CTC.
NOTA: Si consiglia di aggiungere FGF ed EGF freschi quando le CTC sono pronte per la coltura. - Conservare i terreni condizionati con HMC in aliquote da 50 mL a 4 °C.
NOTA: Si consiglia di conservare i terreni condizionati con HMC in aliquote a 4 °C ma non più di 4 settimane.
2. Raccolta del liquido cerebrospinale ed elaborazione dei campioni
- Preraffreddare la centrifuga impostandola a 4 °C.
- Una volta prelevato dal paziente, posizionare immediatamente il campione di liquido cerebrospinale in una provetta conica da 15 ml su ghiaccio per mantenerlo fresco.
NOTA: Il nostro protocollo approvato dall'IRB consente di prelevare 7,5 ml di liquido cerebrospinale dal paziente consenziente. - Centrifugare il liquido cerebrospinale a 257 x g per 5 minuti a 4 °C.
- Rimuovere, salvare e fare aliquote del surnatante CSF senza disturbare il pellet cellulare sul fondo. Le aliquote del surnatante CSF possono essere conservate congelate a -80 °C, se necessario per ulteriori analisi.
NOTA: Il pallino potrebbe non essere visibile ad occhio nudo; quindi, si consiglia di lasciare ~40-50 μL sul fondo della provetta. - Nella stessa provetta, aggiungere 1 mL di soluzione salina sterile tamponata con fosfato (PBS) per risospendere e risciacquare le cellule e ripetere la centrifuga a 257 x g per 5 minuti a 4 °C.
NOTA: (Opzionale) Eseguire la lisi dei globuli rossi (RBC) se il campione contiene contaminazione ematica. Tuttavia, tieni presente che alcune cellule potrebbero andare perse durante il processo, comprese le CTC. LE CTC possono essere propagate senza la procedura di lisi dei globuli rossi. - Rimuovere e scartare il PBS senza disturbare il pellet della cella e lasciare ~50 μl sul fondo.
- Eseguire il conteggio delle cellule per determinare la vitalità cellulare. Da qui, ci sono due opzioni per procedere con la crescita di CSF-CTC: coltura in vitro (fase 3) o tentativo di espansione in vivo dello xenotrapianto derivato dal paziente (fase 4).
NOTA: Se le CTC CSF devono essere coltivate in un secondo momento, crioconservare le cellule nel terreno di congelamento per colture cellulari fino a quando non sono pronte per la propagazione. I terreni di congelamento per colture cellulari possono essere prodotti utilizzando il 90% di FBS + il 10% di DMSO. Se è disponibile un eccesso di CSF (ad esempio, più di una raccolta di CSF dai pazienti o il CSF viene raccolto durante l'autopsia), le CTC possono essere valutate inviando il campione per il test di enumerazioneCTC 17 o la colorazione in immunofluorescenza (IF) per il marcatore del melanoma (cioè anti-MLANA) che può fornire informazioni sulla quantità e la vitalità delle CTC. Le cellule non possono essere recuperate dopo aver eseguito questi esperimenti. Pertanto, non è raccomandato se non sono presenti campioni di liquido cerebrospinale di backup dal paziente.
3. Coltura in vitro ed espansione di CSF-CTC
- Risospensione di CSF-CTC in mezzi condizionati HMC. Se le CTC del CSF sono crioconservate, scongelare le cellule, farle girare e lavarle delicatamente con PBS.
- Dividere tutte le cellule in pozzetti triplicati in una piastra da 96 pozzetti con un volume di 150 μl per pozzetto. Solo le cellule vitali aderiranno leggermente alla superficie durante la notte.
NOTA: Il numero di CSF-CTC può variare notevolmente per singolo campione di paziente (Tabella 1). Per i pazienti con un basso numero di CTC, viene utilizzata una piastra a 96 pozzetti come punto di partenza per la coltura e l'intero pellet viene placcato senza contare per paura di perdere i CTC. Tuttavia, se c'è una quantità maggiore di liquido cerebrospinale (cioè ottenuta da un'autopsia), è possibile contare le cellule. Non tutte le cellule tumorali possono crescere ex vivo; Alcuni si espanderanno lentamente per diversi passaggi prima di diventare statici. Attualmente, la possibilità di successo della crescita del melanoma CSF-CTC ex vivo è di circa il 60%7. - Ogni 3 giorni, rabboccare aggiungendo un terreno fresco condizionato con HMC o rimuovere delicatamente il terreno posizionando il puntale della pipetta sul lato del pozzetto, lasciando un po' di liquido senza disturbare il fondo del pozzetto, quindi sostituirlo con un terreno fresco condizionato con HMC.
- Quando le CSF-CTC ex vivo si espandono e diventano confluenti al 90%, tripsinizzare e trasferire l'intero pozzetto in un nuovo pozzetto in una piastra a 24 pozzetti. Quando il pozzetto in un pozzetto a 24 pozzetti è confluente, trasferirlo in una piastra a 12 pozzetti, quindi in una piastra a 6 pozzetti e così via.
NOTA: Dopo la tripsinizzazione, prendere in considerazione la crioconservazione di un piccolo sottoinsieme di CTC in terreni di congelamento per colture cellulari (10% DMSO + 90% FBS) prima della piastratura come backup. - Continua a coltivare CTC. Alcune cellule possono propagarsi a breve termine e alla fine diventare statiche. Tuttavia, uno o più cloni possono trasformarsi ed espandersi in modo esponenziale (Figura 2A). Selezionare questi cloni, che diventeranno le colture in vitro di CSF-CTC (PD-CSF-CTC) derivate da pazienti.
NOTA: Se questi cloni diventano sovraffollati o si raggruppano, tripsinizzare e riplaccare le cellule in una piastra/matraccio di coltura tissutale fresca.
4. Inoculazione in vivo di CSF-CTC per generare un modello di xenotrapianto derivato da linee cellulari (CDX) o xenotrapianto derivato da paziente (PDX)
NOTA: Un modello PDX prevede l'attecchimento di cellule tumorali direttamente da un paziente oncologico (senza coltura ex vivo ), mentre il modello CDX utilizza linee cellulari tumorali o, in questo caso, CTC che sono state propagate e immortalizzate18.
- Utilizzare topi femmina immunodeficienti NOD SCID gamma (NSG) per l'inoculazione di CSF-CTC. Gli NSG sono utilizzati perché sono gravemente immunodeficienti e sono molto ricettivi all'attecchimento di cellule tumorali umane19. A causa delle loro deficienze immunitarie, questi topi dovrebbero essere tenuti in un ambiente igienico rigorosamente controllato e dovrebbero essere alloggiati in isolamento da altri ceppi di topi. Il metodo per rendere la LMD murina è stato descritto in dettaglio altrove20.
NOTA: per generare il modello PDX vengono utilizzate cellule ex vivo (CSF-CTC dei pazienti che sono state trattate solo nella fase 2 senza coltura); L'osservazione fisica dell'animale e la risonanza magnetica del cervello sono necessarie per determinare la progressione della LMD. D'altra parte, con il modello CDX che utilizza in vitro, le PD-CSF-CTC possono essere marcate con un reporter di luciferasi e lo stato della LMD può essere valutato mediante imaging bioluminescente (BLI). Il sistema di marcatura cellulare utilizzato in questo rapporto è un reporter NanoLuc (NL) che utilizza la furimazina come substrato, che ha dimostrato di aumentare la sensibilità in proporzione alla crescita tumorale21. Non è stata osservata un'interferenza della crescita delle cellule CTC (in vitro o in vivo) da parte dell'espressione di NL. - Verificare la presenza di segni di progressione della LMD utilizzando questi metodi: osservazione fisica: perdita di peso, inclinazione della testa e schiena curva. RMN: ventricoli ingrossati e segni di idrocefalia (Figura 2B). BLI: segnali bioluminescenti positivi nella regione del SNC (Figura 2C).
5. Raccolta di CSF da topi con LMD per la successiva espansione del clone
- Anestetizzare il topo NSG con LMD con isoflurano al 4% (seguendo protocolli istituzionalmente approvati) fino a quando non mostra segni del riflesso raddrizzante.
- Preparare il topo rasando il pelo di tutta la superficie ventrale della testa e preparare la pelle utilizzando la tecnica sterile.
- Posizionare il naso utilizzando un cono nasale a forma di L modificato dell'apparato stereotassico, assicurandosi che le narici rimangano libere. Fissare la pelle tirandola delicatamente in avanti attraverso le superfici ventrali di entrambi i padiglioni auricolari con del nastro adesivo, fissandola al cono del naso e quindi piegando il collo a un angolo di circa 90° dopo averlo fissato. Somministrare isoflurano all'1,5%-3% per mantenere l'anestesia.
- Estendendo completamente il collo e iniziando appena tra i padiglioni auricolari, guidare le punte delle forbici chirurgiche verso il basso attraverso l'osso occipitale con una leggera pressione.
NOTA: In questa posizione della linea mediana, è distinguibile una sottile depressione quando le punte delle forbici entrano nell'area concava sopra la cisterna magna. - Creare una piccola incisione sulla linea mediana di 5-7 mm appena sopra la concavità palpata.
- Utilizzare una pinza a punta smussata con punte da 1-2 mm per esercitare delicatamente una pressione sulla cisterna magna. Introdurre le punte in posizione chiusa e aprirle esercitando una pressione verso il basso sulla dura.
- Ripetere il processo di dissezione smussata come descritto nel passaggio 6 fino a quando la membrana durale è chiaramente distinguibile e i vasi sanguigni associati sono visibili all'interno dell'area esposta.
- Mantenendo la pinza aperta per ritrarre la muscolatura circostante, inserire un ago da 27-29 G collegato a una siringa da 1 ml sotto la dura madre per visualizzare lo smusso. Assicurarsi che l'ago penetri appena oltre lo smusso. Ritrarre gradualmente lo stantuffo della siringa.
- Raccogliere quanto più liquido cerebrospinale possibile (di solito tra 15-30 μL) prima dell'eutanasia nei topi.
NOTA: L'eutanasia si realizza, seguendo protocolli istituzionalmente approvati, esponendo il soggetto a concentrazioni crescenti di gas CO2 compresso. Ad esempio, verrà impiegato un tasso di spostamento dal 30% al 70% del volume della camera al minuto per prevenire o ridurre il disagio o l'angoscia. A ciò si aggiunge la cessazione dei movimenti cardiovascolari e respiratori attraverso un'osservazione prolungata all'aria ambiente per più di 10 minuti. - Distribuire il liquido cerebrospinale dalla siringa a una provetta da microcentrifuga e metterlo sul ghiaccio.
- Centrifugare il campione a 257 x g per 5 minuti a 4 °C e rimuovere delicatamente il liquido (congelare il campione di liquido cerebrospinale di topo a -80 °C, se necessario per ulteriori analisi) senza disturbare il pellet cellulare.
- Aggiungere 500 μl di PBS sterile e lavare il pellet cellulare; Ripetere la centrifuga a 257 x g per 5 minuti a temperatura ambiente.
- Risospendere le cellule in terreni condizionati con HMC in una piastra a 96 pozzetti.
NOTA: Le CSF-CTC che sono state innestate in vivo e cresciute con successo in LMD dovrebbero essere in grado di crescere come normali colture cellulari. Continua a espanderti cambiando i media ogni 3 giorni. Tripsinizzare e trasferire le cellule in un apparato di coltura cellulare più grande quando le cellule sono confluenti. Queste cellule diventeranno le colture in vivo di PD-CSF-CTC. Nel rapporto attuale, c'è stato un tasso di successo del 100% con il modello CDX e non è ancora stato generato un PDX M-LMD.
Representative Results
Comprendere i requisiti per una crescita di successo delle CTC nel liquido cerebrospinale ex vivo è uno sforzo continuo. A tal fine, si ritiene che fornire fattori essenziali che imitano il microambiente del liquido cerebrospinale sia di fondamentale importanza22. Le cellule meningee umane (HMC) secernono una varietà di fattori di crescita nel liquido cerebrospinale, tra cui FGF-2, EGF, IGFBP2 e IGFBP6, e sono note per supportare la crescita delle cellule CTC 12,13,14,23,24. Pertanto, è stata eseguita un'analisi dell'array di citochine umane su terreni condizionati con HMC per identificare componenti potenzialmente importanti necessari per la sopravvivenza di CTC. Infatti, diversi fattori di crescita sono stati sovraregolati nei terreni coltivati con HMC (Figura 3A). Ad esempio, fattore stimolante le colonie di granulociti-macrofagi (GM-CSF), VEGF-A e IGFBP (IGFBP2, 3, 4 e 6).
I componenti cellulari del liquido cerebrospinale dei pazienti possono essere costituiti da più tipi di cellule, come CTC, cellule immunitarie e fibroblasti. I non-CTC alla fine smetteranno di fare gli straordinari. Generalmente, le cellule che si propagano con successo e rimangono in proliferazione sono cellule tumorali (M-LMD). La convalida delle cellule in crescita in coltura è infatti costituita da cellule M-LMD, che possono essere effettuate mediante rilevamento IF dell'espressione MLANA e analisi trascrittomiche, che sono state precedentemente dimostrate7.
Come prova di concetto per mostrare il potenziale uso e l'applicazione di linee PD-CSF-CTC consolidate in vitro e in vivo, è stata utilizzata l'analisi del sequenziamento dell'RNA a singola cellula (scRNA-seq) e i risultati hanno rivelato diversi geni che sono stati arricchiti e conservati dal paziente non in coltura CSF-CTC7. Due di essi includono il recettore tirosina-proteina chinasi ErbB3 e IGF-1R, che hanno implicazioni sulla progressione del melanoma e sulla resistenza alla chemioterapia 25,26,27.
Per verificare se hanno avuto un ruolo nella sopravvivenza del CSF-CTC, è stato condotto un test di proliferazione del cristallovioletto su PD-CSF-CTC trattati con farmaci approvati dalla FDA tucatinib e ceritinib che hanno come bersaglio rispettivamente ErbB28 e IGF-1R 7,29. L'anticorpo anti-IGFBP2 è stato incluso come controllo positivo che dovrebbe ostacolare la crescita delle colture di PD-CSF-CTC. I risultati hanno mostrato che l'assenza di IGFBP2 o IGF-1R era efficace nel ridurre la proliferazione di PD-CSF-CTC (Figura 3B). Dato che la segnalazione MAPK è a valle di IGF-1R, la colorazione con cellule vive calceina-AM e i saggi di sopravvivenza delle cellule MTT sono stati eseguiti anche in tre linee M-LMD, PD-CSF-CTC trattandole con ceritinib o gli inibitori MAPK, dabrafenib e trametinib o una combinazione di tutti e tre. I dati hanno dimostrato che la vitalità di tutte e tre le linee cellulari è stata significativamente ridotta da ceritinib, mentre dabrafenib e trametinib hanno avuto effetti misti (Figura 3C). Il risultato dei trattamenti con debrafenib e trametinib è stato sorprendente. Tutte e tre le linee PD-CSF-CTC sono state derivate da pazienti M-LMD che presentavano una mutazione BRAFV600E 7. Ciò potrebbe suggerire un effetto di chemio-resistenza acquisito delle CTC del CSF, che è qualcosa da studiare in futuro.
Successivamente, come esempio di come le PD-CSF-CTC possono essere utilizzate in vivo, sono stati stabiliti modelli murini-M-LMD inoculati intratecale con un numero variabile di PD-CSF-CTC. Sono stati determinati i tempi mediani di sopravvivenza nei topi (Figura 3D). Per visualizzare la progressione di M-LMD, le linee PD-CSF-CTC sono state etichettate con un marcatore bioluminescente, come il sistema reporter NL21, e catturate da BLI (Figura 2C). La localizzazione delle metastasi LMD è stata dimostrata anche utilizzando l'immunoistochimica con la proteina melan-A (MLANA)30 come marcatore delle cellule di melanoma (Figura 3E). Come prova di concetto per testare strategie terapeutiche contro M-LMD in vivo, alle coorti murine-M-LMD è stata somministrata una monoterapia orale giornaliera di ceritinib o trametinib, o una combinazione di dabrafenib e trametinib o ceritinib e trametinib. La coorte di controllo (non trattata) ha ricevuto soluzione salina orale come confronto. I risultati hanno mostrato una sopravvivenza significativamente prolungata (Figura 3F) e un ritardo nell'individuazione della malattia (Figura 3G) nella coorte trattata con ceritinib e trametinib (sopravvivenza mediana M-LMD non trattata: 28,5 giorni rispetto alla sopravvivenza mediana M-LMD trattata con ceritinib e trametinib: 38,5 giorni; P = 0,0052). Questi dati sottolineano la potenziale utilità delle linee M-LMD PD-CSF-CTC sviluppate per condurre studi preclinici per determinare l'efficacia di nuove terapie.
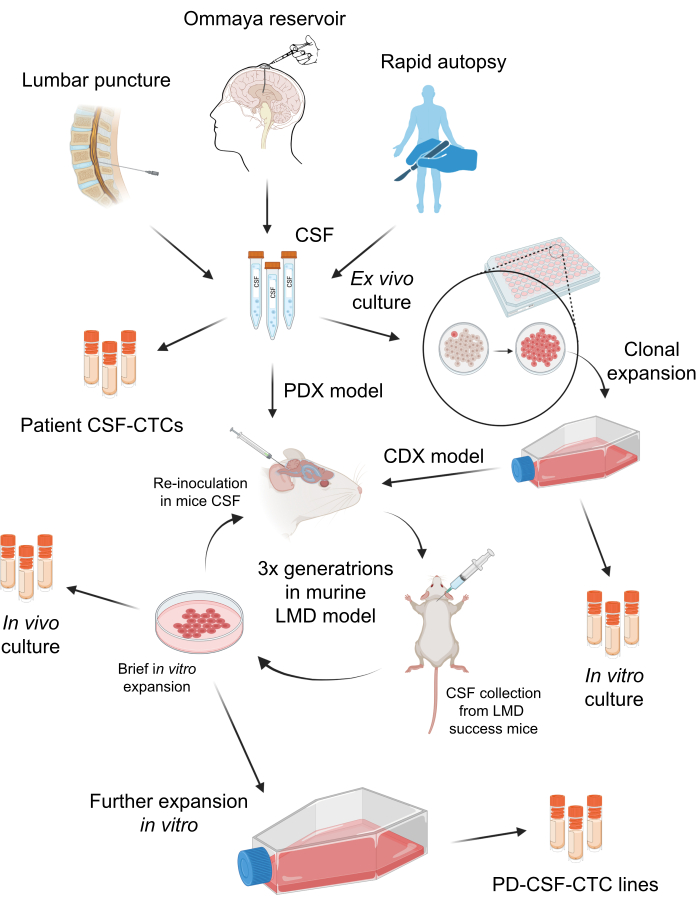
Figura 1: Una panoramica schematica del processo di creazione delle cellule tumorali circolanti nel liquido cerebrospinale derivate da pazienti (PD-CSF-CTC). Il liquido cerebrospinale dei pazienti può essere prelevato tramite puntura lombare, serbatoio di Ommaya o autopsie rapide. Attraverso una serie di propagazioni in vitro e in vivo , ogni fase genera una coltura intermedia di CSF-CTC (i.e., CSF-CTC del paziente, coltura in vitro , coltura in vivo ) fino a stabilire una linea PD-CSF-CTC. Clicca qui per visualizzare una versione più grande di questa figura.
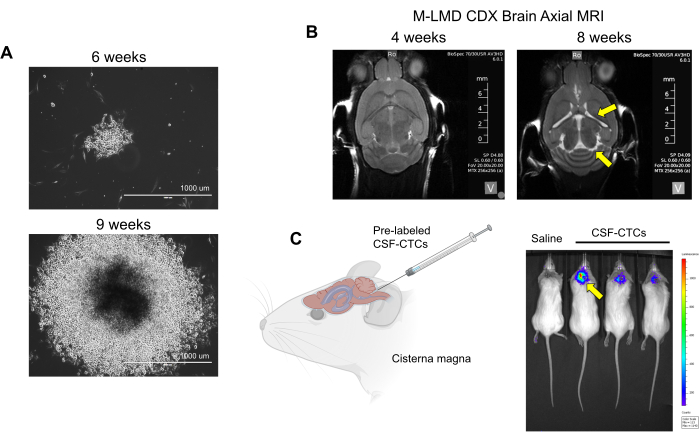
Figura 2: Esempi di coltura in vitro e in vivo di CSF-CTC derivati da pazienti con M-LMD. (A) Immagini rappresentative in campo chiaro che mostrano la crescita in vitro di una colonia di M-LMD CSF-CTC a 6 settimane e 9 settimane in terreni condizionati con HMC. Barra della scala: 1000 μm. (B) Immagini MRI a 4 settimane e 8 settimane dopo l'inoculazione intratecale con PD-CSF-CTC; una riuscita creazione di un modello murino di M-LMD. Le frecce gialle indicano ventricoli ingrossati e possibile idrocefalia in questo topo M-LMD. (C) Visualizzazione rappresentativa del BLI dello sviluppo di M-LMD nei topi. La figura è adattata da Law et al.7. Clicca qui per visualizzare una versione più grande di questa figura.
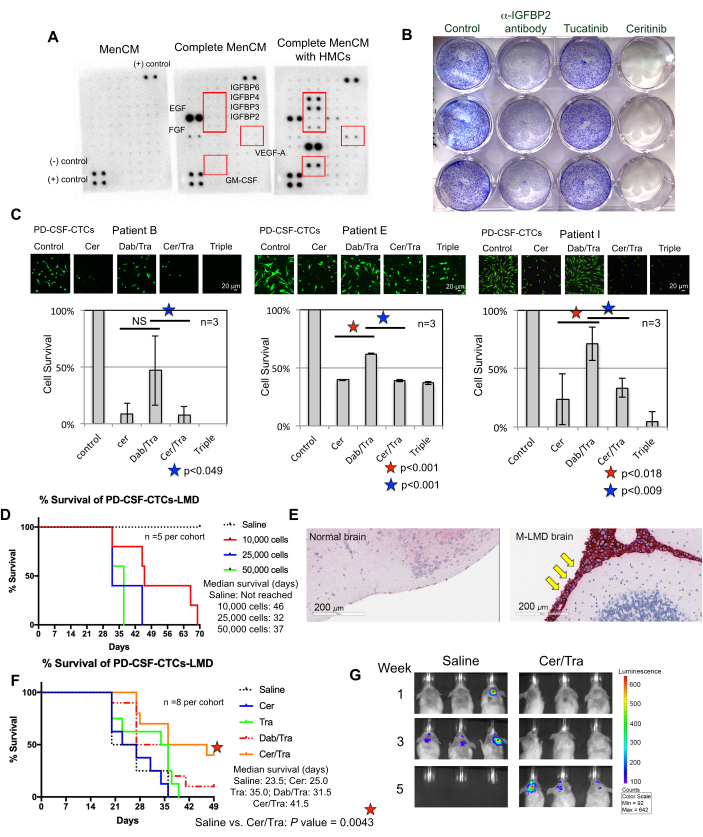
Figura 3: Le linee PD-CSF-CTC sono utilizzate in vari esperimenti preclinici per studiare M-LMD. (A) Un array di citochine umane che mostra un aumento di diversi fattori di crescita secreti (ad esempio, IGFBP, VEGF-A e GM-CSF) in terreni di coltura (MenCM) in presenza di cellule meningee umane (HMC). (B) Un'immagine scansionata di un test di proliferazione cellulare in cristallovioletto per determinare l'efficacia dell'anticorpo anti-IGFBP2, tucatinib e ceritinib contro una delle linee PD-CSF-CTC. La condizione di controllo è stata sottoposta a trattamento del veicolo. L'esperimento è stato eseguito in triplicato. (C) Saggio di sopravvivenza cellulare di tre diverse linee di PD-CSF-CTC stabilite (dai pazienti 09, 12 e 16) in vitro. Le cellule sono state trattate con ceritinib (cer), una combinazione di dabrafenib (dab) + trametinib (tra), cer + tra, o tutti e tre. Le cellule sono state raccolte a 72 ore dopo il trattamento. La colorazione con calceina-AM è stata utilizzata per visualizzare la vitalità cellulare e un test MTT è stato utilizzato per determinare la sopravvivenza cellulare. Per l'analisi statistica è stato utilizzato un t-test a campione accoppiato. Barre della scala: 20 μm. (D) Una curva di sopravvivenza di un modello murino M-LMD. I topi NSG sono stati inoculati per via intratecale (attraverso la cisterna magna) con una delle linee PD-CSF-CTC a 10.000, 20.000 e 50.000 cellule. È stata determinata la sopravvivenza mediana dei topi M-LMD. (E) Rilevamento IHC per MLANA, un marcatore per il melanoma, nelle sezioni cerebrali di topi M-LMD. MLANA positivo è stato trovato nelle meningi (colorate di rosso; indicate da frecce gialle), mentre il cervello normale (sano) non ha mostrato una crescita del cancro (negativo per MLANA). Barre della scala: 200 μm. (F) Un esperimento rappresentativo di efficacia di coorti murine M-LMD a cui è stata somministrata soluzione fisiologica orale giornaliera, cer, tra, dab/tra o cer/tra. La sopravvivenza dei topi è stata determinata. Il test log-rank (Mantel-Cox) è stato utilizzato per l'analisi statistica. (G) Immagini BLI rappresentative della progressione di M-LMD in 5 settimane, confrontando il controllo (soluzione salina) trattato con Coorti murine M-LMD trattate con cer/tra. Il pannello (C) della figura è adattato da Law et al.7. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 1: Riepilogo delle CSF-CTC cliniche ottenute per la coltura ex vivo in pazienti con M-LMD. Una tabella riassuntiva di 11 pazienti con M-LMD, che i loro CSF-CTC sono stati tentati di propagare. I pazienti nella tabella sono stati precedentemente caratterizzati in Law et al.7. Clicca qui per scaricare questa tabella.
Discussion
La M-LMD è una malattia devastante e universalmente fatale e c'è un urgente bisogno di trovare strategie di trattamento migliori. Uno dei principali ostacoli allo studio di M-LMD è l'incapacità di acquisire abbastanza CSF-CTC per eseguire studi molecolari e funzionali 1,7. Sebbene esistano metodi esistenti per coltivare CTC dal sangue periferico e dal liquido cerebrospinale di altri tipi di cancro, come i tumori al seno e alle ovaie 11,31,32, questi metodi di propagazione delle CTC sono solitamente a breve termine e non è stato riportato alcun successo nella coltura di CTC CSF-CTC dal melanoma. Inoltre, le attuali metodologie per la propagazione delle CTC esistono in contesti ex vivo a breve termine e devono ancora produrre un modello LMD in vivo derivato da cellule LMD di pazienti. Qui, viene presentato un nuovo protocollo per coltivare queste cellule in vitro e in vivo, portando a linee cellulari uniche derivate da pazienti. Attualmente, su 11 pazienti con M-LMD nello studio, c'era circa il 60% (7 su 11) di possibilità di successo nella propagazione di M-LMD CSF-CTC in vitro, e mentre questa è stata ridotta a ~20% (2 su 11) in vivo utilizzando il metodo CDX7.
È chiaro che le condizioni in vitro non ricapitolano il microambiente del liquido cerebrospinale. Tuttavia, in precedenza sono stati eseguiti approcci proteomici per studiare i componenti proteici nel liquido cerebrospinale e hanno fornito alcune informazioni sui fattori chiave necessari per la crescita di CTC ex vivo3. Ad esempio, è stato identificato che uno dei principali percorsi che promuovono la sopravvivenza delle CTC nei pazienti con M-LMD era associato a un'aumentata attività correlate all'IGF 3,7. Inoltre, gli studi hanno dimostrato che le leptomeningi secernono una varietà di citochine/fattori di crescita nel liquido cerebrospinale, tra cui FGF-2, EGF, GM-CSF e proteine correlate alla segnalazione IGF12. In effetti, questo è stato riassunto nei media coltivati con HMC, supportando un ruolo potenziale di questi fattori di crescita nel promuovere la crescita di CSF-CTC.
Uno dei principali vantaggi nella generazione di un modello PDX (o CDX) è la capacità di ottenere informazioni più approfondite sulla patologia della malattia, qualcosa che manca alle condizioni in vitro . Idealmente, è preferibile un approccio PDX poiché le CTC del CSF proverrebbero direttamente da pazienti senza coltura ex vivo . Inizialmente, sono stati fatti tentativi per creare M-LMD utilizzando questo approccio, ma finora non hanno avuto successo. La difficoltà nel generare topi PDX è probabilmente associata all'abbondanza e all'integrità del materiale di partenza (cioè, pochissime CTC vitali nel paziente con liquido cerebrospinale al momento della raccolta di routine in clinica). Questo potrebbe spiegare perché abbiamo avuto un successo superiore nella crescita di CTC dal liquido cerebrospinale raccolto all'autopsia7. Per aumentare la probabilità di propagazione in vivo , questo protocollo è stato modificato per fornire un approccio CDX alternativo. Le CSF-CTC possono essere prima espanse in vitro (fase 3) per generare linee PD-CSF-CTC che hanno un potenziale di crescita maggiore e a lungo termine. Queste cellule vengono poi inoculate nei topi per creare M-LMD. Sebbene il metodo attuale abbia generato un numero limitato di modelli in vivo di CDX M-LMD (~ 20%), ciò potrebbe riflettere la diversità trascrizionale delle CTC del CSF, la complessità del microambiente del CSF e la difficoltà di coltivare queste cellule in generale. Ipotizziamo che lo sviluppo futuro di un modello murino umanizzato possa migliorare il tasso di successo dell'attecchimento, data l'importanza del microambiente nel sostenere la vitalità delle cellule tumorali33.
Una limitazione dell'approccio CDX è che solo alcuni cloni sono stati selezionati da campioni di pazienti e la deriva genetica delle cellule tumorali attraverso la coltura ex vivo potrebbe non riflettere più il profilo trascrizionale della fonte originale. Tuttavia, è stato riportato che, nonostante la coltura in vitro , le linee PD-CSF-CTC hanno mantenuto circa il 97% di somiglianza dell'espressione genica con pazienti CSF-CTC isolati e non in coltura7. In quello studio, le analisi scRNA-seq hanno rivelato la sovrapposizione di firme geniche arricchite tra PD-CSF-CTC in vitro non coltivate e PD-CSF-CTC in vivo , come SOX9, ErbB3 e IGF-1R7, suggerendo che questi potrebbero essere potenziali bersagli terapeutici. Inoltre, questi geni comunemente arricchiti sono coinvolti in percorsi biologici associati alla regolazione trascrizionale e al metabolismo7. Nel complesso, ciò evidenzia il valore traslazionale delle colture di PD-CSF-CTC per una migliore comprensione della biologia di M-LMD, l'identificazione di meccanismi molecolari mirabili e percorsi che guidano la malattia e la progettazione di terapie razionali in studi futuri.
Sebbene l'attuale metodologia rimanga imperfetta, in quanto non c'è modo di predeterminare lo stato e la vitalità delle CTC nel liquido cerebrospinale nei pazienti con M-LMD, sono state fatte diverse osservazioni che aumenterebbero la probabilità di successo poiché le CTC sono in numero basso e piuttosto fragili. Questi passaggi critici includono il coordinamento con la clinica per posizionare i campioni di liquido cerebrospinale su ghiaccio non appena vengono prelevati e trasportarli rapidamente in laboratorio in modo da mantenere l'integrità cellulare. Successivamente, le CTC del CSF devono essere trattate immediatamente, mediante placcatura in coltura o crioconservazione delle cellule.
Nel complesso, la coltura e l'espansione delle CTC del CSF è stato un processo per tentativi ed errori, ma l'istituzione di questo protocollo per generare cellule M-LMD derivate da pazienti fornirà ai ricercatori le risorse necessarie per eseguire esperimenti con campioni di pazienti, cosa che non sarebbe stata possibile fare in precedenza. Uno degli obiettivi principali per il futuro è quello di utilizzare le M-LMD PD-CSF-CTC per condurre caratterizzazione molecolare, screening di farmaci ad alto rendimento e studi di efficacia dei farmaci in vivo per progettare terapie razionali per il trattamento della M-LMD. Si ritiene che questo approccio porterà a strategie di trattamento che ridurranno notevolmente la morbilità e la mortalità associate a questo aspetto attualmente fatale del melanoma metastatico avanzato.
Disclosures
Peter Forsyth fa parte dei comitati consultivi di Abvie Inc, Bayer, Bristol Meyers Squib, BTG, Inovio, Novocure, Tocagen e Ziopharm, al di fuori del lavoro presentato. Tutti gli altri autori non hanno nulla da rivelare.
Acknowledgements
Vorremmo ringraziare i pazienti e le famiglie per la loro straordinaria generosità nel donare i tessuti per questo studio scientifico. Questo lavoro è stato sostenuto da sovvenzioni del National Institutes of Health P50 CA168536, R21 CA256289, R21 CA216756 (a KSMS e PAF) K99 CA226679 (a IS). Moffitt Foundation Research Acceleration Fund (a BC e PAF), Moffitt Chemical Biology & Molecular Medicine Program (PAF e DD), Moffitt Foundation (PAF). Il Molecular Genomics, Tissue, and Bioinformatics & Biostatistics Shared Resource Cores di Moffitt è supportato in parte dal National Cancer Institute attraverso un Cancer Center Support Grant (P30-CA076292) e dalla Moffitt Foundation.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringe 27 - 29 G needles | Any vendor | n/a | 0.1 mm Sterile Filtered |
| 1.5 mL Eppendorf tubes | Any vendor | ||
| 15 ml and 50 mL polystyrene centrifuge tubes | Any vendor | n/a | |
| 6 - 8 weeks females NOD SCID gamma (NSG) mice | Charles River | Males optional | |
| Buprenorphine Sustained-Release (Bup-SR) | Zoopharm | DEA controlled | |
| Fetal bovine serum (FBS) | ScienCell | #0010 | |
| Gas inhalation anestehsia system | VeteEquip | #901812 | COMPAC5 |
| Hamilton microliter syringes | Hamilton | 10, 25, 50, and 100ml | 30 G for cisterna magna injection |
| Human basic fibroblast growth factor (bFGF) | Milipore Sigma (or any vender) | #F0291 | |
| Human epidermal growth factor (EGF) | Milipore Sigma (or any vender) | #SRP3027 | |
| Human meningeal cells (HMCs) isolated from human leptomeninges | ScienCell | #1400 | |
| IVIS 200 imaging system | Caliper Life Sciences | n/a | |
| Magnifying glass with light | Any vendor | n/a | |
| Meningeal Cell Culture Media (MenCM) | ScienCell | #1401 | |
| Meningeal cell growth supplement (MCGS) | ScienCell | #1452 | |
| MRI imaging | Bruker | BioSpec series | Optional |
| P1000, P200, P20 pipettes/ pipette tips | |||
| penicillin-streptomycin Antibiotic solution | ScienCell (or any vender) | #0503 | |
| Phosphate buffered saline (PBS) | Any vendor | n/a | 0.1 mm Sterile Filtered |
| Rodent Surgical Instruments (Scissors, Forceps) | Roboz Surgical Instrument (or any vendor) | ||
| Screw cap cryo tubes | |||
| Sterile blue paper/ drape covering | Any vendor | n/a | n/a |
| Sterile cotton sticks | Any vendor | n/a | |
| Tissue culture plates/flasks (96-well, 24-well, 12-well, 6-well, T175 etc.) |
References
- Glitza, I. C., et al. Leptomeningeal disease in melanoma patients: An update to treatment, challenges, and future directions. Pigment Cell Melanoma Res. 33 (4), 527-541 (2020).
- Khaled, M. L., Tarhini, A. A., Forsyth, P. A., Smalley, I., Pina, Y. Leptomeningeal disease (LMD) in patients with melanoma metastases. Cancers (Basel). 15 (6), 1884 (2023).
- Smalley, I., et al. Proteomic analysis of CSF from patients with leptomeningeal melanoma metastases identifies signatures associated with disease progression and therapeutic resistance). Clin Cancer Res. 26 (9), 2163-2175 (2020).
- Larkin, J., et al. Five-year survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med. 381, 1535-1546 (2019).
- Boire, A., et al. Complement component 3 adapts the cerebrospinal fluid for leptomeningeal metastasis. Cell. 168 (6), 1101-1113 (2017).
- Chi, Y., et al. Cancer cells deploy lipocalin-2 to collect limiting iron in leptomeningeal metastasis. Science. 369 (6501), 276-282 (2020).
- Law, V., et al. A preclinical model of patient-derived cerebrospinal fluid circulating tumor cells for experimental therapeutics in leptomeningeal disease from melanoma. Neuro Oncol. 24 (10), 1673-1686 (2022).
- Carmona-Ule, N., et al. Short-term ex vivo culture of CTCs from advance breast cancer patients: Clinical implications. Cancers (Basel). 13 (11), 2668 (2021).
- Zhang, L., et al. The identification and characterization of breast cancer CTCs competent for brain metastasis. Sci Transl Med. 5 (180), (2013).
- Yu, M., et al. Cancer therapy: Ex vivo culture of circulating breast tumor cells for individualized testing of drug susceptibility. Science. 345 (6193), 216-220 (2014).
- Mohamed, B. M., et al. Ex vivo expansion of circulating tumour cells (CTCs). Sci Rep. 13 (1), 3704 (2023).
- Decimo, I., Fumagalli, G., Berton, V., Krampera, M., Bifari, F. Meninges: From protective membrane to stem cell niche. Am J Stem Cells. 1 (2), 92-105 (2012).
- Mercier, F., Hatton, G. I. Connexin 26 and basic fibroblast growth factor are expressed primarily in the subpial and subependymal layers in adult brain parenchyma: Roles in stem cell proliferation and morphological plasticity. J Comp Neurol. 431 (1), 88-104 (2001).
- Stylianopoulou, F., Herbert, J., Soares, M. B., Efstratiadis, A. Expression of the insulin-like growth factor II gene in the choroid plexus and the leptomeninges of the adult rat central nervous system. Proc Natl Acad Sci U S A. 85 (1), 141-145 (1988).
- Nordqvist, A. C., Mathiesen, T. Expression of IGF-II, IGFBP-2, -5, and -6 in meningiomas with different brain invasiveness. J Neurooncol. 5, 19-26 (2002).
- Zumkeller, W., Westphal, M. The IGF/IGFBP system in CNS malignancy. Mol Pathol. 54 (4), 227-229 (2001).
- Wang, L., et al. Promise and limits of the CellSearch platform for evaluating pharmacodynamics in circulating tumor cells. Semin Oncol. 43 (4), 464-475 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8, 160 (2023).
- Chen, J., et al. The development and improvement of immunodeficient mice and humanized immune system mouse models. Front Immunol. 13, 1007579 (2022).
- Law, V., et al. A Murine Ommaya xenograft model to study direct-targeted therapy of leptomeningeal disease. J Vis Exp. (167), e62033 (2021).
- Stacer, A. C., et al. NanoLuc reporter for dual luciferase imaging in living animals. Mol Imaging. 12 (7), 1-13 (2013).
- Luo, Y. T., et al. The viable circulating tumor cells with cancer stem cells feature, where is the way out. J Exp Clin Cancer Res. 37, 38 (2018).
- Stumm, R., Kolodziej, A., Schulz, S., Kohtz, J. D., Hollt, V. Patterns of SDF-1alpha and SDF-1gamma mRNAs, migration pathways, and phenotypes of CXCR4-expressing neurons in the developing rat telencephalon. J Comp Neurol. 502 (3), 382-399 (2007).
- Aviezer, D., et al. basal lamina proteoglycan, promotes basic fibroblast growth factor-receptor binding, mitogenesis, and angiogenesis. Cell. 79 (6), 1005-1013 (1994).
- Tiwary, S., et al. ERBB3 is required for metastasis formation of melanoma cells. Oncogenesis. 3 (7), e110 (2014).
- Sun, X., et al. miR-7 reverses the resistance to BRAFi in melanoma by targeting EGFR/IGF-1R/CRAF and inhibiting the MAPK and PI3K/AKT signaling pathways. Oncotarget. 7 (33), 53558-53570 (2016).
- Satyamoorthy, K., Li, G., Vaidya, B., Patel, D., Herlyn, M. Insulin-like growth factor-1 induces survival and growth of biologically early melanoma cells through both the mitogen-activated protein kinase and beta-catenin pathways. Cancer Res. 61 (19), 7318-7324 (2001).
- Lin, N. U., et al. Tucatinib vs Placebo, both in combination with Trastuzumab and Capecitabine, for previously treated ERBB2 (HER2)-positive metastatic breast cancer in patients with brain metastases: Updated exploratory analysis of the HER2CLIMB randomized clinical trial. JAMA Oncol. 9 (2), 197-205 (2023).
- Russo, A., et al. Ceritinib-induced regression of an insulin-like growth factor-driven neuroepithelial brain tumor. Int J Mol Sci. 20 (17), 4267 (2019).
- Ohsie, S. J., Sarantopoulos, G. P., Cochran, A. J., Binder, S. W. Immunohistochemical characteristics of melanoma. J Cutan Pathol. 35 (5), 433-444 (2008).
- Kulasinghe, A., et al. Short term ex-vivo expansion of circulating head and neck tumour cells. Oncotarget. 7 (37), 60101-60109 (2016).
- Li, X., et al. Clinical significance of detecting CSF-derived tumor cells in breast cancer patients with leptomeningeal metastasis. Oncotarget. 9 (2), 2705-2714 (2018).
- Lelliott, E. J., et al. A novel immunogenic mouse model of melanoma for the preclinical assessment of combination targeted and immune-based therapy. Sci Rep. 9 (1), 1225 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved