Ex Vivo Cultura de Células Tumorais Circulantes no Líquido Cefalorraquidiano de Pacientes com Melanoma para Estudo da Doença Leptomeníngea Associada ao Melanoma
In This Article
Summary
Este artigo descreve um protocolo para a propagação de células tumorais circulantes do líquido cefalorraquidiano (LCR-CTCs) coletadas de pacientes com doença leptomeníngea associada ao melanoma (M-LMD) para desenvolver modelos pré-clínicos para estudar M-LMD.
Abstract
A doença leptomeníngea associada ao melanoma (M-LMD) ocorre quando as células tumorais circulantes (CTCs) entram no líquido cefalorraquidiano (LCR) e colonizam as meninges, as camadas de membrana que protegem o cérebro e a medula espinhal. Uma vez estabelecido, o prognóstico para pacientes com LMD é sombrio, com sobrevida global variando de semanas a meses. Isso se deve principalmente à escassez de nossa compreensão da doença e, como consequência, à disponibilidade de opções de tratamento eficazes. Definir a biologia subjacente do M-LMD melhorará significativamente a capacidade de adaptar as terapias disponíveis para o tratamento do M-LMD ou projetar novos inibidores para esta doença universalmente fatal. Uma grande barreira, no entanto, reside na obtenção de quantidades suficientes de CTCs do LCR derivado do paciente (CSF-CTCs) para realizar experimentos pré-clínicos, como caracterização molecular, análise funcional e estudos de eficácia in vivo . A cultura de CSF-CTCs ex vivo também provou ser um desafio. Para resolver isso, é desenvolvido um novo protocolo para a cultura de M-LMD CSF-CTCs derivados de pacientes ex vivo e in vivo . A incorporação de meios condicionados produzidos por células meníngeas humanas (HMCs) é considerada crítica para o procedimento. A análise do arranjo de citocinas revela que os fatores produzidos pelos HMCs, como proteínas de ligação ao fator de crescimento semelhante à insulina (IGFBPs) e fator de crescimento endotelial vascular-A (VEGF-A), são importantes para apoiar a sobrevivência ex vivo do LCR-CTC. Aqui, a utilidade das linhas isoladas de LCR-CTC derivadas do paciente é demonstrada na determinação da eficácia dos inibidores que têm como alvo as vias de sinalização do fator de crescimento semelhante à insulina (IGF) e da proteína quinase ativada por mitógeno (MAPK). Além disso, é demonstrada a capacidade de inocular intratecalmente essas células in vivo para estabelecer modelos murinos de M-LMD que podem ser empregados para testes pré-clínicos de terapias aprovadas ou novas. Essas ferramentas podem ajudar a desvendar a biologia subjacente que impulsiona o estabelecimento do LCR-CTC nas meninges e identificar novas terapias para reduzir a morbidade e a mortalidade associadas ao M-LMD.
Introduction
A doença leptomeníngea (LMD) ocorre quando as células tumorais circulantes (CTCs) se disseminam no líquido cefalorraquidiano (LCR) e estabelecem nas meninges, a membrana que envolve o cérebro e a medula espinhal 1,2. LMD pode ocorrer em vários tipos de câncer, mas é particularmente prevalente no melanoma. Em estágios avançados do melanoma, aproximadamente 5% dos pacientes desenvolverão M-LMD associado ao melanoma 2,3. Embora relativamente baixas em relação a outros locais de metástase, as consequências do M-LMD são devastadoras, com sobrevida global variando de semanas a meses, e é um contribuinte significativo para a morbidade do paciente 1,3,4. Isso se deve principalmente à escassez de opções de tratamento eficazes, combinada com grandes lacunas em nosso conhecimento sobre como as leptomeninges são colonizadas por células de melanoma2. Portanto, a compreensão da biologia do M-LMD facilitará o desenvolvimento de novas terapias para melhorar os resultados clínicos.
Relatórios recentes mostraram como as CTCs colonizam o microambiente único do LCR. Por exemplo, o complemento C3 promove a invasão de células tumorais no LCR através do plexo coróide, uma intrincada rede de vasos sanguíneos em cada ventrículo do cérebro5. Além disso, em resposta aos escassos micronutrientes no LCR, as CTCs podem regular positivamente a lipocalina-2, uma proteína eliminadora de ferro, e seu receptor SLC22A17 para aumentar a sobrevida6. Usando análises ômicas do LCR, nosso grupo também descobriu que o LCR é enriquecido com proteínas que regulam a sinalização do fator de crescimento semelhante à insulina (IGF), bem como a imunidade inata3. Juntos, esses dados enfatizam o valor das CTCs-LCR de biópsias líquidas para estudar M-LMD.
Embora as CTCs-LCR às vezes possam ser identificadas por amostragem de LCR do paciente por punção lombar, reservatório de Ommaya ou autópsias rápidas, uma grande limitação é obter um número suficiente dessas células raras e frágeis 1,7. Por exemplo, usando a técnica de enumeração CTC, apenas várias centenas a vários milhares de células tumorais são identificáveis por amostra de LCRdo paciente 7, o que dificulta a realização de análises moleculares e funcionais in vitro ou in vivo. Embora tenha havido relatos de sucesso no crescimento breve de CTCs ex vivo a partir do sangue periférico (ou seja, CTCs de câncer de mama) 8 , 9 , 10 , essas células geralmente crescem apenas a curto prazo, e não houve casos relatados de capacidade de cultivar CTCs de melanoma no LCR. Portanto, encontrar maneiras de propagar CSF-CTCs de melanoma, ou CTCs em geral, será altamente benéfico para estudar a biologia do M-LMD 7,11.
Pela primeira vez, uma nova técnica para propagar CSF-CTCs de pacientes com M-LMD ex vivo é descrita. Aqui neste relatório, foi desenvolvido um protocolo detalhado que permite a cultura e expansão de CTCs-LCR de pacientes com LMD M. Uma vez que as meninges secretam uma variedade de fatores de crescimento, como FGF, IGF, VEGF-A e IGFBPs que suportam o crescimento ao redor de seu ambiente 12,13,14,15,16, foi racionalizado que as CTCs-LCR podem exigir que esses componentes cresçam em condições ex vivo. Portanto, este protocolo usa meios condicionados gerados pela cultura de células meníngeas humanas (HMCs-) in vitro. Para inoculação in vivo, células derivadas de pacientes são inoculadas em camundongos imunodeficientes para gerar linhas de CSF-CTCs derivadas de pacientes (PD-CSF-CTCs). A disponibilidade de células M-LMD derivadas de pacientes apoiará ensaios celulares, moleculares e funcionais para estudar M-LMD e propor novas estratégias de tratamento para esta doença mortal.
Protocol
A coleta de amostras de LCR de pacientes não identificadas foi aprovada pelo Conselho de Revisão Institucional (IRB) da Universidade do Sul da Flórida (MCC 50103, 50172 e 19332). Pacientes com LMD-M podem ser diagnosticados de várias maneiras, incluindo citologia positiva do LCR, uma ressonância magnética (RNM) característica do cérebro e/ou coluna vertebral ou uma combinação de achados clínicos com achados sugestivos de ressonância magnética. O LCR desses pacientes com M-LMD foi coletado rotineiramente como parte de seu tratamento clínico padrão. Nenhum procedimento é realizado a menos que haja indicação clínica. O consentimento informado foi obtido dos pacientes para coleta de amostras e uso para pesquisa e publicação. A geração de modelos in vivo murino-LMD foi aprovada pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade do Sul da Flórida (IACUC# IS00010398). O esquema geral deste protocolo está resumido na Figura 1. Os detalhes dos reagentes e equipamentos usados no estudo estão listados na Tabela de Materiais.
1. Preparação de meios condicionados por HMC
- Pré-revestir um balão T175 com poli-L-lisina a 2 μg/cm2.
- Colocar o balão numa estufa a 37 °C durante 1 h.
- Aspirar a solução de poli-L-lisina com uma pipeta serológica estéril. Não é necessário enxaguar o balão e está pronto para a cultura HMC.
- Cultura de aproximadamente 1,0 x 106 HMCs em 30 mL de meio de cultura meníngeo completo (MenCM), que contém 5% de soro fetal bovino, 1% de suplemento de crescimento de células meníngeas e 100 UI / mL de solução antibiótica de penicilina-estreptomicina por frasco. Cultivar as células na incubadora de cultura de células em condições normais de cultura de tecidos a 37 °C e 5% de CO2.
- Mude de mídia a cada 3 dias.
- Quando as células atingirem aproximadamente 75%-80% de confluência, colete e guarde o meio cultivado HMC em um tubo cônico de 50 mL.
- Divida os HMCs em novos frascos T175 e MenCM completo e fresco se forem necessários mais meios cultivados com HMC.
- Aos meios cultivados do HMC, adicione uma proporção de 1:1 de MenCM completo.
- Adicione 20 ng/mL de fator de crescimento de fibroblastos (FGF) e 20 ng/mL de fator de crescimento epidérmico (EGF), que se tornarão o meio condicionado por HMC para CSF-CTCs.
NOTA: Recomenda-se adicionar FGF e EGF frescos quando as CTCs estiverem prontas para o cultivo. - Armazene mídia condicionada em HMC em alíquotas de 50 mL a 4 °C.
NOTA: Recomenda-se que os suportes acondicionados em HMC em alíquotas sejam armazenados a 4 °C, mas não mais de 4 semanas.
2. Coleta de LCR e processamento de amostras
- Centrifugue o pré-frio ajustando-o para 4 °C.
- Uma vez retirada do paciente, coloque a amostra de LCR em um tubo cônico de 15 mL no gelo imediatamente para mantê-la fria.
NOTA: Nosso protocolo aprovado pelo IRB permite a coleta de 7,5 mL de LCR do paciente consentido. - Centrifugar o LCR a 257 x g durante 5 min a 4 °C.
- Remova, salve e faça alíquotas do sobrenadante do LCR sem perturbar o grânulo celular na parte inferior. As alíquotas sobrenadantes do LCR podem ser armazenadas congeladas a -80 °C, se necessário, para análise posterior.
NOTA: O pellet pode não ser visível a olho nu; portanto, sugere-se deixar ~ 40-50 μL no fundo do tubo. - No mesmo tubo, adicione 1 mL de solução salina estéril tamponada com fosfato (PBS) para ressuspender e enxaguar as células e repita a centrifugação a 257 x g por 5 min a 4 °C.
NOTA: (Opcional) Realize a lise dos glóbulos vermelhos (RBC) se a amostra contiver contaminação do sangue. No entanto, lembre-se de que algumas células podem ser perdidas durante o processo, incluindo CTCs. As CTCs podem ser propagadas sem o procedimento de lise de hemácias. - Remova e descarte o PBS sem perturbar o pellet celular e deixe ~ 50 μL no fundo.
- Execute a contagem de células para determinar a viabilidade celular. A partir daqui, existem duas opções para prosseguir com o cultivo de LCR-CTCs: cultura in vitro (etapa 3) ou tentativa de expansão de xenoenxerto derivada de paciente in vivo (etapa 4).
NOTA: Se as CTCs-LCR forem cultivadas posteriormente, criopreserve as células em meios de congelamento de cultura de células até que estejam prontas para propagação. Os meios de congelamento de cultura de células podem ser feitos usando 90% FBS + 10% DMSO. Se houver excesso de LCR disponível (ou seja, mais de uma coleta de LCR de pacientes ou LCR coletado na autópsia), as CTCs podem ser avaliadas enviando a amostra para o ensaio de enumeração CTC17 ou coloração de imunofluorescência (IF) para marcador de melanoma (ou seja, anti-MLANA), que pode fornecer informações sobre a quantidade e viabilidade das CTCs. As células não podem ser recuperadas após a realização desses experimentos. Portanto, não é recomendado se não houver amostras de LCR de backup do paciente.
3. Cultura in vitro e expansão de CSF-CTCs
- Ressuspenda os CSF-CTCs em meios condicionados por HMC. Se as CTCs-LCR forem criopreservadas, descongele as células, gire-as e lave-as suavemente com PBS.
- Divida todas as células em poços triplicados em uma placa de 96 poços com volume de 150 μL por poço. Apenas células viáveis aderirão levemente à superfície durante a noite.
NOTA: O número de LCR-CTCs pode variar muito por amostra de paciente (Tabela 1). Para pacientes com baixa contagem de CTC, uma placa de 96 poços é usada como ponto de partida para a cultura, e todo o pellet é plaqueado sem contar por medo de perder CTCs. No entanto, se houver uma quantidade maior de LCR (ou seja, obtida de uma autópsia), é possível contar as células. Nem todas as células tumorais podem crescer ex vivo; alguns se expandirão lentamente por várias passagens antes de se tornarem estáticos. Atualmente, a chance de sucesso do crescimento de CTCs-LCR de melanoma ex vivo é de aproximadamente 60%7. - A cada 3 dias, complete adicionando um novo meio condicionado com HMC ou remova suavemente o meio colocando a ponta da pipeta na lateral do poço, deixando um pouco de líquido para trás sem perturbar o fundo do poço e, em seguida, substitua-o por um novo meio condicionado com HMC.
- Quando as CSF-CTCs ex vivo se expandirem e se tornarem 90% confluentes, tripsinize e transfira todo o poço para um novo poço em uma placa de 24 poços. Quando o poço em um poço de 24 poços for confluente, transfira-o para uma placa de 12 poços, depois para uma placa de 6 poços e assim por diante.
NOTA: Após a tripsinização, considere a criopreservação de um pequeno subconjunto de CTCs em meios de congelamento de cultura de células (10% DMSO + 90% FBS) antes de plaquear como backup. - Continue cultivando CTCs. Algumas células podem se propagar a curto prazo e, eventualmente, tornar-se estáticas. No entanto, um ou mais clones podem se transformar e expandir exponencialmente (Figura 2A). Selecione esses clones, que se tornarão as culturas de CSF-CTC (PD-CSF-CTCs) derivadas de pacientes in vitro.
NOTA: Se esses clones ficarem superlotados ou agrupados, tripsinize e replaquete as células em uma placa/frasco de cultura de tecidos frescos.
4. Inoculação in vivo de CSF-CTCs para gerar xenoenxerto derivado de linhagem celular (CDX) ou modelo de xenoenxerto derivado de paciente (PDX)
NOTA: Um modelo PDX envolve o enxerto de células cancerígenas diretamente de um paciente com câncer (sem cultura ex vivo ), enquanto o modelo CDX usa linhagens de células cancerígenas ou, neste caso, CTCs que foram propagadas e imortalizadas18.
- Use camundongos fêmeas imunodeficientes de 6-8 semanas NOD SCID gama (NSG) para inoculação de CSF-CTCs. Os NSGs são usados porque são severamente imunodeficientes e são muito receptivos ao enxerto de células tumorais humanas19. Devido às suas deficiências imunológicas, esses camundongos devem ser mantidos em um ambiente higiênico estritamente controlado e devem ser alojados isolados de outras linhagens de camundongos. O método para renderizar LMD murino foi descrito em detalhes em outro lugar20.
NOTA: células ex vivo (CSF-CTCs de pacientes que só foram processadas na etapa 2 sem cultura) são usadas para gerar o modelo PDX; a observação física do animal e a ressonância nuclear magnética (RNM) do cérebro são necessárias para determinar a progressão do LMD. Por outro lado, com o modelo CDX usando in vitro, PD-CSF-CTCs podem ser marcados com um repórter de luciferase, e o status do LMD pode ser avaliado por imagem bioluminescente (BLI). O sistema de marcação celular usado neste relatório é um repórter NanoLuc (NL) que utiliza furimazina como substrato, o que demonstrou aumentar a sensibilidade proporcionalmente ao crescimento do tumor21. Não foi observada interferência do crescimento de células CTC (in vitro ou in vivo) pela expressão de NL. - Verifique se há sinais de progressão do LMD usando estes métodos: observação física: perda de peso, inclinação da cabeça e costas curvadas. RM: ventrículos aumentados e sinais de hidrocefalia (Figura 2B). BLI: sinais bioluminescentes positivos na região do SNC (Figura 2C).
5. Coleta de LCR de camundongos com LMD para posterior expansão do clone
- Anestesiar o camundongo NSG com LMD com isoflurano a 4% (seguindo protocolos aprovados institucionalmente) até que não apresente sinais do reflexo de endireitamento.
- Prepare o rato raspando o pelo de toda a superfície ventral da cabeça e prepare a pele usando a técnica estéril.
- Posicione o nariz usando um cone nasal em forma de L modificado do aparelho estereotáxico, garantindo que as narinas permaneçam desobstruídas. Prenda a pele puxando-a suavemente para frente através das superfícies ventrais de ambas as auriculares com fita adesiva, fixando-a no cone do nariz e, em seguida, dobrando o pescoço em um ângulo de aproximadamente 90 ° depois de prendê-la. Administre 1,5% -3% de isoflurano para manter a anestesia.
- Estendendo totalmente o pescoço e começando apenas entre as pinas, guie as pontas da tesoura cirúrgica para baixo através do osso occipital com uma leve pressão.
NOTA: Nesta posição da linha média, uma depressão sutil é discernível quando as pontas da tesoura entram na área côncava sobre a cisterna magna. - Crie uma pequena incisão na linha média medindo 5-7 mm logo acima da concavidade palpada.
- Use pinças de ponta romba com pontas de 1-2 mm para aplicar pressão suavemente na cisterna magna. Introduza as pontas na posição fechada e abra-as enquanto exerce pressão para baixo na dura-máter.
- Repita o processo de dissecção romba conforme descrito na etapa 6 até que a membrana dural seja claramente discernível e os vasos sanguíneos associados sejam visíveis dentro da área exposta.
- Enquanto mantém a pinça aberta para retrair a musculatura circundante, insira uma agulha de 27-29 G presa a uma seringa de 1 mL abaixo da dura-máter para visualizar o chanfro. Certifique-se de que a agulha penetre um pouco além do chanfro. Retraia gradualmente o êmbolo da seringa.
- Colete o máximo de LCR possível (geralmente entre 15-30 μL) antes da eutanásia do camundongo.
NOTA: A eutanásia é realizada, seguindo protocolos aprovados institucionalmente, expondo o sujeito a concentrações crescentes de gás CO2 comprimido. Por exemplo, uma taxa de deslocamento de 30% a 70% do volume da câmara por minuto será empregada para prevenir ou reduzir o desconforto ou angústia. Isso é seguido pela garantia da cessação dos movimentos cardiovasculares e respiratórios por meio da observação prolongada em ar ambiente por mais de 10 minutos. - Implante o LCR da seringa em um tubo de microcentrífuga e coloque-o no gelo.
- Centrifugar a amostra a 257 x g durante 5 min a 4 °C e remover cuidadosamente o líquido (congelar a amostra de LCR de ratinho a -80 °C, se necessário para análise posterior) sem perturbar o sedimento celular.
- Adicione 500 μL de PBS estéril e lave o pellet celular; Repita a rotação a 257 x g por 5 min em temperatura ambiente.
- Ressuspenda as células em meios condicionados por HMC em uma placa de 96 poços.
NOTA: As CTCs-LCR que foram enxertadas in vivo e cultivadas com sucesso em LMD devem ser capazes de crescer como culturas de células normais. Continue a expandir trocando de mídia a cada 3 dias. Tripsinize e transfira células para um aparelho de cultura celular maior quando as células estiverem confluentes. Essas células se tornarão as culturas in vivo PD-CSF-CTC. No relatório atual, houve uma taxa de sucesso de 100% com o modelo CDX e ainda não gerou um PDX M-LMD.
Representative Results
Compreender os requisitos para o crescimento bem-sucedido de CSF-CTCs ex vivo é um esforço contínuo. Para tanto, acredita-se que o fornecimento de fatores essenciais que mimetizam o microambiente do LCR é de fundamental importância22. As células meníngeas humanas (HMCs) secretam uma variedade de fatores de crescimento no LCR, incluindo FGF-2, EGF, IGFBP2 e IGFBP6, e são conhecidas por apoiar o crescimento de células CTC 12,13,14,23,24. Portanto, uma análise de matriz de citocinas humanas foi realizada em meio condicionado por HMC para identificar componentes potencialmente importantes necessários para a sobrevivência da CTC. De fato, vários fatores de crescimento foram regulados positivamente nos meios cultivados com HMCs (Figura 3A). Por exemplo, fator estimulador de colônias de granulócitos-macrófagos (GM-CSF), VEGF-A e IGFBPs (IGFBP2, 3, 4 e 6).
Os componentes celulares do LCR dos pacientes podem consistir em vários tipos de células, como CTCs, células imunes e fibroblastos. Os não-CTCs acabarão parando de passar horas extras. Geralmente, as células que se propagam com sucesso e permanecem em proliferação são células cancerígenas (M-LMD). A validação de células em crescimento em cultura é de fato células M-LMD, o que pode ser feito pela detecção de IF da expressão de MLANA e análises transcriptômicas, que já foram demonstradasanteriormente 7.
Como prova de conceito para mostrar o potencial de uso e aplicação de linhagens PD-CSF-CTC estabelecidas in vitro e in vivo, foi utilizada a análise de sequenciamento de RNA de célula única (scRNA-seq), e os resultados revelaram vários genes que foram enriquecidos e retidos do paciente não cultivado CSF-CTCs7. Dois deles incluem o receptor tirosina-proteína quinase ErbB3 e IGF-1R, que têm implicações na progressão do melanoma e na resistência à quimioterapia 25,26,27.
Para testar se eles desempenharam um papel na sobrevivência do LCR-CTC, um ensaio de proliferação de cristal violeta foi realizado em PD-CSF-CTCs tratados com medicamentos aprovados pela FDA tucatinibe e ceritinibe que têm como alvo ErbB28 e IGF-1R 7,29, respectivamente. O anticorpo anti-IGFBP2 foi incluído como um controle positivo que deve impedir o crescimento das culturas de PD-CSF-CTC. Os resultados mostraram que a ausência de IGFBP2 ou IGF-1R foi eficaz na redução da proliferação de PD-CSF-CTCs (Figura 3B). Dado que a sinalização MAPK está a jusante do IGF-1R, a coloração de células vivas calceína-AM e os ensaios de sobrevivência de células MTT também foram realizados em três linhas M-LMD PD-CSF-CTC, tratando-as com ceritinibe ou inibidores de MAPK, dabrafenibe e trametinibe ou uma combinação dos três. Os dados demonstraram que a viabilidade de todas as três linhagens celulares foi significativamente reduzida pelo ceritinibe, enquanto o dabrafenibe e o trametinibe tiveram efeitos mistos (Figura 3C). O resultado dos tratamentos com debrafenibe e trametinibe foi surpreendente. Todas as três linhas de PD-CSF-CTC foram derivadas de pacientes com M-LMD que abrigavam uma mutação BRAFV600E 7. Isso pode sugerir um efeito de quimiorresistência adquirido das CTCs-LCR, que é algo a ser investigado no futuro.
Em seguida, como exemplo de como PD-CSF-CTCs podem ser utilizados in vivo, modelos murinos-M-LMD foram estabelecidos por inoculação intratecal com números variados de PD-CSF-CTCs. Os tempos médios de sobrevivência em camundongos foram determinados (Figura 3D). Para visualizar a progressão do M-LMD, as linhas PD-CSF-CTC foram marcadas com um marcador bioluminescente, como o NL reportersystem 21, e capturadas pelo BLI (Figura 2C). A localização das metástases LMD também foi demonstrada usando imuno-histoquímica com a proteína melan-A (MLANA)30 como marcador das células do melanoma (Figura 3E). Como prova de conceito para testar estratégias terapêuticas contra M-LMD in vivo, coortes murinas de M-LMD receberam monoterapia oral diária de ceritinibe ou trametinibe, ou uma combinação de dabrafenibe e trametinibe ou ceritinibe e trametinibe. A coorte controle (não tratada) recebeu solução salina oral como comparação. Os resultados mostraram uma sobrevida significativamente prolongada (Figura 3F) e detecção tardia da doença (Figura 3G) na coorte que foi tratada com ceritinibe e trametinibe (sobrevida média de M-LMD não tratada: 28,5 dias vs. sobrevida média de M-LMD tratada com ceritinibe e trametinibe: 38,5 dias; Valor de p = 0,0052). Esses dados ressaltam a utilidade potencial das linhas M-LMD PD-CSF-CTC desenvolvidas para a realização de estudos pré-clínicos para determinar a eficácia de novas terapêuticas.
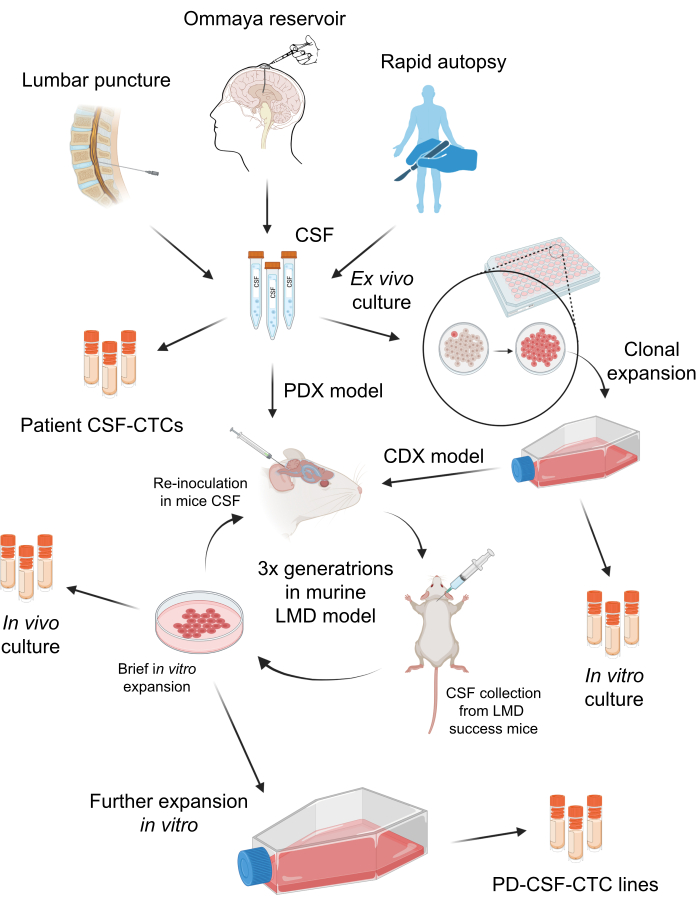
Figura 1: Uma visão geral esquemática do processo de estabelecimento de células tumorais circulantes de LCR derivadas de pacientes (PD-CSF-CTCs). O LCR dos pacientes pode ser coletado por punção lombar, reservatório de Ommaya ou autópsias rápidas. Por meio de uma série de propagações in vitro e in vivo , cada etapa gera uma cultura intermediária de LCR-CTC (ou seja, CSF-CTCs de pacientes, cultura in vitro , cultura in vivo ) até estabelecer uma linha PD-CSF-CTC. Clique aqui para ver uma versão maior desta figura.
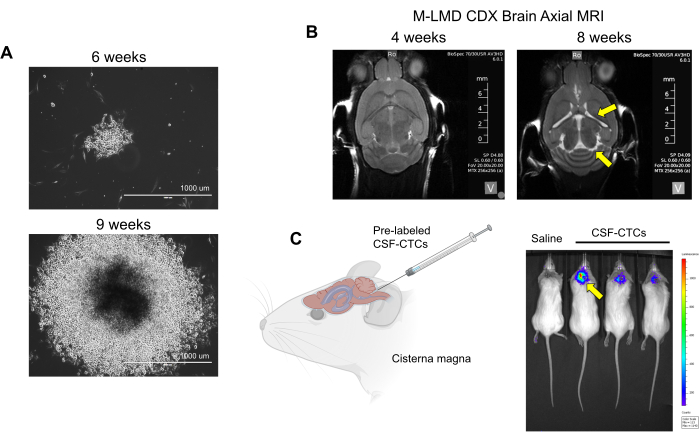
Figura 2: Exemplos de cultura in vitro e in vivo de CSF-CTCs derivadas de pacientes com M-LMD. (A) Imagens representativas de campo claro mostrando o crescimento in vitro de uma colônia M-LMD CSF-CTC em 6 semanas e 9 semanas em meio condicionado por HMC. Barra de escala: 1000 μm. (B) Imagens de ressonância magnética em 4 semanas e 8 semanas após inoculação intratecal com PD-CSF-CTCs; um estabelecimento bem-sucedido de um modelo murino de M-LMD. As setas amarelas apontam para ventrículos aumentados e possível hidrocefalia neste camundongo M-LMD. (C) Visualização representativa do BLI do desenvolvimento de M-LMD em camundongos. A figura é adaptada de Law et al.7. Clique aqui para ver uma versão maior desta figura.
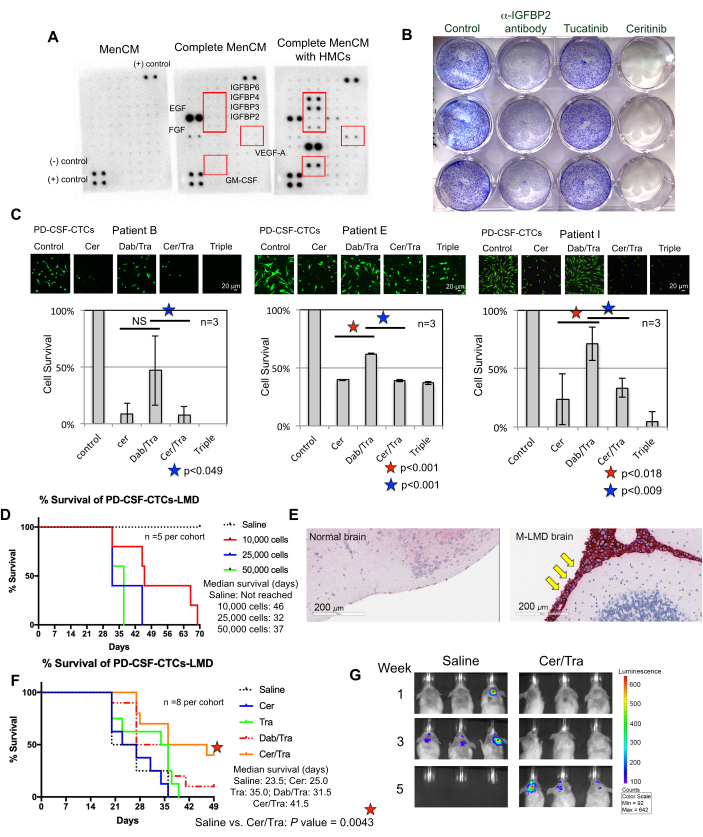
Figura 3: As linhas PD-CSF-CTC são usadas em vários experimentos pré-clínicos para estudar o M-LMD. (A) Uma matriz de citocinas humanas mostrando um aumento de diferentes fatores de crescimento secretados (ou seja, IGFBPs, VEGF-A e GM-CSF) em meios de cultura (MenCM) na presença de células meníngeas humanas (HMCs). (B) Uma imagem digitalizada de um ensaio de proliferação de células violetas cristalinas para determinar a eficácia do anticorpo anti-IGFBP2, tucatinibe e ceritinibe contra uma das linhas PD-CSF-CTC. A condição de controle recebeu tratamento veicular. O experimento foi realizado em triplicata. (C) Ensaio de sobrevivência celular de três diferentes linhas PD-CSF-CTC estabelecidas (dos pacientes 09, 12 e 16) in vitro. As células foram tratadas com ceritinibe (cer), uma combinação de dabrafenibe (dab) + trametinibe (tra), cer + tra ou todos os três. As células foram coletadas 72 h após o tratamento. A coloração Calcein-AM foi usada para visualizar a viabilidade celular e um ensaio de MTT foi usado para determinar a sobrevivência celular. Um teste t de amostra pareada foi usado para análise estatística. Barras de escala: 20 μm. (D) Uma curva de sobrevivência de um modelo M-LMD murino. Camundongos NSG foram inoculados intratecalmente (via cisterna magna) com uma das linhas PD-CSF-CTC em 10.000, 20.000 e 50.000 células. A sobrevida média de camundongos M-LMD foi determinada. (E) Detecção de IHC para MLANA, um marcador de melanoma, nas seções cerebrais de camundongos M-LMD. MLANA positivo foi encontrado nas meninges (coradas em vermelho; apontadas por setas amarelas), enquanto o cérebro normal (saudável) não apresentou crescimento de câncer (negativo para MLANA). Barras de escala: 200 μm. (F) Um experimento de eficácia representativo de coortes M-LMD murinas que receberam solução salina oral diária, cer, tra, dab / tra ou cer / tra. A sobrevivência dos camundongos foi determinada. O teste de log-rank (Mantel-Cox) foi utilizado para análise estatística. (G) Imagens BLI representativas da progressão do M-LMD em 5 semanas, comparando o controle (solução salina) tratado vs. coortes M-LMD murinas tratadas com cer/tra. O painel (C) da figura é adaptado de Law et al.7. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Resumo das CTCs-LCR clínicas obtidas para cultura ex vivo em pacientes com M-LMD. Uma tabela resumida de 11 pacientes com LMD M, que seus LCR-CTCs foram tentados a propagar. Os pacientes da Tabela foram previamente caracterizados em Law et al.7. Clique aqui para baixar esta tabela.
Discussion
O M-LML é uma doença devastadora e universalmente fatal, e há uma necessidade urgente de encontrar melhores estratégias de tratamento. Uma das principais barreiras para o estudo do LMD-M é a incapacidade de adquirir CTCs-LCR suficientes para realizar estudos moleculares e funcionais 1,7. Embora existam métodos existentes para cultivar CTCs de sangue periférico e LCR de outros tipos de câncer, como câncer de mama e ovário 11,31,32, esses métodos de propagação de CTC são geralmente de curto prazo e não houve sucesso relatado na cultura de CSF-CTCs de melanoma. Além disso, as metodologias atuais para propagação de CTCs existem em ambientes ex vivo de curto prazo e ainda não produziram um modelo LMD in vivo derivado de células LMD de pacientes. Aqui, um novo protocolo é apresentado para cultivar essas células in vitro e in vivo, levando a linhagens celulares únicas derivadas de pacientes. Atualmente, de 11 pacientes com M-LMD no estudo, havia uma chance de aproximadamente 60% (7 de 11) de sucesso na propagação de M-LMD CSF-CTCs in vitro, e isso foi reduzido para ~ 20% (2 de 11) in vivo usando o método CDX7.
É claro que as condições in vitro não recapitulam o microambiente do LCR. No entanto, abordagens proteômicas foram realizadas anteriormente para estudar componentes proteicos no LCR e forneceram alguns insights sobre os principais fatores necessários para o crescimento da CTC ex vivo3. Por exemplo, foi identificado que uma das principais vias que promovem a sobrevida da CTC em pacientes com M-LMD estava associada ao aumento das atividades relacionadas ao IGF 3,7. Além disso, estudos mostraram que as leptomeninges secretam uma variedade de citocinas / fatores de crescimento no LCR, incluindo FGF-2, EGF, GM-CSF e proteínas relacionadas à sinalização de IGF12. De fato, isso foi recapitulado na mídia cultivada com HMCs, apoiando um papel potencial para esses fatores de crescimento na promoção do crescimento do CSF-CTC.
Uma grande vantagem na geração de um modelo PDX (ou CDX) é a capacidade de obter insights mais profundos sobre a patologia da doença, algo que falta nas condições in vitro . Idealmente, uma abordagem PDX é preferida, uma vez que as CTCs-LCR seriam diretamente de pacientes sem cultura ex vivo . Inicialmente, foram feitas tentativas de criar o M-LMD usando essa abordagem, mas não foram bem-sucedidas até agora. A dificuldade em gerar camundongos PDX está possivelmente associada à abundância e integridade do material de partida (ou seja, muito poucas CTCs viáveis no LCR do paciente na coleta de rotina na clínica). Isso pode explicar por que tivemos sucesso superior no cultivo de CTCs a partir de LCR coletado na autópsia7. Para aumentar a probabilidade de propagação in vivo , este protocolo foi modificado para fornecer uma abordagem alternativa de CDX. As CTCs-LCR podem ser expandidas primeiro in vitro (etapa 3) para gerar linhagens de PD-CSF-CTC com maior potencial de crescimento e longo prazo. Essas células são então inoculadas em camundongos para criar M-LMD. Embora o método atual tenha gerado um número limitado de modelos IN VIVO CDX M-LMD (~ 20%), isso pode refletir a diversidade transcricional dos CSF-CTCs, a complexidade do microambiente do LCR e a dificuldade em cultivar essas células em geral. Postulamos que o desenvolvimento futuro de um modelo de camundongo humanizado pode aumentar a taxa de sucesso do enxerto, dada a importância do microambiente no apoio à viabilidade das células cancerígenas33.
Uma limitação da abordagem CDX é que apenas alguns clones foram selecionados de amostras de pacientes, e a deriva genética de células cancerígenas por meio de cultura ex vivo pode não refletir mais o perfil transcricional da fonte original. No entanto, foi relatado que, apesar do cultivo in vitro , as linhagens de PD-CSF-CTC mantiveram aproximadamente 97% de semelhança de expressão gênica com pacientes isolados e não cultivados CSF-CTCs7. Nesse estudo, as análises scRNA-seq revelaram assinaturas gênicas enriquecidas sobrepostas entre PD-CSF-CTCs in vitro não cultivadas e PD-CSF-CTCs in vivo , como SOX9, ErbB3 e IGF-1R7, sugerindo que estes podem ser potenciais alvos terapêuticos. Além disso, esses genes comumente enriquecidos estão envolvidos em vias biológicas associadas à regulação transcricional e ao metabolismo7. Coletivamente, isso destaca o valor translacional das culturas PD-CSF-CTC para uma melhor compreensão da biologia do M-LMD, identificando mecanismos moleculares direcionáveis e vias que impulsionam a doença e projetando terapias racionais em estudos futuros.
Embora a metodologia atual permaneça imperfeita, pois não há como predeterminar o status e a viabilidade das CTCs-LCR em pacientes com DML-M, várias observações foram feitas que aumentariam a probabilidade de sucesso, uma vez que as CTCs são em baixo número e bastante frágeis. Essas etapas críticas incluem a coordenação com a clínica para que as amostras de LCR sejam colocadas no gelo assim que forem retiradas e transportadas rapidamente para o laboratório para manter a integridade celular. Posteriormente, as CTCs-LCR devem ser processadas imediatamente, seja por plaqueamento em cultura ou criopreservação das células.
No geral, a cultura e a expansão das CTCs-LCR foram um processo de tentativa e erro, mas o estabelecimento deste protocolo para gerar células M-LMD derivadas de pacientes dará aos pesquisadores os recursos necessários para realizar experimentos com amostras de pacientes, o que não poderia ter sido feito anteriormente. Um dos principais objetivos no futuro é utilizar M-LMD PD-CSF-CTCs para conduzir caracterização molecular, triagem de medicamentos de alto rendimento e estudos de eficácia de medicamentos in vivo para projetar terapias racionais para tratar M-LMD. Acredita-se que essa abordagem levará a estratégias de tratamento que reduzirão muito a morbidade e a mortalidade associadas a esse aspecto atualmente fatal do melanoma metastático avançado.
Disclosures
Peter Forsyth atua em Conselhos Consultivos da Abvie Inc, Bayer, Bristol Meyers Squib, BTG, Inovio, Novocure, Tocagen e Ziopharm, fora do trabalho enviado. Todos os outros autores não têm nada a divulgar.
Acknowledgements
Gostaríamos de agradecer aos pacientes e familiares por sua extraordinária generosidade em doar tecidos para este estudo científico. Este trabalho foi apoiado por doações do National Institutes of Health concessões P50 CA168536, R21 CA256289, R21 CA216756 (para KSMS e PAF) K99 CA226679 (para IS). Fundo de Aceleração de Pesquisa da Fundação Moffitt (para BC e PAF), Programa de Biologia Química e Medicina Molecular da Moffitt (PAF e DD), Fundação Moffitt (PAF). Os Núcleos de Recursos Compartilhados de Genômica Molecular, Tecidos e Bioinformática e Bioestatística da Moffitt são apoiados em parte pelo Instituto Nacional do Câncer por meio de um Subsídio de Apoio ao Centro de Câncer (P30-CA076292) e pela Fundação Moffitt.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringe 27 - 29 G needles | Any vendor | n/a | 0.1 mm Sterile Filtered |
| 1.5 mL Eppendorf tubes | Any vendor | ||
| 15 ml and 50 mL polystyrene centrifuge tubes | Any vendor | n/a | |
| 6 - 8 weeks females NOD SCID gamma (NSG) mice | Charles River | Males optional | |
| Buprenorphine Sustained-Release (Bup-SR) | Zoopharm | DEA controlled | |
| Fetal bovine serum (FBS) | ScienCell | #0010 | |
| Gas inhalation anestehsia system | VeteEquip | #901812 | COMPAC5 |
| Hamilton microliter syringes | Hamilton | 10, 25, 50, and 100ml | 30 G for cisterna magna injection |
| Human basic fibroblast growth factor (bFGF) | Milipore Sigma (or any vender) | #F0291 | |
| Human epidermal growth factor (EGF) | Milipore Sigma (or any vender) | #SRP3027 | |
| Human meningeal cells (HMCs) isolated from human leptomeninges | ScienCell | #1400 | |
| IVIS 200 imaging system | Caliper Life Sciences | n/a | |
| Magnifying glass with light | Any vendor | n/a | |
| Meningeal Cell Culture Media (MenCM) | ScienCell | #1401 | |
| Meningeal cell growth supplement (MCGS) | ScienCell | #1452 | |
| MRI imaging | Bruker | BioSpec series | Optional |
| P1000, P200, P20 pipettes/ pipette tips | |||
| penicillin-streptomycin Antibiotic solution | ScienCell (or any vender) | #0503 | |
| Phosphate buffered saline (PBS) | Any vendor | n/a | 0.1 mm Sterile Filtered |
| Rodent Surgical Instruments (Scissors, Forceps) | Roboz Surgical Instrument (or any vendor) | ||
| Screw cap cryo tubes | |||
| Sterile blue paper/ drape covering | Any vendor | n/a | n/a |
| Sterile cotton sticks | Any vendor | n/a | |
| Tissue culture plates/flasks (96-well, 24-well, 12-well, 6-well, T175 etc.) |
References
- Glitza, I. C., et al. Leptomeningeal disease in melanoma patients: An update to treatment, challenges, and future directions. Pigment Cell Melanoma Res. 33 (4), 527-541 (2020).
- Khaled, M. L., Tarhini, A. A., Forsyth, P. A., Smalley, I., Pina, Y. Leptomeningeal disease (LMD) in patients with melanoma metastases. Cancers (Basel). 15 (6), 1884 (2023).
- Smalley, I., et al. Proteomic analysis of CSF from patients with leptomeningeal melanoma metastases identifies signatures associated with disease progression and therapeutic resistance). Clin Cancer Res. 26 (9), 2163-2175 (2020).
- Larkin, J., et al. Five-year survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med. 381, 1535-1546 (2019).
- Boire, A., et al. Complement component 3 adapts the cerebrospinal fluid for leptomeningeal metastasis. Cell. 168 (6), 1101-1113 (2017).
- Chi, Y., et al. Cancer cells deploy lipocalin-2 to collect limiting iron in leptomeningeal metastasis. Science. 369 (6501), 276-282 (2020).
- Law, V., et al. A preclinical model of patient-derived cerebrospinal fluid circulating tumor cells for experimental therapeutics in leptomeningeal disease from melanoma. Neuro Oncol. 24 (10), 1673-1686 (2022).
- Carmona-Ule, N., et al. Short-term ex vivo culture of CTCs from advance breast cancer patients: Clinical implications. Cancers (Basel). 13 (11), 2668 (2021).
- Zhang, L., et al. The identification and characterization of breast cancer CTCs competent for brain metastasis. Sci Transl Med. 5 (180), (2013).
- Yu, M., et al. Cancer therapy: Ex vivo culture of circulating breast tumor cells for individualized testing of drug susceptibility. Science. 345 (6193), 216-220 (2014).
- Mohamed, B. M., et al. Ex vivo expansion of circulating tumour cells (CTCs). Sci Rep. 13 (1), 3704 (2023).
- Decimo, I., Fumagalli, G., Berton, V., Krampera, M., Bifari, F. Meninges: From protective membrane to stem cell niche. Am J Stem Cells. 1 (2), 92-105 (2012).
- Mercier, F., Hatton, G. I. Connexin 26 and basic fibroblast growth factor are expressed primarily in the subpial and subependymal layers in adult brain parenchyma: Roles in stem cell proliferation and morphological plasticity. J Comp Neurol. 431 (1), 88-104 (2001).
- Stylianopoulou, F., Herbert, J., Soares, M. B., Efstratiadis, A. Expression of the insulin-like growth factor II gene in the choroid plexus and the leptomeninges of the adult rat central nervous system. Proc Natl Acad Sci U S A. 85 (1), 141-145 (1988).
- Nordqvist, A. C., Mathiesen, T. Expression of IGF-II, IGFBP-2, -5, and -6 in meningiomas with different brain invasiveness. J Neurooncol. 5, 19-26 (2002).
- Zumkeller, W., Westphal, M. The IGF/IGFBP system in CNS malignancy. Mol Pathol. 54 (4), 227-229 (2001).
- Wang, L., et al. Promise and limits of the CellSearch platform for evaluating pharmacodynamics in circulating tumor cells. Semin Oncol. 43 (4), 464-475 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8, 160 (2023).
- Chen, J., et al. The development and improvement of immunodeficient mice and humanized immune system mouse models. Front Immunol. 13, 1007579 (2022).
- Law, V., et al. A Murine Ommaya xenograft model to study direct-targeted therapy of leptomeningeal disease. J Vis Exp. (167), e62033 (2021).
- Stacer, A. C., et al. NanoLuc reporter for dual luciferase imaging in living animals. Mol Imaging. 12 (7), 1-13 (2013).
- Luo, Y. T., et al. The viable circulating tumor cells with cancer stem cells feature, where is the way out. J Exp Clin Cancer Res. 37, 38 (2018).
- Stumm, R., Kolodziej, A., Schulz, S., Kohtz, J. D., Hollt, V. Patterns of SDF-1alpha and SDF-1gamma mRNAs, migration pathways, and phenotypes of CXCR4-expressing neurons in the developing rat telencephalon. J Comp Neurol. 502 (3), 382-399 (2007).
- Aviezer, D., et al. basal lamina proteoglycan, promotes basic fibroblast growth factor-receptor binding, mitogenesis, and angiogenesis. Cell. 79 (6), 1005-1013 (1994).
- Tiwary, S., et al. ERBB3 is required for metastasis formation of melanoma cells. Oncogenesis. 3 (7), e110 (2014).
- Sun, X., et al. miR-7 reverses the resistance to BRAFi in melanoma by targeting EGFR/IGF-1R/CRAF and inhibiting the MAPK and PI3K/AKT signaling pathways. Oncotarget. 7 (33), 53558-53570 (2016).
- Satyamoorthy, K., Li, G., Vaidya, B., Patel, D., Herlyn, M. Insulin-like growth factor-1 induces survival and growth of biologically early melanoma cells through both the mitogen-activated protein kinase and beta-catenin pathways. Cancer Res. 61 (19), 7318-7324 (2001).
- Lin, N. U., et al. Tucatinib vs Placebo, both in combination with Trastuzumab and Capecitabine, for previously treated ERBB2 (HER2)-positive metastatic breast cancer in patients with brain metastases: Updated exploratory analysis of the HER2CLIMB randomized clinical trial. JAMA Oncol. 9 (2), 197-205 (2023).
- Russo, A., et al. Ceritinib-induced regression of an insulin-like growth factor-driven neuroepithelial brain tumor. Int J Mol Sci. 20 (17), 4267 (2019).
- Ohsie, S. J., Sarantopoulos, G. P., Cochran, A. J., Binder, S. W. Immunohistochemical characteristics of melanoma. J Cutan Pathol. 35 (5), 433-444 (2008).
- Kulasinghe, A., et al. Short term ex-vivo expansion of circulating head and neck tumour cells. Oncotarget. 7 (37), 60101-60109 (2016).
- Li, X., et al. Clinical significance of detecting CSF-derived tumor cells in breast cancer patients with leptomeningeal metastasis. Oncotarget. 9 (2), 2705-2714 (2018).
- Lelliott, E. J., et al. A novel immunogenic mouse model of melanoma for the preclinical assessment of combination targeted and immune-based therapy. Sci Rep. 9 (1), 1225 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved