בדיקה לגילוי הגנה על כלי הדם ברשתית מפני מוות הקשור לסוכרת בעכברים
In This Article
Summary
בדיקת הגנה פותחה כדי לעקוב אחר עמידות כלי הדם ברשתית למוות מעלבונות הקשורים לסוכרת / רטינופתיה סוכרתית כגון מתח חמצוני וציטוקינים.
Abstract
רטינופתיה סוכרתית (DR) היא מחלת עיניים מורכבת ומתקדמת המאופיינת בשני שלבים שונים בפתוגנזה שלה. השלב הראשון כולל את אובדן ההגנה מפני נזק הנגרם על ידי סוכרת לרשתית, ואילו השלב השני מתמקד בהצטברות של נזק זה. הבדיקות המסורתיות מתמקדות בעיקר בהערכת ניוון נימי, המעיד על חומרת הנזק, ולמעשה מתייחסות לשלב השני של DR. עם זאת, הם רק מספקים בעקיפין תובנות האם מנגנוני ההגנה של כלי הדם ברשתית נפגעו. כדי להתמודד עם מגבלה זו, פותחה גישה חדשנית להערכה ישירה של מנגנוני ההגנה של הרשתית - בפרט, עמידותה מפני עלבונות הנגרמים על ידי סוכרת כמו עקה חמצונית וציטוקינים. בדיקת הגנה זו, למרות שתוכננה בתחילה עבור רטינופתיה סוכרתית, טומנת בחובה פוטנציאל ליישומים רחבים יותר הן בהקשרים פיזיולוגיים והן בהקשרים פתולוגיים. לסיכום, הבנת הפתוגנזה של רטינופתיה סוכרתית כרוכה בהכרה בשלבים הכפולים של אובדן הגנה והצטברות נזקים, כאשר בדיקת הגנה חדשנית זו מציעה כלי רב ערך למחקר ועשויה להתרחב למצבים רפואיים אחרים.
Introduction
רטינופתיה סוכרתית (DR) היא אחד הסיבוכים המיקרו-וסקולריים של סוכרת (DM), והגורם המוביל לעיוורון בקרב אנשים בגיל העבודה במדינות מפותחות1. גורמי הסיכון העיקריים לרטינופתיה סוכרתית הם משך ודרגת היפרגליקמיה 2,3,4. בעוד DM גורם לתפקוד לקוי של המרכיבים הווסקולריים והעצביים של הרשתית5, אבחון DR מבוסס על תכונות מורפולוגיות של כלי הדם ברשתית6.
עקה חמצונית הנגרמת על ידי היפרגליקמיה היא אחד הגורמים לפתוגנזה DR7. עקה חמצונית מוגברת גורמת לנזק נרחב, אשר פוגע בתפקוד המיטוכונדריה ובכך מעלה עוד יותר את רמת מיני החמצן הריאקטיביים. אירועים אלה מלווים בדליפה של כלי דם ברשתית, עלייה ברמת הציטוקינים הדלקתיים, ומוות של תאים עצביים וכלי דם בתוך הרשתית. אובדן תאי כלי הדם, ומכאן הפונקציונליות של רשת הנימים הנרחבת של הרשתית, גורם להיפוקסיה, גירוי רב עוצמה למגוון תגובות5. תגובות אלה כוללות ביטוי מוגבר של גורם גדילה אנדותל כלי דם (VEGF) המניע הן חדירות והן אנגיוגנזה, תכונות קרדינליות של השלבים המתקדמים ומסכני הראייה של DR - בצקת מקולרית סוכרתית, ורטינופתיה סוכרתית שגשוגית6.
תכונות מסוימות של DR מצביעות על כך שלאורגניזם (הן חולים והן חיות ניסוי) יש יכולת פנימית להתנגד להתוויה זו. חולים חווים כמה עשורים של DM לפני שהם מפתחים DR 8,9,10,11,12,13 מסכן ראייה. בעוד מודלים מכרסמים של DM אינם מפתחים את השלבים המתקדמים ומסכני הראייה של DR14, הצורה הראשונית/קלה של DR המתבטאת עושה זאת רק לאחר תקופה של שבועות או חודשים של DM15,16. יתר על כן, הן בחולים והן בחיות ניסוי, DR הוא פרוגרסיבי, ותפקוד לקוי / נזק ברשתית גדל ככל שמשך DM ממושך. לבסוף, חלק מהחולים עם DM לעולם אינם מפתחים DR. במקרים מסוימים, הסיבה לכך היא שאנשים כאלה אינם חווים סוכרת מספיק זמן כדי לפתח DR. במקרים אחרים, הסיבה לכך היא שהם מפגינים התנגדות יוצאת דופן ל- DR; כמו במקרה של משתתפי המחקר Medalist, שאינם מפתחים DR לאחר 50 שנים או יותר של DM17. למרות תמיכה משכנעת כזו בקיומה של הגנה מפני DR והרלוונטיות התרגומית העצומה שלה, המנגנון העומד בבסיס ההגנה לא נחקר באגרסיביות.
בדיקת ההגנה המתוארת כאן פותחה כדי להקל על חקירת הסיבה לכך ש- DR מתעכב מתחילת DM בעכברים סוכרתיים. השלבים העיקריים של בדיקה זו, המיושמים על עכברי DM ועכברים שאינם DM, כוללים (1) מתן עלבון תת-מקסימלי הגורם למוות לעין (ex vivo או in vivo), (2) בידוד כלי הדם ברשתית, (3) צביעת כלי הדם באמצעות TUNEL ו-DAPI, (4) צילום התמונות המתקבלות וכימות אחוז המינים החיוביים הכפולים TUNEL/DAPI.
Protocol
כל המחקרים בבעלי חיים אושרו על ידי המשרד לטיפול בבעלי חיים ובטיחות ביולוגית מוסדית באוניברסיטת אילינוי בשיקגו. עכברי C57/BL6/J זכרים בני שבעה שבועות שוכנו בכלובים קבוצתיים בסביבה נטולת פתוגנים במחזור של 12 שעות אור/חושך וסיפקו גישה חופשית למזון ומים. עכברים הומתו על ידי חנקCO2 , והעיניים עברו חניכה ועיבוד מיידי18. בעלי החיים התקבלו ממקור מסחרי (ראו טבלת חומרים). הכלים החיוניים הדרושים למחקר מתוארים באיור 1.
1. מסירת העלבון הגורם למוות
- בצע עקה חמצונית עם TBH (ex vivo).
- הרדימו את העכברים בהתאם לפרוטוקולים שאושרו על-ידי מוסדות ולמדו את עיניהם18 (איור 2A).
- שים את גלגלי העיניים ישירות לתוך בארות בודדות של צלחת 24 בארות המכילה DMEM + 1% BSA, עם או בלי 5 mM Tert-butyl hydroperoxide (TBH) (ראה טבלה של חומרים); לדגור במשך 1 שעה ב 37 ° C. דגימת בקרה חיובית מטופלת ב- DNase (50 U/100 μL) למשך 10 דקות כדי לפצל DNA.
הערה: המינון של TBH (החומר שגורם לעקה חמצונית) נבחר כדי לגרום לרמה ניתנת לזיהוי ותת-מקסימלית של מוות תאי בתוך כלי הרשתית המבודדים18. - יש לקבע את העיניים ב-10% פורמלין חוצץ למשך הלילה (16 שעות לפחות).
- השתמשו בקוקטייל ציטוקינים כדי לגרום לדלקת (in vivo).
- מרדימים את העכברים בזריקה תוך צפקית של 100 מ"ג/ק"ג קטמין ו-5 מ"ג/ק"ג קסילזין.
- השתמש במחט מותאמת אישית של 33 גרם (ראה טבלת חומרים) כדי להזריק 1 μL / עין של קוקטייל הציטוקינים לתוך הזגוגית; אתר ההזרקה נמצא במרחק של 2-3 מ"מ מהלימבוס (איור 2B).
הערה: קוקטייל הציטוקינים מכיל יחס של 1:1:1 של 1 מיקרוגרם/מ"ל TNF-α, 1 מיקרוגרם/מ"ל IL-1β ו-1500 U/μL IFN-γ18 (ראה טבלת חומרים). - 24 שעות לאחר ההזרקה, הרדימו את העכברים (בהתאם לפרוטוקולים שאושרו על ידי מוסדות), הוציאו את עיניהם וקבעו עם 10% פורמלין חוצץ למשך הלילה.
הערה: ניתן להשהות את הניסוי לאחר קיבוע למשך שבוע אחד לכל היותר ולאחר מכן להפעיל אותו מחדש מאוחר יותר.
2. בידוד רשתית
- חתכו את גלגל העין.
- השתמשו במלקחיים ישרות כדי לתפוס את עצב הראייה בעדינות (איור 2C). החזיקו מיקרו-סכין ביד השנייה כדי לבצע חתך של 2-3 מ"מ אחורי ללימבוס.
- עברו מהמיקרו-סכין למיקרו-מספריים כדי לחתוך במקביל ללימבוס תוך סיבוב גלגל העין יחד עם עצב הראייה עד שגלגל העין נחתך לשני חצאים.
- השליכו את החצי הקדמי של העין, כולל העדשה (איור 2C).
- הסר את הסקלרה.
- השתמש במלקחיים ישרים כדי להרים בעדינות את לובן העין 1-3 מ"מ מהרשתית.
- השתמש במיקרו-מספריים כדי לבצע שני חתכים רדיאליים בלובן העין בחלק של הדרך לעצב הראייה. הימנע חיתוך הרשתית הבסיסית.
- השתמש בזוג מלקחיים מעוקלים כדי לתפוס את הדש הסקלרלי ולתלוש אותו מהרשתית. שכבת RPE תרד עם הסקלרה.
- לשטוף את הרשתית.
- השתמשו במיקרו-מרית כדי להעביר את הרשתית המבודדת לבאר בתוך צלחת בת 24 בארות שמולאה במים מזוקקים פעמיים.
- נערו בעדינות את התבשיל במהירות בינונית-בינונית בטמפרטורת החדר. החליפו את המים כל 30 דקות עד שעה, לפחות 4-5 פעמים, ואז השאירו למשך הלילה.
3. בידוד כלי דם ברשתית
- עיכול: יש להחליף את המים המזוקקים פעמיים ב-800 מיקרוליטר של תמיסת טריפסין YL (3% טריפסין ב-0.1 M Tris buffer (pH 7.8)). יש לדגור בטמפרטורה של 37°C ללא טלטול עדין במשך 4 שעותו-15 דקות 19 (איור 2D).
הערה: הימנע מרעד מהיר מכיוון שהדבר עלול לפגוע בכלי הדם. - העברה: טובלים את הקצה הרחב של צינור העברת זכוכית בתמיסת טריפסין YL כדי להעביר את הרשתית לצלחת פטרי בקוטר 35 מ"מ המכילה מים ללא סיבים ובזיקוק כפול.
- הסירו את השכבה הגרעינית החיצונית (פוטורצפטורים) (איור 2E).
- הפוך את חצי כדור הרשתית כלפי מטה. השתמשו במברשת השיער הישר כדי ללחוץ בעדינות את הרשתית לתחתית הצלחת.
- השתמשו במברשת הלולאה כדי להבריש בעדינות את הפוטורצפטורים של הרשתית. משיכות המכחול מיושמות בכיוון לעצב הראייה לכיוון הפריפריה של הרשתית. הפוטורצפטורים יכולים להתנתק ביריעות גדולות מכיוון שהם אינם מעוגנים לשאר הרשתית על ידי כלי דם.
- באמצעות פיפטה של 200 μL כדי לאסוף ולהשליך את היריעות של הרקמה העצבית.
- הסר את הזגוגית.
- הפוך את חצי כדור הרשתית כך שהיא פונה כלפי מעלה. השתמשו בזוג מלקחיים מעוקלים (A) כדי לתפוס את הזגוגית ככל האפשר תחת מיקרוסקופ מנתח.
הערה: הזגוגית נראית כמו יריעה של רקמה שקופה המחוברת לעצב הראייה או לרשתית. - השתמש במלקחיים מעוקלות אחרות (B) כדי לתפוס את קצה הזגוגית במקום שבו הוא מחבר את עצב הראייה. הסר את הזגוגית על ידי משיכת מלקחיים A הרחק מלקחיים B.
- השליכו את הזגוגית. בדוק את שארית הזגוגית וחזור על שלב זה כדי להסיר את כל הזגוגית מכיוון שהשאריות יעכבו את השלבים הבאים.
- הפוך את חצי כדור הרשתית כך שהיא פונה כלפי מעלה. השתמשו בזוג מלקחיים מעוקלים (A) כדי לתפוס את הזגוגית ככל האפשר תחת מיקרוסקופ מנתח.
- הסירו את הרקמה העצבית והרקמה הגליה שנותרו (איור 2F).
- הפוך את חצי כדור הרשתית כך שהיא פונה שוב כלפי מטה. שוב, השתמשו במברשת הישרה כדי ללחוץ בעדינות את הרשתית לתחתית הצלחת (אין להשתמש בקצה השיער).
- השתמש במברשת הלולאה כדי להבריש בעדינות את כלי הדם מראש עצב הראייה לכיוון הפריפריה כדי להסיר את הרקמה העצבית הנותרת20.
- סובבו את הרשתית באיטיות עם המברשת הישרה והשתמשו במברשת הלולאה כדי להסיר את כל הגושים הקטנים של הרקמה העצבית על כלי הדם ברשתית, עד שרשת כלי הדם תנוקה היטב (איור 2G,H).
4. הרכבת כלי הדם הרשתית המבודדים על שקופית מיקרוסקופ
- מקם שקופית מיקרוסקופ.
- הניחו קסטת הרכבה נקייה (ראו טבלת חומרים) תחת מיקרוסקופ מנתח. ממלאים את הקלטת במים מזוקקים כפול.
- השתמש ברקע שחור מתחת למיקרוסקופ המנתח כדי לסייע ביצירת ניגודיות כדי לראות את כלי הדם השקופים המוארים.
- השתמש במלקחיים כדי למקם מיקרוסקופ נקי עם תווית שקופית בתחתית קלטת ההרכבה.
- להעביר את כלי הדם ברשתית.
- טבלו את הקצה הרחב של צינור העברת זכוכית בתמיסת טריפסין YL.
- מעבירים את כלי הדם ברשתית הנקיים ומוציאים בעדינות את כלי הדם למים המזוקקים פעמיים בתוך קלטת ההרכבה ומעל מגלשת המיקרוסקופ.
- הר את כלי הדם ברשתית.
הערה: בזמן שכלי הדם מרחף מעל מגלשת המיקרוסקופ, כלי הדם המבודדים יקבלו את צורת הקערה הרגילה שלהם.- השתמש במברשת הלולאה כדי להפוך את חצי כדור הרשתית הפונה כלפי מעלה ודחף בעדינות את כלי הדם כלפי מטה אל מגלשת הזכוכית, ולאחר מכן השתמש בשיער כדי להדביק את כלי הדם הפתוחים למרכז המגלשה. כלי הדם צריכים להיצמד לשקופית כשהיא נוגעת.
- הרכבה שטוחה של כלי הדם על ידי הברשה של כלי הרשתית בצורת קערה לעצב הראייה לפריפריה.
- יש לחזור על הצחצוח לכל הכיוונים עד שכלי הדם נדבקים לחלוטין למגלשה.
- אוויר לייבש את כלי הדם ברשתית.
- ברגע שכל כלי הדם ברשתית נצמדים למגלשה, הוציאו את המגלשה מהמים על-ידי הרמה עדינה של קצה אחד או על-ידי ניקוז איטי של מים בפינת הקלטת כדי למזער זרמים, ואז משכו אותם החוצה (איור 2I).
הערה: כלי הדם יהיו גלויים לעין ברגע שהם יתייבשו באוויר (איור 2J). - סמן את היקף כלי הדם ברשתית בגב השקופית באמצעות עט טוש.
- המשך להכתים את הדגימה ללא הפסקה.
- ברגע שכל כלי הדם ברשתית נצמדים למגלשה, הוציאו את המגלשה מהמים על-ידי הרמה עדינה של קצה אחד או על-ידי ניקוז איטי של מים בפינת הקלטת כדי למזער זרמים, ואז משכו אותם החוצה (איור 2I).
5. זיהוי מוות עם צביעת טונל
הערה: לקבלת פרטים על הליך זה, עיין ב- Zheng et al.21. תמונות מייצגות של איסכמיה +/- גופים אפופטוטיים הנגרמים על ידי לחץ שור בכלי דם רשתית מבודדים מתוארים באיור 3.
- יש לייבש מחדש את כלי הדם המבודדים באמצעות PBS. שטפו אותו 3 פעמים ב-PBS ולאחר מכן דגרו עם 1% Triton X-100 ב-PBS במשך 2 דקות על קרח כדי לחלחל את כלי הדם המבודדים.
- שטפו את המגלשות פעמיים עם PBS כדי להסיר את שאריות Triton X-100. יבשו את האזור סביב הדגימה.
- הוסף 50 μL של תערובת תגובת TUNEL (ראה טבלת חומרים) לדגימה. דגור על המגלשה באווירה לחה במשך 60 דקות ב 37 ° C בחושך.
- שטפו את השקופית 3 פעמים עם PBS כדי להסיר את תערובת התגובה TUNEL. יבשו את האזור סביב הדגימה.
- הוסף טיפה של מדיית הרכבה DAPI כדי להכתים את הגרעינים עם DAPI והרכיב את הדגימה עם זכוכית כיסוי. יש לאחסן בטמפרטורה של 4°C בחושך.
הערה: ניתן היה להשהות את הפרוטוקול למשך עד שבוע לפני לכידת תמונות. - צלמו את כלי הדם המתקבלים במיקרוסקופ פלואורסצנטי קונפוקלי (ראו טבלת חומרים). לכדו שישה עד שמונה שדות שנבחרו באופן אקראי בפריפריה הרחוקה המקיפה את עצב הראייה (איור 4).
הערה: תמונות מייצגות של גופים אפופטוטיים הנגרמים על ידי ציטוקינים בכלי דם רשתית מבודדים מודגמות באיור 5. - נתח את התוצאות.
- עבור ex vivo, דגימות שטופלו ב-TBH, בצע את השלבים הבאים.
- ספור את מספר הגופים האפופטוטיים (TUNEL/DAPI מינים חיוביים כפולים) בכל שדה באמצעות תמונה J (ראה טבלת חומרים). חישוב הממוצע של הגופים האפופטוטיים בכל השדות של מדגם יחיד.
- חישוב שינוי הקיפול במספר הגופים האפופטוטיים בין זוג דגימות שאינן DM ו-DM שנבחרו באופן אקראי.
- קבע אם יש הבדל מובהק סטטיסטית באמצעות מבחן t של תלמיד דו-זנבי18.
הערה: הכתימו את דגימות הבקרה והניסוי (שאינן DM ו-DM) באותו אירוע מכיוון שמידת הצביעה של טונל עשויה להשתנות, גם כאשר היא נעשית באותו אופן. מכיוון שמשתמש מנוסה יכול לנקות ולהרכיב עד 10 רשתיות ביום, תכנן לעבד מספר שווה של רשתיות בקרה וניסוי לפני תחילת פרוטוקול זה.
- עבור in vivo, ציטוקינים קוקטייל מטופלים דגימות, לבצע את השלבים הבאים.
- ספירה ידנית של מספר הגופים האפופטוטיים (TUNEL/DAPI מינים חיוביים כפולים) בכל כלי הדם ברשתית.
- חישוב שינוי הקיפול במספר הגופים האפופטוטיים בין זוג דגימות שאינן DM ו-DM שנבחרו באופן אקראי.
- קבע אם יש הבדל מובהק סטטיסטית באמצעות מבחן t של תלמיד דו-זנבי.
- עבור ex vivo, דגימות שטופלו ב-TBH, בצע את השלבים הבאים.
Representative Results
הבידוד המוצלח של כלי הדם ברשתית גורם להרכבה שטוחה של כל הרשת של כלי הדם ברשתית העכבר, עם שלמות אדריכלית שלמה (איור 2J). לאחר צביעה בהמטוקסילין חומצי-שיף תקופתי (PASH), ניתן להבחין בין שני סוגי תאי כלי הדם: תאי אנדותל (ECs) ופריציטים (PC) (איור 6). גרעיני תאי האנדותל מוארכים, מוכתמים קלות ושוכנים כולם בתוך דפנות כלי הדם. גרעיני פריציטים הם עגולים, מוכתמים בצפיפות ובולטים מדפנות הנימים. הדגימות המוכתמות ב-PASH חושפות גם נימים אצלולריים, חסרי גרעינים.
הגישה לגרימת מוות הונחה על ידי הרציונל הבא. הועלתה השערה כי ההגנה מוגבלת, כלומר, עלולה להיות מוכרעת על ידי עלבון חזק מאוד הגורם למוות. כתוצאה מכך, עלבונות (גם איסכמיה/עקה חמצונית וגם ציטוקינים18) עברו אופטימיזציה כך שהם יגרמו לעלייה קלה לזיהוי, אך עם זאת להיקף תת-מקסימלי של מוות (איור 3 ואיור 5).
חשוב להדגיש כי נוכחותם של גרעינים חיוביים ל-TUNEL הייתה מותנית בסוג העלבון הספציפי שהופעל כדי לגרום למוות תאי. עלבון האיסכמיה/העקה החמצונית הוביל לדפוס של אפופטוזיס תאי, כפי שמודגם באיור 3, בעוד שעלבון הציטוקינים הביא לדפוס ברור ומוגדר היטב, כפי שמתואר באיור 5. ניתן לראות את שני הדפוסים בכלי דם ברשתית מחולי DR22, דבר המצביע על כך ששני סוגי הסוכנים גורמים למוות תאי בבני אדם. יתר על כן, ההבחנות המורפולוגיות הנצפות מציעות אמצעי להעריך אם הפתולוגיה הונעה על ידי עקה חמצונית או ציטוקינים.
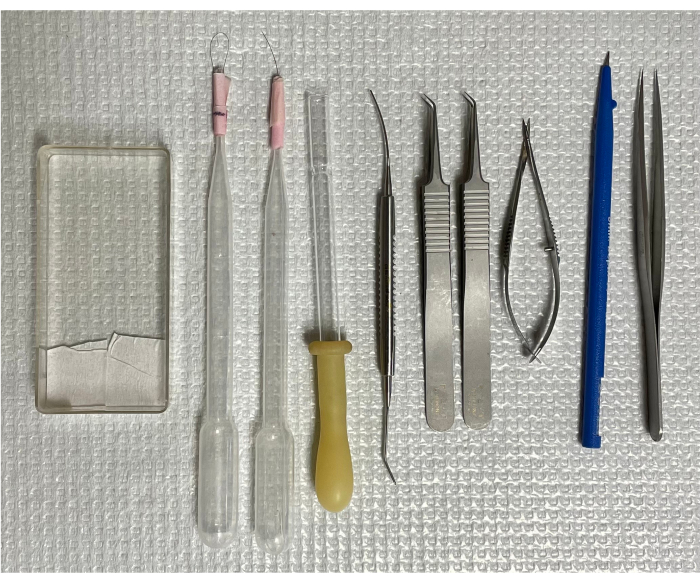
איור 1: כלים לבידוד כלי דם ברשתית עכבר. משמאל לימין: קלטת ההרכבה, שתי מברשות שיער בודדות, צינור העברה הפוך, מיקרו-מרית, שני מלקחיים מעוקלים, מספריים קפיציים, מיקרו-סכין ומלקחיים עם קצוות ישרים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: סכמטי המראה את שלבי המפתח של העברת עלבון הגורם למוות ולאחר מכן בידוד כלי הדם ברשתית מעין עכבר. (A) השראת איסכמיה/פגיעה חמצונית, ex vivo. לאחר enucleation, גלגל העין נתון איסכמיה בנוכחות TBH. (B) מתן In vivo (הזרקה תוך ויטריאלית) של ציטוקינים. (ג) חיתוך גלגל העין לשני חצאים. (D) עיכול אנזימי ברשתית: הסרת לובן העין ושטיפת הרשתית במים מזוקקים פעמיים למשך הלילה. דגירה בתמיסת טריפסין YL ב 37 ° C במשך 4 שעות 15 דקות בבאר של צלחת 24 באר. (ה) הסרת הפוטורצפטורים. (F) הסרת הרקמה העצבית והרקמה הגליה הנותרת. (G) רשת כלי דם בצורת קערה מנוקה הפונה כלפי מעלה. (H) רשת כלי דם מבודדת בכלי 35 מ"מ עם רקע שחור על במת מיקרוסקופ מנתח. (I) כלי דם ברשתית שטוחים על מגלשה. (J) כלי דם רשתית מיובשים באוויר במגלשה. נתון זה שונה מ Li et al.18. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
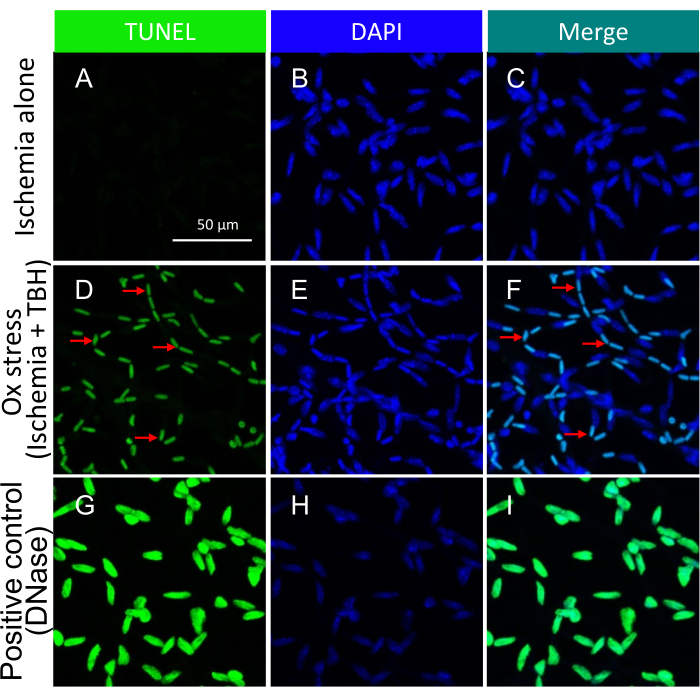
איור 3: זיהוי גופים אפופטוטיים בתוך כלי דם ברשתית עכבר שטופלו ex vivo עם איסכמיה +/- TBH. תמונות מייצגות של איסכמיה +/- גופים אפופטוטיים הנגרמים על ידי לחץ שור בכלי רשתית מבודדים. הכותרת של כל עמודה מציינת את הצביעה. (א-ג) כלי רשתית מבודדים מגלגלי עיניים שעברו 1 שעה של איסכמיה בלבד. (ד-ו) כמו (A-C), למעט העלבון של 1 שעות היה שילוב של איסכמיה ועקה חמצונית (5 mM TBH). החיצים האדומים מצביעים על מינים חיוביים כפולים מייצגים של TUNEL/DAPI. (ז-י) בקרה חיובית מטופלת ב- DNase. סרגל קנה מידה = 50 מיקרומטר. נתון זה שונה מ Li et al.18. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: איור של בחירת שדה לכימות תוצאות. סריקת אריחים בגודל 5 x 5 של כלי הדם ברשתית עם מיזוג של TUNEL ואות DAPI. הבחירה של שישה עד שמונה שדות בפריפריה הרחוקה המקיפה את עצב הראייה מוצגת עם ריבועים אדומים. הגדלה, פי 200. סרגל קנה מידה = 100 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
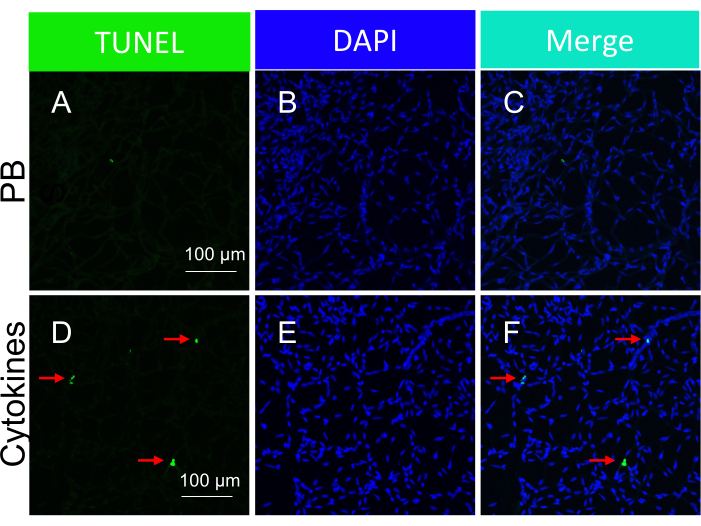
איור 5: זיהוי גופים אפופטוטיים בתוך כלי הדם ברשתית של עכבר בתגובה להזרקה תוך-ויטריאלית של ציטוקינים (מתן in vivo). תמונות מייצגות של גופים אפופטוטיים הנגרמים על ידי ציטוקינים בכלי דם רשתית מבודדים. הכותרת של כל עמודה מציינת את הצביעה. (א-ג) תמונות של כלי הדם ברשתית שבודדו מעכברים שהוזרקו עם PBS. (ד-ו) כמו (A-C), למעט קוקטייל ציטוקינים הוזרק יחד עם PBS. החיצים האדומים מצביעים על מינים חיוביים לטונל. פסי קנה מידה = 100 מיקרומטר. נתון זה שונה מ Li et al.18. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
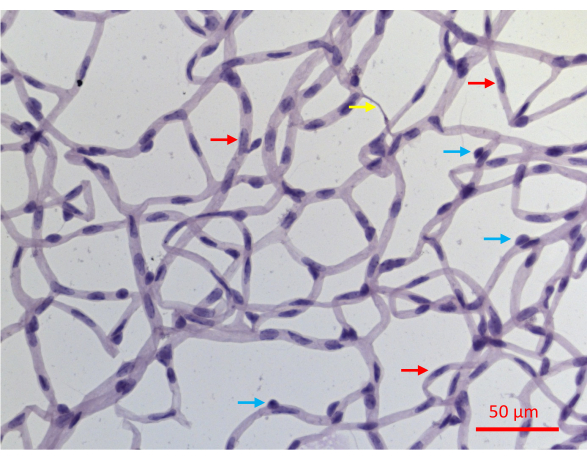
איור 6: תמונה מייצגת של כלי דם ברשתית מוכתמים ב-PASH. כלי דם ברשתית של עכבר שחוו 20 שבועות של DM המושרה על ידי STZ בודדו כמתואר באיור 2, הוכתמו ב-PASH וצולמו כשהם מוארים באור נראה. גרעיני פריציטים בנימים נוטים להיות עגולים יותר ומוכתמים בצפיפות רבה יותר (חיצים כחולים), ואילו גרעינים מוארכים ומוכתמים פחות בצפיפות מאבחנים תאי אנדותל (חיצים אדומים). החץ הצהוב מצביע על נימים אצלולריים. סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
במחקר זה, בדיקה הוקמה כדי לזהות התנגדות / פגיעות של כלי הדם ברשתית למוות המושרה על ידי עלבונות הקשורים DM / DR כגון איסכמיה / מתח חמצוני וציטוקינים. כתב יד זה מספק תיאור מפורט של בדיקה זו, שהיא שינוי של כמה פרוטוקולים שפורסמו 19,20,21.
הפרוטוקול מקיף מספר שלבים מכריעים. ראשית, חובה לנתח בקפידה את הרשתית, להבטיח את שימור רשת כלי הדם ולמנוע קרעים משמעותיים. ניתן להשיג זאת על ידי ביצוע חתך 2-3 מ"מ אחורי ללימבוס מכיוון שהרשתית נצמדת בחוזקה לאורה סראטה, והפרדתה מאתגרת. שנית, יש לצפות את כל המכשירים הבאים במגע עם כלי הדם (למשל, מברשות לשיער יחיד, פיפט מעביר ומלקחיים) בטריפסין על ידי טבילת כלים אלה בתמיסת טריפסין YL לאורך כל ההליך. זה מונע את כלי הדם מלהיצמד למכשירים המשמשים בפרוטוקול זה. שלישית, מכיוון שהמיקרו-וסקולטורה כמעט בלתי נראית באור רגיל, נדרשת ערנות מוגברת במהלך שאיפת הפסולת והעברתה למגלשת המיקרוסקופ על מנת למנוע אובדן מקרי.
מידה מתאימה של עיכול אנזימטי של השכבות השונות של הרשתית היא חיונית; עיכול לא מספיק מונע את ההפרדה של רקמה עצבית מרשת כלי הדם, בעוד עיכול מוגזם ממיס את מקלעת כלי הדם. דווח על זמני עיכול שונים הנעים בין שעה19 ל-23 בלילה. בהתבסס על תצפיות, זמן עיכול של 4 שעות ו -15 דקות מניב את התוצאות הטובות ביותר בהשוואה למשך שעתיים, 3 שעות ו -4 שעות. הארכת העיכול מעבר לנקודה זו לא צפויה לשפר את התהליך ובמקום זאת עלולה לפגוע בשלמות כלי הדם.
במקרים בהם הרשתית המעוכלת נצמדת למברשת בעלת השערה היחידה, יש לטבול את השיער בתמיסת טריפסין YL מספר פעמים. פעולה זו מפחיתה את האזורים הדביקים של המברשת. אם מברשת השיער עדיין דבקה ברקמת כלי הדם, ואז לבדוק אותו עבור שברים שיורית של זגוגית, ולהסיר אותם עם מלקחיים.
הרגע האופטימלי להסרת זגוגית מלאה הוא לאחר חיסול הפוטורצפטורים, אך לפני הסרת הרקמה העצבית והגלייה הנותרת. הרשתית שומרת על קשיחות עד להסרת פוטורצפטורים. הוצאת הזגוגית בשלב זה עלולה לקרוע את הרשתית/כלי הדם. השכבות העדינות של רקמת הגויה והרקמה העצבית השיורית ממלאות תפקיד מרכזי בשימור הצורה העקומה של מבנה כלי הדם. הם מונעים מהרשתית להיקרע במרכזה כאשר הזגוגית מנותקת מעצבים הראייה.
אם כלי הדם המבודדים אינם נצמדים כלל לשקופית המיקרוסקופ, אז זה מצביע על כך שהחלק בשקופית שבו צפויה להתרחש הדבקה הוא מלוכלך. נסה להזיז את הכלים על פני השטח של המגלשה כדי לאתר נקודה דביקה, לעבור למגלשה אחרת או לנקות את המגלשה בקפידה ולנסות שוב. אם הכלים נדבקים למגלשה לפני שהם נפרשים לצורתם דמוית הקערה, הרימו את כלי הדם מהמגלשה כדי לאפשר לו לצוף שוב בחופשיות במים. בצע שלב זה עם מלקחיים שנטבלו שוב ושוב בתמיסת טריפסין YL.
דווח על מספר טכניקות חלופיות לבידוד כלי הדם, אשר לא יתאימו לבדיקת ההגנה המתוארת כאן. לדוגמה, ליזה אוסמוטית שימשה כדי לבודד את כלי הדם מדגימות רשתית לא קבועות, להקל על חקירות ביוכימיות של הרקמה24,25. עם זאת, הליך זה עשוי שלא לשמר את האנטומיה של כלי הדם, כמו גם את הגישה המיושמת במאמר זה. באופן דומה, בעוד ששיטת הדפסת הרקמה לבידוד מקטעים גדולים של מיקרו-כלי דם מאפשרת ניתוח של הארכיטקטורה האלקטרוטונית של כלי הדם26, מיטת כלי הדם כולה בדרך כלל אינה מתאוששת.
בדיקה זו פותחה מכיוון שהגישות הקיימות לניטור ניוון נימי אינן מתייחסות לנושא ההגנה. ניוון נימי, המתרחש לאחר DM ממושך, מציין אם DR התפתח. בנוסף לאבחון DR, תוצאה זו שימושית כדי להעריך אם סוכן/טיפול מונע DR. עם זאת, בדיקות ניוון נימי קיימות אינן מדברות על מנגנון הפעולה הבסיסי של הסוכן. סוכן כזה עשוי למנוע אירועים פתולוגיים המניעים DR כגון מתח חמצוני מוגבר או ציטוקינים. לחלופין, הסוכן עשוי לאכוף הגנה על ידי שיפור העמידות לעקה חמצונית וציטוקינים ו / או לקדם את תיקון הנזק. ניתן להשתמש בבדיקת הגנה חדשה זו כדי לקבוע אם ההשפעה המיטיבה של טיפול נתון כרוכה באכיפת המערכת האנדוגנית המגנה מפני מוות הקשור ל- DM.
החיסרון של בדיקת הגנה זו הוא שהיא אינה מבחינה בין שני סוגי התאים בתוך כלי הרשתית: תאי אנדותל (ECs) ופריציטים (PC). בעוד שמראה הגרעינים שלהם במקטעים מוכתמים ב-PASH הוא ספציפי לסוג התא (איור 6), לא כל גרעין מציג מאפיינים אבחנתיים. כ-30% מהגרעינים אינם ניתנים להגדרה חד-משמעית כ-EC או PC, לפחות חלקית, משום שהתמונות הדו-ממדיות המתקבלות מדגימות מוכתמות ב-PASH פותרות באופן חלקי את המבנה התלת-ממדי של מקלעת כלי הדם. מכשול זה יכול להתגבר על ידי ניתוח נוסף כגון צביעה immunofluorescent עם סמנים ספציפיים סוג התא. תמונות כאלה, אשר מבדילות בין שני סוגי התאים יכולות להיות מוכתמות יחד עם TUNEL כדי לקבוע את ההתנגדות / פגיעות של כל אחד מסוגי תאי כלי הדם.
בדיקה ממוקדת כלי דם זו אינה מספקת מידע לגבי הרשתית העצבית. ניתן לפתח בדיקות נוספות כדי לספק מידע כזה. לדוגמה, במקום לבודד את כלי הדם ברשתית, ניתן ליצור תרחיף תא בודד של הרשתית כולה ולאחר מכן לנתח אותו (על ידי מיון תאים מופעלים פלואורסצנטיים) להתנגדות/פגיעות. הכללת סמנים ספציפיים לסוג התא (הן עצביים והן וסקולריים) יחד עם אינדיקטורים למוות תאי תספק תמונה מלאה יותר של סוגי תאי הרשתית שיש להם את היכולת להגנה מפני מוות בתיווך DM / DR.
לסיכום, מבחן ההגנה המתואר כאן מספק גישה רבת עוצמה לחקירת המנגנון האחראי לעיכוב בין הופעת DM לבין הופעת DR בעכברים.
Disclosures
למחברים אין ניגודי עניינים לדווח עליהם.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מהאגודה למניעת עיוורון באילינוי, המכון הלאומי לבריאות (EY031350 ו-EY001792) ומענק בלתי מוגבל מקרן המחקר למניעת עיוורון.
Materials
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Fischer Scientific | SF100-4 | Fixation |
| 24-well plates | Falcon | 353047 | |
| 33 G needle | Hamilton | customized | |
| Ammonium hydroxide | Sigma | 221228-1L-PCA | |
| C57/BL6/J mice | The Jackson Laboratory | Jax #000664 | |
| Cytokine cocktail | consisted of a 1:1:1 ratio of 1 µg/mL TNF-α, 1 µg/mL IL-1 β and and 1500 U/µLIFN- γ | ||
| Dissecting microscope | Any microscope that allows good visualization of the retina is adequate. | ||
| Dumont #3 forceps | Fine Science Tools (FST) | 11231-30 | Straight tips |
| Dumont #5 forceps | Fine Science Tools (FST) | 11253-25 | Micro-blunted tips |
| Easy-Grip Tissue Culture Dishes | Falcon | 353001 | 35 x 10 mm |
| Glass transfer pipet | Fischer Scientific | 1367820A | snap off the thin end of a Pasteur pipet and fit the “broken” end with a rubber bulb. |
| Harris modified hematoxylin | Sigma | HHS32 | |
| Image J | NIH, Bethesda | https://imagej.nih.gov/ij/ | |
| In Situ Cell Death Detection Kit, Fluorescein | Milipore | 11684795910 | TUNEL reaction mixture |
| Micro cover glasses | VWR | 48366-227 | 22 mm x 22 mm |
| Microknife | Sharpoint | 72-1551 | |
| Micro-spatula | Fine Science Tools | 10091-12 | |
| Mounting cassette | Any transparent cassette that is slightly bigger than the microscope slide | ||
| Periodic acid | Sigma | 3951 | |
| Periodic acid solution | 35 mM periodic acid with 12 mM sodium acetate in H2O | ||
| Permount mounting medium | Fischer Scientific | SP15- 100 | |
| Prism 9 | GraphPad | ||
| Prolog Gold antifade reagent with DAPI | Invitrogen | P36935 | |
| Recombinant human IFN- γ | Peprotec | 300-02 | |
| Recombinant human IL-1 β | Peprotec | 200-01B | |
| Recombinant human TNF-α | Peprotec | 300-01A | |
| Schiff reagent base | Sigma | 3952016 | |
| Shaker Incubator (belly button shaker) | IBI Scientific | BBUAAUV1S | |
| Sodium acetate | Sigma | 71196 | |
| Steritop sterile vacuum bottle | Millipore | SCGPS05RE | Create filtered water |
| Superfrost Plus treated microscope slides | Fischer Scientific | 12-550-15 | use slides from unopened box |
| Tert-butyl hydroperoxide (TBH) | Sigma | 75-91-2 | |
| TRIZMA base | Fischer Scientific | 11-101-5522 | make 100 mM Tris, adjust pH to 7.8 using HCl) |
| Trypsin 1:250 | Amresco | 0458-50G | |
| Two “brushes” | made from single black hair taped to the end of plastic transfer pipet. One brush with a free end. The other brush with a loop | ||
| Vannas Spring Scissors | Fine Science Tools (FST) | 15000-00 | |
| Xylene | Sigma | 65351-M | |
| YL trypsin solution | 3% trypsin in 0.1 M Tris (pH 7.8) | ||
| Zeiss LSM 710 fluorescence microscope | Zeiss Microscopy |
References
- Teo, Z. L., et al. Global prevalence of diabetic retinopathy and projection of burden through 2045: Systematic review and meta-analysis. Ophthalmology. 128 (11), 1580-1591 (2021).
- Lee, R., Wong, T. Y., Sabanayagam, C. Epidemiology of diabetic retinopathy, diabetic macular edema and related vision loss. Eye Vis (Lond). 2, 21 (2015).
- Lima, V. C., Cavalieri, G. C., Lima, M. C., Nazario, N. O., Lima, G. C. Risk factors for diabetic retinopathy: A case-control study. Int J Retina Vitreous. 2, 21 (2016).
- Sabanayagam, C., Yip, W., Ting, D. S., Tan, G., Wong, T. Y. Ten emerging trends in the epidemiology of diabetic retinopathy. Ophthalmic Epidemiol. 23 (4), 209-222 (2016).
- Antonetti, D. A., Silva, P. S., Stitt, A. W. Current understanding of the molecular and cellular pathology of diabetic retinopathy. Nat Rev Endocrinol. 17 (4), 195-206 (2021).
- Wong, T., Cheung, C., Larsen, M., Sharma, S., Simó, R. Diabetic retinopathy. Nat Rev Dis Primers. 2, 16012 (2016).
- Wu, M. Y., Yiang, G. T., Lai, T. T., Li, C. J. The oxidative stress and mitochondrial dysfunction during the pathogenesis of diabetic retinopathy. Oxid Med Cell Longev. 2018, 3420187 (2018).
- Hietala, K., Harjutsalo, V., Forsblom, C., Summanen, P., Groop, P. H. Age at onset and the risk of proliferative retinopathy in type 1 diabetes. Diabetes Care. 33 (6), 1315-1319 (2010).
- Aiello, L. P., et al. Diabetic retinopathy. Diabetes Care. 21 (1), 143-156 (1998).
- Klein, R., Klein, B. E., Moss, S. E., Davis, M. D., Demets, D. L. The wisconsin epidemiologic study of diabetic retinopathy. Prevalence and risk of diabetic retinopathy when age at diagnosis is less than 30 years. Arch Ophthalmol. 102 (4), 520-526 (1984).
- Nathan, D. M., et al. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med. 329 (14), 977-986 (1993).
- . Clustering of long-term complications in families with diabetes in the diabetes control and complications trial. The diabetes control and complications trial research group. Diabetes. 46 (11), 1829-1839 (1997).
- Cruickshanks, K. J., Moss, S. E., Klein, R., Klein, B. E. Physical activity and proliferative retinopathy in people diagnosed with diabetes before age 30 yr. Diabetes Care. 15 (10), 1267-1272 (1992).
- Robinson, R., Barathi, V. A., Chaurasia, S. S., Wong, T. Y., Kern, T. S. Update on animal models of diabetic retinopathy: From molecular approaches to mice and higher mammals. Dis Model Mech. 5 (4), 444-456 (2012).
- Samuels, I. S., Bell, B. A., Pereira, A., Saxon, J., Peachey, N. S. Early retinal pigment epithelium dysfunction is concomitant with hyperglycemia in mouse models of type 1 and type 2 diabetes. J Neurophysiol. 113 (4), 1085-1099 (2015).
- Sergeys, J., et al. Longitudinal in vivo characterization of the streptozotocin-induced diabetic mouse model: Focus on early inner retinal responses. Invest Ophthalmol Vis Sci. 60 (2), 807-822 (2019).
- Sun, J. K., et al. Protection from retinopathy and other complications in patients with type 1 diabetes of extreme duration: The joslin 50-year medalist study. Diabetes Care. 34 (4), 968-974 (2011).
- Li, Y., et al. The slow progression of diabetic retinopathy is associated with transient protection of retinal vessels from death. Int J Mol Sci. 24 (13), 10869 (2023).
- Chou, J. C., Rollins, S. D., Fawzi, A. A. Trypsin digest protocol to analyze the retinal vasculature of a mouse model. J Vis Exp. 76, e50489 (2013).
- Veenstra, A., et al. Diabetic retinopathy: Retina-specific methods for maintenance of diabetic rodents and evaluation of vascular histopathology and molecular abnormalities. Curr Protoc Mouse Biol. 5 (3), 247-270 (2015).
- Zheng, L., Gong, B., Hatala, D. A., Kern, T. S. Retinal ischemia and reperfusion causes capillary degeneration: Similarities to diabetes. Invest Ophthalmol Vis Sci. 48 (1), 361-367 (2007).
- Mizutani, M., Kern, T. S., Lorenzi, M. Accelerated death of retinal microvascular cells in human and experimental diabetic retinopathy. J Clin Invest. 97 (12), 2883-2890 (1996).
- Weerasekera, L. Y., Balmer, L. A., Ram, R., Morahan, G. Characterization of retinal vascular and neural damage in a novel model of diabetic retinopathy. Invest Ophthalmol Vis Sci. 56 (6), 3721-3730 (2015).
- Dagher, Z., et al. Studies of rat and human retinas predict a role for the polyol pathway in human diabetic retinopathy. Diabetes. 53 (9), 2404-2411 (2004).
- Podestà, F., et al. Bax is increased in the retina of diabetic subjects and is associated with pericyte apoptosis in vivo and in vitro. Am J Pathol. 156 (3), 1025-1032 (2000).
- Puro, D. G. Retinovascular physiology and pathophysiology: New experimental approach/new insights. Prog Retin Eye Res. 31 (3), 258-270 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved